薛思雯1,衣晓坤2,于小波1,徐幸莲1*
1(南京农业大学 食品科学与技术学院,肉品加工与质量控制教育部重点实验室,江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京,210095) 2(山东省烟台市东方海洋科技股份有限公司,山东 烟台,246003)
摘 要 为探究兔肉在僵直前经不同的超高压处理,对其斩拌肉糜在加热后(20~80 ℃)所形成的凝胶品质的影响。实验以兔肉为主要原料,将僵直前的兔里脊肉在100~300 MPa下分别保压15 s或180 s,再成熟,加盐(质量分数2%)斩拌。对肉糜的储能模量(G′)和相位角等流变特性进行测定和分析,同时测定肉糜的拉曼光谱,计算蛋白的二级结构变化情况。结果表明,对僵直前的兔肉进行超高压处理,会影响其斩拌后蛋白体系中蛋白质的空间构型和理化性质,总体上会使α-螺旋含量降低,β-折叠含量增加,其中以200 MPa-15 s处理组最为显著。这些变化与加热后形成的凝胶功能特性有显著的相关性。
关键词 兔肉;僵直前;超高压处理;二级结构;流变特性
DOI:10.13995/j.cnki.11-1802/ts.017738
第一作者:博士研究生(徐幸莲教授为通讯作者,E-mail:xlxu@njau.edu.cn)。
基金项目:国家自然科学基金(31471601);江苏高校优势学科建设工程资助项目(PAPD)
收稿日期:2018-05-10,改回日期:2018-07-18
超高压加工(high pressure processing, HPP) 技术作为一种非热加工技术,在食品加工行业备受青睐[1]。使用该技术,可在较低温度下实现对于食品的杀菌灭酶作用,因此能更好地保证食品中的营养成分不被破坏[2]。随着食品行业的发展和消费者对于营养和健康食品需求的提升,超高压加工技术在食品领域中的应用逐渐从杀菌拓展到改善食品品质等方面[3]。其中,利用超高压技术来改变或改善肉制品食用品质与功能特性在近年来备受研究者关注。但是伴随而来的就是超高压设备的维护问题。超高压设备依赖高压腔体的密封性以及高压阀的工作性能,而当超高压压力达到400 MPa及以上时,会显著增加对设备的损耗,使其使用寿命缩短[4]。因此若能在400 MPa以下压力水平可以最大程度利用超高压设备,将在维护设备稳定运行的基础上,最大限度提高企业的经济效益。
宰后动物的肌肉在僵直前仍然会进行一系列的代谢活动,且极易受到外界因素变化的影响,导致成熟后肉的品质会发生改变[5]。因此,若对该状态下的肌肉进行较低水平(100~300 MPa)短时的超高压处理,将很有可能改变肌肉的宰后代谢过程,从而达到改变肉中蛋白质,尤其是肌原纤维蛋白(约占总蛋白的55%)的理化状态的目的。除了可能能起到改善凝胶特性的作用之外,这对维护超高压设备、延长机器寿命也能起到良好的效果[6]。
凝胶类肉制品如香肠、肉丸等方便肉制品深受消费者青睐。该类产品的口感和品质主要由肉中蛋白质,尤其是肌原纤维蛋白的理化和凝胶特性决定[7]。但这类产品多以猪肉、牛肉等为主要原料,并且添加大量NaCl以及脂肪,不符合当下的健康消费观念[8]。近几年中国兔肉产量逐年增加,根据数据统计,中国自2012~2016年的兔肉年产量达到784 065 t/年[9]。另外兔肉属于高蛋白,低脂肪且风味独特的健康肉类,从健康饮食角度出发,具有较大的开发潜能[10]。若能利用较低的超高压水平达到改变肉蛋白理化特性的目的,使其能在加工过程中减少脂肪和NaCl的添加量但不降低产品的食用品质,将有效促进多方利益。
因此,本文拟采用100~300 MPa的压力水平,分别处理僵直前的兔肉15 s或180 s,来研究较低强度下的超高压处理是否能够改变蛋白质的凝胶特性,从而为将来进一步开发健康的低盐低脂的凝胶类兔肉制品提供技术和理论参考。
3月龄雄性新西兰大白兔(Oryctolagus cuniculus),每只重约2.5~3 kg,购于江苏省农业科学院畜牧所;NaCl为分析纯,购于广东科密欧化学试剂有限公司;聚酰胺/聚乙烯真空包装袋,20 ℃条件下透氧率为1 cm3/(m2·h),购于北京华顿塑料有限公司。
S-IL-100-850-9-W超高压设备,英国Stansted Fluid Power公司;LABRAM 800 型激光拉曼光谱仪,法国JY公司;MCR 301 流变仪,奥地利Physica公司;SANYO SIM-F124 制冰机,日本三洋公司;ASC-30 电子秤,沈阳朝阳衡器厂;Grindomix GM 200 刀式混合研磨仪,德国Retsch公司。
1.3.1 样品前处理
取7只健康的新西兰雄性大白兔,宰前充分休息,提供饮水,减少应激。头部机械致昏后,切断颈部血管放血,迅速剥皮去头、爪及内脏,自来水冲洗去除血迹,沥干淋水放入冰箱(4 ℃),约15 min后,剔取腰大肌。将兔腰大肌切成2 cm × 3 cm的小块,将所有兔腰大肌混合,分装到真空包装袋中(每袋75 g),该过程在45 min之内完成。然后使用100、200或300 MPa高压分别处理15 s或180 s,超高压处理过程在30 min之内完成。高压处理结束后,将经超高压处理的以及未经超高压处理的对照组兔肉置于4 ℃冷库24 h,待肌肉充分成熟,再进行下一步处理。
1.3.2 肉糜制备
样品制备参照XUE等[11]的方法。Grindomix GM 200刀式研磨仪的斩拌速率设定为3 000 r/min处理10 s。 然后加入最终体积25%(体积分数)的盐溶液(0 ℃, 8%(质量分数)NaCl)继续斩拌(3 200 r/min,30 s)。 得到最终的肉糜体系盐为2%(质量分数)。斩拌过程中,肉糜温度始终保持在7 ℃以下。
1.3.3 拉曼光谱测定
取适量肉糜用于激光拉曼光谱扫描实验。拉曼光谱测定和参数选定参照XU等[12]的方法,测定400~3 600 cm-1的拉曼光谱,测定时分辨率为2 cm-1,曝光时间为60 s,数据获取速度为120 cm-1/min。每个样品随机选择3个点进行测定。拉曼光谱分析使用NGSLabSpec 5.0软件,对光谱扣除背底后进行平滑,再以(1 003±0.5) cm波数处的峰强度对拉曼光谱进行归一化处理,并根据ALIX等[13]的方法,对酰胺Ⅰ带(1 645 ~1 685 cm-1)进行计算,得到α-螺旋,β-折叠,β-转角以及无规卷曲的相对含量。
1.3.4 动态流变测定
取适量肉糜用于升温过程中肉糜流变特性测定。参照YANG等[14]的方法,设置参数为:狭缝宽度1.5 mm, 应变2%,振动频率0.1 Hz,升温速率1.5 ℃,升温20~80 ℃,如式(1)所示。
![]()
(1)
式中:Tanδ代表相位用正切值,G″代表损耗模量,G′代表储能模量。
所有试验都进行3次重复,每次重复至少进行3次平行试验。利用SPSS 23.0对所得到的二级结构相对含量进行Duncan多重比较方差分析,当P<0.05 时认为差异显著。动态流变特性取3次重复的平均值作图;储能模量(G′)和相位角正切值(tanδ)的起点和终点平均值与蛋白质二级结构相对含量一起用于主成分分析(Umetric Simca P 11.0+)。
拉曼光谱技术是分析研究蛋白体系微环境以及蛋白结构变化的重要且经典的方法,该方法尤其适合水分活度高的体系[15]。图1所展示的对照组兔肉糜蛋白拉曼光谱图,可明显观察到蛋白体系的拉曼特征峰,如C—H弯曲振动,S—S伸缩振动等,因此,本次试验的拉曼光谱分析结果是可信的[16]。
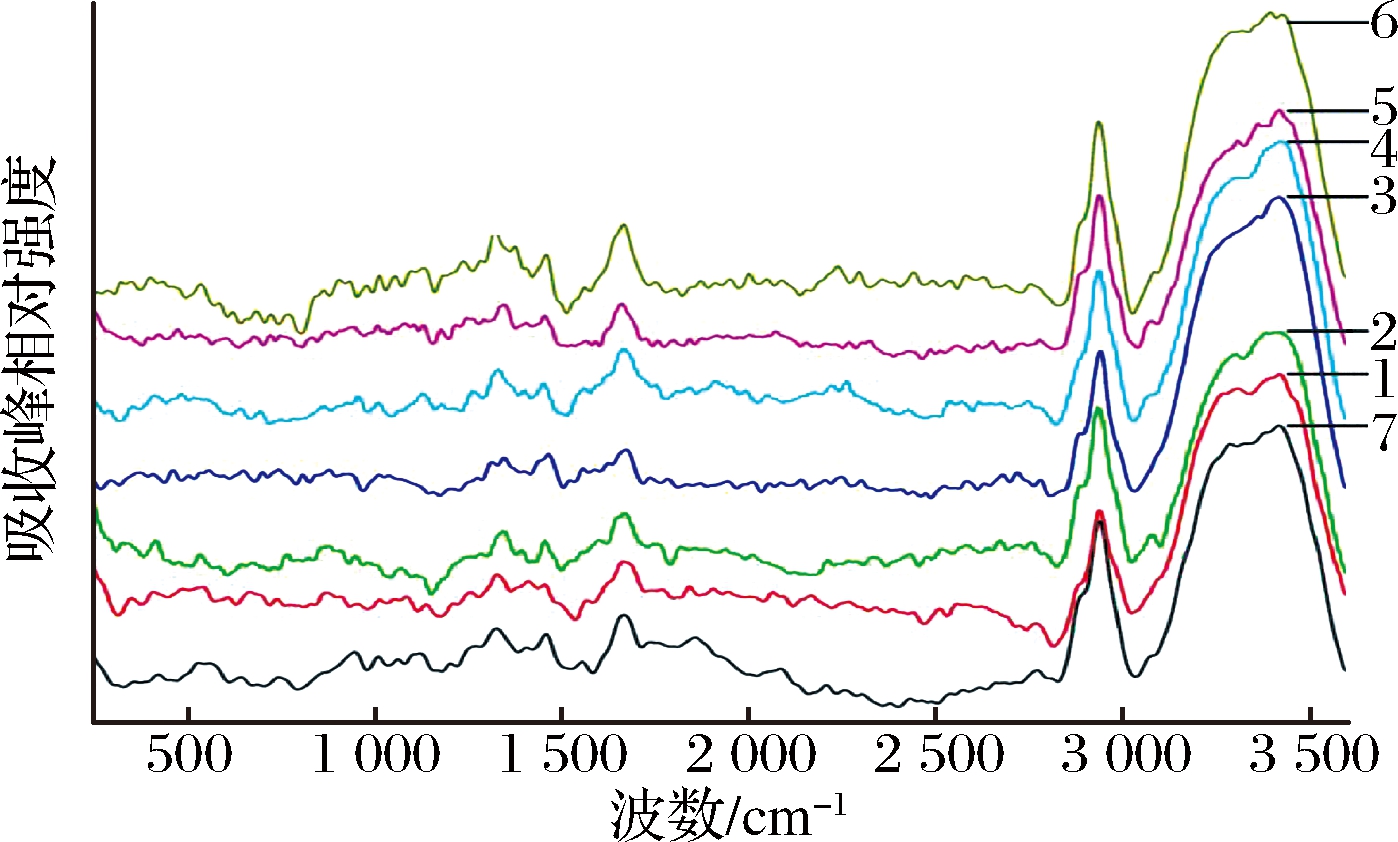
1-100 MPa处理15 s;2-100 MPa处理180 s;3-200 MPa处理15 s;4-200 MPa处理180 s;5-300 MPa处理15 s;6-300 MPa处理180 s;7-对照组
图1 不同处理组兔肉糜拉曼光谱图(360~3 600 cm-1)
Fig.1 Raman spectrum of the untreated rabbit meat batter
由图2可知,将僵直前兔肉采用超高压处理会使后期斩拌形成的肉糜体系中的蛋白α-螺旋结构的相对含量显著降低(P<0.05)。其中,200 MPa-15 s处理组的α-螺旋结构显著低于其他处理组(P<0.05)。除了100 MPa-15 s处理组外,其他高压处理组中蛋白体系的β-折叠的相对含量显著高于对照组(P<0.05)。 说明在这些超高压条件处理后,蛋白质二级结构发生了解螺旋现象。值得注意的是,当压力水平达到300 MPa时,肉糜中蛋白质的α-螺旋结构含量有回升的趋势,且300 MPa-15 s处理组的α-螺旋结构含量显著高于200 MPa-15 s处理组(P<0.05)。 这一现象很可能是由于超高压处理保压过程中,蛋白质结构的变化随着超高压处理的程度不同而达到不同的稳定状态。因此当压力达到300 MPa时,蛋白质解螺旋的二级结构可能又重新结合形成新的螺旋结构,表现出比200 MPa处理条件下更高的螺旋结构含量。
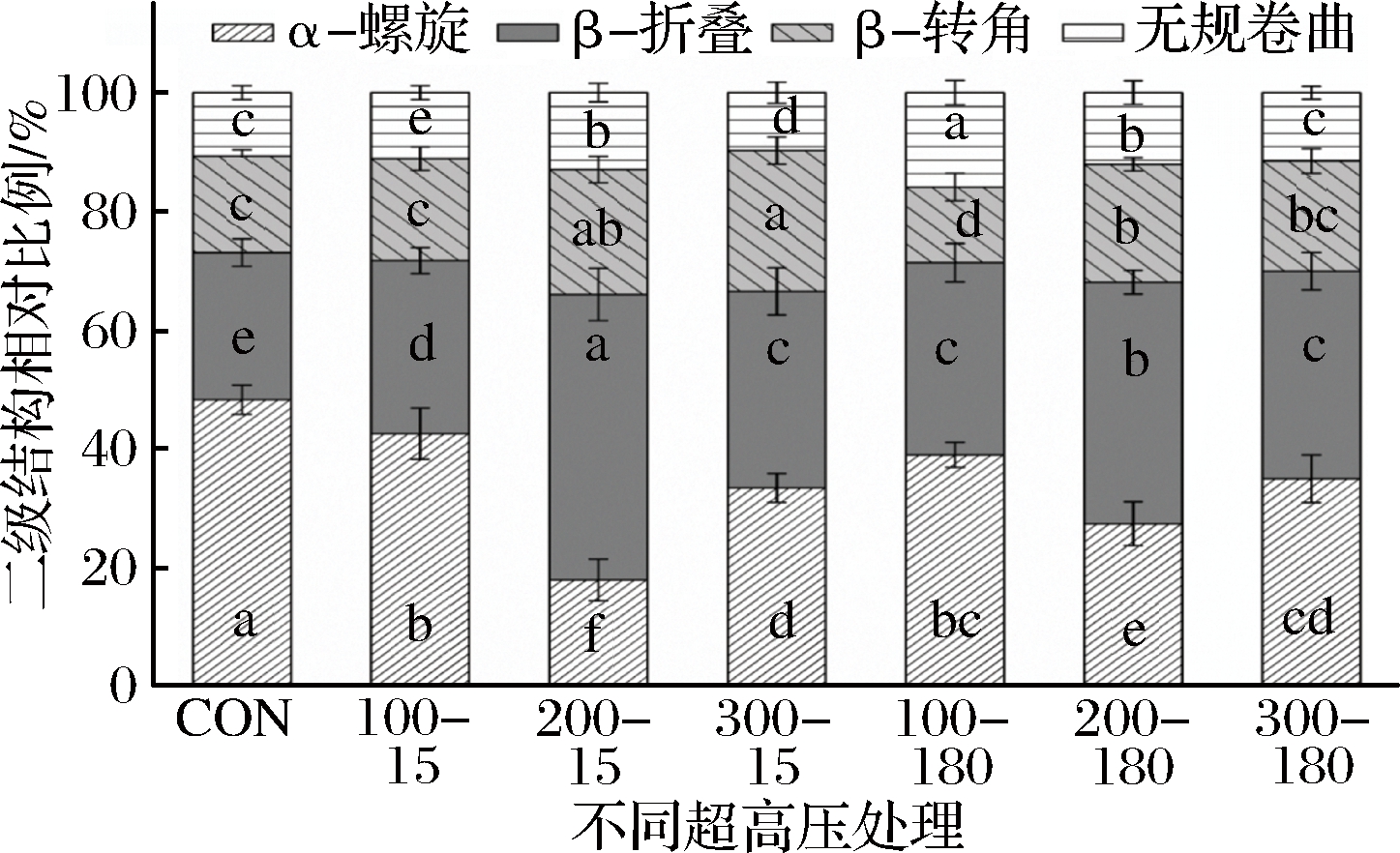
CON为对照组;100-15为100 MPa处理15 s;200-15为200 MPa处理15 s;300-15为300 MPa处理15 s;100-180为100 MPa处理180 s;200-180为200 MPa处理180 s; 300-180为300 MPa处理180 s
图2 超高压处理僵直前兔肉对斩拌兔肉糜中肌原纤维蛋白二级结构的影响
Fig.2 Effects of pre-rigor high-pressure processing on the secondary structures of proteins of the rabbit meat batters
注:图中相同二级结构结果中不同字母表示结果差异显著(P<0.05)。
结合图3和表1发现,经超高压处理过的蛋白在加热前储能模量(G′)显著高于对照组(P<0.05)。
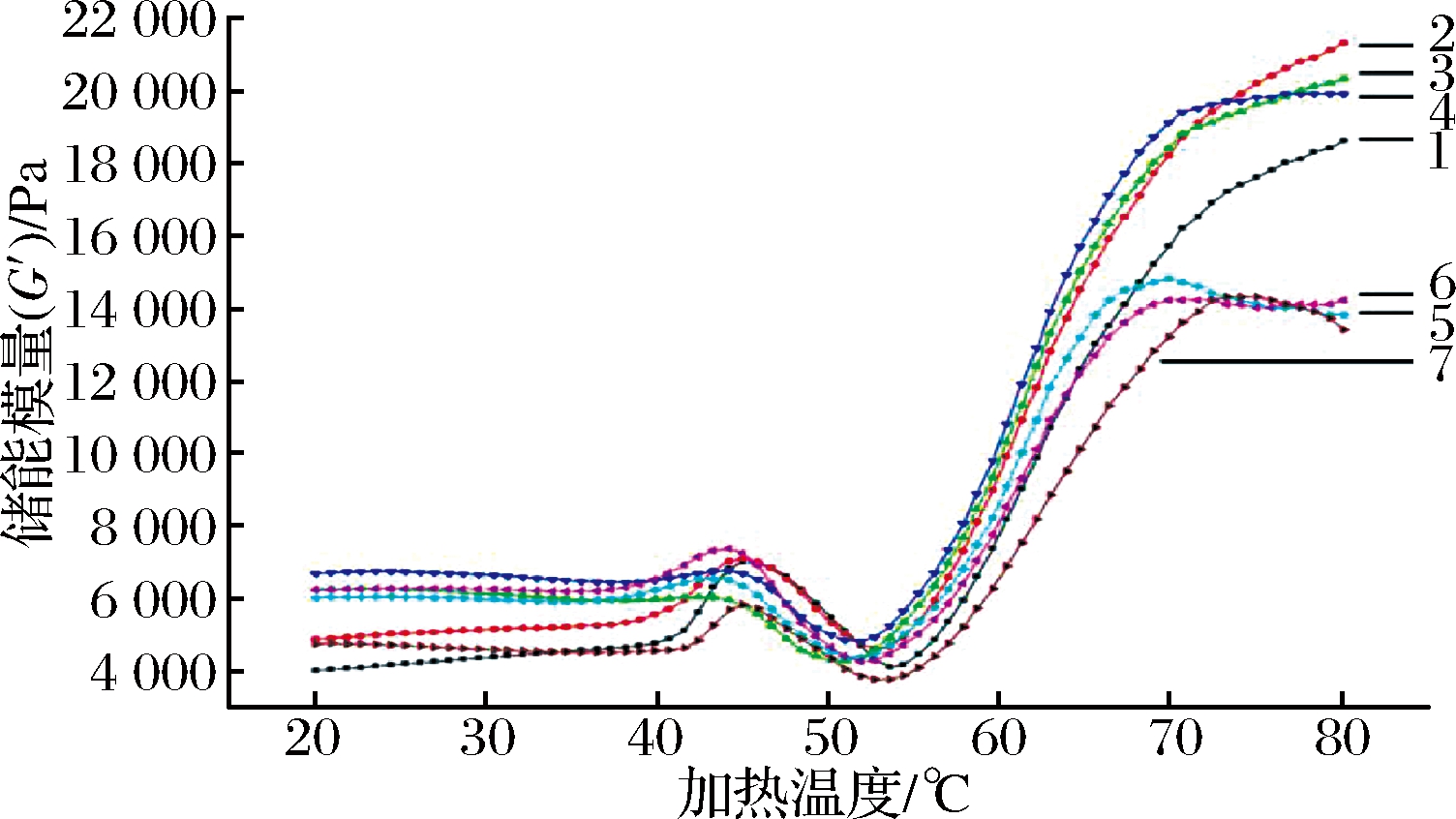
1-对照组;2-100 MPa处理15 s;3-100 MPa处理180 s;4-200 MPa处理15 s;5-200 MPa处理180 s;6--300 MPa处理15 s;7-300 MPa处理180 s
图3 超高压处理僵直前兔肉对斩拌兔肉糜加热过程(20~80 ℃)中储能模量(G′)的影响
Fig.3 Effects of high-pressure processing of pre-rigor rabbit muscle on storage modulus(G′) of the chopped rabbit meat batters
其中200 MPa-15 s处理组的G′值最高,且其与100 MPa-180 s处理组没有显著性差异(P>0.05)。 值得注意的是,这2个处理组样品在加热过程中的第一个G′峰消失,在45 ℃左右G′下降,在51 ℃左右开始急剧增加。另外,其他处理组的第一个G′峰与对照组相比都有不同程度的减弱。该现象说明,僵直前对兔肉进行超高压处理改变了兔肉中蛋白质,尤其是肌球蛋白的分子的理化特性,如蛋白二级结构、空间构型以及/或蛋白分子之间的作用力。
表1 超高压处理僵直前兔肉对斩拌兔肉糜流变特性(20 ℃,80 ℃)的影响
Table 1 Effects of high-pressure processing of pre-rigor rabbit muscle on the rheological properties of the chopped rabbit meat batters
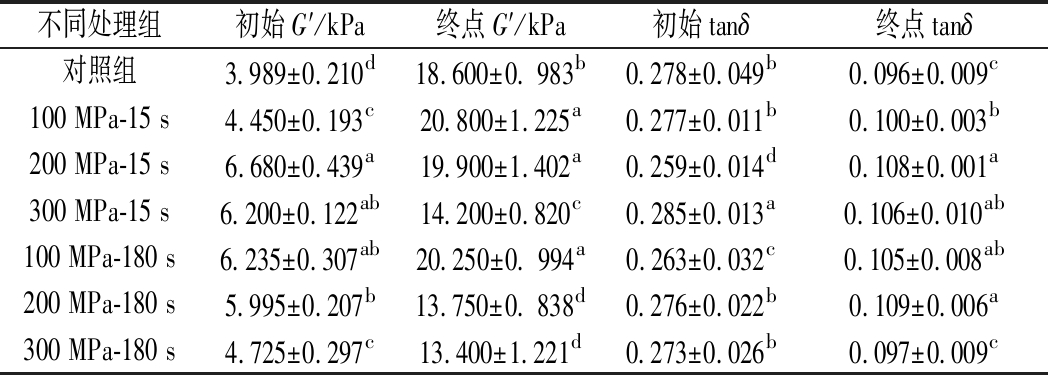
注:表中每一列中不同字母表示结果差异显著(P<0.05)。
对比图4中不同处理兔肉糜的相位角正切值(tanδ)发现,6组超高压处理不同程度上影响了肉糜蛋白体系在加热过程中的相转变过程以及肉糜的黏弹(viscosity)特性。其中,300 MPa-180 s处理组的tanδ值在升温过程中变化最为剧烈,100 MPa-180 s和200 MPa-15 s处理组肉糜的tanδ值在升温过程中变化过程最为平缓。
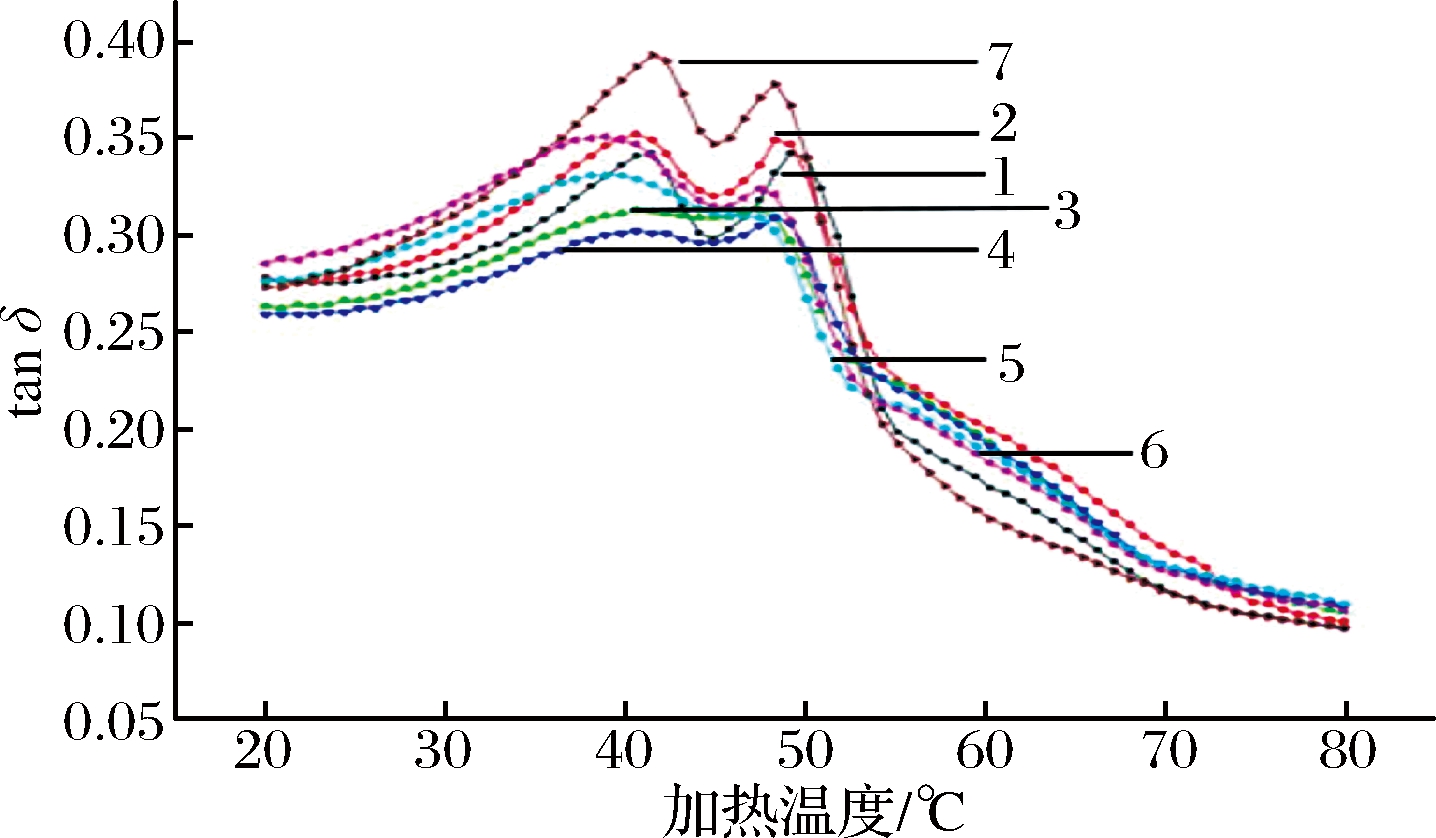
1-对照组;2-100 MPa处理15 s;3-100 MPa处理180 s;4-200 MPa处理15 s;5-200 MPa处理180 s;6-300 MPa处理15 s;7-300 MPa处理180 s
图4 超高压处理僵直前兔肉对斩拌兔肉糜加热过程(20~80 ℃)相位角正切值(tanδ)的影响
Fig.4 Effects of high-pressure processing of pre-rigor rabbit muscle on tanδ of the chopped rabbit meat batters during heating
分析表1中7组样品的初始tanδ和终点tanδ值发现,加热前100 MPa-180 s和200 MPa-15 s处理组样品的tanδ值显著低于其他处理组(P<0.05),但加热终点的tanδ值高于对照组、100 MPa-15 s和300 MPa-180 s(P>0.05)处理组。这表明100 MPa-180 s和200 MPa-15 s处理组样品的相对黏性高于对照组。
图5所示是样品流变特性与其蛋白质二级结构主成分分析的双重结果图(bi-plot),蓝色正方形代表的是不同处理的评分图(score plot),而红色三角形则代表的是不同指标之间载荷图(loading plot)。

图5 超高压处理僵直前兔肉后斩拌兔肉糜流变特性与蛋白质二级结构主成分分析
Fig.5 Principle component analysis of rheological properties and protein secondary structures of rabbit meat batter with various high-pressure processing of pre-rigor rabbit muscle
主成分1和主成分2占比为50.5%和33.8%, 共计84.3%,因此可以在主成分1和2的基础上对结果进行分析。100 MPa-180 s、200 MPa-15 s、200 MPa-180 s以及300 MPa-15 s都处于二、三象限,对照组、100 MPa-15 s和300 MPa-180 s同归于一、四象限,说明100 MPa-15 s和300 MPa-180 s 超高压处理后的凝胶品质与对照组相近,而其他高压处理组的凝胶性质与对照组相比发生了显著改变。另外,从指标的分布来看,初始G′,β-折叠和终点tanδ距离近,且都落在一、四象限远离x轴零点的位置,同时α-螺旋远离x轴零点,落在第一象限;而无规卷曲和终点G′、β-转角和初始tanδ则落在了远离y轴中点的位置,且方向相反。由此认为,对僵直前的兔肉采用中等程度(100 MPa-180 s、200 MPa- 15 s、200 MPa-180 s以及300 MPa-15 s)的高压处理会使兔肉糜中的肌原纤维蛋白α-螺旋相对含量降低,同时β-折叠相对含量增加,使肉糜加热前弹性增加,且加热形成凝胶后拥有中等黏弹性质的凝胶品质。
蛋白的二级结构通常被认为与加热形成凝胶后蛋白凝胶的功能特性相关[17]。HERRERO等[18]研究发现,蛋白质β-折叠和β-转角的相对含量与加热形成的凝胶的硬度,弹性以及内聚性有显著的正相关关系,而与凝胶的表面黏附性呈负相关关系。XU等[12]在对猪肉肌原纤维蛋白加热凝胶形成过程的研究中,也发现了类似的规律。因此结合本试验结果可以推断,对僵直前的兔肉采用适当的超高压处理,可以改善兔肉凝胶的质构特性,如适当增加凝胶硬度,适当降低黏弹比例等[11]。
蛋白体系的动态流变特性能够反映蛋白体系在特性条件下体系中蛋白之间的相互作用结果。一般认为,蛋白体系的储能模量(G′)能反映体系的弹性,而损耗模量(G″)则能反映体系的黏性相关信息,体系的相转变过程由相位角的值来体现[19]。本研究通过分析肉糜的G′和相位角正切值(tanδ=G″/G′),探讨超高压处理僵直前的兔肉对其斩拌肉糜的凝胶特性影响。研究发现,僵直前对兔肉进行超高压处理改变了兔肉中蛋白质,尤其是肌球蛋白的理化性质。根据前人的研究推测,这可能是因为超高压处理过的样品在斩拌后所释放的肌球蛋白之间的相互作用发生改变,更倾向于蛋白之间弱交联的形成,从而表现出更高的G′[13]。在此基础上,经过加热形成的凝胶网络结构的交联方式也极有可能不同,最终表现为加热终点凝胶的G′大小的差异[20]。
300 MPa-180 s处理组的tanδ值变化最为剧烈,说明其蛋白体系的作用力在加热过程中较其他处理组发生了更加剧烈的变化[21],这可能与不同高压处理对肉糜中蛋白的变性程度不同有关[22]。而100 MPa-180 s和200 MPa-15 s处理组肉糜的tanδ值变化过程最为平缓,意味着这2组肉糜样品在加热过程中,尤其是加热前期(20~50 ℃),样品的状态在该升温区间的相转变程度小且整体变化均匀。
通过比较不同处理组的初始和终点tanδ值发现,100 MPa-180 s和200 MPa-15 s处理组样品具有更高的相对黏性。结合之前的研究结果[11],这2组处理样品的硬度和弹性都高于对照组。综上分析,100 MPa-180 s和200 MPa-15 s处理组样品的凝胶产品应该拥有更受消费者青睐的品质以及黏弹适中的口感。
不同处理组分布在不同象限,该结果的出现,很可能是由于100 MPa-15 s压力小,作用时间短,不足以对肌肉中的蛋白起到明显改变作用,而300 MPa-180 s处理反而对蛋白质的性质的改变,如二级结构变化具有限制作用,导致功能特性改变不显著,最终形成了与对照组类似的凝胶品质。而其他处理组的作用适中,使其凝胶性质与对照组相比发生了显著改变。中等程度的高压处理如100 MPa-180 s、200 MPa-15 s、200 MPa-180 s或300 MPa-15 s同样对指标分布产生显著影响,这进一步说明,中等程度的超高压处理会对后续斩拌加热后形成的的凝胶品质产生影响。
综上分析,对僵直前的兔肉进行中等程度(100 MPa-180 s、200 MPa-15 s、200 MPa-180 s以及300 MPa-15 s)的超高压处理能够通过修饰蛋白质二级结构等理化特性来达到改变最终热凝胶功能特性的目的。以流变特性变化为例,200 MPa-15 s的超高压对僵直前的兔肉进行预处理,能够改善其斩拌肉糜粘弹性以及相应热凝胶的弹性。100 MPa-15 s超高压处理对兔肉蛋白结构和最终凝胶特性没有显著影响(P>0.05)。 300 MPa-180 s超高压处理会对蛋白结构产生显著影响,但是对最终凝胶的黏弹特性没有效果。本次试验为超高压处理改善肉类产品质量提供了理论依据,有利于促进超高压技术在肉品加工领域的应用。
参考文献
[1] BAJOVIC B, BOLUMAR T, HEINZ V. Quality considerations with high pressure processing of fresh and value added meat products[J]. Meat Science, 2012, 92(3): 280-289.
[2] BUCKOW R, SIKES A, TUME R. Effect of high pressure on physicochemical properties of meat[J]. Critical Reviews in Food Science and Nutrition, 2013, 53(7): 770-786.
[3] HYGREEVA D, PANDEY C. Novel approaches in improving the quality and safety aspects of processed meat products through high pressure processing technology-A review[J]. Trends in Food Science & Technology, 2016, 54: 175-185.
[4] BALDA F, APARICIO B, SAMSON C. Industrial high pressure processing of foods: Review of evolution and emergingtrends[J]. Journal of Food Science and Engineering, 2012, 2(10): 543-549.
[5] MILLER K, ELLIS M, SUTTON D, et al. Effects of live animal sampling procedures and sample storage on the glycolytic potential of porcine longissimus muscle samples[J]. Journal of Muscle Foods, 2000, 11(1): 61-67.
[6] SAMPEDRO F, MCALOON A, YEE W, F et al. Cost analysis and environmental impact of pulsed electric fields and high pressure processing in comparison with thermal pasteurization. Food and Bioprocess Technology, 2014, 7(7): 1 928-1 937.
[7] CHIO Y, KIM B. Muscle fiber characteristics, myofibrillar protein isoforms, and meat quality[J]. Livestock Science, 2009, 122(2): 105-118.
[8] TROY D, KERRY J. Consumer perception and the role of science in the meat industry[J]. Meat Science, 2010, 86(1): 214-226.
[9] Food and agriculture organization of the united nations. Livestock Primary: Production Quantity [DB/OL]. [2017-12-15]. http://www.fao.org/faostat/en/#data/QL.
[10] DALLE A, SZENDRO Z. The role of rabbit meat as functional food[J]. Meat Science, 2011,88(3): 319-331.
[11] XUE Siwen, YANG Huijuan, LIU Rui, et al. Applications of high pressure to pre-rigor rabbit muscles affect the functional properties associated with heat-induced gelation[J]. Meat Science, 2017, 129: 176-184.
[12] XU Xinglian, HAN Minyi, FEI Ying, et al. Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic[J]. Meat Science, 2011, 87(3): 159-164.
[13] ALIX A, PEDANOU G, BERJOT M. Fast determination of the quantitative secondary structure of proteins by using some parameters of the Raman amide I band[J]. Journal of Molecular Structure, 1988, 174: 159-164.
[14] YANG Huijuan, KHAN M A, YU Xiaobo, et al. Changes in protein structures to improve the rheology and texture of reduced-fat sausages using high pressure processing[J]. Meat Science, 2016,121: 79-87.
[15] LI E, NAKAI S, HIROTSUKA M. Raman Spectroscopy as a Probe of Protein Structure in Food Systems[M]. Boston, MA: Springer US publishing, 1994: 163-197.
[16] HOWELL N K, ARTEAGA G, NAKAI S, et al. Raman spectral analysis in the CH stretching region of proteins and amino acids for investigation of hydrophobic interactions[J]. Journal of Agricultural and Food Chemistry, 1999, 47(3): 924-933.
[17] LIU Ru, ZHAO Siming, XIONG Shanbai, et al. Role of secondary structures in the gelation of porcine myosin at different pH values[J]. Meat Science, 2008, 80(3): 632-639.
[18] HERRERO A M, CARMONA P, LOPEZ I, et al. Raman spectroscopic evaluation of meat batter structural changes induced by thermal treatment and salt addition[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 7 119-7 124.
[19] WU Mangang, XIONG Youlin, CHEN Jie. Rheology and microstructure of myofibrillar protein-plant lipid composite gels: Effect of emulsion droplet size and membrane type[J]. Journal of Food Engineering, 2011, 106(4): 318-324.
[20] UPADHYAY R, GHOSAL D, MEHRA A. Characterization of bread dough: Rheological properties and microstructure[J]. Journal of Food Engineering, 2012, 109(1): 104-113.
[21] IKEDA S. Heat-induced gelation of whey proteins observed by rheology, atomic force microscopy, and Raman scattering spectroscopy[J]. Food Hydrocolloids, 2003, 17(4): 399-406.
[22] XUE Siwen, YANG Huijuan, YU Xiaobo, et al. Applications of high pressure to pre-rigor rabbit muscles affect the water characteristics of myosin gels[J]. Food Chemistry, 2018, 240: 59-66.
XUE Siwen1, YI Xiaokun2, YU Xiaobo1, XU Xinglian1*
1(Nanjing Agricultural University, College of food science and technology, Key Laboratory of Meat Processing and Quality Control, MOE; Jiangsu Synergetic Innovation Center of Meat Processing and Quality Control; Nanjing 210095, China) 2 (Shangdong Yantai Oriental Technology Co., Ltd, Yantai 246003)
ABSTRACT This study aimed to explore the effects of applying different high pressure (HP) treatments to the pre-rigor rabbit meat (PRRM) on the gelling property of its meat batters after heating (20-80 ℃). Rabbit meat was used as raw material, PRRM was subjected to 100-300 MPa HP for 15 s and 180 s, respectively, before aging. The aged meat was chopped with 2% salt. The storage modulus (G′), phase angle, and other rheological properties of meat batters were analyzed. Meanwhile, the Raman spectra were determined and the secondary structural changes of proteins were calculated. The results showed that applying HP treatments to PRRM affected conformations and physicochemical properties of proteins in the batter system, as the content of α-helix reduced and the content of β-sheet enhanced. Samples treated by 200 MPa HP for 15 s exhibited the most significant modifications. These changes had significant correlations with the gelling property of meat batters after heating.
Key words rabbit meat; pre-rigor; high pressure processing; secondary structures; rheological properties