松花粉提取物对胰岛素抵抗HepG2细胞糖脂代谢的影响
赵可心1,3,夏凯1,3,苑鹏1,3,温霖2,李爱民2,李永强2,段盛林1,3*
1(中国食品发酵工业研究院有限公司,北京,100015)2(国珍健康科技(北京)有限公司,北京,102206) 3(功能主食创制与慢病营养干预北京市重点实验室,北京,100015)
摘 要 研究松花粉提取物对胰岛素抵抗HepG2细胞糖脂代谢的影响,探究其潜在分子机制。采用游离脂肪酸构建HepG2细胞胰岛素抵抗模型,经油红O染色确认模型成功后,采用MTT法研究不同极性的松花粉提取物对细胞增殖的影响。测定各组上清葡萄糖,胞内糖原,上清甘油三酯(TG),胞内TG以及胞内总胆固醇(TC)的含量,实时荧光PCR定量检测细胞裂解液中的调控糖脂代谢关键基因InSR、PI3K以及GLUT-4的mRNA 表达水平。结果表明,不同极性的松花粉提取物在质量浓度为100~500 μg/mL时,对细胞无明显毒性;不同极性的松花粉提取物能够促进细胞吸收葡萄糖,抑制糖原降解,抑制TG和TC的形成,促进TG向细胞外转运,从而改善HepG2胰岛素抵抗状况。各松花粉处理组细胞PI3K以及GLUT-4 mRNA表达量均上调,说明松花粉能够激活PI3K/Akt/GLUT-4通路从而促进糖代谢;乙酸乙酯相(AE),正丁醇相(BU)和水相(WT)组细胞InSR mRNA表达量显著上调,说明这3种提取物能够通过提高胰岛素的敏感性改善胰岛素抵抗。
关键词 松花粉;糖脂代谢;q-RT-PCR;InSR;PI3K;GLUT-4
DOI:10.13995/j.cnki.11-1802/ts.018251
第一作者:硕士研究生(段盛林教授级高级工程师为通讯作者,E-mail:dslbeijing@163.com)。
基金项目:北京市科技计划项目(D171100001917003)
收稿日期:2018-07-10,改回日期:2018-07-23
胰岛素抵抗是指胰岛素作用的靶器官对胰岛素的敏感性下降,即正常剂量的胰岛素产生低于正常生物学效应的一种状态,主要表现为葡萄糖摄取减少及糖原的合成减少。肝脏是人体物质代谢的中枢,也是胰岛素作用的主要靶器官。肝脏胰岛素抵抗主要表现为肝糖异生、肝糖的输出增加、甘油三酯释放量增加及肝脏脂肪变性[1-2]。随着社会经济发展和人民生活水平的不断提高,人们的生活方式发生了巨大变化,代谢综合征的患病率逐年上升,已成为严重危害人类身体健康的十大隐性杀手之一。国外一项针对35~70岁人群的调查表明,患有代谢综合征的病人,在未来7年里,每8人中会有1人因代谢综合征而死亡,其中糖尿病导致心血管事件发生的数量是血糖正常者的4.5倍[3]。因此普遍认为,胰岛素抵抗是代谢综合征发病的“共同土壤”,糖脂代谢紊乱是其基础病理改变,但其具体的发病机制尚不十分明确[4]。
胰岛素抵抗是由遗传和环境因素等多种因素引起的胰岛素受体(insulin receptor,InsR)及受体后缺陷所导致的[5]。胰岛素由胰岛B细胞分泌后,经血液循环送达外周靶细胞,与靶细胞膜上的InsR特异性结合,经过一系列磷酸化以及去磷酸化的过程,顺序激活多种激酶,活化胰岛素受体底物(insulin receptor substrate 1,IRS-1),经由磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)信号通路调节糖代谢[6-8]。通过激活蛋白激酶B(protein kinase B,Akt)完成下游信号蛋白的级联效应,促使葡萄糖转运蛋白4 (glucose transporter 4,GLUT-4)向细胞膜转位,完成各组织的葡萄糖代谢[9-11]。该通路受到干扰时,会影响胰岛素的信号转导,主要包括胰岛素受体活性减弱、胰岛素信号转导的异常、葡萄糖转运减少、糖原分解增多等。
松花粉是一种传统的药食同源的花粉,具有降低血糖,血脂和血胆固醇的含量,预防心脑血管疾病的发生的作用[12-13]。松花粉含有多种维生素、微量元素、多酚,黄酮、酶及辅酶等200余种营养成分及生物活性物质;是迄今为止所发现的天然食品中营养成分最全面的物质之一[14]。松花粉调节糖脂代谢的研究已经有不少报道,但对肝细胞胰岛素抵抗的保护作用仍缺乏研究。因此,本研究以松花粉为研究对象,用游离脂肪酸(free fatty acids,FFAs) 诱导人肝癌HepG2细胞建立胰岛素抵抗模型,探讨松花粉对胰岛素抵抗HepG2细胞保护作用及其保护机制,为松花粉的深度开发和进一步充分利用提供一定依据。
1 材料与方法
1.1 材料与试剂
松花粉,新时代健康产业(集团)有限公司惠赠;肝癌细胞株(HepG2),北京协和医院细胞库;DMEM(dulbecco’s modified eagle medium)培养基、磷酸盐缓冲液(phosphate buffered saline,PBS)、DMEM无糖培养基、新生牛血清,美国Gibco;油酸钠(sodium sulfate,OANa)、棕榈酸钠(sodium palmitate,PA)、二甲基亚砜(dimethyl sulfoxide,DMSO),噻唑兰(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenylterazolium bromide,MTT),胰蛋白酶,美国Sigma化学公司;无FFA牛血清蛋白(FFA-free bovine serum albumin,BSA),日本WAKO公司;RIPA裂解液、TG试剂盒、葡萄糖试剂盒,糖氏试剂盒,碧云天生物技术研究所;TransZol Up Plus RNA Kit试剂盒、TransScriptR Green One-Step qPCR SuperMix试剂盒,北京全式金生物技术有限公司。
1.2 仪器与设备
倒置生物显微镜,日本Olympus公司;生物安全柜,中国济南鑫贝西生物技术有限公司;37℃ CO2培养箱,日本松下公司;Spectra Max i3酶标仪,美国MD公司;分析天平,梅特勒-托利多仪器有限公司;超声波清洗仪,昆山超声仪器有限公司KQ-250DE;pH计,上海雷磁仪器厂;GL-20G-Ⅱ型高速冷冻离心机,上海安亭科学仪器厂;DK-8D三温三控水槽,上海博迅实业有限公司;CFX Connect Real-Time System,美国Bio-RAD公司;超微量核酸蛋白分析仪,英国BioDrop公司。
1.3 方法
1.3.1 松花粉的提取以及分级萃取
取松花粉10 g,置于烧杯中,加入200 mL 70%乙醇溶液,料液比为1∶20(g∶mL),温度为30 ℃;超声波辅助提取2 h;提取液经真空抽滤得到澄清提取液①;在滤渣中继续加入200 mL 70%乙醇溶液,超声波辅助提取1 h,真空抽滤得到澄清提取液②;合并提取液①和②,真空旋转蒸发浓缩,回收乙醇,浓缩后浸膏采用真空冷冻干燥,得到棕黄色硬质膏状提取物,称为松花粉乙醇提取物(pine pollen ethanol extract,AC)[15]。
取27 g松花粉按上述步骤处理后得到的浸膏中加入500 mL蒸馏水,溶解后置于分液漏斗中,依次加入等体积的石油醚、乙酸乙酯、水饱和正丁醇进行多次萃取;各不同极性的萃取液合并后,用旋转蒸发仪减压浓缩,彻底除去有机溶剂后真空冷冻干燥,得到松花粉的分级部位,按极性自小到大依次为:石油醚相(pine pollen petroleum ether phase,PE)、乙酸乙酯相(pine pollen ethyl acetate phase,AE)、正丁醇相(pine pollen butanol phase,BU)、水相(pine pollen water phase,WT)。
1.3.2 总多酚、总黄酮含量测定
1.3.2.1 总多酚含量测定
采用福林酚法[16]测定总酚,总酚含量用没食子酸当量GAE (gallic acid equivalent)计。
1.3.2.2 总黄酮含量测定
采用硝酸铝—亚硝酸钠比色法[17],以芦丁作为标准品。
1.3.3 HepG2细胞实验
1.3.3.1 HepG2细胞的培养
人肝癌细胞株HepG2细胞培养于含有10%新生牛血清、青霉素100 U/mL和链霉素100 μg/mL的DMEM培养基中,于培养箱37 ℃、5% CO2培养条件下中常规培养。选取对数生长期细胞进行实验。将细胞以1×106 个/mL浓度接种于96孔板,待细胞贴壁并长满时,用PBS润洗细胞1次,加入不同的处理液。
1.3.3.2 MTT法测定细胞存活率
取96孔培养板,每孔加100 μL细胞悬液,HepG2细胞浓度为1×105个/mL,37 ℃培养24 h后弃去培养液,用PBS清洗1次,每孔加入不同的处理液100 μL,以无检测物的相同培养基孵育细胞为对照,培养24 h后除去培养液,加入0.5 mg/mL MTT-DMEM于37℃避光孵育4 h,再加入100 μL DMSO,振荡混匀以完全溶解出MTT紫色结晶产物。用酶标仪在490 nm处测定吸光度值。以对照组细胞的细胞存活率为100%计算其余组别细胞存活率。
1.3.3.3 实验分组
实验分为对照组:25 mmol/L葡萄糖组+10 g/L(质量浓度)BSA、模型组:20 mmol/L葡萄糖+15 mmol/L果糖+1 mmol/L OANa+1 mmol/L PANa +10 g/L BSA组[21],二甲双胍组(MET):造模液中加入终浓度为200 μg/mL二甲双胍,以及造模液中加入各浓度松花粉提取物的实验组(终浓度为200或500 μg/mL)。
1.3.3.4 油红O染色
细胞加样处理24 h后,弃掉旧培养基,用PBS缓冲液洗去残余的细胞培养基。而后采用陈亚蓝等[18]的方法对细胞进行染色处理。
1.3.3.5 细胞糖吸收测定
各组细胞加样处理24 h后,小心弃去培养液,用PBS洗1次,换为葡萄糖浓度为12.5 mmol/L DMEM培养基,培养 24 h后取5 μL上清液,用葡萄糖试剂盒测定葡萄糖含量,计算样品24 h葡萄糖消耗量。
1.3.3.6 细胞内糖原含量的测定
加样处理24 h后,小心弃去培养液,PBS洗1次,细胞用RIPA裂解液裂解,用糖原试剂盒测定胞内糖原含量。结果除以蛋白含量为最终表示结果。
1.3.3.7 上清液及细胞内TG含量的测定
各组细胞加样处理24 h后,取50 μL待测细胞上清液,用TG试剂盒测定TG含量,结果以模型组TG含量的百分比表示。
各组细胞加样处理24 h后,小心弃去培养液,将板内待测定细胞用PBS润洗2次后,加入RIPA裂解液。充分裂解后,用TG试剂盒测定TG含量。结果以模型组TG含量的百分比表示(%)。
1.3.3.8 InSR,PI3K以及GLUT-4 mRNA的表达
采用TransZol Up Plus RNA Kit试剂盒提取HepG2细胞中的总RNA,检测其浓度和纯度。用TransScriptR Green One-Step qPCR SuperMix试剂盒检测InSR,PI3K以及GLUT-4 mRNA的表达,以GAPDH为内参。各引物序列见表1。
表1 引物序列
Table 1 Primer sequences

基因上游引物5’-3’下游引物5’-3’片段长度/bpGAPDHGGTGGTCTCCTCTGACTTCAACAGTTGCTGTAGCCAAATTCGTTGT126InSRATGGGCTTCGGGAGAGGAGGATGTCCATACCAGGGCAC120PI3KAAATGGTTTCACGCCACACGCAGTGCCAAGTTCCAAAGGC393GLUT-4AGAGCCAGCTCTCTCTACCCGTCACACGAGGGGAATGAGG166
1.4 统计分析
采用每组实验重复3次,结果以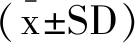 表示。采用IBM SPSS Statistics 23软件进行单因素方差(One-Way ANOVA)分析,来判断显著性差异,P<0.05 代表有显著性差异,P<0.01代表有极显著性差异。
表示。采用IBM SPSS Statistics 23软件进行单因素方差(One-Way ANOVA)分析,来判断显著性差异,P<0.05 代表有显著性差异,P<0.01代表有极显著性差异。
2 结果与分析
2.1 松花粉提取物得率
松花粉各有效成分提取率如表2所示。
表2 松花粉提取物得率 (n=3)
Table 2 Pine pollen extract yield
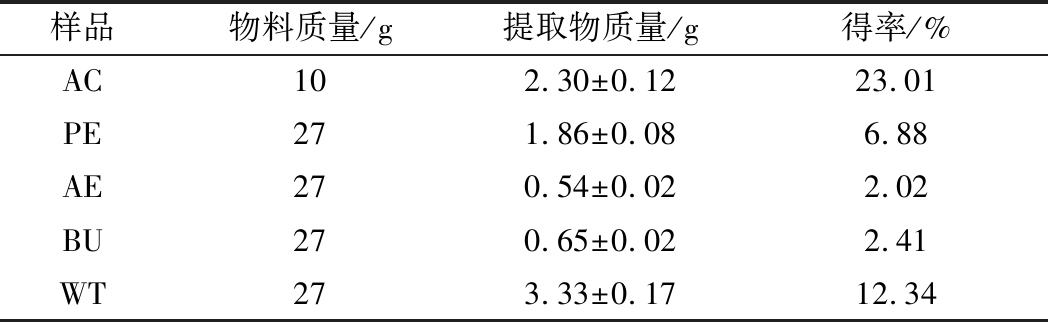
样品物料质量/g提取物质量/g得率/%AC102.30±0.1223.01PE271.86±0.086.88AE270.54±0.022.02BU270.65±0.022.41WT273.33±0.1712.34
注:表中提取物质量数字为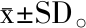
由表2可知,以上4种萃取物中,WT和PE得率较高。
2.2 松花粉醇提物及分级萃取物中总多酚及总黄酮含量测定
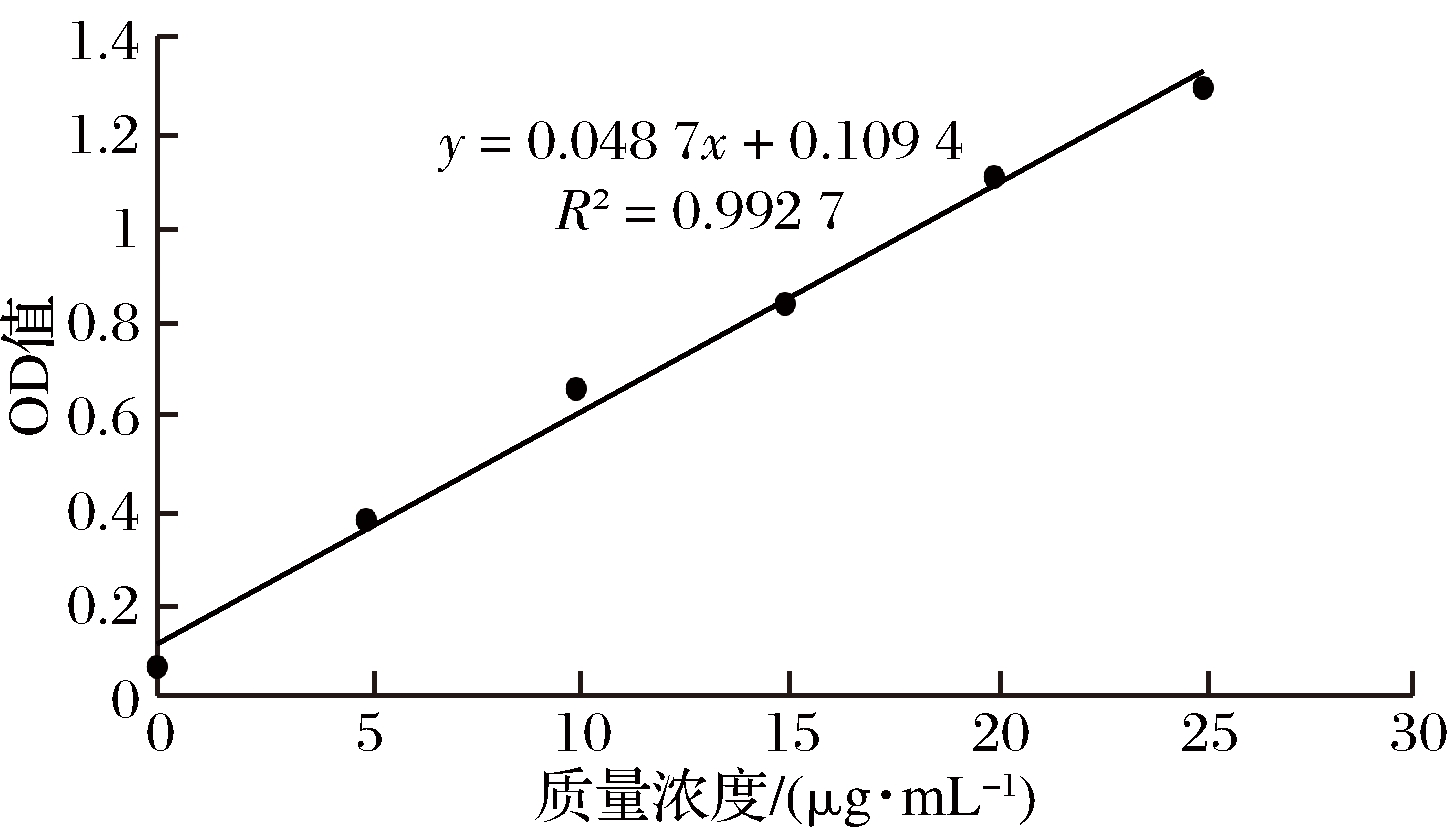
以没食子酸浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,进行线性回归,得到回归方程为y = 0.048 7x+0.109 4,R2=0.992 7(n=3),表明没食子酸在2~25 μg/mL线性良好。以芦丁浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,进行线性回归,得到回归方程为y=0.006 2x+0.048 3,R2=0.998 8 (n=3),表明没食子酸在0~50 μg/mL线性良好。
图1 没食子酸标准曲线
Fig.1 Gallic acid standard curve
图2 芦丁标准曲线
Fig.2 Rutin standard curve
表3 松花粉提取物多酚、黄酮含量
(n=3)
Table 3 Pine pollen extract polyphenols, flavonoids content
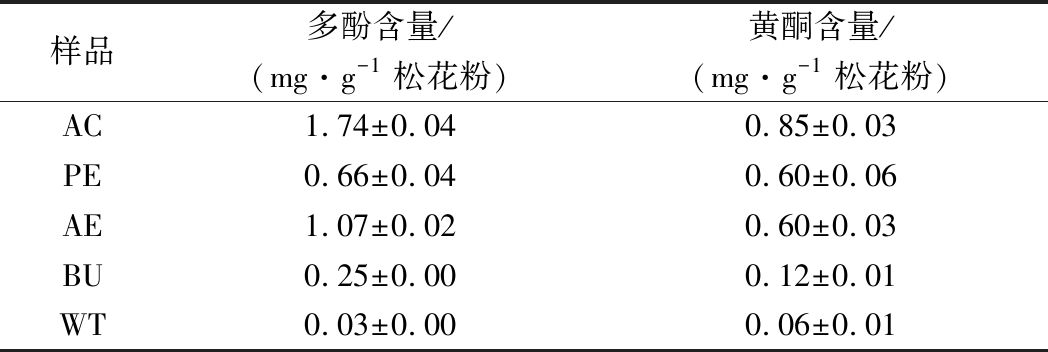
样品多酚含量/(mg·g-1松花粉)黄酮含量/(mg·g-1松花粉)AC1.74±0.040.85±0.03PE0.66±0.040.60±0.06AE1.07±0.020.60±0.03BU0.25±0.000.12±0.01WT0.03±0.000.06±0.01
注:表中数字为
在以上松花粉萃取物中,AE的多酚含量最高,其次为PE和BU,WT多酚含量最低。其中,AE中多酚含量达1.07 mg/g,是WT的35.7倍。整体而言,松花粉醇提物及萃取物中多酚含量较高。
从黄酮的含量来看,在以上松花粉萃取物中,AE和PE中黄酮含量最高,其次为BU,WT含量最低。其中,AE中黄酮含量是WT的10倍。
2.1 松花粉乙醇提取物及各萃取相对细胞存活力的影响
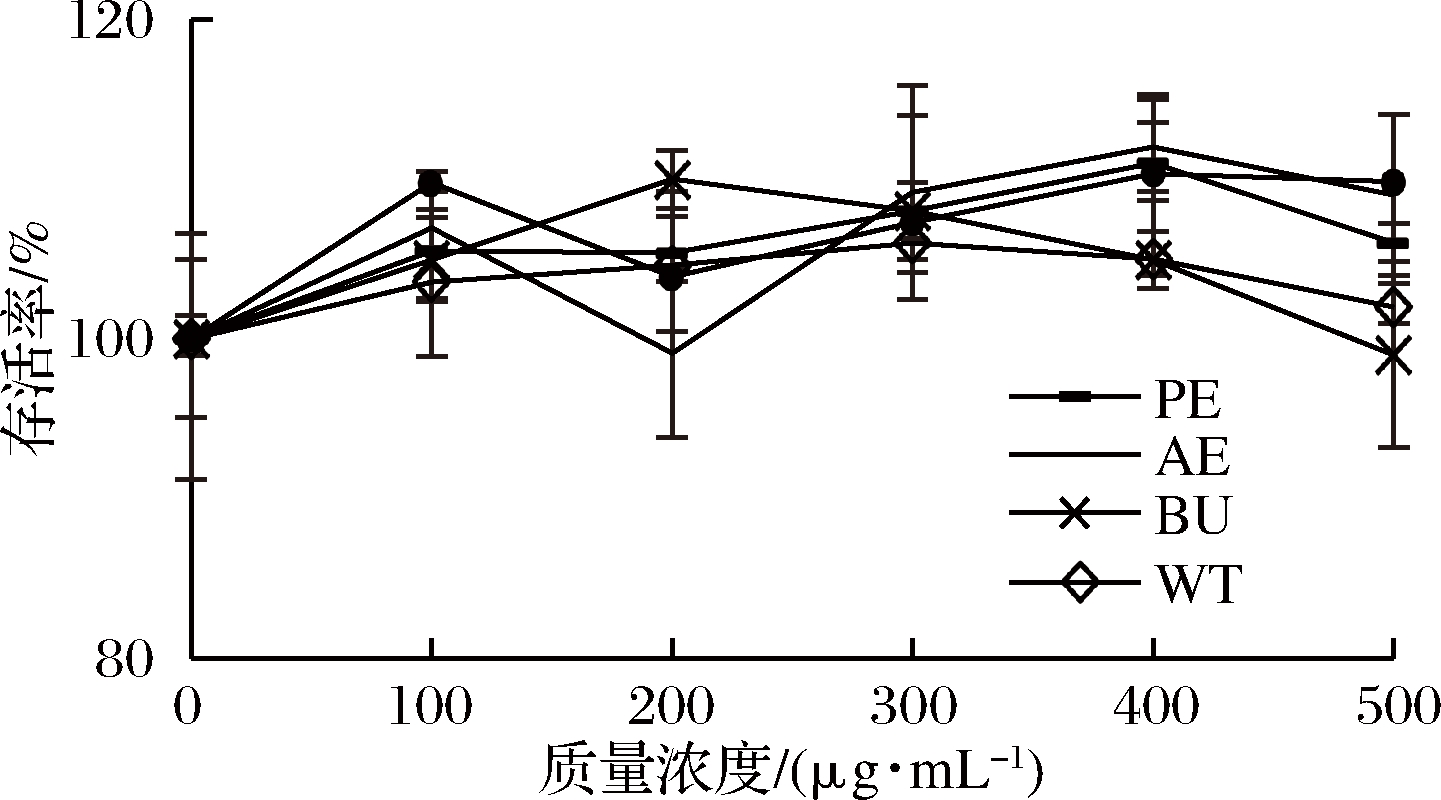
如图3所示,在质量浓度为100~500 μg/mL时,AC组,PE组,AE组,BU组和WT组均不影响HepG2细胞的活力,对细胞增殖无明显影响(P>0.05)。考虑到后续实验,因此,各组均选择低剂量(200 μg/mL)和高剂量(500 μg/mL)2种浓度。
图3 松花粉醇提物及其萃取物处理24 h对细胞增殖的影响
Fig.3 Effect of pine pollen ethanol extract and its extracts on cell proliferation after 24 h 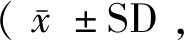 n=3)
n=3)
2.2 油红O染色结果
油红O,又称苏丹红5B,是一种脂溶性偶氮染料,具有很强的脂溶性和染脂性,该染料可特异性的与组织内或细胞内的甘油三酯等中性脂肪结合成小滴状而使脂类物质着色呈现橘红色,同时又可以避免使细胞内的其他成分与油红O发生反应而被其染色,以干扰实验结果[19-21]。
油红O染色结果表明,对照组细胞与模型组细胞的细胞形态出现明显差异,模型组细胞内出现油滴发生脂质累积,在模型组中能看到明显的胞内油滴被染为红色,说明胰岛素抵抗细胞模型构建成功(图4)。
2.2 松花粉乙醇提取物及各萃取相对细胞上清葡萄糖含量的影响
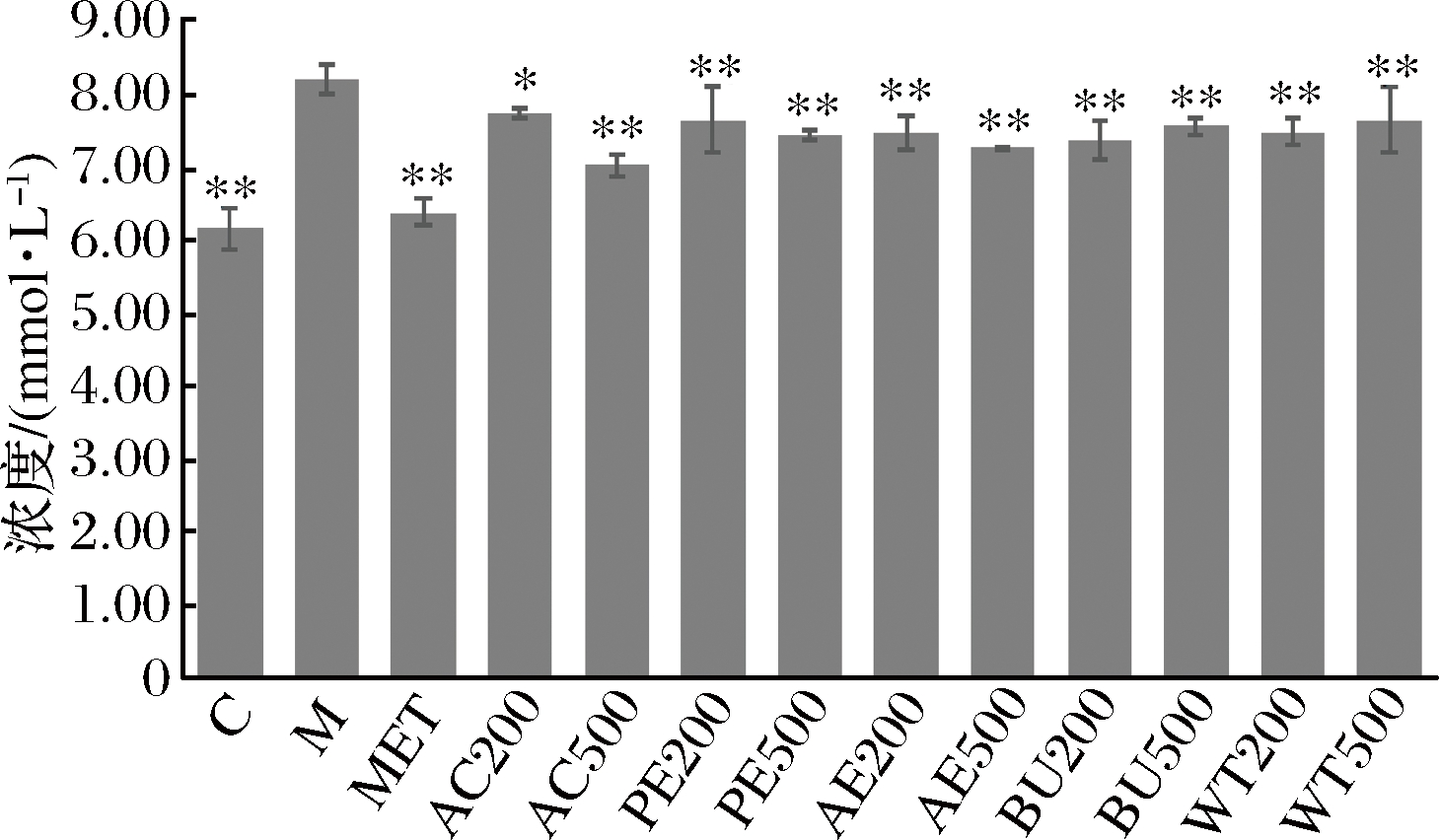
造模液处理24 h后,模型组细胞上清葡萄糖含量极显著高于对照组(P<0.01)。提取物与造模液共处理24h后,与模型组相比,AC200组细胞上清葡萄糖水平显著降低(P<0.05),其他各实验组细胞上清葡萄糖水平极显著降低(P<0.01)。结果表明,FFAs诱导后,HepG2细胞吸收葡萄糖的能力下降,松花乙醇提取物及各萃取相可促进细胞摄取葡萄糖,从而改善细胞的胰岛素抵抗水平(图5)。
2.3 松花粉乙醇提取物及各萃取相对细胞内糖原含量的影响
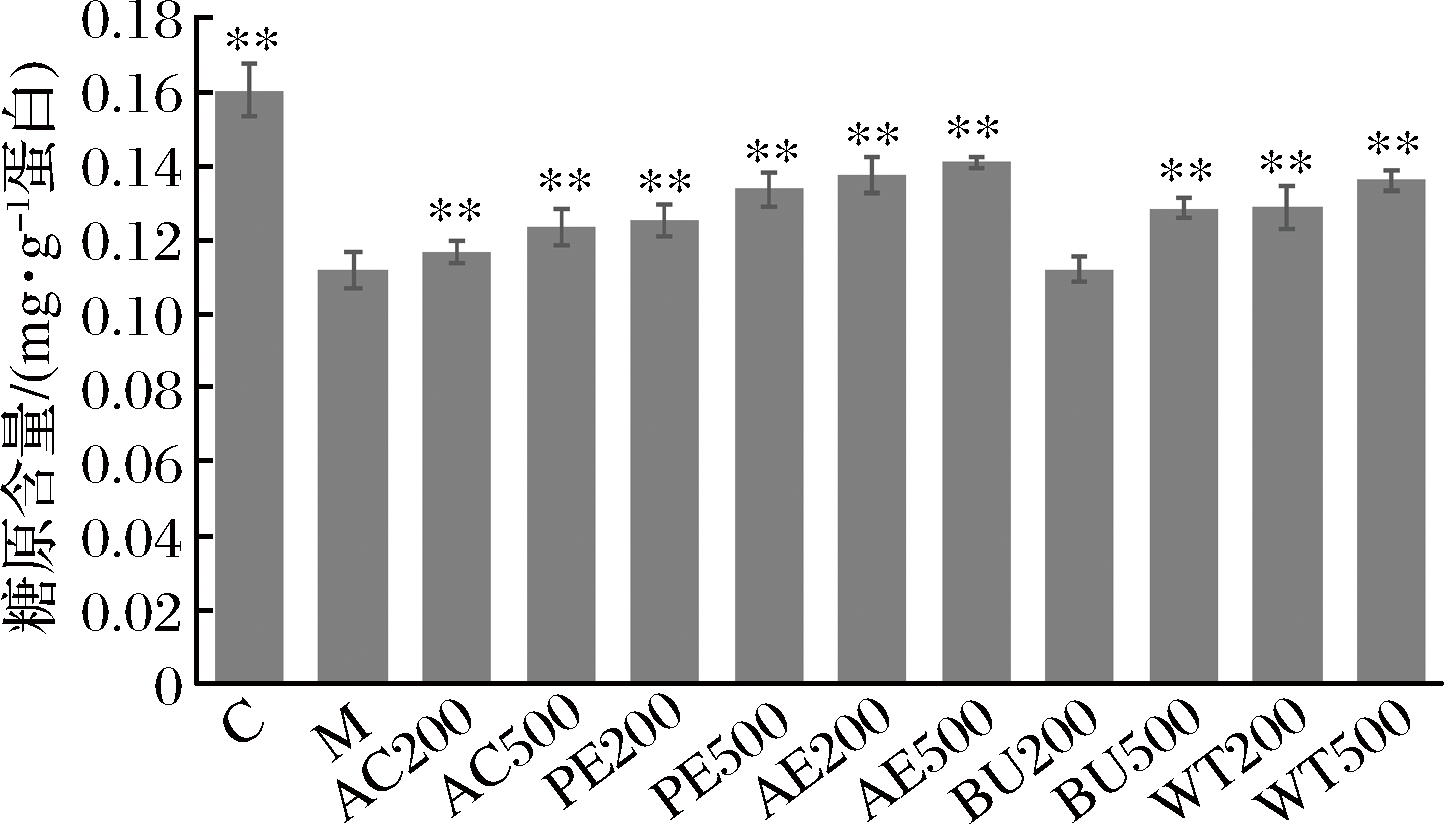
造模液处理24 h后,模型组细胞内糖原含量含量极显著低于对照组(P<0.01),如图4所示,造模液与提取物共处理24 h后,与模型组相比,各剂量AC组细胞内糖原水平均极显著提高(P<0.01),500 μg/mL AC组的糖原含量高于200 μg/mL组,呈现出一定的剂量依赖性;其他各萃取相结果与AC组结果类似,仅200 μg/mL BU组糖原水平与模型组相比无显著变化。综上所述,FFAs诱导后,HepG2细胞中糖原快速降解,松花粉乙醇提取物及各萃取相可以抑制细胞内糖原的降解[22],抑制糖异生途径,从而改善细胞的胰岛素抵抗水平(图4,图6)。
图4 油红O染色图(400×)
Fig.4 Oil Red O staining (400×)
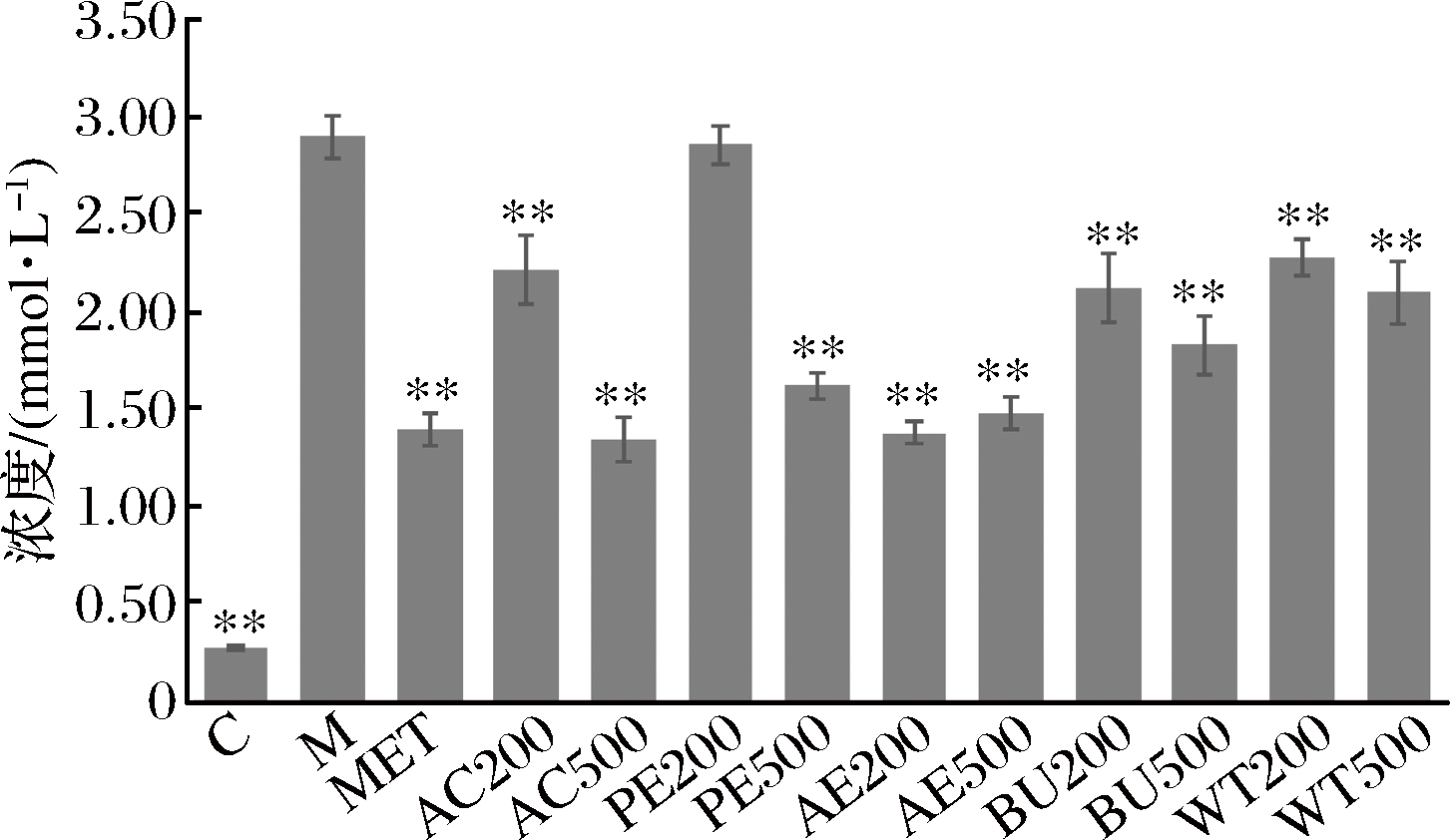
2.4 松花粉乙醇提取物及各萃取相对细胞内和上清甘油三酯(TG)含量的影响
模型组细胞内TG的含量显著高于对照组(P<0.01),如图5所示,提取物与造模液共处里24 h后,各剂量AC处理组细胞内TG含量与模型组相比极显著降低(P<0.01),且样品浓度越高,胞内TG的含量越低,呈现负相关性;如图6,AC组上清TG的含量明显高于模型组(P<0.01),且500 μg/mL AC组的上清TG含量高于200 μg/mL组,呈现一定的剂量依赖性;其他各萃取结果与AC结果相类似。因此,推测松花粉提取物调节胰岛素抵抗HepG2细胞脂代谢是通过将TG从细胞内转运到细胞外而实现的(图7,图8)。
图5 松花粉乙醇提取物及其萃取物处理24 h对上清葡萄糖含量的影响
Fig.5 Effect of pine pollen ethanol extract and its extracts on glucose content in supernatant for 24 h
注:与M组相比,*表示显示(P<0.05), **表示极显著(P<0.01)。
图6 松花粉乙醇提取物及其萃取物处理24 h对细胞内糖原含量的影响
Fig.6 Effect of pine pollen ethanol extract and its extracts on intracellular glycogen content for 24 h
注:与M组相比,**表示极显著(P<0.01)。
图7 松花粉乙醇提取物及其萃取物处理24 h对细胞内TG含量的影响
Fig.7 Effect of pine pollen ethanol extract and its extracts on TG content in cells for 24 h
注:与M组相比,**表示极显著(P<0.01)。
图8 松花粉乙醇提取物及其萃取物处理24 h对上清TG含量的影响
Fig.8 Effect of pine pollen ethanol extract and its extracts on the content of TG in supernatant for 24 h
注:与M组相比,**表示极显著(P<0.01)。
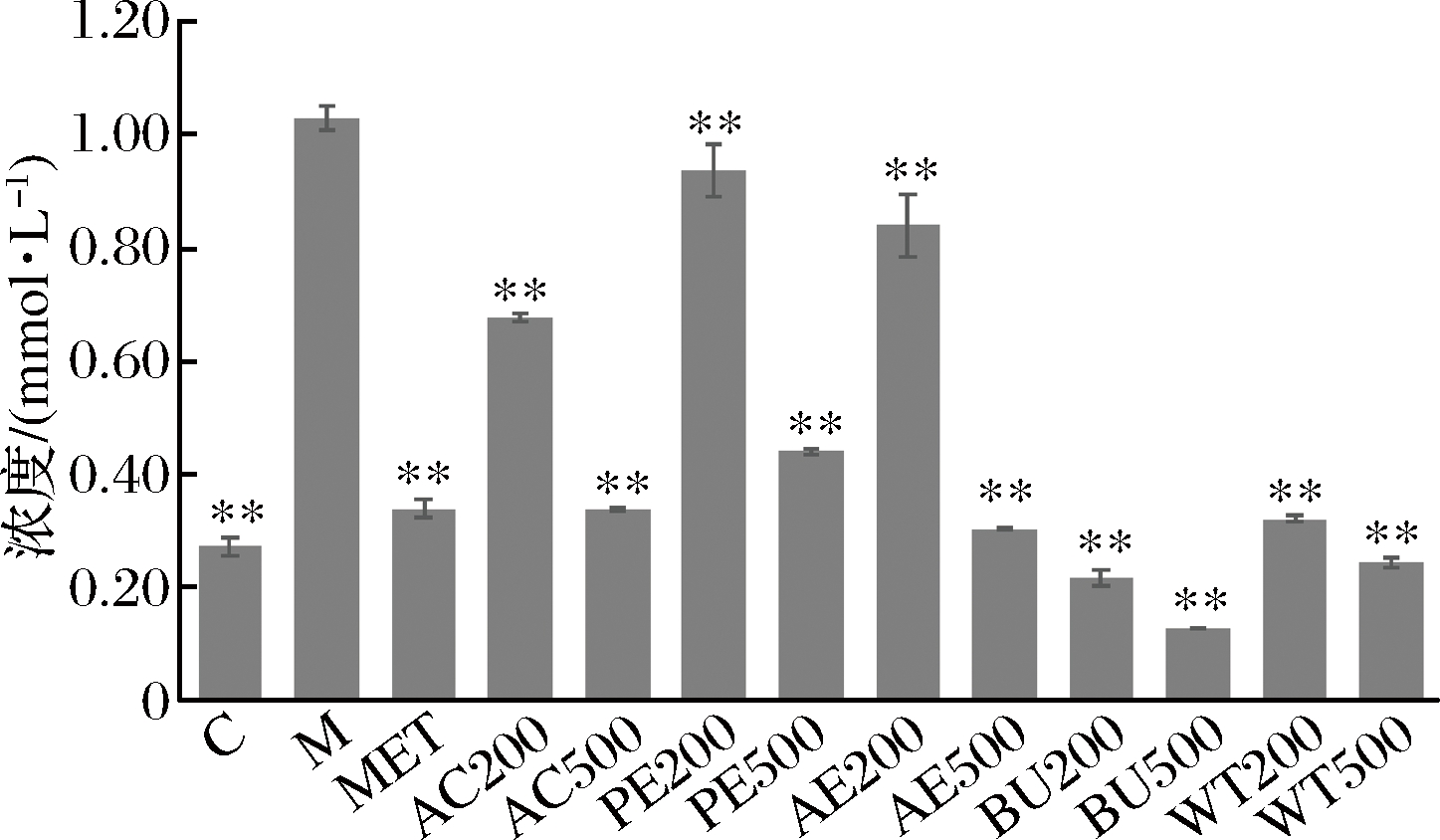
2.5 松花粉乙醇提取物及各萃取相对细胞内总胆固醇(TC)含量的影响
模型组细胞内TC含量明显高于对照组,为对照组的3.78倍,各剂量AC处理组的细胞内TC的含量极显著低于模型组(P<0.01),且呈现一定的剂量依赖性;其他各组结果与AC组类似。其中正丁醇萃取物处理后效果最为明显,500 μg/mL BU处理组细胞内TC含量最低,约为模型组的12.36%。结果表明,FFAs诱导后,细胞内总胆固醇含量显著上升,脂代谢出现异常,松花粉具有促进脂代谢,降低细胞内总胆固醇的作用(图9)。
图9 松花粉乙醇提取物及其萃取物处理24 h对细胞内TC含量的影响
Fig.9 Effect of pine pollen ethanol extract and its extracts on intracellular TC content after 24 h treatment
注:与M组相比,**表示极显著(P<0.01)。
2.6 松花粉对HepG2细胞中InSR,PI3K以及GLUT-4 mRNA表达量的影响。
图10 松花粉对HepG2细胞中InSR,PI3K以及GLUT-4 mRNA表达量的影响
Fig.10 Effect of pine pollen on the expression of InSR, PI3K and GLUT-4 mRNA in HepG2 cells
注:与M组相比,*表示显著(P<0.05),**表示极显著(P<0.01)。
与对照组相比,造模液处理24 h后,模型组细胞中InSR,PI3K以及GLUT-4 mRNA表达量显著下降(P<0.05),FFAs会导致胰岛素受体InSR的丝氨酸/苏氨酸磷酸化,从而降低活化PI3K的能力,并削弱下游胰岛素受体GLUT-4的信号传导(图10),这与SHULMAN的结论相一致[23]。与模型组相比,MET组InSR mRNA表达量显著上升,PI3K以及GLUT-4 mRNA表达量有一定程度的上调但没有统计学意义。AC组和PE组PI3K以及GLUT-4 mRNA表达量上调,AE组,BU组和WT组InSR,PI3K以及GLUT-4 mRNA表达量均上调,且组间差异具有统计学意义。说明不同极性的松花粉提取物可以通过调控PI3K/Akt/GLUT-4信号通路促进葡萄糖的转运,加速糖代谢;AE,BU,WT组还可以上调InSR的表达,增强胰岛素的敏感性。
3 讨论
HepG2细胞是一种表型与肝细胞极为相似的肝胚胎瘤细胞株,保留了肝细胞的许多生物学特性[24]。大量研究发现,人体出现代谢综合征与高糖高脂饮食有直接关系。故本文采用果糖、葡萄糖联合FFAs[25]诱导24 h建立胰岛素抵抗模型并给予各剂量不同极性松花粉提取物处理,检测上清葡萄糖,上清TG,细胞内糖原,TG和TC水平。发现松花粉处理组上清葡萄糖的含量显著低于模型组,而细胞内糖原的含量显著高于模型组,说明松花粉能够促进肝癌细胞吸收葡萄糖,抑制细胞内糖原的降解从而抑制肝糖异生;松花粉处理后细胞内TG和细胞内TC的含量下降,而上清TG的含量上升,说明松花粉可以调节HepG2细胞的脂代谢,其中调节TG代谢可能是通过将TG从细胞内转运到细胞外实现的。
机体物质代谢几乎都受到胰岛素的调控,一旦产生胰岛素抵抗,糖类、脂类和蛋白质代谢都会发生紊乱,胰岛素抵抗是机体物质代谢紊乱的共同通路[26]。胰岛素进入肝脏后,会与肝细胞膜上的InSR结合,并沿着PI3K/Akt/GLUT-4信号通路发生级联反应,对肝糖原的合成、分解、糖异生途径以及血糖稳定起调节作用。二甲双胍是口服降糖药物,被广泛应用于糖尿病的治疗。这也是二甲双胍起作用的主要途径之一。此外,二甲双胍还能通过激活腺苷酸活化蛋白激酶(AMPK)来实现降糖的作用[27]。本研究以HepG2细胞为研究对象,MET组细胞内InSR的表达量明显增多,说明MET能够通过提高HepG2细胞中InSR的表达量来增强胰岛素敏感性,但由于本研究采用FFAs诱导HepG2细胞产生胰岛素抵抗,在没有胰岛素存在的情况下,胰岛素不能与受体的α亚基相结合,从而改变β亚基的构象,进而影响了IRS1/2的磷酸化[28],因此,下游的PI3K和GLUT-4的表达量增加不明显,推测本研究中MET调节糖脂代谢主要是通过激活AMPK抑制细胞的合成代谢,调节细胞的能量代谢来实现的[29]。
本研究中AC组和PE组InSR的表达量与模型组相比没有显著变化,说明这2组松花粉提取物并非是通过增强胰岛素的敏感性来起到降糖的作用,而AE,BU和WT组中InSR的表达量与模型组相比显著提高,初步认为这3组提取物可以通过提高胰岛素的敏感性来起到降糖的作用。PI3K/Akt/GLUT-4信号通路是调节糖代谢的一条重要通路,多种生长因子和信号传导复合物,包括成纤维细胞生长因子(FGF)、血管内皮生长因子(VEGF)、人生长因子(HGF)、血管位蛋白I(Ang1),胰岛素以及氧化应激(ROS)都能启始PI3K的激活过程[30]。很多研究认为高胰岛素诱导的胰岛素抵抗HepG2模型中IRS1/PI3K/GLUT-4通路被激活,从而起到调节糖代谢的作用。与模型组相比,AE,BU,WT组细胞内InSR的mRNA表达量显著提高,5种松花粉提取物中PI3K和GLUT-4的含量均显著提高,说明松花粉提取物能够激活PI3K/Akt/GLUT-4信号通路,但是本研究中PI3K的激活过程不是由胰岛素起始的,推测可能是由于FFAs诱导HepG2细胞产生氧化应激所致,具体诱因有待进一步验证。
参考文献
[1] MOLLER D E. New drug targets for type 2 diabetes and the metabolicsyndrome[J]. Nature, 2001, 414: 821-827.
[2] YALOW R S, et al. Immunoassay of endogenous plasma insulin inman[J]. J Clin Invest, 1960, 39(7): 1 157-1 175.
[3] 祝红梅. FoxO1在氧化应激诱导糖异生/胰岛素抵抗机制中的作用[D].泸州:西南医科大学泸州医学院,2011.
[4] MAHADEV K, MOTOSHIMA H, WU Xiangdong, et al. The NAD(P)H oxidase homolog Nox4 modulates insulin-stimulated generation of H202 and plays an integral role in insulin signal transduction[J]. Mol Cell Biol, 2004, 24(5): 1 844-1 854.
[5] AVRAMOGLU R K, BASEIANO H, ADELI K. Lipid and lipoprotein dysregulation in insulin resistant states[J]. Clinica Chimica Acta, 2006, 368(1-2):l-19
[6] LI Y, WANG J, GU T, et al. Oleanolic acid supplement attenuates liquid fructose-induced adipose tissue insulin resistance through the insulin receptor substrate-1/phosphatidylinositol 3-kinase/Akt signaling pathway in rats[J]. Toxicol Appl Pharmacol, 2014, 277(2): 155-163.
[7] 赵金香,胡章云,李耀华,等.菊粉联合游泳训练对代谢综合征大鼠骨骼肌胰岛素受体底物1及葡萄糖转运子4表达的影响[J].中国糖尿病杂志,2017,25(9):831-835.
[8] 蔡双朋,李俊,黄成,等. 丹参酮Ⅰ对HepG2细胞胰岛素抵抗作用及机制的研究[J]. 安徽医科大学学报, 2016, 51(7): 974-977.
[9] MATSUDA S, NAKANISHI A, WADA Y, et al. Roles of PI3K/AKT/PTEN pathway as a target for pharmaceutical therapy[J]. Open Med Chem J, 2013, 7: 23-29.
[10] 石明隽,肖瑛,桂华珍,等. 糖尿病大鼠肾组织中AKT的表达及意义[J]. 中国老年学杂志, 2011, 31(22): 4 375-4 378.
[11] ALBURY-WARREN T M, PANDEY V, SPINEL L P, et al. Prediabetes linked to excess glucagon in transgenic mice with pancreatic active AKT1[J]. J Endocrinol, 2016, 228(1): 49-59.
[12] 樊柏林,刘烈刚. 破壁松花粉对大鼠降血脂效应及作用机制研究[J].职业与健康, 2005, 21 (6): 809-811.
[13] 潘小玲,竹剑平. 破壁松花粉的降血糖作用[J].中国医院药学杂志, 2006, 26 (6): 777-778.
[14] 毛永强. 松花粉的营养成分及保健功能综述[J]. 中国食物与营养, 2008(3): 50-52.
[15] 刘杰尔. 松花粉成分分析及其轻身减肥功能初探[D]. 杭州:浙江大学,2008.
[16] CAI Y Z, LUO Q, SUN M, et al. Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J]. Life Science, 2004, 74: 2 157-2 184.
[17] 俞卓裕.竹叶药用有效部位提取、分离、精制工艺技术的研究[D]. 杭州:浙江大学,2003.
[18] 郑婧.肉桂多酚对HepG2细胞脂质代谢的影响及其机制[J]. 山东医药, 2017(1):38-40.
[19] 欧露,麻燕妮,张彩平,等.烟酸通过下调PCSK9的表达促进HepG2细胞摄取LDL-C[J].中国药理学通报, 2017(2): 243-248.
[20] 李欣,王帅,周岳,等.羟基肉桂酸对HepG2和C2C12细胞糖脂代谢的调节作用[J]. 国际药学研究杂志, 2017(7): 693-698.
[21] 陈亚蓝,王雪青,王怡雯,等.普洱茶茶色素对HepG2细胞脂质代谢的影响及作用机理[J].食品科学, 2017, 38(17):203-209.
[22] SHULMAN G I. Cellular mechanisms of insulin resistance[J]. Journal of Clinical Investigation, 2000, 106(2): 171-176.
[23] KNOWLES B B,HOWE C C, ADEN D P. Human hepatocellular careinoma cell lines secrete the major plasma protein and hepatitis B surface antigen[J]. Science,1980,209(4 455): 497-499.
[24] 柳嘉,郭孝萱,吴薇,等.高糖高脂诱导胰岛素抵抗HepG2细胞模型的建立及活性成分的功能评价[J].食品科技, 2012, 37(3): 73-78.
[25] PICKUP J C. Inflammation and activated innate immunity in the pathogenesis of type2diabetes[J].Diabetes Care,2004,27(3):813-823.
[26] NOLAN C J, RUDERMAN N B, KAHN S E, et al. Insulin resistance as a physiological defense against metabolic stress: implications for the management of subsets of type 2 diabetes[J]. Diabetes, 2015, 64(3): 673-686.
[27] 刘颐轩,臧莎莎,宋光耀.二甲双胍分子机制的研究进展[J].中国糖尿病杂志,2015,23(4):375-377.
[28] XIAO B, SANDERS M J, UNDERWOOD E, et al. Structure of mammalian AMPK and its regulation by ADP[J]. Nature, 2011, 472(7342):230-233.
[29] 龙琼先,吴才良,唐治蓉,等.卵巢上皮性癌中血管内皮生长因子-C和酪氨酸激酶受体B表达与微淋巴管密度的关系[J]. 四川医学, 2015(7): 927-930.
[30] 高婷,王子旭,陈祝茗,等. ROS介导的氧化应激与自噬[J]. 中国畜牧兽医, 2018, 45(3):656-662.
Effects of pine pollen extracts on insulin resisted glycolipid metabolism in HepG2 cells
ZHAO Kexin1,3, XIA Kai1,3, YUAN Peng1,3, WEN Lin2, LI Aimin2, LI Yongqiang2, DUAN Shenglin1,3*
1(China Food Fermentation Industry Research Institute Co., Ltd., Beijing 100015, China) 2(Guozhen Health Technology (Beijing) Co., Ltd. Beijing 102206, China) 3(Beijing Key Laboratory of the Innovative Development of Functional Staple and the Nutritional Intervention for Chronic Disease Co., Ltd., Beijing 100015, China)
ABSTRACT This study aimed to evaluate the effects of pine pollen extracts on glycolipid metabolism in insulin-resistant HepG2 cells, and explore its underlying molecular mechanisms. The insulin-resistant HepG2 cell model was established by free fatty acids and validated using Oil red O staining. MTT assay was used to study the effects of pine pollen extracts with different polarities on cell proliferation. Levels of glucose, glycogen, and triglycerides (TG) in cell supernatants were measured. TG and total cholesterol (TC) in cytoplasm were also determined. Quantitative real-time PCR (qRT-PCR) was used to detect the mRNA expression levels of glucose and lipid metabolism-related genes in cell lysis buffer, such as InSR, PI3K and GLUT-4. The results showed that there were no obvious toxic effects of pine pollen extracts on HepG2 cells at 100-500 μg/mL. The absorption of glucose and transhipment of TG were promoted, and the degradation of glycogen and formations of TG and TC were suppressed after pine pollen extracts treatment, indicating that the insulin-resistance of HepG2 was improved. Meanwhile, the mRNA expressions of PI3K and GLUT-4 significantly increased in all pine pollen extracts treatment groups, which means that pine pollen could promote glucose metabolism by activating the PI3K/Akt/GLUT-4 pathway. It was also found that pine pollen after ethyl acetate, butanol and water treatments could attenuate insulin resistance through enhancing insulin sensitivity, because the mRNA expression of InSR up-regulated significantly among these three groups.
Key words pine pollen;glycolipid metabolism;q-RT PCR;InSR;PI3K;GLUT-4