李玲*,郭燕云,周怡
(临沂大学 生命科学学院,山东 临沂,276000)
摘 要 采用羟自由基氧化体系(H2O2浓度为0、0.5、1、5和10 mmol/L)对猪肉肌原纤维蛋白进行不同氧化程度处理,研究氧化对蛋白质理化特性和凝胶水分分布的影响。结果表明,随H2O2浓度升高,猪肉肌原纤维蛋白游离巯基含量下降,表面疏水性增加,二聚酪氨酸含量升高,内源色氨酸荧光强度降低,说明蛋白质氧化程度增加。随H2O2浓度升高,蛋白凝胶的蒸煮得率、白度和保水性均显著下降(P<0.05),与对照组相比,10 mmol/L组分别下降了22.4%、4.33%和16.47%。低场核磁共振结果显示,氧化处理不影响凝胶的结合水含量,但会显著影响不易流动水和自由水的比例。随H2O2浓度升高,凝胶中的不易流动水含量降低,自由水增加,与凝胶保水性结果一致。相关性分析表明,凝胶保水性与蛋白质侧链氧化程度密切相关。
关键词 肌原纤维蛋白;蛋白质氧化;理化特性;水分分布
DOI:10.13995/j.cnki.11-1802/ts.018135
第一作者:教授(本文通讯作者,E-mail:lytuliling@163.com)。
基金项目:国家自然科学基金(31501503)
收稿日期:2018-06-27,改回日期:2018-07-20
肌原纤维蛋白是肉类中含量最高最重要的蛋白质,占总蛋白的55%~60%,其主要功能特性是能够形成热诱导凝胶,从而赋予肉类制品良好的质地和口感。肉类产品在加工过程中很容易发生蛋白质氧化从而导致产品质量下降,营养价值降低,甚至影响消费者的健康安全[1]。蛋白质氧化会导致蛋白质侧链基团修饰,蛋白质大分子发生交联聚集等,从而影响肉制品的色泽、保水性和口感[2]。近年来关于肌原纤维蛋白氧化凝胶特性的研究多集中在氧化剂种类、浓度、离子强度(食盐、磷酸盐含量)及不同的抗氧化剂等方面[3-6]。关于氧化的肌原纤维蛋白对热诱导凝胶特性的研究机制还有待继续探讨[7-9],凝胶水分分布与蛋白质氧化程度之间的关系需要深入研究。本试验采用羟自由基模拟氧化体系对肌原纤维蛋白进行不同程度的氧化处理,研究氧化程度对蛋白活性巯基、疏水性、二聚酪氨酸以及内源色氨酸荧光强度等蛋白质理化特性的影响,采用低场核磁技术研究蛋白质氧化与凝胶水分分布之间的关系,为凝胶类肉制品的加工提供一定的理论依据。
猪背最长肌(小里脊)购自南京苏果超市,本研究主要在南京农业大学国家肉品工程中心完成。KCl、MgCl2、EGTA、Na2HPO4、NaCl、NaOH、CuSO4、酒石酸钾钠、FeCl3、抗坏血酸、H2O2、甘氨酸、EDTA、DTNB(5,5’-二硫双(5’-硝基苯甲酸))、Trolox(水溶性维生素E),以上试剂均为分析纯,购于国药集团化学试剂有限公司。牛血清蛋白,购于沃卡威(北京)生物技术有限公司。
PQ001核磁共振分析仪,上海纽迈电子设备有限公司;RetschGM200绞肉机,IKA T25匀浆机,Avanti J-26S XP高速冷冻离心机,美国Beckman coulter;CR-400色差仪(日本柯尼卡美能达公司),M2e多功能酶标仪(美国MD公司),UV-2800A型紫外可见分光光度计。
1.3.1 肌原纤维蛋白的提取
参考PARK等[10]和FENG等[5]的方法并略作修改。在市场上购买最新鲜的猪背肌(小里脊),用刀剔除猪肉上多余的筋膜、脂肪后,将猪肉切成均匀的小块并用绞肉机搅碎,所得的肉糜用于接下来提取猪肉肌原纤维蛋白。称取50 g肉样,加4倍体积的pH 7.0缓冲液(0.1 mol/L KCl, 2 mmol/L MgCl2, 1 mmol/L EDTA, 10 mmol/L Na2HPO4)匀浆离心,弃上清液,取沉淀重复上述步骤3遍。所得沉淀加入4倍体积的0.1 mol/L NaCl洗液,匀浆离心,沉淀重复洗涤2次,第3次加洗液匀浆后,用4层纱布过滤以除去结缔组织等,最后用0.1 mol/L HCl调pH值为6.25后离心除去上清液,所得膏状物为肌原纤维蛋白。
1.3.2 羟自由基氧化体系的构建及氧化
参考XIONG等[11]的方法并修改。首先用20 mmol/L磷酸盐缓冲溶液(pH 7.0)将猪肉肌原纤维蛋白溶解后,在溶解后的蛋白质溶液中依次加入无水FeCl3、抗坏血酸、H2O2溶液以用来构建羟自由基的模拟氧化体系,并且整个体系最终含有以下成分:20 mg/mL的猪肌原纤维蛋白、0.01 mmol/L的FeCl3和0.1 mmol/L的VC,其中的H2O2分为0、0.5、1、5、10 mmol/L 5个浓度梯度。在4 ℃恒温操作间中氧化12个小时后,用1 mmol/L Trolox/EDTA来终止氧化反应,此即为氧化后的猪肉肌原纤维蛋白,贮藏于0~4 ℃,2 d内用完。
自由巯基和总巯基含量按照XIA等[12]的方法进行测定。疏水性测定采用溴酚蓝结合法进行,参照CAO[4]描述的方法进行测定。二聚酪氨酸含量参考李学鹏等[13]的方法测定。内源色氨酸荧光的变化通过F4600荧光分光光度仪进行检测。用 20 mmol/L磷酸盐缓冲溶液(pH 7.0)将样品稀释为0.1 mg/mL。激发波长283 nm,记录下300~400 nm的发射光谱。
将氧化后的猪肉肌原纤维蛋白调至40 mg/mL后,在80 ℃下水浴30 min,制得凝胶,用于测定其蒸煮得率、白度、保水性及凝胶水分分布分析。
1.5.1 蒸煮得率计算
将凝胶倒置于滤纸上,用滤纸吸干水分,称量凝胶重量。蒸煮得率以蒸煮后的质量与蒸煮前的质量的比值计算。
1.5.2 凝胶白度测定
用色差仪测定蛋白凝胶的色差值,其中亮度值L*;红度值a*;黄度值b*。仪器经零点白板校正后进行样品测定,每组测定3次,取平均值。凝胶白度值按式(1)计算。
![]()
(1)
1.5.3 凝胶保水性测定
用离心法测定凝胶保水性(water holding capacity,WHC),将制备好的蛋白凝胶准确称其质量后,于 4 ℃下 6 000×g离心15 min,记录离心前后离心管的质量以及空管质量。WHC按式(2)计算。
![]()
(2)
式中:m2为离心出液体后离心管与凝胶的质量,g;m1为离心前离心管与凝胶的质量,g;m为空管质量,g。
1.5.4 凝胶水分分布的测定
低场核磁数据测量参考HAN等[6]和JI等[14]的方法进行。测定条件:质子共振频率为22.6 MHz,测量温度为32 ℃。将大约1.0 g样品放入直径15 mm核磁管中,随后立即放入PQ001核磁共振成像仪中进行分析。采用Carr-Purcell-Meiboom-Gill(CPMG)序列测定样品弛豫时间T2 值。不同弛豫时间各峰峰面积分别记为P21,P22和P23。
试验重复进行3次,每次重新提取肌原纤维蛋白。用SPSS 18.0统计软件进行单因素方差分析,Duncan’s多重比较和差异显著性分析(P<0.05)。所有数据均为平均值±标准差。
氧化程度对肌原纤维蛋白游离巯基含量的影响见图1。游离巯基的含量随H2O2浓度的升高而降低,对照组与其余各组之间差异显著(P<0.05)。当H2O2浓度1 mmol/L时,游离巯基含量比对照组降低了9.6%,H2O2浓度为10 mmol/L时下降最明显,下降了19.4%。这与前人的研究基本一致[15-16],氧化导致肌原纤维蛋白的游离巯基转变为二硫键及相关化合物,氧化同时引起蛋白质侧链结构发生修饰,导致游离巯基含量减少。本课题组前期研究也发现添加抗氧化剂也未能阻止氧化引起的巯基减少[17],其原因可能是蛋白质侧链中巯基是最容易受到氧化攻击的基团。
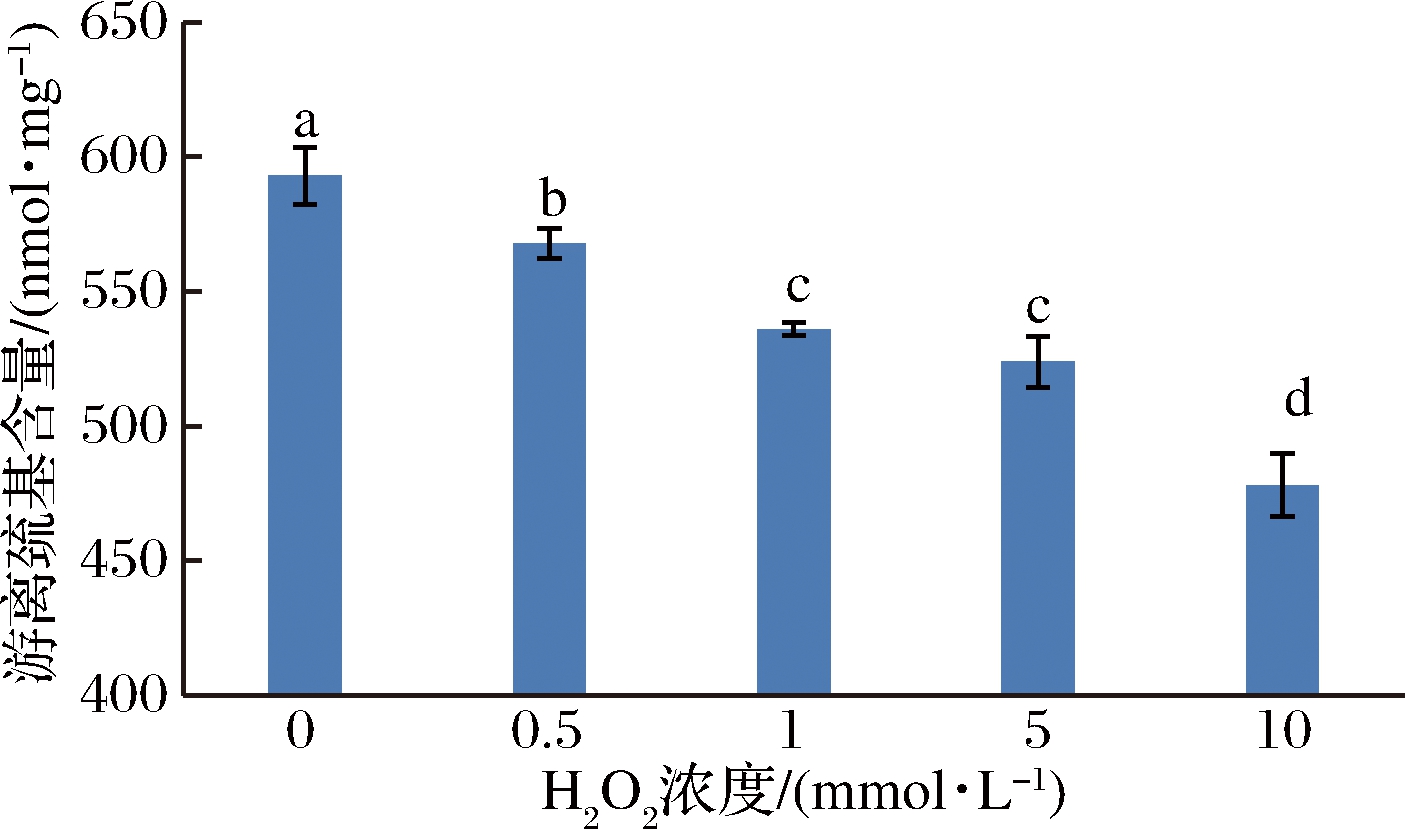
图1 不同氧化程度对肌原纤维蛋白游离巯基含量的影响
Fig.1 Effect of different oxidation degrees on the freesulfydryl of myofibrillar protein
注:图中不同字母表示差异显著(P<0.05)。下同。
氧化程度对肌原纤维蛋白表面疏水性的影响见图2。随着H2O2浓度的升高,蛋白质表面疏水性逐渐增大。H2O2浓度0 mmol/L与0.5 mmol/L组差异不显著(P<0.05),这可以说明在较低的浓度进行氧化处理时,蛋白质的构象变化很小。继续增大H2O2浓度,溴酚蓝(BPB)结合量显著增大,H2O2浓度为1 mmol/L 与5 mmol/L组差异显著(P<0.05)。H2O2浓度5 mmol/L与10 mmol/L 组差异显著(P<0.05)。其中,5 mmol/L组H2O2浓度比对照组增加了75.3%;而10 mmol/L组比对照组增加了103.6%。蛋白质氧化后,经过变性解折叠,就会很容易增强其表面疏水性,从而分子之间就会发生交联和聚集等反应[11]。本研究中随氧化剂浓度的升高,蛋白质表面疏水性增加,这说明蛋白质的构象在氧化剂处理下会发生比较显著的变化,蛋白质分子的表面会暴露出更多的疏水氨基酸残基,并且逐渐被氧化,此外,蛋白质的疏水性还与其他的许多因素有关,比如氨基酸之间会发生疏水相互作用以及氧化会导致的蛋白质间发生聚集和交联等反应[18]。所以,蛋白质的侧链发生氧化、去折叠和聚集等变化,从而三者之间的相互影响导致蛋白质的疏水性等性质发生改变。
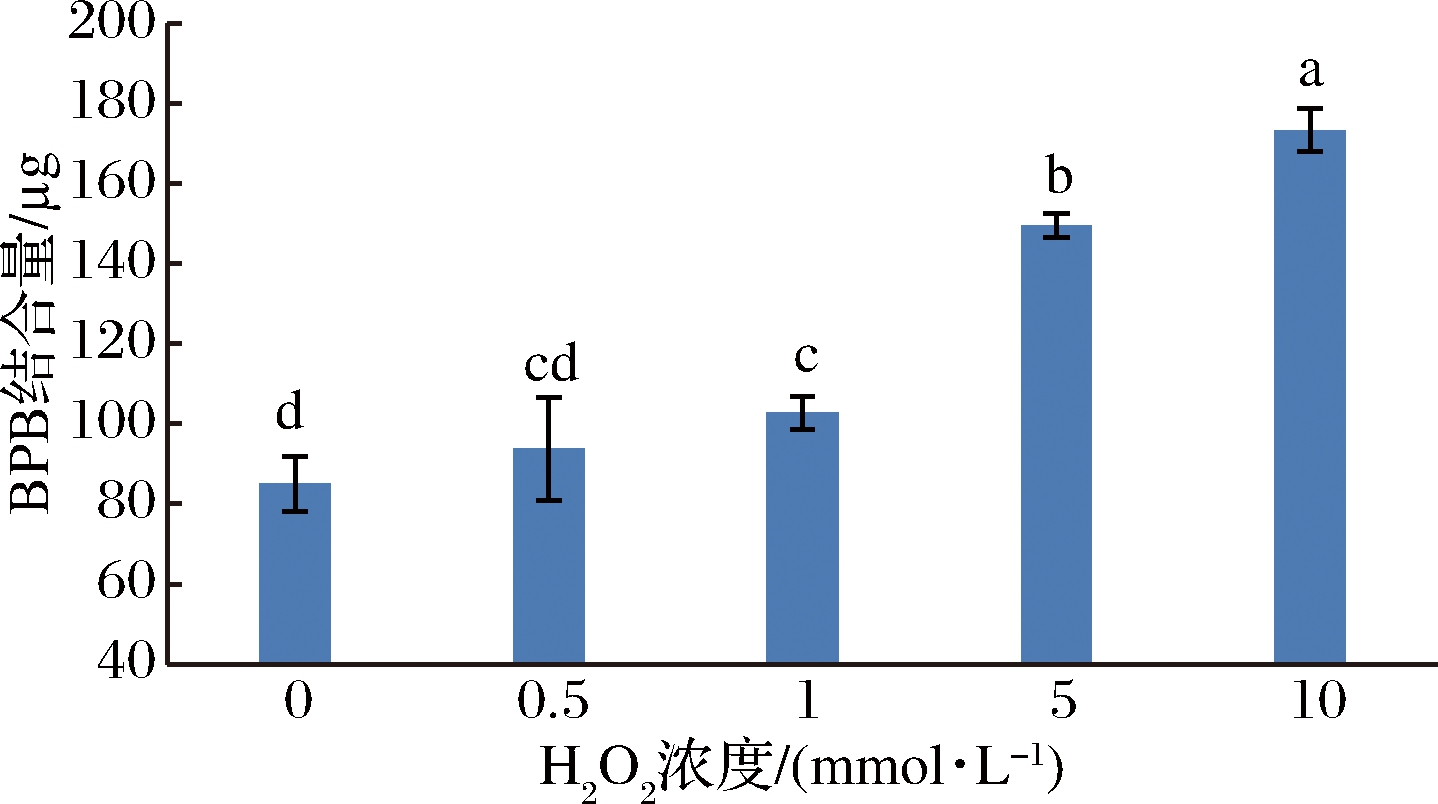
图2 不同氧化程度对肌原纤维蛋白表面疏水性的影响
Fig.2 Effect of different oxidation degrees on the BPB content of myofibrillar protein
肌原纤维蛋白酪氨酸残基被氧化后就会形成二聚酪氨酸,并且会通过共价键和非共价键之间的相互作用形成蛋白质的聚集物,能够反映蛋白质氧化的程度和蛋白质结构的变化。猪肉肌原纤维蛋白经羟自由基氧化处理之后,二聚酪氨酸的含量变化如图3所示,随着氧化剂浓度的增加,二聚酪氨酸相对荧光值增大,0.5、5和10 mmol/L组与对照组差异显著(P<0.05)。与对照组相比,5 mmol/L和10 mmol/L组分别增加了50%和57%,说明酪氨酸残基对于·OH也比较敏感,易发生交联反应进一步聚合而形成二聚酪氨酸。有研究采用2种自由基氧化大黄鱼肌原纤维蛋白时均发现,随氧化剂浓度的升高,二聚酪氨酸含量显著增加,并且与对照组相比差异显著[13]。而XIONG等[19]研究发现在3种氧化体系中,肌原纤维蛋白的二聚酪氨酸含量与对照组没有显著差异,其测定的酪氨酸含量与其他食品中含量一致,认为二聚酪氨酸不是蛋白质氧化交联的主要方式。出现不同的研究结果,可能与氧化剂的浓度以及氧化体系的差异引起的,将来有可能探讨二聚酪氨酸新的测定方法,解决争议问题。
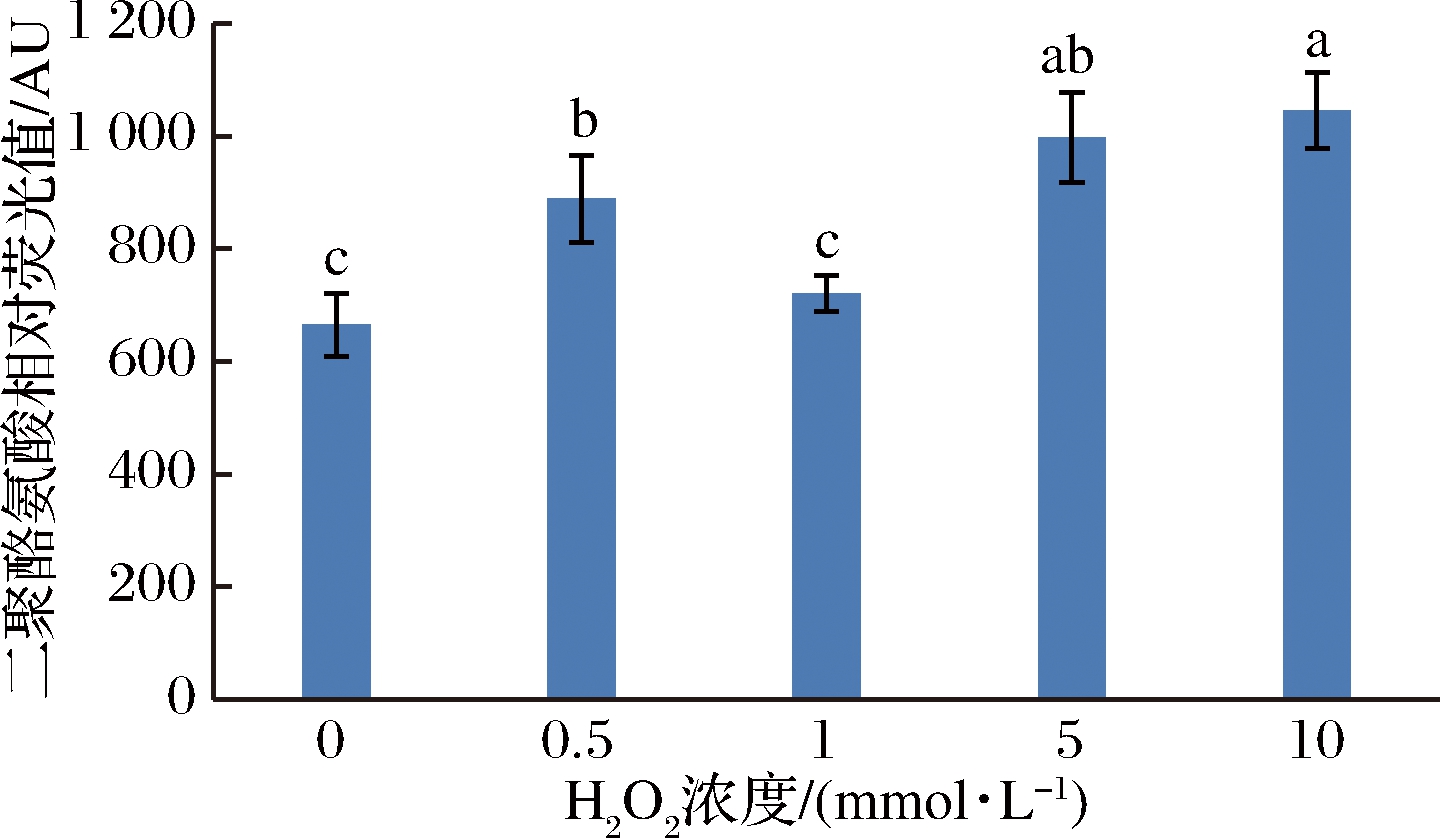
图3 不同氧化程度对肌原纤维蛋白二聚酪氨酸含量的影响
Fig.3 Effect of different oxidation degrees on the dityrosine of myofibrillar protein
肌原纤维蛋白内源色氨酸荧光强度见图4,随着H2O2浓度的逐渐升高,蛋白内源荧光强度显著降低。内源荧光是用来表示蛋白质氧化程度和微环境的影响,进而揭示蛋白质的结构变化情况。

图4 不同氧化程度对肌原纤维蛋白内源色氨酸荧光的影响
Fig.4 Effect of different oxidation degrees on the tryptophan fluoescence of myofibrillar protein
对于蛋白质内源荧光强度下降的原因,我们认为一种可能是在蛋白质的氧化初期,由于色氨酸残基发生了包埋而引起的,并且随着时间的延长包埋的效率会逐渐越来越低,由此可知蛋白质的包埋程度会受到氧化剂浓度的影响,并且所受影响较大;另一种可能是氧化处理会使得蛋白质侧链中的荧光氨基酸被猝灭等[20]。
氧化程度对猪肉肌原纤维蛋白凝胶性能的影响见表1。蛋白质凝胶的蒸煮得率随H2O2浓度的增加,凝胶蒸煮得率降低,各组之间显著差异(P<0.05)。5 mmol/L H2O2组与对照组相比,凝胶蒸煮得率下降了24.16%,10 mmol/L组与对照组相比,凝胶蒸煮得率下降了22.4%,这可能是由于在较高浓度的氧化处理之下,就会破坏猪肉蛋白质结构,蛋白构象发生变化,部分水分析出,形成汁液流失,从而导致凝胶的蒸煮得率显著降低[3]。
如表1所示,随H2O2浓度的增加,白度值逐渐下降,10 mmol/L组与对照组显著差异(P<0.05),其余各组与对照组差异不显著(P>0.05)。蛋白凝胶的白度可以体现蛋白质的变性程度,根据XIA等[21]的研究发现,蛋白凝胶白度值的下降,与氧化产物和蛋白质的氨基酸侧链之间发生非酶褐变等的反应相关。本研究中,高浓度的H2O2,导致蛋白质氧化严重。
表1 氧化程度对肌原纤维蛋白凝胶蒸煮得率、白度及保水性的影响
Table 1 Effect of different oxidation degrees on the boiling rate, whiteness and water holding capacity of myofibrillar protein
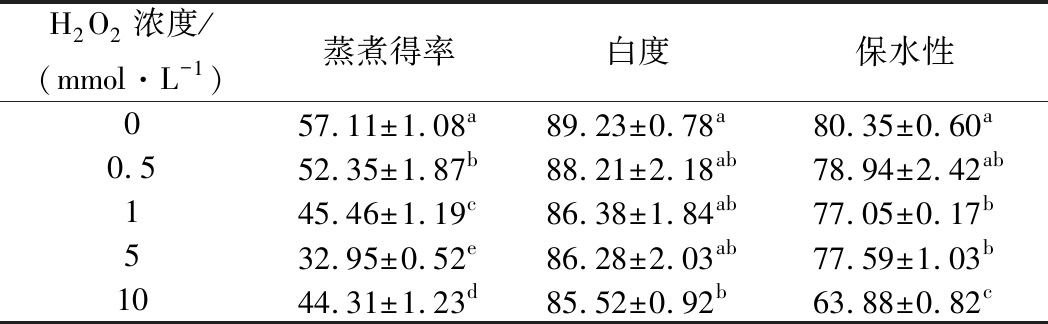
注:同列不同小写字母表示差异显著(P<0.05)。下同。
蛋白凝胶的保水性随H2O2浓度的增加而降低,10 mmol/L组与其余各组差异显著(P<0.05)。与对照组相比,当H2O2浓度增加到 10 mmol/L时,蛋白质凝胶保水性下降了16.47%(P<0.05)。蛋白质凝胶的保水性主要是由于蛋白质的水合作用和毛细管作用力,从而水分就会被束缚在蛋白质的凝胶网络结构中。肌原纤维蛋白热诱导凝胶有以下作用力:疏水作用力、氢键、静电作用力、巯基氧化形成的二硫键等,需要经历变性、聚集和交联3个过程,任何影响这3个过程的因素都会影响蛋白质的热诱导凝胶特性[10]。高浓度氧化剂导致肌原纤维蛋白交联形成部分二硫键,蛋白质分子表面也会暴露出更多的疏水氨基酸残基,疏水性氨基酸通过疏水相互作用形成不溶性聚集物,溶解度下降,使肌原纤维蛋白凝胶结构变得疏松,在凝胶结构中产生较多的空隙,水分流失,使得蛋白质的水合作用和毛细管作用力逐渐降低,并且蛋白质凝胶网络中的空隙逐渐增多,让蛋白质凝胶中一部分不易流动的水变成了自由水,所以凝胶保水性也变差[3]。
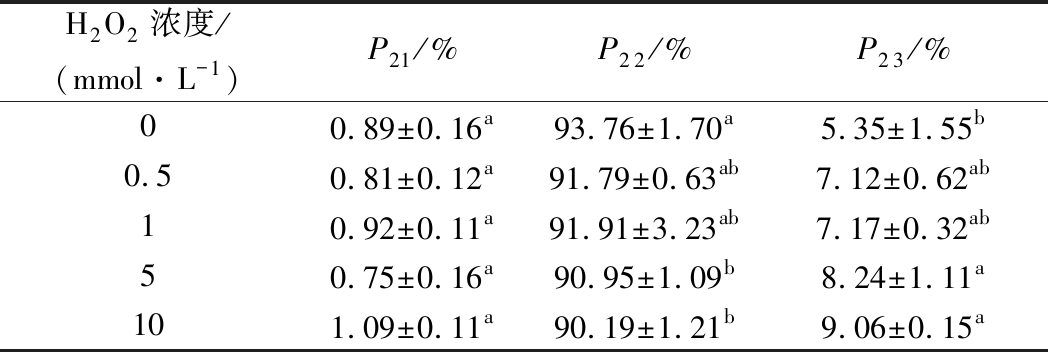
氧化程度对肌原纤维蛋白水分分布图谱见图5。

图5 不同氧化程度对肌原纤维蛋白凝胶水分子的T2弛豫特性的影响
Fig.5 Effect of different oxidation degrees on T2 relaxation time of myofibrillar protein
猪肉肌原纤维蛋白凝胶弛豫时间(T2)在1~10 000 ms 内出现了3个峰,这与韩敏义等[6]研究猪肉肌原纤维蛋白热凝胶的试验结果基本一致。T2值范围内对应的3个峰分别对应凝胶中的3种状态的水,弛豫时间T21在0~15 ms,属于凝胶中的结合水,弛豫时间T22在63~382 ms,属于凝胶中的不易流动水,弛豫时间T23在714~2 171 ms,属于凝胶中的自由水。弛豫时间(T2)在1~10 000 ms对应的3个峰的峰面积分别记为P21, P22,P23。通过分析各峰的峰面积结果可以得知(如表2),H2O2浓度对结合水含量P21影响不大(P>0.05)。结合水是肌原纤维蛋白凝胶中与蛋白质大分子结合的水分子,大部分研究结果表明,T21与肉的微观结构及机械压力无关[22-23]。不易流动的水P22随H2O2浓度的增加而下降,其中H2O2浓度为5 mmol/L和10 mmol/L时与对照组差异显著(P<0.05),H2O2浓度为0.5 mmol/L和1 mmol/L 时与对照组差异不显著(P>0.05)。自由水含量P23随H2O2浓度的增加而增加,其中H2O2浓度为0.5 mmol/L 和1 mmol/L 时与对照组差异不显著(P>0.05), H2O2浓度为5 mmol/L和及10 mmol/L时与对照组差异显著(P<0.05),P23分别增加了54%和73%。上述分析表明,随着H2O2浓度的升高,猪肉肌原纤维蛋白凝胶中的一部分不容易流动的水可能会变成自由水,但自由水是蛋白凝胶结构中结合最不紧密的水和最容易损失的水[24]。其他研究也发现,猪肉保水性与T2弛豫时间存在很强的相关性[25-26]。因此,H2O2浓度越大,不易流动的水含量越低,而自由水含量就越高,凝胶保水性越低,这与本试验关于猪肉肌原纤维蛋白的凝胶保水性研究结果相一致。
表2 羟自由基氧化对猪肌原纤维蛋白热诱导凝胶峰面积的影响
Table 2 Effect of different oxidation degrees on thepeaks area proportion of myofibrillar protein
由相关性分析表明(见表3),H2O2浓度与猪肌原纤维蛋白中游离巯基含量极显著负相关(r=-0.931, P<0.01),与疏水性值(r=0.963,P<0.01)和二聚酪氨酸含量(r=0.787,P<0.01)正相关,说明H2O2浓度越高,蛋白质侧链基团越容易被氧化修饰,从而影响蛋白质的功能特性。H2O2浓度与凝胶蒸煮得率(r=-0.554,P<0.05)显著负相关,及凝胶保水性(r=-0.904,P<0.01)极显著负相关,说明H2O2浓度越高,凝胶的蒸煮得率、保水性越差。同时游离巯基含量与凝胶蒸煮得率显著相关(r=0.597,P<0.05),与凝胶保水性(r=0.888,P<0.01) 极显著相关;疏水性与凝胶蒸煮得率极显著负相关(r=-0.702,P<0.01),与凝胶保水性(r=-0.790, P<0.01)极显著负相关。这表明H2O2浓度越高,蛋白被氧化程度越严重,凝胶的蒸煮得率、保水性越差。
表3 各指标相关性分析
Table 3 Correlation analysis between indexes of gels

注:*表示P<0.05 水平差异显著;**表示P<0.01 水平差异极显著。
在羟自由基氧化体系中,随着氧化剂浓度的增加,猪肉肌原纤维蛋白游离巯基含量、内源色氨酸荧光强度、蛋白质凝胶的蒸煮得率、白度和保水性以及低场核磁中不易流动水含量显著下降,而二聚酪氨酸含量、表面疏水性和低场核磁中自由水含量增加。以上变化可以说明氧化处理使肌原纤维蛋白侧链基团中的游离巯基、酪氨酸、色氨酸残基发生显著的氧化修饰,蛋白质分子之间彼此发生交联和聚集等反应,蛋白质构象进一步发生显著变化,进而影响其凝胶的保水性。
参考文献
[1] 周光宏,李春保,徐幸莲. 肉类食用品质评价方法研究进展[J]. 中国科技论文, 2007, 2(2):75-82.
[2] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2007, 101(3): 1 239-1 246.
[3] 李银,李侠,张春晖,等. 羟自由基导致肉类肌原纤维蛋白氧化和凝胶性降低[J]. 农业工程学报, 2013(12): 286-292.
[4] CAO Y, XIONG Y L. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry, 2015, 180: 235-243
[5] FENG X, CHEN L, LEI N, et al. Emulsifying properties of oxidatively stressed myofibrillar protein emulsion Gels prepared with (-)-epigallocatechin-3-gallate and NaCl[J]. Journal of Agricultural and Food Chemistry, 2017, 65(13): 2 816-2 826.
[6] HAN M, WANG P, XU X, et al. Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with microstructural characteristics[J]. Food Research International, 2014, 62:1 175-1 182.
[7] NIU H, CHEN Y, ZHANG H, et al. Protective effect of porcine plasma protein hydrolysates on the gelation of porcine myofibrillar protein exposed to a hydroxyl radical-generating system[J]. International Journal of Biological Macromolecules, 2018,107:654-661.
[8] ZHUANG X, JIANG X, HAN M, et al. Influence of sugarcane dietary fiber on water states and microstructure of myofibrillar protein gels[J]. Food Hydrocolloids, 2016, 57:253-261.
[9] 梁慧,于立梅,陈秀兰,等. 多酚对鸡肉氧化脂肪诱导蛋白质变性的影响[J]. 食品与发酵工业, 2016, 42(5):146-151.
[10] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2007, 101(3): 1 239-1 246.
[11] XIONG Y L, BLANCHARD S P, OOIZUMI T, et al. Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J]. Journal of Food Science, 2010, 75(2):C215-C221.
[12] XIA X, KONG B, LIU Q, et al. Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freeze-thaw cycles[J]. Meat Science, 2009, 83(2): 239-245.
[13] 李学鹏,周凯,周明言,等. 自由基氧化对大黄鱼肌原纤维蛋白交联和聚集的影响[J]. 中国食品学报, 2015, 15(4): 13-21.
[14] JI H, DONG S, HAN F, et al. Effects of dielectric barrier discharge (DBD) cold plasma treatment on physicochemical and functional properties of peanut protein[J]. Food & Bioprocess Technology, 2018, 11(2):344-354.
[15] 胡忠良,邹玉峰,林玉海,等. 氧化程度对肌原纤维蛋白热凝胶及理化特性的影响[J]. 食品科学, 2013, 34(17):19-23.
[16] 陈霞霞,杨文鸽,吕梁玉,等. 羟自由基氧化体系对银鲳肌原纤维蛋白生化特性及其构象单元的影响[J]. 食品科学, 2016, 37(23):123-128.
[17] 李玲,季慧,段家玉. 绿原酸抑制猪肉肌原纤维蛋白氧化及NDEA生成的作用研究[J]. 食品工业科技, 2018, 39(8): 29-33.
[18] SUN W, ZHOU F, SUN D W, et al. Effect of oxidation on the emulsifying properties of myofibrillar proteins[J]. Food & Bioprocess Technology, 2013, 6(7):1 703-1 712.
[19] XIONG Y L, PARK D, OOIZUMI T. Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J]. Journal of Agricultural & Food Chemistry, 2009, 57(1):153-159.
[20] ZHANG T, XUE Y, LI Z, et al. Effects of ozone-induced oxidation on the physicochemical properties of myofibrillar proteins recovered from bighead carp (Hypophthalmichthys nobilis)[J]. Food & Bioprocess Technology, 2015, 8(1):181-190.
[21] XIA X, KONG B, XIONG Y, et al. Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science, 2010, 85(3):481-486.
[22] PEARCE K L, ROSENVOLD K, ANDERSEN H J, et al. Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes—A review[J]. Meat Science, 2011, 89(2): 111-124.
[23] SHAO J H, DENG Y M, JIA N, et al. Low-field NMR determination of water distribution in meat batters with NaCl and polyphosphate addition[J]. Food Chemistry, 2016, 200: 308-314.
[24] WANG L, ZHANG M, BHANDARI B, et al. Effects of malondialdehyde-induced protein modification on water functionality and physicochemical state of fish myofibrillar protein gel[J]. Food Research International, 2016, 86:131-139.
[25] LI C, LIU D, ZHOU G, et al. Meat quality and cooking attributes of thawed pork with different low field NMR T21[J]. Meat Science, 2012, 92(2): 79-83.
[26] BERTRAM H C, ANDERSEN H J, KARLSSON A H. Comparative study of low-field NMR relaxation measurements and two traditional methods in the determination of water holding capacity of pork[J]. Meat Science, 2001, 57(2): 125-132.
LI Ling*, GUO Yanyun, ZHOU Yi
(College of Life Science, Linyi University, Linyi 276000, China)
ABSTRACT The effects of 0, 0.5, 1, 5 and 10 mmol/L H2O2 induced oxidation on gelling water distribution and physicochemical properties of pork myofibrillar protein (MP) gels were investigated. The results showed that in MP, free sulfydryl content declined and surface hydrophobicity steadily increased with increasing H2O2 concentration. Moreover, the content of dityrosine increased slightly, and the fluorescence intensity of tryptophan gradually decreased, which indicated that the oxidation level of protein increased. Additionally, the boiling rate, whiteness, and water holding capacity of gels decreased significantly (P<0.05). Compared with the control, the boiling rate, whiteness, and water holding capacity of gels declined by 22.4%, 4.33%, and 16.47%, respectively, by 10 mmol/L H2O2. The low-field NMR showed that the oxidation degree of protein had no effects on bound water level in gels, but had significant effects on the ratio of immobile water to free water. Levels of immobile water and free water declined and increased, respectively, with increasing H2O2 concentration, which was consistent with the water holding capacity of gels. It was also found that the water holding capacity of gels was closely correlated with the oxidation degree of protein side chains.
Key words myofibrillar protein; protein oxidation; physicochemical property; water distribution