计红芳1,2,李莎莎1,王雪菲1,张令文1,陈复生2,马汉军1*
1(河南科技学院 食品学院,河南 新乡,453003) 2(食品科学与工程博士后流动站(河南工业大学),河南 郑州,450001)
摘 要 以牛背最长肌为原料,研究豌豆蛋白对其盐溶蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate and polyacrylamide gelelectrophoresis, SDS-PAGE)、溶解度、表面疏水性、巯基、二硫键含量、乳化性等理化性质及二级结构的影响,并探讨了豌豆蛋白与盐溶蛋白凝胶形成过程中化学作用力类型。结果表明,SDS-PAGE电泳中,豌豆蛋白中的vicilin(7S)、legA和legB分别与盐溶蛋白中的肌动蛋白、肌钙蛋白T和肌钙蛋白C结合。当豌豆蛋白添加质量浓度为0.08 g/mL时,盐溶蛋白的表面疏水性上升明显(P<0.05);二硫键含量在豌豆蛋白添加浓度超过0.12 g/mL后,迅速上升(P<0.05)。随豌豆蛋白添加浓度的增加,盐溶蛋白总巯基和表面活性巯基含量下降,浊度和乳化性上升;溶解度呈先升高后下降趋势,在添加浓度为0.04 g/mL时最大。豌豆蛋白添加质量浓度与α-螺旋、表面活性巯基含量等均呈显著负相关,与β-折叠、β-转角、无规则卷曲、二硫键含量、表面疏水性等呈显著正相关;疏水相互作用是豌豆蛋白-牛肉盐溶蛋白凝胶网络结构形成中最主要化学作用力。
关键词 牛肉盐溶蛋白;豌豆蛋白;理化性质;二级结构
第一作者:博士,副教授(马汉军教授为通讯作者,E-mail:xxhjm@126.com)。
基金项目:河南省重大科技专项项目(161100110600); 河南省博士后基金(2017); 河南科技学院博士后基金(2017)
收稿日期:2018-07-27,改回日期:2018-10-08
DOI:10.13995/j.cnki.11-1802/ts.018383
盐溶蛋白是一类具有重要生物学功能的结构蛋白复合体,约占蛋白总量的50%,主要是由肌球蛋白、肌动蛋白、肌动球蛋白、原肌球蛋白等构成[1],是影响肉制品品质特性的主要肌肉蛋白质,例如,它可影响肉制品的乳化特性、质构特性与感官品质[2]。近些年来,豌豆蛋白以极高的营养价值与保健功能,备受人们关注。豌豆蛋白中除蛋氨酸含量较低外,其他氨基酸比例相对较为均衡,基本可称为全价蛋白质,且具有调节肠胃,降低血压及提高免疫力的功能[3-4]。豌豆蛋白具有良好的溶解性、起泡性、泡沫稳定性和乳化性等,全部或部分添加,可优化成品的营养组成,改善成品质构,增强其稳定性[5-6]。近些年来对豌豆蛋白的应用进行了一些研究,豌豆蛋白不仅有助于凝胶的形成,还能促进表面疏水性的形成,产生类似脂肪的口感,可作为脂肪替代品生产低能量食品,但与大豆蛋白等相比,在肉制品中的应用有限[7]。
冯婷等研究发现,当花生浓缩蛋白添加量为2.5%时,可以明显改善鸡肉盐溶蛋白凝胶硬度、弹性等[8]。张巍、李先保等把大豆分离蛋白添加到猪肉、兔肉盐溶蛋白中发现,大豆分离蛋白添加量为20%、4.5% 时均可改善其凝胶品质[9-10]。还有一些学者报道,添加豌豆蛋白的香肠,具有更好的质构与感官品质[11-13],然而以上植物蛋白究竟是如何影响各种肉类盐溶性蛋白的功能性质与结构,进而影响凝胶品质的则鲜见相关报道。
本课题组前期研究表明,添加质量浓度为0.12 g/mL的豌豆蛋白可显著改善牛肉盐溶蛋白凝胶的品质,但是豌豆蛋白对牛肉盐溶蛋白性质与结构的影响规律,尚未阐明。因此,本文研究了不同添加量的豌豆蛋白对牛肉盐溶蛋白理化性质与二级结构的影响,以及相互结合的化学作用力类型,为豌豆蛋白在牛肉凝胶制品中的应用奠定理论基础。
牛背最长肌、大豆油,河南省新乡市易购世纪华联超市;豌豆蛋白,烟台东方蛋白科技有限公司。牛血清白蛋白,分析纯,北京奥博星生物技术有限公司;异硫氰酸胍、甘氨酸、十二烷基硫酸钠、溴酚蓝(bromophenol blue, BPB)、EDTA、DTNB、尿素等,以上试剂均为分析纯。
YP5002型电子天平,上海佑科仪器仪表有限公司;AD200L-P型分散均质机,上海昂尼仪器仪表有限公司;TGL-15B高速离心机,上海安亭科学仪器厂;WFJ7200型紫外可见分光光度计,上海尤尼柯仪器有限公司;FE28型pH计,梅特勒-托利多仪器(上海)有限公司;DZKW-4恒温水浴锅,北京中兴伟业仪器有限公司;DYCZ-24DN型电泳仪,北京六一生物科技有限公司;Labram HR800激光拉曼光谱仪,法国Jobin-Yvon公司。
1.3.1 牛肉盐溶蛋白的提取及与豌豆蛋白混合液的制备
参考CHEN[14]及孔鹏等[15]的方法并稍作修改。取70 g新鲜牛肉剔除脂肪和结缔组织,制成肉糜状,按1∶3质量比加入0.6 mol/L NaCl溶液,匀浆,调pH值7.0,4 ℃放置24 h,10 000 r/min离心10 min,上清液即为盐溶性蛋白。
将豌豆蛋白0、1.6、3.2、4.8、6.4、8 g分别添加到40 mL 30 mg/mL的盐溶蛋白溶液中(豌豆蛋白的质量浓度分别为0、0.04、0.08、0.12、0.16、0.20 g/mL),均质,4 ℃条件下静置12 h。标准蛋白为牛血清蛋白,双缩脲法测定混合液的蛋白浓度,标准曲线为Y=0.104 2X-0.004,相关系数R2=0.999 8。凝胶制备参考栗俊广等[16]的方法。
1.3.2 混合蛋白溶液SDS-PAGE凝胶电泳分析
参照郭尧君[17]和LAEMMLI[18]的方法。采用SDS-PAGE法对蛋白进行电泳分析。
1.3.3 浊度的测定
根据尚永彪等[19]的方法。取1 mg/mL的混合蛋白溶液,在25 ℃的恒温水浴锅中水浴20 min,在340 nm处测量吸光度变化,以吸光度值代表溶液的浊度。
1.3.4 溶解度的测定
参照魏朝贵等[20]的方法。取4 mg/mL的混合蛋白溶液,在4 ℃、1 500×g条件下离心10 min,用双缩脲法测其上清液的蛋白质量浓度,计算公式如下:
溶解度![]()
(1)
式中:ρ1为离心后上清液中的蛋白质质量浓度(mg/mL);ρ2为离心前的蛋白质质量浓度(mg/mL)。
1.3.5 表面疏水性的测定
参照CHELH等的方法,并作一定的改进[21]。计算公式如下:
溴酚蓝结合量![]()
(2)
1.3.6 乳化活性指数和乳化稳定性指数的测定
参考邵俊花[22]的方法,测定乳化活性指数(emulsifying activity index,EAI)、乳化稳定性指数(emulsifying stability index,ESI)。根据公式(3)、(4)计算:
![]()
(3)
![]()
(4)
式中:ΔA为乳状液初始的吸光度(A0)与静置5 min后的吸光度(A5)的差;ρ为乳化前混合蛋白溶液质量浓度,mg/mL;φ为乳状液中大豆油所占的体积分数,%。
1.3.7 二硫键含量的测定
参照THANNHAUSER等[23]的方法。取0.5 mL 4 mg/mL的混合蛋白溶液,加入3.0 mL新配NTSB检测溶液(pH 9.5),混匀后在暗处反应25 min,412 nm处测定吸光值。根据公式(5)计算:
二硫键含量![]()
(5)
式中:B为稀释倍数,此处为1.46;C为混合蛋白溶液浓度。
1.3.8 巯基含量的测定
参照曾宪明等的方法,并略作改变[24]。
总巯基含量的测定除在缓冲液中加入8 mol/L的尿素,其他方法同活性巯基含量的测定。计算公式为:
巯基含量![]()
(6)
式中:B为稀释倍数,此处为1.46;C为混合蛋白溶液浓度。
1.3.9 静电相互作用、氢键、疏水相互作用的测定
参照GOMEZ等[25]的方法并稍作修改。
1.3.10 拉曼光谱的测定
参照YANG等[26]的方法。将激光(配备514.5 nm氩离子激光)聚焦在样品上,样品表面的激光功率控制在100 mW左右,光谱的获得条件:600 g/mm光栅,狭缝200 μm,3次扫描累加,分辨率为2 cm-1,数据获取速度为120 cm-1/min,积分时间60 s,获取的拉曼光谱在400~3 600 cm-1。根据苯丙氨酸环在1 003 cm-1伸缩振动强度作为内标进行归一化。根据酰胺I带的变化,用ALIX的方法计算蛋白二级结构含量。
采用Microsoft Excel 2010对数据进行分析处理,采用SPSS 19.0软件进行单因素方差分析(one-way analysis of variance, ANOVA)、最小显著差法(least significant difference, LSD)、相关性分析(pearson),P<0.05为差异显著。每组试验除特殊说明外均重复3次。
盐溶蛋白是一种混合蛋白,其中最重要的是肌球蛋白,分子质量大约为480 kDa,由2条重链(约200 kDa)和4条轻链(16~25 kDa)组成[27]。豌豆蛋白中大部分蛋白为球蛋白,球蛋白可分为legumin(11S)和vicilin(7S)。11S球蛋白是六聚体(320~380 kDa),7S球蛋白是三聚体(150~180 kDa),由相对分子质量为47~50,30~34,<19 kDa的亚基构成[28],此外,豌豆蛋白中还有一类伴豌豆球蛋白(convicilin)[29],分子质量为71~75 kDa,也有文献将其归为vicilin的1个亚基[30]。

M-标准蛋白;A-G分别为豌豆蛋白添加质量浓度:
0、0.04、0.08、0.12、0.16、0.20、1 g/mL
图1 豌豆蛋白添加到盐溶蛋白溶液中SDS-PAGE电泳图谱
Fig.1 SDS-PAGE electrophoretogram of salt-soluble protein solution with different content of pea protein
由图1推测可知,A泳道对应的条带1、2、4、6、7、8、9依次为肌球蛋白重链、C-蛋白、α-肌动素、肌动蛋白、肌钙蛋白T、肌钙蛋白I、肌钙蛋白C;G泳道对应的条带3、6、10均为vicilin(7S)的亚基,5、7、9依次为伴豌豆球蛋白、legA(11S)、legB(11S)。随豌豆蛋白添加量的增加,条带3、5、10为豌豆蛋白的vicilin(7S)亚基和伴豌豆球蛋白,逐渐变粗颜色加深。6、7、9条带的变粗与颜色变深,可能是由于豌豆蛋白中的vicilin(7S)亚基、legA和legB与盐溶性蛋白中的肌动蛋白、肌钙蛋白T、肌钙蛋白C结合所致。
浊度的大小可以反映蛋白聚集程度,并可检测蛋白相互作用程度及蛋白聚集体相对尺寸[31]。由图2可知,盐溶性蛋白的浊度整体呈上升趋势,可能是因为豌豆蛋白添加量的增加使豌豆蛋白与盐溶蛋白形成的聚集体进一步增大,颗粒直径变大,浊度升高。
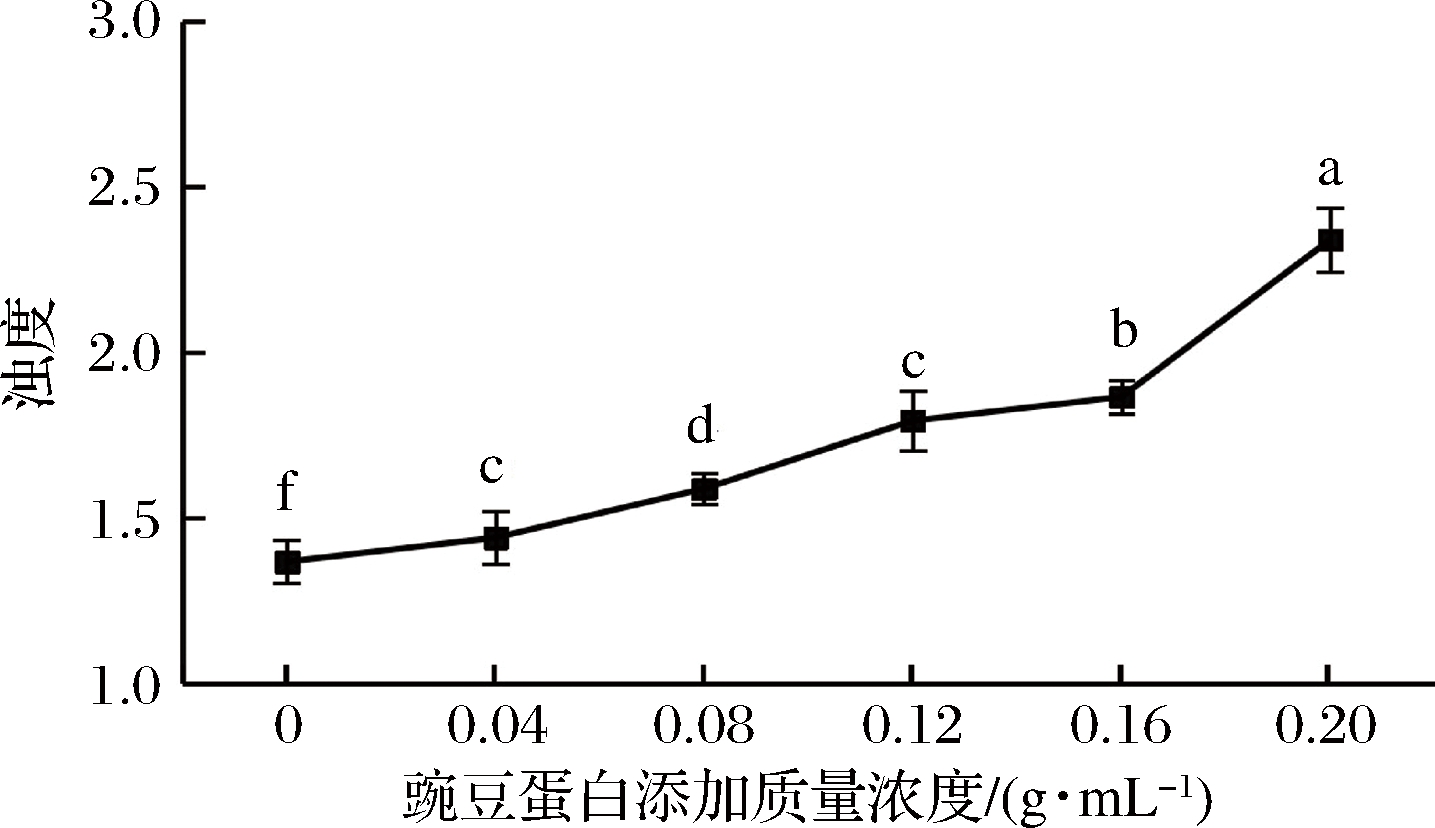
图2 豌豆蛋白添加量对盐溶蛋白浊度的影响
Fig.2 Effect of pea protein addition on turbidity of salt-soluble protein
溶解性是蛋白质变性程度的一个重要参数。由图3可知,豌豆蛋白的添加量不同,对盐溶蛋白的溶解度产生的影响也不同。当添加质量浓度为0.04 g/mL时,溶解度上升至最大,为45.26%,随后开始下降,可能是因为过量的豌豆蛋白阻碍了盐溶蛋白与水分子结合的能力,样品处理过程中表面疏水集团暴露,疏水相互作用增强,也可使蛋白质溶解度进一步降低。
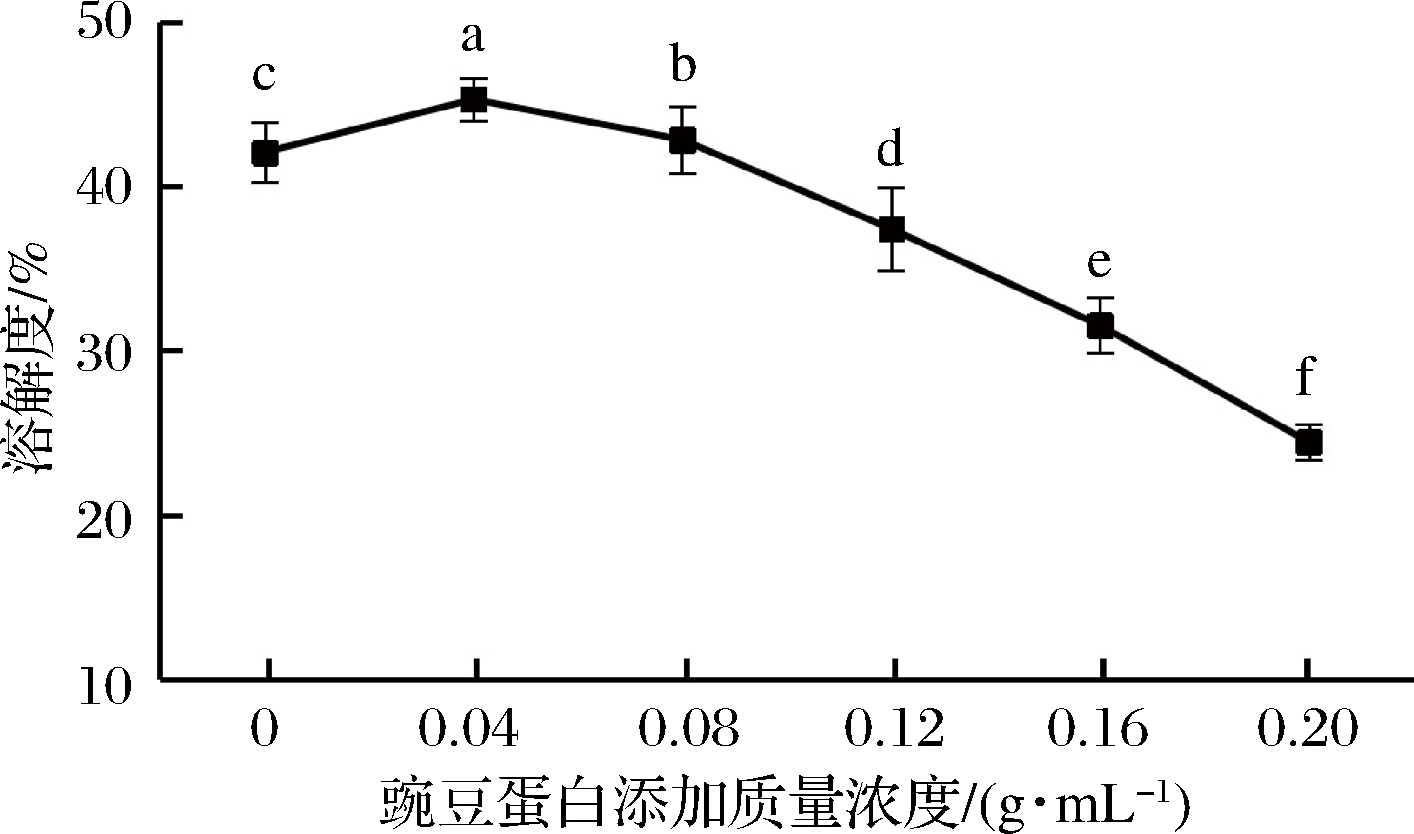
图3 豌豆蛋白添加量对盐溶蛋白溶解度的影响
Fig.3 Effect of pea protein addition on solubility of salt- soluble protein
表面疏水作用力在维持蛋白三级结构和蛋白构象及功能特性等方面起着非常重要的作用[32]。由图4可知,被结合的BPB含量即盐溶蛋白的表面疏水性随着豌豆蛋白添加量的增加呈上升趋势,当添加量为0.08 g/mL时,迅速上升(P<0.05),与对照相比,上升了76.25%;当添加量大于0.08 g/mL,上升较为缓慢;添加量为0.20 g/mL时,表面疏水性最大,与其他添加量相比,差异显著(P<0.05)。可能是因为样品在处理过程中,蛋白质分子内部的疏水性氨基酸残基暴露,引起溴酚蓝与蛋白质的疏水性氨基酸残基的结合量增加,从而使表面疏水性增加。

图4 豌豆蛋白添加量对盐溶蛋白表面疏水性的影响
Fig.4 Effect of pea protein addition on surface hydropho-bicity of salt-soluble protein
由图5可知,盐溶蛋白的EAI和ESI均随着豌豆蛋白添加量的增加呈上升趋势。豌豆蛋白在添加质量浓度为0.04~0.12 g/mL时,增长较为明显(P<0.05);添加质量浓度0.16~0.20 g/mL时,差异不显著(P>0.05)。当豌豆蛋白添加量较低时,蛋白液中的蛋白分子间距较大,单个蛋白分子有效乳化表面积较高,使得乳化活性增加较快,随着豌豆蛋白添加量持续增加,蛋白分子逐渐聚集,形成了比较稳定的乳化状态。
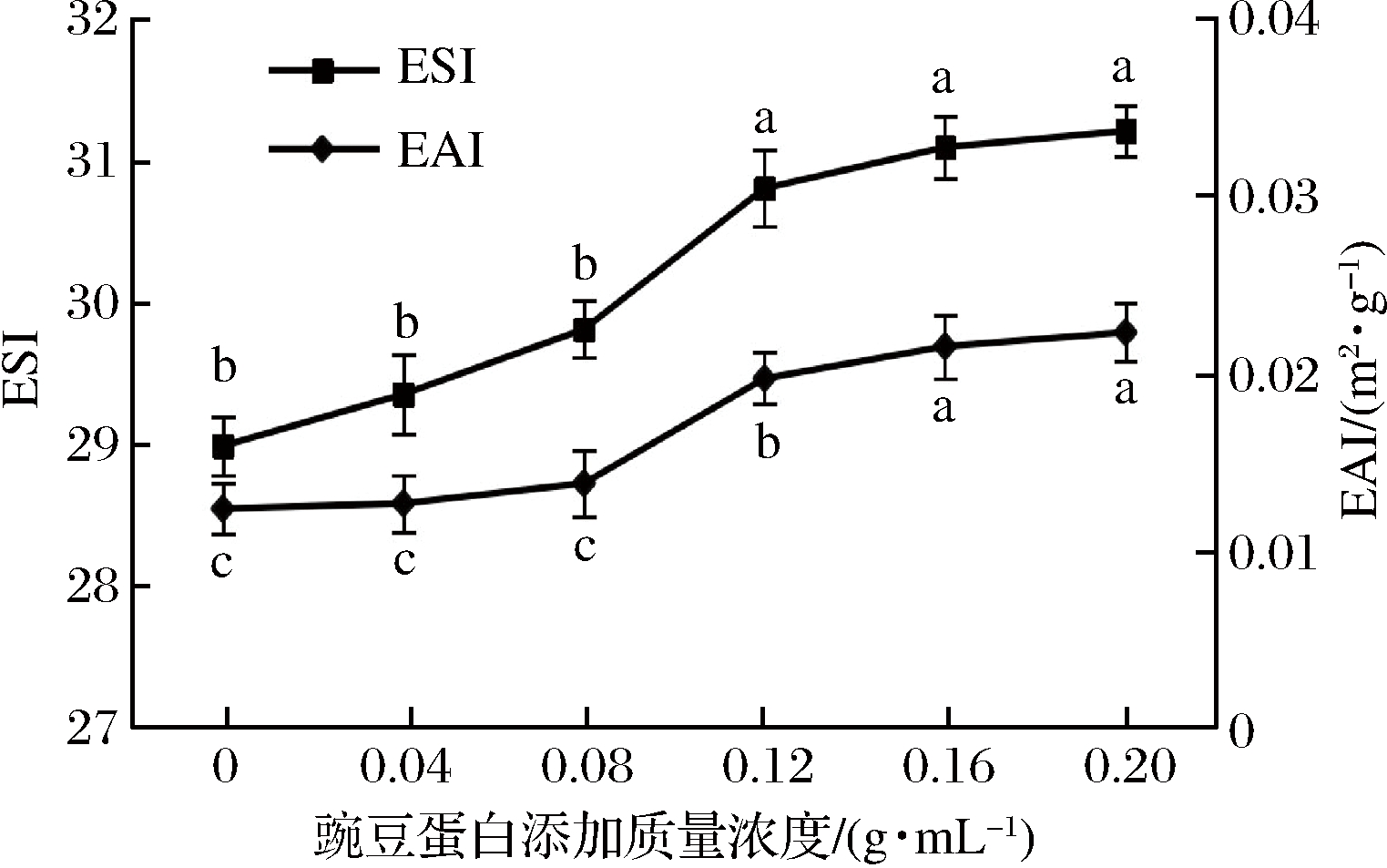
图5 豌豆蛋白添加量对盐溶蛋白EAI和ESI的影响
Fig.5 Effect of pea protein addition on EAI and ESI of salt-soluble protein
二硫键直接影响着蛋白质折叠的速率和途径,对于稳定蛋白质的空间结构和保持一定的活性功能具有很重要作用[33],巯基是蛋白分子活性基团的关键部位,其含量的变化对蛋白质的性质影响较大。结合图6和图7,盐溶蛋白中的总巯基和表面活性巯基含量均呈下降趋势,且均在豌豆蛋白添加质量浓度为0.04~0.12 g/mL时,下降较为缓慢(P>0.05),之后下降迅速;二硫键含量呈上升趋势。这可能是由于豌豆蛋白与盐溶蛋白相互作用,并经过剧烈均质,使隐藏在盐溶蛋白结构内部的巯基暴露,分子间和分子内通过交联形成二硫共价键,使得二硫键含量增加,暴露的巯基含量减少。
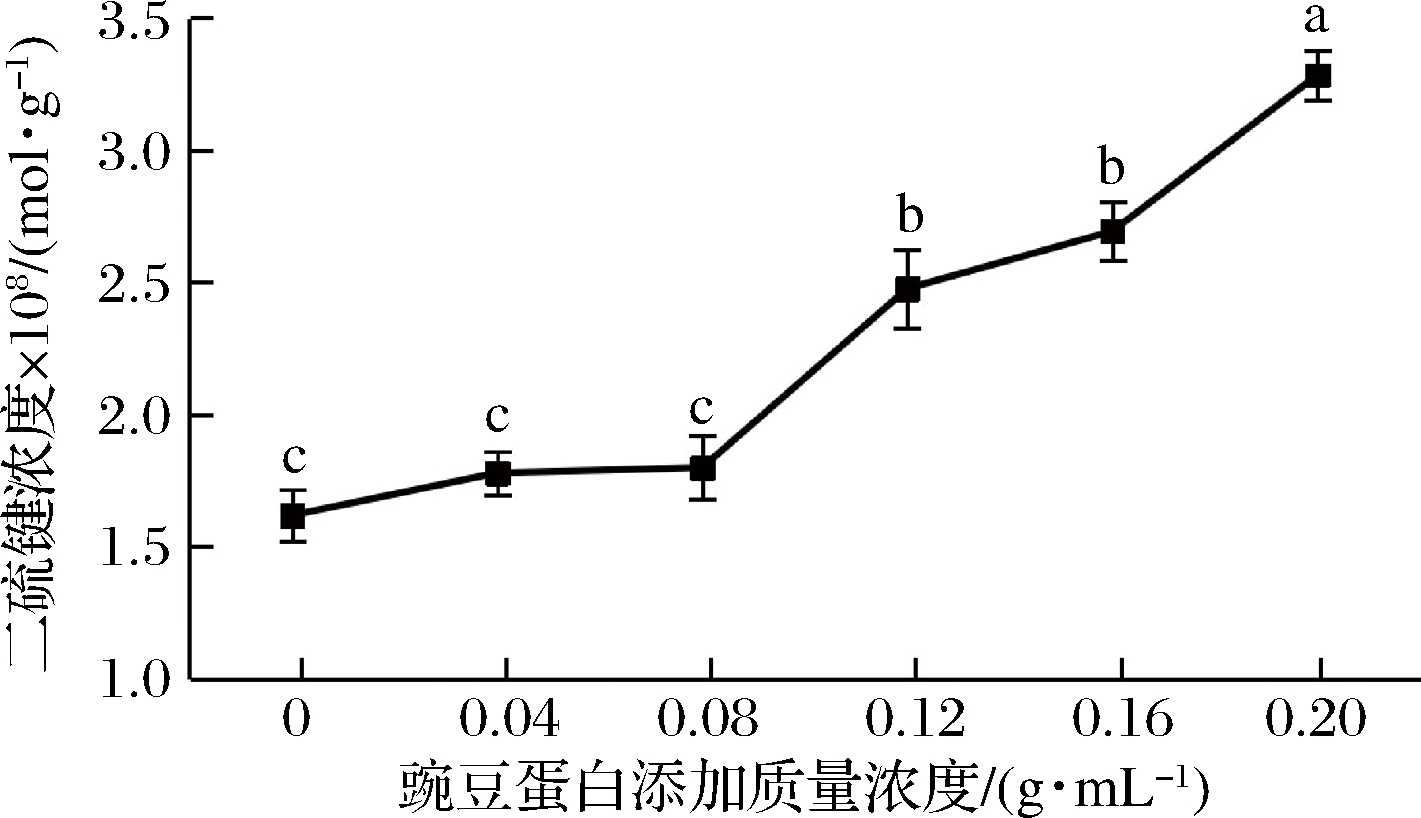
图6 豌豆蛋白添加量盐溶蛋白二硫键含量的影响
Fig.6 Effect of pea protein addition on disulfide bonds content of salt-soluble protein
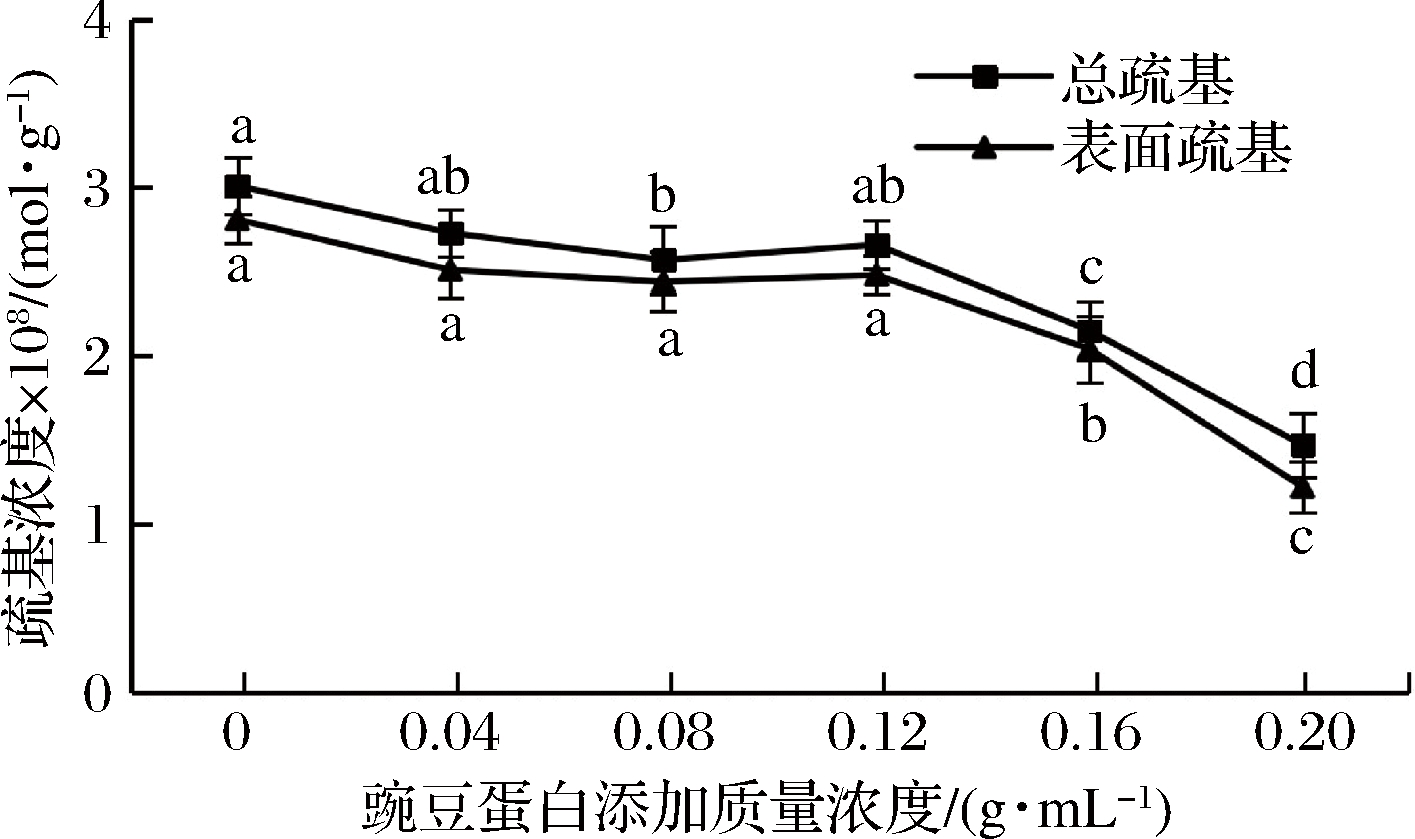
图7 豌豆蛋白添加量对盐溶蛋白巯基含量的影响
Fig.7 Effect of pea protein addition on sulfhydryl content of salt-soluble protein
氢键、静电作用及疏水作用是维持蛋白凝胶三维网络结构最主要的作用力[34]。从图8可知,凝胶的静电作用、氢键所对应的蛋白溶解量差,都<1 mg/mL,表明二者均不是维持豌豆蛋白与盐溶蛋白共混热诱导凝胶网络结构的主要化学作用力。
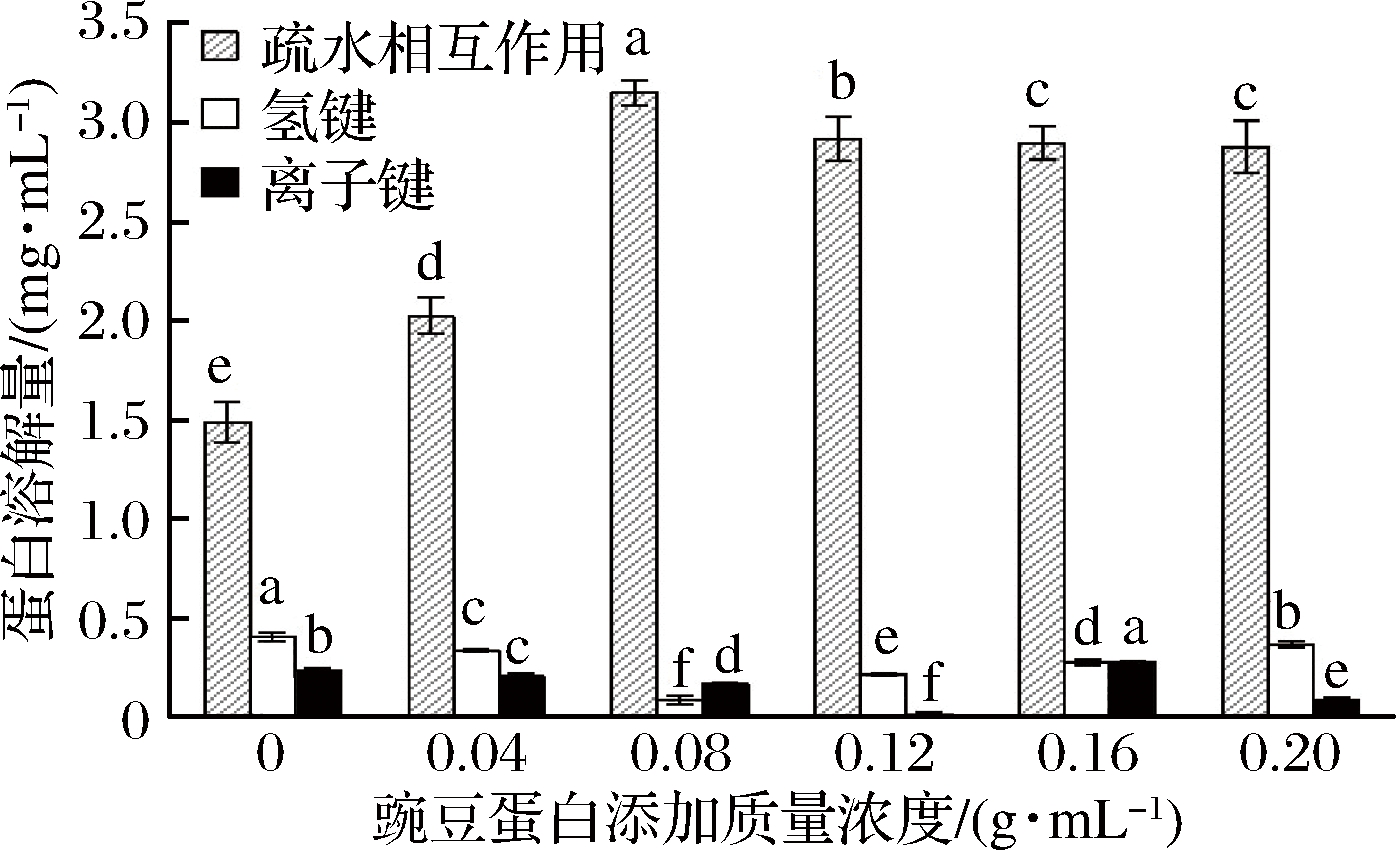
图8 豌豆蛋白对凝胶形成过程中化学作用力的影响
Fig.8 Effect of pea protein on chemical forces during gel formation
随豌豆蛋白添加质量浓度的增加,凝胶的疏水相互作用力呈上升趋势,在添加质量浓度为0.08 g/mL时,疏水作用最强,是对照组的2.11倍,表明添加豌豆蛋白明显增强了凝胶的疏水相互作用力。这可能是由于豌豆蛋白与盐溶蛋白发生相互作用,改变了盐溶蛋白的结构和构象,促进了蛋白分子的解聚和伸展,使包埋的非极性多肽基团充分地暴露出来,从而增强了共混凝胶的网络结构。
拉曼光谱中酰胺I带处振动与蛋白质二级结构密切相关,包括高α-螺旋含量的酰胺I带振动主要集中在(1 655±5)cm-1处,高β-折叠含量的酰胺I带振动主要集中在(1 670±5)cm-1,β-转角、无规则卷曲主要集中在1 680 cm-1和(1 665±5)cm-1[35]。据报道,加热升温会使α-螺旋结构解开而逐渐减少,β-折叠逐渐增加,有序结构总体减少,无序结构总体增加[36]。由表1可知,随豌豆蛋白添加量的增加,α-螺旋含量逐渐下降,对照含量为62.36%,添加质量浓度为0.20 g/mL时,α-螺旋含量最低为49.26%,但与0.12和0.16 g/mL的添加量相比,差异不显著(P>0.05);β-折叠含量持续增加,由对照的14.77% 增加到添加质量浓度为0.20 g/mL的22.42%,增加了7.65%,添加质量浓度在0.08~0.12 g/mL时,β-折叠含量彼此差异不显著(P>0.05);β-转角与无规则卷曲含量也呈上升趋势,分别由对照的12.5%、10.79% 增加到添加质量浓度为0.20 g/mL的15.88%、14.03%。WU等[37]研究发现,肌肉中α-螺旋结构越多,越有利于蛋白二级结构稳定,β-折叠和无规则卷曲结构越多,蛋白自由度越高,变性程度越大。在加热条件下,α-螺旋结构发生解折叠,其含量下降表征蛋白分子变性程度增加,β-折叠含量增加表征蛋白分子间聚集程度增加,而β-折叠结构是蛋白聚集和形成良好凝胶的基础结构[38]。
表1 添加豌豆蛋白对共混凝胶蛋白二级结构含量的影响
Table 1 Effect of pea protein addition on proteinsecondary structure content of blended gel
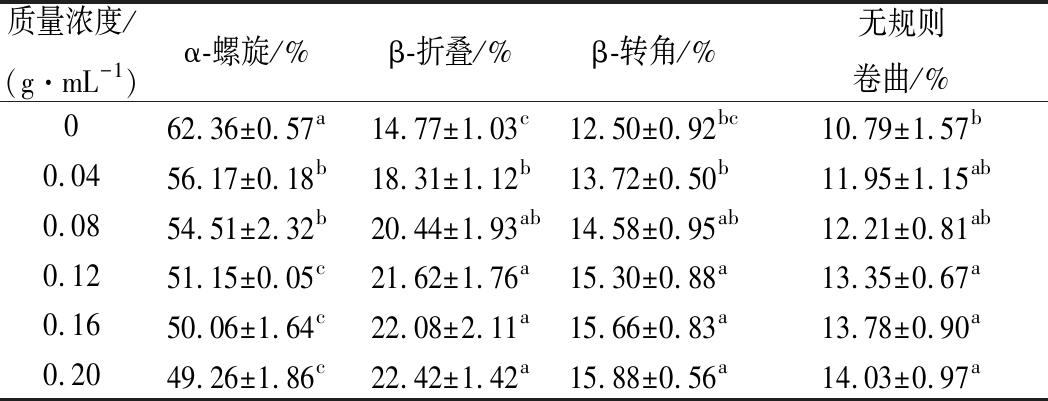
注:同一列中不同小写字母表示显著差异(P<0.05)。
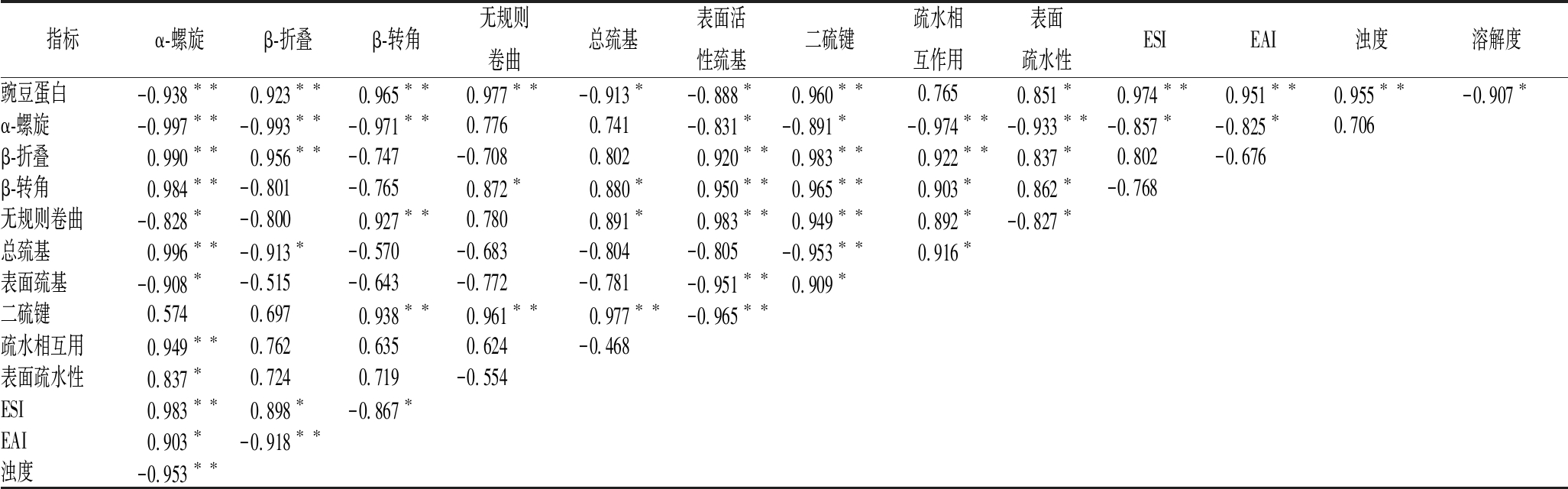
由表2可知,豌豆蛋白添加质量浓度与α-螺旋、总巯基、表面活性巯基含量、溶解度均呈显著负相关(P<0.05),与β-折叠、β-转角、无规则卷曲、二硫键含量、表面疏水性、乳化活性、乳化稳定性、浊度均呈显著正相关(P<0.05),表明豌豆蛋白可以显著影响牛盐溶蛋白的理化性质。加热过程促进了盐溶性蛋白的变性与聚集,降低了α-螺旋含量,增加了β-折叠、β-转角、无规则卷曲等含量,实现了蛋白从有序到无序的转变。表面疏水性、疏水相互作用均与凝胶α-螺旋含量呈显著负相关(P<0.05),与β-折叠、β-转角含量呈显著正相关(P<0.05);二硫键与α-螺旋含量呈显著负相关(P<0.05),而与β-转角和无规则卷曲含量呈显著正相关(P<0.05),表明表面疏水性、疏水相互作用、二硫键等显著影响蛋白二级结构含量。β-折叠结构是蛋白集聚和形成良好凝胶的基础,疏水相互作用、二硫键是形成凝胶的主要化学作用力[38-39],添加豌豆蛋白,有利于牛盐溶蛋白良好凝胶结构的形成。
表2 添加豌豆蛋白的各指标相关性
Table 2 Correlation analysis between each index of different addition of pea protein
在SDS-PAGE电泳中,牛肉盐溶性蛋白中的肌动蛋白、肌钙蛋白T和肌钙蛋白C分别与豌豆蛋白中的vicilin(7S)亚基、legA和legB结合,因此条带随着豌豆蛋白添加量的增加逐渐变粗且颜色加深;浊度、表面疏水性、二硫键含量、乳化性均随着豌豆蛋白添加量的增加呈现上升趋势,且乳化活性和乳化稳定性均在添加质量浓度为0.04~0.12 g/mL时,迅速上升;溶解度在添加质量浓度为0.04 g/mL时达到最大;总巯基和表面活性巯基变化趋势一致,均呈下降趋势;豌豆蛋白添加量与α-螺旋、总巯基、表面活性巯基含量、溶解度均呈显著负相关,与β-折叠、β-转角、无规则卷曲、二硫键含量、表面疏水性、乳化活性、乳化稳定性、浊度均呈显著正相关;疏水相互作用是凝胶网络结构形成最主要的化学作用力。
参考文献
[1] 周纷,谷大海,徐家慧,等. 淀粉对鸡胸肉盐溶性蛋白乳化特性的影响[J]. 食品科学, 2016, 37(15): 7-12.
[2] 彭增起. 肌肉盐溶蛋白质溶解性和凝胶特性研究[D]. 南京:南京农业大学, 2005.
[3] 周向军, 朱敏涛,袁毅君. 赤藓糖醇对豌豆分离蛋白结构和功能特性的影响[J]. 食品工业科技, 2018, 39(8): 73-77;84.
[4] SWIATECKA D, NARBAD A, RIDGWAY K P, et al. The study on the impact of glycated pea proteins on human intestinal bacteria [J]. International Journal of Food Microbiology, 2011, 145(1): 267-272.
[5] 何希强, 肖怀秋,李玉珍. 豌豆蛋白酶法水解及产物特性研究[J]. 粮油食品科技, 2012, 20(5): 8-11.
[6] COSTA G E D A, QUEIROZ-MONICI K D S, REIS S M P M, et al. Chemical composition, dietary fibre and resistant starch contents of raw and cooked pea, common bean, chickpea and lentil legumes[J]. Food Chemistry, 2006, 94(3): 327-330.
[7] 马宁, 魏姜勉. 豌豆蛋白的改性及其开发利用研究进展[J]. 中国市场, 2015, 32: 231-233.
[8] 冯婷, 孙京新,吴振,等. 花生浓缩蛋白对鸡胸肉盐溶蛋白热诱导凝胶性能的影响[J]. 现代食品科技, 2015, 31(10): 97-102;128.
[9] 张巍. 大豆分离蛋白(SPI)与猪肉盐溶蛋白共凝胶的研究[D]. 哈尔滨:哈尔滨商业大学, 2011.
[10] 李先保, 程千赫. 大豆分离蛋白对兔肉盐溶蛋白凝胶特性的影响[J]. 食品与发酵工业, 2010, 36(5): 133-139.
[11] 白一凡, 王辉,杨震,等. 豌豆蛋白加工特性及在乳化香肠中的应用[J]. 肉类研究, 2014, 28(12): 14-16.
[12] 杨震, 曲超,贡慧,等. 豌豆蛋白组织化挤压工艺参数优化及其在肉制品中的应用[J]. 延边大学农学学报, 2016, 38(4): 317-324.
[13] SU Y K, BOWERS J A, ZAYAS J F. Physical characteristics and microstructure of reduced-fat frankfurters as affected by salt and emulsified fats stabilized with nonmeat proteins [J]. Journal of Food Science, 2000, 65(1): 123-128.
[14] CHEN H, XU S Y, WANG Z. Interaction between flaxseed gum and meat protein [J]. Journal of Food Engineering, 2007, 80(4): 1 051-1 059
[15] 孔鹏, 王志耕. 3种淀粉对鸡肉糜盐溶蛋白特性影响及其配方研究[J]. 肉类研究, 2011, 25(6): 9-15.
[16] 栗俊广, 蒋爱民,白艳红,等. 木薯淀粉对猪肉盐溶蛋白凝胶特性的影响[J]. 现代食品科技, 2016, 32(11): 123-127, 55.
[17] 郭尧君. 蛋白质电泳实验技术[M]. 北京:科学出版社, 2005: 123-157.
[18] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[19] 尚永彪, 夏杨毅,张彩霞,等. 磷酸盐对PSE猪肉肌原纤维蛋白溶胶及凝胶性质的影响[J]. 食品科学, 2010, 31(1): 38-42.
[20] 魏朝贵, 吴菊清,邵俊花,等. KCl和MgCl2部分替代NaCl对猪肉肌原纤维蛋白乳化凝胶特性的影响[J]. 食品科学, 2014, 35(5): 89-95.
[21] CHELH I, GATELLIER P, SANTELHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination [J]. Meat Science, 2006, 74(4): 681-683.
[22] 邵俊花. 猪肉蛋白质构象变化与保油保水性关系研究[D]. 南京:南京农业大学, 2012.
[23] THANNHAUSER T W, KONISHI Y, SCHERAGA H A, et al. Analysis for disulfide bonds in peptides and proteins [J]. Methods in Enzymology, 1987, 143(1): 115-119.
[24] 曾宪明, 徐幸莲,白云,等. 兔肌球蛋白热诱导凝胶过程中的物理化学变化[J]. 食品科学, 2008, 29(4): 149-153.
[25] G MEZ-GUILL
MEZ-GUILL N M C, BORDE
N M C, BORDE AS A J, MONTERO P. Chemical interactions of nonmuscle proteins in the network of sardine (sardine pilchardus) muscle gels [J]. LWT-Food Science and Technology, 1997, 30(6): 602-608.
AS A J, MONTERO P. Chemical interactions of nonmuscle proteins in the network of sardine (sardine pilchardus) muscle gels [J]. LWT-Food Science and Technology, 1997, 30(6): 602-608.
[26] YANG H, ZHANG W, LI T, et al. Effect of protein structure on water and fat distribution during meat gelling [J]. Food Chemistry, 2016, 204: 239-245.
[27] 刘英丽, 谢良需,丁立,等. 小麦麸膳食纤维对猪肉肌原纤维蛋白凝胶功能特性的影响[J]. 食品科学, 2016, 37(19): 15-23.
[28] GATEHOUSE J A, LYCETT G W, CROY R R, et al. The post-translational proteolysis of the subunits of vicilin from pea (Pisum sativum L.)[J]. Biochemical Journal, 1982, 207(3): 629-632.
[29] BARAC M, CABRILO S, PESIC M, et al. Profile and functional properties of seed proteins from six pea (Pisum sativum) genotypes [J]. International Journal of Molecular Sciences, 2010, 11(12): 4 973-4 990.
[30] O’KANE F E, HAPPE R P, VEREIJKEN J M, et al. Characterization of pea vicilin 2: Consequences of compositional heterogeneity on heat-induced gelation behavior[J]. Journal of Agricultural and Food Chemistry, 2004, 52(10): 3 149-3 154.
[31] CHAN J K, GILL T A. Thermal aggregation of mixed fish myosins [J]. Journal of Agriculture and Food Chemistry, 1994, 42(12): 2 649-2 655.
[32] 闫海鹏. 不同种类肉肌原纤维蛋白功能特性的研究[D]. 南京:南京农业大学, 2013.
[33] 宋江宁, 李炜疆. 蛋白质二硫键的分布特征[J]. 无锡轻工大学学报, 2002, 21(5): 464-467.
[34] 张兴, 杨玉玲,马云,等. pH对肌原纤维蛋白及其热诱导凝胶非共价键作用力与结构的影响[J]. 中国农业科学, 2017, 50(3): 564-573.
[35] CHOI S M, MA C Y. Structural characterization of globulin from common buckwheat (Fagopyrum esculentum Moench) using circular dichroism and Raman spectroscopy [J]. Food Chemistry, 2007, 102(1): 150-160.
[36] 杨玉玲, 游远,彭晓蓓,等. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J]. 中国农业科学, 2014, 47(10): 2 013-2 020.
[37] WU Z, BERTRAM H C, BCKER U, et al. Myowater dynamics and protein secondary structural changes as affected by heating rate in three pork qualities: a combined FT-IR microspectroscopic and 1H NMR relaxometry study [J]. Journal of Agricultural and Food Chemistry, 2007, 55: 3 990-3 997.
[38] WANG S F, SMITH D M. Dynamic rheological properties and secondary structure of chicken breast myosin as influenced by isothermal heating [J]. Journal of Agricultural and Food Chemistry, 1994, 42(7): 1 434-1 439.
[39] 康怀彬, 邹良亮,张慧芸,等. 高温处理对牛肉蛋白质化学作用力及肌原纤维蛋白结构的影响[J/OL]. 食品科学: http://kns.cnki.net/kcms/detail/11.2206.TS.20180622.1127.164.html
JI Hongfang1,2, LI Shasha1, WANG Xuefei1, ZHANG Lingwen1,CHEN Fusheng2, MA Hanjun1*
1(School of Food Science, Henan Institute of Science and Technology, Xinxiang 453003,China) 2(Food Science and Engineering Post-doctoral Research Station(Henan University of Technology), Zhengzhou 450001,China)
Abstract Salt-soluble proteins were extracted from bovine longissimus thoracis muscles (BLTM). Effects of pea protein on physicochemical properties (SDS-PAGE, solubility, surface hydrophobicity, sulfhydryl group, disulfide bond content, emulsifying properties) and secondary structures of salt-soluble proteins from BLTM were studied. Additionally, the types of chemical bonds formed during the gelling of pea protein and salt-soluble proteins were explored. The SDS-PAGE results indicated that vicilin (7S), legA, and legB in pea protein were bound to actin, troponin T, and troponin C in salt-soluble proteins. When 0.08 g/mL pea protein was added, the surface hydrophobicity of salt-soluble protein increased significantly (P<0.05). Moreover, the disulfide bond content increased rapidly when more than 0.12 g/mL pea protein was added (P<0.05). As the concentration of pea protein increasing, the contents of both total sulfhydryl and surface active sulfhydryl of salt-soluble proteins decreased, while their turbidity and emulsibility increased. Furthermore, the solubility of salt-soluble proteins increased first and then decreased, with the maximal reached when 0.04 g/mL pea protein was added. Additionally, the amount of pea protein added was negatively correlated with α-helix and surface active sulfhydryl content, and it was positively correlated with β-folding, β-rotation, irregular curl, disulfide bond content, and surface hydrophobicity of salt soluble proteins. Besides, hydrophobic interaction was the most important chemical force when forming pea protein- BLTM salt soluble proteins gel network structure.
Key words beef salt-soluble protein; pea protein; physicochemical properties; protein secondary structure