李君兰*,杨澜,吴潇霞,孟文芬,袁静,禹兴海,冯久海
(河西学院 农业与生物技术学院,甘肃 张掖,734000)
摘 要 以鲜枣(Zizyphus jujube cv.Fengmiguan)为材料,用0.1 mol/L葡萄糖酸钙在白露时节开始每7 d喷洒1次果实,根据喷洒次数预设处理1、处理2、处理3和CK(未处理),果实着色面积达到50%~70%时采摘,0±0.5 ℃下贮藏,每10 d取样并测定相关指标。结果表明,与CK相比,不同处理组都能抑制果实的失重率、维生素C、叶绿素和多酚含量的下降,阻止H2O2、相对电导率和MDA含量的上升,CK>处理1>处理2>处理3,且差异显著(P<0.05);采前钙处理能降低腐烂率![]() 的含量、提高硬度和可溶性蛋白,但处理次数对腐烂率的影响不显著(P>0.05),硬度
的含量、提高硬度和可溶性蛋白,但处理次数对腐烂率的影响不显著(P>0.05),硬度![]() 可溶性蛋白的变化未表现出规律性。
可溶性蛋白的变化未表现出规律性。
关键词 鲜枣;葡萄糖酸钙;采前处理;贮藏品质;活性氧代谢
第一作者:教授(本文通讯作者,E-mail:qwzhaohui@126.com)。
基金项目:甘肃省农业生物技术研究开发项目(GNSW-2014-02);甘肃省林业科技项目(2017kj012)
收稿日期: 2018- 09- 03; 改回日期: 2018- 09- 19
DOI:10.13995/j.cnki.11-1802/ts.018672
枣树具有抗旱、抗风沙、耐寒、耐盐碱、耐瘠薄,适应性强等特点[1],是一种生态效益和经济效益兼备的优良树种。在我国不仅分布面积广,且拥有全世界99%的枣种质资源。果实因其味甜、肉质厚、有较高的营养价值及食疗功能而受到消费者青睐。但枣果采后易失水皱缩、软化、褐变和腐烂,常温下保鲜期仅3~5 d,货架期较短,是造成鲜枣果实商品性丧失和损失的主要原因,已成为其市场拓展的限制因素,也是当前鲜枣果实在冷链集散和流通中急需解决的关键问题。因此,研究鲜枣的采后保鲜技术,延长其贮藏运输寿命和货架期,具有重要的经济意义。
随着植物钙调素(calmodulin,CaM)的发现与研究,人们认识到钙不仅是植物生长发育所必需的营养元素之一,在植物生理活动中,既起着结构成分的作用,也具有酶的辅助因素功能,而且作为信号物质,与CaM一起调节植物体内许多生理生化过程[2-6]。果实缺钙会导致一些生理性病害发生和贮藏性变劣,枣缺钙会引起裂果病[7-8],是一种生理失调病,由于钙含量的缺少,会降低细胞壁的弹性及破坏膜结构的稳定性进而降低了果实的抗裂性。钙在延缓果实的成熟、衰老和控制生理病害方面有较好的效果。据资料报道,常用的钙盐主要在苹果[9]、茄子[10]、梨[11]、枇杷[12]、猕猴桃[13]和灵武枣[14]等果蔬保鲜上。而且钙对贮藏效果的研究仅仅局限于在果实采摘后利用无机钙浸钙研究的基础上,关于在采摘前运用有机钙喷洒钙处理的研究报道较少。本实验以甘肃省张掖市临泽县栽种的鲜食红枣品种“蜂蜜罐”为试验材料,通过采前多次喷洒葡萄糖酸钙处理果实,探讨外源钙采前处理对冷藏鲜枣果实品质劣变进程的作用机制,并分析品质劣变与活性氧代谢的关系,以期为进一步研究鲜枣果实采后低温贮藏品质劣变进程中调控生理生化机理和贮运保鲜技术奠定基础。
试验材料为红枣品种“蜂蜜罐”。2017年10月5号采摘于甘肃省张掖市甘州区林业局西城驿林场。枣树的树龄均为5年以上盛果期树种,其他田间施肥、灌溉和病虫害管理统一不变。采摘前将枣树每10株为一小区,共划分为4个区域,实验从白露时节开始,在傍晚时分每7 d用0.1 mol/L的葡萄糖酸钙溶液均匀喷洒枣树及果实,以枣树果实及叶面全部湿润为止。第0天喷洒1次的果实记为处理1;在第0天和第7天喷洒2次的果实记为处理2;在第0天、第7天和第14天喷洒3次的果实记为处理3;以不喷洒葡萄糖酸钙溶液的果实记为对照CK。枣果实着色面积达到50%~70%时人工采摘,当日运回实验室。选取成熟度一致、无伤病、无畸形、单果重量8~9 g左右的果实为实验材料。装入带有若干小孔(孔径为0.2 cm)的泡沫饭盒,每盒质量约为300 g左右,置于0±0.5 ℃的冷库中贮藏,每10 d取样1次并进行各项指标测定。
1.2.1 硬度、失重率和腐烂指数测定
果实硬度:用GY-1型果实硬度计(四平市兴科仪器仪表厂)测定。随机取若干个鲜枣,在每个果实最大横径处将硬度计垂直于被测表面,在均匀力的作用下将压头压入果肉内5 mm处,以此时指针的读数作为鲜枣的硬度。单果重复4次,测定10个果实的硬度,取平均值,单位kg/cm2。
果实失重率计算如公式(1)所示:
失重率![]()
(1)
果实腐烂指数:将果实按腐烂面积大小分为4级。0级,无腐烂; 1级,皱缩、软化和腐烂面积小于果实面积的10%; 2级,皱缩、软化和腐烂面积占果实面积的10%~30%; 3级,皱缩、软化和腐烂面积大于果实面积的30%。按公式(2)计算腐烂率:
腐烂指数![]()
(2)
1.2.2 鲜枣果肉营养成分测定
维生素C测定采用钼蓝比色法,结果用mg/100g(FW)来表示;可溶性蛋白含量测定采用考马斯亮蓝法,测定结果用mg/g(FW)表示;叶绿素含量的测定采用丙酮比色法,测定结果用mg/g表示;多酚含量测定采用高锰酸钾法[15],结果以百分数表示。
1.2.3 相对电导率和丙二醛(MDA)含量的测定
用相对电导率(%)表示果实细胞膜透性大小,用DDJ-308A型电导率仪(上海精科仪器有限公司)测定。测定方法参照林河通等[16]的方法,其计算如公式(3)所示:
相对电导率![]()
(3)
丙二醛(malonic dialdehyde, MDA)含量测定采用硫代巴比妥酸法。
1.2.4 H2O2和![]() 含量的测定
含量的测定
H2O2含量测定参照BRENNAN[17]的Ti4+还原法。称取鲜枣果肉组织4 g,加入5 mL经-20 ℃预冷的丙酮、石英砂研磨成匀浆,于4 ℃、12 000 r/min离心20 min。取1 mL上清液,加入100 μL 20%的四氯化钛溶液和200 μL浓氨水,混匀反应5 min后离心10 min。沉淀部分用经-20 ℃预冷的丙酮洗涤3次除去植物色素,最后将沉淀溶于3 mL、1 mol/L H2SO4溶液中,并在415 nm处测定溶液的吸光度值,用30%分析纯H2O2溶液制作标准曲线,空白用预冷的丙酮。样品中H2O2含量以μmol/g(FW)表示。
![]() 的含量测定采用羟胺氧化法[15]:准确称取3.0 g果肉组织,加入50 mmol/L pH 7.8的磷酸缓冲液(内含1 mmol/L EDTA,0.3%Triton X-100,2% PVP) 5 mL,在冰浴中充分研磨,于4 ℃、12 000 r/min离心20 min。取1 mL上清液,依次加入1 mL磷酸缓冲液和1 mL 1 mmol/L的盐酸羟胺溶液,在25 ℃混合培养1 h后,再加入17 mmol/L对氨基苯磺酸、7 mmol/L α-萘胺各1 mL,30 ℃恒温水浴中显色反应30 min。530 nm波长下测定显色液吸光值,用不同浓度的NaNO2制作标准曲线,根据标准曲线计算出样品中
的含量测定采用羟胺氧化法[15]:准确称取3.0 g果肉组织,加入50 mmol/L pH 7.8的磷酸缓冲液(内含1 mmol/L EDTA,0.3%Triton X-100,2% PVP) 5 mL,在冰浴中充分研磨,于4 ℃、12 000 r/min离心20 min。取1 mL上清液,依次加入1 mL磷酸缓冲液和1 mL 1 mmol/L的盐酸羟胺溶液,在25 ℃混合培养1 h后,再加入17 mmol/L对氨基苯磺酸、7 mmol/L α-萘胺各1 mL,30 ℃恒温水浴中显色反应30 min。530 nm波长下测定显色液吸光值,用不同浓度的NaNO2制作标准曲线,根据标准曲线计算出样品中![]() 的质量分数,计算
的质量分数,计算![]() 含量,单位μg/g(FW)。
含量,单位μg/g(FW)。
实验数据用Origin 8.5(OriginLab Inc,美国)作图,统计处理,差异显著性(Duncan′s)分析采用DPS 7.05数据分析软件,每个样品重复3次,结果以平均值±标准差表示。差异不显著,P>0.05;差异显著,P<0.05;差异极显著,P<0.01。
果实硬度是评价果实贮藏品质的重要指标,对果实贮藏品质有重要影响。采前葡萄酸钙处理对鲜枣果实硬度的影响如图1-a所示。随着贮藏时间延长,鲜枣果实的硬度逐渐下降。与对照相比,处理组的硬度下降较慢,贮藏到40 d后,处理2的硬度高出对照、处理1和处理3分别为1.48、1.15和1.08倍,处理2与处理1和处理3之间出现了显著性差异,处理1和处理3在50 d时,果实硬度变化没有显著性差异,表明采前葡萄糖酸钙处理及不同处理次数对枣果硬度变化有显著的影响。该结论与邢尚军等[18-20]的研究结果相似。
鲜枣采后成熟衰老最明显的变化是果肉组织迅速软化和质地改变,失水萎蔫是其主要的特征,果实细胞的保水力与细胞中可溶性物质和亲水性胶体的含量有关。采前葡萄糖酸钙处理对鲜枣果实失重率的影响如图1-b所示。随存放时间的延长失重率逐渐升高,与CK相比,贮藏40 d时候,随葡萄糖酸钙处理次数的增加,失重率下降缓慢,且差异极显著,处理3的果实失重率最低。表明采前葡萄糖酸钙喷洒及喷洒次数能够抑制采后鲜枣果实的失重率。与GHULAM等[21]的结果一致。
采前葡萄酸钙喷洒处理对鲜枣腐烂率的影响如图1-c所示。鲜枣果实采后腐烂主要是侵染性病害引起的,采前葡萄糖酸钙喷洒均能有效地降低低温贮藏期间果实的软化和腐烂。处理组与CK组之间对比发现,随贮藏时间延长,CK组果实腐烂率增加极显著,处理组的软化和腐烂率也略有增加。其原因可能是钙通过影响细胞内pH值而间接影响酶活性或是影响细胞壁向外分泌酶起作用[22]。也可能是钙防止果实软化的细胞壁、细胞膜及各种钙调节的生理反应综合作用的结果。但是处理1、处理2和处理3之间的差异不显著,即葡萄糖酸钙喷洒次数对果实腐烂率的影响不显著。表明采前葡萄糖酸钙处理鲜枣能够抑制果实的生理性病害,但对其侵染性病害可能没有抑制作用。
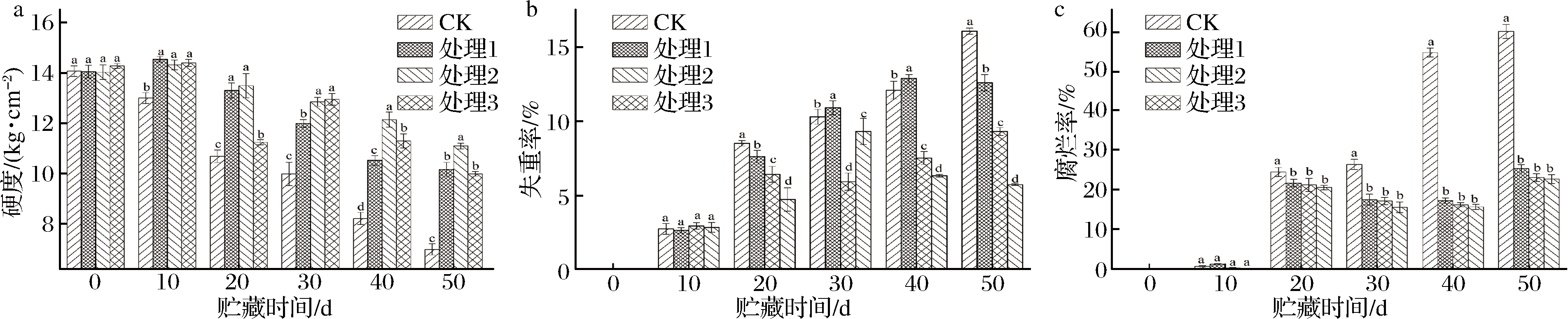
图1 采前葡萄糖酸钙处理对鲜枣果实硬度(a)、失重率(b)和腐烂率(c)的影响
Fig.1 Effect of gluconate calcium preharvest treatment on fruit firmness (a), weight loss (b) and rotting rate (c) of fresh jujube
维生素C(VC)含量的高低是鲜枣品质好坏的重要指标之一。由图2-a可以看出,采前葡萄糖酸钙喷洒处理组及CK组在采摘后0 d,鲜枣VC含量未表现出显著性的差异,但是随贮藏时间的延长,处理组和CK组果实的VC含量均呈下降趋势,在0~20 d时CK组的VC含量高于处理1和处理2但低于处理3,在贮藏30~50 d时,VC含量低至处理组以下。处理3的抗坏血酸含量始终高于CK和处理1、处理2。葡萄糖酸钙喷洒次数对VC含量的影响:随贮藏时间的增加,差异性越显著(P<0.01)。经过50 d的贮藏后,CK的Vc含量下降了43.78%,处理1、处理2和处理3 VC含量分别下降了35.14%、33.91%和32.84%。结果表明,采前葡萄糖酸钙喷洒处理有延缓VC下降的作用。
采后鲜枣果肉色泽受叶绿素、类胡萝卜素、花色素苷、类黄酮及酚类物质含量的综合变化影响[23]。采前葡萄糖酸钙处理对鲜枣果实叶绿素含量的影响如图2-b所示。采摘0 d时,各处理组之间和CK组叶绿素的含量有极显著性差异,葡萄糖酸钙处理次数对叶绿素含量降低有抑制作用,喷洒次数越多,抑制作用越强,由高到低的顺序是处理3>处理2>处理1>CK,随冷藏时间的延长,叶绿素的含量逐渐降低,说明采前喷洒葡萄糖酸钙处理能延缓鲜枣果肉的叶绿素含量降低。这可能是由于采前钙处理减少了MDA(图3-b)、活性氧等有害物质对叶绿体膜的破坏,维持了叶绿体结构的稳定性或是由于钙处理抑制了叶绿素降解酶的活性,保护了细胞膜的完整性,从而有助于延迟鲜枣果实的衰老。
许多可溶性蛋白是构成果蔬中酶的重要组成部分,参与果蔬多种生理生化代谢过程的调控,与果蔬生长、衰老、抗逆性以及抗病性等密切相关。采前葡萄糖酸钙处理对鲜枣果实可溶性蛋白质含量的影响如图2-c所示。采摘后0 d时,CK组和处理组之间可溶性蛋白质含量没有显著性差异。低温下冷藏30 d时,CK、处理1、处理2和处理3的可溶性蛋白质含量逐渐上升,之后CK开始迅速下降,处理组下降则较为缓慢,由快到慢的顺序依次为处理2>处理1>处理3,且差异显著。且枣裂果现象减轻(实验数据未显示)。原因可能是果实的蛋白质含量高有利于较好地控制果皮的强度和伸展性进而避免裂果的发生[24]。综上所述,采前葡萄糖酸钙喷洒能较好的保持鲜枣果肉中可溶性蛋白质的含量。可溶性蛋白作为植物中的有机渗透保护物质之一,有助于适当保持植物的渗透势,同时可以稳定和保护生物大分子的结构和功能[25],高浓度的可溶性蛋白可以使细胞维持较低的渗透势,帮助果实抵抗低温胁迫环境带来的伤害。有研究者认为,植物在逆境条件下体内某些正常蛋白合成往往会受到抑制,同时诱导出一些新的蛋白或使原有蛋白含量明显增加[26]。但是葡萄糖酸钙喷洒次数对可溶性蛋白质的影响并未表现出规律性变化。其原因有待进一步研究。
酚类物质是植物体内分布最为广泛的次生代谢物质,它不仅是参与酶促褐变反应的必要底物,而且也是植物防御体系的重要部分。是评价果实中抗氧化物质含量的重要指标[27],采前葡萄糖酸钙处理对鲜枣果实多酚含量的影响如图2-d所示。采摘后0 d,CK组和处理组以及处理组之间多酚物质含量均存在显著性差异,处理组均高于CK组。之后在整个冷藏过程中,CK组的多酚含量变化基本呈先上升后下降趋势,处理组没有明显的的下降趋势。贮藏10 d以后,在同一贮藏时间下,多酚含量为处理3>处理2>处理1>CK。说明葡萄糖酸钙喷洒及喷洒次数对鲜枣果实采后多酚含量下降有显著的抑制作用。这可能与钙处理能果实褐变[18],减少了酶促褐变过程中酚类物质消耗,抑制鲜枣低温贮藏有关。

图2 采前葡萄糖酸钙处理对鲜枣果实维生素C(a)、叶绿素(b)、可溶性蛋白(c) 和多酚含量(d)的影响
Fig.2 Effect of gluconate calcium preharvest treatment on ascorbic acid (a), chlorophyll(b),soluble protein (c),polyphenol content(d) and of fresh jujube
细胞膜对物质具有选择性透过的能力,当细胞膜遭到破坏时,膜透性增大,使得电解质外渗,以致植物细胞浸提液的电导率增大。而细胞膜结构的损伤与膜脂过氧化产物的积累有关,膜脂过氧化是低温诱导氧化损伤的一个重要表征,MDA含量是反映膜氧化损伤程度的公认指标[28-29]。能与膜结构上的蛋白质和酶结合、交联而使之失活,破坏膜的结构。采前葡萄糖酸钙处理对鲜枣果实相对电导率的影响如图3-a所示。在贮藏0 d时,CK组与处理组的相对电导率有显著性差异,CK的相对电导率最大。处理组之间果实相对电导率没有显著性的差异,之后随鲜果贮藏时间的延长,相对电导率逐渐上升,处理组和对照CK组之间出现了极显著性差异,由低到高的排列顺序为处理3<处理2<处理1<CK。说明采前葡萄糖酸钙喷洒处理次数对果实相对电导率有明显的抑制效果,而且随喷洒次数增加,抑制效果越显著。
采前葡萄糖酸钙处理对果实MDA的影响如图3-b所示。在鲜枣果实采摘后贮藏0 d时,CK组与处理组及处理组之间MDA的含量有明显差异,之后随贮藏时间延长,MDA含量不断上升;其变化幅度由大到小的排列顺序是CK>处理1>处理2>处理3,且存在显著性的差异。说明采前葡萄酸钙处理能抑制鲜枣果肉细胞膜相对渗透率和MDA上升,维持细胞膜结构完整作用显著,使鲜枣膜脂氧化程度显著降低。Ca2+是一种膜保护剂,通过维持细胞壁和细胞膜结构与功能的稳定,保持果实硬度,降低腐烂。膜结构损伤导致液泡中的钙流入细胞质,引起运输Ca2+和Ca2+-ATP酶的反向传递系统功能受到破坏,进入胞质的Ca2+难以流出[30]。因此可以认为采前葡萄糖酸钙的多次喷洒对破坏膜结构及其功能的因素有一定的拮抗作用。
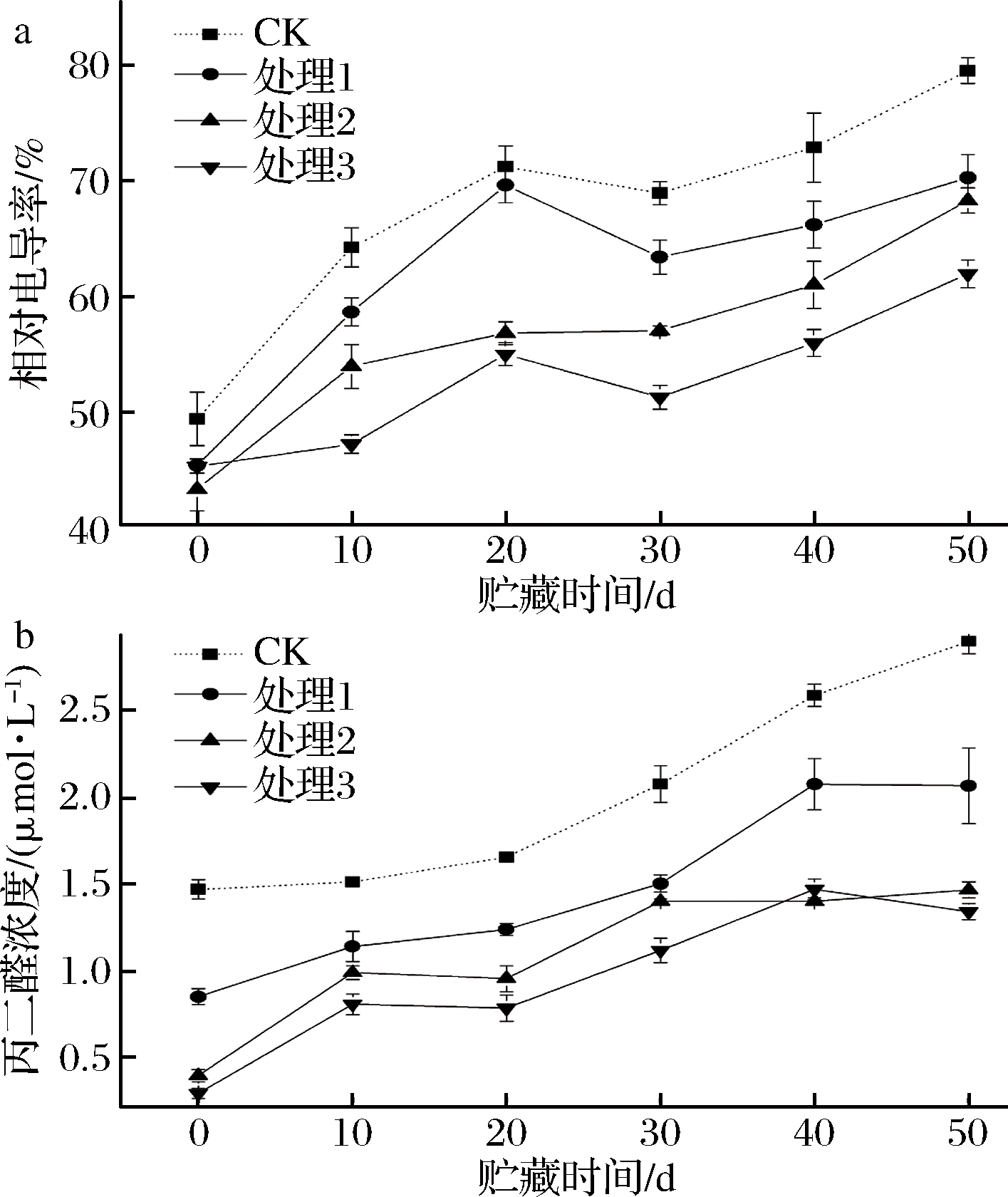
图3 采前葡萄糖酸钙处理对鲜枣果实相对电导率(a)和丙二醛(b)的影响
Fig.3 Effect of gluconate calcium preharvest treatment on the relative electric conductivity (a) and malondialdehyde content (b) of fresh jujube
H2O2和![]() 是生物体在氧化代谢的过程中产生的毒副产品。它们具有很强的氧化能力,可以使生物体生物膜的结构及功能受到损伤,引起核酸及蛋白质变性等,从而对细胞及组织产生多种生物学效应。采前葡萄糖酸钙喷洒处理对鲜枣果实H2O2含量的影响如图4-a所示。采摘后贮藏0 d时,CK组和处理组及处理组之间H2O2的含量变化差异不显著。之后随贮藏时间延长,H2O2的含量逐渐升高,贮藏至后期30~50 d时,H2O2含量在同一贮藏时间由高到低的变化顺序为CK>处理1>处理2>处理3,由此可见,适宜浓度钙处理在一定程度上可以抑制H2O2含量的增加,延缓果实衰老。如图4-b所示,采前葡萄糖酸钙喷洒处理对鲜枣果实
是生物体在氧化代谢的过程中产生的毒副产品。它们具有很强的氧化能力,可以使生物体生物膜的结构及功能受到损伤,引起核酸及蛋白质变性等,从而对细胞及组织产生多种生物学效应。采前葡萄糖酸钙喷洒处理对鲜枣果实H2O2含量的影响如图4-a所示。采摘后贮藏0 d时,CK组和处理组及处理组之间H2O2的含量变化差异不显著。之后随贮藏时间延长,H2O2的含量逐渐升高,贮藏至后期30~50 d时,H2O2含量在同一贮藏时间由高到低的变化顺序为CK>处理1>处理2>处理3,由此可见,适宜浓度钙处理在一定程度上可以抑制H2O2含量的增加,延缓果实衰老。如图4-b所示,采前葡萄糖酸钙喷洒处理对鲜枣果实![]() 的影响。采摘后在贮藏0 d时,CK组和处理组
的影响。采摘后在贮藏0 d时,CK组和处理组![]() 的含量变化差异不明显。之后随贮藏时间的延长,
的含量变化差异不明显。之后随贮藏时间的延长,![]() 的含量逐渐升高,处理1和处理2的
的含量逐渐升高,处理1和处理2的![]() 含量始终低于对照CK。在0~20 d时,CK组略高于处理组,30 d之后,CK的
含量始终低于对照CK。在0~20 d时,CK组略高于处理组,30 d之后,CK的![]() 含量却低于处理3,但高于处理1和处理2,处理组之间存在显著性差异,处理1的变化幅度最小,处理3的变化幅度最大,表明鲜枣果实
含量却低于处理3,但高于处理1和处理2,处理组之间存在显著性差异,处理1的变化幅度最小,处理3的变化幅度最大,表明鲜枣果实![]() 含量的变化与一定浓度的葡萄糖酸钙喷洒及喷洒次数有一定的关联性。其原因可能是Ca2+能激活细胞质膜氧化还原酶类如NADPH氧化酶、过氧化物酶等的活性,从而促进植物体内活性氧的产生,增强植物的过敏反应和系统获得性反应[12, 31-32],所以低温胁迫条件下,植物体内Ca2+水平的上升与活性氧的迸发是密不可分的,两者可共同在植物防御反应中发挥作用。
含量的变化与一定浓度的葡萄糖酸钙喷洒及喷洒次数有一定的关联性。其原因可能是Ca2+能激活细胞质膜氧化还原酶类如NADPH氧化酶、过氧化物酶等的活性,从而促进植物体内活性氧的产生,增强植物的过敏反应和系统获得性反应[12, 31-32],所以低温胁迫条件下,植物体内Ca2+水平的上升与活性氧的迸发是密不可分的,两者可共同在植物防御反应中发挥作用。
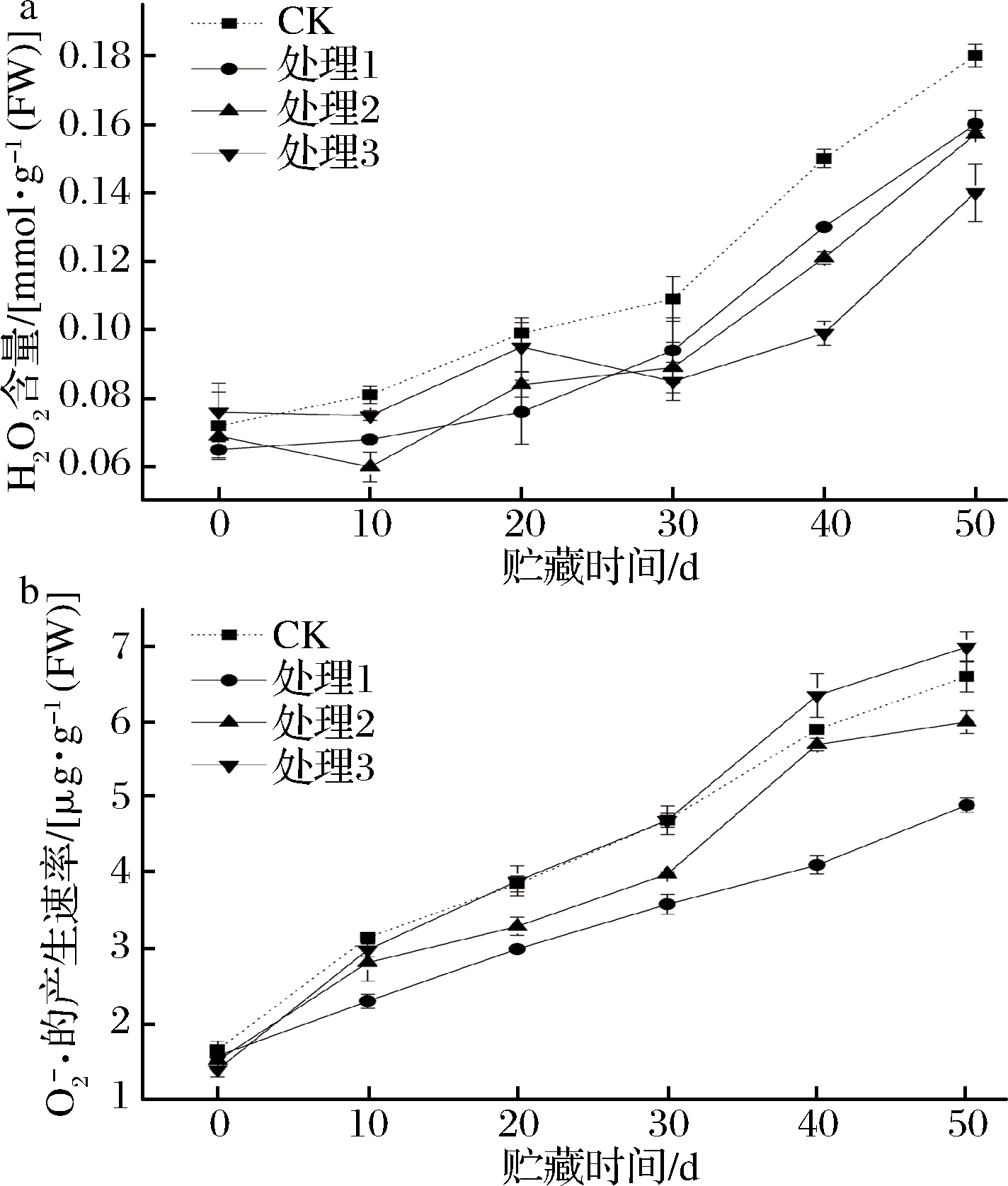
图4 采前葡萄糖酸钙处理对鲜枣果实H2O2(a)和![]() 的产生速率(b)的影响
的产生速率(b)的影响
Fig.4 Effect of gluconate calcium preharvest treatment
on H2O2 content (a) and superoxide anion free radical (b) of fresh jujube
用0.1 mol/L葡萄糖酸钙采前喷洒鲜枣果实,在0±0.5 ℃的冷藏库中贮藏,与对照CK相比,采前钙处理能够较好地抑制鲜枣果实水分的散失,延缓果实硬度和腐烂率的下降,保持果实较高的VC、叶绿素、可溶性蛋白和多酚物质的含量,有效阻止了枣果实采后软化和营养物质的损失。同时对枣果肉细胞膜透性和丙二醛、H2O2和![]() 的增加起到了显著的抑制作用,从而延缓了枣果实细胞膜的损坏,延长了鲜枣的货架期,保持果实较好的贮藏品质。但喷洒处理次数对腐烂率的影响不显著,对硬度
的增加起到了显著的抑制作用,从而延缓了枣果实细胞膜的损坏,延长了鲜枣的货架期,保持果实较好的贮藏品质。但喷洒处理次数对腐烂率的影响不显著,对硬度![]() 可溶性蛋白含量未表现出规律性的变化,对鲜枣采后侵染性的病害不能有效的防治。所以钙的合理施入时间、方法、使用种类等技术应用于鲜枣果实的贮藏仍有待进一步探讨。
可溶性蛋白含量未表现出规律性的变化,对鲜枣采后侵染性的病害不能有效的防治。所以钙的合理施入时间、方法、使用种类等技术应用于鲜枣果实的贮藏仍有待进一步探讨。
参考文献
[1] GAO Q H, WU P T, LIU J R, et al. Physico-chemical properties and antioxidant capacity of different jujube (Ziziphus jujube Mill.) cultivars grown in loess plateau of China[J]. Scientia Horticulturae, 2011,130: 67-72.
[2] HEMANDEZ-MUNOZ P, ALMENAR E, DEL VALLE V, et al. Effect of chitosan coating combined with postharvest calcium treatment on strawberry quality during refrigerated storage[J]. Food Chemistry, 2008, 110(2): 428-435.
[3] MCAINSH M R, PITTMAN J K. Shaping the calcium signature [J]. New Phytologist, 2009, 181:275-294.
[4] 陈见晖,周卫.苹果缺钙对果实组分、亚细胞分布及超微结构的影响[J]. 中国农业科学, 2004, 37(4): 572-576.
[5] DEFALCO T A, BENDER K W, SNEDDEN W A. Breaking the code: Ca2+ sensors in plant signaling [J]. Biochemical Journal, 2010, 425:27-40.
[6] ANIREDDY S N, GUL S, HELENA C, et al. Coping with stresses: Roles of calcium and calcium/calmodulin-regulated gene expression [J]. Plant Cell, 2011, 23:2 010-2 032.
[7] 汪星,朱德兰,杨荣慧,等.陕北山地红安抗裂裂性研究[J].果树学报,2011,28(1):82.
[8] 陈辉惶,库建贵,张俊,等.新疆红枣裂果机理研究进展[J].新疆农业科学,2012,49(6):1 066-1 072.
[9] 杨巍,刘晶,吕春晶,等.氯化钙和抗坏血酸处理对鲜切苹果品质和褐变的影响[J]. 中国农业科学, 2010, 43(16): 3 402-3 410.
[10] BARBAGALLO R N, CHISARI M, CAPUTA G. Effects of calcium citrate and ascorbate as inhibitors of browning and softening in minimally processed ‘Birgah’ eggplants [J]. Postharvest Biology and Technology, 2012, 73(6): 107-114.
[11] ALANDES L, PEREZ-MUNUERA I, LLORCA E, et al. Use of calcium lactate to improve structure of “Flor de Invierno” fresh-cut pears [J]. Postharvest Biology and Technology, 2009, 53(3): 145-151.
[12] 吴锦程, 陈宇,吴毕莎,等. 钙处理对低温胁迫下枇杷幼苗Ca2+-ATPase活性和膜脂过氧化水平的影响[J].西北农林科技大学学报,2015,44(2):121-128.
[13] BEIRAO-DA-COSTA S, CARDOSO A, MARTINS L, et al. The effect of calcium dips combined with mild heating of whole kiwifruit for fruit slices quality maintenance[J]. Food Chemistry, 2008, 108(1): 191-197.
[14] 魏天军, 窦云萍. 真空渗透钙离子和植物激素对灵武长枣贮藏保鲜效果的影响[J]. 中国农学通报, 2008, 124(10): 118-121.
[15] 中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学出版社,1999.
[16] 林河通,席玙芳,陈绍军.龙眼果实采后失水果皮褐变与活性氧及酚类代谢的关系[J].植物生理与分子生物学学报,2005,31(3):287-297.
[17] BRENNAN T C. Involvement of hydrogen peroxide in the regulation of senescence in pear[J]. Plant Physiol, 1977, 59 (2): 411-416.
[18] 邢尚军,刘方春,杜振宇,等. 采前钙处理对冬枣贮藏品质、钙形态及亚细胞分布的影响[J].食品科学,2009,30(2):235-240.
[19] 刘剑锋,程云清,彭抒昂.采后钙处理对梨果实钙的形态和果胶及相关代谢酶类影响的研究[J].热带亚热带植物学报,2005,13(5):408-412.
[20] 庞凌云,李瑜,詹丽娟,等.不同钙处理对中华猕猴桃软化的影响[J].食品与发酵工业,2014,40(9):102-106.
[21] GHULAM K, MAHMUD T M M, ASGAR A, et al. Effect of gum arabic coating combined with calcium chloride on physico-chemical and qualitative properties of mango (Mangifera indica L.) fruit during low temperature storage [J]. Scientia Horticulturae,2015,190: 187-194.
[22] 柯玉清,张长峰.钙对果实采后生理作用及其机理研究进展[J].保鲜与加工, 2005, 5(5):8-10.
[23] ZHONG Q P, XIA W S. Effect of 1-methylcyclopropene and/or chitosan coating treatments on storage life and quality maintenance of Indian jujube fruit [J]. LWT-Food Science and Technology, 2007,40:404-411.
[24] 李洁,义宇琴,韩金龙,等.矿质营养处理对枣裂果和品质的影响[J].山西农业科学,2013,41(10):1 054-1 057.
[25] 田晓艳,刘延吉,郭迎春. 盐胁迫对NHC牧草Na+、K+、Pro、可溶性糖及可溶性蛋白的影响[J].草业科学, 2008,25(10):34-38.
[26] 杜长霞,李娟,郭世荣,等.外源亚精胺对盐胁迫下黄瓜幼苗生长和可溶性蛋白表达的影响[J].西北植物学报,2007,27(6):1 179-1 184.
[27] 卢娟芳,刘盛雨,芦旺,等.不同类型桃果肉酚类物质及抗氧化活性分析[J].中国农业科学, 2017,50(16):3 205-3 214.
[28] 张宗申,利容千,王建波.外源Ca2+预处理对高温胁迫下辣椒叶片细胞膜透性和GSH、AsA含量及Ca2+分布的影响[J].植物生态学报,2001,25(2):230-234.
[29] 陈见晖, 周卫. 苹果缺钙对果实组分、亚细胞分布及超微结构的影响[J]. 中国农业科学, 2004, 37(4): 572-576.
[30] 田敏,饶龙兵,李纪元. 植物细胞中的活性氧及其生理作用[J].植物生理学通讯,2005,41(2):235-242.
[31] BONZA M C, DEMICHELIS M I. The plant Ca2+-ATPase repertoire: Biochemical feature and physiological functions [J]. Plant Biology,2011,13(3):421-430.
[32] 林素英,梁杰,黄志明,等.钙调素拮抗剂TFP对低温胁迫下枇杷幼果AsA-GSH循环的影响[J].热带作物学报,2012,33(11):1 980-1 984.
LI Junlan*, YANG Lan, WU Xiaoxia, MENG Wenfen, YUAN Jing,YU Xinghai, FENG Jiuhai
(College of Agricultural and Biological Technology, Hexi University, Zhangye 734000, China)
Abstract This paper explored the effects of preharvest spraying of calcium gluconate on the quality and active oxygen metabolism of fresh jujube fruit stored at low temperature. Using fresh jujube cultivar (Zizyphus jujube cv.Fengmiguan) as raw material, fruits were sprayed with 0.1 mol/L calcium gluconate once every 7 days from white dew. According to spraying times, four treatments were preset: treatment 1, treatment 2, treatment 3 and unsprayed fruits (CK). The fruits were picked when the coloring area reached 50%-70%, and stored at (0±0.5) ℃. Fruits were sampled and measured every 10 days. The results indicated that in comparison to CK, preharvest calcium gluconate treatment and different treatment times significantly inhibited decreases in weight loss rates, vitamin C, chlorophyll, and polyphenol contents of fresh jujube fruits. Moreover, increases in H2O2, relative conductivity of cell membrane, and MDA contents of fresh jujube fruits were inhibited, with an order of CK>treatment 1>treatment 2>treatment 3, and the differences were significant (P<0.05). Although calcium gluconate could reduce the decay rates, ![]() contents, improved hardness and soluble protein contents, times of spraying had no significant influences on decay rates (P>0.05). Additionally, no change laws observed for hardness, contents of
contents, improved hardness and soluble protein contents, times of spraying had no significant influences on decay rates (P>0.05). Additionally, no change laws observed for hardness, contents of ![]() and soluble protein. In conclusion, this paper provides theoretical basis for quality changes in fresh jujube during low temperature storage.
and soluble protein. In conclusion, this paper provides theoretical basis for quality changes in fresh jujube during low temperature storage.
Key words fresh jujube; calcium gluconate; preharvest treatment; storage quality; reactive oxygen metabolism