拟指数—DO-stat两阶段补料策略在糖蜜酵母高密度培养中的应用
徐富增1,2,王柯1,2,李善元3,毛忠贵1,2,张建华1,2*
1(江南大学 生物工程学院,江苏 无锡,214122) 2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 3(云南保山九隆酵母有限公司,云南 保山,678000)
摘 要 高密度培养(high cell density cultivation,HCDC)是酵母生产实现高效高产的途径。文中以菌体量、菌体得率和生产强度为评价指标,探讨了拟指数和DO-stat两种补料策略的优缺点,提出了1种两阶段补料策略:在21 h的分批培养结束后,首先采用比生长速率为0.03 h-1的拟指数补料,然后在溶氧跌到20%以下后将补料方式切换为DO 40%的DO-stat补料。结果显示,两阶段补料策略达到了菌体量123.57 g/L、总菌体得率0.51 g/g、生产强度1.15 g/(L·h)。与拟指数补料策略相比,菌体量提高了23.8%、菌体得率提高 6.25%;与DO-Stat补料策略相比,培养周期缩短20.4%、生产强度提高了14.5%。研究结果表明,两阶段补料策略可以有效地提高酵母生长能力。
关键词 酿酒酵母;高密度培养;补料分批培养模式;菌体得率;生产强度
第一作者:硕士研究生(张建华副研究员为通讯作者,E-mail:jhzh882@163.com)。
收稿日期:2018-11-15,改回日期:2019-01-04
DOI:10.13995/j.cnki.11-1802/ts.019332
酵母及其副产品可广泛地应用于食品、医药、饲料等行业,有着广阔的应用市场和良好的经济效益。2016年全球酵母产品市场达到近71亿美元,预计到2022年将达到107亿美元[1]。酵母生产原材料的廉价易得是酵母产品经济效益好的一个原因。糖蜜作为制糖加工的副产物,是最廉价的碳水化合物之一,含有大约50%的糖类,以及一些含氮物质、维生素和微量元素,是用于酵母培养的主要原料[2-4]。
在酵母培养过程中出现的Crabtree效应[5]是制约酵母生长的一个因素,该效应指当可发酵性碳源浓度过高时,即使供氧充足,也会导致碳源流向乙醇合成途径,导致乙醇积累,使得糖利用率下降。而且,高浓度的乙醇副产物也会对细胞结构及功能造成损伤,抑制菌体生长和产物合成[6]。因此,酵母培养难点主要在于如何有效控制糖浓度,在保证酵母正常生长的同时减小溢流代谢,提高原料利用率,实现酵母的高得率、高浓度生长[7]。
高密度培养是酵母工业的发展趋势,实现高密度、高产率和高浓度培养是酵母工业的目标和方向[8-9]。在补料分批过程中可以通过补料策略的优化,控制培养基营养的流入,实现生物量和得率最大化。近年来,随着研究的不断深入,补料策略逐渐变得复杂化,引入一些更为复杂的数学模型及人工智能技术。
张许等[10]将差分进化算法(differential evolution,DE)与传统比例-积分-微分(proportional-integral-derivative,PID)控制策略相结合,构建了用于酿酒酵母分批补料培养过程的在线自适应控制策略,成功将乙醇稳定地控制在设定值(1 g/L)附近,同时使得酵母增殖质量浓度达到34.45 g/L。CHOPDA等[11]采用基于TCP/IP协议的解耦输入-输出线性化控制器(decoupled input-output linearizing controller,DIOLC)实时在线控制溶氧和残余葡萄糖,实现酵母生长最大化,与PID或PID- 控制器相比,可提高23%和18%的菌体量。HOCALAR等[12]基于状态估计算法构建了状态反馈线性控制策略,通过在控制算法中设定菌体浓度和乙醇浓度,通过调节最小乙醇浓度来控制比生长速率,调整流加策略,成功实时控制乙醇浓度,以使生物质生产率最大化。但是,对于多数中小型酵母生产企业来讲,这些方法并不适用,因为先进的方法往往涉及复杂的控制设备和实施复杂控制算法,需要必要的辅助设备,这些额外且昂贵的经济投入是大多数中小型企业现代化道路上的一个严重障碍[13]。因此,开发一种简单、低成本的方法进行酿酒酵母培养,更适用于小企业的需要。
控制器相比,可提高23%和18%的菌体量。HOCALAR等[12]基于状态估计算法构建了状态反馈线性控制策略,通过在控制算法中设定菌体浓度和乙醇浓度,通过调节最小乙醇浓度来控制比生长速率,调整流加策略,成功实时控制乙醇浓度,以使生物质生产率最大化。但是,对于多数中小型酵母生产企业来讲,这些方法并不适用,因为先进的方法往往涉及复杂的控制设备和实施复杂控制算法,需要必要的辅助设备,这些额外且昂贵的经济投入是大多数中小型企业现代化道路上的一个严重障碍[13]。因此,开发一种简单、低成本的方法进行酿酒酵母培养,更适用于小企业的需要。
本文以实验室优化的糖蜜培养基为基础,以菌体量、菌体得率和生产强度为评价指标,探究了DO-Stat和拟指数2种常规补料策略,在此基础上开发了“拟指数—DO-Stat”两阶段补料策略,该策略可以尽可能解除Crabtree效应,避免溢流代谢,提高酵母菌体得率和生产强度,提高设备利用率,为酵母工业高密度培养工艺的开发提供了新的思路。
1 材料与方法
1.1 菌株
酿酒酵母(Saccharomyces cerevisiae),由云南保山九隆酵母有限公司提供。于斜面保藏培养基4 ℃保藏。
1.2 培养基
(1)种子培养基(g/L):葡萄糖22.0,酵母抽提物8.5,NH4Cl 1.3,MgSO4·7H2O 0.1,无水CaCl2 0.06,pH自然,115 ℃灭菌15 min。
(2)斜面保藏培养基(g/L):葡萄糖22.0,酵母提取物8.5,NH4Cl 1.3,MgSO4·7H2O 0.1,无水CaCl2 0.06,琼脂2.0。pH自然,115 ℃灭菌15 min。
(3)上罐培养基(g/L):糖蜜稀释液总糖79.0,(NH4)2SO4 8.56,KH2PO4 1.85,MnCl2·4H2O 0.003,ZnSO4·7H2O 0.007 5。
(4)补料培养基(g/L):糖蜜稀释液总糖350,(NH4)2SO4 38,KH2PO4 8.16。培养基为保证碳源总量一致,均按总糖计称取相应质量的糖蜜。
1.3 试剂与材料
葡萄糖、NH4Cl、MgSO4·7H2O、CaCl2、KH2PO4、MnCl2·4H2O、ZnSO4·7H2O等(分析纯),上海国药集团;酵母抽提物(分析纯),英国Oxoid公司;甜菜糖蜜,云南保山九隆酵母有限公司,经稀释后配料使用,主要成分如表1所示。
表1 糖蜜主要成分 单位:%(质量分数)
Table 1 The chemical composition of molasses

总糖水分粗蛋白灰分胶体粗脂肪其他45.51±5.024.12±2.110.13±0.811.33±0.61.12±0.30.06±0.017.5~8
1.4 仪器与设备
5 L二联发酵罐(BLBIO-5GJ-2),上海百伦生物设备有限公司;高效液相(U-3000),USA Dionex;立式压力蒸汽灭菌器(LS-B50L),上海化学医用核子仪器公司;分析天平(AB204-N),瑞士梅特勒公司;真空干燥箱(DZF-6050),上海博讯实业有限公司;回转式恒温摇床(HYG-Ⅱ),上海欣蕊自动化设备有限公司;电子天平(BS1100+),上海友声衡器有限公司;超净工作台(SW-CJ-1FD),苏州安泰空气技术有限公司。
1.5 种子培养
从斜面培养基中挑取1~2环酵母菌,接种于种子培养基,500 mL三角瓶装液量为200 mL,于200 r/min、30 ℃条件下培养16~17 h,至酵母数为3×108~4×108个/mL。
1.6 酵母培养方式
酵母高密度培养采取先分批后流加的方式。先将种子培养基按体积分数为10%的接种量接种于上罐培养基,待可发酵性糖和乙醇消耗完毕,溶氧(dissolved oxygen,DO)上升开始流加。本文所探究的补料方式共有3种,分别为拟指数补料、DO-Stat补料、两阶段补料。不同的补料方式均流加相同的体积。
(1)分批培养:在5 L机械搅拌式通风发酵罐中装入2.7 L上罐培养基,接入300 mL种子培养基。调整通气量为5.0 L/min,初始转速400 r/min。在酵母达到对数生长的3~4 h之后,将转速调整到600 r/min。利用2 mol/L的H2SO4和2 mol/L的NaOH维持pH值为5.5,温度30 ℃,食品消泡剂控制泡沫产生。
(2)拟指数补料:采用上罐培养基进行分批培养,在21 h左右溶氧上升,即可发酵性糖和乙醇消耗完毕后,开启补料泵,按照预设的补料速率将补料培养基流加入罐内。开始补料后,调整通气流量为7.0 L/min,转速600~900 r/min,溶氧关联搅拌控制DO不低于30%。pH值、温度、泡沫控制与分批培养相同。
补料速率按公式(1)[14]计算:
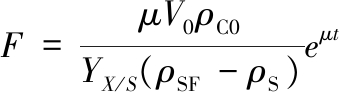
(1)
其中:F,补料速率,L/h;μ,所设定的酵母比生长速率,h-1;V0,补料开始罐内培养基体积,L;ρC0,开始补料时罐内菌体质量浓度,g/L;YX/S,菌体得率,%;ρSF,补料培养基的总糖质量浓度,g/L;ρS,开始补料时段的罐内总糖质量浓度,g/L;t,指数补料时间,h。
补料方式[15]:采用脉冲型蠕动泵补料,但难以实现随时间的精确变化的补料速度。因此,采用时间差分法进行补料速率的计算和控制。设定每2 h更改补料速率,即以补料开始时间t时刻更改补料速率,该速率在t~t+2时间段持续,根据公式计算该2 h内的平均补料速度,计算t值取中间时刻t+1。
以μ=0.02 h-1为例,补料速率的计算值和操作值如图1所示。
图1 拟指数补料的理论流速与实际操作流速
Fig.1 The theoretical feeding rate and the actual set value
of the quasi-exponential
(3)DO-Stat补料:在分批培养的基础上,当溶氧开始上升后,启动DO-Stat机制进行补料。当溶氧高于设定值时,通过反馈机制开启蠕动泵加入培养基,溶氧低于设定值时,通过在线自动控制提高转速,在该过程中将通气调整在7.0 L/min。pH值、温度、泡沫控制与分批培养相同。
(4)两阶段补料:采用上罐培养基进行分批培养,在21 h左右溶氧上升,按照拟指数补料方式进行补料,在48 h左右溶氧跌到20%以下并有乙醇产生时,调整为DO 40%的DO-stat补料。
1.7 分析方法
总糖测定:斐林试剂滴定法[16]。
乙醇测定:HPLC法[17]。发酵液在4 ℃、12 000 r/min条件下离心10 min,取上清液进行0.22 μm膜过滤处理,滤液进行HPLC(Dionex,USA)测定。液相色谱条件:Aminex HPX-87H色谱柱(300 mm×7.8mm,9 μm,Hercules,CA);RI检测器(Shodex RI-101,Japan)和UV检测器(Dionex,USA);流动相5 mmol/L H2SO4;柱温65 ℃;流速0.6 mL/min;进样量20 μL。
菌体干重(dry cell weight,DCW):取发酵液置于烘干至恒重的离心管中,8 000 r/min离心10 min,弃去上清液,用去离子水反复洗涤离心菌体3~4次。于真空干燥箱中干燥至恒重。称量计算菌体干重。
菌体得率:生成菌体与所消耗糖的质量比值。按公式(2)计算:
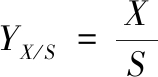
(2)
其中:YX/S,菌体得率,%;X,总的菌体干重,g;S,总的糖消耗质量,g。
生产强度:单位体积反应器的生产能力。计算采用公式(3):
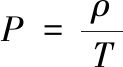
(3)
其中:P,生产强度,g/(L·h);ρ,菌体质量浓度,g/L;T,培养时间,h。
2 结果与讨论
2.1 初始糖浓度优化
将底物浓度定为上罐培养基的1.5倍和2.0倍进行分批培养与初始上罐培养基结果进行比较,结果如表2所示,随着培养基浓度的提高,菌体量仅有小幅提升,但是生长周期和最大乙醇产量却大大增加。说明培养基中营养物质增加到一定浓度时,菌体生长显示饱和动力学,底物浓度的进一步增加引起底物抑制,使得迟滞期延长[18];而且过量的碳源引起Crabtree效应,使得糖代谢从TCA循环转至乙醇合成途径,导致大量乙醇的产生,抑制了细胞密度的进一步提高[19]。因此,分批培养难以实现高密度的水平,要提高细胞密度,需采用补料培养的方式。
表2 不同底物质量浓度下酵母生长参数比较
Table 2 Comparison of yeast growth parameters for
different substrate concentration
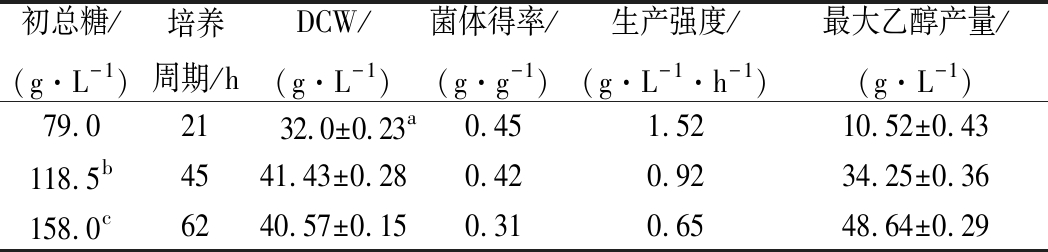
初总糖/(g·L-1)培养周期/hDCW/(g·L-1)菌体得率/(g·g-1)生产强度/(g·L-1·h-1)最大乙醇产量/(g·L-1)79.02132.0±0.23a0.451.5210.52±0.43118.5b4541.43±0.280.420.9234.25±0.36158.0c6240.57±0.150.310.6548.64±0.29
注:a-以标准偏差(SD) 表示;b、c,分别为1.5倍、2.0倍培养基浓度中初总糖浓度;其中培养基各成分均以上罐培养基为基础按照倍数增加。
2.2 拟指数补料条件下酵母的生长特性
拟指数补料是一种根据菌体生长规律制定补料速率的方法,理论上可以使菌体在最佳状态下生长[20],因此本文采用控制比生长速率的拟指数补料。开始补料的初始条件以分批结束时的生长状态为准,初始体积为3.0 L、菌体质量浓度为32 g/L、补料开始糖质量浓度为10.0 g/L。分别在比生长速率为0.02、0.03、0.04 h-1条件下考察补料效果(图2)。
结果如图2所示,随着比生长速率的提高,酵母的生长周期明显缩短。但是在不同的比生长速率控制条件下,后期均有乙醇出现,乙醇的出现均与溶氧的下降同时发生,μ为0.02、0.03、0.04 h-1分别在60、48、42 h溶氧降到20%以下甚至更低。该现象应该是由于菌体浓度较大,有限的通风搅拌供氧已经难以维持酵母的有氧呼吸,造成Crabtree效应,此时酵母的生长速率已经难以维持在设定值[15,19]。
A-μ=0.02 h-1;B-μ=0.03 h-1;C-μ=0.04 h-1
图2 拟指数补料流加培养过程图
Fig.2 The culture process with quasi-exponential feeding at specific growth rate
从表3可以看出,乙醇溢流代谢的出现导致糖的利用率下降,最大的菌体量出现在μ为0.02 h-1时,也仅有100.5 g/L,说明单一的拟指数补料并不适合于酿酒酵母的高密度培养。但是本研究发现,在TE时刻之前,并没有导致糖的累积和乙醇的出现,该阶段酵母的生产强度较高,μ为0.02、0.03、0.04 h-1分别达到1.03、1.55、1.61 g/(L·h),高于全过程的生产强度。而在TE之后,由于糖的流加速率大于酵母的消耗速率才使得糖累积、Crabtree效应出现。因此,在溶氧下降之后可以适当降低流加速率,避免该现象的发生。考虑到操作的易行性,可以采取后期进行DO-stat流加。本文选择μ为0.03 h-1是比较适合的。因为在0~TE,相比于μ为0.04 h-1的补料,μ为0.03 h-1的生产强度仅低了3.8%;TE时刻流加培养基的体积为0.82 L,低于μ为0.04 h-1的1.14 L,但此时DCWE却高出2.9%,说明在TE时刻之前,菌体生长已经不能遵循预设的0.04 h-1的比生长速率,一部分糖已经出现累积,这在图3中也可以看出。
2.3 DO-Stat补料条件下酵母的生长特性
酵母的高密度培养制约因素主要来自于两个方面[14]:一是供氧不足导致酵母发生厌氧代谢生成乙醇;二是当培养基中的糖浓度较高时产生Crabtree效应,糖溢流代谢生成乙醇。两者均会影响糖的转化率。所以,对于酵母的培养应当从控制溶氧和控制糖浓两方面入手。由于无法实时监控发酵罐内糖的浓度,而离线检测存在一定的滞后性,容易造成糖的累积或缺乏,目前难以通过糖浓度控制补料速率。
表3 拟指数补料中不同比生长速率酵母生长参数比较
Table 3 Comparison of yeast growth parameters for different μ in quasi-exponential feeding strategy
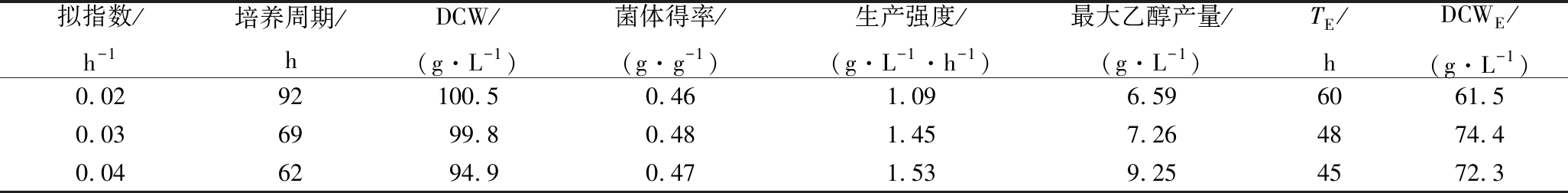
拟指数/h-1培养周期/hDCW/(g·L-1)菌体得率/(g·g-1)生产强度/(g·L-1·h-1)最大乙醇产量/(g·L-1)TE/hDCWE/(g·L-1)0.0292100.50.461.096.596061.50.036999.80.481.457.264874.40.046294.90.471.539.254572.3
注:TE指乙醇出现时的时间;DCWE指乙醇出现时刻DCW。下同。
溶氧是反映菌体生长的一个指标,当糖足够且菌体生长旺盛时,表现溶氧下降;糖浓不足时,菌体会由于饥饿死亡,表现为溶氧上升。所以考虑采用DO-stat的手段进行反馈流加,使得溶氧维持在一定水平,既不因为溶氧不足或糖浓过高产生乙醇溢流代谢,也不会出现供糖不足造成的菌体死亡的现象[21-23]。
在21 h可发酵性糖及乙醇消耗完毕后,在10 min内溶氧急剧上升至超过设定溶氧值10%以上,启动溶氧反馈流加。分别将溶氧设定为30%、40%、50%对酵母进行补料培养。从图3中可以看出,溶氧的设定对酵母的生长有较大的影响,随着设定溶氧值的升高,当转速上升到一定高度时,为了维持较高溶氧,培养基的流加速率逐渐降低,使得体系中糖无法累积甚至溶氧过高时,菌体出现饥饿状态,导致酵母生长减缓,发酵周期延长。当设定溶氧值较低时,为了匹配较低溶氧,糖的流加速率加快,使得酵母快速生长繁殖,溶氧保持在较低水平,但是由于溶氧的降低以及糖的积累使得更多的糖流向乙醇代谢,对酵母生长造成不利,影响原料利用。
A-30% DO;B-40% DO;C-DO 50%
图3 DO-stat补料流加培养过程图
Fig.3 The culture process with DO-stat feeding at dissolved oxygen concentrations
因此,一个合适的溶氧水平对酵母的流加培养是至关重要的。从表4可以看出,DO为40%时的DCW、菌体得率是最高的,且各条件下均未发现明显的乙醇累积,说明合适的DO-stat可以有效达到高密度水平,抑制Crabtree效应。但是较长的培养周期严重影响了菌体的生产强度,即使在最优的DO40%时,生产强度也只有1.004 g/(L·h)。
合适的DO-stat虽然能够得到比较高的菌体浓度,但是其生长周期较长,降低了体积生产率。对于企业生产尤其是比较廉价的酵母来讲,生产效率也是决定产业利益的一个重要因素。因此,如何在保证较高菌体浓度的前提下,提高生产强度是提高酵母生产能力的关键。
表4 DO-stat补料中不同溶氧水平酵母生长参数比较
Table 4 Comparison of yeast growth parameters fordifferent DO in DO-stat feeding strateg
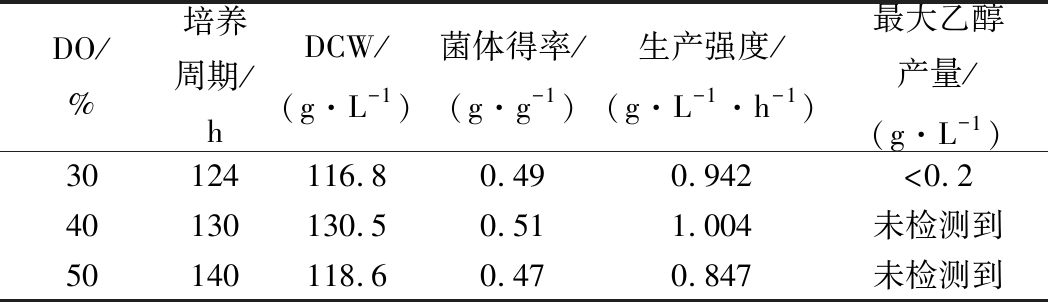
DO/%培养周期/h DCW/(g·L-1)菌体得率/(g·g-1)生产强度/(g·L-1·h-1)最大乙醇产量/(g·L-1)30124116.80.490.942<0.240130130.50.511.004未检测到50140118.60.470.847未检测到
2.4 拟指数结合DO-stat的两阶段补料条件下酵母的生长特性
基于拟指数和DO-stat各有优缺点,因此将二者进行结合,首先在糖和乙醇消耗完毕之后进行μ为0.03 h-1的拟指数补料,在拟指数补料的第48 h产生乙醇之前,将补料方式改为溶氧为40%DO-Stat,降低补料速率,减缓生长,将溶氧控制在合适范围。结果如图4所示。
图4 拟指数—DO-stat两阶段补料流加培养过程图
Fig.4 The culture process with two-step feeding strategy
从图4可以看出,两阶段补料可以有效解决指数补料后期溶氧不足、乙醇积累的问题,并且可以提高DO-stat过程中菌体的生长速率。经过108 h的两阶段补料可得到123.57 g/L的菌体、0.51 g/g的总菌体得率和1.15 g/(L·h)的生产强度。相对于DO-stat培养周期缩短了20.4%,生产强度提高了15%,达到了预期的高密度培养的目标。
拟指数补料由于后期溶氧难以维持,实际比生长速率低于设定值造成糖累积,产生乙醇代谢,通过将乙醇出现之后阶段的补料方式调整为DO-stat补料,可以有效解决该问题,因此将补料前期设定为高速生长的拟指数补料,后期切换可避免乙醇代谢的DO-stat补料,可以有效综合两种补料的优势,提高酵母生长水平。
3 结论与讨论
酵母培养中,如果有乙醇溢流代谢的出现,不可避免的会造成细胞浓度的下降。保持酿酒酵母生长中非常低水平的乙醇,可以有效实现高浓菌体量,提高糖的转化率。因此,为了在酿酒酵母的培养过程中获得高产量的菌体,糖浓度必须满足两点:一是足够满足酵母生长需求,二是避免过量而产生溢流代谢[24-25]。合理的补料方式是提高酵母生长能力,提高菌体密度的关键。
单一的恒速或指数补料可以解决分批培养中菌体浓度较低的问题,使酵母快速增殖达到较高菌体浓度,但是Crabtree效应难以避免,糖的转化率总是难以保证。例如KIM等[26]使用酿酒酵母JUL3利用50%糖蜜进行恒速补料培养80 h后得到95.7 g/L DCW;康远军[27]采用μ为0.05 h-1的指数补料培养鲁氏酵母48 h得到72.91 g/L的DCW,菌体得率仅为0.3 g/g。为了解决Crabtree效应,有学者采用在指数补料后期将比生长速率降低或者全程保持较高溶氧,这样可以避免乙醇产生,但是也会带来生产效率较低或菌体浓度较低的问题。例如,季萌等[15]使用酿酒酵母AFY-1利用优化的线性减少比生长速率的指数补料方式,培养102 h后得到77.5 g/L DCW;GAO等[28]对酿酒酵母采用DO-stat补料培养50 h得到了51.2 g/L的DCW。
总体来讲,传统的单一补料方式很难进行全局调控,菌体浓度很难高于本研究的两阶段补料。本研究提出了两阶段补料,在前期进行拟指数补料,在后期由于菌体浓度高溶氧难以维持、造成乙醇溢流代谢时将补料方式切换为DO-stat补料。同时解决了细胞增殖缓慢与残糖累积、乙醇代谢的问题,可有效提高生产强度、提高菌体得率。经过108 h的两阶段补料培养可以得到123.57 g/L的DCW。比分批培养和拟指数补料分别高了286%和23.8%;菌体得率达到0.51 g/g,比分批培养和指数补料分别高了13.3%和6.25%;相比DO-stat补料,生长周期缩短了20.4%,生产强度提高了14.6%。表明两阶段补料模式可以有效地提高酵母生长能力,达到高密度培养水平,在生产上具有明显的优势。
参考文献
[1] BCC Research.Yeasts,yeast extracts,autolysates and related products: the global market[R].BCC Research Report Code: CHM053B.Wellesley, MA,2017.
[2] 
 RKA E,BUBNIK Z,HINKOVA A,et al.Beet molasses-desugarization,composition,properties and application possibilities[J].Sugar Industry,2013,138(2):105-114.
RKA E,BUBNIK Z,HINKOVA A,et al.Beet molasses-desugarization,composition,properties and application possibilities[J].Sugar Industry,2013,138(2):105-114.
[3] ALEKSANDRA M,MIRO CZUK M,RAKICKA M,et al.A two-stage fermentation process of erythritol production by yeast Y. lipolytica from molasses and glycerol[J].Bioresource Technology, 2015,198:445-455.
CZUK M,RAKICKA M,et al.A two-stage fermentation process of erythritol production by yeast Y. lipolytica from molasses and glycerol[J].Bioresource Technology, 2015,198:445-455.
[4] TORRADO R,GAMERO E,G MEZ R,et al.Yeast biomass,an optimised product with myriad applications in the food industry[J]. Trends in Food Science & Technology,2015,46(2):167-175.
MEZ R,et al.Yeast biomass,an optimised product with myriad applications in the food industry[J]. Trends in Food Science & Technology,2015,46(2):167-175.
[5] DEKEN D, H R.The Crabtree effect:a regulatory system in yeast[J].J Gen Microbiol,1966,44:149-156.
[6] GIBSON B R,LAWRENCE S J,LECLAIRE J P,et al.Yeast responses to stresses associated with industrial brewery handling[J]. Fems Microbiology Reviews,2010,31(5):535-569.
[7] ARNDT M,HITZMANN B.Kalman filter based glucose control at small set points during fed-batch cultivation of Saccharomyces cerevisiae[J].Biotechnology Progress,2010,20(1):377-383.
[8] 陈洪章,李佐虎.酵母菌的高密度发酵[J].工业微生物,1998,18(1):28-31.
[9] 齐士朋,徐尔尼,罗玉芬,等.细胞高密度培养技术的应用研究进展[J].食品与发酵工业,2011,37(2):139-143.
[10] 张许,丁健,高鹏,等.基于差分进化算法的酿酒酵母分批补料培养在线自适应控制[J].中国生物工程杂志,2016,36(1):68-75.
[11] CHOPDA V R, RATHORE A S, GOMES J.Maximizing biomass concentration in baker’s yeast process by using a decoupled geometric controller for substrate and dissolved oxygen[J].Bioresource Technology,2015,196:160-168.
[12] HOCALAR A, TüRKER M. Model based control of minimal overflow metabolite in technical scale fed-batch yeast fermentation[J]. Biochemical Engineering Journal,2010,51(1):64-71.
[13] MISZCZAK W, CIBIS E, KRZYWONOS M.A straight forward logistic method for feeding a fed-batch baker′s yeast culture[J].Bio-chemical Engineering Journal,2012,60:36-43.
[14] 于景芝.酵母生产与应用手册[M].北京:中国轻工业出版社,2005:79-82.
[15] 季萌,缪冶炼,陈介余,等.线性减小比生长速率指数补料策略对酵母生产效率的改善[J].食品与发酵工业,2016,42(9):34-39.
[16] 杨林娥,彭晓光,杨庆文,等.斐林试剂法测定还原糖方法的改进[J].中国酿造,2010,29(5):160-161.
[17] 王柯.酒精—沼气双发酵耦联生态系统的机理和关键技术研究[D].无锡:江南大学, 2014:25.
[18] 李寅,高海军,陈坚.高细胞密度发酵技术[M].北京:化学工业出版社,2006:231-232.
[19] HAGMAN A,S LL T,PI
LL T,PI KUR J.Analysis of the yeast short-term Crabtree effect and its origin[J].FEBS Journal,2014,281(21):4 805-4 814.
KUR J.Analysis of the yeast short-term Crabtree effect and its origin[J].FEBS Journal,2014,281(21):4 805-4 814.
[20] LI Xin, KANG Yuanjun,YU Can, et al.Exponential feeding strategy of high-density cultivation of a salt-tolerant aroma-producing yeast Zygosaccharomyces rouxii in stirred fermenter[J].Biochemical Engineering Journal, 2016,111:18-23.
[21] Yang F C,MAA D W.Fed-batch culture of yeast Saccharomyces cerevisiae, with a DO-stat method by a fuzzy controller[J].Bioprocess Engineering,1998,18(2):79-82.
[22] 窦冰然,郭会明,骆海燕,等.耐高糖面包酵母发酵工艺优化[J].食品工业科技,2016,37(18):208-212.
[23] 康国凯,冯国栋,曹坤琳,等.重组毕赤酵母(Pichia pastoris)高产Lunasin的发酵工艺优化[J].中国生物工程杂志,2016,36(8):73-79.
[24] FEI S,WEN S,XI W,et al.High-cell-density fermentation for ergosterol production by Saccharomyces cerevisiae[J].Journal of Bioscience & Bioengineering,2006,101(1):38-41.
[25] VU V H, KIM K.High-cell-density fed-batch culture of Saccharomyces cerevisiae KV-25 using molasses and corn steep liquor[J]. J Microbiol Biotechnol,2009,19(12):1 603-1 611.
[26] KIM Y H,KANG S W,LEE J H,et al.High cell density fermentation of Saccharomyces cerevisiae JUL3 in fed-batch culture for the production of β-Glucan[J].Journal of Industrial & Engineering Chemistry,2007,13(1):153-158.
[27] 康远军.高耐性鲁氏酵母高密度发酵研究[D].武汉:湖北工业大学,2015:37-51.
[28] GAO H,TAN T.Fed-batch fermentation for ergosterol production[J].Process Biochemistry,2004,39(3):345-350.
Application of quasi-exponential-DO-Stat two-stage feeding strategy in high-cell-density cultivation of Saccharomyces cerevisiae
XU Fuzeng1,2, WANG Ke1,2, LI Shanyuan3, MAO Zhonggui1,2, ZHANG Jianhua1,2*
1(School of Biotechnology, Jiangnan University, Wuxi 214122, China) 2(Key Laboratory of Industrial Biotechnology, Ministry of Education(Jiangnan University), Wuxi 214122, China) 3(Baoshan Jiulong Yeast Co., Ltd., Baoshan 678000, China)
Abstract High cell density cultivation (HCDC) is a way to achieve efficient and high yeast production yield. Two feeding strategies, quasi-exponential and DO-Stat, were evaluated according to the dry cell weight, yield, and productivity. Based on the results, a two-step feeding strategy was developed, which started with quasi-exponential at specific growth rate of 0.03 h-1 after 21 h batch cultivation. The feeding strategy was then switched to DO-Stat with 40% DO when the dissolved oxygen fell to 20%. Implementation of the two-step feeding strategy resulted in 123.57 g/L dry cell weight, total yield of 0.51 g/g, and 1.15 g/(L·h) productivity. Compared with quasi-exponential feeding strategy, the dry cell weight and the yield of the two-step feeding strategy increased by 23.8% and 6.25%, respectively. Compared with DO-Stat feeding strategy, the production period shortened by 20.4% and the productivity increased by 14.5%. The results indicated that the two-step feeding strategy can effectively improve the growth capacity of yeast, which provides valuable reference and significant guidance for industrial production of yeast.
Key words Saccharomyces cerevisiae; high cell density cultivation; fed-batch; yield; productivity
 控制器相比,可提高23%和18%的菌体量。HOCALAR等[12]基于状态估计算法构建了状态反馈线性控制策略,通过在控制算法中设定菌体浓度和乙醇浓度,通过调节最小乙醇浓度来控制比生长速率,调整流加策略,成功实时控制乙醇浓度,以使生物质生产率最大化。但是,对于多数中小型酵母生产企业来讲,这些方法并不适用,因为先进的方法往往涉及复杂的控制设备和实施复杂控制算法,需要必要的辅助设备,这些额外且昂贵的经济投入是大多数中小型企业现代化道路上的一个严重障碍[13]。因此,开发一种简单、低成本的方法进行酿酒酵母培养,更适用于小企业的需要。
控制器相比,可提高23%和18%的菌体量。HOCALAR等[12]基于状态估计算法构建了状态反馈线性控制策略,通过在控制算法中设定菌体浓度和乙醇浓度,通过调节最小乙醇浓度来控制比生长速率,调整流加策略,成功实时控制乙醇浓度,以使生物质生产率最大化。但是,对于多数中小型酵母生产企业来讲,这些方法并不适用,因为先进的方法往往涉及复杂的控制设备和实施复杂控制算法,需要必要的辅助设备,这些额外且昂贵的经济投入是大多数中小型企业现代化道路上的一个严重障碍[13]。因此,开发一种简单、低成本的方法进行酿酒酵母培养,更适用于小企业的需要。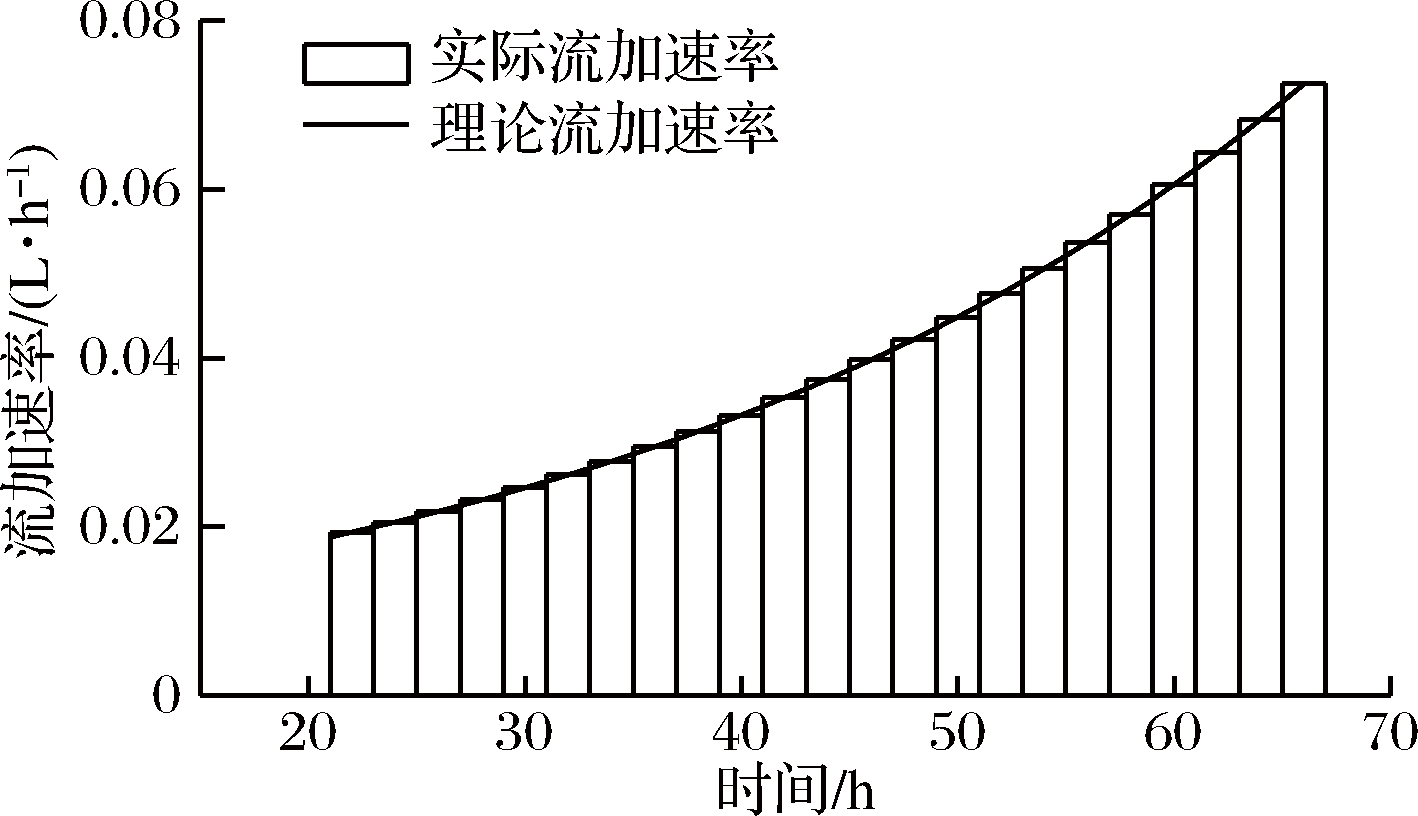





 RKA E,BUBNIK Z,HINKOVA A,et al.Beet molasses-desugarization,composition,properties and application possibilities[J].Sugar Industry,2013,138(2):105-114.
RKA E,BUBNIK Z,HINKOVA A,et al.Beet molasses-desugarization,composition,properties and application possibilities[J].Sugar Industry,2013,138(2):105-114. CZUK M,RAKICKA M,et al.A two-stage fermentation process of erythritol production by yeast
CZUK M,RAKICKA M,et al.A two-stage fermentation process of erythritol production by yeast  MEZ R,et al.Yeast biomass,an optimised product with myriad applications in the food industry[J]. Trends in Food Science & Technology,2015,46(2):167-175.
MEZ R,et al.Yeast biomass,an optimised product with myriad applications in the food industry[J]. Trends in Food Science & Technology,2015,46(2):167-175. LL T,PI
LL T,PI