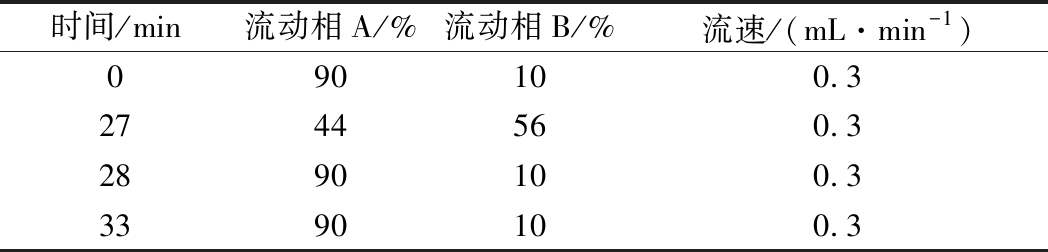
表1 梯度洗脱程序
Table 1 Gradient elution program
陈欣然1,2, 张波1,2, 张欢3, 解迎双3, 王波3, 周小平3, 李敏1,2, 韩舜愈1,2*
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730700) 2(甘肃省葡萄与葡萄酒工程学重点实验室(甘肃农业大学),甘肃 兰州,730700) 3(甘肃出入境检验检疫局 检验检疫综合技术中心,甘肃 兰州,730000)
摘 要 采用超高效液相色谱-电喷雾离子化串联三重四级杆质谱联用技术(ultra-high performance liquid chromatography tandem triple quaternary mass spectrometry,UPLC-ESI-QQQ),以葡萄和葡萄酒中5种基本花色苷为标准,利用多反应监测(MRM),确立红葡萄酒中花色苷的分析鉴定方法。结果显示:用色谱柱Poroshell 120 EC-C18(150 mm×2.1 mm,2.7 μm),流动相A(V(甲酸)∶V(水)=0.2∶100),流动相B(V(甲酸)∶V(甲醇)∶V(乙腈)=0.2∶50∶50)色谱条件,5种基本花色苷在15 min内得到了很好的分离,其浓度和峰面积呈现良好的线性关系(R2>0.998 3),且回收率为83.38%~118.71%,日内精密度与日间精密度RSD分别为0.62%~1.70%,2.13%~3.90%,并在28 min内从不同的葡萄酒样品中准确鉴定出45种花色苷,其中包括25种单葡萄糖苷和20种吡喃型葡萄糖苷。该检测方法快速、简单,实现了对红葡萄酒花色苷类物质准确的定性、定量分析。
关键词 花色苷;超高效液相色谱串联三重四级杆质谱(UPLC-ESI-QQQ);检测
第一作者:硕士研究生(韩舜愈教授为通讯作者,E-mail:gsndhsy@163.com)。
基金项目:国家自然科学基金地区科学基金项目(31560451);甘肃省自然科学基金项目(17JR5RA153);甘肃省商务厅葡萄酒产业发展专项资金项目(2017010);甘肃省葡萄与葡萄酒工程学重点实验室开放课题项目(GSPTJ-2017-03)
收稿日期:2018-09-17,改回日期:2018-12-18
DOI:10.13995/j.cnki.11-1802/ts.018817
颜色是评价葡萄酒质量优劣的重要指标之一,花色苷作为颜色的物质基础,在其中发挥着重要的作用。检测发现,花色苷是一类多酚类物质,作为一种安全性高的天然色素已在食品、医药、化妆品等领域有广泛应用[1]。红葡萄酒中的花色苷可以从葡萄果皮中浸渍而来,并在生产和贮藏中转化形成以花色苷及其衍生物为主要类型的花色苷体系,从而影响葡萄酒的色泽[2]。这其中花翠素(delphinidin,Dp)、花青素(cyanidin,Cy)、3’-甲基花翠素(petunidin,Pt)、3’-甲基花青素(peonidin,Pn)和3’, 5’-二甲花翠素(malvidin,Mv)的3-O-单葡萄糖苷形式和其酰化形式(乙酰基、p-香豆酰基和咖啡酰基等)的衍生物是葡萄和葡萄酒中主要的花色苷[3]。
近年来,由于缺乏花色苷标准品,导致可准确鉴定的花色苷数量有限。因此,建立高灵敏度、高准确度的花色苷分析方法越来越受到人们的关注。目前,国外对葡萄及葡萄酒中花色苷物质及其衍生物的鉴定研究比较成熟[4-5],但国内对葡萄及葡萄酒中花色苷的研究却主要集中在对总花色苷的提取及含量测定方面,其中紫外分光光度法最为常见[6],而对花色苷的定性鉴定则多采用液相色谱技术[7-8]。超高效液相色谱串联三重四级杆质谱(ultra-high performance liquid chromatography tandem triple quaternary mass spectrometry,UPLC-ESI-QQQ)技术是近年来发展起来的一项新的天然产物有效成分定性定量分析方法,可以在缺少标准品的情况下对提取物中微量成分进行结构分析,具有灵敏度高,选择性强,分析快速,定量重现性好等特点,是目前最受关注的分析检测技术。
本研究以红葡萄酒为材料,以UPLC-ESI-QQQ为检测方法,通过不同洗脱程序选择最佳方案,建立超高效液相色谱(UPLC)技术检测葡萄酒花色苷的分析方法,进一步采用UPLC-ESI-QQQ技术,判断花色苷结构类型,为深入研究葡萄及葡萄酒中色素种类提供技术参考。
酒样:本实验室自酿的红葡萄酒样品:美乐干红葡萄酒(2017年)、赤霞珠桃红葡萄酒(2017年)、混酿干红葡萄酒(2017年)。将1 mL红酒样品直接注入0.45 μm无机膜(聚醚砜)过滤,然后分析。
标准品:花翠素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷、3’-甲基花青素-3-O-葡萄糖苷、3’, 5’-二甲花翠素-3-O-葡萄糖苷、3’-甲基花翠素-3-O-葡萄糖苷(美国Miragen公司,纯度均≥98.0%)。
试剂:甲酸(分析级)、乙腈(色谱级)、甲醇(色谱级)、水(广州屈臣氏食品饮料有限公司)。
Agilent 1290系列UPLC(G1316C二元高压梯度泵,G4226A自动进样器,G4220A柱温箱);Agilent 6460型三重四级杆质谱;SK8200H型超声波清洗器,上海科导超声仪器有限公司;OFO-945601型涡旋混合器,美国Talboys公司;CP224S型分析天平,德国Sartorius公司。
1.3.1 标准溶液的配制
将购得的标准品分别用2%甲酸甲醇溶解,然后转移至5 mL容量瓶中定容,配制成100 mg/L的标准储备液,保存于-20 ℃。根据试验情况,再把标准储备液稀释成不同质量浓度的工作液。
1.3.2 色谱条件
参考LI[9]的方法并略有改动。色谱柱:Poroshell 120 EC-C18柱(150 mm×2.1 mm,2.7 μm;Agilent Technologies);进样体积:3 μL;流动相A(V(甲酸)∶V(水)=0.2∶100),流动相B(V(甲酸)∶V(甲醇)∶V(乙腈)=0.2∶50∶50);柱温:30 ℃。具体的梯度洗脱程序见表1。
表1 梯度洗脱程序
Table 1 Gradient elution program

1.3.3 质谱条件
ESI离子源温度350 ℃;正离子模式;雾化器压力35 psi;干燥气流速12 L/min;干燥气温度350 ℃;m/z扫描范围100~1 000。
1.3.4 花色苷成分的定量分析
以标准物质3’,5’-二甲花翠素-3-O-葡萄糖苷为标准,对其进行相关外标定量,质量浓度梯度为0~50 mg/L,9个水平,其他花色苷以相当于3’, 5’-二甲花翠素-3-O-葡萄糖苷的含量计。
统计分析由安捷伦质谱亨特工作站软件版本b.04.00数据采集和处理。
2.1.1 色谱柱的选择
本试验首先使用葡萄及葡萄酒中5种基本花色苷标准品建立液相方法。花色苷作为极性化合物,易溶于水、甲醇和乙腈等极性溶剂[10],我们通常采用非极性固定相和极性流动相的反相色谱法分析花色苷。首先选择用Zorbax SB C18(150 mm×2.1 mm,3.5 μm)色谱柱对其进行分离。当甲酸调节流动相pH为1.5时,键合相会逐渐水解,降低柱效,造成峰展宽,保留时间长,并且存在拖尾现象,影响本试验对5种花色苷的准确定性和定量。而Poroshell 120 EC-C18(150 mm×2.1 mm,2.7 μm)色谱柱有较强的耐酸性,可在pH 1.5条件下重复进样,缩短了保留时间,获得了良好的峰形、优异的重现性。该色谱柱为亚3 μm填料和表面多孔层,颗粒分布度小,柱效高。其多孔层和实心核的特点限制了扩散距离,提高了花色苷物质的分离速度,而窄粒径分布则提高了柱效和分离度,实现了花色苷物质的快速、高效分离[11]。
2.1.2 流动相的选择
在分离的反相系统中,常采用混合水相和有机相作为流动相,并随着时间改变流动相的洗脱能力,从而改变被测组分的相对保留值[12]。由于花色苷类物质结构类似,不能通过改变溶剂强度而增加分离度,而当有机相为甲醇、乙腈(V(甲醇)∶V(乙腈)=1∶1)时,花色苷物质响应更高且噪音更低。此外,pH较高时(pH>2.5),由于花色苷中常有的烊阳离子形式存在干扰[3],导致色谱峰加宽。为了避免这种现象发生,本试验选择甲酸调节pH环境至1.5水平,在此条件下对花色苷进行分离,并进行准确定量。另外,在ESI+模式下,甲酸还可以提供H+,提高了花色苷的离子化效率[13]。因此,当以V(甲醇)∶V(乙腈)=1∶1为有机相,并加入0.2%甲酸时,样品中花色苷分离度、重现性均较好,得到了理想的分离效果。
2.2.1 标准曲线及线性范围的确定
取高于定量下限不同浓度的含花色苷混合标准液,配成9个不同质量浓度的标样,每个水平点重复操作3次,进样分析,分别获得各自的峰面积,通过建立样品质量浓度与峰面积的标准曲线,计算其回归方程,并计算相关系数R2。考虑到进样质量浓度太高,质谱响应值将过大,超过仪器所能响应的上限会导致质量数不准确,因此,检测样品时将通过稀释相关倍数,使质量浓度在线性范围之内。
由表2可知,5种花色苷标准曲线线性回归方程的R2在0.99以上,各方法检出限较低(0.001~0.010 mg/L),表明该方法对花色苷检测有较高的灵敏度。
表2 五种花色苷回归方程及相关系数
Table 2 Regression equation and correlation coefficient of five anthocyanins

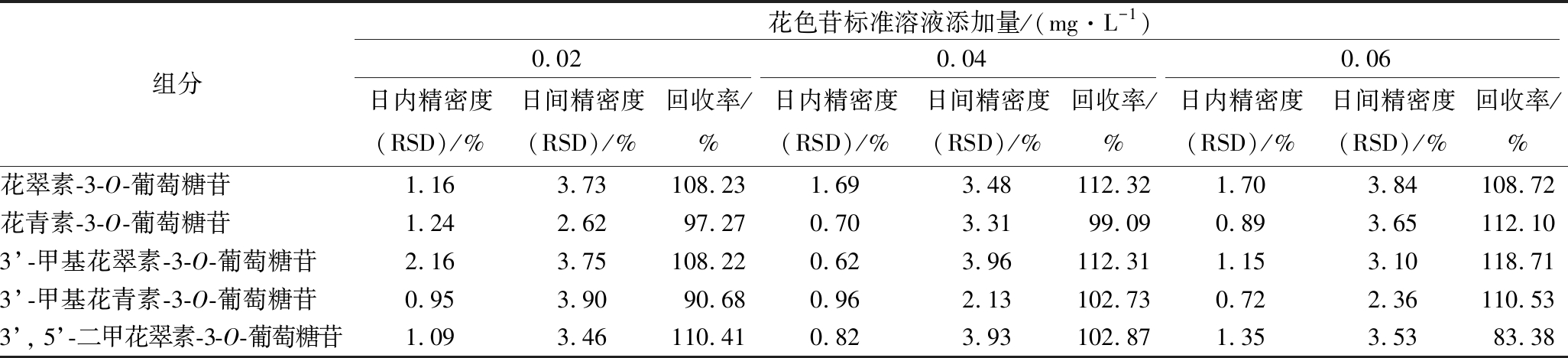
2.2.2 精密度及回收率试验
分别以0.02、0.04、0.06 mg/L三个质量浓度为添加水平,每个水平重复6次,在已知花色苷含量的葡萄酒样中添加相应质量浓度的5种基本花色苷标准溶液,室温静置30 min后,按照1.3.2和1.3.3方法测定葡萄酒中5种花色苷含量,结果见表3。由表3可知,回收率为83.38%~118.71%,表明该方法准确度较高。日内精密度与日间精密度RSD分别为0.62%~1.70%,2.13%~3.90%,表明日内与日间有良好的稳定性,可用于葡萄酒中花色苷的定量分析。
表3 精密度及添加回收率(n=6)
Table 3 Precision and additive recovery(n=6)
在QQQ仪器中,Q1和Q3为两扫描四极模块,在其之间,包含有Q2模块,作为碰撞池结构。选择性离子检测(selected ion monitor)即单离子监测(single ion monitor)扫描方式,对于已知化合物,为了提高某个离子的灵敏度,并排除其他离子的干扰,Q1只允许目标离子通过,而其他离子不被记录,Q2碰撞单元产生碎片离子,Q3只分析一个碎片离子。[M+H]+为花色苷的分子离子,可以利用不同的毛细管电压扫描固定[M+H]+,根据各离子在不同电压下碎裂的相应丰度找出最佳的碰撞诱导解离电压。而在碎片离子扫描模式下找出最佳的碰撞能量,以及各化合物的碎片离子。优化好分子离子解离电压和碎片离子碰撞能量后,采用多反应监测(MRM)模式检测葡萄酒中目标花色苷。
源于葡萄原料中的花色素的单葡萄糖苷、乙酰化葡萄糖苷、香豆酰化葡萄糖苷以及咖啡酰化葡萄糖苷,分别通过丢失一个葡萄糖、乙酰化葡萄糖、香豆酰化葡萄糖和咖啡酰化葡萄糖,产生[M-162]+、[M-204]+、[M-308]+和[M-324]+特征性碎片离子,而在葡萄酒发酵和陈酿过程中形成的4位乙烯甲酸、乙烯基儿茶酚、乙烯基苯酚等衍生物,由于4位上基团比较稳定,在ESI-QQQ的正离子模式下不发生裂解,仅从3位上丢失葡萄糖、乙酰化葡萄糖、香豆酰化葡萄糖和咖啡酰化葡萄糖母体,产生相应的[M+A-162]+、[M+A-204]+、[M+A-308]+、[M+A-324]+的特征性碎片离子(A为4位上缩合的基团分子量)。
花色苷的极性不同,其洗脱顺序也不同[9,14]。其洗脱规律可总结为:(1)对于具有相同取代基的花色苷,洗脱顺序为花翠素、花青素、3’-甲基花翠素、3’-甲基花青素、3’, 5’-二甲花翠素;(2)对于其酰化花色苷洗脱顺序为:非酰化、乙酰化、香豆酰化、咖啡酰化。其中,香豆酰化顺式异构体较反式异构体洗脱时间早,这与之前报道相一致[15-16]。研究表明,出现香豆酰化花色苷的顺式异构体,是葡萄皮经过阳光照射的缘故[16-17];(3)对于吡喃型花色苷,其洗脱顺序为乙烯基甲酸,乙醛,丙酮,4-乙烯基邻苯二酚,4-乙烯基苯酚,4-乙烯基愈创木酚等。
依据花色苷母离子、子离子质谱信息并结合其洗脱规律,可推测出花色苷类物质,如表4所示。
表4 花色苷物质谱信息表
Table 4 Anthocyanins mass spectrometry information

续表4

注:glu为glicoside的缩写。(下同)。
利用上述建立的优化技术检测来自本实验室自酿的美乐干红葡萄酒(2017年)、赤霞珠桃红葡萄酒(2017年)、黑比诺赤霞珠美乐混酿干红葡萄酒(2017年)3种酒样,从其中共鉴定出45种花色苷类物质(表5)。
表5 不同葡萄酒样中花色苷含量![]() 以Mv-3-O-glu计)
以Mv-3-O-glu计)
Table 5 Anthocyanins contents in different wine samples

续表5
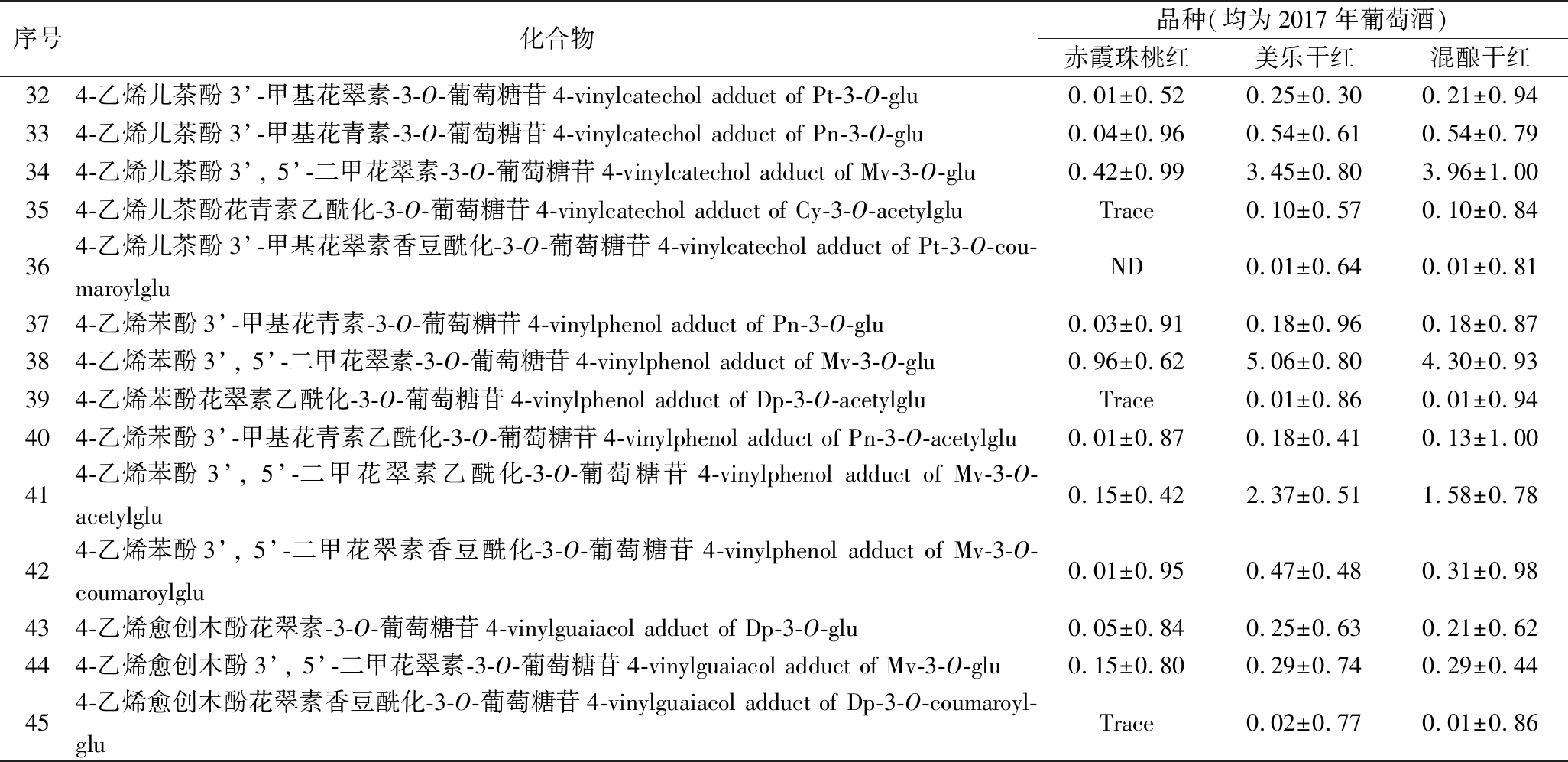
注:Trace,痕量;ND,未检测到。
从表5中可以看出,无论是从种类还是含量的分布上,主要以源自葡萄的5种花色素葡萄糖苷、花色素乙酰化葡萄糖苷及花色素香豆酰化葡萄糖苷为主,而对与在葡萄酒发酵和陈酿过程中形成的衍生物,尽管在部分酒样中只被少量的检测到,但它们对葡萄酒口味的改变起着重要的作用。
本试验在色谱柱Poroshell 120 EC-C18柱(150mm × 2.1 mm,2.7 μm),流动相A:V(甲酸)∶V(水)=0.2∶100,流动相B:V(甲酸)∶V(甲醇)∶V(乙腈)=0.2∶50∶50色谱条件下,以葡萄和葡萄酒中5种基本花色苷为标准,建立了花色苷分析方法。采用UPLC-ESI-QQQ技术,结合MRM多反应监测,在28 min内从不同的葡萄酒样品中准确鉴定出45种花色苷及其衍生物。本方法简单、快速,直接可用于对花色苷类物质的准确定性、定量分析。
参考文献
[1] 刘丽媛,苑伟,刘延琳. 红葡萄酒中花色苷辅助成色作用的研究进展[J]. 中国农业科学, 2010, 43(12): 2 518-2 526.
[2] GORDILLO B, RODR GUEZ-PULIDO F J, ESCUDERO-GILETE M L, et al. Comprehensive colorimetric study of anthocyanic copigmentation in model solutions. Effects of pH and molar ratio [J]. Journal of Agricultural and Food Chemistry, 2012, 60(11): 2 896-2 905.
[3] 韩富亮, 李杨,李记明,等. 红葡萄酒花色苷结构和颜色的关系研究进展[J]. 食品与生物技术学报, 2011, 30(3): 328-336.
[4] IBERN-G MEZ M, ANDRES-LACUEVA C, LAMUELA-RAVENTOS R M, et al. Rapid HPLC analysis of phenolic compounds in red wines[J]. American Journal of Enology and Viticulture, 2002, 53(3): 218-221.
MEZ M, ANDRES-LACUEVA C, LAMUELA-RAVENTOS R M, et al. Rapid HPLC analysis of phenolic compounds in red wines[J]. American Journal of Enology and Viticulture, 2002, 53(3): 218-221.
[5] ALCALDE-EON C, ESCRIBANO-BAILON M T, SANTOS-EUELGA C, et al. Changes in the detailed pigment composition of red wine during maturity and ageing: A comprehensive study[J]. Analytica Chimica Acta, 2006, 563(1/2): 238-254.
[6] 冯靖, 时玉正,邱晓,等. 葡萄皮天然色素的提取工艺及其稳定性研究[J]. 食品研究与开发, 2018, 39(4): 60-68.
[7] 刘冰, 葛谦,张艳,等. HPLC法同时测定葡萄和葡萄酒中6种基本花色苷[J]. 中国酿造, 2017, 36(2): 162-165.
[8] 李琪, 李广,金丽琼,等. HPLC法测定甘肃地产不同品种酿酒葡萄中的花色苷[J]. 中国酿造, 2014,33(3): 132-136.
[9] LI S Y, HE F, ZHU B Q, et al. A systematic analysis strategy for accurate detection of anthocyanin pigments in red wines[J]. Rapid Communications in Mass Spectrometry 2016, 30(13): 1 619-1 626.
[10] EUGENIO R A.Value of high-performance liquid chromatographic analysis of anthocyanins in the differentiation of red grape cultivars and red wines made from them[J]. Journal of Chromatography A, 2001, 88(915): 53-60.
[11] 邓欣, 蒋娅兰,黄芳,等. 亚3微米色谱分离-串联质谱法同时筛查中药材中非法添加的30种人工色素[J]. 分析试验室, 2018, 37(4): 454-460.
[12] 王波. 2D-LC在酒花颗粒的T、U-酸、异T-酸及蛋糕中合成色素检测的应用研究[D]. 兰州:甘肃农业大学, 2009.
[13] 蔡玮红, 冼燕萍,罗海英,等. UPLC-MS/MS法同时测定焙烤食品中的丙烯酰胺、4-甲基咪唑与5-羟甲基糠醛[J]. 现代食品科技, 2014, 30(2): 249-254.
[14] 孙建平. 葡萄与葡萄酒中酚类物质LC-UV-MS/MS谱库构建及应用[D]. 北京:中国农业大学, 2006.
[15] ASENSTORFER R E, LEE D F, JONES G P. Influence of structure on the ionisation constants of anthocyanin and anthocyanin-like wine pigments[J]. Analytica Chimica Acta, 2006, 563: 10-14.
[16] ROMERO C, BAKKER J. Anthocyanin and colour evolution during maturation of four port wines: Effect of pyruvic acid addition[J].Journal of the Science of Food and Agriculture, 2000, 81: 252-260.
[17] CAPRON X, SMEYERS-VERBEKE J, MASSART D L. Multivariate determination of the geographical origin of wines from four different countries[J]. Food Chemistry, 2007, 101: 1 585-1 597.
CHEN Xinran1, ZHANG Bo1, ZHANG Huan2, XIE Yingshuang2, Wang Bo2,ZHOU Xiaoping2, LI Min1, HAN Shunyu1*
1(Gansu Key Laboratory of Viticulture and Enology, College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730700, China) 2(Central Laboratory of Technical Center of Gansu Entry-Exit Inspection and Quarantine Bureau, Lanzhou 730000, China)
Abstract A method that aimed to identify anthocyanins in red wines was established by high-performance liquid chromatography-electrospray ionization tandem triple quaternary mass spectrometry (UPLC-ESI-QQQ) and multi-reaction monitoring (MRM). Five basic anthocyanins in grapes and wines were used as standards. The results found that the five basic anthocyanins were clearly separated within 15 minutes by Poroshell 120 EC-C18 column. The mobile phase A was formic acid: water (0.2:100, volume fraction) and mobile phase B was formic acid: methanol: acetonitrile (0.2:50:50, volume fraction). Under this condition, a positive linear relationship was established between concentration and peak area (R2>0.9983). The recovery rate was 83.38%-118.71%. The RSDs of intra-day and inter-day precisions were 0.62%-1.70% and 2.13%-3.90%, respectively. Meanwhile, there were 45 anthocyanins accurately identified from different wine samples within 28 min, which included 25 monoglycosides and 20 pyranoid glucosides. This method is rapid, simple, and accurate, and can be used for qualitative and quantitative analysis of anthocyanins in red wines.
Key words anthocyanins; ultra-high performance liquid chromatography tandem triple quaternary mass spectrometry; detection