吴传超1,2,徐富成1,2,顾秋亚1,2,余晓斌1,2*
1(江南大学 生物工程学院,江苏 无锡, 214122) 2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
摘 要 以姜黄素(curcumin,CUR)为唯一碳源的培养基中初筛出83株菌种,再利用高效液相色谱(high performance liquid chromatography,HPLC)复筛,得到5株可以以姜黄素为底物生产二氢姜黄素(dihydrocurcumin,DHC)与四氢姜黄素(tetrahydrocurcumin,THC)的菌株。以初始产率最高的菌种作为目的菌种,通过形态学特征与26S rDNA D1/D2区基因序列比对鉴定出该菌株为Cyberlindnera rhodanensis。对基础发酵培养基中碳源、氮源及无机盐进行单因素优化,得出结果为,产DHC的最佳碳源为40 g/L葡萄糖、氮源为30 g/L蛋白胨、无机盐为2 g/L K2HPO4,在此条件下产率由10.49%提高到20.20%;产THC的最优碳源、氮源和无机盐分别为20 g/L葡萄糖、20 g/L蛋白胨和3 g/L K2HPO4,优化后产率由13.67%提高到24.31%。首次筛选得到1株能以姜黄素为底物,通过微生物转化得到二氢姜黄素与四氢姜黄素的酵母菌,为姜黄素加氢衍生物的研究提供一定参考,并且提供新菌种资源。
关键词 姜黄素;微生物转化;二氢姜黄素;四氢姜黄素
第一作者:硕士研究生(余晓斌教授为通讯作者,E-mail:xbyu@jiangnan.edu.cn)。
基金项目:国家轻工技术与工程一流学科自主课题资助(LITE2018-11)
收稿日期:2018-11-14,改回日期:2018-12-26
DOI:10.13995/j.cnki.11-1802/ts.019321
姜黄素(C21H20O6,curcumin,CUR)是从姜科姜黄属一些植物的根茎中提取的一种天然多酚类化合物[1],为橙黄色结晶粉末,难溶于水,易溶于甲醇、乙醇、丙酮等有机溶剂[2]。其结构式中独特的β-二酮结构,使其具有酮与烯醇式互变异构体[3-4],在酸性或中性溶液中以酮式结构存在,在碱性溶液中呈红褐色的烯醇式[5]。因其具有抗氧化作用[6]、抗炎作用[7]、抗肿瘤作用[8]等多种生理生化活性,日益受到国内外学者的关注。但水溶性低、生物利用度低、易降解、稳定性差[9-12]等特性,限制其在临床上的广泛应用。
因此,在保留姜黄素原有药效的基础上,通过化学法和微生物法对姜黄素的结构改造以获得新的衍生物成为近年来研究的热点[13-14]。
通过对其连接链中4个双键不同程度的还原,可以得到相应的加氢衍生物[15]。相比于化学合成法,微生物转化[16-18]具有反应条件温和,选择性强,成本低,环境友好等特点。MAEHARA SHOJI等[19]从姜黄根茎中分离筛选到1株可制得4种姜黄素衍生物的Diaporthe sp.菌株,通过结构鉴定,分别为四氢姜黄素(tetrahydrocurcumin,THC)、六氢姜黄素、(3S,5S)-八氢姜黄素和八氢姜黄素。张维宇等[20]从土壤中分离出1株能够以姜黄素为底物转化成四氢姜黄素与六氢姜黄素的酵母菌株。罗杨春[21]利用红球菌90-4以姜黄素为底物生成六氢姜黄素与八氢姜黄素。目前对于姜黄素的加氢衍生物的研究主要集中在四氢姜黄素[22-23],尚未见对于其他的加氢衍生物,尤其是二氢姜黄素(dihydrocurcumin, DHC)发酵方面的研究报道。
本研究以实验室保藏菌种及不同种类的蜂蜜为样品,首次筛选得到1株酵母菌,它能够同时以姜黄素为底物生成二氢姜黄素与四氢姜黄素,为微生物发酵法生产姜黄素加氢衍生物提供参考。
菌种,实验室菌种库保藏、不同种类的蜂蜜。
试剂:姜黄素(AR级)、乙腈(色谱纯),国药集团有限公司;姜黄素标准品,大连生物美仑技术有限公司;二氢姜黄素标准品,武汉天植生物技术有限公司;四氢姜黄素标准品,上海源叶生物科技有限公司;其他实验所用试剂均为分析纯。
筛选培养基[20]:姜黄素2 g/L,(NH4)2SO4 2 g/L,KH2PO4 1 g/L,K2HPO4 1 g/L,MgSO4·7H2O 0.4 g/L,agar 20 g/L。
固体培养基:YPD、PDA培养基。
种子培养基:YPD、PDA液体培养基。
酵母菌基础发酵培养基:蔗糖40 g/L,蛋白胨2 g/L,姜黄素0.1 g/L,吐温20 mL/L。
曲霉基础发酵培养基:大米粉5 g/L,玉米粉5 g/L,黄豆粉10 g/L,葡萄糖20 g/L,甘油20 mL/L,NaNO3 5 g/L,KH2PO4 2.5 g/L。
日立U-3900紫外可见光分光光度计,日本日立株式会社;Agilent-1260高效液相色谱仪,美国安捷伦科技公司;超高效液相色谱串联四极杆飞行时间质谱联用仪,美国沃特世公司;高速冷冻离心机,美国赛默飞世尔科技公司。
菌种初筛:将实验室保藏的菌种在筛选培养基(以姜黄素为唯一碳源)中培养3 d,挑选能够在筛选培养基上生长的单菌落。将1 g不同种类的蜂蜜用无菌水稀释到10-4~10-6的菌悬液,取100 μL涂布于筛选培养基,30 ℃培养5 d。观察菌落的生长状况,从平板上生长的菌落中挑取各种形态不一样的单菌落,置于甘油管中,4 ℃保存备用。
菌种复筛:将初筛得到的菌种经过基础发酵培养基培养后,采用HPLC检测产物,通过比对CUR、DHC、THC标准品HPLC的出峰时间和峰面积,确定待检测菌种能否将底物姜黄素转化成加氢衍生物及其产率。
1.4.1 样品前处理方法
将筛选的菌种取固体培养基上单菌落接种至种子液培养基中,在30 ℃、180 r/min条件下,培养2 d,以10%的接种量接种至基础发酵培养基,在30 ℃、180 r/min条件下,培养3 d。实验中同时设立菌种对照和底物对照,即转化体系中只加菌体不加姜黄素和转化体系中只加入姜黄素不加菌种。转化反应结束后,将转化液离心(8 000 r/min,10 min)分离菌体,取上清液,用乙酸乙酯萃取3次,每次30 mL,合并萃取液,于45 ℃减压蒸馏除去乙酸乙酯,用10 mL的色谱级甲醇溶解,用0.22 μm微孔滤膜过滤得到转化液,待检测分析。
1.4.2 CUR、DHC与THC检测波长的选择
称取CUR、DHC和THC标准品(纯度≥95%)适量,溶于色谱甲醇,定容得标准溶液。稀释到适宜的浓度后,在200~600 nm内进行全光谱扫描,确定其检测波长[24]。
1.4.3 液相色谱检测方法[25]
将转化液样品谱图与底物对照组样品、菌种对照组样品和标准品组图谱进行相互比对,观察是否出现新的峰。色谱柱:ZORBAX SB-C18(4.6 mm×150 mm,Agilent)。流动相:0.1%磷酸水溶液(A)-乙腈(B),梯度洗脱(0~10 min,30%~60% B,10~12 min,60%~65% B,12~15 min,65%~70% B,15~20 min,70%~100% B)。检测波长:280 nm(THC与CUR)、370 nm(DHC),进样量:15 μL,流速:1 mL/min,检测温度:30 ℃。
1.4.4 液质联用测定方法
转化液使用UPLC-Q-TOF SYNAPT MS(美国Waters公司)进一步测定,分析软件为Mass Lynx V4.3。色谱条件:色谱仪为Waters Acquity UPLC;检测器为Waters Acquity PDA;检测波长:200~600 nm;柱温:45 ℃;流速:0.3 mL/min;流动相:A-100%甲醇,B-0.1%甲酸。质谱条件:电喷雾离子源:负离子电离模式(ESI-);离子源温度, 100 ℃;脱溶剂温度, 400 ℃;毛细管电压, 3 kV;锥孔电压, 20 V;碰撞能量6 V;选择离子扫描范围m/z 20~1 000。
DHC与THC的产率通过HPLC法测定[26],产率按式(1)计算。其中CUR的摩尔质量为368,DHC的摩尔质量为370,THC的摩尔质量为372。统计学分析:采用SPSS 20.0进行差异显著性分析,实验数据用![]() 为显著差异,P<0.01 为极显著差异。
为显著差异,P<0.01 为极显著差异。
产率![]()
(1)
式中:C,浓度,mol/L;M,摩尔质量。
按照1.3的方法,在筛选培养基(以CUR为唯一碳源)能够生长的菌种有83株,其中酵母菌种有52株,曲霉菌种有31株。
采用HPLC测定83株菌种转化液中是否含有DHC与THC。结果如图1所示,能够通过转化DHC与THC的菌种有5株(其中酵母菌种有3株、曲霉菌种有2株),只产DHC有3株,只产TCH有5株。菌株ISO344的姜黄素转化率最优,DHC为10.49%,THC为13.67%。选取ISO344菌株作为目的菌种。

图1 菌株对姜黄素的生物转化率
Fig.1 Biotransformation rate of curcumin by strain
2.3.1 DHC与THC标准曲线的绘制
准确称取5 mg DHC与THC标准品分别溶于10 mL色谱甲醇,稀释到不同质量浓度的标准液(0.05、0.1、0.15、0.2、0.3 g/L),每组重复3次,检测各自的质量浓度与峰面积的线性关系,DHC的标准方程为Y
=16 092X+15.016,相关系数R2=0.999 3,出峰时间为10.973 min。THC的标准方程为Y=28 922X+63.919,相关系数R2=0.999 8,出峰时间为10.558 min。
2.3.2 菌种ISO344转化液高效液相的结果
分别将处理后菌种ISO344的样品组、底物对照组、菌种对照组的转化液进行HPLC进一步鉴定,如图2右边所示,样品组(图2-A)在10.963 min处出峰,与DHC标准品(图2-D)、CUR标准品(图2-E)基本吻合,底物对照组与菌种对照组在该时间点均未出现峰。如图2左边所示,样品组(图2-a)在10.473 min处出峰,与THC标准品(图2-d)、CUR标准品(图2-e)基本吻合,底物对照组与菌种对照组在该时间点均未出现峰。可以初步确定该菌种能够以CUR为底物生产DHC与THC。
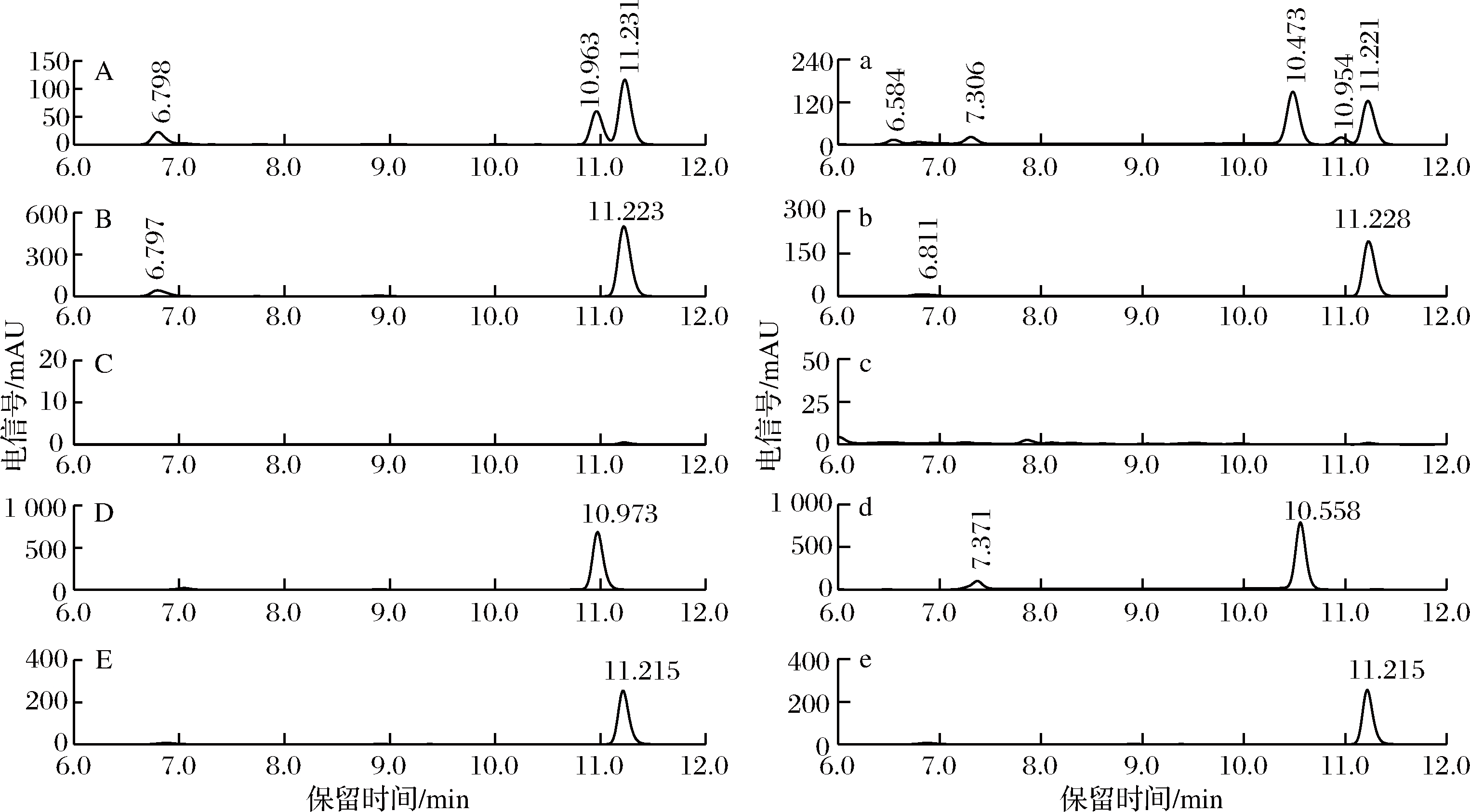
A-样品组在370 nm下HPLC图;B-底物对照在370 nm下HPLC图;C-菌种对照在370 nm下HPLC图;D-DHC标准品HPLC图;E-CUR标准品HPLC图;a-样品组在280 nm下HPLC图;b-底物对照在280nm下HPLC图;c-菌种对照在280 nm
下HPLC图;d-THC标准品HPLC图;e-CUR标准品HPLC图
图2 菌株ISO344转化液液相图谱
Fig.2 Liquid phase map of strain ISO344
将菌种ISO344转化液,进行UPLC-TOF-MS分析,进一步确定目标产物的相对分子量,根据离子色谱图、负离子一级质谱图以及一些特征的碎片离子进一步推断转化液中是否含有DHC与THC。质谱扫描范围m/z 0~700。如图3-A所示转化液在分子量370(DHC)处保留时间TR分别为4.69 min和5.75 min(具有酮式和烯醇式互变结构),图3-B所示转化液在分子量372(THC)处保留时间TR分别为4.76 min和5.68 min (具有酮式与烯醇式结构)。
转化液在4.69 min与5.75 min处的负离子吸收峰(一级质谱图)如图4-A和4-B所示,转化液的负离子图谱中主要有一个明显的最高峰,在m/z 369.1和370.01分别代表[M]-和[M+H]-的质谱信号峰,可以推测该物质为DHC。图4-C、4-D分别是转化液在4.76 min与5.68 min的负离子吸收峰(一级质谱图),其负离子图谱中分别在m/z 371.1和372.1分别代表[M]-和[M+H]-的质谱信号峰,可以推测该物质为THC。故可进一步确认该菌株ISO344可以姜黄素为底物转化为DHC及THC。

A-转化液在370分子量下的离子色谱图;B-转化液在372分子量下的离子色谱图
图3 高效液相色谱-质谱联用选择离子色谱图
Fig.3 High performance liquid chromatography-mass spectrometry combined ion chromatogram
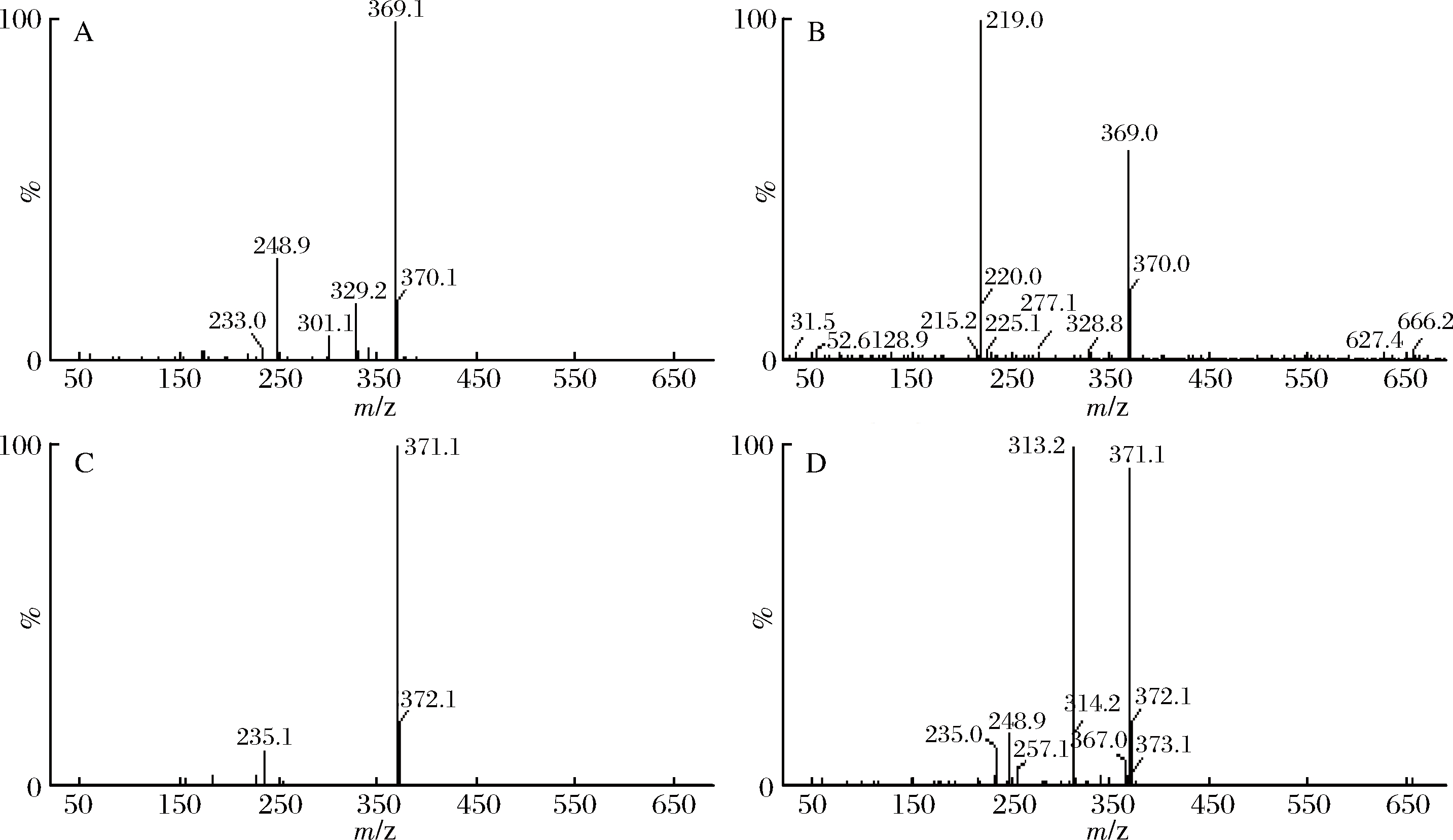
A-转化液在4.69 min处一级质谱图;B-转化液在5.75 min处一级质谱图;C-转化液在4.76 min处一级质谱图;D-转化液在5.68 min处一级质谱图
图4 菌株ISO344转化液的一级质谱图
Fig.4 Primary mass spectrum of strain ISO344
2.5.1 菌种形态特征
将菌株ISO344在YPD固体平板上培养3 d,观察该菌种在平板上的菌落形态,其结果如图5-A所示。
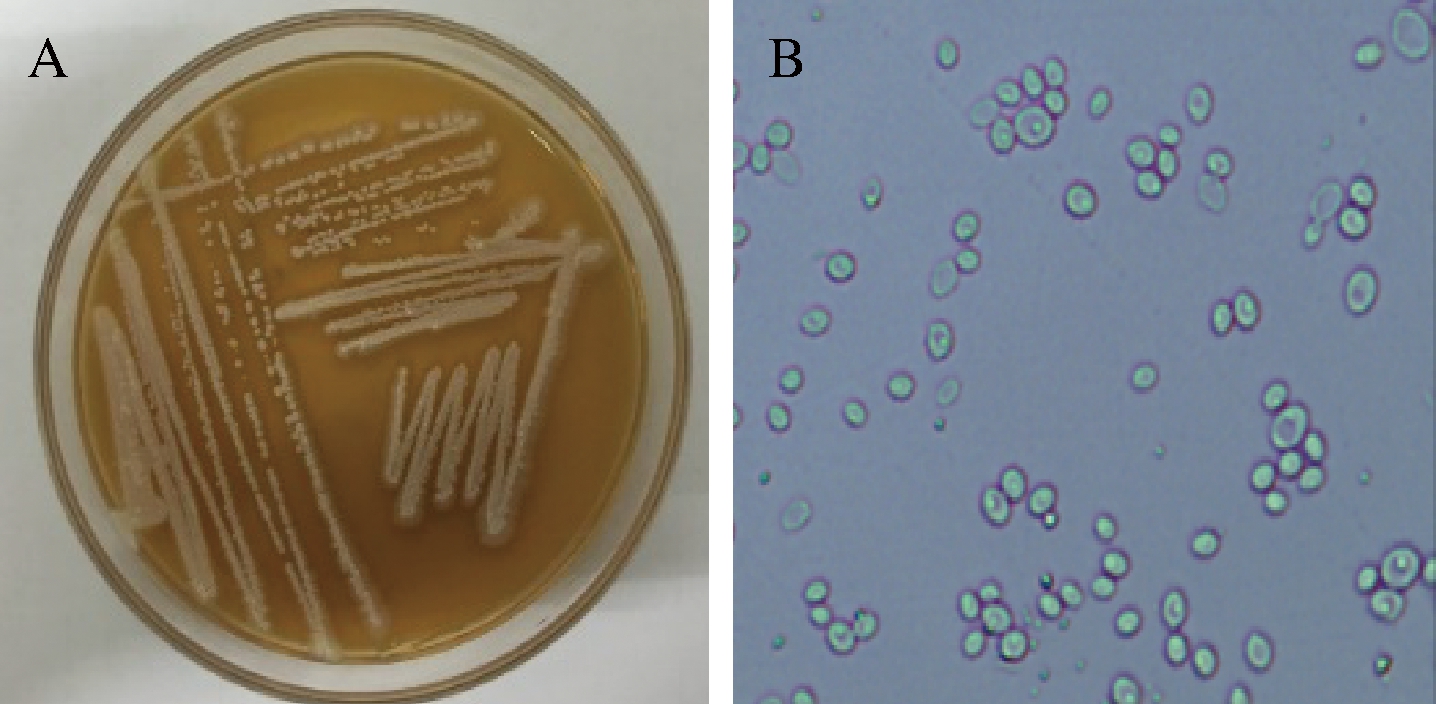
A-菌株ISO344平板菌落形态;B-菌株ISO344的显微特征
图5 菌株ISO344形态特征
Fig.5 Morphological characteristics of strain ISO344
形状:圆形;色泽:灰白;质地:干燥、粗糙、疏松;边缘:锯齿状隆起;状况:扁平。显微镜检该菌种,观察该菌种的形态,其结果如图5-B所示。细胞呈圆形或椭圆形,紧密排列形成假菌丝。
2.5.2 菌种序列分析
挑取菌株ISO344的单菌落送上海生工生物科技有限公司进行基因测序,序列提交GenBank数据库获序列号(基因库登录号为MH894770)。利用BLAST程序对所测菌种26S rDNA D1/D2区基因序列进行同源性比对,并用MEGA7.0软件绘制系统进化树。用邻接法(neighbor-joining)进行发育树分析。
由图6可知,通过与模式菌株和试验菌株基因序列比对分析,发现该菌株与Cyberlindnera rhodanensis strain DMKU-RK452相似性的高达100%,因此确定该菌株为Cyberlindnera rhodanensis。

图6 基于26S rDNA Dl/D2区序列构建的菌株ISO344的系统发育进化树
Fig.6 Phylogenetic tree of ISO344 based on the 26S rDNA D1/D2 domain sequence alignment
2.6.1 碳源对菌株转化姜黄素的影响
以酵母菌的基础发酵培养基为基础,考察不同碳源以及不同浓度对产率的影响,如图7所示。以葡萄糖为碳源时,DHC与THC的产率达到最大,分别为(9.85±0.12)%和(14.48±0.13)%,与其他碳源相比DHC和TCH产率存在显著性差异(P<0.05)。因此选取40 g/L与20 g/L葡萄糖进行后续的试验。
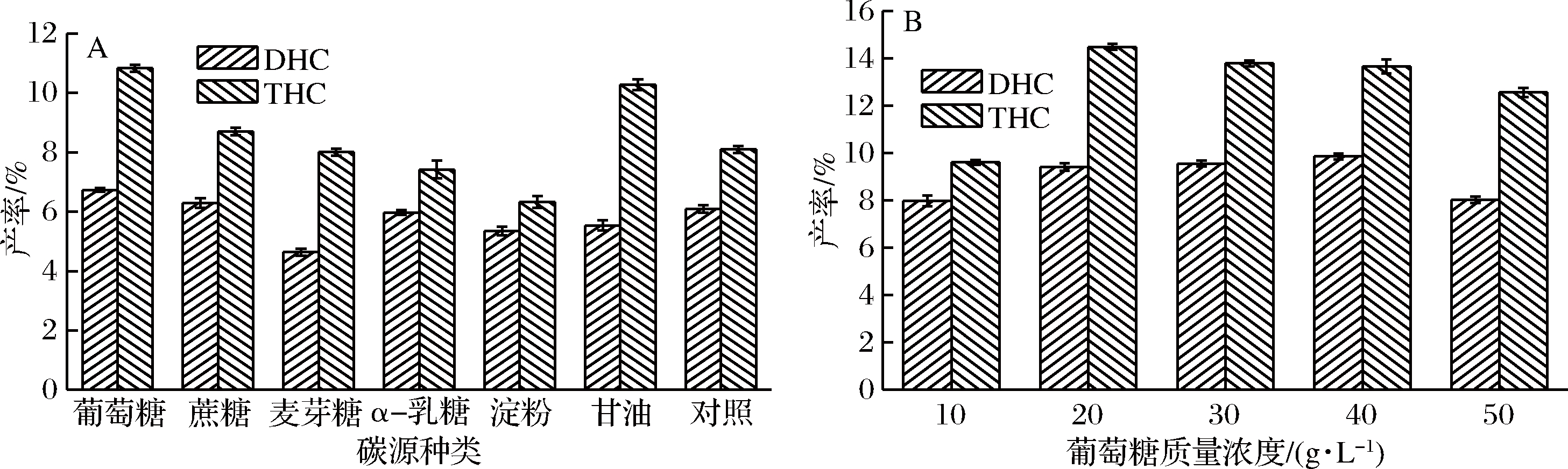
图7 不同碳源(A)及碳源质量浓度(B)对DHC和THC的影响
Fig.7 Effects of different carbon sources(A) and carbon source concentrations(B) on DHC and THC
2.6.2 氮源对菌株转化姜黄素的影响
DHC与THC产率随着氮源种类及质量浓度的变化而变化。由图8可知,在30 g/L蛋白胨时,DHC产率达到最大,为(15.48±0.22)%。
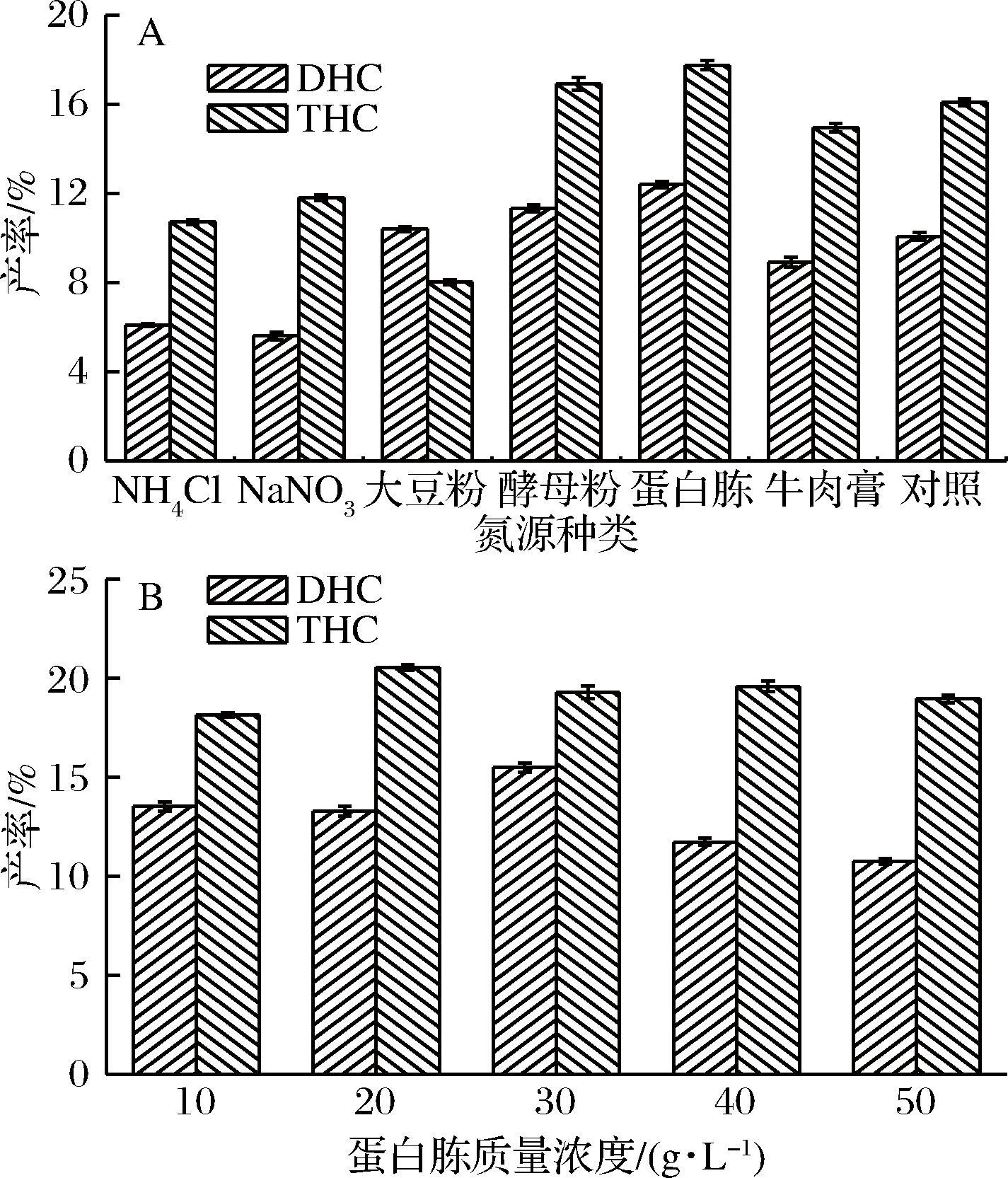
图8 不同氮源(A)及氮源质量浓度(B)对DHC和THC的影响
Fig.8 Effects of different nitrogen sources(A) and nitrogen sources concentration(B) on DHC and THC
在20 g/L蛋白胨时,THC产率达到最大,为(20.52±0.13)%,与其他氮源相比,DHC和TCH产率存在极显著性差异(P<0.01)。因此确定DHC与THC发酵培养基的最优氮源为蛋白胨,质量浓度分别为30 g/L和20 g/L。
2.6.3 无机盐对菌株转化姜黄素的影响
无机盐是菌体细胞生长代谢不可或缺的成分,如图9所示。在最优的碳源与氮源基础上,DHC在2 g/L K2HPO4产率达到最大,为(20.20±0.25)%。THC在3 g/L K2HPO4可达(24.31±0.12)%。K2HPO4不仅为菌体生长代谢提供钾元素和磷元素,磷酸氢根还能在发酵液pH的缓冲和调节方面发挥一定的作用。因此选取2 g/L和3 g/L K2HPO4为发酵培养基最佳无机盐。

图9 不同无机盐(A)及无机盐质量浓度(B)对DHC和THC的影响
Fig.9 Effects of different inorganic salts(A) and inorganic salts concentration(B) on DHC and THC
本试验采取以姜黄素为唯一碳源的筛选培养基,筛选出83株菌种。通过HPLC初步确定有5株菌种能够以姜黄素为底物,转化生成DHC和THC。选择初始产率最高的菌株ISO344作为目的菌种,进而通过液质联用技术对转化液进行分析,进一步推测是否含有DHC与THC。经过形态学观察和26S rDNA D1/D2区基因序列比对分析,鉴定为Cyberlindnera rhodanensis。对基础发酵培养基进行单因素试验优化,使DHC产率由10.49%提高至20.20%,THC产率由13.67%提高至24.31%。还需要多因素多水平的组合优化实验,得到更为准确的优化培养基,此外还需分离提纯DHC与THC做进一步鉴定。
参考文献
[1] SHARMA R A,GESCHER A J,STEWARD W P.Curcumin: the story so far[J].European Journal of Cancer,2005,41(13):1 955-1 968.
[2] 吴燕华.深海真菌Aspergillus sp.SCSIOW2对白藜芦醇和姜黄素的生物转化研究[D].深圳:深圳大学, 2017.
[3] ANAND P,KUNNUMAKKARA A B,NEWMAN R A,et al.Bioavailability of curcumin: problems and promises[J].Molecular Pharmaceutics,2007,4(6):807-818.
[4] 李锐,刘芳,李芸香,等.微生物转化法制备双脱甲氧基姜黄素糖苷化产物及其对HepG2肿瘤细胞的抑制作用[J].食品与发酵工业,2016,42(6):20-25.
[5] KHARAT M,DU Z,ZHANG G,et al.Physical and chemical stability of curcumin in aqueous solutions and emulsions: Impact of pH, temperature, and molecular environment[J].Journal of Agricultural and Food Chemistry,2017,65(8):1 525-1 532.
[6] MASUDA T,HIDAKA K,SHINOHARA A,et al.Chemical studies on antioxidant mechanism of curcuminoid: analysis of radical reaction products from curcumin[J].Journal of Agricultural & Food Chemistry,1999,47(1):71-77.
[7] KUMAR V,LEWIS S A,MUTALIK S,et al.Biodegradable microspheres of curcumin for treatment of inflammation[J].Indian J Physiol Pharmacol,2002,46(2):209-217.
[8] TEITEN M H,GAASCHT F,EIFES S,et al.Chemopreventive potential of curcumin in prostate cancer[J].Genes & Nutrition,2010,5(1):61-74.
[9] JAGANNATHAN R,ABRAHAM P M,PODDAR P.Temperature-dependent spectroscopic evidences of curcumin in aqueous medium: a mechanistic study of its solubility and stability[J].Journal of Physical Chemistry B,2012,116(50):14 533-14 540.
[10] MODASIYA M K,PATEL V M.Studies on solubility of curcumin[J].International Journal of Pharmacy & Life Sciences,2012,3(3):1 490-1 497.
[11] LAO C D,RUFFIN M T,NORMOLLE D,et al.Dose escalation of a curcuminoid formulation[J].Bmc Complementary & Alternative Medicine,2006,6(1):1-4.
[12] SIVIERO A,GALLO E,MAGGINI V,et al.Curcumin, a golden spice with a low bioavailability[J].Journal of Herbal Medicine,2015,5(2):57-70.
[13] ZHANG Rongkai,QU Jianqiang.Progress in structure modification of curcumin[J].Chemical Industry & Engineering,2011,28(5):61-67.
[14] LIN J K,PAN M H,LIN-SHIAU S Y.Recent studies on the biofunctions and biotransformations of curcumin[J].Biofactors,2010,13(1-4):153-158.
[15] TAN S,RUPASINGHE T W T, TULL D L,et al.Degradation of curcuminoids by in vitro pure culture fermentation[J].Journal of Agricultural and Food Chemistry,2014,62(45):11 005-11 015.
[16] 舒琅.姜黄根茎内生真菌多样性及其对姜黄素的微生物转化[D].吉首:吉首大学, 2012.
[17] 关松磊,吴雅馨,孙赫,等.微生物转化技术在中药开发中的应用进展[J].微生物学通报,2018,45(4):900-906.
[18] QUAN L H,KIM Y J,LI G H,et al.Microbial transformation of ginsenoside Rb1 to compound K by Lactobacillus paralimentarius[J].World J Microbiol Biotechnol,2013,29(6):1 001-1 007.
[19] MAEHARA S,IKEDA M,HARAGUCHI H,et al.Microbial conversion of curcumin into colorless hydroderivatives by the endophytic fungus Diaporthe sp. associated with Curcuma longa[J].Chemical & Pharmaceutical Bulletin,2011,59(8):1 042-1 044.
[20] ZHANG Weiyu,HUANG Jin,WO Xingde,et al.Microbial transformation of curcumin to its derivatives with a novel Pichia kudriavzevii ZJPH0802 strain[J].Appl Biochem Biotechnol,2013,170(5):1 026-1 037.
[21] 罗杨春.微生物转化法制备姜黄素衍生物的研究[D].杭州:浙江工业大学, 2014.
[22] 郑彬彬,张维宇,罗杨春,等.毕赤酵母生物转化制备四氢姜黄素的转化条件优化[J].生物加工过程,2017,15(2):30-34.
[23] 廖利,华桦,赵军宁.四氢姜黄素的研究进展[J].世界科学技术-中医药现代化,2014,16(12):2 708-2 712.
[24] ZHANG Xing,YE Min,LI Rui,et al.Microbial transformation of curcumin by Rhizopus chinensis[J].Biocatalysis,2015,28(5-6):380-386.
[25] 张维宇.姜黄素微生物转化产物的研究[D].杭州:浙江工业大学, 2013.
[26] 方磊,陈红,余晓斌.高转化人参皂苷菌株筛选鉴定及发酵培养基优化[J].食品与发酵工业,2017,43(4):147-151.
WU Chuanchao1,2, XU Fucheng1,2, GU Qiuya1,2, YU Xiaobin1,2*
1(School of Biotechnology, Jiangnan University, Wuxi 214122,China) 2(The Key Laboratory of Industrial Biotechnology, Ministry of Education(Jiangnan University),Wuxi 214122,China)
Abstract There were 83 strains screened out from the medium using curcumin (CUR) as the sole carbon source, and they were evaluated by high performance liquid chromatography (HPLC). There were five strains that were able to produce dihydrocurcumin (DHC) and tetrahydrocurcumin (THC) using curcumin as substrate. The strain with the highest initial yield was used as target and was identified as Cyberlindnera rhodanensis by morphological characteristics and 26S rDNA D1/D2 region gene sequence alignment. The results showed that the optimal amounts of carbon source, nitrogen source, and inorganic salts to produce DHC were 40 g/L glucose, 30 g/L peptone, and 2 g/L K2HPO4, respectively. Under this condition, the yield of DHC increased from 10.49% to 20.20%. The optimal amounts of carbon source, nitrogen source, and inorganic salts to produce THC were 20 g/L glucose, 20 g/L peptone, and 3 g/L K2HPO4, respectively. The optimized yield of THC increased by 24.31% from 13.67%. This study screened a yeast strain that can use CUR as a substrate to obtain DHC and THC by microbial transformation for the first time, together with providing new strain resources.
Key words curcumin; microbial transformation; dihydrocurcumin; tetrahydrocurcumin