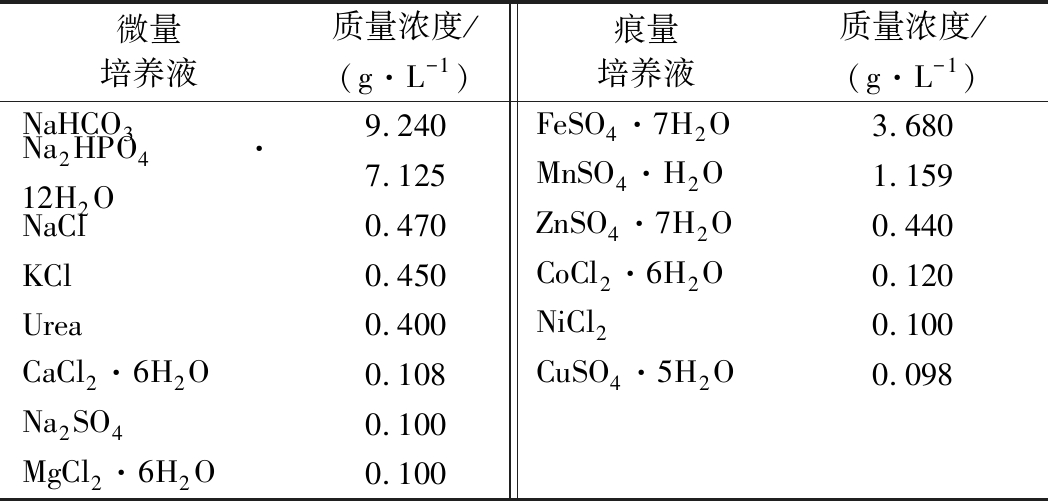
表1 体外发酵培养液的组成
Table 1 The composition of fermentation broth
郑慧1,2,郑淘1,王睿捷1,唐锦瑶1,绍欣欣1,李顺祥2*
1(湖南中医药大学 药学院,食品药品工程系,湖南 长沙,410208) 2(湖南省中药活性物质筛选工程技术研究中心,湖南 长沙,410208)
摘 要 通过体外模拟方式,对比4种不同粉碎粒径的油菜蜂花粉在消化各阶段的多酚溶出量、消化完成后多酚残留量,同时结合高效液相色谱分析残留多酚组分及其利用肠道菌群发酵产酸能力。结果表明,在体外模拟消化过程中蜂花粉多酚溶出量随粉碎粒径的减小而增加,粉碎提高了溶出多酚在肠液消化过程中的保留率。经消化完成后,蜂花粉多酚残留量随着粉碎粒径的减小而增加,同时粉碎对其残留多酚的组分有一定影响。在体外模拟后肠发酵产酸过程,粉碎粒径越小发酵液pH值越低,产生的乙酸、丙酸、丁酸含量越高,发酵产酸特性越好。研究表明,在蜂花粉多酚的体外消化特性上破壁优于未破壁,为蜂花粉深加工产品的开发与应用提供理论依据。
关键词 油菜蜂花粉;粉碎粒径;多酚;体外模拟消化
第一作者:硕士,讲师(李顺祥教授为通讯作者,E-mail:lishunxiang@hotmail.com)。
基金项目:湖南省教育厅科学研究项目(17C1208);湖南中医药大学双一流食品科学与工程学科建设经费(4901|020000200902)
收稿日期:2018-11-22,改回日期:2019-01-07
DOI:10.13995/j.cnki.11-1802/ts.019413
蜂花粉是蜜蜂采集植物花蕊中的花粉,添加花蜜及其分泌物混合而成的不规则团状物,颗粒直径介于2.0~3.5 mm,具有良好的增强免疫力、抑制脂褐素、抗氧化、抗肿瘤等功效[1-3]。在中国,油菜花粉、玉米花粉、荞麦花粉等蜂花粉被原卫生部2014年17号公告纳入“作为普通食品管理的食品新资源名单”,产品生产、管理、研发门槛相对较低。近年来蜂花粉研发热度日益升温,其中因其多酚类组分含量丰富,具有较强的抗氧化性,已成为蜂花粉的特征性功效成分[4-5]。
蜂花粉细胞外壁质地坚硬,具有抗渗透、抗酸碱、抗生物分解性能;但同时又存在萌发孔和萌发沟,可通过此与外界进行物质交换。有研究表明破壁后蜂花粉抗氧化、免疫、降血脂等功效增强;另一方面又有研究表明在胃肠消化过程中,蜂花粉营养物质可通过萌发孔和萌发沟渗透出而被吸收,破壁反而不利于花粉的保存,故至今蜂花粉破壁与否对其保健功能、质量控制等方面的影响还存在不同观点[6-8]。因蜂花粉本身呈颗粒状,很多时候须将其进行粉碎、甚至破壁处理以便后续加工[9-10],为探究粉碎粒径对蜂花粉多酚在人体胃肠道消化吸收特性的影响,本实验通过体外模拟方式,对比4种粉碎粒径的油菜蜂花粉其多酚溶出情况以及被肠道菌群利用发酵产酸特性,为蜂花粉深加工及其产品开发应用提供理论基础。
冻干油菜蜂花粉,2017年产自湖南;α-淀粉酶、胃蛋白酶、胰蛋白酶、猪胆盐,上海源叶生物技术有限公司;甲醇(色谱纯),默克化工技术上海有限公司;乙酸(标准品),天津市光复精细化工研究所;丙酸、丁酸(标准品),上海阿拉丁生化科技股份有限公司;原儿茶酸、福林酚、FeSO4·7H2O、CaCl2·6H2O、MnSO4·H2O、CoCl2·6H2O、MgCl2·6H2O、ZnSO4·7H2O、NiCl2、CuSO4·5H2O等,均为国产分析纯。
XQM-2球磨机,湖南长沙天创粉末技术有限公司;LS-POP激光粒度仪,珠海欧美克仪器有限公司;EVO 18扫描电子显微镜,德国蔡司公司;ZHWY-200D恒温振荡器,上海智诚分析仪器制造有限公司;AV1120电子分析天平,日本岛津仪器有限公司;UV 1800紫外可见分光光度计,日本岛津仪器有限公司;DW-40W390低温保存箱,澳柯玛股份有限公司;STARTER 3100/F实验室pH计,奥豪斯仪器有限公司;Agilent 1260高效液相色谱仪配紫外检测器,美国安捷伦科技有限公司。
1.3.1 样品处理
将蜂花粉原料置于普通粉碎机、XQM-2球磨机中分别处理一定时间,经筛网筛分后收3个粒径区间的蜂花粉:蜂花粉A组:未通过100目筛网组分;蜂花粉B组:过100目、未通过 250目筛网组分;蜂花粉C组:过250目筛网组分。
1.3.2 粒径测定
蜂花粉B、C组用LS-POP激光粒度仪以蒸馏水作为分散剂湿法进样,测定颗粒的粒径大小及分布。
1.3.3 显微结构观察
样品固定后表面喷金处理,将其置于扫描电子显微镜下观察,并参考张全龙等[11]的方法通过显微观察测定破壁率。
1.3.4 体外模拟消化过程
参照GULLON等[12]的方法,根据实验室情况稍作改动。
模拟口腔消化:准确称取1.200 g原料于10 mL离心管中,分别加入0.5 mL模拟唾液(用 1 mmol/L CaCl2配置100 U/mL α-淀粉酶溶液,并用1 mol/L NaHCO3调至pH 6.9)和4.5 mL蒸馏水,混合均匀后,置于37 ℃ 50 r/min振摇2 min。
模拟胃液消化:模拟口腔消化后,向管中滴加6 mol/L HCl调至pH 2,加入0.5 mL模拟胃液(0.108 g 胃蛋白酶溶于10 mL 0.1 mol/L HCl溶液)混合均匀后,置于恒温振荡器37 ℃ 50 r/min振摇2 h。
模拟肠液消化:模拟口腔、胃液消化后,向管中滴加6 mol/L NaOH调至pH 7,分别加入1.2 mL模拟肠液(0.080 g胰蛋白酶溶于10 mL 0.5 mol/L NaHCO3溶液)和1.2 mL胆汁(500 mg胆盐溶于10 mL 0.5 mol/L NaHCO3溶液)混合均匀后,置于恒温振荡器37 ℃ 50 r/min振摇2 h。
1.3.5 体外模拟消化过程各阶段溶出多酚的提取
蜂花粉经模拟口腔、胃、肠每步消化后3 500 r/min离心10 min,取上清液用蒸馏水定容,用于测定消化液中的溶出多酚含量。
1.3.6 体外模拟消化后残留多酚的提取
经体外模拟口腔、胃、肠消化结束后的残余物转移至3 kDa透析袋中,置于10 mmol/L NaCl溶液中37 ℃下透析过夜,3 500 r/min离心10 min。参考肖星凝等[13]方法,取沉淀加入1 mL 2 mol/ L NaOH溶液,充分搅拌后避光消化1 h,用浓盐酸调至pH 2。加入2 mL乙酸乙酯并充分搅拌10 min,3 500 r/min离心10 min,取上清液。重复提取5次,合并上清液,抽滤后45 ℃旋转蒸干,用甲醇定容,-5 ℃保存备用,用于测定残留多酚含量及进行HPLC图谱分析。
1.3.7 多酚含量的测定
原儿茶酸标准曲线制作:准确称取原儿茶酸标准品,定容后得原儿茶酸标准溶液。准确量取原儿茶酸标准溶液0.0、0.1、0.2、0.3、0.4、0.5 mL于10 mL容量瓶中,各加6 mL水,摇匀,再加0.5 mL福林酚试剂,充分摇匀。1 min之后,加入20%(质量分数)Na2CO3溶液1.5 mL, 混匀后定容。在室温下反应10 min,于765 nm波长下测定吸光值,以原儿茶酸浓度为横坐标,吸光值为纵坐标,得到回归方程:y=102.54x+0.005 1 (R2=0.999 2)。 样品多酚含量测定的操作同标准曲线制备。
1.3.8 体外模拟消化后残留多酚HPLC图谱分析
参考旷慧等[14]方法,蜂花粉经模拟口腔、胃、肠消化结束后的残留多酚提取液,经0.45 μm微孔滤膜过滤后进行HPLC分析。色谱条件:Ultimate XB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相:纯水-甲醇(体积比50∶50);柱温:25 ℃;检测波长:280 nm;流速:1.0 mL/min; 每次进样量:20 μL。
1.3.9 体外模拟肠道发酵产酸
1.3.9.1 体外发酵培养液的配制
参考文献[15]略作改动,体外发酵培养液由微量培养液与痕量培养液以体积比100:1的比例使用前临时配制,混匀(表1)。
表1 体外发酵培养液的组成
Table 1 The composition of fermentation broth

1.3.9.2 肠道发酵菌液的配制
采集3名日常饮食正常,未刻意服用益生素及抗生素等相关产品的健康成年人新鲜粪便。取20 g新鲜粪便与100 mL pH 6.5磷酸缓冲溶液充分混匀,用4层纱布过滤得肠道发酵菌液,密封后贮存于-20 ℃备用[16],使用前在37 ℃恒温解冻。其中新鲜粪便的采集与处理需在1 h内完成。
1.3.9.3 体外模拟肠道发酵产酸过程pH值的测定
取经体外模拟口腔、胃、肠消化结束后,透析过的残余物10 mL,加入25 mL体外发酵培养液、25 mL肠道发酵菌液,混合均匀,密封,置于37 ℃厌氧条件下发酵24 h。期间每4 h测定其pH值,监控其体外模拟肠道发酵产酸过程中pH值变化。发酵结束后,置于-20 ℃下保存备用,用于测定其发酵产酸量。
1.3.9.4 体外模拟肠道发酵产酸的测定
分别准确量取乙酸、丙酸、丁酸标准品,用超纯水配置成不同浓度梯度,过0.45 μm滤膜后进HPLC分析。色谱条件:Ultimate XB-C18色谱柱(250 mm×4.6 mm, 5 μm);流动相:0.02 mol/mL KH2PO4 -甲醇(体积比为98∶2);柱温:30 ℃;检测波长为217 nm,流速为1.0 mL/min;每次进样量:20 μL。以标准品浓度为横坐标,吸收峰面积为纵坐标,制作标准曲线回归方程:乙酸y=575.54x+23.33(R2=0.999 4);丙酸y=493.59x+36.56(R2=0.999 6);丁酸y=513.01x+146.30(R2=0.998 5)。发酵液解冻后3 000 r/min 离心20 min取上清液,过0.45 μm滤膜后按标准曲线方法进行HPLC分析。
1.3.10 统计分析
每个试样重复3次,数据采用SPSS 22.0软件进行统计分析,结果采用平均数±标准差表示。
蜂花粉原料,未粉碎,呈不规则团状物,颗粒直径介于2.0~3.0 mm。蜂花粉A组为粉碎后未通过100目筛网组分,且因粒度相对较大不能采用激光粒度仪对其进行粒径分布测定,理论上其颗粒粒径大于150 μm。蜂花粉B、C组采用激光粒度仪对其进行粒径测定,其粒径大小及其分布情况如表2所示。蜂花粉B组95%粒径约小于141 μm,蜂花粉C组95%粒径约小于53 μm,蜂花粉C组的粒径分布范围更窄,颗粒均匀性更好。
表2 蜂花粉B、C组粒径分布
Table 2 Particle size distribution of bee pollen powders B,C

注:D10、D50、D90、D95,分别表示在粒径累积分布曲线上,10%、50%、90%、95%颗粒的直径小于或等于此值。同一列中标不同字母表示差异显著(P<0.05)。
蜂花粉A、B、C组显微结构见图1。蜂花粉A组细胞大小均匀,外观形态完整,细胞表面凹凸结构及其萌发沟清晰可见,未出现破壁。蜂花粉B组部分细胞外观形态完整,可见表面凹凸结构及萌发沟;部分细胞外壁自萌发沟裂开或完全分解为数块残片,细胞内容物流出,通过显微观察计算细胞破壁率(67.11±0.04)%。 蜂花粉C组几乎未见清晰萌发沟,细胞外壁自萌发沟裂开或完全分解为数块残片,细胞内容物流出覆盖在细胞表面,细胞破壁率(100±0.00)%。蜂花粉细胞内壁主要为纤维素、果胶质、半纤维素等,纤维类组分含量丰富[17],蜂花粉B、C两组细胞壁存在破裂的现象,则其纤维类组分结构也势必受到相应破坏。

Ⅰ-细胞壁上的萌发沟;Ⅱ-破碎的细胞残片;Ⅲ-细胞表面被流出的细胞内容物所覆盖
图1 蜂花粉A、B、C组显微结构扫描电子显微镜图(×2 000)
Fig.1 Scanning electron microscpoe images of bee pollen powders A,B,C (×2 000)
由表3可知,在体外模拟口腔、胃、肠消化过程中,每个阶段消化液中的多酚溶出量均随着蜂花粉粒径的减小而增加。同时,蜂花粉多酚溶出量在经模拟胃液消化后达到最高,经模拟肠液消化后多酚含量降低。这与李俶、FULGENCIO等[18-19]研究相似,某些多酚组分在模拟肠液消化后有所损失,这可能与肠道的碱性环境和溶解氧相关。与经胃液消化后相比,蜂花粉原料、A、B、C组经肠液消化后多酚保留率分别为(75.64±0.44)%、(81.29±0.72)%、(80.79±0.40)%、(81.70±0.65)%。胃肠消化环境较为复杂,粒径不同,蜂花粉多酚溶出量不同;同时纤维类组分破裂情况不同,所得产物及其产生的空间阻碍,物质之间相互作用等也不同。总体而言,粉碎有利于蜂花粉多酚在消化过程中的溶出,且提高了多酚在肠液消化过程的保留率。
表3 体外模拟消化各阶段多酚溶出量
Table 3 Dissolved polyphenols contents at different stages of bee pollen in vitro digestion
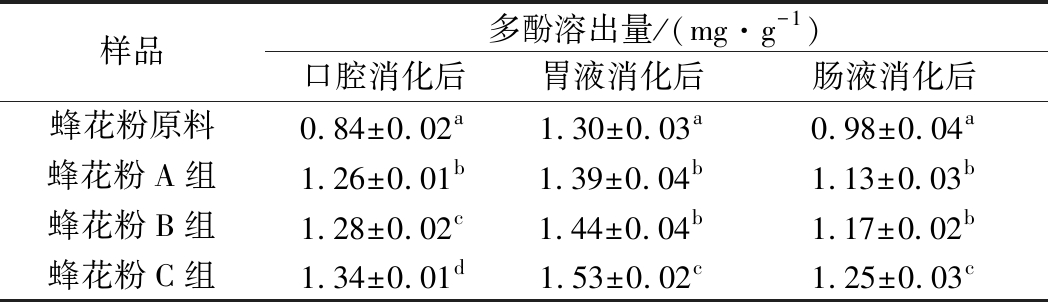
注:同一列中标不同字母表示差异显著(P<0.05)。
研究表明,经口腔、胃、肠消化吸收后的残留多酚,可能以单体的形式通过物理吸附、截留,或与基质通过化学键结合,这部分多酚则能到达大肠在肠道菌群作用下发挥功效[20-21]。由图2可知,蜂花粉多酚残留量随粉碎粒径的减小而增加。由图1可知B、C两组蜂花粉细胞壁存在破裂的现象,纤维类组分受到破坏,结构相对松散,可能更易于对多酚类物质的物理吸附、截留,或化学结合。同时,粒径越小,越易于与提取溶剂接触,从而提取出的残留多酚越多。
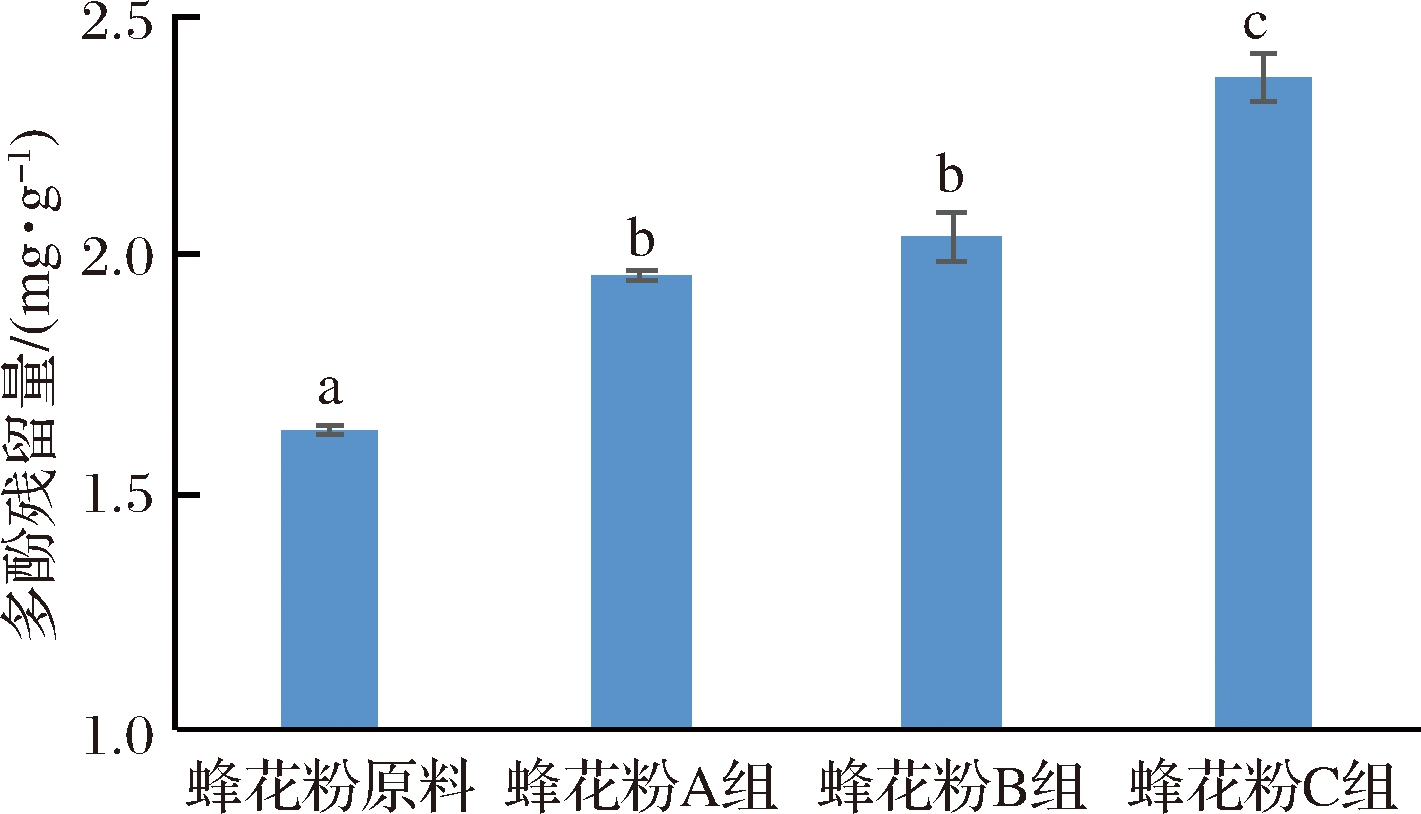
图2 蜂花粉在体外模拟消化后多酚残留量
Fig.2 Residual polyphenols contents of bee pollen after vitro digestion
注:图中标不同字母表示差异显著(P<0.05),下同。
采用中药色谱指纹图谱相似度评价系统软件得到不同粒径的蜂花粉经体外模拟口腔、胃、肠消化后残留多酚的HPLC叠加图谱,见图3。
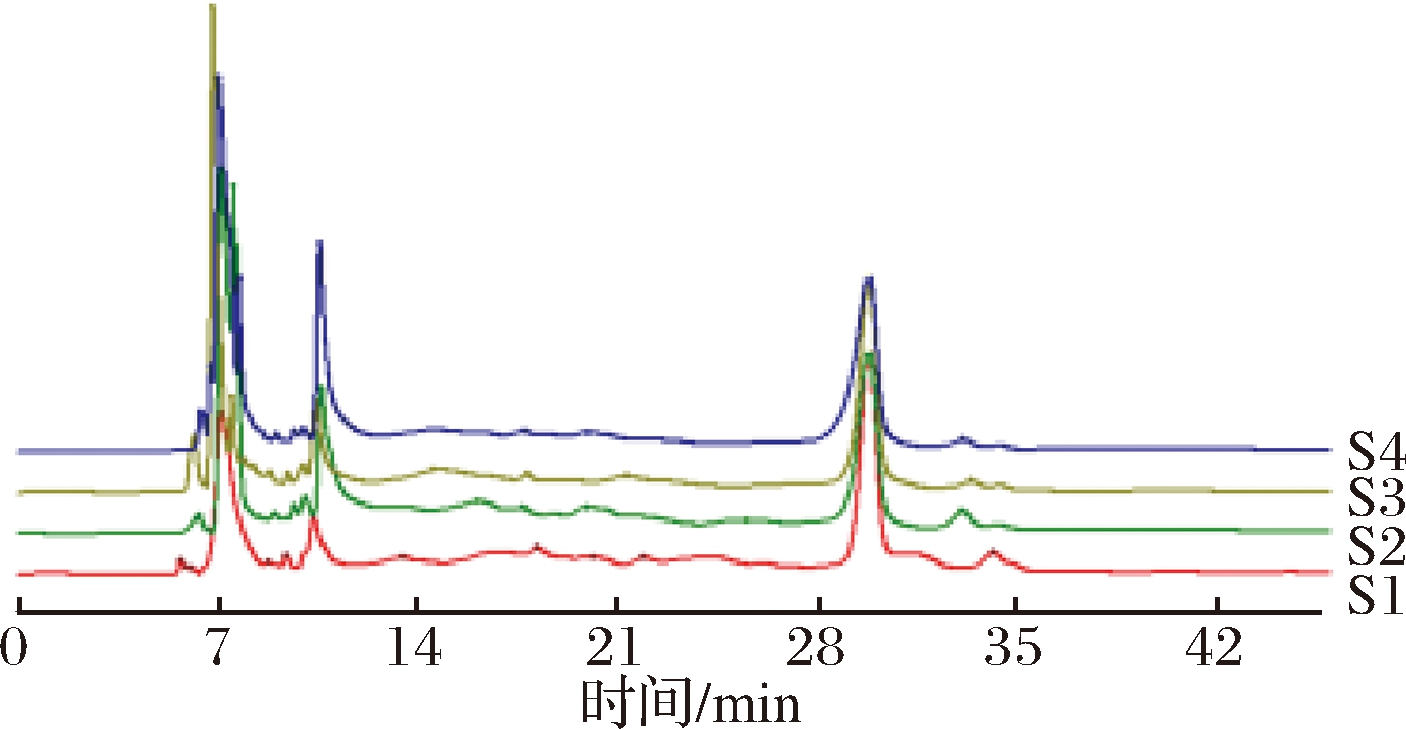
S1-蜂花粉原料;S2-蜂花粉A组;S3-蜂花粉B组;S4-蜂花粉C组
图3 蜂花粉残留多酚HPLC图谱
Fig.3 HPLC chromatograms of residual polyphenols of bee pollen
蜂花粉原料与A、B、C组残留多酚的HPLC图谱峰形相似,出峰时间相近,在7.231、10.455、30.023 min附近均出现较大吸收峰。且通过图谱匹配,4个样品残留多酚的HPLC图谱两两之间相似度评价值在0.93 以上。同时,蜂花粉原料组在13.362、17.900、21.539、33.461 min附近出现了蜂花粉A、B、C组所没有的吸收峰;蜂花粉A、B、C组在6.250、7.528、9.801 min 附近均出现了原料组所没有的吸收峰;且蜂花粉A、B、C组之间出峰也略有差异。故总体而言,4个样品残留多酚的HPLC叠加图谱有较好的相关性,粉碎对其残留多酚的组分也有一定影响。
蜂花粉经体外模拟口腔、胃、肠消化结束后的残余物在模拟肠道发酵过程中的pH值如图4可知,在0~24 h内发酵液pH值随着发酵时间的延长不断降低,pH值从6.3降至6.0;其中0~16 h pH值降低趋势较强,16~24 h降低趋势减弱,趋于平缓。同时,发酵相同时间,粉碎粒径越小发酵液pH值越低。图5~图7分别为蜂花粉体外模拟肠道发酵产酸24 h后其乙酸、丙酸、丁酸的含量,结果表明,随着蜂花粉粉碎粒径的减小,其发酵液中乙酸、丙酸、丁酸的含量越高。相对而言,粉碎粒径对产生乙酸、丙酸的影响作用强于产生丁酸的影响作用。
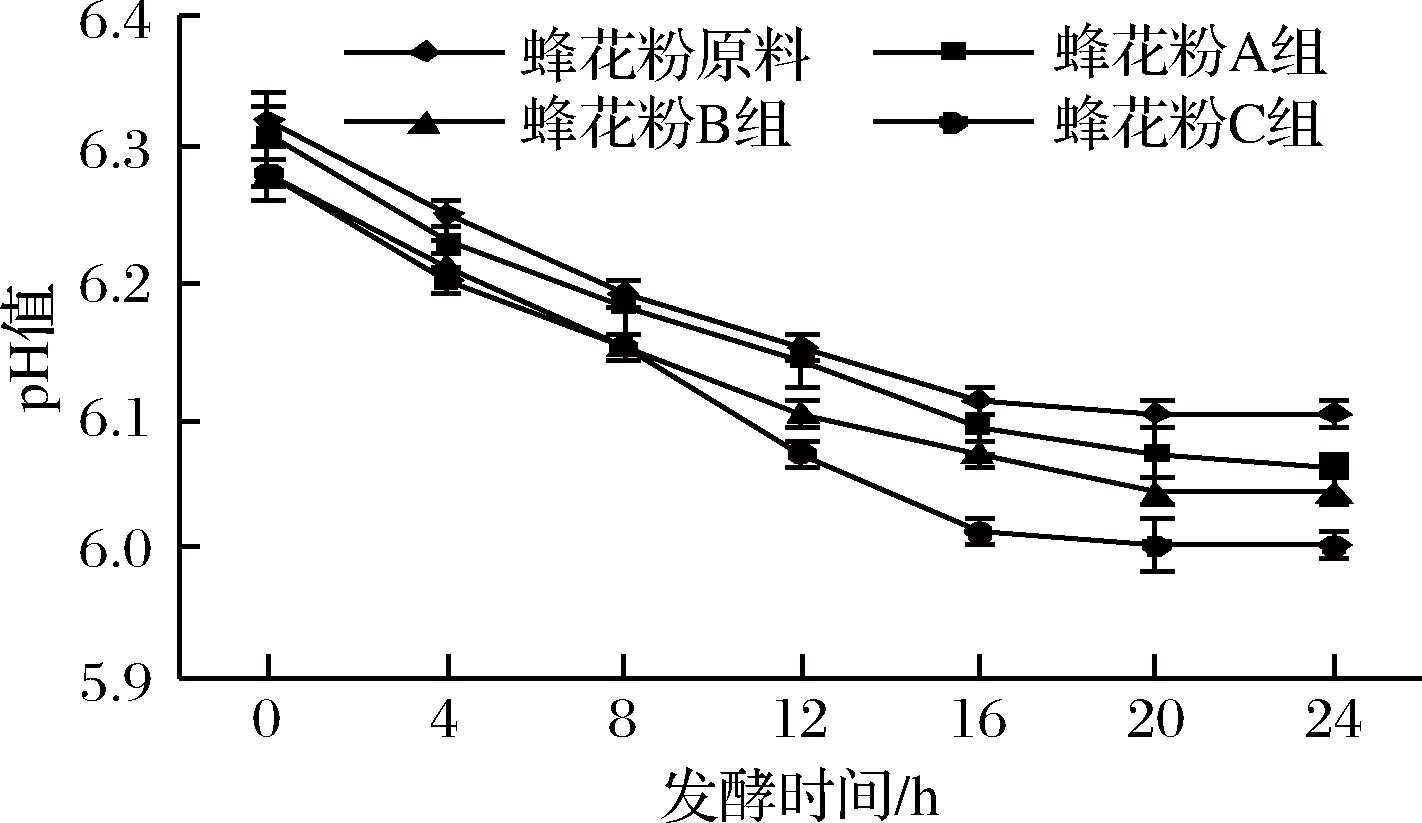
图4 体外模拟肠道发酵产酸过程pH值变化
Fig.4 pH in vitro intestinal fermentation process
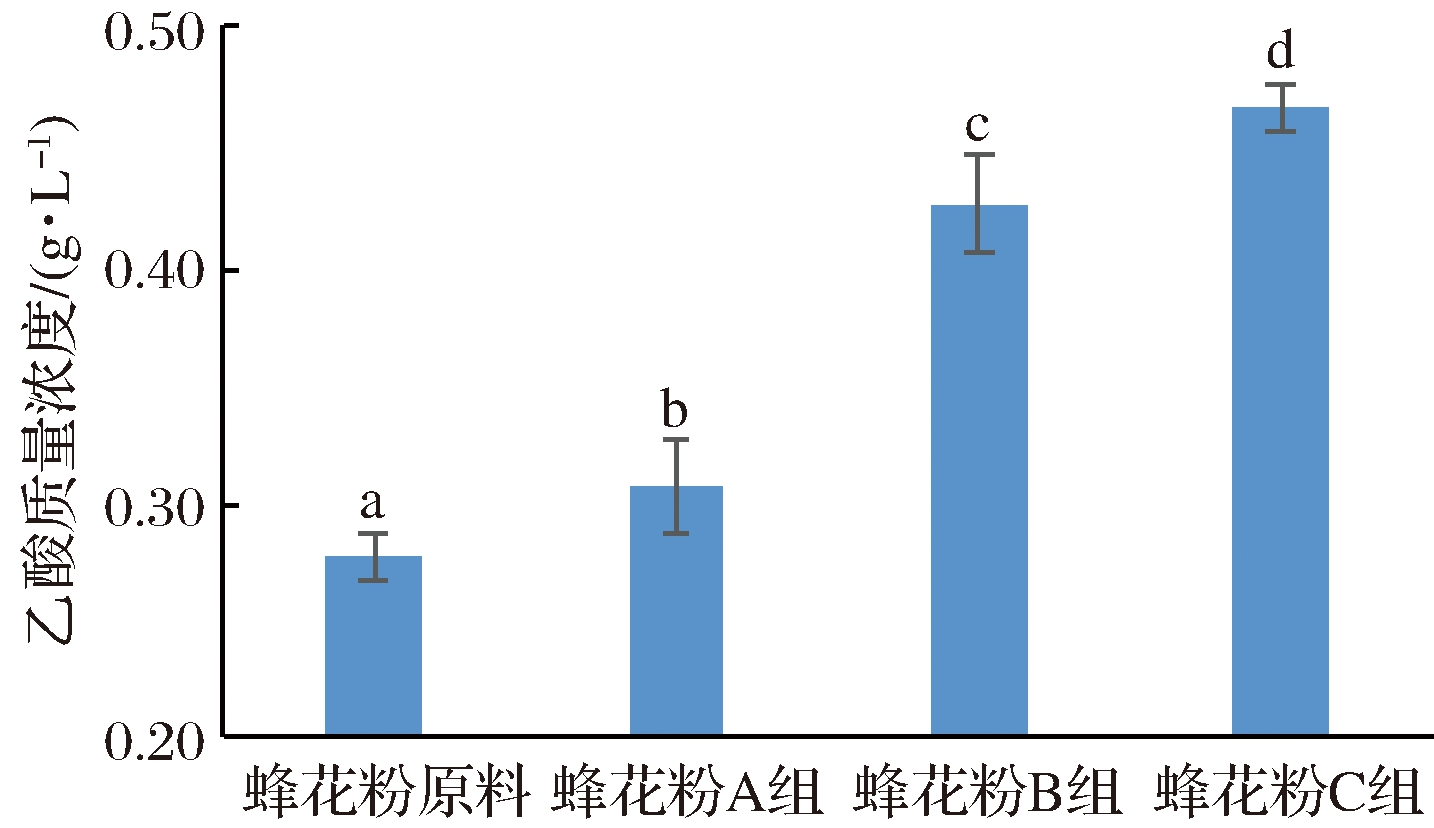
图5 蜂花粉体外模拟肠道发酵产乙酸含量
Fig.5 The content of acetic acid in vitro intestinal fermentation process

图6 蜂花粉体外模拟肠道发酵产丙酸含量
Fig.6 The content of propionic acid in vitro intestinal fermentation process

图7 蜂花粉体外模拟肠道发酵产丁酸含量
Fig.7 The content of butyric acid in vitro intestinal fermentation process
多酚可影响肠道菌群的生长,这与多酚结构、含量、微生物的种类以及多酚的代谢物等因素相关[22];同时,糖分是微生物生长的必需组分,蜂花粉粉碎粒径不同,经模拟口腔、胃、肠消化后蜂花粉残留物其糖分的种类与含量、分子质量大小、碳链长短等不同,影响肠道菌群生长、发酵产酸能力也不同[23]。从结果可知,在体外模拟后肠发酵产酸过程,蜂花粉粉碎粒径越小,发酵液pH值越低,发酵产酸特性越好。
以蜂花粉原料、蜂花粉A组(未破壁)、蜂花粉B组(破壁率(67.11±0.04)%)、蜂花粉C组(破壁率(100.00±0.00)%)4种不同粒径蜂花粉为研究对象,通过体外模拟人体消化系统,研究粉碎粒径对蜂花粉多酚在胃肠道中的溶出情况以及被肠道菌群利用发酵产酸特性的影响。
在体外模拟消化过程中,各阶段消化液中溶出多酚量随蜂花粉粉碎粒径的减小而增加。溶出多酚先增加后降低,在模拟胃液消化后达到最高,随后在模拟肠液消化后降低。与模拟胃液消化后相比,粉碎提高了蜂花粉在肠液消化过程中溶出多酚的保留率。经体外模拟口腔、胃、肠消化后,蜂花粉中残留多酚含量随着粉碎粒径的减小而增加,其HPLC叠加图谱有较好的相关性,同时也发现粉碎处理对其残留的多酚组分有一定影响,具体差异性还需进一步研究确定。在体外模拟后肠发酵过程,蜂花粉粉碎粒径越小,发酵液的pH值越低,发酵产酸特性越好;且粉碎粒径对产生乙酸、丙酸的促进作用强于对产生丁酸的促进作用。至今研究者对蜂花粉破壁与否还存在不同观点,从本实验结果可知,在蜂花粉多酚的体外消化特性上破壁优于未破壁。
膳食纤维可通过物理包裹、化学结合多酚类化合物,从而影响其在胃肠道的消化吸收[24-25],且蜂花粉中含有丰富的纤维类组分[17],故本研究中粉碎粒径对油菜蜂花粉在模拟消化过程中多酚溶出及其残留的影响,可能与粉碎对蜂花粉中膳食纤维类组分的影响相关。因此后续将对粉碎粒径对蜂花粉膳食纤维类组分的影响做进一步研究。
参考文献
[1] LI Shanshan, YANG Guang, YAN Jingmin, et al. Polysaccharide structure and immunological relationships of RG-I pectin from the bee pollen of Nelumbo nucifera.[J]. International Journal of Biological Macromolecules, 2018,15(1):660-666.
[2] CHEN Xuan, WU Renzhao, ZHU Yongqiang, et al. Study on the inhibition of Mfn1 by plant-derived miR5338 mediating the treatment of BPH with rape bee pollen[J]. Bmc Complementary & Alternative Medicine, 2018, 18(1):38-44.
[3] ZHANG Yawei, YANG Fengtian, JAMALI M A, et al. Antioxidant enzyme activities and lipid oxidation in rape (Brassica campestris L.) bee pollen added to salami during processing[J]. Molecules, 2016, 21(11):1 439-1 452.
[4] ANNA R S, JERZY S, ANNA K G, et al. Polyphenols from bee pollen: Structure, absorption, metabolism and biological activity[J]. Molecules, 2015, 20(12):21 732-21 749.
[5] JUCILENE A, EMERSON C,MARIA C, et al. Chemical composition and biological activities of mono- and heterofloral bee pollen of different geographical origins[J]. International Journal of Molecular Sciences, 2017, 18(5):921-936.
[6] 任向楠, 张红城,董捷. 蜂花粉破壁的研究进展[J]. 食品科学, 2009, 30(21):380-383.
[7] DONG Jie, GAO Kun, WNAG Kai, et al. Cell wall disruption of rape bee pollen treated with combination of protamex hydrolysis and ultrasonication[J]. Food Research International, 2015, 75:123-130.
[8] 曹红刚, 张政,木华芬,等. 油菜蜂花粉的4种真菌发酵破壁酶活变化及营养分析[J]. 中国食品学报, 2016, 16(1):258-263.
[9] 唐维, 张星海. 花粉破壁方法的研究进展[J]. 食品与发酵工业, 2003, 29(2):86-92.
[10] 马福敏, 刘玉玲. 复合破壁方法对蜂花粉破壁率及其主要功能性成分的影响[J]. 食品与发酵工业, 2016, 42(5):184-186.
[11] 张全龙. 花粉破壁率测定方法介绍[J]. 药学与临床研究, 1999, 7(1):44-45.
[12] GULLON B, PINTADO M E, JUANA F L, et al. In vitro, gastrointestinal digestion of pomegranate peel (Punica granatum) flour obtained from co-products: Changes in the antioxidant potential and bioactive compounds stability[J]. Journal of Functional Foods, 2015, 19:617-628.
[13] 肖星凝,李苇舟,石芳,等.不同品种李子多酚组成及抗氧化活性[J].食品科学,2017,38(15):31-37.
[14] 旷慧,冯建文,范倩,等.红树莓多酚的组分分析及体外抗脂质过氧化活性[J].食品科学,2018,39(3):83-89.
[15] LEBET V, ARRIGONI E, AMADO R. Measurement of fermentation products and substrate disappearance during incubation of dietary fibre sources with human faecal flora [J]. LWT - Food Science and Technology, 1998, 31(5):473-479.
[16] 孔璐, 赵新淮. 外源乳酸菌对低聚异麦芽糖肠道发酵产酸的影响[J]. 中国食品学报, 2016, 16(12):30-36.
[17] 郑慧, 陈希平,尤祯丹,等. 四种蜂花粉纤维组分分析与评价[J]. 营养学报, 2017, 39(5):513-514.
[18] 李俶, 王谢祎,翟宇鑫,等. 多酚化合物体外模拟消化的稳定性分析[J]. 食品科学, 2016, 37(13):1-5.
[19] FULGENCIO S C,SERRANO J, GONI I. Intake and bioaccessibility of total polyphenols in a whole diet[J]. Food Chemistry, 2007, 101(2):492-501.
[20] 颜才植, 叶发银,赵国华. 食品中多酚形态的研究进展[J]. 食品科学, 2015, 36(15):249-254.
[21] USUNE E, ALFREDO F Q, MILAGRO F I, et al. Impact of polyphenols and polyphenol-rich dietary sources on gut microbiota composition.[J]. Journal of Agricultural & Food Chemistry, 2013, 61(40):9 517-9 533.
[22] 杨华, 叶发银,赵国华. 膳食多酚与肠道微生物相互作用研究进展[J]. 食品科学, 2015, 36(3):223-227.
[23] CHEN Huimin, YU Yanan, WANG Jilin, et al. Decreased dietary fiber intake and structural alteration of gut microbiota in patients with advanced colorectal adenoma[J]. American Journal of Clinical Nutrition, 2013, 97(5):1 044-1 052.
[24] 谌小立, 赵国华. 抗氧化膳食纤维研究进展[J]. 食品科学, 2009, 30(5): 291-294.
[25] CHANTARO P, DEVAHASTIN S, CHIEWCHAN N. Production of antioxidant high dietary fiber powder from carrot peels[J]. LWT-Food Science and Technology, 2008, 41(10):1 987-1 994.
ZHENG Hui1,2, ZHENG Tao1, WANG Ruijie1, TANG Jinyao1, SHAO Xinxin1,LI Shunxiang2*
1(Department of Food and Drug Engineering, College of Pharmacy, Hunan University of Traditional Chinese Medicine,Changsha 410208, China) 2(Hunan Province Engineering Research Center of Bioactive Substance Discovery of Traditional Chinese Medicine, Changsha 410208, China)
Abstract Rape bee pollen with four different particle sizes were digested in vitro. The contents of dissolved polyphenols at different digestion stages, and contents of residual polyphenols after digestion were analyzed. The constituents of residual polyphenols and their acid production characteristics using intestinal flora were determined by high performance liquid chromatography. The results showed that during in vitro digestion, the contents of dissolved polyphenols increased with decreasing particle size. Moreover, smashing was beneficial for improving the retention rates of dissolved polyphenols. Furthermore, the contents of residual polyphenols after digestion increased with decreasing particle size. Additionally, smashing had impacts on the constituents of residual polyphenols. Besides, the pH of fermentation broth decreased with smaller particle size, and contents of acetic acid, propionic acid, and butyric acid increased. The acid production characteristics of bee pollen were better with decreasing particle size. The results showed that the in vitro digestion characteristics of polyphenols of wall-broken bee pollen were better than those without wall-broken. These findings can provide a theoretical basis for developing and applying deep processed bee pollen products.
Key words rape bee pollen; particle size; polyphenols; in vitro digestion