表1 实验用各目标基因特异性引物序列
Table 1 Sequences of primers for target genes of amplified
fragment

潘聪1,4,李占东5*,苑鹏2,4,张大力1,段盛林2,4,夏凯2,4,周文萱2,4,赵可心2,4,于伟厚3
1(吉林农业大学 食品科学与工程学院,吉林 长春,130118) 2(中国食品发酵工业研究院有限公司,北京,100015) 3(大连双迪科技股份有限公司,大连,116635)
4(功能主食创制与慢病营养干预北京市重点实验室,北京,100015) 5(吉林工程技术师范学院 食品工程学院,吉林 长春,130052)
摘 要 为探讨高核苷酸酵母水解物对RAW264.7小鼠巨噬细胞免疫活性调节及其相关作用机制,采用脂多糖(1 μg/mL)刺激RAW264.7细胞来建立体外细胞炎症模型,以不同质量浓度的高核苷酸酵母水解物干预来明确其抗炎效果。ELISA法检测细胞培养上清中白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)的含量,RT-PCR法检测相关mRNA表达水平,Western blot法检测细胞iNOS及胞核内核转录因子NF-κBp65蛋白水平。结果表明:高核苷酸酵母水解物作用RAW264.7细胞的安全范围≤150 μg/mL。与LPS模型组相比,质量浓度60~150 μg/mL的高核苷酸酵母水解物能显著增强RAW264.7吞噬能力,高核苷酸酵母水解物(60~150 μg/mL)能有效抑制脂多糖(lipopolysaccharide,LPS)诱导RAW264.7细胞释放NO、TNF-α、IL-1β和IL-6炎症因子及相关mRNA表达,降低iNOS及NF-κB蛋白水平。研究结果证实了高核苷酸酵母水解物对LPS刺激RAW264.7细胞炎症的保护作用,作用机制与NF-κB通路有关,为食疗干预慢性病提供一定的理论依据。
关键词 酵母水解物;核苷酸;抗炎;NF-κB
第一作者:硕士研究生(李占东副教授为通讯作者,E-mail:lizd591@163.com)。
基金项目:十三五-农机院薯类专项:薯类发酵主食新产品(面包)加工工艺技术研究(2016YFD0401303-02);马铃薯主食加工装备研究及特膳食品开发(北京市科委重大专项)马铃薯主食化关键技术研究与产业化示范(D171100001917003)
收稿日期:2018-10-24,改回日期:2019-01-07
DOI:10.13995/j.cnki.11-1802/ts.019150
我国已逐渐步入老龄化社会,伴随着年龄的增长,人体的基础代谢和消化能力会逐渐下降,最终导致免疫力下降,睡眠障碍等各种常见的健康问题。营养补充不仅可以为人体提供热量、蛋白质等多种营养物质,还直接参与机体代谢,是人体免疫功能的物质基础[1-2]。免疫营养不仅可以防止营养缺乏,还能通过特定方式来刺激免疫细胞,增强机体的免疫应答,通过调控细胞因子的产生和释放,减轻过度的炎症反应[3-4]。
炎症是伴随很多疾病状态的一种共有的病理现象,如糖尿病、高血脂等疾病均与炎症反应有一定的关联。巨噬细胞是主要的炎症细胞,当其受到外界抗原(如LPS)刺激时会释放白介素-6、肿瘤坏死因子-α等一系列炎性细胞因子,从而促进炎症反应和造成组织损伤[5]。炎症是机体对感染、组织损伤及伤害性刺激等做出的保护性反应[6]。已发现炎症反应与核转录因子NF-κB、MARK、p38信号传导及转录激活因子STAT-3等信号通路相关,通过炎症信号通路中的关键分子筛选抗炎药物是研究的重要手段[7]。
酵母水解物(yeast hydrolyzate,YH)也称复合酵母,是采用纯培养食用酵母(Saccharomyces cerevisiae)利用内源酶及外源酶水解,充分释放核酸、小肽等功能成分酶解自溶并经分离提取而获得的氨基酸、肽、多肽等酵母细胞中的可溶性成分。高核苷酸酵母水解物(high nucleotide yeast hydrolyzate,HNYH)富含核酸、核苷酸(AMP、CMP、GMP、UMP、IMP)、小肽、消化酶、游离氨基酸和丰富的B族维生素及酵母细胞壁[8-9]。核苷酸具有多种生物学活性,在脂类、糖类、能量代谢及蛋白质生物合成中起着重要的作用[10]。据报道,酵母核苷酸具有抗氧化,增强机体免疫力,维持机体胃肠道功能等功能,促进机体损伤修复,降低细胞凋亡,抗炎等功能活性。当经过胃肠道时,小分子肽、氨基酸可直接被吸收。核苷酸作为核酸的组成单位,几乎参与了体内所有的代谢过程,它是体内许多酶和辅酶的重要组成成分,在细胞物质能量代谢和功能调节中起重要作用[11-14]。
高核苷酸酵母水解物是一种新型、绿色、富含多种功能性成分的食品原料,具有很大的研究价值,因此,本研究通过脂多糖(lipopolysaccharide,LPS)诱导小鼠巨噬细胞系RAW264.7炎症模型,初步探讨了高核苷酸酵母水解物的抗炎作用,提高免疫力的功能活性,为高核苷酸酵母水解物的产品开发利用提供理论基础。
高核苷酸酵母水解物,大连珍奥生物技术有限公司提供,蛋白含量61.95%,NaCl 0.2%,总核苷酸含量13.56%,其中AMP 0.049%、CMP 2.17%、GMP 3.39%、UMP 3.54%、IMP 4.42%;小鼠巨噬细胞株(RAW264.7),由中国食品发酵工业研究院保存;DMEM(dulbecco’s modified eagle medium)培养基、磷酸盐缓冲液(phosphate buffered saline,PBS)、平衡盐缓冲液(hank’s balanced salt solution,HBSS)、DMEM无糖培养基、胎牛血清(fetal calf serum,FBS),美国Gibco;噻唑兰(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenylterazolium bromide,MTT),脂多糖(lipopolysaccharides,LPS),美国Sigma化学公司;NO试剂盒、肿瘤坏死因子-α试剂盒、白细胞介素-6试剂盒、白细胞介素-1β试剂盒、细胞核蛋白和浆蛋白抽提试剂盒、山羊抗鼠IgG/HRP二抗、山羊抗兔IgG/HRP二抗、鼠抗β-actin单克隆抗体,碧云天生物技术有限公司;β-actin、iNOS、TNF-α、IL-1β和IL-6引物合成,英潍捷基贸易有限公司;兔抗iNOS单克隆抗体、兔抗NF-κBp65单克隆抗体,Cell Signaling Technology公司;所有有机溶剂均为国产分析纯。
奥林巴斯CKX41型生物显微镜,OLympus公司;CO2培养箱,松下公司;Spectra Max i3酶标仪,MD公司;pH计,上海雷磁仪器厂;GL-20G-Ⅱ型高速冷冻离心机,上海安亭科学仪器厂;凝胶成像仪,北京五洲东方科技发展有限公司;WB显影仪,上海勤翔科学仪器有限公司;Bio-Rad CFX Maestro RT-PCR仪器,伯乐有限公司。
称取高核苷酸酵母水解物溶于超纯水中,4 000 r/min,离心10 min取上清,0.22 μm滤膜除菌后待用。
1.3.1 RAW264.7细胞的培养
RAW264.7细胞于含有体积分数10%胎牛血清、100 μL/mL青霉素和100 μL/mL链霉素的DMEM培养基中培养(下文简称DMEM10),在37 ℃、5% CO2培养条件下常规培养。选取对数生长期细胞进行实验。对照组,DMEM10正常培养;模型组,DMEM10+LPS(1 μg/mL)共培养;样品组,DMEM10+LPS(1 μg/mL)+不同质量浓度高核苷酸酵母水解物共培养[15]。
1.3.2 MTT法测定RAW264.7细胞存活率
取对数生长期的RAW264.7细胞接种于96孔板中,每孔接种1×105个细胞。37 ℃培养24 h后弃去培养液,用PBS清洗1次,在培养基中分别加入质量浓度20、40、60、80、100、150、200和250 μg/mL的高核苷酸酵母水解物,以无检测物的相同培养基孵育细胞为对照,培养24 h后弃去培养液,加入质量浓度0.5 mg/mL MTT-DMEM10于37 ℃避光孵育2 h,小心吸弃培养液,再加入100 μL二甲基亚砜(dimethyl sulfoxide,DMSO),静置待完全溶解出MTT紫色结晶产物。使用酶标仪在490 nm处测定吸光度值。以对照组细胞的细胞存活率为100 %计算其余组别细胞存活率[16]。
1.3.3 HNYH对RAW264.7细胞吞噬中性红作用的影响
取对数生长期的RAW264.7细胞接种于96孔板中,每孔接种1×105个细胞,设对照组、模型组、样品组(高核苷酸酵母水解物质量浓度为20、40、60、80、100、150 μg/mL)培养24 h,每孔加入100 μL 0.075%中性红生理盐水溶液,培养1 h,弃去上清,用无血清的RPMI-1640洗涤2次,向各孔加入100 μL细胞溶解液(0.1 mol/L冰醋酸与无水乙醇1∶1等体积混合),室温静置过夜,待细胞全部溶解后,570 nm测吸光值[17]。
1.3.4 HNYH对RAW264.7细胞释放NO能力的影响
RAW264.7细胞按照1.3.3分组和处理方法,处理24 h后,吸取50 μL上清液于96孔板中,依次加入NO试剂盒中试剂A,B 2种反应液各50 μL,于540 nm处测OD值。
1.3.5 HNYH对RAW264.7细胞释放炎症因子的影响
将对数生长期的巨噬细胞按每孔浓度为1×105个细胞数接种于96孔板中,设对照组、模型组,样品组(高核苷酸酵母水解物质量浓度为10、50、100、150 μg/mL),且每组3个复孔,放置于细胞培养箱培养,24 h后采用碧云天试剂盒分别测定细胞IL-6,IL-1β和TNF-α的释放量[18]。
1.3.6 HNYH对LPS刺激RAW264.7细胞iNOS,TNF-α,IL-1β和IL-6mRNA的影响
RAW264.7细胞悬液接种6孔板,细胞数为1×106个/mL,每孔2 mL,分别设正常组、模型组、样品组(高核苷酸酵母水解物浓度为10、50、100、150 μg/mL),细胞培养24 h后,收集各组巨噬细胞,按照全式金试剂盒说明书提取细胞总RNA,用紫外分光光度计对RNA进行定量分析,测定RNA纯度及浓度。PCR反应条件为45 ℃ 5 min;94 ℃ 30 s,94 ℃ 5 s,60 ℃ 1 min,循环40次;PCR扩增完毕后,琼脂糖凝胶电泳检测mRNA表达情况,Bio-Rad公司图像分析成像仪进行半定量分析。引物序列及产物大小见表1[5]。
表1 实验用各目标基因特异性引物序列
Table 1 Sequences of primers for target genes of amplified
fragment

1.3.7 Western blot检测NF-κB及iNOS蛋白的表达
RAW264.7细胞按照1.3.6分组和处理方法,常规培养24 h后,收集各组细胞,置于冰上,使用细胞核蛋白抽提试剂盒提取核蛋白,检测细胞核内NF-κBp65蛋白表达情况,Bradford法测定蛋白浓度。每孔上样30 μg蛋白,10% SDS-PAGE分离样品,转膜,5%脱脂奶粉封闭2 h,将膜置于1∶1 000稀释的一抗稀释液中,4 ℃过夜,TBST洗膜3次,将膜浸入以1∶1 000稀释的二抗稀释液中,室温摇床孵育1 h,TBST洗膜3次。ECL显色液显色,曝光,利用Image J软件进行灰度值分析。
1.3.8 统计学处理
采用Origin 8.0统计软件进行实验数据分析,结果用![]() 表示。并对实验结果进行单因素方差分析,P<0.05表示差异显著。
表示。并对实验结果进行单因素方差分析,P<0.05表示差异显著。
由表2可知,高核苷酸酵母水解物在质量浓度20~150 μg/mL处理细胞的存活率都在95%左右,观察到细胞形态良好,没有显著差异,未观察到细胞毒性作用。质量浓度在200 μg/mL以上时高核苷酸酵母水解物对RAW264.7细胞生长有明显的抑制作用,所以在后续的实验中选择150 μg/mL为最大质量浓度。
表2 不同质量浓度高核苷酸酵母水解物对RAW264.7细胞活力的影响
Table 2 Effect of different concentrations of high-doseyeast hydrolysates on the viability of RAW264.7 cells

注:![]() 与对照组相比,差异显著,P<0.05。
与对照组相比,差异显著,P<0.05。
吞噬作用是巨噬细胞发挥其免疫功能的重要方式之一,由图1可以看出,与对照组相比,模型组的细胞吞噬能力显著升高,与模型组相比,样品组质量浓度在100~150 μg/mL时,能明显地增强RAW264.7细胞的吞噬能力(P<0.05)。说明高核苷酸酵母水解物能够提高巨噬细胞的免疫活性[19]。
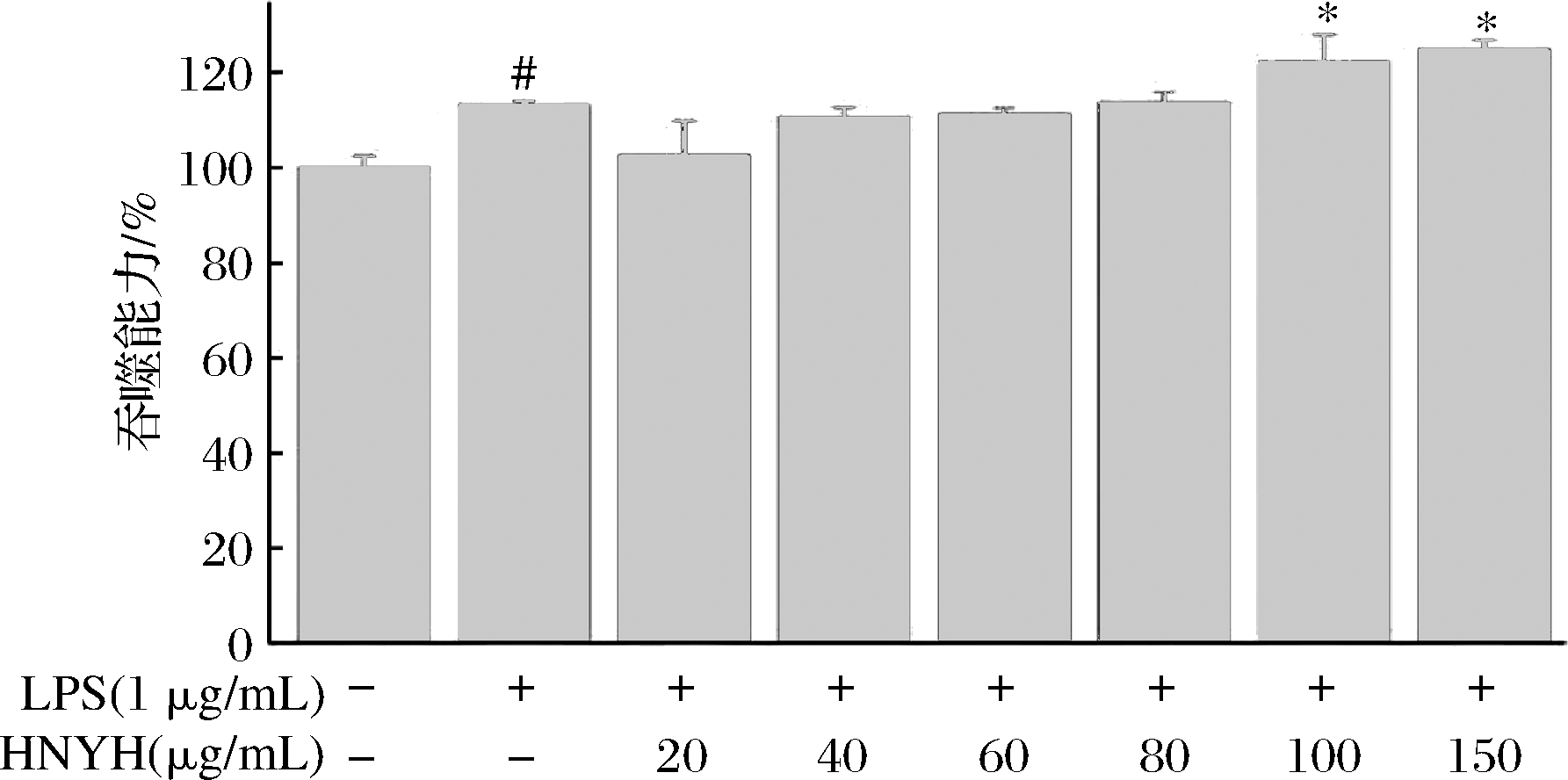
图1 HNYH对RAW264.7细胞吞噬中性红的影响
Fig.1 Effect of HNYH on phagocytic neutral red in RAW264.7 cells
注:![]() 与对照组相比,差异显著,P<0.05;*,与模型组相比,差异显著,P<0.05,下同。
与对照组相比,差异显著,P<0.05;*,与模型组相比,差异显著,P<0.05,下同。
在体内,NO是通过一氧化氮合酶(NOS)催化L-精氨酸(L-Arg)产生的。iNOS主要是在炎症和免疫刺激下表达,进而催化NO持续生成,过多的NO则会促使炎症性疾病的发生和发展[5]。将1 μg/mL LPS作用于巨噬细胞RAW264.7后24 h,如图2所示,产生的NO量显著高于正常对照组,差异具有统计学意义(P<0.05),在一定浓度范围内,高核苷酸酵母水解物作用巨噬细胞后,NO的生成量随高核苷酸酵母水解物浓度的增加而降低,NO标准曲线,线性回归方程为:y=0.014 9x+0.019 8,R2=0.998 7。
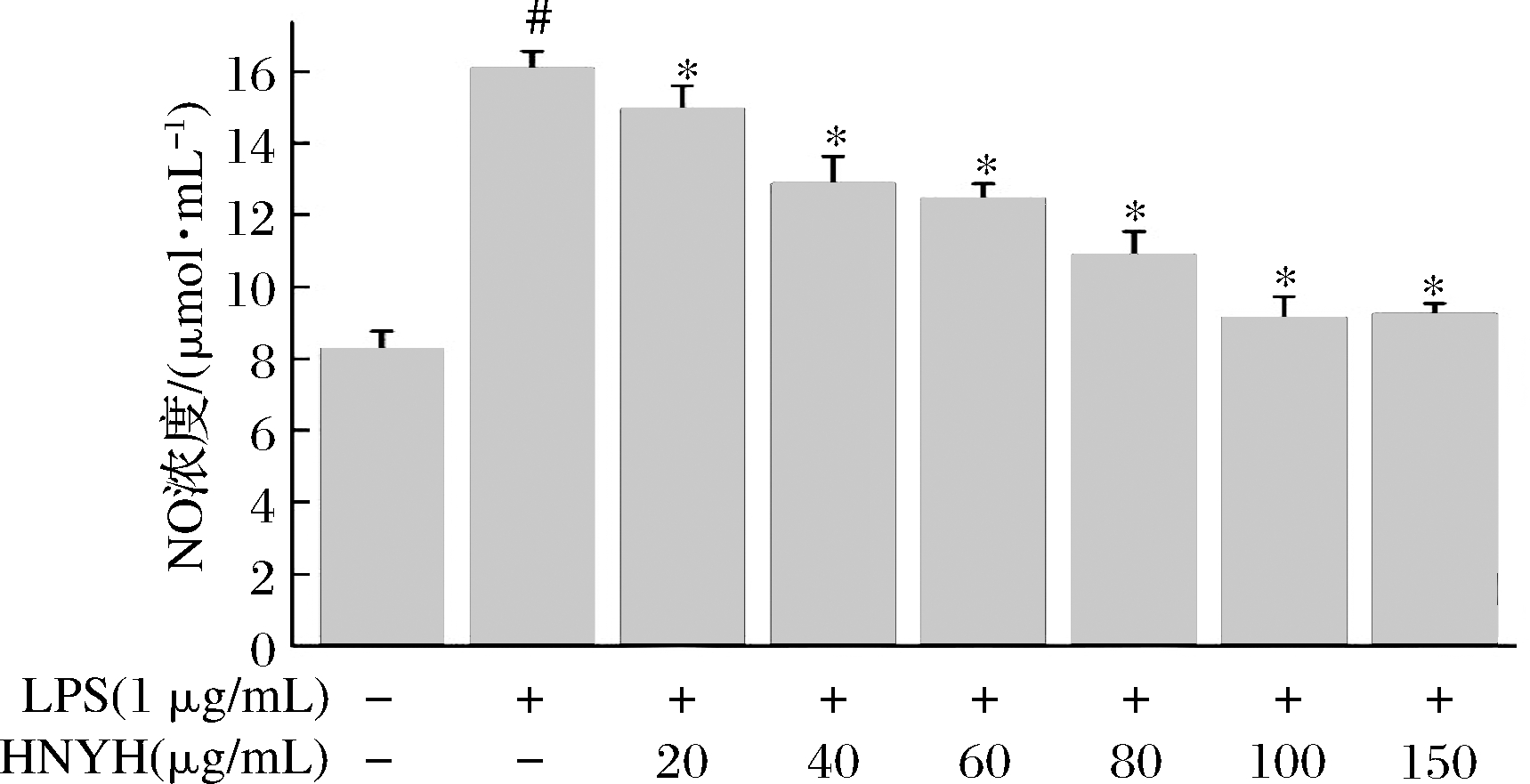
图2 HNYH对LPS诱导的RAW264.7细胞内NO含量的影响
Fig.2 Effects of HNYH on the content of NO in LPS- induced RAW264.7 cells
结果如图3、图4和图5所示。
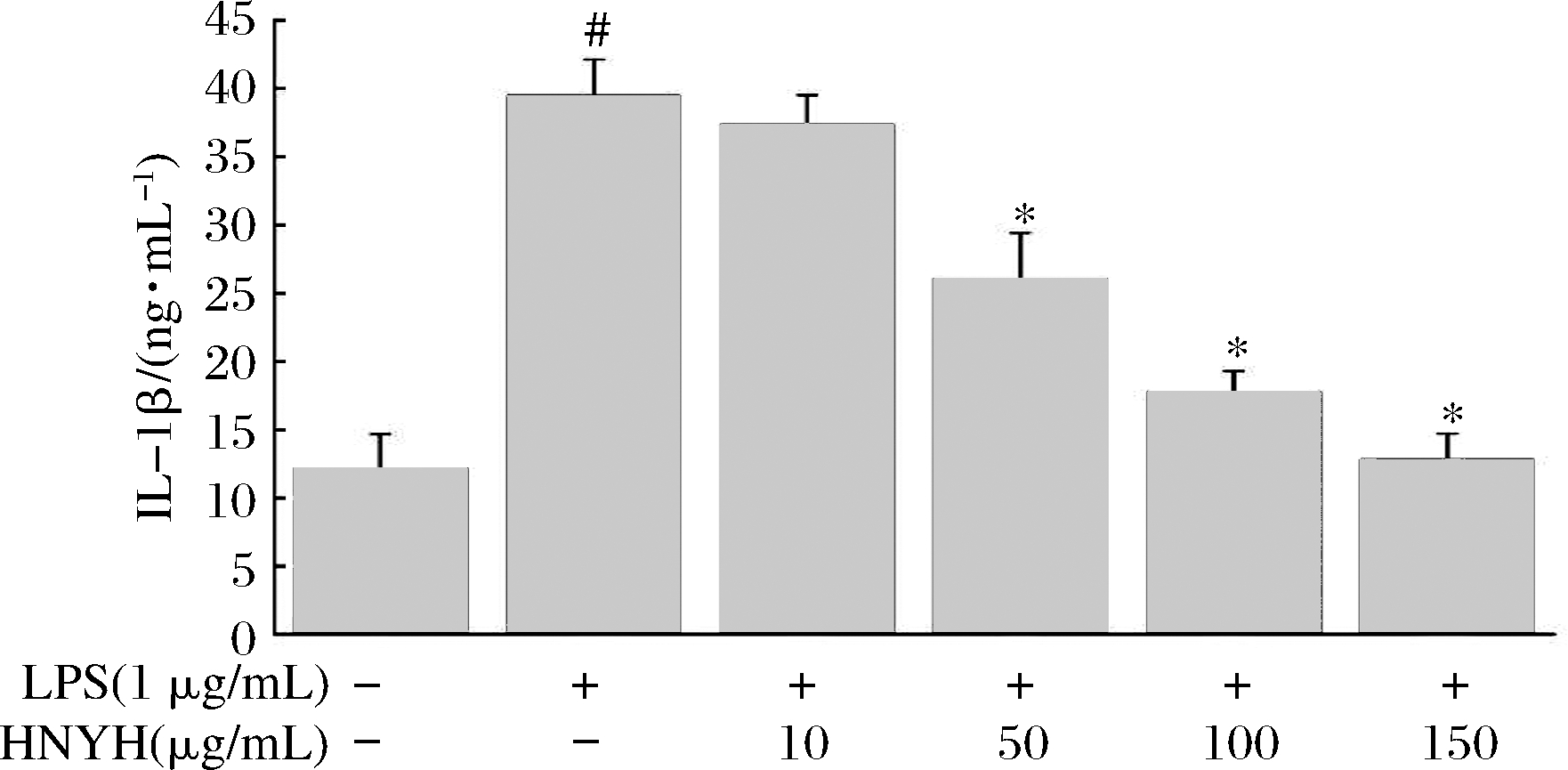
图3 HNYH对LPS诱导RAW264.7 细胞IL-1β的影响
Fig.3 Effects of HNYH on the content of IL-1β in LPS-induced RAW264.7 cells
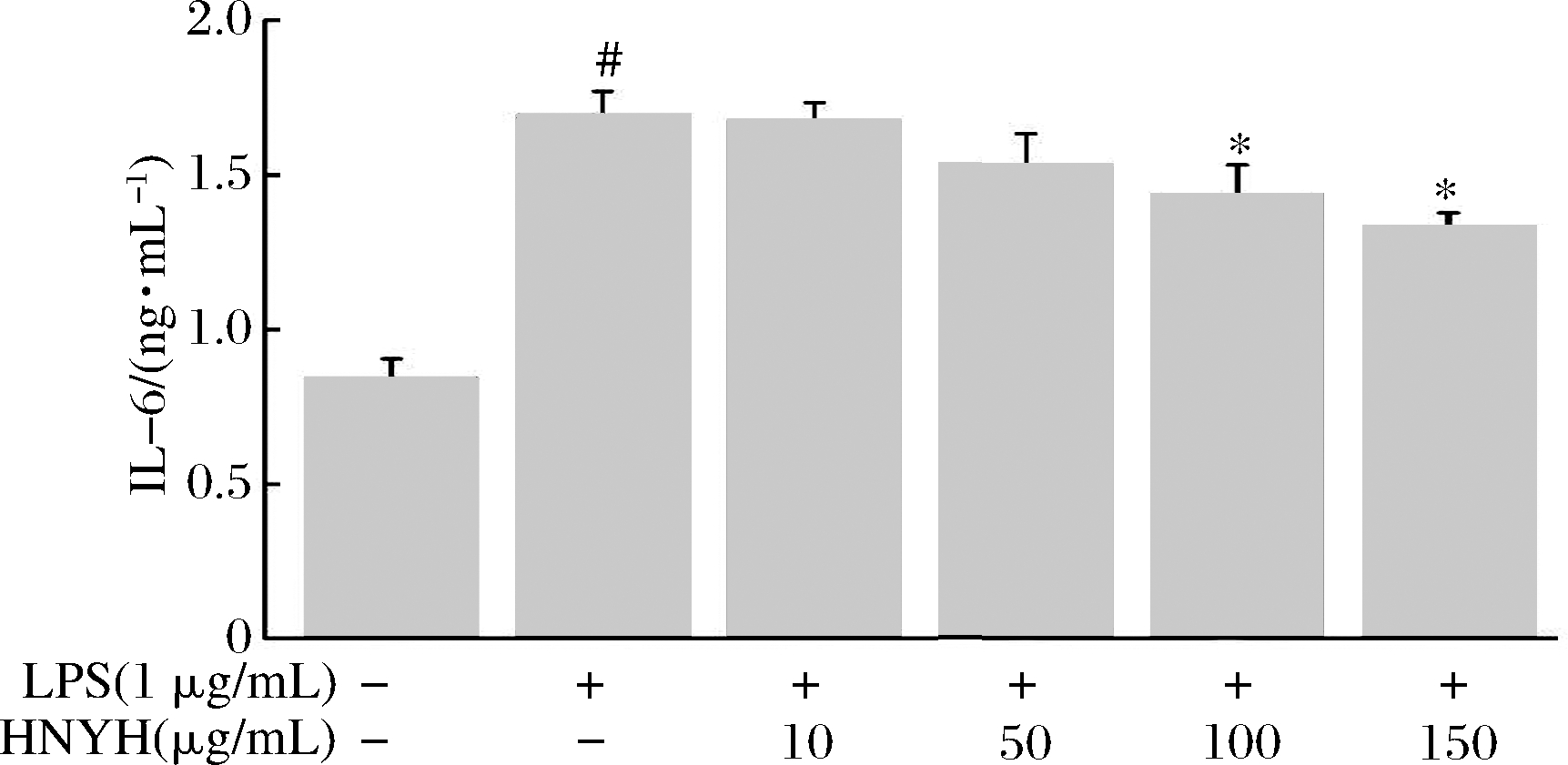
图4 HNYH对LPS诱导RAW264.7 细胞IL-6的影响
Fig.4 Effects of HNYH on the content of IL-6 in LPS-induced RAW264.7 cells
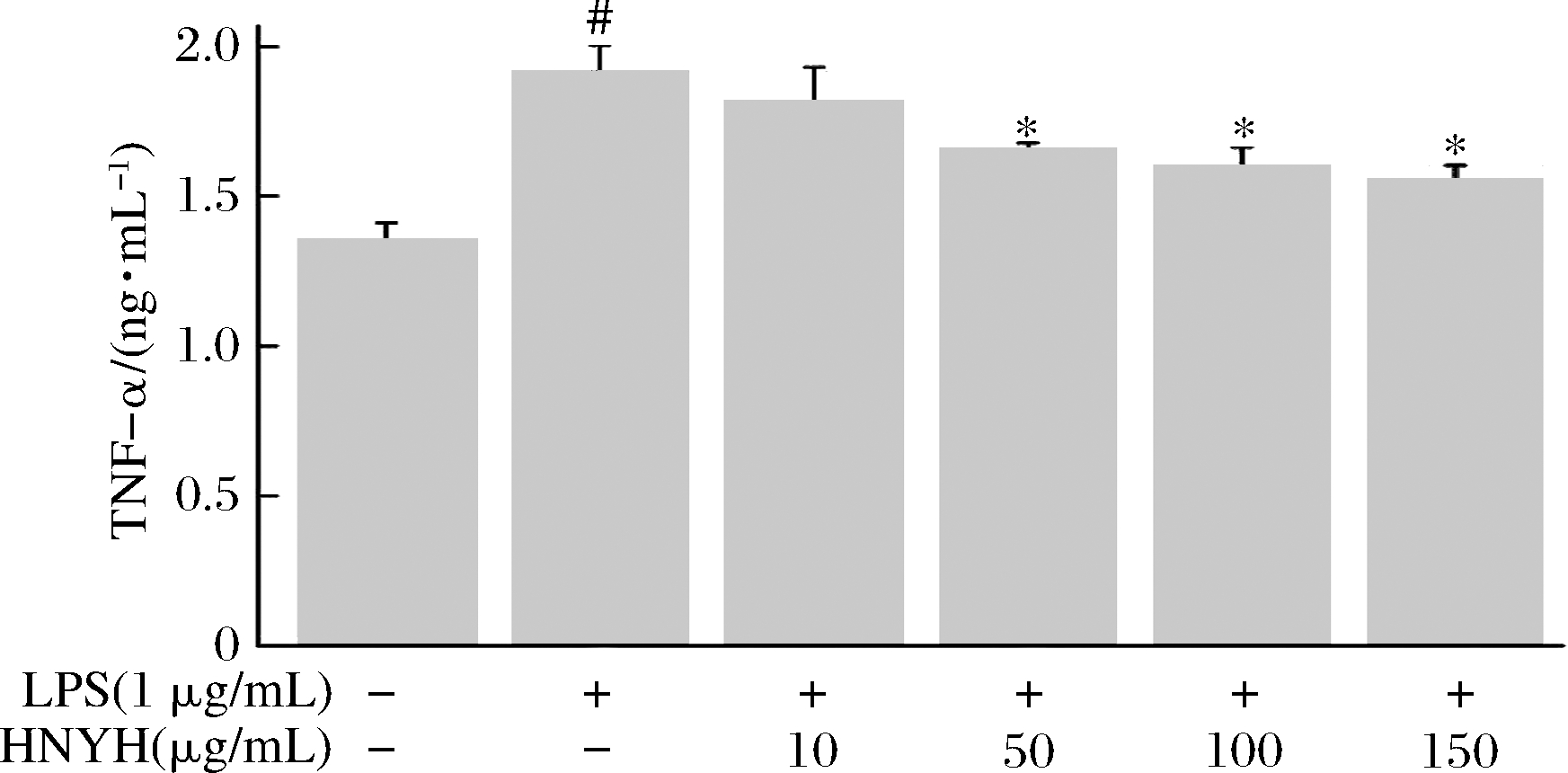
图5 HNYH对LPS诱导RAW264.7 细胞TNF-α的影响
Fig.5 Effects of HNYH on the content of TNF-α in LPS-induced RAW264.7 cells
正常组细胞上清液中IL-1β、IL-6、TNF-α分泌较少,给予1 μg/mL LPS刺激24 h后,IL-1β、IL-6和TNF-α分泌均显著增加(P<0.05),与模型组相比,高核苷酸酵母水解物组中IL-1β、IL-6和TNF-α的分泌则受到明显抑制(P<0.05),并呈现一定的剂量依赖关系。根据实验结果推测HNYH通过调节多种炎症因子的分泌来缓解LPS诱导的RAW264.7细胞炎症。
RT-PCR实验结果分析如图6显示,与对照组相比,模型组的iNOS、IL-6、IL-1β和TNF-α mRNA均显著升高(P<0.05),与模型组相比,不同质量浓度的高核苷酸酵母水解物组能够显著降低iNOS、IL-6、IL-1β、TNF-α mRNA表达。
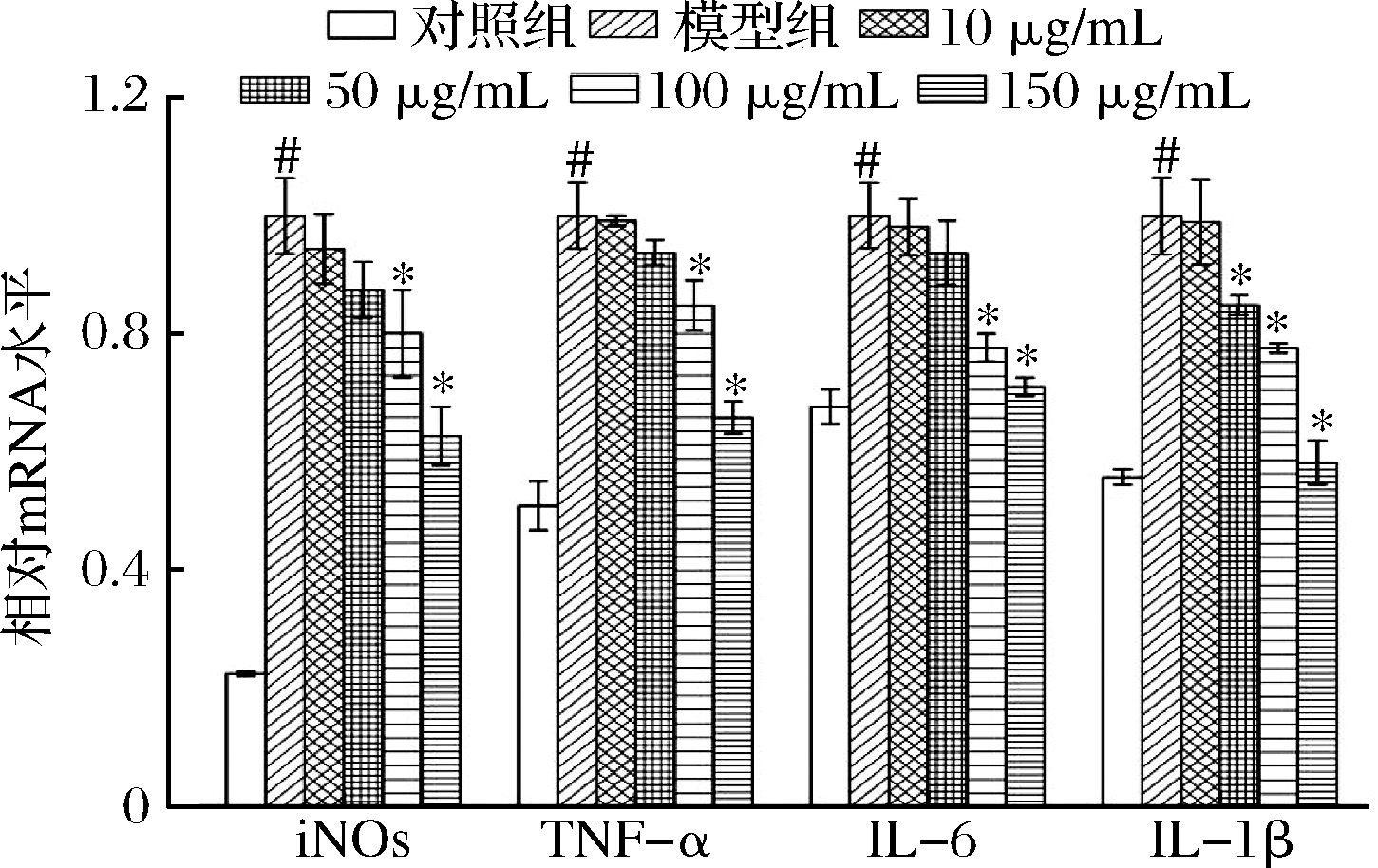
图6 HNYH对LPS刺激RAW264.7细胞iNOS,TNF-α,IL-6,IL-1β mRNA的影响
Fig.6 The effect of iNOS,TNF-α,IL-6 and IL-1β mRNA expressionafter the intervention of total saponins of Panax japonicus on RAW264.7 cells stimulated by LPS
蛋白免疫印迹实验(Western Blot)结果如图7所示,模型组细胞核内NF-κBp65蛋白的表达明显高于对照组(P<0.05);HNYH各组剂量依赖性地抑制由LPS所诱导的NF-κBp65蛋白的表达,与模型组比较,存在显著性差异(P<0.05)。

图7 HNYH对LPS刺激RAW264.7细胞NF-κBp65的影响
Fig.7 Effect of HNYH on NF-κBp65 stimulated by LPS in RAW264.7 cells
Western Blot检测结果如图8所示,对照组中,iNOS蛋白表达较低,而经LPS刺激后,RAW264.7细胞分泌的iNOS蛋白表达显著上调(P<0.05)。
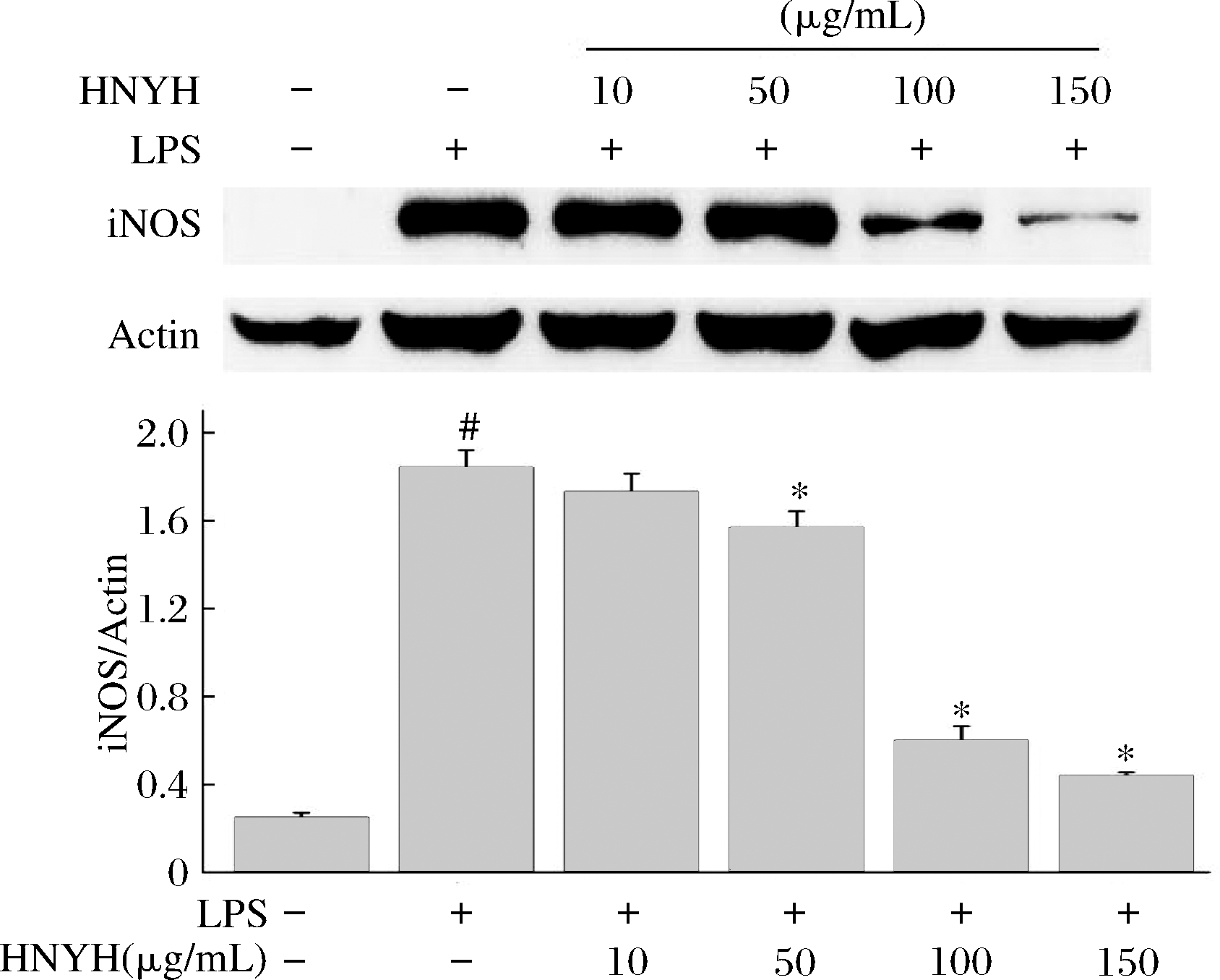
图8 HNYH对LPS刺激RAW264.7细胞iNOS蛋白的影响
Fig.8 Effect of HNYH on iNOS stimulated by LPS in RAW264.7 cells
与模型组比较,高核苷酸酵母水解物(150、100、50、10 μg/L)呈浓度依赖性下调iNOS蛋白表达(P<0.05),从而抑制了NO的生成,来减轻炎症反应。说明了HNYH组通过降低RAW264.7细胞中iNOS蛋白表达,从而减少NO炎症介质的产生。
炎症是伴随各种疾病的一种常见病理现象,巨噬细胞是主要的炎性细胞,同时也是免疫反应的效应细胞,在机体免疫系统中起着重要的作用。研究发现,LPS作为一种炎症诱导剂可以通过与细胞膜表面受体TLR4的结合,来激活丝裂原活化蛋白激酶(MAPK)和NF-κB信号通路,介导单核巨噬细胞的激活,诱导多种细胞因子如NO、IL-1β、IL-6、TNF-α等的合成和释放[20-22]。
体内NO是由一氧化氮合酶(iNOS)催化L-精氨酸(L-Arg)产生[5]。一氧化氮合酶是NO合成所必须的酶,分为原生型一氧化氮合酶(cNOS)和诱导型一氧化氮合酶(iNOS)[23],iNOS主要是在炎症和免疫刺激下表达,进而催化NO持续生成,过量的NO则会促进炎症性疾病的发生和发展[24-25]。因此,抑制NO的释放或iNOS表达可能是缓解炎症反应的重要靶点[26-27]。NO合成酶iNOS的表达直接决定NO分泌量,是检测炎症重要指标。目前,调节诱导型合成酶iNOS的表达和NO的合成被认为是治疗炎症疾病的重要途径。NO及iNOS mRNA表达水平的降低与中和炎症反应密切相关,iNOS是介导炎症分子机制中一个重要分子机制[7]。LPS诱导的iNOS的表达受NF-κB调控。NF-κB受刺激因子诱导激活从细胞质转移至核内,诱导多种基因的表达和多种细胞因子的释放。
在炎症反应的各阶段,NF-κB作为核转录因子起着重要的调控作用,其主要的诱导型亚基是p60/p65[28]。静息状态时,NF-κB和IκB形成的复合体存在于细胞质中。在通过LPS刺激后,IκB被活化的激酶复合体(IκBkinase,IKK)磷酸化,NF-κB与IκB解离,游离的NF-κBp65迅速转移到细胞核并与κB结合位点结合,从而启动炎性介质及促炎症细胞因子的转录与表达[29-31]。
综上所述,通过LPS诱导的RAW264.7细胞体外细胞炎症模型中,模型组的炎症因子iNOS、TNF-α、IL-6和IL-1β表达明显上升,核NF-κB p65 和iNOS蛋白表达明显上调,说明NO、TNF-α、IL-6和IL-1β释放,NF-κB信号通路被激活,证明细胞炎症模型构建成功,与模型组相比高核苷酸酵母水解物组中NO、IL-1β、IL-6和TNF-α的分泌则受到明显抑制,并呈现一定的剂量依赖关系。高质量浓度HNYH能显著抑制NO、IL-1β、IL-6、TNF-α的释放,然后又采用RT-PCR法检测细胞中iNOS、TNF-α、IL-6和IL-1β mRNA表达,各剂量组(10、50、100、150、μg/mL)均能抑制iNOS、TNF-α、IL-6和IL-1β mRNA表达。可知HNYH通过调控炎症因子基因的表达进而抑制炎症因子的过度释放,起到抗炎作用。
Western Blot检测证实了HNYH能够调控激活RAW264.7细胞核因子NF-κB通路,通过抑制iNOS表达,进一步抑制NO和炎性因子TNF-α、IL-1β和IL-6的产生,降低iNOS、TNF-α、IL-6和IL-1β mRNA表达,具体作用机制仍需进一步深入研究。炎症反应和慢性病总是有着密不可分的联系,HNYH作为一种天然的具有抗氧化、增强免疫力等功能性营养食品添加剂,本研究可能为食疗干预慢性病提供一定的基础理论依据。
参考文献
[1] DEROSA V, GALGANIM, SANTOPAOLOM, et al. Nutritional control of immunity: balancing the metabolic requirements with an appropriate immune function[J]. Seminars in Immunology, 2015, 27(5): 300-309.
[2] 邓文英,李宁,夏欣欣,等.肿瘤免疫营养现状及进展[J].肿瘤学杂志,2014,20(8):619-624.
[3] 李帅军, 刘欣. 胃肠道恶性肿瘤围术期肠内免疫营养对术后免疫功能的影响[J]. 实用临床医药杂志, 2012, 16(17): 46-48.
[4] 仝瑞防.脓毒症/严重脓毒症患儿营养评估及微量元素Cu Fe Zn的调查[D].新乡:新乡医学院,2015.
[5] 代艳文,袁丁,万静枝,等.竹节参总皂苷通过NF-κB通路对LPS致RAW264.7细胞炎症的保护作用研究[J].中国中药杂志,2014,39(11):2 076-2 080.
[6] 李艳红,高志玲,马金姝.藜芦酸抑制LPS刺激的RAW264.7细胞中NO表达的研究[J].中国免疫学杂志,2014,30(3):326-329.
[7] 阮洪生,牟晋珠.表儿茶素对脂多糖诱导RAW264.7细胞分泌炎症因子的影响[J].中国实验方剂学杂志,2017,23(4):159-163.
[8] 张吕颖.核酸生物化学[M].北京:中国医药科技出版社,1993:341.
[9] 邬小兵,乐国伟,施用晖.外源核苷酸对婴幼儿的营养作用及其在代乳品中的应用[J].食品科技,2000 (5):17-19.
[10] 曹凯鸣,李碧羽,彭泽国.核酸化学导论[M].上海:复旦大学出版社,1992:226.
[11] MICHAEL C.Nucleotides[J].Nutrition, 1998(14):748-751.
[12] JANE D.Carver.Advancesinn utritional modification so finfantformu-las [J].Am J China Nutr, 2003(77):1 550-1 554.
[13] SHIGERU YAMAMOTO, WANG Mingfu.Role of nucleo sides and nucleo-tides in the immune system gut rep aration after injury, an dB rain function [J].Nutrition, 1997(13):372-374.
[14] 钱佳,施用晖,马立芹,等.5′-磷酸腺苷(5′-AMP)体外抗氧化作用的研究[J].食品与机械,2008 (1):89-92.
[15] 袁琴,袁丁,周志勇,等.竹节参齐墩果烷皂苷对RAW264.7巨噬细胞SIRTI活性影响及抗炎作用研究[J].中国药理学通报,2016,32(3):349-354.
[16] 张东芳,肖鹏,韩晨露,等.表没食子儿茶素-3-没食子酸酯抑制脂多糖诱导的巨噬细胞促炎因子TNF-α和IL-1β基因表达[J].中国生物化学与分子生物学报,2014,30(4):402-408.
[17] 何利惠,张元丽,蒋林宏,等.苦瓜提取物对小鼠腹腔巨噬细胞吞噬活性及NO、H2O2分泌的影响[J].中兽医医药杂志,2014,33(4):55-58.
[18] 赵凯华,赵烽,刘珂.腺梗豨莶提取物对脂多糖活化巨噬细胞释放一氧化氮的抑制作用[J].烟台大学学报,2009,22(2):137-140.
[19] 尚京迎,付海田,邓超,等.基于巨噬细胞模型的竹荪多糖的免疫功能[J].食品与生物技术学报,2016(8):849-854.
[20] IONITA M G,ARSLAN F,KLEIJN D P D,et al.Endogenous inflammatory molecules engage Toll-like receptors in cardiovascular disease[J].J Innate Immun,2010,2(4):307-315.
[21] DRELXER S K,FOXWELL B M.The role of Toll-like receptors in chronic inflammation[J]. Int J Biochem Cell Biol,2010,42(4): 506-518.
[22] 丛友权,韩晶晶,方芸,等.雪荔方总黄酮对LPS致RAW264.7细胞炎症的保护作用[J].中成药,2017 (5):890-895.
[23] KORHONEN R,LAHTI A,KANKAANRANTA H,et al.Nitric oxide production and signaling in inflammation[J].Curr Drug Targets Inflamm Allergy,2005,4(4):471-479.
[24] 杨晓露,章丹丹,唐宁,等.诱导型一氧化氮合酶的调控机制及其抑制剂的研究进展[J].中国药房,2011,22(39):3 728-3 732.
[25] 孙世学,李运曼.NO在类风湿性关节炎症中的作用及相关药物研究进展[J].药学与临床研究,2007,15(3):175-178.
[26] OTANI H. The role of nitric oxide in myocardial and remodeling[J]. Antioxid Redox Signal,2009,11(8):1 913-1 928.
[27] 袁小媚,雷寒,柳青,等.CaM抑制剂对LPS/IFN-γ诱导的RAW264.7细胞NO生成及iNOS表达的影响[J].第三军医大学学报,2011,5(30):1 032-1 035.
[28] 邢飞跃,赵克森,姜勇.NF-κB的信号通路与阻断策略[J].中国病理生理杂志,2003,19(6): 849-855.
[29] OH Y C,JEONG Y H,HAJH,et al Oryeongsan inhibits LPS-induced production of infiammatory mediators via blockade of the NF-kappaB,MAPK pathways and leads to HO-1 induction in macrophage cells[J]. BMC Complement Altern Med, 2014, 14:242.
[30] BAWADEKAR M,DE ANDREA M,LO CIGNO I,et al.The exteacellular IFIL6 protein propagates inflammation in endothelial cells via p38 MAPK and NF-κBp65 activation[J]. J Interferon Cytokine Res,2015,35(6):441-453
[31] 陈嘉定.大豆皂甙Ba抑制棕榈酸诱导的巨噬细胞炎症反应活性及其机理研究[D].广州:南方医科大学,2016.
PAN Cong1,4, LI Zhandong5*, YUAN Peng2,4, ZHANG Dali1,DUAN Shenglin2,4,XIA Kai2,4,ZHOU Wenxuan2,4, ZHAO Kexin2,4, YU Weihou3
1(School of Food Science and Engineering, Jilin Agricultural University, Changchun 130118,China) 2(China Food Fermentation Industry Research Institute, Beijing 100015,China) 3(Dalian Shuangdi Technology, Dalian 116635,China) 4(Beijing Key Laboratory of the Innovative Development of Functional Staple and the Nutritional Intervention for Chronic Disease, Beijing 100015,China) 5(School of Food Engineering, Jilin Engineering Normal University, Changchun 130052,China)
Abstract This study aimed to investigate the effects of high-nucleotide yeast hydrolysates on the immune activities of macrophages in RAW264.7 cells and the related mechanisms. In vitro cell inflammation model was created by stimulating RAW264.7 cells with 1 μg/mL lipopolysaccharide (LPS). Different concentrations of high-nucleotide yeast hydrolysates were used as interventions to determine their anti-inflammatory effects. ELISA was used to detect the contents of interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α), and interleukin-1β (IL-1β) in cell culture supernatant. Reverse transcription-polymerase chain reaction (RT-PCR) was used to detect related mRNAs, and Western blot was used to detect the levels of iNOS and nuclear transcription factor NF-κBp65 at protein levels in cells. The results showed that ≤150 μg/mL high nucleotide yeast hydrolysates were safe for RAW264.7 cells. Compared with the LPS model with no intervention, 60-150 μg/mL high-nucleotide yeast hydrolysates could significantly enhance the phagocytic ability of RAW264.7 cells, inhibit the releases of NO, TNF-α, IL-1β, and IL-6 inflammatory factors and their related mRNAs in LPS-induced RAW264.7 cells. Besides, iNOS and NF-κB decreased at protein levels. The results confirmed the protective effects of high nucleotide yeast hydrolysates on LPS-induced inflammation in RAW264.7 cells, and the mechanism was related to the NF-κB pathway, which provides a theoretical basis for therapeutic intervention by foods for chronic diseases.
Key words yeast hydrolysate; nucleotide; anti-inflammatory; NF-κB