表1 乳液基本配方
Table 1 The recipe of emulsion
刘建华,杜启伟,丁玉庭*
(浙江工业大学 海洋学院,浙江 杭州,310014)
摘 要 对比分析两性离子型乳化剂——大豆卵磷脂和非离子型乳化剂分子蒸馏单甘酯对高能量乳液体系的作用影响。研究表明,高温杀菌前,大豆卵磷脂和单甘酯都有较好的乳化作用,离心沉淀率、稳定系数、粒径电位和脂肪聚结率等都反应出较好的稳定度。高温杀菌后,单甘酯热稳定性不如大豆卵磷脂,甚至加重了乳液体系失稳,大豆卵磷脂和单甘酯最终离心沉淀率分别为2.89%和10.32%,稳定系数分别为0.995和0.875,平均粒径分别为402和813 nm,脂肪聚结率分别为29.6%和34.23%,结合共聚焦显微呈像,反应出大豆卵磷脂热稳定性更好,质量分数为0.06%就能够达到较好的乳化稳定效果,继续添加提升不明显。
关键词 两性离子型食品乳化剂;大豆卵磷脂;单甘酯;高能量乳液;稳定性
第一作者:博士,副教授(丁玉庭教授为通讯作者,E-mail:dingyt@zjut.edu.cn)。
收稿日期:2018-06-07,改回日期:2018-09-11
DOI:10.13995/j.cnki.11-1802/ts.017982
乳液一般分为O/W或者W/O型,油相作为分散相分散在连续相中,即形成一个水包油型稳定的分散体系[1]。而乳化剂对于形成乳化稳定体系十分重要,单甘酯在椰汁、豆奶、乳饮料中应用较多,大豆卵磷脂一般应用于巧克力和冰淇淋中,在乳液中应用较少。大豆卵磷脂能够兼具乳化和营养作用,但在高能量乳液中缺少关于乳化剂的研究,以大豆卵磷脂代替乳液中常用的乳化剂单甘酯,应用于高能量乳液,是一种比较新颖的尝试。乳液中添加高油脂、高蛋白、高碳水化合物,能够制备成高能量的运动饮品或是医用营养液,而经过较好乳化的乳液则能够提高营养物质吸收率。随着如今工作生活节奏加快,以及人们对于运动及健康的重视,一款既能够代餐又能够快速提供能量的即食饮品需求量也日益提升。
乳化剂可以分为阳离子型、阴离子型、两性离子型及非离子型乳化剂,两性离子乳化剂指在分子结构中同时含有被共价键连接的一个或多个正、负电荷的乳化剂[2]。两性离子型乳化剂相较于其他乳化剂具有乳化和分散效果好,杀菌抑霉作用强,热稳定性好的优点。大豆卵磷脂又称作大豆蛋黄素,是大豆油经过脱胶加工干燥之后沉淀出来的磷脂质,分子蒸馏单甘酯以天然植物油脂为原料,通过将单硬脂酸甘油酯经过分子蒸馏技术提纯后得到,两者作为乳化剂均能够在油和水之间形成稳定界面,使得油水结合形成稳定的分散体系。李冉等[3]研究了不同乳化剂对于花生油乳液稳定性的影响,发现SE15、卵磷脂、单甘酯对于降低粒径及减少脂肪上浮率有显著影响。在常温下,相同添加量的单甘酯比大豆卵磷脂能够起到更好的稳定效果,但是在高温灭菌或者巴氏灭菌下单甘酯是否还能够起到很好的稳定效果,这一点还属未知。SWEENEY等[4]研究了单甘酯和卵磷脂对于模拟婴儿奶粉乳化体系热稳定性的影响,发现单甘酯在加热后会降低乳液稳定性,而卵磷脂会与蛋白形成蛋白质磷脂复合物,从而提高了乳液的热稳定性,但该研究是在140 ℃油浴下进行,对于生产加工灭菌不具有借鉴作用。山野善正等[5]研究了乳化条件对于大豆卵磷脂乳化作用的影响,发现用分散法形成的卵磷脂乳液稳定性比较好,在温度低于60 ℃下也可以保持较好的稳定性,但此研究没有解决60 ℃以上甚至超高温条件下稳定性差的问题。毕爽等[6]研究了大豆分离蛋白与卵磷脂相互作用对于乳液稳定性的影响,发现蛋白与卵磷脂复配比例在10∶1时并在交互作用影响下起到较好的乳化作用。
超高温杀菌一般会使得乳液中的碳水化合物以及蛋白质发生美拉德反应,蛋白质发生变性产生絮凝现象[7]。而热稳定性较高的乳化剂会使得乳液经过超高温灭菌后还保持较稳定的状态。本研究将高温灭菌的条件设置在121 ℃、15 min,研究两性离子型乳化剂大豆卵磷脂与单甘酯在单因素条件下对于高蛋白、高糖、高油的乳液稳定性及热稳定性的影响。
椰子油,菲律宾supercoco;花生油,福临门压榨花生油;玉米油,益海嘉里公司;美国9410乳清蛋白(90%)和酪蛋白酸钠(80%),欣欣化工有限公司;麦芽糊精(DE 16~20),孟州市金玉米有限责任公司;分子蒸馏单甘酯(≥90%,食品级),张家港市中鼎添加剂有限公司;卡拉胶(95%,食品级),肇庆市海星食品工业有限公司;油红O色素(70%),北京百灵威科技有限公司。
高压均质机(NS1001L),意大利Niro Soavi;高速分散机(FA25),上海Fluko流体机械制造有限公司;高压灭菌锅,上海博迅医疗生物仪器股份有限公司;旋转流变仪,荷兰PNAlytical公司;激光粒度分析仪(Marvin),英国Marvin公司;高速离心机(CR21GⅡ),日立Hitachi公司;紫外分光光度计(UV759型),上海奥普勒仪器有限公司;激光共聚焦显微镜,德国卡尔蔡司公司。
1.3.1 基本配方及方法
表1 乳液基本配方
Table 1 The recipe of emulsion

注:a-试验设计添加量为质量分数0.02%~0.08%;b-试验设计添加量为质量分数0.02%~0.08%。
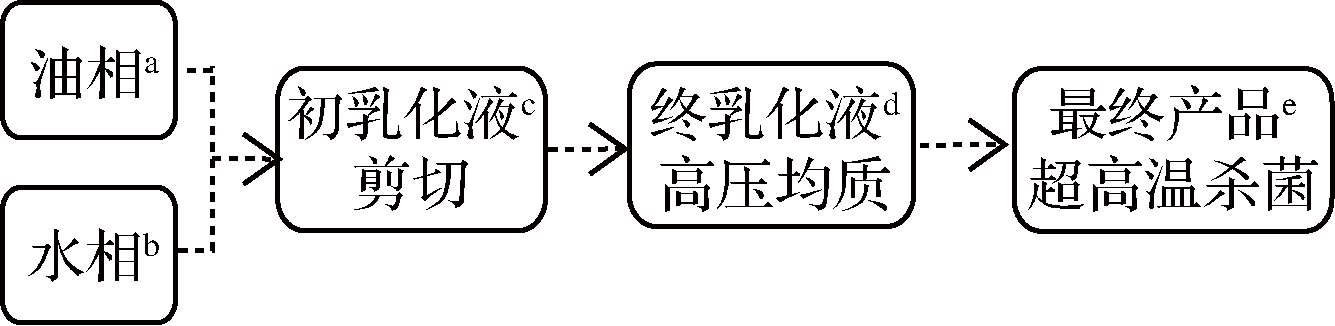
a-原料植物油在75 ℃下混合,边搅拌边加入单甘酯;b-去离子水在55 ℃条件下分别加入麦芽糊精、卡拉胶、乳清蛋白、酪蛋白酸钠、大豆卵磷脂;c-剪切速率7 000 r/min,剪切时间1 min;d-均质压力200 bar,均质次数2次;e-杀菌温度121 ℃,杀菌时间15 min
图1 乳液制作工艺流程图
Fig.1 Flow chart of emulsion preparation
1.3.2 离心沉淀率的测定
参照吴金鋆[8]的方法将放置一段时间的饮料摇匀后准确称取20 g样品,于3 000 r/min离心15 min,称取离心管底部的沉淀物质量,每个样品3次重复,通过公式(1)计算离心沉淀率:
离心沉淀率![]()
(1)
1.3.3 稳定系数的测定
将放置一段时间的饮料摇匀,准确称取20 g样品,3 000 r/min离心15 min,吸取0.2 mL中间的乳清相,用去离子水按体积比1∶30稀释,在其520 nm波长下测定吸光值A。直接摇匀饮料,吸取乳液同上述稀释,测定吸光值A0,以A/A0(≤1)来表示饮料的稳定性系数,值越大说明微体系越稳定。
1.3.4 粒度分布的测定
采用去离子水作为分散相,乳浊液样品按质量比1∶1 000稀释[9],用滤纸过滤除去大颗粒不溶物,以避免误差。用动态光散射粒径分析仪确定颗粒尺寸分布,在粒度分布的计算中采用1.414的折射率(颗粒的折射率/周围液体的折射率)。每个样品测定3次,取平均值。
1.3.5 ZETA-电位的测定
取过滤后的乳液稀释后,采用电位分析仪测定乳液中油滴的ZETA-电位、颗粒流动性和电导率。每个样品测定3次,取平均值。
1.3.6 激光共聚焦显微呈像
参照DONG等的方法[10]将摇匀后的乳液取出5 mL于10 mL离心管中,分别加入尼罗红染液(以丙酮为溶剂,质量浓度为0.25 mg/mL)20 μL,固绿染液(质量浓度为10 μg/mL)50 μL,振荡摇匀,避光保存。取50 μL染过的乳液于干净的载玻片上,盖上盖玻片,避光放置15~20 min,将载玻片放置于40倍油镜下观察(尼罗红激发波长为488 nm,固绿激发波长为633 nm)
1.3.7 脂肪球部分聚结率的测定
参照PALANUWECH等[11]的方法,精确称取油红O色素0.005 g,加至500 g玉米胚芽油中,在室温25 ℃下慢速搅拌12 h,使油红O色素充分溶解,制备的油红O色素溶液避光保存。准确称取奶油(未搅打或打发后)样品40 g,油红O色素溶液20 g,用药匙反复搅拌混合均匀,10 000×g,30 ℃离心30 min,离心后立即移取上层红色油液,相同条件下再次离心,移取上层红色油液,加入比色皿,在520 nm波长条件下测定吸光度值。
在离心力和重力的作用下,奶油乳浊液中的游离脂肪会溶解在油红O色素溶液中,并稀释了色素,从而导致油红O色素吸光度的改变,由公式(2)计算出脂肪球的部分聚结率:
![]()
(2)
式中:Φd是脂肪球部分聚结率;m0是添加的染料溶液的质量;me是乳液的质量;φ是奶油中油脂的质量分数;a是在萃取过程之前和之后测量的油红O色素的吸光度的比率。
1.3.8 表观黏度的测定
参照李伟伟[12]的方法,采用Kinexuslab旋转流变仪进行流变测试,转子型号为PP25,测试温度均为25 ℃。所有流变测试的数据采用orgin 8.6软件进行分析处理。加样后将转子降至指定高度进行测定,每个样品重复3次,取平均值。设定剪切速率为1~300 s-1,以线性取点方式采集数据,采集数为300。采用剪切速率为横坐标,表观黏度为纵坐标,绘制剪切速率与表观黏度的关系图。
采取完全随机试验,重复3次,数据分析与结果绘图分别采用SPSS 17.0和Origin 8.0软件,数据均以平均值±标准差表示,方差分析采用Duncan法,显著性水平为0.05。
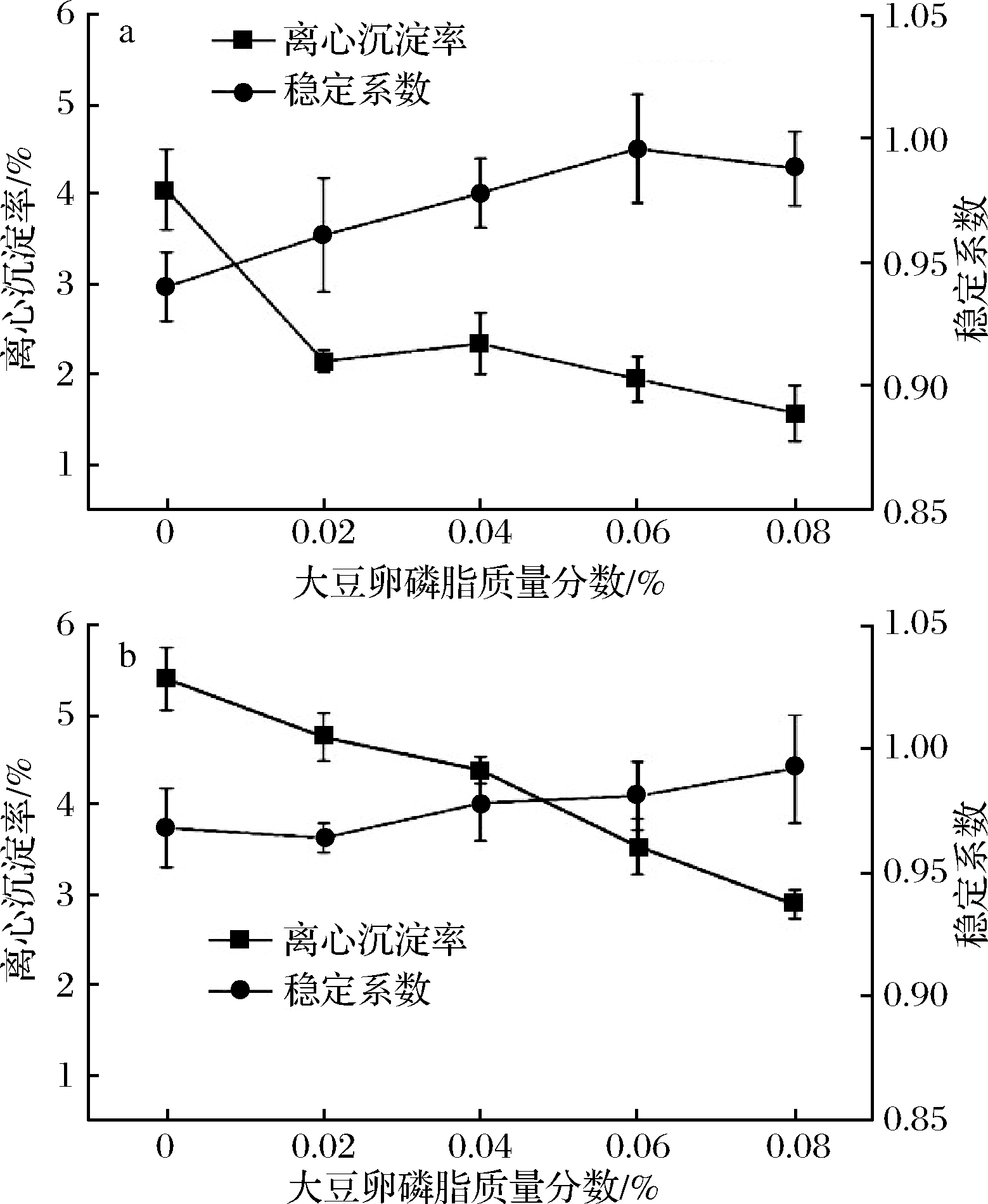
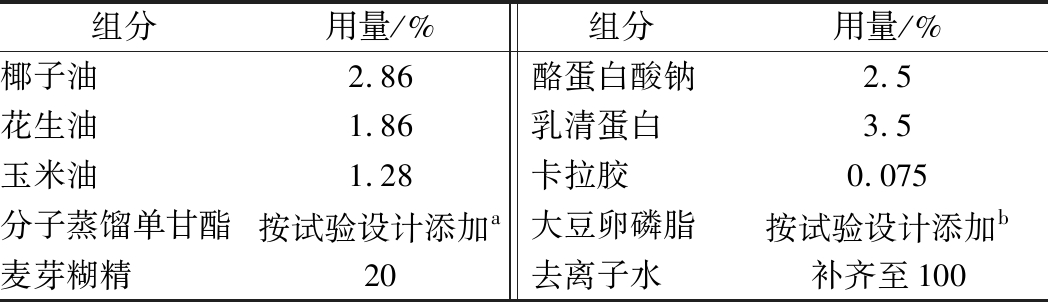
a-大豆卵磷脂;b-经121 ℃,15 min杀菌处理大豆卵磷脂
图2 大豆卵磷脂对乳液的乳化稳定性影响
Fig.2 Effect of soybean lecithin on emulsification stability
of emulsion
在高速离心后,离心沉淀量越少,稳定系数越高。由图2可以看出,随着大豆卵磷脂质量分数增加,乳液整体的离心沉淀率呈下降趋势。一方面由于大豆卵磷脂在乳液的溶解性好,另一方面也由于其在油脂和水相之间结合度高。在添加至质量分数0.06%时,离心沉淀率达到2%以下。大豆卵磷脂添加量上升,稳定性也是呈现上升趋势,并且稳定系数基本都在0.95以上,大豆卵磷脂添加质量分数0.06%,稳定系数可以达到0.996,此时乳液离心稳定性最高。而质量分数为0.08%的乳液稳定系数有所下降,说明此时油脂可能被大豆卵磷脂结合了,过量的大豆卵磷脂溶解并且分散于水相中,导致离心后的乳液中间层浊度上升[13]。
由图3可以看出,在单甘酯添加量上升时,乳液整体离心沉淀率不断下降,在添加量为0.02%时,离心沉淀率达到2%左右;继续添加,下降程度不明显。说明单甘酯在较少量的情况下就能达到比较好的离心稳定性,添加量达到0.08%时,离心沉淀率上升,说明过量的单甘酯由于不溶于冷水,与其他未结合的蛋白一起沉淀于底部。
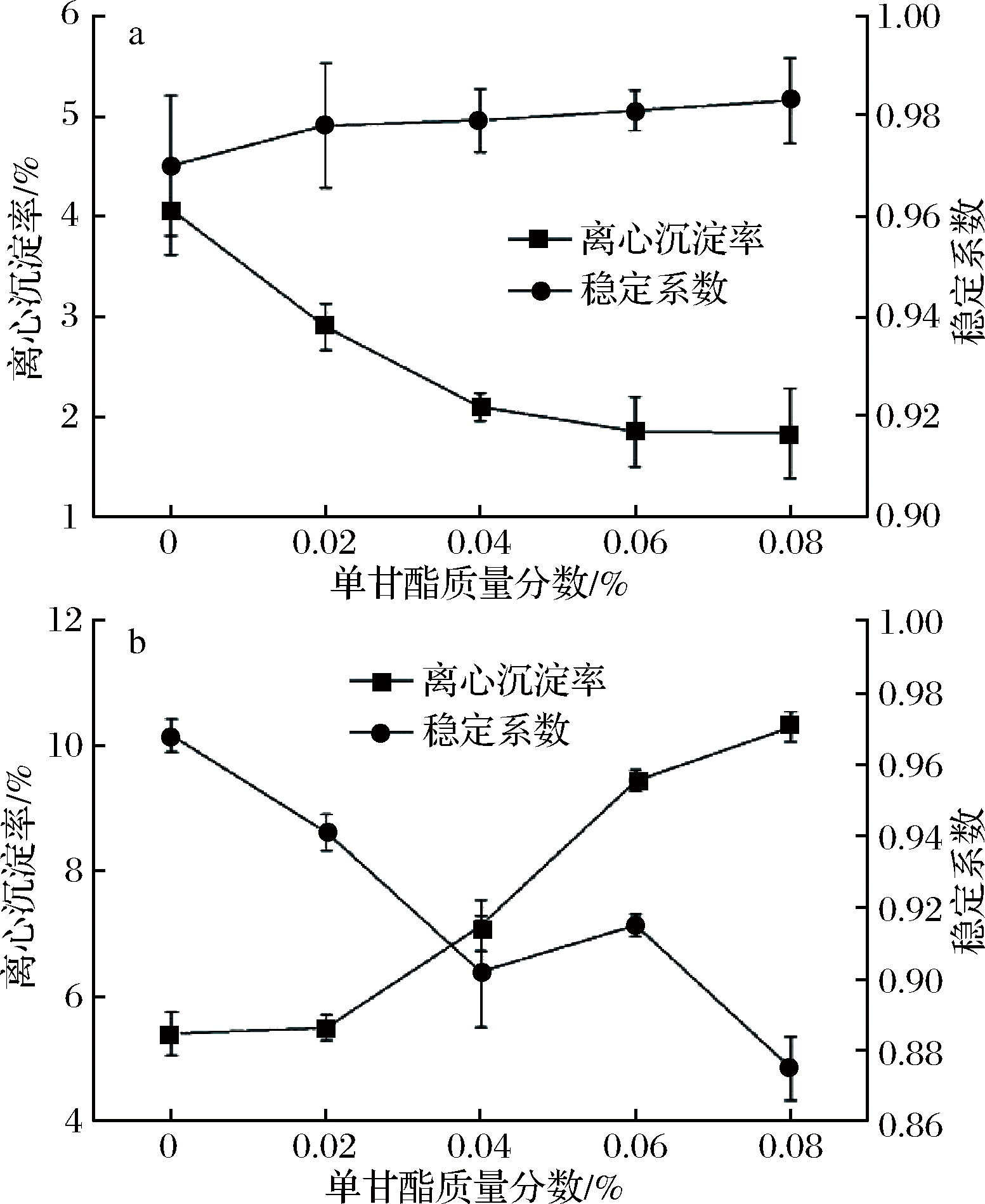
a-单甘酯;b-经121 ℃,15 min杀菌处理的单甘酯
图3 单甘酯对乳液的乳化稳定性影响
Fig.3 Effect of monoglyceride on emulsification stability of emulsion
稳定系数同样随着单甘酯添加量上升而上升,在添加量达到0.02%后,稳定系数上升程度不明显,这也印证了少量单甘酯就能够达到较好的离心稳定性[14]。经过121 ℃、15 min杀菌处理后,2种乳化剂的乳液离心沉淀率较杀菌前均有所上升,并且离心稳定系数较杀菌前都有所下降。从图2-b和图3-b可以看到,添加大豆卵磷脂的乳液随着添加量的上升,离心沉淀率不断下降,并且稳定系数不断上升。而添加单甘酯的乳液,离心沉淀率反而不断升高,稳定系数不断下降。从外观也能看出,热杀菌后的乳液有较明显的絮凝现象,导致沉淀增多,稳定系数下降。因此从热杀菌的效果来看,大豆卵磷脂热稳定性较好。
平均粒径和粒径分布反应了乳液体系中脂肪球体积大小以及均一程度,体积越小,均一程度越高,说明乳液稳定性越高。从图4可以看出,在热杀菌前,随着乳化剂浓度上升,粒径不断下降,说明乳化剂的添加能够提高乳液脂肪球分散,使得脂肪与水相更好地结合,减少乳液的分层。而添加大豆卵磷脂的乳液比添加分子蒸馏单甘酯的乳液平均粒径小,说明大豆卵磷脂的乳化效果比分子蒸馏单甘酯更突出,最终平均粒径基本达到250 nm左右[15]。
而经过121 ℃、15 min处理后的乳液,可以明显发现乳液整体平均粒径急剧上升,尤其添加分子蒸馏单甘酯的乳液,说明分子蒸馏单甘酯热稳定性比较差,在超高温杀菌处理后,乳液絮凝状况随着分子蒸馏单甘酯添加量增加更显严重,粒径上升主要由于在油脂周围产生蛋白质聚集导致。添加大豆卵磷脂的乳液虽然在超高温灭菌后粒径也大幅度上升,但是在大豆卵磷脂浓度上升时,粒径却不断变小,最终达到400 nm,因此大豆卵磷脂热稳定性更好。从图5-a可以看到,大豆卵磷脂在不同添加量下,粒径分布均一程度不同,分布均一程度越高,表明油脂分散更加均匀,不容易出现部分脂肪聚集导致整体乳液失稳,添加质量分数0.06%和未添加大豆卵磷脂的乳液分布比较均一,但由于添加质量分数0.06%的乳液粒径分布更小,因此大豆卵磷脂添加量在0.06%时最稳定。从图5(c-d)可以看出,常温下,添加0.02%的单甘酯和未添加单甘酯的粒径分布比较均一,而添加量为0.02%时,乳液粒径分布更小,但均一程度大幅下降[16]。经过121 ℃、15 min灭菌处理后,添加单甘酯的乳液粒径分布曲线都在未添加单甘酯乳液粒径的右边,说明单甘酯在超高温灭菌处理后,不利于乳液的稳定,而添加量为0.02%的乳液,在超高温灭菌条件下相对粒径分布会小一些。
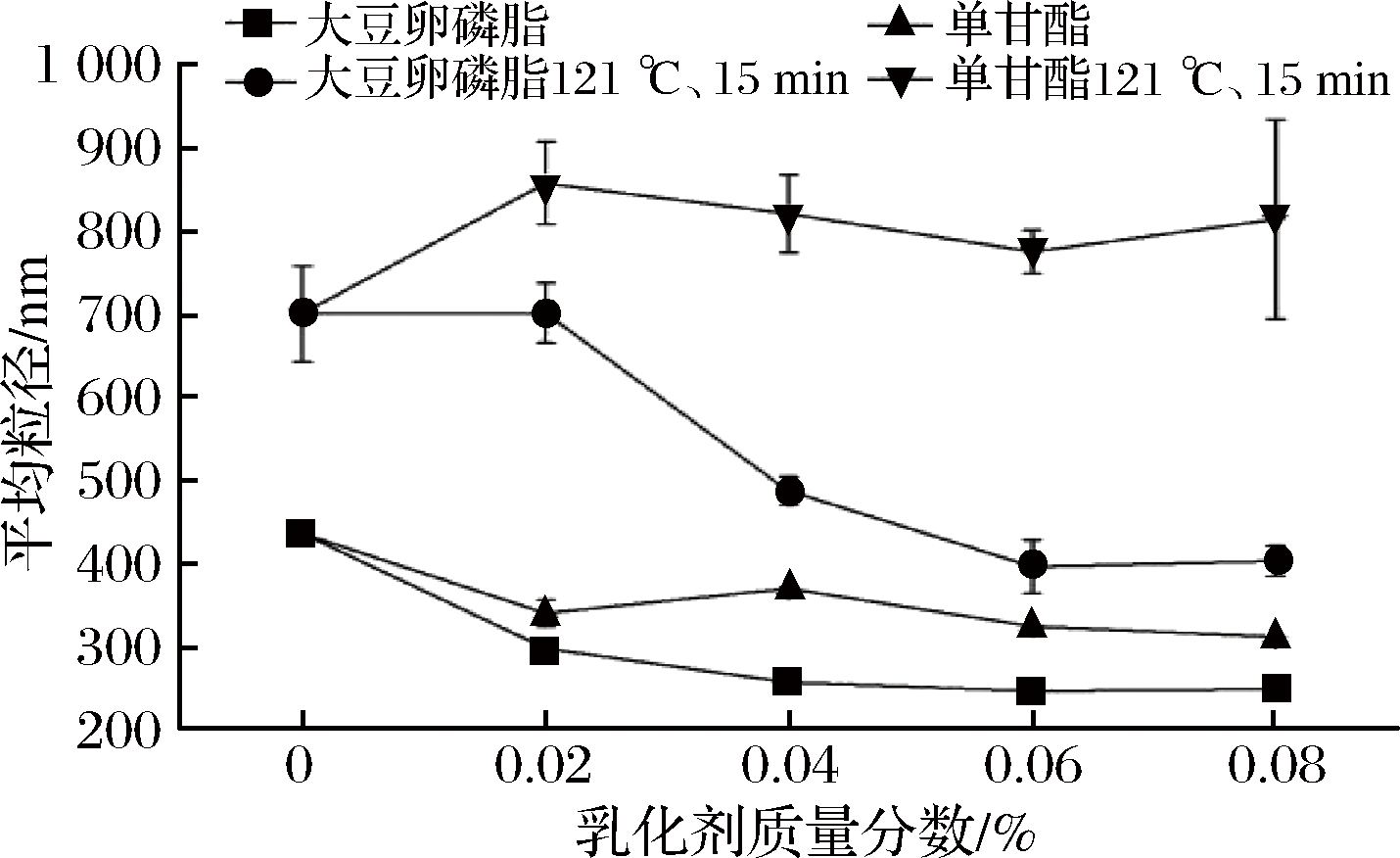
图4 添加不同质量分数乳化剂的乳液平均粒径变化
Fig.4 Changes of average particle size of emulsions with different emulsifier concentration

a-大豆卵磷脂;b-经121 ℃,15 min杀菌处理大豆卵磷脂;c-单甘酯;d-经121 ℃,15 min杀菌处理单甘酯
图5 不同乳化剂浓度下的乳液粒径分布变化
Fig.5 Changes of particle size distribution of emulsions with different emulsifier concentrations
Zeta电位反映了乳液的电荷情况,本研究最终pH值都达到中性条件,此时比蛋白质等电点大,在不同pH下多糖一般都带负电荷,蛋白和多糖带相斥电荷可以防止油脂相互吸附聚集,因此电位的绝对值越大,说明乳液越稳定[17]。从图6可以看出,在热杀菌前,添加单甘酯的乳液随着浓度上升,电位略微上升,并且绝对值保持在较高的数值,而添加大豆卵磷脂的乳液在常温下电位和添加单甘酯的乳液差异不大,均保持在绝对值40 mv左右[18]。然而在经过121 ℃、15 min灭菌处理后,大豆卵磷脂依旧随着浓度的提高,电位绝对值不断上升,而添加单甘酯的乳液在乳化剂质量分数为0.04%后,电位开始下降,并且相比于热杀菌前,下降程度高,电位绝对值整体比大豆卵磷脂低。这也印证了粒径测定的结果,单甘酯在超高温条件下,稳定性很差,而大豆卵磷脂稳定性更好。

图6 不同质量分数乳化剂的乳液Zeta电位变化
Fig.6 Change of Zeta potential in emulsion with different emulsifier concentrations
蛋白质和油脂染色后,在共聚焦显微镜下能够清晰区分开来,通过图7(a-d)可以发现,红色脂肪球随着单甘酯浓度的增加而变小,蛋白质分布比较均匀,没有明显的蛋白聚集从而导致的部分区域绿色亮度激增的现象。这与上述的平均粒径以及粒径分布结果一致。然而当经过121 ℃、15 min处理后,可以从图7(e-h)看到,在红色的脂肪球周围产生许多黄色不规则块状物质以及亮度很高的绿色不规则物质,说明此时蛋白质在脂肪球周围产生凝聚,脂肪球周围蛋白质浓度很高,而由于红色脂肪球与绿色蛋白质重合,导致产生黄色不规则块状[19]。当单甘酯质量分数达到0.08%时,乳液整体絮凝严重甚至从流体变成凝固体。蛋白质的絮凝与脂肪球形成聚合物,说明单甘酯在超高温的条件下,热稳定性差,不仅起不到乳化的作用,反而加重了蛋白质的絮凝,使得乳液失稳[20]。

(a)-(d)单甘酯质量分数0.02%、0.04%、0.06%、0.08%;(e)-(h)经121 ℃、15 min杀菌,单甘酯质量分数0.02%、0.04%、0.06%、0.08%
图7 单甘酯对乳液共聚焦显微成像的影响
Fig.7 Effect of monoglyceride on emulsion confocal microscopy imaging
从图8(a-d)可以看到常温下,添加大豆卵磷脂的乳液随着大豆卵磷脂浓度的上升,红色脂肪球不断变小,绿色蛋白质分布比较均匀,没有明显的蛋白聚集导致的部分区域绿色亮度激增的现象。而经过121 ℃、15 min处理后,可以从图8(e-h)看到,红色脂肪球周围产生了蛋白质聚集,出现黄色不规则块状体,但是相对于单甘酯,其蛋白质聚集明显少了很多,并且这种蛋白聚集现象随着大豆卵磷脂浓度的上升而减少,这与添加大豆卵磷脂的乳液平均粒径以及粒径分布结果一致。

(a)-(d)大豆卵磷脂质量分数0.02%、0.04%、0.06%、0.08%;(e)-(h)121 ℃、15 min大豆卵磷脂质量分数0.02%、0.04%、0.06%、0.08%
图8 大豆卵磷脂对乳液共聚焦显微成像的影响
Fig.8 Effects of soy lecithin on emulsion confocal microscopy imaging
如图9所示,热杀菌前未添加乳化剂的脂肪部分聚结率高达49.56%,但添加一定量的乳化剂后,脂肪部分聚结率明显降低,单甘酯质量分数达到0.06%后,脂肪部分聚结率变化不大,单甘酯已经在油脂界面上吸附完全,阻止了脂肪球互相碰撞聚结,最后脂肪聚结率趋于定值,保持在20%左右。而添加大豆卵磷脂的乳液,脂肪部分聚结率总体会比添加单甘酯的要小,最终脂肪聚结率达到10%以下。在经过121 ℃、15 min超高温灭菌处理后,乳液的脂肪部分聚结率均大幅提高,一方面高温处理对于蛋白质产生变性作用,蛋白变性后与油脂界面脱离,另一方面乳化剂在高温处理后分解或者发生反应,使得油脂容易碰撞聚集。在超高温灭菌处理后,脂肪聚结率都显著上升,而添加大豆卵磷脂的乳液比单甘酯脂肪部分聚结率低,这与常温时的规律相同,并且最终脂肪部分聚结率达到30%以下[15]。
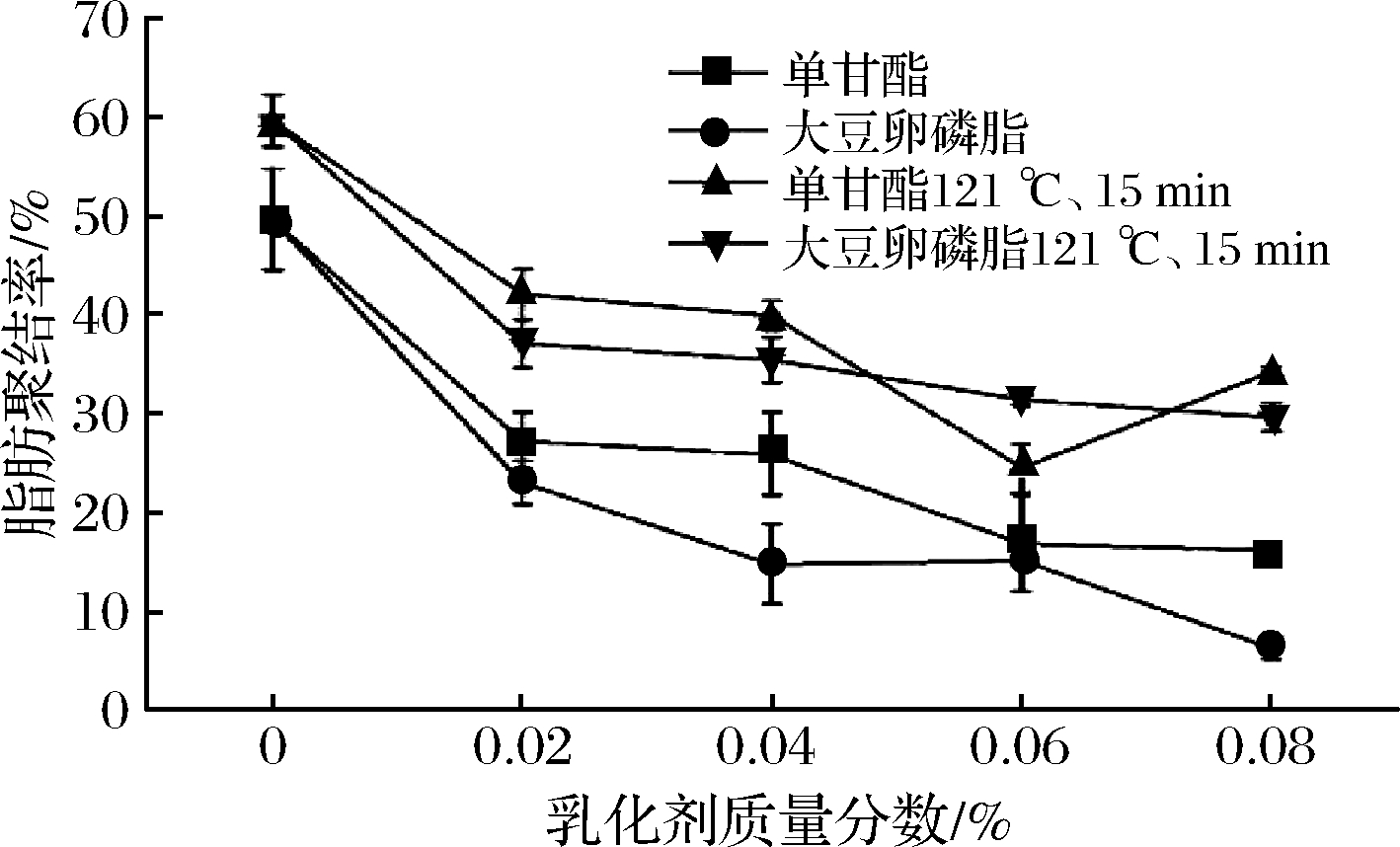
图9 添加不同质量分数乳化剂的乳液脂肪聚结率变化
Fig.9 Changes of partial fat coalescence rate of emulsions with different emulsifier concentrations
剪切黏度反应了乳液在剪切速率不断上升时是牛顿流体还是非牛顿流体,一般来说牛顿流体呈现剪切变稀的假塑性。黏度越高,由于黏度带来的阻力,乳液中脂肪球的迁移率就会下降,脂肪迁移率下降就减少了脂肪球之间相互碰撞的几率,也就减少了由于脂肪球聚集而产生的分层失稳现象。从图10可以看到,添加大豆卵磷脂,乳液的黏度增加不多,添加质量分数0.04%以及0.06%的乳液黏度更高,并且比较接近,而添加质量分数0.02%以及0.08%的乳液相对黏度较低。添加质量分数0.02%乳液黏度低,可能由于油脂没有与水相完全乳化结合,使得黏度接近没有添加大豆卵磷脂的乳液。而添加质量分数0.08%的乳液黏度低,可能是由于大豆卵磷脂在浓度高时会对蛋白质空间构型产生一定压缩影响,降低了整体体系黏度。而单甘酯添加后的黏度下降,可能与其对蛋白质的肽链亲水性产生影响,高蛋白质、高油脂、高碳水化合物乳液体系中乳化剂作用机制有待于后续进一步研究。

a-大豆卵磷脂;b-单甘酯
图10 添加不同乳化剂质量分数的乳液剪切黏度变化
Fig.10 Changes of emulsion shear viscosity at different emulsifier concentrations
热杀菌前,随着大豆卵磷脂和单甘酯质量分数上升,离心沉淀率从(4.06±0.45)%降至(1.57±0.31)%和(1.83±0.45)%,平均粒径从(435.55±4.6)nm降至(248.1±5.3)nm和(310.5±0.71)nm。对照共聚焦显微成像可以看出,染红的脂肪球粒径维持在较小的水平,并且随乳化剂质量分数上升变化不明显。脂肪部分聚结率从(49.63±5.18)%降至(16.12±0.01)%和(6.24±1.14)%。Zeta电位维持在-38~-40 mV,质量分数的提高没有增加Zeta电位的绝对值。添加大豆卵磷脂的乳液黏度较高。因此热杀菌前大豆卵磷脂的稳定性更好。
在经过121 ℃、15 min灭菌处理后,随着大豆卵磷脂和单甘酯质量分数上升,离心沉淀率分别从(5.41±0.35)%降至(2.89±0.16)%和(10.78±0.15)%,随大豆卵磷脂质量分数上升,平均粒径从(700.3±57.56)nm降至(395.6±31.96)nm,而单甘酯质量分数上升,平均粒径从(700.3±57.56)nm上升至(857.53±49.72)nm。对照共聚焦显微成像中的红色脂肪球显示出和平均粒径相同的规律。Zeta电位规律性不明显。脂肪部分聚结率从(59.65±2.64)%降至(29.60±1.45)%和(34.23±0.5)%。因此单甘酯的热稳定性较差,大豆卵磷脂在热杀菌后还能够为乳液体系提供较好的稳定性。
参考文献
[1] 郭丽. 再生纤维素饮料乳液的制备、表征及其稳定性研究[D].南京:南京农业大学,2015.
[2] 邓伶俐,余立意,买尔哈巴·塔西帕拉提,等.纳米乳液与微乳液的研究进展[J].中国食品学报,2013,13(8):173-180.
[3] 李冉,白婧,冷小京,等.花生油乳液稳定特性研究[J].中国奶牛,2009(7):39-42.
[4] MC SWEENEY S L, HEALY R, MULVIHILL D M. Effect of lecithin and monoglycerides on the heat stability of a model infant formula emulsion[J]. Food Hydrocolloids, 2008,22(5):888-898.
[5] 山野善正,陈葆新.乳化条件对大豆卵磷脂乳化作用的影响[J].食品工业科技,1985,6(6):30-36.
[6] 毕爽,朱颖,齐宝坤,等.大豆分离蛋白与卵磷脂间相互作用对O/W型乳状液稳定性的影响[J].食品科学,2017,38(9):79-84.
[7] 吕瑞娜,王莉君,邵平平,等.超高温灭菌乳货架期品质稳定性变化研究[J].农产品加工(学刊),2011(10):33-35.
[8] 吴金鋆. 复合全豆植物蛋白饮料的稳定性及流变特性研究[D].广州:华南理工大学,2010.
[9] SCHOKKER E P, DALGLEISH D G. The shear-induced destabilization of oil-in-water emulsions using caseinate as emulsifier[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 1998, 145(1-3):61-69.
[10] DONG HYEOP HAN, SANGMEE PARK, EUN JOONG KIM,et al. In situ confocal microscopy of electrochemical generation and collision of emulsion droplets in bromide redox system[J]. Electrochimica Acta, 2017, 252(20):
164-170.
[11] PALANUWECH J, POTINENI R, ROBERTS R F, et al. A method to determine free fat in emulsions[J]. Food Hydrocolloids, 2003, 17(1):55-62.
[12] 李伟伟. 高乳化性大豆蛋白的制备及其界面流变性质的研究[D].无锡:江南大学,2017.
[13] 陈龙,林艳春,王冬梅,等.不同大豆蛋白卵磷脂相互作用对乳化特性的影响[J].食品工业,2018,39(2):222-225.
[14] 龙肇,赵强忠,赵谋明.单甘酯和蔗糖酯复配比例对核桃乳稳定性的影响[J].食品与发酵工业,2009,35(5):181-184.
[15] 余权.乳化剂对酪蛋白乳状液稳定性影响的机理研究[D].广州:华南理工大学,2011.
[16] 邝婉湄,赵谋明,赵强忠.单甘酯对酪蛋白乳浊液稳定性的影响[J].食品工业科技,2012,33(16):131-133;137.
[17] RAVINDRAN S, WILLIAMS M A K, WARD R L,et al. Understanding how the properties of whey protein stabilized emulsions depend on pH, ionic strength and calcium concentration, by mapping environmental conditions to zeta potential[J].Food Hydrocolloids,2018,79:572-578.
[18] 徐明进,李明远,彭勃,等.Zeta电位和界面膜强度对水包油乳状液稳定性影响[J].应用化学,2007(6):623-627.
[19] FAHMI WAN MOHAMAD W A, ROMAN BUCKOW, MARYANN AUGUSTIN,et al. In situ quantification of β-carotene partitioning in oil-in-water emulsions by confocal Raman microscopy[J]. Food Chemistry, 2017,233(15):197-203.
[20] ZHANG Li, LI Zhenbang, WANG Lei,et al. High temperature stable W/O emulsions prepared with in-situ hydrophobically modified rodlike sepiolite[J]. Journal of Colloid and Interface Science, 2017,493(1):378-384.
LIU Jianhua,DU Qiwei,DING Yuting*
(Ocean College,Zhejiang University of Technology,Hangzhou 310014,China)
Abstract The effects of zwitterionic emulsifier-soy lecithin and nonionic emulsifier-molecular distillation monoglyceride on the high energy emulsion system were compared and analyzed. The results showed that both soybean lecithin and monoglyceride had good emulsifying ability before high temperature sterilization. The centrifugal sedimentation rate, stability coefficient, particle size potential, and fat coalescence rate were all showed good stability. After high temperature sterilization, the thermal stability of monoglyceride was not as good as soybean lecithin, and the emulsion system with monoglyceride was even more unstable. The final centrifugal precipitation rates of soybean lecithin and monoglyceride were 2.89% and 10.32%, respectively. The stability coefficients of soybean lecithin and monoglyceride were 0.995 and 0.875, respectively. The average particle sizes of soybean lecithin and monoglyceride were 402 nm and 813 nm, respectively. The fat aggregation rates of soybean lecithin and monoglyceride were 29.6% and 34.23%, respectively. In combination with the confocal microscopy, the thermal stability of soybean lecithin was better, and 0.06% soybean lecithin could achieve better stable emulsifying effect. However, the stability of the emulsion did not increase significantly when the concentration of soybean lecithin was above 0.06%.
Key words zwitterionic emulsifiers; soybean lecithin; monoglycerides; high energy emulsion; stability