黄酒,是用糯米、黍米等为原料,加入酒曲、酒母等糖化发酵剂酿制而成的一种发酵酒,与啤酒、葡萄酒并称为世界三大古酒[1-3]。黄酒富含多种氨基酸、微量元素、有机酸等营养物质[4-6],有抗衰老、降血压、降胆固醇和免疫调节等作用[7-10]。我国传统的黄酒主要以甜型和半甜型为主,随着人们保健意识的提高,低糖型黄酒的开发成为相关研究人员关注的热点。酵母菌在黄酒酿造过程中起着至关重要的作用,传统酿造的客家黄酒糖化程度高,过高的糖度抑制酵母的生长繁殖,从而抑制酒精度的提高。抗逆性能优良的酵母菌能够提升黄酒的品质,具有很大的研究价值[11-12]。
杨鲁君[13]利用高糖环境(40%糖浓度的培养基)从发酵醪液中筛选到优良菌株F-18,该菌株在产酒精量上和工厂菌株相差不多,产酒率高于工厂菌株,且总酸、氨态氮和非糖固形物也高于工厂菌株,但总糖含量与工厂菌株基本上相差不多。夏艳秋等[14]对原始菌株YS分别采用乙醇-热冲击法、细胞紫外诱变法和原生质体紫外诱变法,结合高温驯育进行选育,筛选到1株在38 ℃能正常生长发酵的黄酒酵母突变株YS6.2.5,该菌株在30 ℃时产酒精能力、酒精耐性、高糖耐性分别为9.0%、19%、30 °Bx,38 ℃时相应指标分别为6.5%、20%、28 °Bx。谢广发等[15]采用TTC法、CO2失重法及酿酒试验,筛选出菌种GY-9,并把该菌种投入到黄酒生产,发现该菌种能缩短发酵周期,提高黄酒的酒精度。
本研究在黄酒生产过程中添加蜂蜜接合酵母LGL-1,该菌株能更好地在高糖环境下发酵产酒精,可提高酒精发酵的效率。将该酵母应用于广东黄酒酿造中,可得到糖度低、酒精度高、口味醇厚的黄酒。为确定酵母的最佳添加量、添加时间以及水添加量和前发酵时间,借助Design-Expert软件设计中心复合试验设计组合设计法(central composite design,CCD)设计响应面试验,对生产工艺进行优化,以期提高设备利用率及经济效益,为工业化生产提供一定的理论依据。
酒曲、麦曲、红曲:河源黄龙紫金酒业有限公司提供;白糯米:市售;麦芽汁培养基:广东凯瑞微生物科技有限公司;蜂蜜接合酵母LGL-1:仲恺农业工程学院实验室筛选出的耐高糖酵母菌株。
HZQ-C空气浴振荡器,哈尔滨市东明医疗仪器厂;JJ600精密电子天平,常熟双杰测试仪器厂;722-G紫外可见分光光度计,上海仪电分析仪器有限公司;DHP-9602恒温培养箱,上海-恒科学仪器有限公司;HH-4数显恒温水浴锅,常州澳华仪器有限公司;酒精比重计(0~50%),余姚市方桥试验仪表厂。
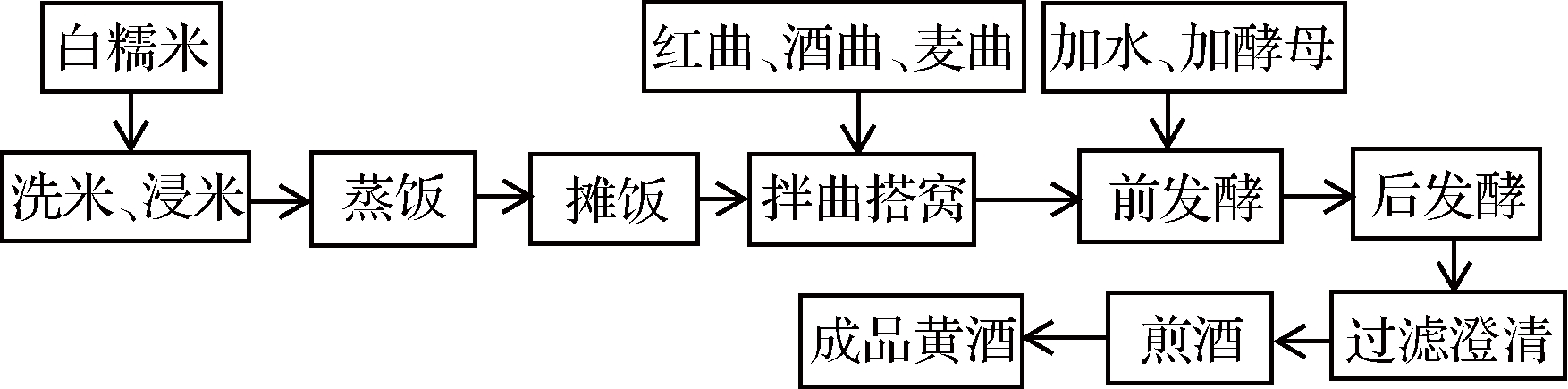
1.2.1 黄酒酿造的工艺流程[16-18]

1.2.2 蜂蜜接合酵母LGL-1生长曲线的测定
从低温保藏酵母中挑取两环接种于70 °Bé麦芽汁培养基的试管中,在28 ℃、170 r/min的摇床中培养2 d,然后将蜂蜜接合酵母LGL-1全部转移到相同培养基的锥形瓶中于相同环境下继续培养。
采用比浊法对酵母菌生长曲线进行测定。每隔6 h取2 mL菌悬液,将比色皿置于紫外可见分光光度计560 nm处测量OD值,对照组为不加酵母菌的麦芽汁培养基。以酵母菌培养时间为横坐标,酵母菌悬菌液OD值为纵坐标绘制生长曲线。
1.2.3 理化指标测定
总糖、酒精度:均参照GB/T 13662—2018《黄酒》[1]国家标准中规定的方法测定。
1.2.4 影响黄酒发酵工艺的单因素试验
1.2.4.1 酵母添加量对广东黄酒发酵的影响
固定酵母添加时间(即添加酵母时黄酒发酵的时间)为48 h,前发酵时间为7 d,不加水,100 g干米中分别添加酵母0、2、3、4、5、7、9 mL。以糖度和酒精度为指标考察酵母添加量对黄酒的影响。
1.2.4.2 酵母添加时间对广东黄酒发酵的影响
固定酵母添加量为4 mL,前发酵时间为7 d,不加水,分别选取酵母添加时间为42、48、54、60、66、72 h。 以糖度和酒精度为指标考察酵母添加时间对黄酒的影响。
1.2.4.3 水添加量对广东黄酒发酵的影响
固定酵母添加量为4 mL,酵母添加时间为54 h,前发酵时间为7 d,分别选取加水量为干米总质量的0%、10%、20%、30%、40%、50%、60%、70%。以糖度和酒精度为指标考察水添加量对黄酒的影响。
1.2.4.4 前发酵时间对广东黄酒的影响
固定酵母添加量为4 mL,酵母添加时间为54 h,加水量为70%,分别选取前发酵时间为6、7、8、9、10、11、12 d。以糖度和酒精度为指标考察前发酵时间对黄酒的影响。
1.2.5 响应面优化黄酒发酵工艺
在单因素试验结果的基础上,借助Design-Expert软件,采用中心复合试验设计原理,选取酵母添加量(A)、酵母添加时间(B)、水添加量(C)和前发酵时间(D)为响应面优化的考察量,以酒精度(Y)为响应值,设计4因素3水平的响应面试验对黄酒发酵工艺进行优化。响应面试验因素水平见表1。
表1 响应面试验因素水平
Table 1 Factors and levels of response surface experiment
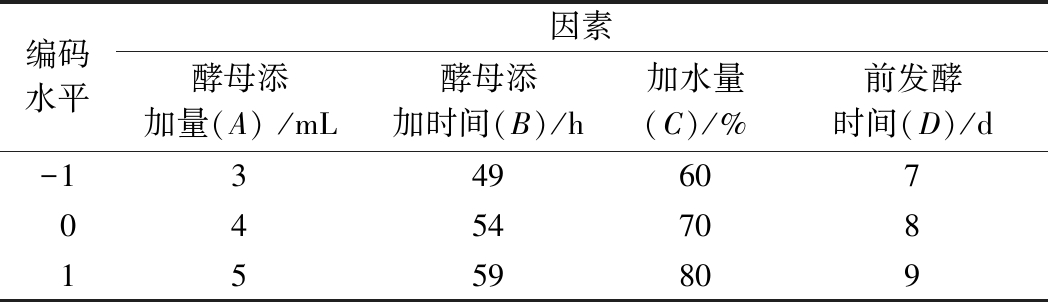
编码水平因素酵母添加量(A) /mL酵母添加时间(B)/h加水量(C)/%前发酵时间(D)/d-134960704547081559809
由图1可知,在培养基糖度为700 g/L时,0~20 h 是蜂蜜接合酵母LGL-1的迟滞期,酵母数量增长缓慢,20 h左右进入对数生长期,50 h后基本进入稳定期,该酵母迟滞期相对较短,对数生长期和稳定期较长,运用于实际生产中可节约一定的成本。综上所述,选择50 h作为蜂蜜接合酵母LGL-1的最佳培养时间,即蜂蜜接合酵母LGL-1培养50 h后加入黄酒中发酵。
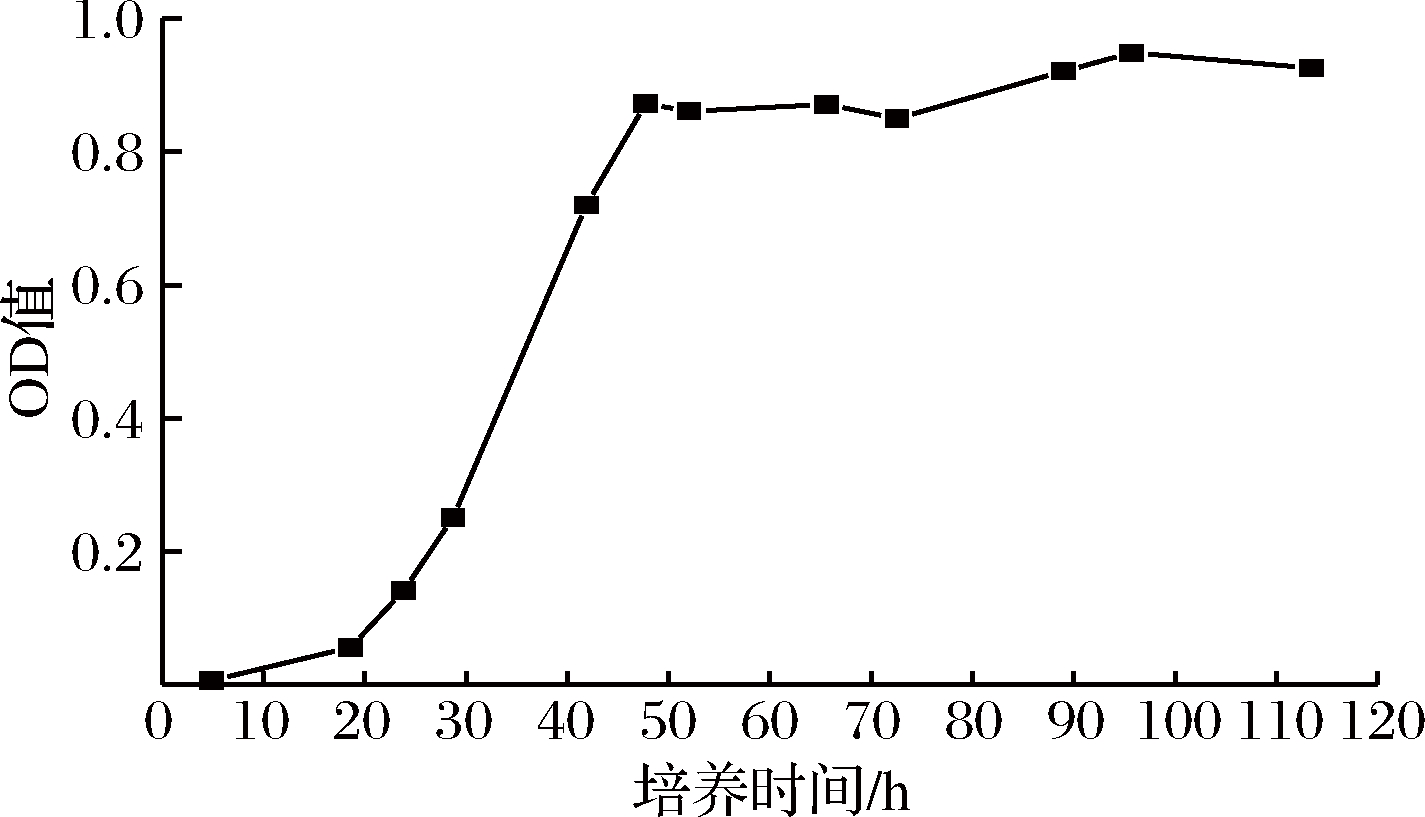
图1 蜂蜜接合酵母LGL-1的生长曲线
Fig.1 Growth curve ofZygosacharomyces mellis LGL-1
2.2.1 酵母添加量对广东黄酒的影响
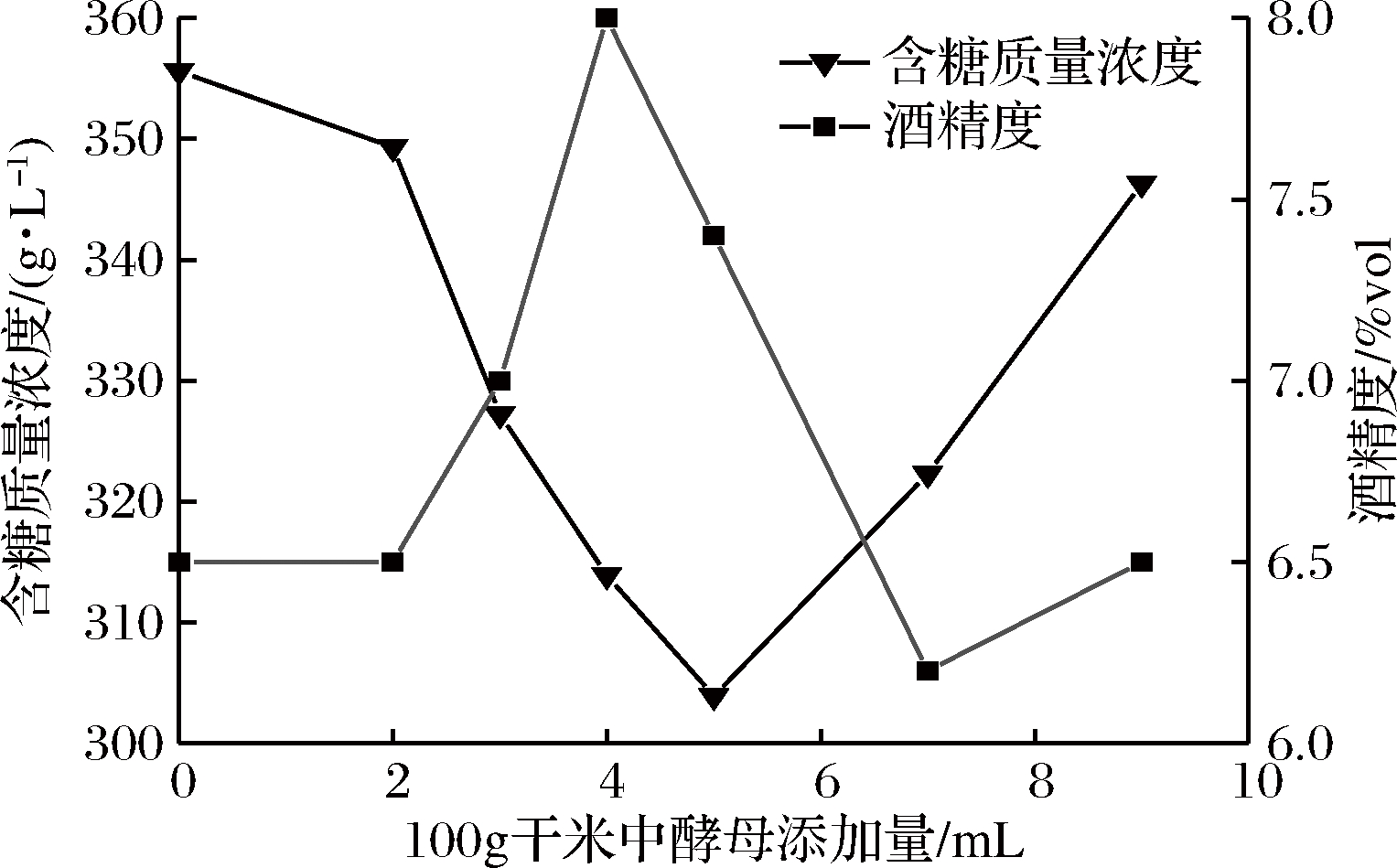
图2 酵母添加量对广东黄酒糖度和酒精度的影响
Fig.2 Effect of theZygosacharomyces mellis LGL-1 addition on the sugar content and alcohol content of yellow rice wine
图2是酵母添加量与黄酒糖度和酒精度的关系曲线图。由图可知,当酵母添加量低于5 mL时,随着酵母添加量的增加,黄酒含糖质量浓度呈现下降趋势;当酵母添加量增加到5 mL时,黄酒含糖质量浓度达最低值;当酵母添加量高于5 mL时,随着酵母添加量的增加,黄酒含糖质量浓度升高。当酵母添加量低于4 mL时,随着酵母添加量的增加,黄酒酒精度不断增加;当酵母添加量为4 mL时,黄酒酒精度达到最大值,此时黄酒的含糖质量浓度为313.9 g/L,酒精度为8%vol;当酵母添加量高于4 mL时,酵母添加量增加,黄酒酒精度下降。推测可能前期酵母菌由于营养充足而快速生长繁殖,到后期发酵体系营养供应不足,酵母菌无氧呼吸作用被抑制导致生成酒精减少,且发酵过程中部分乙醇被代谢生成乙酸参与乙酯类化合物的形成,导致酒精浓度降低[19]。因此,确定酵母的最优添加量为4 mL。
2.2.2 酵母添加时间对广东黄酒的影响
图3是酵母添加时间与黄酒糖度和酒精度的关系曲线图。由图3可知,糖化42~54 h,随着酵母添加时间越晚,黄酒含糖质量浓度呈现降低趋势。当糖化至54 h 时,黄酒含糖质量浓度达到最低值。糖化54~72 h, 酵母添加时间越晚,黄酒含糖质量浓度越高。从图中可知,糖化42~66 h,黄酒酒精度在8%vol附近波动,变化不大。此结果与崔闯等[20]研究糖化时间对小米黄酒糖度的影响一致。因此,选择酵母的最佳添加时间为54 h。

图3 酵母添加时间对广东黄酒糖度和酒精度的影响
Fig.3 Effect of theZygosacharomyces mellis LGL-1 adding time on the sugar content and alcohol content of yellow rice wine
2.2.3 水添加量对广东黄酒的影响
图4是水添加量对黄酒糖度和酒精度的关系曲线图。由图4可知,前发酵7 d,随着水添加量的增加,黄酒含糖质量浓度降低,且下降趋势接近于线性关系,黄酒酒精度呈缓慢上升趋势。高糖度会抑制酵母菌的生长,引起细胞内水分活度和细胞质组成发生显著变化,酵母菌的细胞膜及菌体内的酶受到破坏,不利于将糖分转化成酒精。在糖化后加入一定的无菌水,可减少高渗透压对酵母菌的抑制作用,提高出酒率[21]。赖樱花等[22]研究水添加量对黄酒质量的影响,分析得到随着水添加量的增加,黄酒糖度呈现下降趋势。因此,选择70%(质量分数)为最佳的水添加量,此时黄酒含糖质量浓度达到最低值104.3 g/L,酒精浓度达到最高值11%vol。
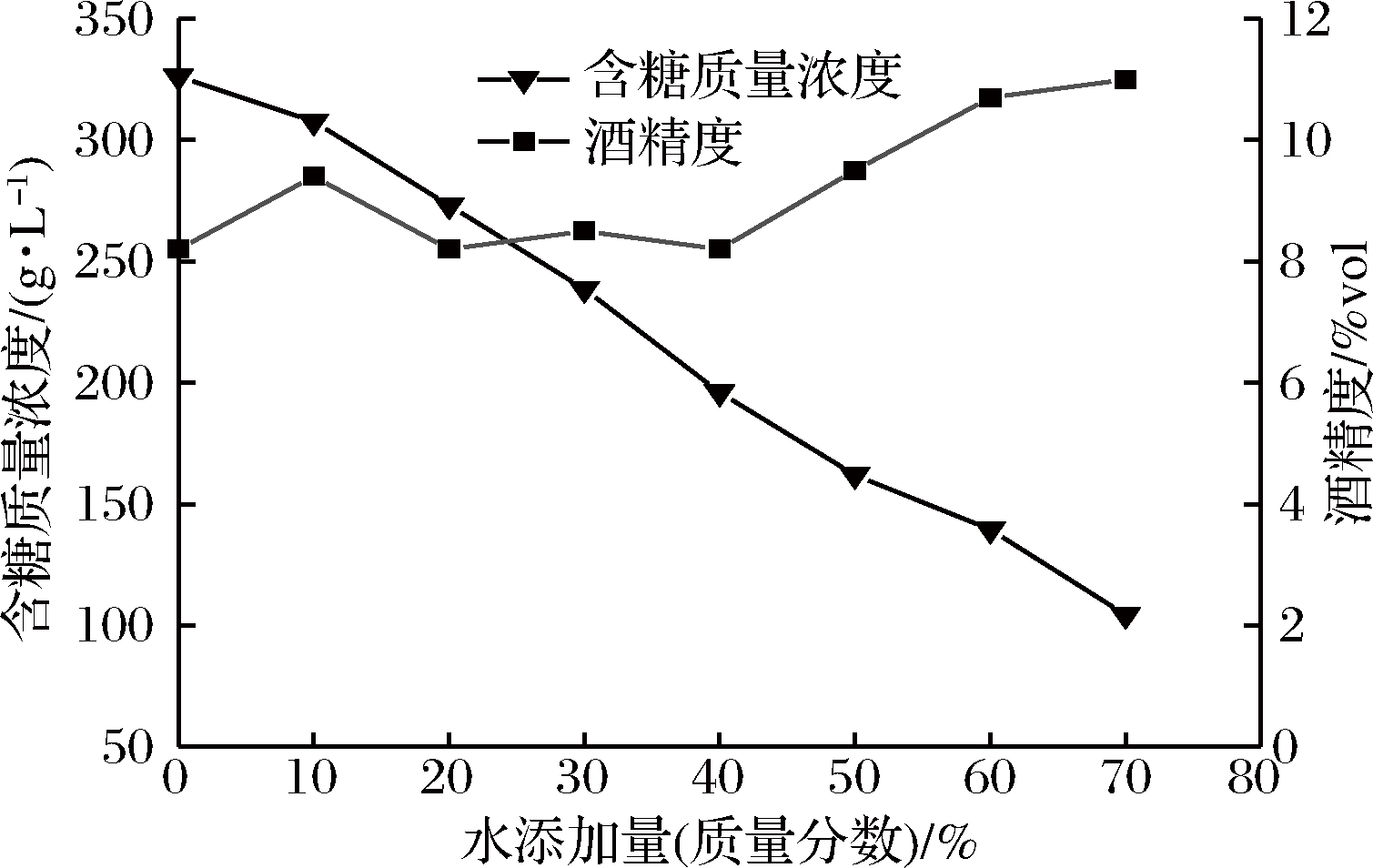
图4 水添加量对广东黄酒糖度和酒精度的影响
Fig.4 Effect of the water’s additionon the sugar content and alcohol content of yellow rice wine
2.2.4 前发酵时间对广东黄酒的影响
图5是前发酵时间对黄酒糖度和酒精度的关系曲线图。由图5可知,随着前发酵时间的增加,黄酒含糖质量浓度不断降低,直至第8天后,黄酒含糖质量浓度下降趋势较平缓。

图5 前发酵时间对广东黄酒糖度和酒精度的影响
Fig.5 Effect of the pre-fermentaition time on the sugar content and alcohol content of yellow rice wine
前发酵过程中,黄酒酒精度不断上升,到第8天时,酒精度上升缓慢趋于平缓。徐艳等[23]研究发酵时间对黄酒的影响,分析得到黄酒在10~25 d,总糖的产生量随着时间的增加而减少,然后趋于稳定;酒精度在发酵时间为10~25 d呈线性增加趋势,25 d后有所下降。因此,确定最佳的前发酵时间为8 d。
按CCD中心复合试验方案进行4因素3水平试验,试验结果见表2。
表2 响应面分析方案及结果
Table 2 Experimental design and results for response surface analysis
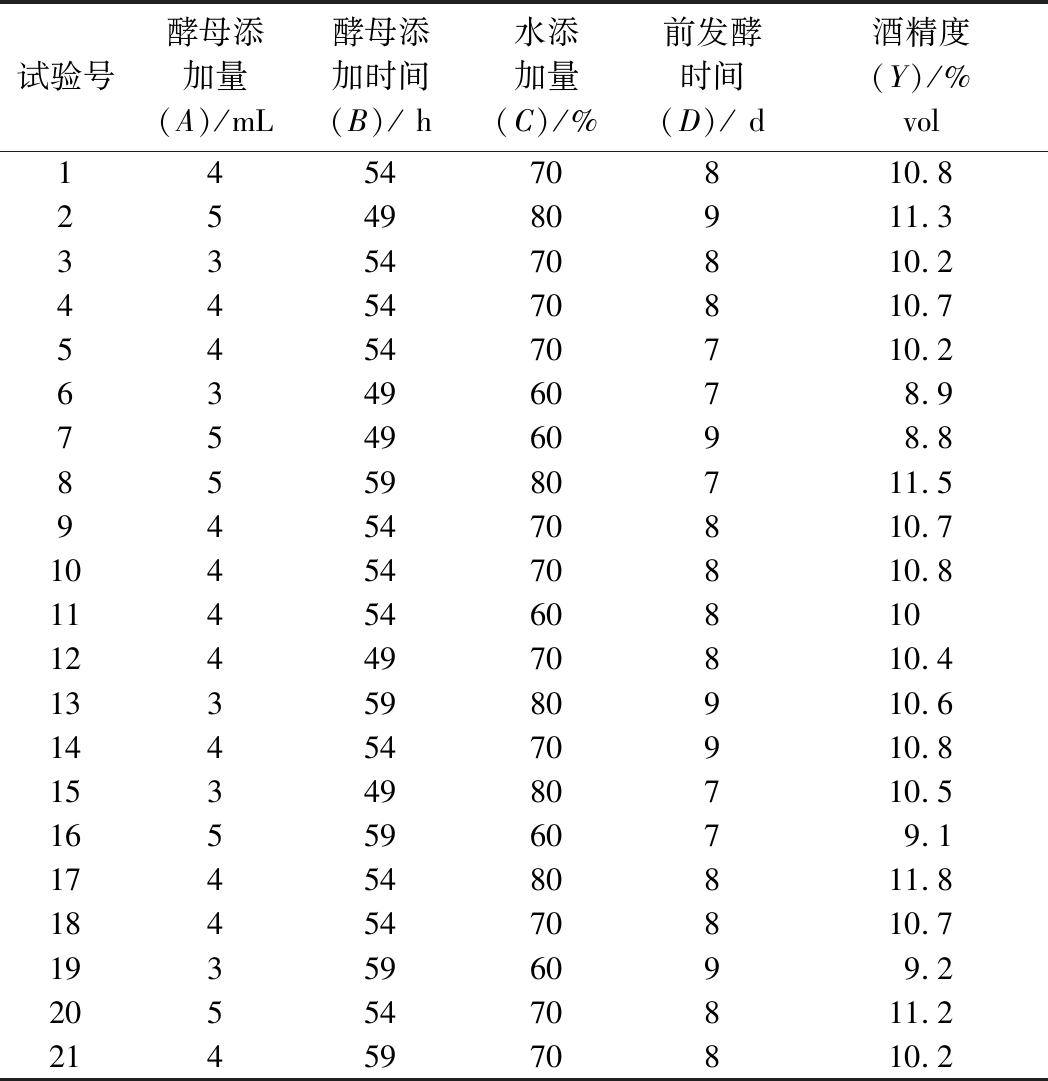
试验号酵母添加量(A)/mL酵母添加时间(B)/ h水添加量(C)/%前发酵时间(D)/ d酒精度(Y)/%vol145470810.8254980911.3 335470810.2 445470810.7 545470710.2 63496078.9 75496098.8 855980711.5 945470810.7 1045470810.8 1145460810 1244970810.41335980910.61445470910.81534980710.5165596079.11745480811.81845470810.7193596099.22055470811.22145970810.2
对表2中的试验数据进行二次多项式回归拟合,得到酵母添加量(A)、酵母添加时间(B)、水添加量(C)、前发酵时间(D)的回归模型方程为:
Y=10.78+0.5A-0.1B+0.97C+0.3D+0.31AB+0.24AC -0.21AD-0.038BC+0.31BD-0.012CD-0.097A2-0.50B2+0.1C2-0.3D2
采用Design Expert软件对表2的数据进行回归分析,预测黄酒发酵的最优工艺参数,方差分析结果见表3。
由表3可知,回归模型具有显著性(P<0.05),失拟差不显著(P=0.126 9>0.05),说明广东黄酒酒精度模型和实际情况拟合度较好,因此可用该数学模型对试验结果进行预测。4个因素对酒精度的影响大小依次为C(水添加量)>A(酵母添加量)>D(前发酵时间)>B(酵母添加时间)。从表3可知,AB、AC、AD和BD的相互作用具有显著性,其响应面曲面图见图6。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
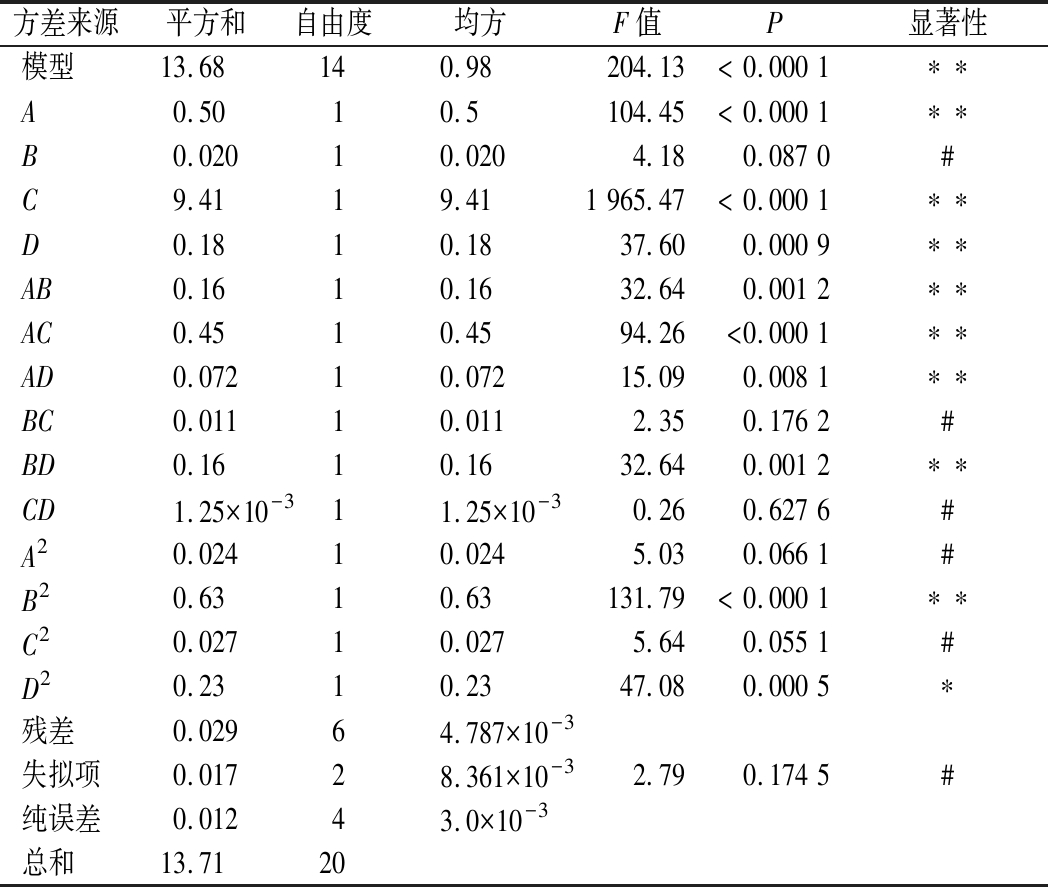
方差来源平方和自由度均方F值P显著性模型13.680140.9800204.13< 0.000 1∗∗A0.5010.5104.45< 0.000 1∗∗B0.02010.0204.180.087 0#C9.4119.411 965.47< 0.000 1∗∗D0.1810.1837.600.000 9∗∗AB0.1610.1632.640.001 2∗∗AC0.4510.4594.26<0.000 1∗∗AD0.07210.07215.090.008 1∗∗BC0.01110.0112.350.176 2#BD0.1610.1632.640.001 2∗∗CD1.25×10-311.25×10-30.260.627 6#A20.02410.0245.030.066 1#B20.6310.63131.79< 0.000 1∗∗C20.02710.0275.640.055 1#D20.2310.2347.080.000 5∗残差0.02964.787×10-3 失拟项0.01728.361×10-32.790.174 5#纯误差0.01243.0×10-3 总和13.7120
注:*,差异显著(P<0.05);**,差异极显著(P<0.01);#,差异不显著(P>0.05)。

a-酵母添加量与添加时间;b-酵母添加量与水添加量;
c-酵母添加量与前发酵时间;d-酵母添加时间与前发酵时间
图6 各因素交互作用的响应曲面和等高线
Fig.6 Diagrams of response surface and contour of the interactions between each factor
由图6可直观反映出酵母添加量(A)、酵母添加时间(B)、水添加量(C)和前发酵时间(D)之间交互作用对广东黄酒酒精度的影响。当等高线呈圆形时表示两因素交互作用不显著,呈椭圆形或马鞍形时表示两因素交互作用显著[24-25]。图6中的等高线均成明显的椭圆形,说明AB、AC、AD以及BD相互作用对广东黄酒酒精度有显著影响(P<0.05)。
通过响应面法得到广东黄酒发酵最优工艺条件:酵母添加量4 mL、酵母添加时间54 h、水添加量70%(质量分数)、前发酵时间8 d。根据所建立的数学模型,可得到最大响应值时的15个最优条件。将这15个试验条件和正交实验中最佳结果的试验条件(试验17)一起组成验证实验,以得到广东黄酒的最佳工艺条件。验证试验条件和结果见表4。
表4 验证试验条件和结果
Table 4 The conditions and results of validation test
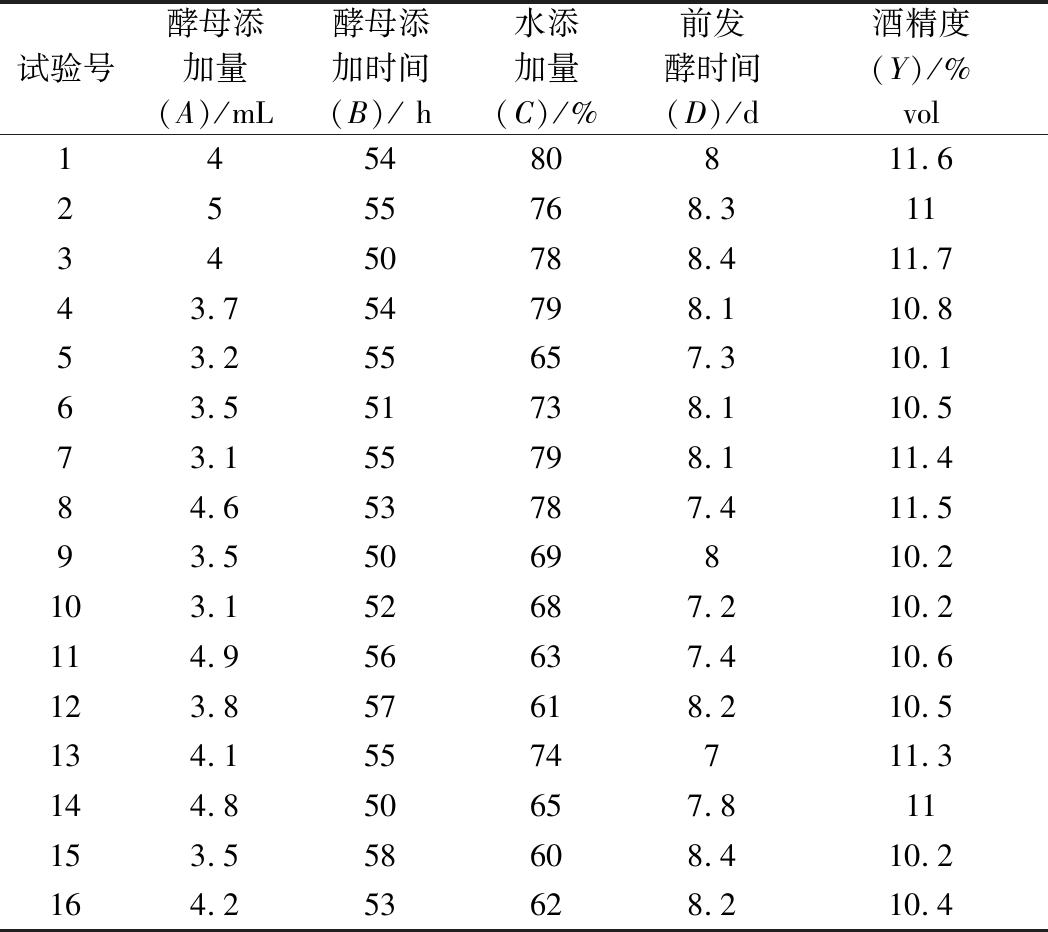
试验号酵母添加量(A)/mL酵母添加时间(B)/ h水添加量(C)/%前发酵时间(D)/d酒精度(Y)/%vol145480811.62555768.3113450788.411.743.754798.110.853.255657.310.163.551738.110.573.155798.111.484.653787.411.593.55069810.2103.152687.210.2114.956637.410.6123.857618.210.5134.15574711.3144.850657.811153.558608.410.2164.253628.210.4
由表4可知,试验3的黄酒酒精度最高,该条件下,黄酒酒精度为11.7%vol。因此,确定黄酒的最佳酿造工艺条件为:酵母添加量4 mL、酵母添加时间50 h、 水添加量78%(质量分数)、前发酵时间8.4 d,该条件下,含糖质量浓度为95.6 g/L,酒精度为11.7%vol。
本研究首先通过单因素试验分别考察酵母添加量、酵母添加时间、水添加量和前发酵时间对广东黄酒糖度和酒精度的影响,在此基础上,采用响应面法对广东黄酒发酵工艺进行优化,得到较优的发酵工艺条件,并进行验证实验,最后得到广东黄酒的最佳发酵工艺条件:酵母添加量4 mL(100 g干米中)、酵母添加时间50 h、水添加量78%、前发酵时间8.4 d,此条件下得到的黄酒含糖质量浓度和酒精度分别为95.6 g/L和11.7%vol。可见,以蜂蜜接合酵母LGL-1协同传统曲种发酵广东黄酒为低糖型黄酒的开发提供了一定的理论依据及技术支持。
[1] 全国食品工业标准化技术委员会. GB/T 13662—2018,黄酒[S].北京:中国标准出版社, 2018.
[2] 崔闯,任清,常欣春.响应面法优化干型黄酒挥发性成分的检测条件[J].食品科技,2014,39(12):312-318.
[3] LUO T, FAN W L, XU Y. Characterization of volatile and semi-volatile compounds in Chinese rice wines by headspace solid phase microextraction followed by gas chromatography -mass spectrometry [J].Journal of the Institute of Brewing, 2008, 114(2): 172-179.
[4] LU Q Y, LEE R P, HUANG J J, et al. Quantification of bioactive constituents and antioxidant activity of Chinese yellow wine[J].Journal of Food Composition and Analysis,2015, 44:86-92.
[5] WU Z, XU E, LONG J, et al.Comparison between ATR-IR, Raman, concatenated ATR-IR and Raman spectroscopy for the determination of total antioxidant capacity and total phenolic content of Chinese rice wine[J].Food Chemistry,2016, 194:671-679.
[6] HAN F L, XU Y. Identification of low molecular weight peptides in Chinese rice wine (Huang Jiu) by UPLC-ESI-MS/MS[J].Journal of the Institute Brewing,2011, 117(2):238-250.
[7] 刘月,祁国栋,张炳文.黄酒功能成分的研究进展[J].中国酿造,2015,34(11):27-30.
[8] QUE F, MAO L C, PAN X. Antioxidant activities of five Chinese rice wines and the involvement of phenolic compounds[J].Food Res Int,2006,39(5):581-587.
[9] QUE F, MAO L, ZHU C, et al. Antioxidant properties of Chinese yellow wine, its concentrate and volatiles[J].LWT-Food Science and Technology,2006, 39(2):111-117.
[10] MATCHAR D B, MC-CRORY D C, ORLANDO L A, et al. Systematic review: Comparative effectiveness of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers for treating essential hyperten[J].Ann. Intern. Med., 2008, 148(1): 16-29.
[11] 杨鲁君,蒋予箭,李余动.黄酒酵母优良抗逆菌株的筛选、鉴定及发酵特性研究[J].中国食品学报,2013,13(9):71-77.
[12] 刘杰,傅勤峰,蒋启海,等.两株酵母菌协同酿造黄酒的控制工艺[J].食品研究与开发,2015,36(1):82-84.
[13] 杨鲁君.优良黄酒酵母菌株的筛选、鉴定和发酵特性研究[D].杭州:浙江工商大学,2013.
[14] 夏艳秋,朱强,汪志君,等.耐受性黄酒酵母YS6.2.5的选育及初步应用[J].食品科学,2010,31(23):228-232.
[15] 谢广发,郑志强,马晋,等.快速发酵黄酒酵母菌的筛选[J].中国酿造,2010(8):12-14.
[16] 冯爱军,白卫东,汪薇,等.广东客家娘酒的研究进展[J].酿酒科技,2010(3):91-95.
[17] 郑洋洋,林捷,刘宇坚,等.广东客家娘酒发酵工艺的改良与优化[J].酿酒科技,2014(8):59-61.
[18] 赵文红,莫依灿,洪泽淳,等.红曲对广东客家黄酒抗氧化活性的影响[J].现代食品科技,2016,32(1):143-150.
[19] 孙敏,高鑫,李博,等.响应面法优化桑葚糯米黄酒的发酵工艺研究[J].中国酿造,2018,37(4):196-200.
[20] 崔闯,任清.响应面法优化黄酒酿造工艺[J].食品科学,2015,36(11):134-139.
[21] 刘昭明,蒋世云.糯米甜酒发酵过程的生物学特性研究[J].酿酒,2001,28(5):59-62.
[22] 赖樱花,成坚,李勇波,等.响应面法优化低糖型广东黄酒的生产工艺[J].中国酿造,2011(12):137-140.
[23] 徐艳,骆玮诗.传统客家黄酒的发酵条件优化[J].科技视界,2016(20):166-167;212.
[24] 陈晨,胡文忠,田沛源,等.超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析[J].食品科学, 2014, 35(2): 12-17.
[25] 王海燕,李睿,曾秀,等.响应面优化超声波提取桑叶槲皮素工艺[J].食品科学, 2014, 35(22): 56-62.