表1 响应面实验设计因素及水平
Table 1 The factor and levels of response surface optimization experiment

水平因素A(微波功率)/WB(微波时间)/minC(KOH-乙醇溶液浓度)/(mol·L-1)-1400100.50500121.01600141.5
类胡萝卜素是一类由异戊二烯单元组成碳骨架的脂溶性色素,根据结构中是否含有氧官能团分为碳氢胡萝卜素(carotene)和含氧衍生物叶黄素(xanthophyll)[1]。人体自身不能主动合成类胡萝卜素,而柑桔却富含丰富的类胡萝卜素。研究者在柑桔中鉴定出超过115种类胡萝卜素,且果皮中类胡萝卜素的组成及含量远超果汁[3]。目前,关于柑桔类胡萝卜素的研究对象主要集中在果汁中[4],而果皮类胡萝卜素的研究报道较少。随着人们对天然营养成分的需求呈指数级增长[5],开发柑桔副产品作为天然类胡萝卜素的来源并将其应用于食品中极具研究前景。
单羟基或二羟基化类胡萝卜素即含氧衍生物叶黄素(xanthophyll)通常以更稳定的酯化形式存在于植物中,皂化是类胡萝卜素提取纯化而释放游离类胡萝卜素,除去叶绿素、脂肪等杂质的有效手段。据研究传统冷皂化法时间长、对活性物质影响大;热皂化法耗时虽短,但高温易引起类胡萝卜素降解。目前微波辅助法广泛应用于食品中酯类的水解反应,它具有耗时短、效率高、回收率高、安全无污染等优点。微波辐射不同于传统的由表及里加热方式,是通过电磁波与反应物中存在的分子(特别是偶极子或离子分子)的直接耦合产生有效的“内部加热”,实现能量的瞬时转移,这种“内加热作用”加热速度快且均匀、无温度梯度、无滞后效应,加快了化学反应并提高反应均匀性;除此之外,微波辐射的非热效应如分子移动性和场稳定性,也可能有助于增强化学反应[6]。LIU等[7]研究证实微波能快速水解叶黄素酯,且很少产生叶黄素异构体。因此,本实验以南丰蜜桔皮粉作为原料,在单因素实验基础上,采用响应面法对微波皂化的主要工艺参数进行优化,并研究不同皂化方式(冷皂化、热皂化、微波皂化)对类胡萝卜素组成及含量的影响,旨在提供一套高效的桔皮类胡萝卜素皂化工艺且明确南丰蜜桔皮中类胡萝卜素的种类,以期为南丰蜜桔桔皮副产物综合利用和天然类胡萝卜素的开发提供有效途径。
新鲜南丰蜜桔皮,由中国农业科学院柑桔研究所提供。
无水乙醇(AR)、乙醚(AR)、KOH(AR)、丙酮(AR)、NaCl(AR),重庆川东化工有限公司;甲醇(HPLC)、乙腈(HPLC)、二氯甲烷(HPLC)、β-隐黄素(纯度≥99.0%),美国Sigma公司;叶黄素、玉米黄素、β-胡萝卜素(纯度均≥96.0%),上海源叶生物技术有限公司。
HWC-3LA型微波提取设备,天水华圆制药设备科技有限责任公司;双光束紫外-可见分光光度计,北京普析通用仪器有限责任公司;高效液相色谱Ultimate3000,戴安有限公司;LCMS-8030三重四级杆质谱仪(HPLC-DAD-APCI-MS,Shimadzu UFLCXR系统,配备光电二极管阵列检测器SPD-M20A);6202型高速粉碎机,北京燕山正德机械设备有限公司;旋转蒸发仪,瑞士BUCHI公司;恒温水浴锅,上海双舜实业发展有限公司。
1.3.1 桔皮类胡萝卜素皂化提取物的制备
参考黄巧娟[8]的方法并稍作改动。将新鲜南丰蜜桔皮在40 ℃烘干至水分含量降至10%左右,粉碎、过200目筛,置于-18 ℃冷藏备用。取桔皮粉40 g,加入400 mL无水乙醇,在40 ℃水浴浸提3 h,重复浸提两次,合并提取液并抽滤,将滤液真空浓缩至干,用乙醚复溶、离心后取上清液即桔皮总酯萃取物;将总酯萃取物、KOH-乙醇溶液加入25 mL棕色具塞试管中,震荡摇匀并密封,经皂化处理后将皂化液倒入250 mL分液漏斗中,依次加入8 mL乙醚,8 mL 5 g/L的NaCl水溶液分层,用8 mL乙醚萃取下相2次,用0.5% NaCl水溶液水洗乙醚上相至中性,收集有机层浓缩得类胡萝卜素皂化提取物。
1.3.2 微波皂化法工艺优化
1.3.2.1 单因素实验
取4 mL桔皮总酯萃取物为原料,以类胡萝卜素得率为指标进行单因素实验,分别研究微波功率(200、300、400、500、600、700 W)、皂化时间(6、8、10、12、14、16 min)、KOH-乙醇溶液浓度(0.5、1.0、1.5、 2.0、2.5、3.0 mol/L)、KOH-乙醇溶液添加量(1、2、4、6、8、10 mL)对类胡萝卜素得率的影响。
1.3.2.2 响应面实验
在单因素实验的基础上,选取对总类胡萝卜素得率影响明显的3个因素(微波功率、皂化时间、KOH-乙醇溶液浓度),采用Box-Benhnken中心组合试验设计对微波皂化类胡萝卜素工艺条件进行响应面优化,确定最佳工艺参数。试验设计因素与水平见表1。
表1 响应面实验设计因素及水平
Table 1 The factor and levels of response surface optimization experiment

水平因素A(微波功率)/WB(微波时间)/minC(KOH-乙醇溶液浓度)/(mol·L-1)-1400100.50500121.01600141.5
1.3.2.3 紫外-可见分光光度法测定总类胡萝卜素
将桔皮类胡萝卜素皂化提取物用丙酮复溶至10 mL, 在454 nm处测定吸光度值。同法制备β-胡萝卜素标准溶液,绘制质量浓度和吸光值的标准曲线为y=0.141 9x+0.013 7(R2=0.999 1),并由此计算类胡萝卜素总量,类胡萝卜素得率计算公式如式(1):
类胡萝卜素得率/‰![]()
(1)
式中:m,样品中总类胡萝卜素的质量,g;M,桔皮粉质量,g。
1.3.3 微波皂化法与传统皂化法的对比
取总酯萃取物4 mL、2.0 mol/L的KOH-乙醇溶液4 mL进行皂化反应。3种皂化方式参数如下:微波皂化(500 W,12 min)、热皂化(60 ℃,30 min)、冷皂化(25 ℃,12 h),将类胡萝卜素皂化提取物用V(甲醇)∶V(二氯甲烷)=1∶1混合液定容至2.0 mL,过0.22 μm滤膜后用HPLC测定,对比3种皂化方法后类胡萝卜素组成和含量的变化。
1.3.4 C30-HPLC-DAD-APCI-MS法测定类胡萝卜素
1.3.4.1 C30-HPLC-DAD-APCI-MS条件
HPLC:色谱柱为YMC -C30(4.6 mm×250 mm, 5 μm) 色谱柱;柱温:40 ℃;检测器SPD-M20A,波长450 nm,紫外-可见光谱扫描范围250~600 nm;进样量为10 μL,流动相为V(甲醇(A))∶V(乙腈(B))=8∶2,A、B均含有0.1%BHT。
MS:APCI源,离子源温度450 ℃;干燥气(氮气)流速5.0 L/min;雾化气(氮气)流速4.0 L/min;CDL温度:300 ℃;加热板温度:300 ℃;质谱仪全程采用正离子全扫描模式,m/z扫描范围为350 ~1 200。
1.3.4.2 类胡萝卜素的定性定量分析
叶黄素、玉米黄素、β-隐黄素、β-胡萝卜素利用与标准品的保留时间的一致性进行鉴定,其余类胡萝卜素组分将其紫外-可见光谱特征和质谱特征(质荷比m/z)与文献中报道的数据进行比较,对类胡萝卜素进行鉴定。
叶黄素、玉米黄素、β-隐黄素、β-胡萝卜素通过相应标准品的标准曲线进行计算;无标品的类胡萝卜素组分根据文献报道的替换计算方法进行定量[9],叶黄素之前洗脱的类胡萝卜素组分和叶黄素异构体采用叶黄素标准曲线进行计算,zeinoxanthin和β-隐黄素环氧化物、顺式β-隐黄素采用β-隐黄素标准曲线进行计算,八氢番茄红素、六氢番茄红素、ξ-胡萝卜素采用β-胡萝卜素标准曲线进行定量。总类胡萝卜素含量即为分离的类胡萝卜素含量之和。
1.3.5 数据处理
试验数据以平均值±标准差的形式给出,采用SPSS 20.0.0 软件进行方差分析和显著性检验;利用Design-Expert 8.0.6 软件进行试验设计和多元线性回归分析程序拟合回归曲线;用Origin 9.0作图。
2.1.1 单因素实验结果
2.1.1.1 微波功率对桔皮类胡萝卜素得率的影响
微波处理时,高频波使反应体系中含有的极性分子产生极化,并在交变电磁场作用下急剧运动而相互摩擦产生热量,加速化学反应;同时由于键的振动、撕裂和粒子之间的相互摩擦、碰撞,促进分子活性部分更好地接触和反应[10]。微波功率对类胡萝卜素得率的影响如图1-a所示,在皂化时间15 min、KOH-乙醇溶液浓度2.0 mol/L、KOH-乙醇溶液添加量2 mL的条件下,当微波功率为200~500 W时,随着微波功率的增大皂化反应速率不断加快,类胡萝卜得率显著上升,直至微波功率为500 W时,类胡萝卜素得率达到了0.635 0‰。当微波功率达到600 W时,类胡萝卜素得率迅速下降,产生这一现象的原因可能是由于过高的微波功率产生的瞬时高温使密封体系在很短时间内产生很大压强,影响体系密封性,从而使有机溶剂挥发导致萃取率下降;另一方面,由于类胡萝卜素的热不稳定性,而高温可能导致降解等副反应发生,使得类胡萝卜素得率下降。陈佩等[11]在微波提取胡萝卜素汁中类胡萝卜素的研究中,微波功率对类胡萝卜素提取率的影响与本结果相似。因此,选取类胡萝卜酯皂化的最佳微波功率为500 W。
2.1.1.2 皂化时间对类胡萝卜素得率的影响
由图1-b可知,在微波功率500 W、KOH-乙醇溶液浓度2.0 mol/L、KOH-乙醇溶液添加量2 mL的条件下,皂化时间对类胡萝卜素得率影响显著。皂化6 min时,微波辐射时间短,反应体系获得的能量不足,类胡萝卜素皂化不完全,其类胡萝卜素得率仅为0.455 0‰。皂化6 min之后,类胡萝卜素得率呈现上升的趋势,在此期间,随着类胡萝卜素酯与KOH-乙醇溶液在微波场中不断相互作用,类胡萝卜素酯的脂肪酸基团不断被羟基所取代,游离类胡萝卜素不断生成,类胡萝卜素得率在12 min达到0.718 5‰。微波皂化12 min后,随着皂化时间的延长,类胡萝卜素得率开始下降。实验表明微波皂化时间过长,类胡萝卜素皂化过度,持续增加的热能提供的高温环境导致类胡萝卜素发生降解,类胡萝卜素得率有所降低。综合考虑经济效益和类胡萝卜素得率,皂化时间12 min最佳。
2.1.1.3 KOH-乙醇溶液浓度对类胡萝卜素得率的影响
KOH-乙醇溶液浓度对类胡萝卜素得率的影响如图1-c所示。在微波功率500 W、皂化时间12 min、KOH-乙醇溶液添加量2 mL的条件下,当KOH-乙醇溶液浓度为0.5 mol/L时,因碱液浓度过低,故催化效果不明显,类胡萝卜素得率仅为0.547 1‰。提高KOH-乙醇溶液浓度至1.0 mol/L时,类胡萝卜素得率达到0.682 0‰。此后当KOH-乙醇溶液浓度继续加大,类胡萝卜素得率则有所降低。过高的碱液浓度会增大皂化体系的pH值,部分不耐碱的类胡萝卜素可能发生降解;同时碱液浓度过高,皂化体系易发生乳化现象,需增加水洗次数,导致类胡萝卜素损失增大。胡玉琴等[12]研究辣椒类胡萝卜素皂化工艺,结果显示KOH-乙醇溶液的浓度高于20%时,类胡萝卜素的含量呈下降趋势,分析认为可能是高浓度的强碱导致游离类胡萝卜素分解。综合分析本实验选取KOH-乙醇溶液浓度为1.0 mol/L。
2.1.1.4 KOH-乙醇溶液添加量对类胡萝卜素得率的影响
微波加速反应原理主要主要归于微波辐射对极性分子的选择性加热,KOH-乙醇溶液对打开类胡萝卜素酯键有直接关系。由图1-d可知,在微波功率500 W、皂化时间12 min、KOH-乙醇溶液浓度1.0 mol/L的条件下,随着KOH-乙醇溶液添加量的增加,类胡萝卜素酯和碱液的接触面增大,提高了反应的传质效率,类胡萝卜素得率上升,当添加量为4 mL时,类胡萝卜素得率为0.644 4‰。添加量超过4 mL时,类胡萝卜素得率呈现下降的趋势。这可能是由于碱液过量,类胡萝卜素皂化过度并发生降解;此外也可能是分层阶段过量碱液影响了类胡萝卜素在乙醇-乙醚-水体系中乙醚相的分配,从而导致类胡萝卜素回收量降低。因此,在本研究中选取KOH-乙醇溶液添加量为4 mL。
2.1.2 响应面实验结果
响应面试验设计与结果见表2,将所得的试验数据进行二次回归分析,得到以类胡萝卜素得率为目标函数的二次回归方程:Y=0.70+0.011A-0.024B+8.487E-003C+0.014AB+7.500E-004AC+8.975E -003BC-0.027A2-0.011B2-0.043C2。
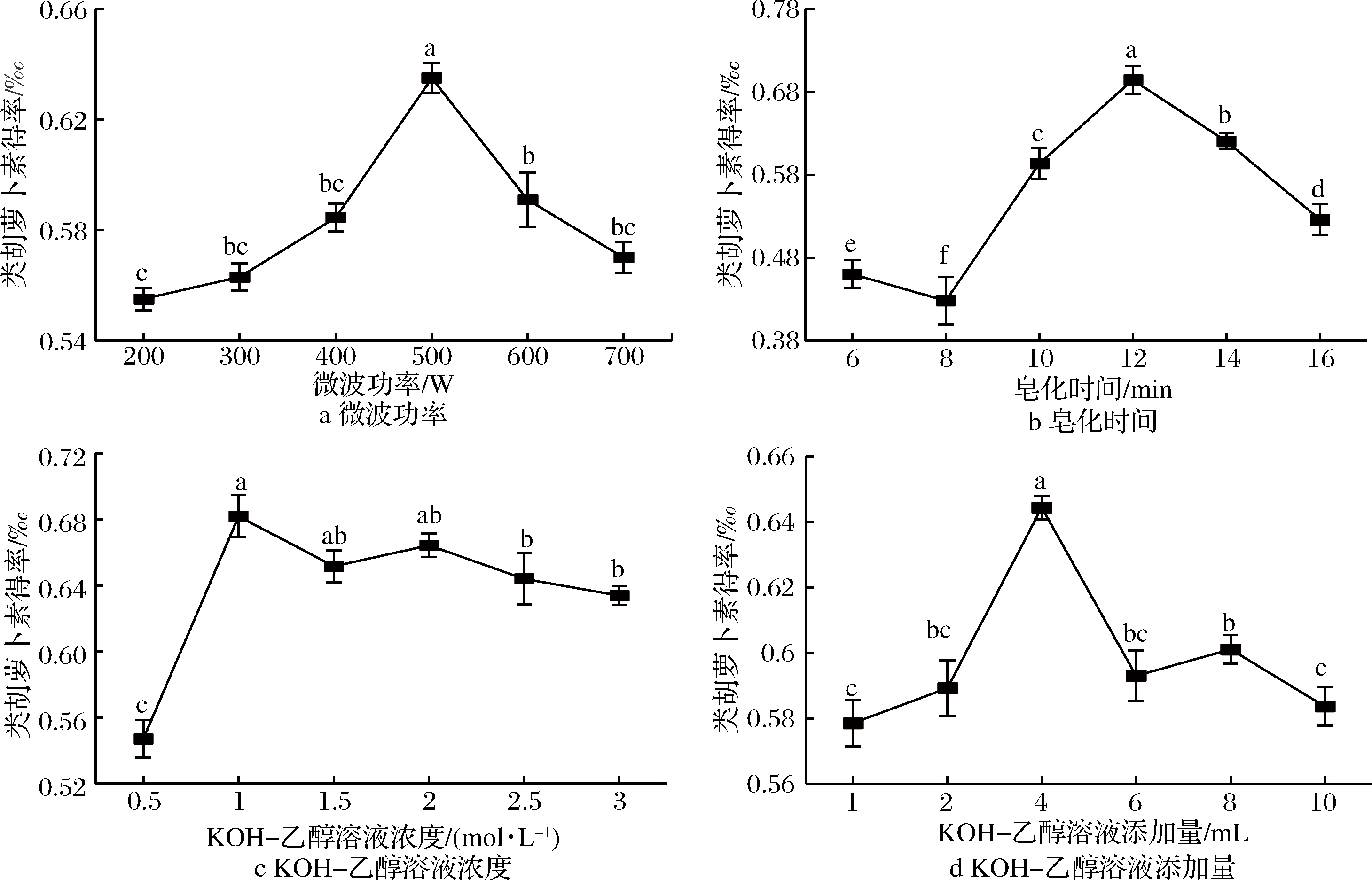
图1 不同因素对类胡萝卜素得率的影响
Fig.1 Effects of different factors on the yield of carotenoids
表2 Box-Behnken试验设计及结果
Table 2 The design matrix and results of Box-Behnken experiments
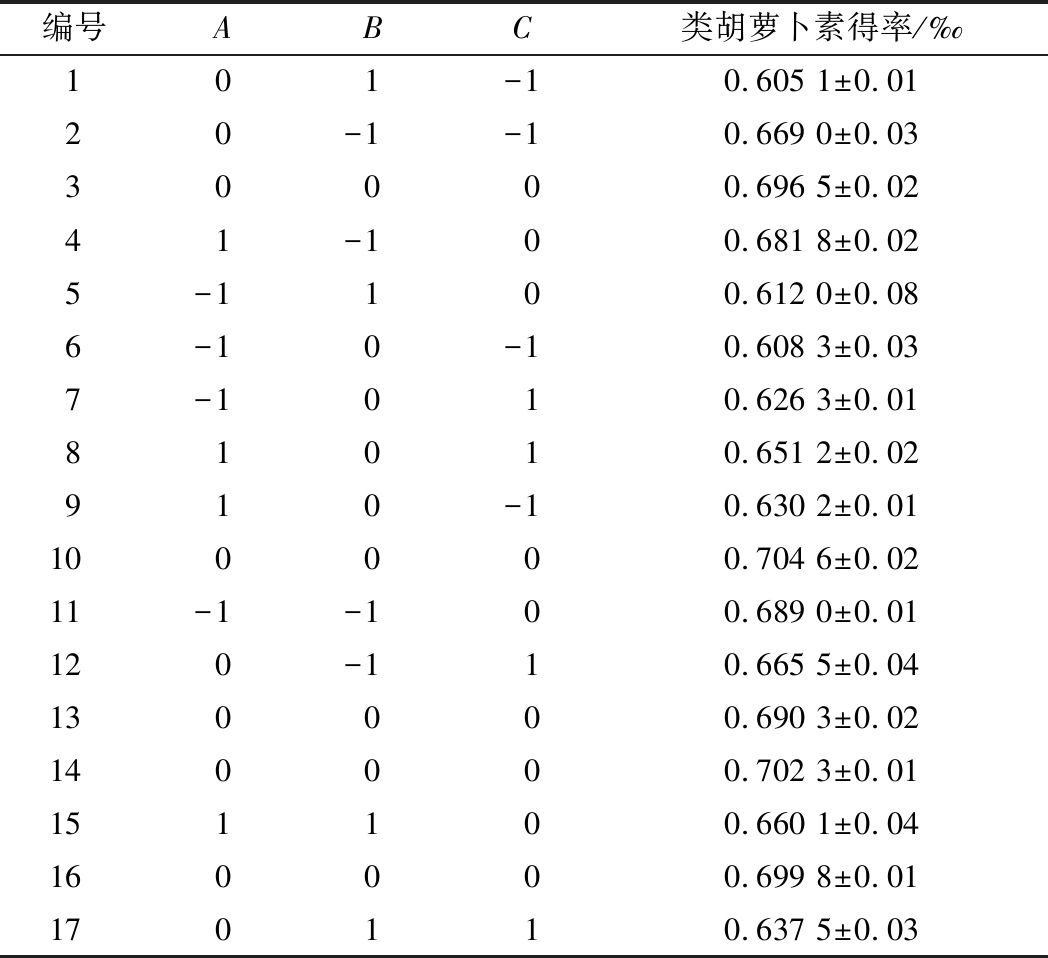
编号ABC类胡萝卜素得率/‰101-10.605 1±0.0120-1-10.669 0±0.0330000.696 5±0.0241-100.681 8±0.025-1100.612 0±0.086-10-10.608 3±0.037-1010.626 3±0.0181010.651 2±0.02910-10.630 2±0.01100000.704 6±0.0211-1-100.689 0±0.01120-110.665 5±0.04130000.690 3±0.02140000.702 3±0.01151100.660 1±0.04160000.699 8±0.01170110.637 5±0.03
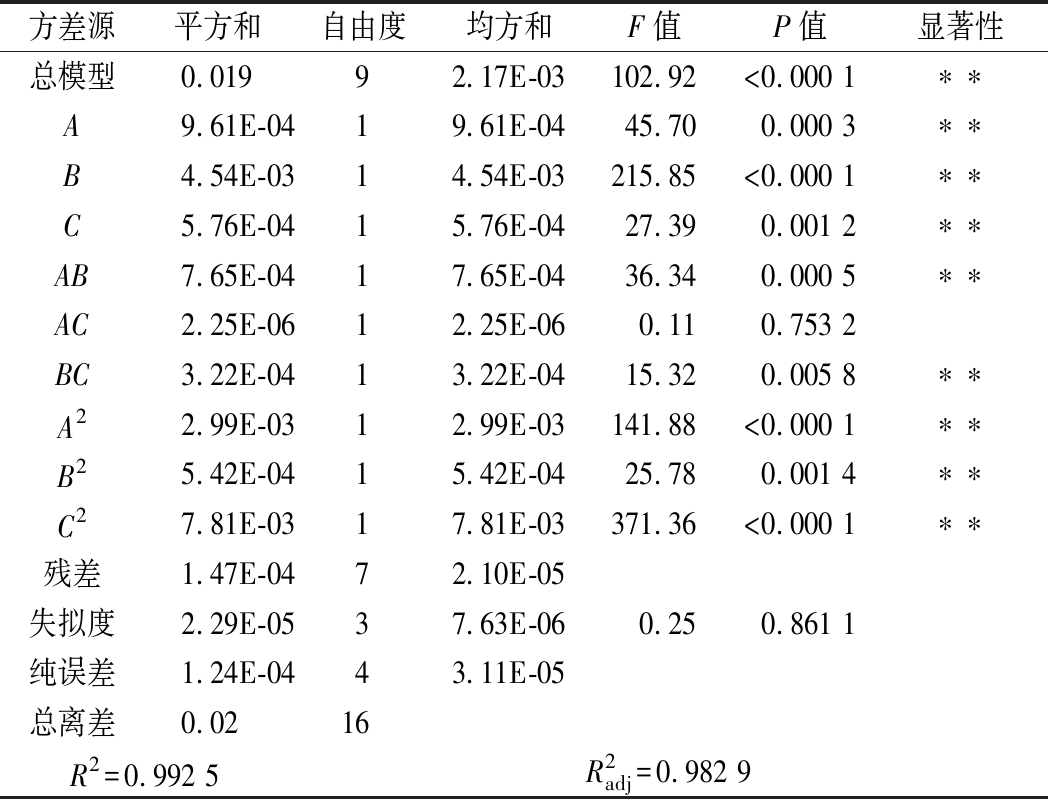
对该模型进行回归方差分析,结果见表3。由表3可知的回归模型极显著(P<0.01),失拟项不显著(P>0.05),决定系数R2为 0.992 5,调整决定系数![]() 为 0.982 9,说明所选用的模型对响应值拟合性良好,实验随机误差较小,可用该回归模型分析预测桔皮类胡萝卜素提取得率,确定最佳皂化参数。进一步分析可知该模型中3个因素对类胡萝卜素得率的影响顺序为:皂化时间(B)>微波功率(A)>KOH-乙醇溶液浓度(C),其中A、B、C、AB、BC、A2、B2、C2均达到极显著水平。
为 0.982 9,说明所选用的模型对响应值拟合性良好,实验随机误差较小,可用该回归模型分析预测桔皮类胡萝卜素提取得率,确定最佳皂化参数。进一步分析可知该模型中3个因素对类胡萝卜素得率的影响顺序为:皂化时间(B)>微波功率(A)>KOH-乙醇溶液浓度(C),其中A、B、C、AB、BC、A2、B2、C2均达到极显著水平。
表3 回归模型方差分析
Table 3 Analysis of variance of regression model
方差源平方和自由度均方和F值P值显著性总模型0.01992.17E-03102.92<0.000 1∗∗A9.61E-0419.61E-0445.700.000 3∗∗B4.54E-0314.54E-03215.85<0.000 1∗∗C5.76E-0415.76E-0427.390.001 2∗∗AB7.65E-0417.65E-0436.340.000 5∗∗AC2.25E-0612.25E-060.110.753 2BC3.22E-0413.22E-0415.320.005 8∗∗A22.99E-0312.99E-03141.88<0.000 1∗∗B25.42E-0415.42E-0425.780.001 4∗∗C27.81E-0317.81E-03371.36<0.000 1∗∗残差1.47E-0472.10E-05失拟度2.29E-0537.63E-060.250.861 1纯误差1.24E-0443.11E-05总离差0.0216R2=0.992 5R2adj=0.982 9
注:**表示差异极显著,P<0.01。
图3中的响应面和等高线的形状反映了微波功率(A)、皂化时间(B)、KOH-乙醇溶液浓度(C)对类胡萝卜素得率的影响。由图2-a可知,根据响应面在皂化时间和微波功率两因素下曲面的陡峭程度,可见两因素交互作用中皂化时间占主导作用,且等高线呈现明显的椭圆形,表明两因素交互作用显著。同理由图2-b可知,微波功率和KOH-乙醇溶液浓度两因素交互作用中微波功率占主导作用,但两因素交互作用不显著。同理由图2-c可知,皂化时间和KOH-乙醇溶液浓度两因素交互作用中皂化时间占主导作用,且两因素交互作用显著。以上结果与方差分析结果一致。利用Design-Expert 8.0.6软件分析得出微波皂化法提取类胡萝卜素的最佳工艺为:微波功率494.46 W、皂化时间为10 min、KOH-乙醇溶液浓度为1.0 mol/L,在此条件下模型预测类胡萝卜素得率为0.711 2‰。为便于操作,将最佳条件调整为:微波功率为495 W、皂化时间为10 min、KOH-乙醇溶液浓度为1.0 mol/L,在此条件下进行3次平行实验,所得类胡萝卜素的平均得率为(0.709 6±0.11)‰,与理论预测值的相对误差为0.5%,说明该模型给出的工艺参数可靠,可以为微波皂化法提取桔皮类胡萝卜素的工艺优化提供理论指导。

图2 各两因素交互作用对类胡萝卜素得率
影响的曲面图与等高线图
Fig.2 Surface and contour maps of the pariwise effects of interaction between two factors on carotenoid yield
采用C30-HPLC-DAD-APCI-MS法对南丰蜜桔皮中类胡萝卜素组分进行分离和鉴定,桔皮中类胡萝卜素的HPLC图如图3所示。
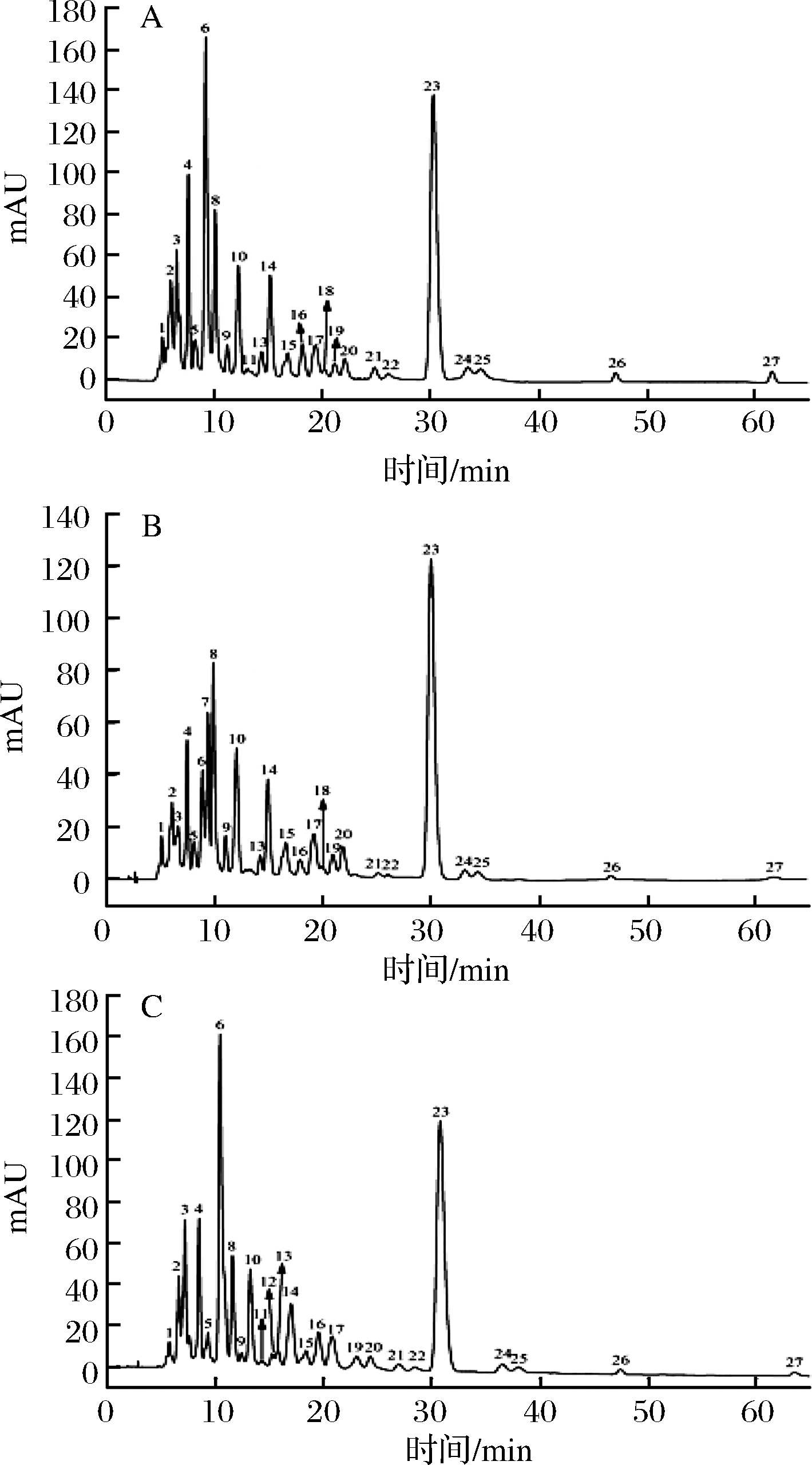
A-微波皂化;B-热皂化;C-冷皂化
图3 南丰蜜桔皮类胡萝卜素的HPLC图
Fig.3 HPLC diagram of carotenoids from Nanfeng mandarin peel
在本研究实验的色谱条件下,C30色谱柱中共分离出27种类胡萝卜素,将色谱、光谱、质谱信息的组合信息与研究者对水果类胡萝卜素鉴定的详细描述进行比对[13-17],鉴定出了23种主要的类胡萝卜素组分,其色谱、光谱、质谱特征如表4所示。不足的是仍然有4种类胡萝卜素组分由于含量太低或存在共洗脱现象(特别是环氧类胡萝卜素),无法获得完整、准确的光谱信息和质谱特征,故未能进行鉴定,4种未鉴定的类胡萝卜素组分标记为未鉴定组分a、b、c、d。迄今未见文献报道南丰蜜桔皮中类胡萝卜素组分鉴定的详细信息,XUE等[18]用C30-HPLC-DAD法鉴定出南丰蜜桔皮中紫黄质、叶黄素、α-胡萝卜素、β-胡萝卜素4种类胡萝卜素。本研究初步鉴定出南丰蜜桔中23种类胡萝卜素,与柑桔果皮类胡萝卜素的相关文献报道有所不同[19-22],未能检测出β-柠乌素、β-citraurinene、α-隐黄素、α-胡萝卜素和柠黄质,但检测出zeinoxanthin,其在柑桔汁中多次报道[23]。与文献报道不一致的地方可能是因为类胡萝卜素在不同柑桔品种间的差异性,也有可能是提取溶剂和分析方法的差异性所导致。
3种皂化方式下桔皮类胡萝卜素皂化提取物组成及含量见表4。由表4可知,3种皂化方式处理的桔皮类胡萝卜素均主要以全反式形式存在,β-隐黄素、9-cis-紫黄质、黄体黄质、9-cis-花药黄质、di-cis-新黄质、叶黄素、玉米黄素等是主要类胡萝卜素组分,这与柑桔皮中类胡萝卜素的研究一致[19-22]。3种皂化方式得到的相同类胡萝卜素组分有23种,不同组分如zeinoxanthin在冷皂化样品中未检出,可能由于冷皂化时间长,zeinoxanthin大量降解;热皂化后新生成的5,8-环氧-叶黄素,可能来源于高温下叶黄素的环氧化反应,与KIMURA等[24]的研究结果一致。3种皂化方式中,总类胡萝卜素含量微波皂化>冷皂化>热皂化,微波皂化样品总类胡萝卜含量为590.49 μg/g,高出热皂化37.15%,高出冷皂化3.63%。相较于胡萝卜素(carotene),含氧叶黄素(xanthophyll)对皂化方式更为敏感。CHEN等[25]研究不同皂化方式对不同植物材料类胡萝卜素组分及含量的影响,结果也显示热皂化后叶黄素(xanthophyll),特别是环氧类胡萝卜素降解显著。通过上述皂化方式对桔皮类胡萝卜素的组成和含量的影响研究可得出,微波皂化法可作为一种有潜力的类胡萝卜素快速皂化方法。
表4 南丰蜜桔皮中类胡萝卜素组分的鉴定及含量
Table 4 Identification and content of carotenoids in Nanfeng mandarin peel
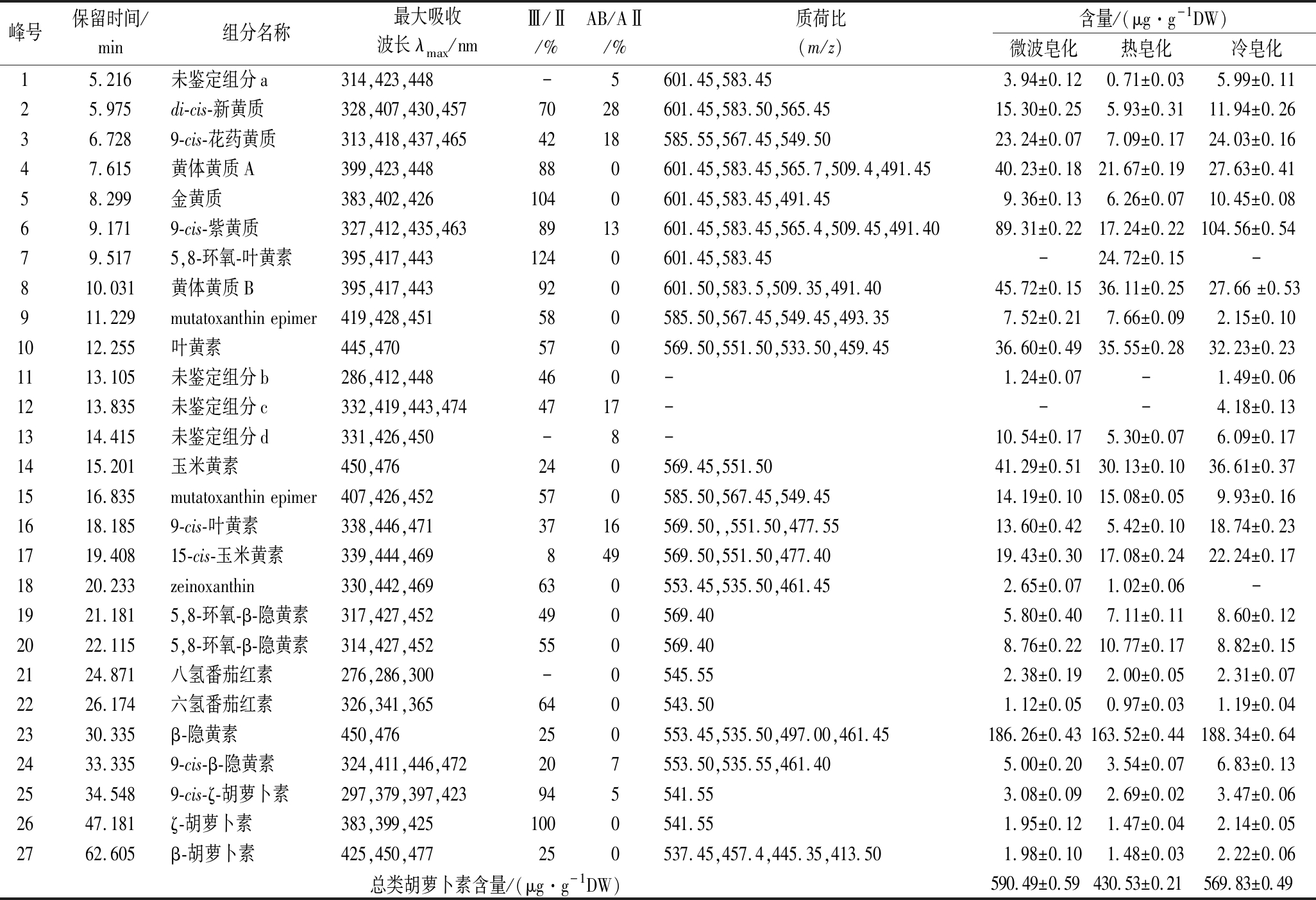
峰号保留时间/min组分名称最大吸收波长λmax/nmⅢ/Ⅱ/%AB/AⅡ/%质荷比(m/z)含量/(μg·g-1DW)微波皂化热皂化冷皂化15.216未鉴定组分a314,423,448-5601.45,583.453.94±0.120.71±0.035.99±0.1125.975di-cis-新黄质328,407,430,4577028601.45,583.50,565.4515.30±0.255.93±0.3111.94±0.2636.7289-cis-花药黄质313,418,437,4654218585.55,567.45,549.5023.24±0.077.09±0.1724.03±0.1647.615黄体黄质A399,423,448880601.45,583.45,565.7,509.4,491.4540.23±0.1821.67±0.1927.63±0.4158.299金黄质383,402,4261040601.45,583.45,491.459.36±0.136.26±0.0710.45±0.0869.1719-cis-紫黄质327,412,435,4638913601.45,583.45,565.4,509.45,491.4089.31±0.2217.24±0.22104.56±0.5479.5175,8-环氧-叶黄素395,417,4431240601.45,583.45-24.72±0.15-810.031黄体黄质B395,417,443920601.50,583.5,509.35,491.4045.72±0.1536.11±0.2527.66 ±0.53911.229mutatoxanthin epimer419,428,451580585.50,567.45,549.45,493.357.52±0.217.66±0.092.15±0.101012.255叶黄素445,470570569.50,551.50,533.50,459.4536.60±0.4935.55±0.2832.23±0.231113.105未鉴定组分b286,412,448460-1.24±0.07-1.49±0.061213.835未鉴定组分c332,419,443,4744717---4.18±0.131314.415未鉴定组分d331,426,450-8-10.54±0.175.30±0.076.09±0.171415.201玉米黄素450,476240569.45,551.5041.29±0.5130.13±0.1036.61±0.371516.835mutatoxanthin epimer407,426,452570585.50,567.45,549.4514.19±0.1015.08±0.059.93±0.161618.1859-cis-叶黄素338,446,4713716569.50,,551.50,477.5513.60±0.425.42±0.1018.74±0.231719.40815-cis-玉米黄素339,444,469849569.50,551.50,477.4019.43±0.3017.08±0.2422.24±0.171820.233zeinoxanthin330,442,469630553.45,535.50,461.452.65±0.071.02±0.06-1921.1815,8-环氧-β-隐黄素317,427,452490569.405.80±0.407.11±0.118.60±0.122022.1155,8-环氧-β-隐黄素314,427,452550569.408.76±0.2210.77±0.178.82±0.152124.871八氢番茄红素276,286,300-0545.552.38±0.192.00±0.052.31±0.072226.174六氢番茄红素326,341,365640543.501.12±0.050.97±0.031.19±0.042330.335β-隐黄素450,476250553.45,535.50,497.00,461.45186.26±0.43163.52±0.44188.34±0.642433.3359-cis-β-隐黄素324,411,446,472207553.50,535.55,461.405.00±0.203.54±0.076.83±0.132534.5489-cis-ζ-胡萝卜素297,379,397,423945541.553.08±0.092.69±0.023.47±0.062647.181ζ-胡萝卜素383,399,4251000541.551.95±0.121.47±0.042.14±0.052762.605β-胡萝卜素425,450,477250537.45,457.4,445.35,413.501.98±0.101.48±0.032.22±0.06总类胡萝卜素含量/(μg·g-1DW)590.49±0.590430.53±0.210569.83±0.490
注:-:未检出;Ⅲ/Ⅱ,光谱精细结构,类胡萝卜素光谱中第三吸收峰与第二吸收峰的峰高之比,%;AB/AⅡ,顺式峰强度,顺式吸收峰吸光度之比。
本研究以南丰蜜桔皮为原料,采用微波皂化法提取桔皮类胡萝卜素并对其组成进行鉴定。研究了不同因素对类胡萝卜素得率的影响,并选取微波功率、皂化时间、KOH-乙醇溶液浓度这3个影响较大的因素,利用响应面法对微波皂化法提取桔皮类胡萝卜素工艺进行优化,考虑实验的可行性及效应等综合因素,确定的最佳工艺条件为:微波功率为500 W、皂化时间为10 min、KOH-乙醇溶液浓度为1.0 mol/L,其类胡萝卜素得率为(0.709 6±0.11)‰,这一结果与陶俊[26]对南丰蜜桔皮类胡萝卜素含量的报道基本吻合,且类胡萝卜素得率显著高于甄天元[27]、曾东慧等[28]和TAO等[29]研究者所获得的类胡萝卜素得率。利用C30-HPLC-DAD -MS所鉴定出的23种桔皮类胡萝卜素组分与文献报道基本吻合,并分析检测了微波皂化、冷皂化、热皂化3种皂化方式下南丰蜜桔皮中类胡萝卜素的组成及含量,结果显示3种皂化方式下类胡萝卜素组分主要是以全反式形式存在,其中β-隐黄素、黄体黄质、9-cis-紫黄质、di-cis-新黄质、花药黄质、叶黄素、玉米黄素等为主要类胡萝卜素组分;微波皂化法获得的类胡萝卜素得率高于传统热皂化和冷皂化,能显著缩短分析时间,且类胡萝卜素在微波处理中表现出较高的稳定性,微波处理有效地抑制了皂化中类胡萝卜素的降解、氧化等副反应,因此微波皂化法比传统皂化法更有优势,这与LIU等[7]研究的玉米黄素酯的微波皂化与传统热回流皂化对比的结果相似。
本研究结果显示,微波皂化法提取桔皮类胡萝卜素,更有利于加速皂化反应、提高类胡萝卜素的得率,节能降耗,为类胡萝卜素的提取提供了新思路,同时也为桔皮类胡萝卜素的进一步利用提供了理论基础。
[1] RODRIGUEZ-CONCEPCION M, AVALOS J, LUISABONET M, et al. A global perspective on carotenoids: Metabolism, biotechnology, and benefits for nutrition and health[J]. Progress in Lipid Research, 2018,70:62-93.
[2] SAINI R K, NILE S H, PARK S W. Carotenoids from fruits and vegetables: Chemistry, analysis, occurrence, bioavailability and biological activities[J]. Food Research International, 2015,76(Pt 3):735-750.
[3] WEI X, HU H, TONG H, et al. Profiles of gene family members related to carotenoid accumulation in citrus genus[J]. Journal of Plant Biology, 2017,60(1):1-10.
[4] PETRY F C, MERCADANTE A Z, PETRY F C, et al. New method for carotenoid extraction and analysis by HPLC-DAD-MS/MS in freeze-dried citrus and mango pulps[J]. Journal of the Brazilian Chemical Society, 2018,29(1):206-215.
[5] MARTINS N, FERREIRA I C F R. Wastes and by-products: Upcoming sources of carotenoids for biotechnological purposes and health-related applications[J]. Trends in Food Science & Technology, 2017,62:33-48.
[6] DE l H A, D AZORTIZ A, MORENO A. Review on non-thermal effects of microwave irradiation in organic synthesis[J]. Journal of Microwave Power & Electromagnetic Energy A Publication of the International Microwave Power Institute, 2007, 41(1):45-66.
AZORTIZ A, MORENO A. Review on non-thermal effects of microwave irradiation in organic synthesis[J]. Journal of Microwave Power & Electromagnetic Energy A Publication of the International Microwave Power Institute, 2007, 41(1):45-66.
[7] LIU H, ZHANG Y,ZHENG B. Microwave-assisted hydrolysis of lutein and zeaxanthin esters in marigold (L.)[J]. International Journal of Food Sciences & Nutrition, 2011,62(8):851-856.
[8] 黄巧娟,盛冉,孙志高,等. 超声皂化法提取β-隐黄素[J]. 食品与发酵工业, 2016(10):210-215.
[9] PETRY F C, MERCADANTE A Z, PETRY F C, et al. New method for carotenoid extraction and analysis by HPLC-DAD-MS/MS in freeze-dried citrus and mango pulps[J].Journal of the Brazilian Chemical Society, 2018, 29(1):205-215.
[10] 王丽昀. 微波辅助提取天然产物有效成分工艺研究[D]. 北京:北京化工大学, 2010.
[11] 陈佩.处理技术对胡萝卜汁中类胡萝卜素提取效果的研究[D]. 西安:陕西师范大学, 2008.
[12] 胡玉琴,郁继华,王小龙,等. 辣椒叶片中类胡萝卜素组分分离及测定方法的研究[J]. 西北师范大学学报(自然科学版), 2015(4):75-80.
[13] ERNAWITA,WAHYUONO R A, HESSE J, et al. Carotenoids of indigenous citrus species from Aceh and its in vitro antioxidant, antidiabetic and antibacterial activities[J]. European Food Research & Technology, 2016,242(11):1-13.
[14] RIVERA S M, CHRISTOU P, CANELA GARAYOA R. Identification of carotenoids using mass spectrometry[J]. Mass Spectrometry Reviews, 2014,33(5):353-372.
[15] CHISTÉR C, MERCADANTE A Z. Identification and quantification, by HPLC-DAD-MS/MS, of carotenoids and phenolic compounds from the amazonian fruit caryocar villosum[J]. Journal of Agricultural and Food Chemistry, 2011,60(23):5 884-5 892.
[16] FARIA A F D, ROSSO V V D, MERCADANTE A Z. Carotenoid composition of jackfruit (Artocarpus heterophyllus), determined by HPLC-PDA-MS/MS[J]. Plant Foods for Human Nutrition, 2009,64(2):108-115.
[17] DUGO P, HERRERO M, GIUFFRIDA D, et al. Analysis of native carotenoid composition in orange juice using C30 columns in tandem[J]. Journal of Separation Science, 2008,31(12):2 151.
[18] XUE F, LI C, PAN S. Subacute toxicity assessment of carotenoids extracted from citrus peel (Nanfengmiju, Citrus reticulata Blanco) in rats[J]. Regulatory Toxicology and Pharmacology, 2012,62(1):16-22.
[19] LUO T, XU K, LUO Y, et al. Distinct carotenoid and flavonoid accumulation in a spontaneous mutant of ponkan (Citrus reticulata Blanco) results in yellowish fruit and enhanced postharvest resistance[J]. Journal of Agricultural and Food Chemistry, 2015,63(38):8 601-8 614.
[20] AGCS A, NAGY V, SZAB Z, et al. Comparative study on the carotenoid composition of the peel and the pulp of different citrus species[J]. Innovative Food Science & Emerging Technologies, 2007,8(3):390-394.
[21] XU C, FRASER P D, WANG W, et al. Differences in the carotenoid content of ordinary citrus and lycopene-accumulating mutants[J]. Journal of Agricultural and Food Chemistry, 2006,54(15):5 474-5 481.
[22] FARIN D, IKAN R, GROSS J. The carotenoid pigments in the juice and flavedo of a mandarin hybrid (Citrus reticulata) cv michal during ripening[J]. Phytochemistry, 1983,22(2):403-408.
[23] MELÉNDEZ-MART NEZ A J, BRITTON G, VICARIO I M, et al. Identification of zeinoxanthin in orange juices[J]. Journal of Agricultural and Food Chemistry, 2005,53(16):6 362-6 367.
NEZ A J, BRITTON G, VICARIO I M, et al. Identification of zeinoxanthin in orange juices[J]. Journal of Agricultural and Food Chemistry, 2005,53(16):6 362-6 367.
[24] KIMURA M, RODRIGUEZ-AMAYA D B, GODOY H T. Assessment of the saponification step in the quantitative determination of carotenoids and provitamins A[J]. Food Chemistry, 1990,35(3):187-195.
[25] CHEN B H, YANG S H. An improved analytical method for the determination of carotenes and xanthophylls in dried plant materials and mixed feeds[J]. Food Chemistry, 1992,44(1):61-66.
[26] 陶俊.柑橘果实类胡萝卜素形成及调控的生理机制研究[D].杭州:浙江大学, 2002.
[27] 甄天元,慕鸿雁. 橙皮中类胡萝卜素的提取工艺研究[J]. 安徽农业科学, 2012(29):14 493-14 495.
[28] 曾东慧,张俊,陆胜民. 响应曲面法提取温州蜜柑果皮中类胡萝卜素的工艺优化[J]. 食品工业科技, 2013,34(19):183-187.
[29] TAO N G, GAO Y M, LIU Y J, et al. Carotenoids from the peel of Shatian pummelo (Citrus grandis Osbeck) and its antimicrobial activity[J]. American-Eurasian Journal of Agricultural and Environmental Science, 2010,7(1):110-115.
[30] SOUZA H A L, MARIUTTI L R B, BRAGAGNOLO N. Microwave assisted direct saponification for the simultaneous determination of cholesterol and cholesterol oxides in shrimp[J]. Journal of Steroid Biochemistry and Molecular biology, 2017,169(SI):88-95.