青稞,主要分布在海拔4 000多米的高寒地区,如青海、西藏和四川西北部等,作为藏区的第一大粮食生产作物,种植面积最大,是农牧民的主粮[1]。青稞麸皮是青稞加工过程中的副产物,因具有很好的膳食纤维资源逐步受到人们的重视。青稞麸皮中的β-葡聚糖是由β-D-葡萄糖单元组成的长链线性多糖,是可溶性膳食纤维的主要组成部分[2]。研究表明,β-葡聚糖可以降低餐后血糖水平[3-4]和血液中胆固醇水平[5-6],并可改善血清脂质谱[7]等。WOOD等[8]发现β-葡聚糖在较低浓度时就可以形成黏性溶液或高黏度的凝胶,在食品加工中可将其作为增稠剂使用。因此,探索从青稞麸皮中提取β-葡聚糖的方法,对提高青稞麸皮的综合利用和附加值具有重要意义。
目前,溶剂水提(碱提醇沉)[9-11]是β-葡聚糖常见的提取方法之一,但是其存在提取效率低、提取时间长的缺点[12-13]。近年来,超声-微波联用技术作为一种新的提取方法,具有缩短提取时间、降低能耗和提高产品质量等特点[14-15]。梁茜茜等[16]研究了超声-微波协同提取时间、料液比、微波功率和pH对燕麦麸皮多糖得率的影响,燕麦麸多糖的得率与传统水提法相比提高了96.51%;张国财等[17]采用超声-微波协同法提取富硒蛹虫草硒多糖,硒多糖的提取率较水提法和超声法分别提高了3.70%、19.96%。超声-微波协同法是将超声波和微波这2种作用结合的综合利用技术,但尚未见超声-微波协同提取青稞β-葡聚糖的研究报道。本文通过单因素及正交试验探究超声-微波协同法提取青稞β-葡聚糖的工艺条件,并与水提法、超声法和微波法的提取效果进行对比。采用扫描电镜观察青稞麸皮粉在提取前后的结构变化,初步分析超声-微波协同提取的机制,以期为青稞β-葡 聚糖的开发利用提供参考。
青稞麸皮,由西藏昌都君亲农业科技开发有限公司提供,将青稞在脱皮机上碾压后取其第1道麸皮过80目筛得到青稞麸皮粉;β-葡聚糖标准品,美国Sigma公司;耐高温α-淀粉酶,阿拉丁公司;胰蛋白酶,广州赛国生物科技有限公司。其他化学试剂均为国产分析纯。
EG823LA6-NR型微波炉,美的公司;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;UV-2450 型紫外分光光度计,日本岛津公司;Phenom Pro-17A00403型扫描电镜,荷兰Phenom World公司。
1.3.1 原料预处理
青稞麸皮中含有一定的β-葡聚糖酶,因此提取前要先用乙醇回流灭酶。本试验中采用无水乙醇(麸皮粉∶乙醇=1∶4(g∶mL))在80 ℃下回流2 h灭酶,50 ℃下烘干备用。
1.3.2 超声-微波协同提取青稞β-葡聚糖
超声-微波协同提取青稞β-葡聚糖的提取工艺在文献[18-22]的基础上进行了改进。工艺流程如下:
青稞麸皮粉→加去离子水→超声波辅助提取→微波辅助提取→离心→除淀粉→除蛋白→离心→旋转蒸发浓缩→乙醇沉淀→离心→沉淀复溶→冷冻干燥→青稞β-葡聚糖
操作要点:称取5~6 g预处理后的青稞麸皮粉,按比例添加去离子水,混匀。经一定条件的超声和微波处理,离心(6 000 r/min、20 min)取上清液。滤渣加水,重复处理1次。合并2次滤液并调其pH为7.0, 以4 U/mL添加α-淀粉酶放置于90 ℃下处理40 min 除去淀粉;溶液冷至室温并调其pH为8.0,以1∶50的体积比添加1%的胰蛋白酶放置于37 ℃下处理30 min后灭酶。溶液冷却后调其pH为4.5,在4 ℃ 下静置12 h,离心(6 000 r/min、20 min)取上清液,经旋转蒸发浓缩后用体积分数为95%的乙醇以1∶3 的体积比沉淀12 h,离心(6 000 r/min、20 min)取沉淀,沉淀加水复溶后冷冻干燥即得青稞β-葡聚糖粗品。
1.3.3 β-葡聚糖含量测定及得率计算
采用刚果红法[23]测定β-葡聚糖含量,吸光值与β-葡聚糖含量的相关性方程为y=0.003 5x+0.007 1,相关系数为0.997 7,两者的相关性良好。将冷冻干燥后的β-葡聚糖溶于蒸馏水中,定容至250 mL,稀释到一定倍数后测定其吸光度。由标准曲线计算出样液中β-葡聚糖含量,再按式(1)计算β-葡聚糖得率:
得率![]()
(1)
式中:m,提取β-葡聚糖的质量,g;M,青稞麸皮粉质量,g。
1.3.4 单因素试验
以β-葡聚糖得率为试验指标,分别考察超声功率(100~500 W)、超声时间(5~40 min)、微波功率(100~1 000 W)、微波时间(1~5 min)、料液比(1∶10~1∶30 (g∶mL))5个单因素对β-葡聚糖得率的影响。单因素试验中不变的因素设定为料液比1∶15(g∶mL)、超声波功率200 W、超声波时间20 min、微波功率500 W、 微波时间3 min。
1.3.5 正交优化试验
根据单因素试验的结果,选择超声功率(A)、超声时间(B)、微波功率(C)、微波时间(D)进行L9(34)正交试验,优化超声-微波协同提取青稞麸皮β-葡聚糖的工艺,因素水平的选择见表1。
表1 正交试验因素水平表
Table 1 Factors and levels design of orthogonal test

水平A(超声功率)/WB(超声时间)/minC(微波功率)/WD(微波时间)/min1250155002.52300208003.03350251 0003.5
采用水提法[11]、超声法、微波法和本研究中的超声-微波协同法分别提取青稞β-葡聚糖,并比较不同方法间的提取效果,其中超声和微波的提取条件选择正交优化的结果。
本研究中每个试验均重复进行3次,并运用Microsoft Excel 2007、Origin 8.6和SPSS 18.0软件对实验数据进行整理、图表绘制和显著性分析(不同的字母表示P<0.05的显著性差异)。实验结果采用平均值±标准差表示。
2.1.1 超声功率对青稞麸皮β-葡聚糖得率的影响
如图1所示,在超声功率100~300 W时,β-葡聚糖的得率随着功率的增大显著提高;当功率超过300 W后,得率有所下降。

图1 超声功率对青稞麸皮β-葡聚糖得率的影响
Fig.1 Effect of ultrasonic power on the extraction efficiency of β-glucan
注:图中不同小写字母表示各处理组间差异显著。下同。
这可能是当超声功率较小时,超声波的空化作用随着功率的加大而有所增强,导致原料组织破碎程度加深,β-葡聚糖更多地被提取出来;另一方面可能是由于超声功率的增加加速了溶液的水循环,使得β-葡 聚糖更容易溶出和扩散到溶液中[18,24],但当超声波功率过大时,可能会导致青稞麸皮中一些非糖类杂质溶出和β-葡聚糖的降解程度变大[19-20],从而使得率有所降低。
2.1.2 超声时间对青稞麸皮β-葡聚糖得率的影响
如图2所示,β-葡聚糖得率在5~20 min呈线性增加,超声时间对得率具有显著性影响;但在超声20 min 后延长超声处理时间得率有所下降。这可能是在一定的时间范围内,随着超声时间的延长而使得溶液的振动时间延长,有利于β-葡聚糖的溶出;但超声时间过长会增大超声波作用强度,使β-葡聚糖的降解程度加大[19-20],从而导致β-葡聚糖得率下降。因此,超声时间应考虑在20 min左右。

图2 超声时间对青稞麸皮β-葡聚糖得率的影响
Fig.2 Effect of ultrasonic time on the extraction efficiency of β-glucan
2.1.3 微波功率对青稞麸皮β-葡聚糖得率的影响
如图3所示,微波功率对β-葡聚糖得率有显著性地影响。微波功率在100~1 000 W,随着微波功率的增加,青稞β-葡聚糖的得率呈现先上升后下降的趋势,当微波功率为800 W时,青稞β-葡聚糖的得率表现出最大值。可能是因为微波功率变大而使得微波的热效应作用增强,有助于提升原料内部的温度,从而使得原有的组织结构变得疏松,加大β-葡聚糖的溶出[25]。但微波功率过大可能会使得体系压力增大、溶剂温度迅速上升和溶剂挥发,造成β-葡聚糖溶出减少;同时当微波功率过高时原料容易溢出,易引起实验误差。
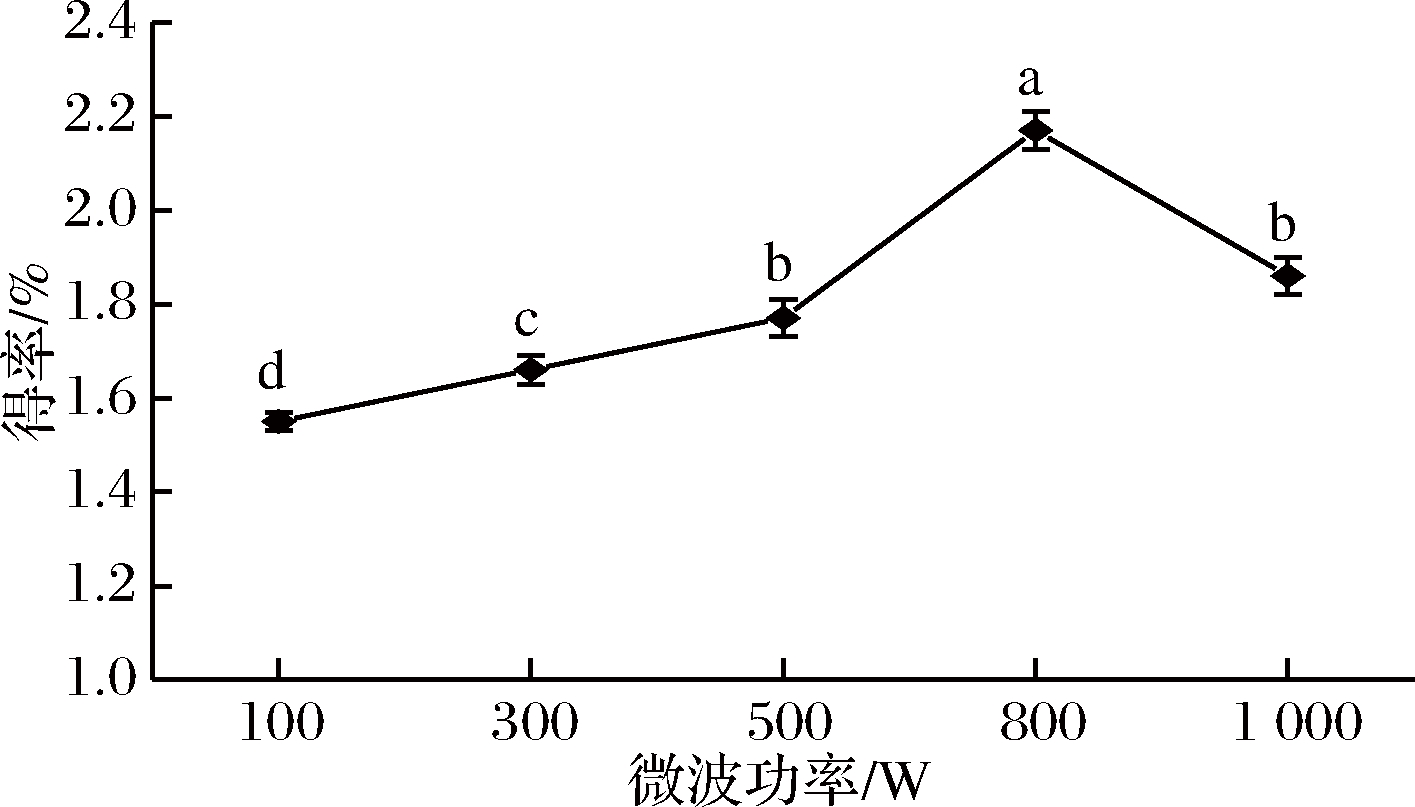
图3 微波功率对青稞麸皮β-葡聚糖得率的影响
Fig.3 Effect of microwave power on the extraction efficiency of β-glucan
2.1.4 微波时间对青稞麸皮β-葡聚糖得率的影响
如图4所示,短时间的微波处理有利于β-葡聚糖的溶出,当微波时间达3 min后再延长微波处理时间,得率却有所下降。可能是因为微波处理时间过短时并没有充分提高溶液的内部温度和压力,使得β-葡聚糖提取不够彻底。但是,长时间的微波处理可能会降低某些反应的活化能,从而促使β-葡聚糖分子与其他分子之间形成新的化学键,增加分子之间的作用力,阻止β-葡聚糖浸入溶液[15,25]。
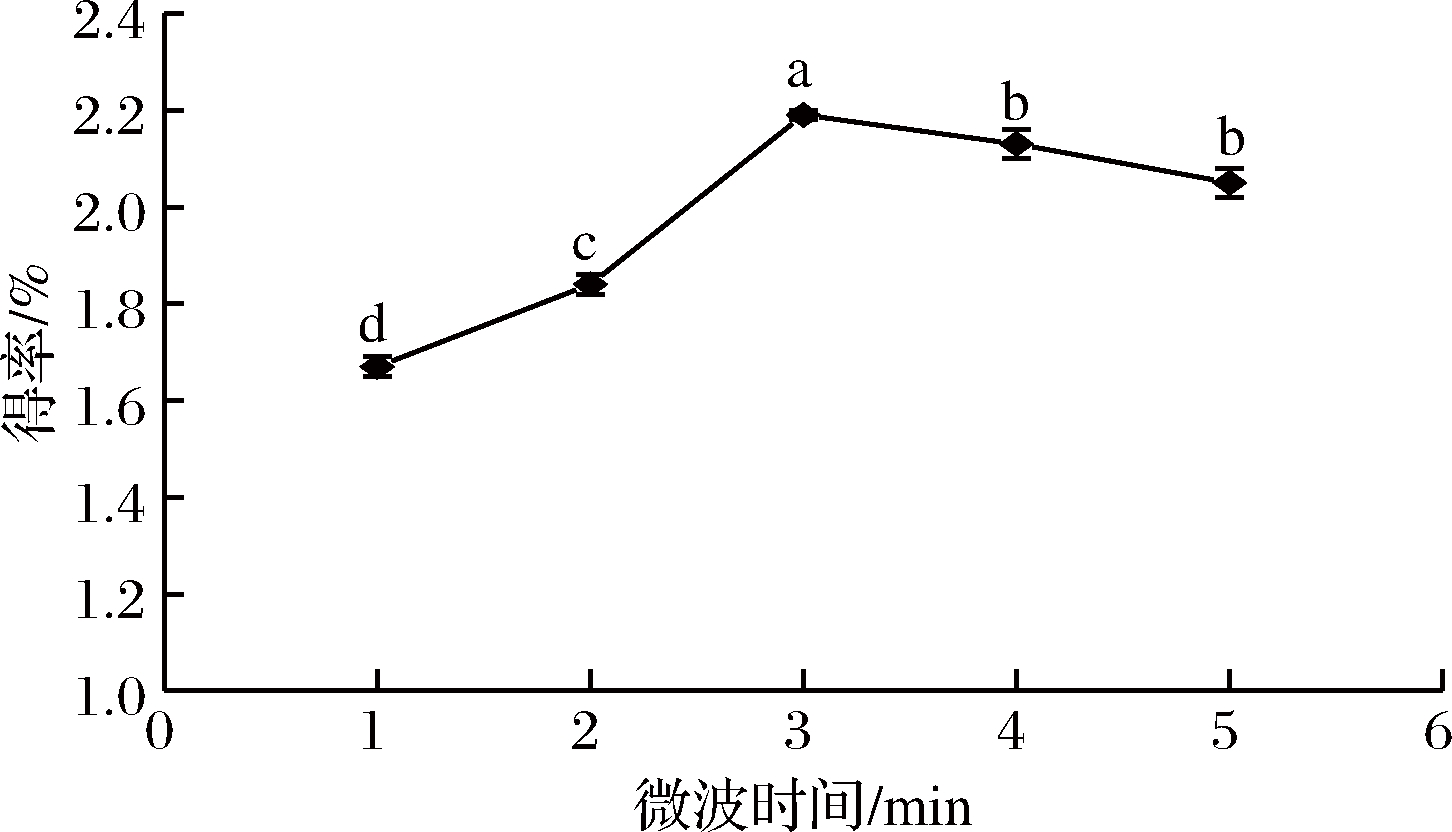
图4 微波时间对青稞麸皮β-葡聚糖得率的影响
Fig.4 Effect of microwave time on the extraction efficiency of β-glucan
2.1.5 料液比对青稞麸皮β-葡聚糖得率的影响
如图5所示,β-葡聚糖得率随着料液比的增加而增大,但是当料液比增加到一定程度后得率的增加幅度明显变缓。在固液萃取理论中,液体溶剂的增加可以加速溶质的溶出和扩散,但当液体溶剂的量增加到一定程度后会因溶质的溶出达到动态平衡而使得溶液中溶质含量不再增加或者增加趋于平稳。与此同时,考虑到实际的操作情况及后续的浓缩效率和耗能成本,因此本实验选择的料液比应为1∶25(g∶mL)左右。

图5 料液比对青稞麸皮β-葡聚糖得率的影响
Fig.5 Effect of solid to solvent ratio on the extraction efficiency of β-glucan
根据单因素试验结果,以青稞β-葡聚糖得率为试验指标,选择L9(34)正交实验,结果见表2。由表2可知,各因素对β-葡聚糖得率的影响程度依次为:微波功率>超声时间>超声功率>微波时间。其中微波功率对实验影响最大,极差为0.483,微波功率为800 W时β-葡聚糖得率最高,这与单因素试验结果是相符的。方差分析(表3)结果显示A、B、C、D四个因素对实验结果的影响均不显著,由统计学分析可知该正交水平选取合理,所以从直观分析得到最佳的工艺组合为A1B2C2D2,即超声功率250 W、超声时间20 min、微波功率800 W、微波时间3 min,在该条件下对正交实验的结果进行验证,β-葡聚糖的得率为(2.29±0.03)%。
表2 超声-微波协同提取青稞麸皮β-葡聚糖L9(34)正交试验结果
Table 2 Orthogonal array design L9(34)with experimental results of Ultrasonic-microwave synergistic extraction of β-glucan from hull-less barley bran
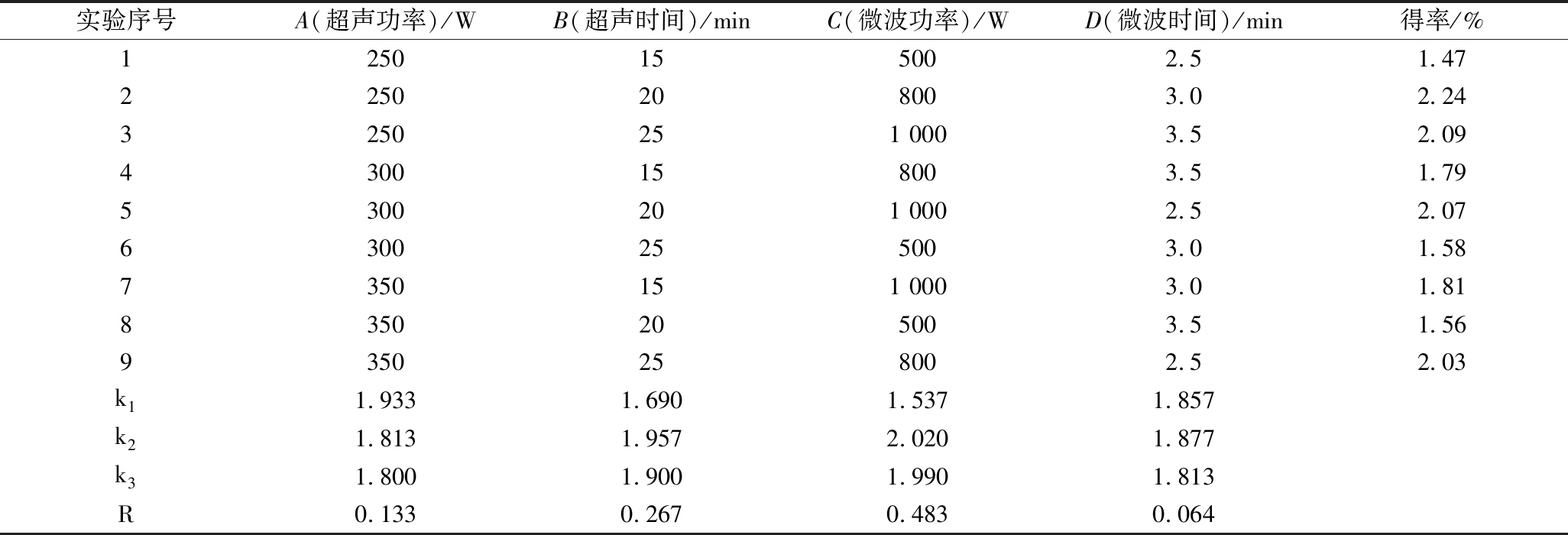
实验序号A(超声功率)/WB(超声时间)/minC(微波功率)/WD(微波时间)/min得率/%1250155002.51.472250208003.02.243250251 0003.52.094300158003.51.795300201 0002.52.076300255003.01.587350151 0003.01.818350205003.51.569350258002.52.03k11.9331.6901.5371.857k21.8131.9572.0201.877k31.8001.9001.9901.813R0.1330.2670.4830.064
表3 超声-微波协同提取青稞麸皮β-葡聚糖正交试验方差分析
Table 3 Analysis of variance of orthogonal array experimental results for Ultrasonic-microwave synergistic extraction of β-glucan from hull-less barley bran
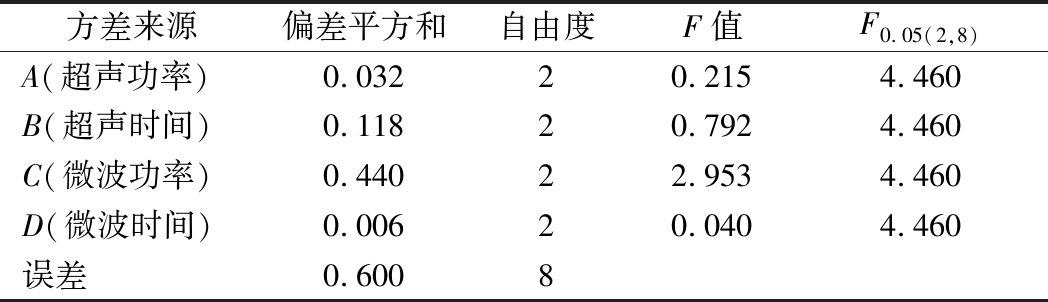
方差来源偏差平方和自由度F值F0.05(2,8)A(超声功率)0.03220.2154.460B(超声时间)0.11820.7924.460C(微波功率)0.44022.9534.460D(微波时间)0.00620.0404.460误差0.6008
超声-微波协同法与水提法(料液比1∶15(g∶mL)、提取温度80 ℃、提取时间2 h)、超声法(250 W、超声时间20 min)和微波法(微波功率800 W、微波时间3 min) 的提取效果进行对比。如图6,超声-微波协同法、水提法、超声法和微波法提取β-葡聚糖的得率分别为(2.29±0.03)%、(1.04±0.04)%、(1.45±0.05)%、 (1.93±0.04)%;超声-微波协同法的得率较这三者分别提高了120.19%、57.93%、18.65%。经SPSS 18.0软件进行显著性分析发现,超声-微波协同法显著性地提高了β-葡聚糖的得率。这与文献[16-17]中的研究结果类似。
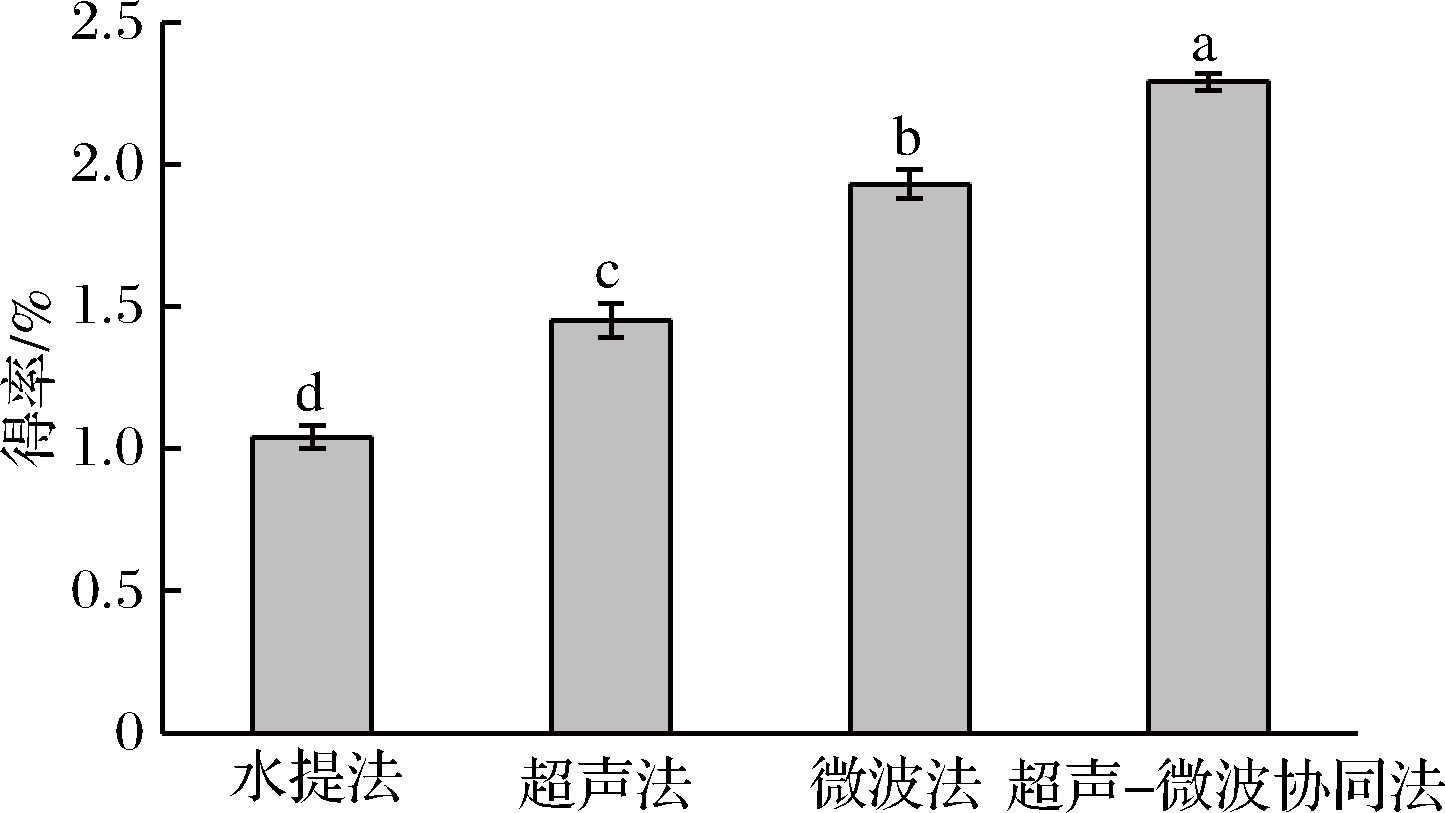
图6 不同提取方法的提取效果分析
Fig.6 Analysis of the extraction effect of different extraction methods
采用扫描电镜观察不同方法提取后青稞麸皮粉的表观结构变化,进一步分析超声-微波协同提取技术的机制。由扫描电镜的结果(图7)可以看出,青稞麸皮粉在水提后发生溶胀,原来紧密的结构变得松散;超声处理使其片状颗粒变得更加细小、均匀;微波提取使麸皮粉的表观结构明显发生了膨胀、体积增大;而超声-微波协同法使得麸皮粉的结构变得更加地膨大疏松、细碎多孔。对比分析不同扫描电镜图后,可能是超声-微波联用结合了超声波的空化作用与微波的热效应,而超声波的机械振动作用打破了青稞麸皮粉的组织结构,微波的热效应可以在短时间升高其内部温度,使结构变得膨胀,使超声-微波协同提取后青稞麸皮的表面结构膨大多孔、细碎松散。对比不同提取方法的提取效果,超声-微波协同提取法是将机械振动和热效应有机结合后更彻底地破坏麸皮粉表面结构,有利于β-葡聚糖溶出,从而提高β-葡聚糖得率。

图7 青稞麸皮粉扫描电镜图(×5 000)
Fig.7 The images of scanning electron microscope(×5 000)
(1)对正交试验结果分析可知,影响β-葡聚糖得率的因素主要为微波功率和超声时间;最佳工艺参数为:超声功率250 W、超声时间20 min、微波功率800 W、 微波时间3 min、料液比1∶25(g∶mL),在该条件下β-葡聚糖得率为2.29%。
(2)超声-微波协同法与水提法、超声法和微波法相比,β-葡聚糖得率分别提高了120.19%、57.93%、18.65%。
(3)扫描电镜结果显示超声-微波协同提取法使青稞麸皮粉的结构变得更加膨大疏松、细碎多孔,颗粒间缝隙变大,有利于β-葡聚糖的溶出。然而,关于不同提取方法对青稞β-葡聚糖的分子结构、分子质量、理化特性和生理功能的影响还有待进一步的研究。
[1] 张峰,杨勇,赵国华,等.青稞β-葡聚糖研究进展[J].粮食与油脂,2003(12):3-5.
[2] LIMBERGERBAYER V M, DE F A, CHAN A, et al. Barley β-glucans extraction and partial characterization[J]. Food Chemistry, 2014,154(154):84-89.
[3] WOOD P J, BRAATEN J T, SCOTT F W, et al. Effect of dose and modification of viscous properties of oat gum on plasma glucose and insulin following an oral glucose load[J]. Br J Nutr, 1994,72(5):731-743.
[4] 汪海波.燕麦中β-葡聚糖的化学结构、溶液行为及降血糖作用的机制研究[D].武汉:华中农业大学,2004:125-128.
[5] RIMM E B, ASCHERIO A, GIOVANNUCCI E, et al. Vegetable, fruit, and cereal fiber intake and risk of coronary heart disease among men[J]. Jama, 1996, 275(6):447-451.
[6] 申瑞玲,王志瑞,董吉林,等.燕麦β-葡聚糖对高脂血症大鼠空腹和餐后脂代谢的影响[J].食品科学,2009,30(1):260-262.
[7] INYOUNG B, SUYONG L, SUNGMI K, et al. Effect of partially hydrolyzed oat β-glucan on the weight gain and lipid profile of mice[J].Food Hydrocolloids, 2009, 23(7):2 016-2 021.
[8] WOOD P J. Cereal -glucans in diet and health[J]. Journal of Cereal Science, 2007, 46(3):230-238.
[9] 姜忠杰,李国明,周明,等.青稞麸皮可溶性粗多糖的提取及其抗氧化性研究[J].中国食品添加剂,2012(6):70-77.
[10] 刘焕云,李慧荔,马志民.燕麦麸中β-葡聚糖的提取与纯化工艺研究[J].中国粮油学报,2008,23(2):56-58.
[11] 贾莹.青稞麸皮水溶性β-葡聚糖的提取、分离纯化和性质研究[D].上海:华东理工大学,2013:10-12.
[12] ZHU F, DU B, XU B. A critical review on production and industrial applications of beta-glucans[J]. Food Hydrocolloids, 2016,52:275-288.
[13] 申瑞玲,何俊,赵学伟.谷物β-葡聚糖的提取方法、化学结构及功能性质研究进展[J].食品科学,2009,30(3):288-291.
[14] LIANFU Z, ZELONG L. Optimization and comparison of ultrasound/microwave assisted extraction (UMAE) and ultrasonic assisted extraction (UAE) of lycopene from tomatoes[J]. Ultrasonics Sonochemistry, 2008,15(5):731-737.
[15] EKEZIE F G C, SUN D W, HAN Z, et al. Microwave-assisted food processing technologies for enhancing product quality and process efficiency: A review of recent developments[J]. Trends in Food Science & Technology, 2017,67:58-69.
[16] 梁茜茜,李芬,李良玉,等.超声-微波协同法提取燕麦麸皮多糖的参数优化及结构分析[J].中国食品添加剂,2016(9):178-187.
[17] 张国财,赵博,刘春延,等.响应面法优化超声波-微波协同提取富硒蛹虫草硒多糖工艺[J].食品科学,2016,37(12):33-39.
[18] 徐菲,党斌,迟德钊.超声波辅助提取青稞β-葡聚糖工艺优化[J].食品科技,2014(12):217-221.
[19] BENITO-ROM N
N , ALONSO E, COCERO M J. Ultrasound-assisted extraction of β-glucans from barley[J]. LWT-Food Science and Technology,2013,50(1):57-63.
, ALONSO E, COCERO M J. Ultrasound-assisted extraction of β-glucans from barley[J]. LWT-Food Science and Technology,2013,50(1):57-63.
[20] 刘振春,刘春萌,苏彤.响应面优化超声波辅助提取大麦β-葡聚糖工艺[J].食品科学,2013,34(14):113-117.
[21] 王若兰,姚玮华.青稞膳食纤维微波法提取工艺的研究[J].食品科学,2005,26(6):169-174.
[22] 罗燕平,李家林,张雪飞.微波辅助提取青稞β-葡聚糖工艺优化[J].农产品加工,2016(14):35-38.
[23] 江春艳,严冬,袁瑞瑛,等.紫外分光光度法测定西藏青稞中β-葡聚糖的含量[J].西藏大学学报(自然科学版),2010,25(1):12-16.
[24] 康田田,董海洲,侯汉学,等.响应面法优化紫麦麸中水溶性β-葡聚糖提取工艺研究[J].中国食物与营养,2013,19(1):40-45.
[25] AKTAS-AKYILDIZ E, SIBAKOV J, NAPPA M, et al. Extraction of soluble β-glucan from oat and barley fractions: Process efficiency and dispersion stability[J]. Journal of Cereal Science,2018,81:60-68.