柑橘是我国重要的经济作物。其果实富含可溶性糖、有机酸、Vc、矿物质、膳食纤维等营养物质以及类黄酮、类胡萝卜素、香豆素类等功能性物质[1-2],且自古以来,橘络、枳壳、枳实、青皮、陈皮就是传统的中药材,具有理气健脾,燥湿化痰等作用[3],在中医临床中应用广泛。我国常见种植品种为宽皮柑橘、橙、柚、柠檬和枸橼等[4];据国家统计局数据显示,2017年我国柑橘总产量达到3 816.78万t,但加工利用程度远远不足,主要集中在橙汁和橘罐头等产品,鲜销压力大,甚至滞销。
近年来乳酸菌发酵果蔬汁备受关注,既提供调节肠道微生物平衡、促进消化的益生菌,又可通过苹果酸-乳酸发酵赋予果蔬汁发酵风味[5],甚至可能影响到果蔬汁中功能性物质及其生理作用[6]。目前已有部分国内外学者对乳酸菌发酵柑橘汁进行研究[7-9],主要采用去皮果汁为原料进行轻度发酵,果皮部分的功能性物质未能得到很好利用;以柑橘全果汁发酵基质的研究还鲜有报道,仅限于果酒和果醋方面[10-11]。同时,原料品种在很大程度上影响着果实中可溶性糖、有机酸、黄酮、挥发性物质等种类及其含量[12-13],这些特征均与微生物发酵、产品品质密切相关[14-15],因此应选择合适的柑橘品种进行乳酸菌发酵。
课题组从传统发酵食品中筛选得到植物乳杆菌L.plantarum 15,具有良好发酵性能和高安全性;前期实验表明其适用于柑橘带皮渣全果汁的半固态发酵,且苦涩味不明显。本文以市场常见的宽皮柑橘(蜜桔,春见)、柚(胡柚)和橙(脐橙)4种柑橘为研究对象,探讨其全果汁在植物乳杆菌L.plantarum15发酵过程中各物质的变化以及发酵前后挥发性物质变化。
市售蜜桔(C.unshiu Marcow,温州)、胡柚(C.paradise Macf,常山)、脐橙(C.sinensis Osbeck,赣南)、春见[(C.unshiu Marcow ×C.sinensis Osbeck) ×C.reticulata Blanco,浦江],选择成熟度合适、无明显缺陷的新鲜果品。植物乳杆菌L.plantarum15为浙江工业大学食品科学与工程专业所保藏。
PHB-4便携式pH计,上海仪电科学仪器股份有限公司;752型紫外分光光度计,上海光谱仪器有限公司;Thermo Trace1300-ISQ单四极杆气相色谱-质谱联用仪,美国Thermo公司;SPME手动进样装置、萃取纤维头50/30 μm DVB/CAR/PDMS,美国Supelco公司;YXQ-LS-50高压灭菌锅、SPX-250B-Z生化培养箱,上海博迅实业有限公司医疗设备厂;美的JE25C11榨汁机,广东美的生活电器制造有限公司。
1.3.1 柑橘全果汁的发酵
柑橘全果依次用次氯酸钠溶液(有效氯质量分数0.06%)和水清洗后,采用电动榨汁机对其进行压榨,得到富含果肉果皮的浑浊型柑橘全果汁,调整其pH值为4.5,按100 mL体积分装到250 mL已灭菌的三角瓶中,无菌条件下接种一定量的植物乳杆菌L.plantarum 15,于30 ℃下发酵10 d。
1.3.2 化学成分分析
采用酸度计测定pH值;采用硫酸-苯酚法测定总糖含量[16];采用3,5-二硝基水杨酸比色法(DNS法)测定还原糖含量[16];采用电位滴定法测定总酸含量[17];采用硝酸铝比色法测定总黄酮含量[17]。
1.3.3 挥发性物质的测定
1.3.3.1 顶空固相微萃取条件
3 mL样液置于15 mL顶空样品瓶中,加入1.1 g NaCl,40 ℃下平衡5 min后,插入50/30 μm DVB/CAR/PDMS萃取头,40 ℃吸附20 min;快速取出萃取头并插入气相色谱仪进样口,250 ℃解吸5 min。
1.3.3.2 色谱条件
色谱柱:DB-5 MS毛细管柱(60 m×0.25 mm×0.25 μm);升温程序:30 ℃保持2 min,以5 ℃/min升至250 ℃,保持5 min,载气(He)流速1.0 mL/min,分流比10∶1。
1.3.3.3 质谱条件
电子轰击(electron impact,EI)离子源;电子能量70 eV;传输线温度250 ℃;离子源温度250 ℃;质量扫描范围m/z 40~550,扫描速率0.2 scan/s。
1.3.3.4 定性方法
GC-MS数据定性采用各组分在图谱库NIST和Xcalibur 3.0(Thermo Fisher Scientific)中匹配度大于80%的鉴定结果,并与文献资料[13]相关化合物保留指数(retention index, RI)进行比对分析,挥发性物质的相对百分含量按峰面积归一法进行计算。
每组样品平行测定3次,均值、标准偏差计算及作图采用Graphpad Prism 7软件,主成分分析和显著性差异分析采用SPSS软件,数据统计采用Duncan统计方法,显著性差异水平为0.05。
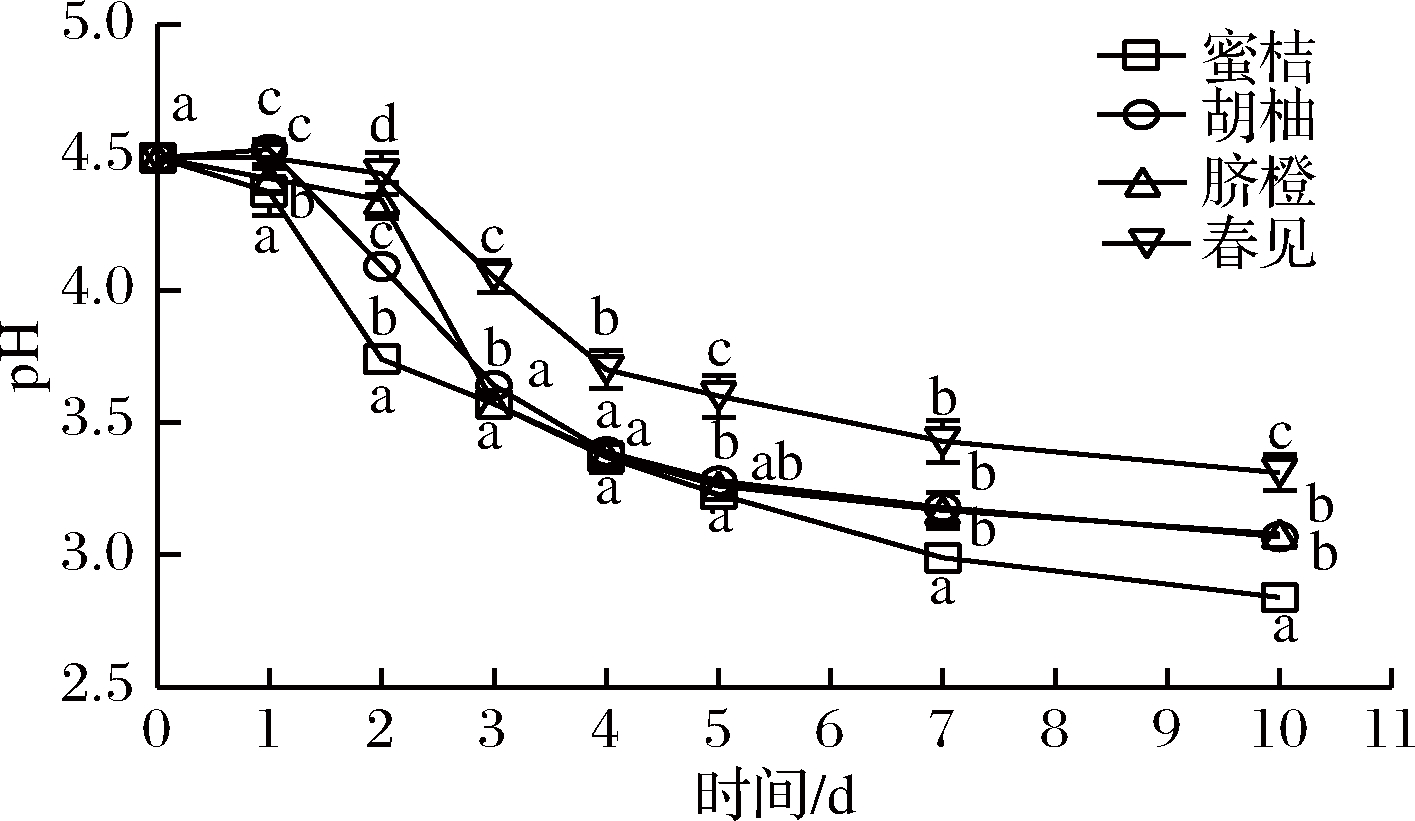
植物乳杆菌L.plantarum 15发酵不同品种柑橘全果汁过程中pH变化如图1所示。结果表明,蜜桔、胡柚、脐橙和春见全果汁pH值在发酵前期(1~2 d) 基本保持稳定,而后发生快速下降并逐渐趋于平缓。这是由于果汁起始pH值较低(4.50),且氮源营养物质不足,在此环境中乳酸菌生长延滞期增加,甚至酸胁迫下其活菌数量发生下降[16-18];RATCHADAPORN等[16]发现起始pH<4.5条件下,腰果梨汁经植物乳杆菌发酵后其pH未有明显变化。随着植物乳杆菌L.plantarum 15对柑橘全果汁环境的适应,其利用葡萄糖、果糖和蔗糖等进行同型发酵,产生大量乳酸,当乳酸积累达到一定程度时又会抑制其自身的生长,造成pH快速下降。蜜桔全果汁的pH下降时间明显早于胡柚、脐橙和春见全果汁,且下降程度与后三者之间存在显著差异,发酵10 d后,其pH值由4.50降至2.84,低于曹雪丹等[9]报道。这说明原料品种在一定程度上影响着植物乳杆菌L.plantarum 15对柑橘全果汁的发酵进程,其中蜜桔全果汁更适合乳酸菌的生长发酵。

图1 植物乳杆菌L.plantarum 15发酵柑橘全果汁过程中pH的变化
Fig.1 Changes in pH of citrus juices during fermentation byL.plantarum 15
注:不同小写字母表示处理组间差异显著(P<0.05)。下同。
植物乳杆菌L.plantarum15发酵不同品种柑橘全果汁过程中总糖、还原糖、总酸和总黄酮等含量变化如图2~图5所示。
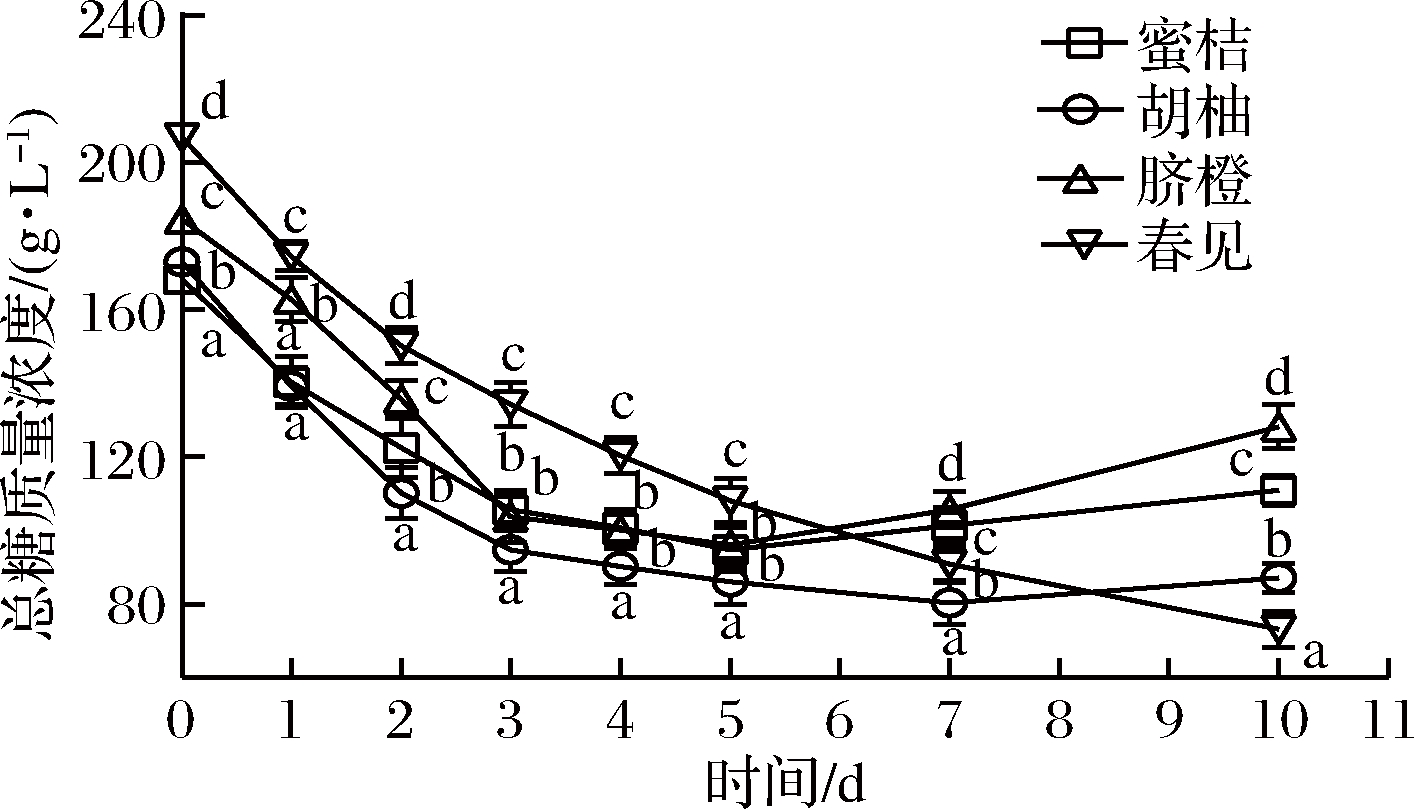
图2 植物乳杆菌L.plantarum 15发酵柑橘全果汁过程中总糖含量的变化
Fig.2 Changes in total sugar content of citrus juices during fermentation byL.plantarum 15

图3 植物乳杆菌L.plantarum 15发酵柑橘全果汁过程中还原糖含量的变化
Fig.3 Changes in reducing sugar content of citrus juices during fermentation byL.plantarum 15
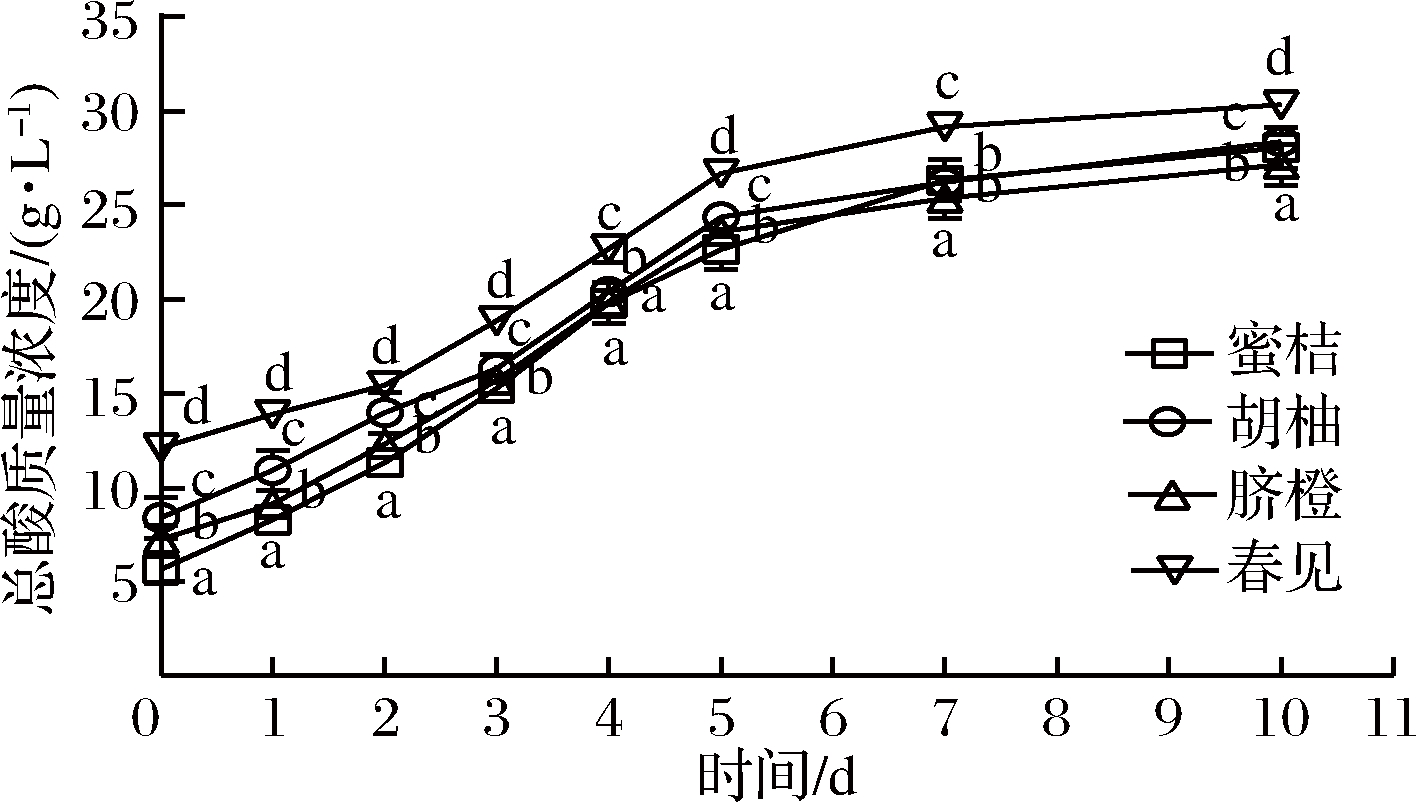
图4 植物乳杆菌L.plantarum 15发酵柑橘全果汁过程中总酸含量的变化
Fig.4 Changes in total acid content of citrus juices during fermentation byL.plantarum 15
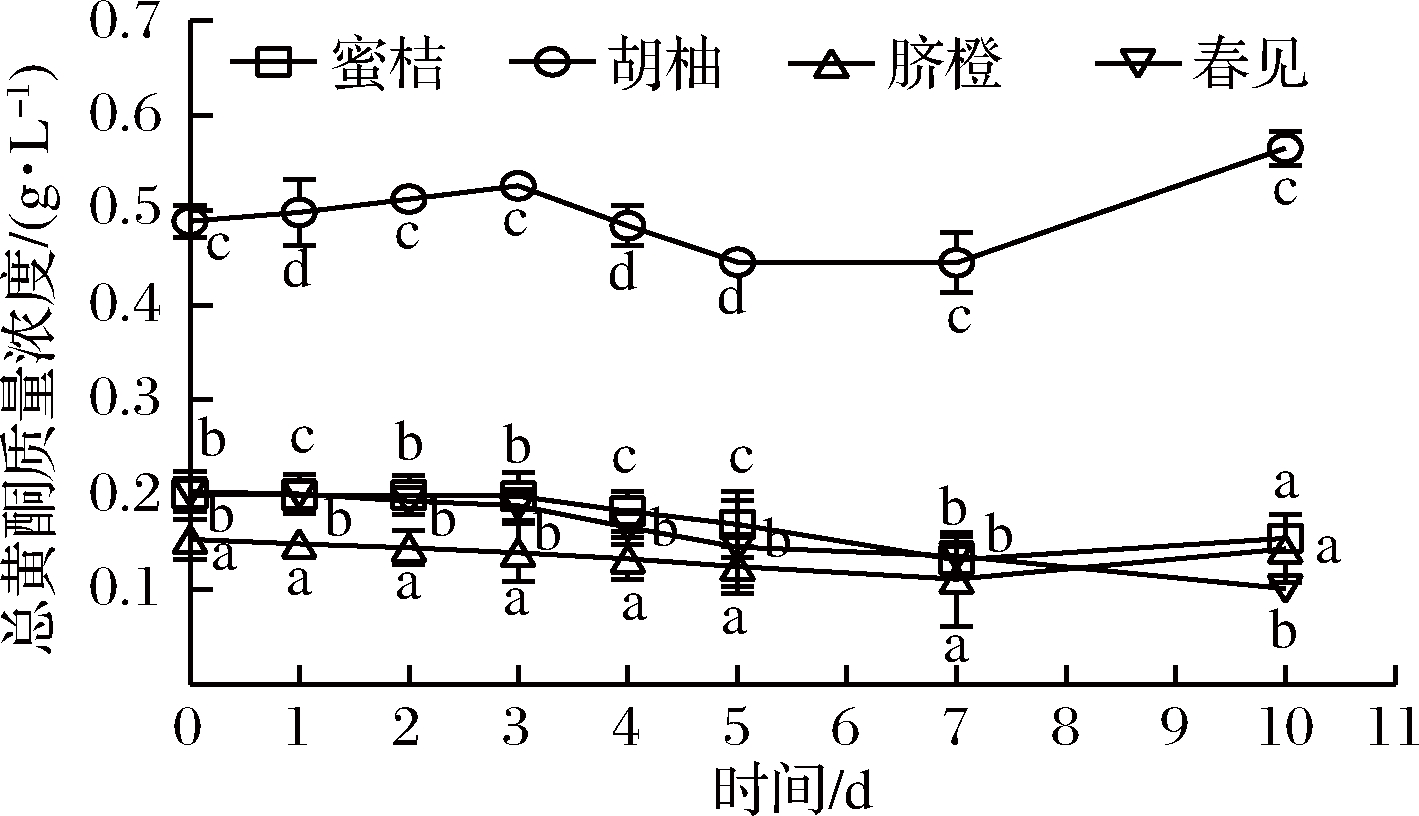
图5 植物乳杆菌L.plantarum 15发酵柑橘全果汁过程中总黄酮含量的变化
Fig.5 Changes in total flavonoids content of citrus juices during fermentation byL.plantarum 15
结果表明,发酵过程中蜜桔、胡柚、脐橙和春见全果汁中总糖含量(见图2)和还原糖(见图3)含量均发生下降,但两者下降幅度并不一致,主要是因为柑橘中葡萄糖、果糖和蔗糖等起始含量不相同,而乳酸菌对各种糖的利用次序不同[19];经植物乳杆菌L.plantarum 15发酵10 d后,春见全果汁中总糖含量显著降低了64.66%,蜜桔全果汁中还原糖含量明显降低了50.71%。随着发酵时间的增加,蜜桔、胡柚、脐橙和春见等全果汁中总酸含量(见图4)随之明显增加,与pH变化(见图1)相一致,主要源于乳酸菌同型发酵所积累的乳酸,发酵10 d后总酸含量分别增加了22.38、19.94、19.89和18.22 g/L。此外,蜜桔、脐橙和春见等全果汁中总黄酮(见图5)含量基本发生下降而后呈现一定程度上的增加,胡柚全果汁中总黄酮含量随发酵时间则表现为上升-下降-上升的变化趋势,曹雪丹等[9]亦发现乳酸菌发酵瓯柑汁中橙皮苷、柚皮苷等黄酮含量明显降低,但与杨冲等[17]的结果相反;推测其原因是乳酸菌可分泌糖苷酶[20],一方面黄酮苷被水解成水不溶的黄酮苷元,另一方面膳食纤维结合的黄酮得到释放。值得关注的是,胡柚发酵全果汁中总黄酮含量远高于其他3种柑橘发酵全果汁。
不同品种柑橘全果汁发酵前后挥发性物质种类及其相对含量如表1和表2所示。蜜桔、胡柚、脐橙和春见等全果汁及其发酵全果汁中共检出46种挥发性物质,均以烯类为主,其中D-柠檬烯相对含量最高(82.04%~88.76%),这与李汴生[5]、束文秀等[8]报道相一致。与全果汁相比较,发酵全果汁中烯类相对含量稍有增加,因为乳酸菌分泌糖苷酶,释放键合态烯类成游离态[21-22],其中β-月桂烯和γ-松油烯相对含量的提高可增强橘香风味;醛类种类及其相对含量明显减少,如己醛、辛醛和癸醛等相对含量显著降低甚至未检出,CAGNOTRO等[23]认为醛类在外源性乳酸菌代谢作用下还原成为醇类,导致果汁的清香风味减弱。但植物乳杆菌L.plantarum 15发酵并未能丰富醇、酯、酮、酸等挥发性物质种类,其中乙醇、芳樟醇相对含量发生明显减少,4-萜烯醇相对含量得到显著提高,而酯类和酮类的相对含量基本无变化,仅在蜜桔发酵全果汁和胡柚发酵全果汁中检出乙酸。
蜜桔、胡柚、脐橙和春见发酵全果汁在挥发性物质种类与相对含量等方面均存在着很大的差异,如前两者中醛类种类较少,后者烯类种类较少,而脐橙发酵全果汁中可检出香橙烯,且与其全果汁情况基本一致;这说明发酵全果汁中挥发性物质很大程度上取决于原料品种,其与乳酸菌代谢共同构建出嗅感风味的复杂性和典型性。蜜桔发酵全果汁中主要挥发性物质为柠檬烯、γ-松油烯、β-月桂烯、β-榄香烯、金合欢烯、大根香叶烯D、4-萜烯醇、芳樟醇和乙酸,胡柚发酵全果汁中主要挥发性物质为柠檬烯、γ-松油烯、β-月桂烯、大根香叶烯D、大根香叶烯B、4-萜烯醇、萘酚乙酸酯和乙酸;脐橙发酵全果汁中主要挥发性物质为柠檬烯、β-月桂烯、香橙烯、γ-松油烯、癸醛、芳樟醇和4-萜烯醇,春见发酵全果汁中主要挥发性物质为柠檬烯、γ-松油烯、β-月桂烯、α-蒎烯、癸醛、芳樟醇和4-萜烯醇。
表1 柑橘全果汁发酵前后挥发性物质组成及其相对含量
Table 1 Composition and relative contents of volatile compounds in citrus juices before and after fermentation
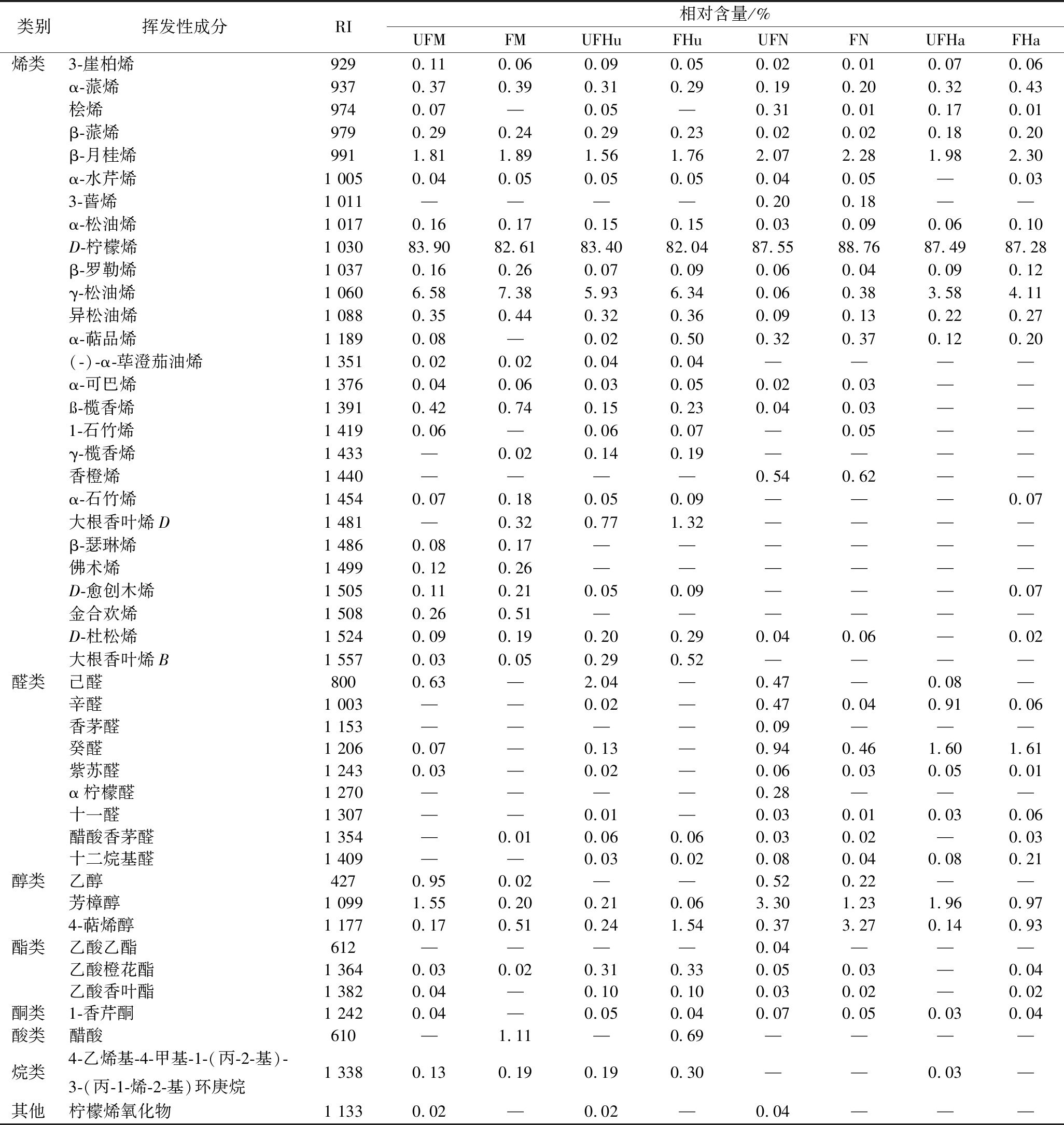
类别挥发性成分RI相对含量/%UFMFMUFHuFHuUFNFNUFHaFHa烯类3-崖柏烯9290.110.060.090.050.020.010.070.06 α-蒎烯9370.370.390.310.290.190.200.320.43 桧烯9740.07—0.05—0.310.010.170.01 β-蒎烯9790.290.240.290.230.020.020.180.20 β-月桂烯9911.811.891.561.762.072.281.982.30 α-水芹烯1 0050.040.050.050.050.040.05—0.03 3-蒈烯1 011————0.200.18—— α-松油烯1 0170.160.170.150.150.030.090.060.10 D-柠檬烯1 03083.9082.6183.4082.0487.5588.7687.4987.28 β-罗勒烯1 0370.160.260.070.090.060.040.090.12 γ-松油烯1 0606.587.385.936.340.060.383.584.11 异松油烯1 0880.350.440.320.360.090.130.220.27 α-萜品烯1 1890.08—0.020.500.320.370.120.20 (-)-α-荜澄茄油烯1 3510.020.020.040.04———— α-可巴烯1 3760.040.060.030.050.020.03—— ß-榄香烯1 3910.420.740.150.230.040.03—— 1-石竹烯1 4190.06—0.060.07—0.05—— γ-榄香烯1 433—0.020.140.19———— 香橙烯1 440————0.540.62—— α-石竹烯1 4540.070.180.050.09———0.07 大根香叶烯D1 481—0.320.771.32———— β-瑟琳烯1 4860.080.17—————— 佛术烯1 4990.120.26—————— D-愈创木烯1 5050.110.210.050.09———0.07 金合欢烯1 5080.260.51—————— D-杜松烯1 5240.090.190.200.290.040.06—0.02 大根香叶烯B1 5570.030.050.290.52————醛类己醛8000.63—2.04—0.47—0.08— 辛醛1 003——0.02—0.470.040.910.06 香茅醛1 153————0.09——— 癸醛1 2060.07—0.13—0.940.461.601.61 紫苏醛1 2430.03—0.02—0.060.030.050.01 α柠檬醛1 270————0.28——— 十一醛1 307——0.01—0.030.010.030.06 醋酸香茅醛1 354—0.010.060.060.030.02—0.03 十二烷基醛1 409——0.030.020.080.040.080.21醇类乙醇4270.950.02——0.520.22—— 芳樟醇1 0991.550.200.210.063.301.231.960.97 4-萜烯醇1 1770.170.510.241.540.373.270.140.93酯类乙酸乙酯612————0.04——— 乙酸橙花酯1 3640.030.020.310.330.050.03—0.04 乙酸香叶酯1 3820.04—0.100.100.030.02—0.02酮类1-香芹酮1 2420.04—0.050.040.070.050.030.04酸类醋酸610—1.11—0.69————烷类4-乙烯基-4-甲基-1-(丙-2-基)-3-(丙-1-烯-2-基)环庚烷1 3380.130.190.190.30——0.03—其他柠檬烯氧化物1 1330.02—0.02—0.04———
注: “—”代表未检出。UFM和FM分别代表蜜桔全果汁及其发酵全果汁; UFHu和FHu分别代表胡柚全果汁及其发酵全果汁; UFN和FN分别代表脐橙全果汁及其发酵全果汁; UFHa和FHa分别代表春见全果汁及其发酵全果汁。下同。
表2 柑橘全果汁发酵前后的各类挥发性物质相对百分含量 单位:%
Table 2 Relative contents of fractions of volatile compounds in citrus juice before and after fermentation
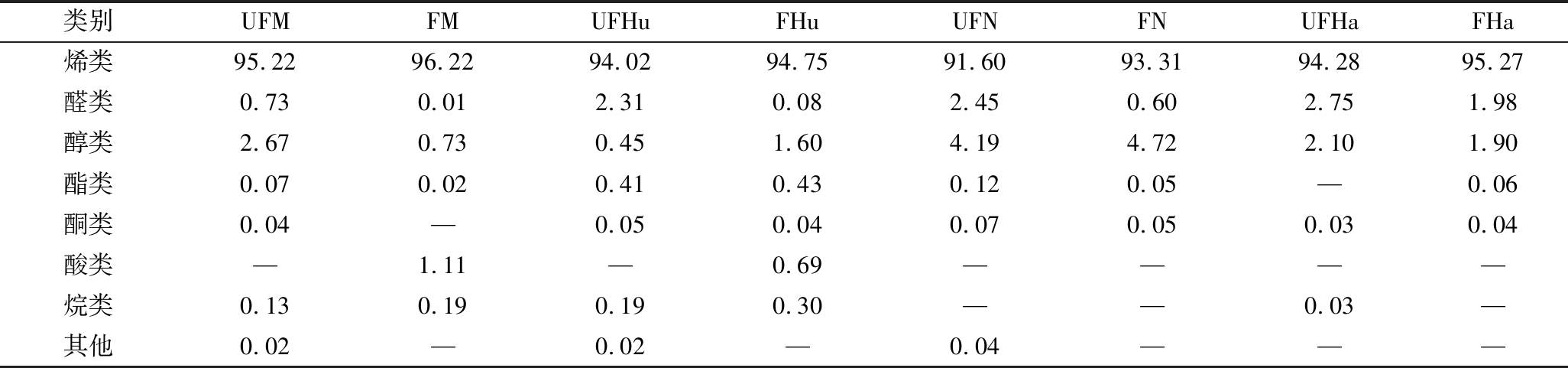
类别UFMFMUFHuFHuUFNFNUFHaFHa烯类95.2296.2294.0294.7591.6093.3194.2895.27醛类0.730.012.310.082.450.602.751.98醇类2.670.730.451.604.194.722.101.90酯类0.070.020.410.430.120.05—0.06酮类0.04—0.050.040.070.050.030.04酸类—1.11—0.69————烷类0.130.190.190.30——0.03—其他0.02—0.02—0.04———
4种全果汁及其发酵全果汁中的主成分分析的特征值及其贡献率结果如表3所示。
表3 主成分特征值及其贡献率
Table 3 Eigenvalues and variance contribution rate of principal components
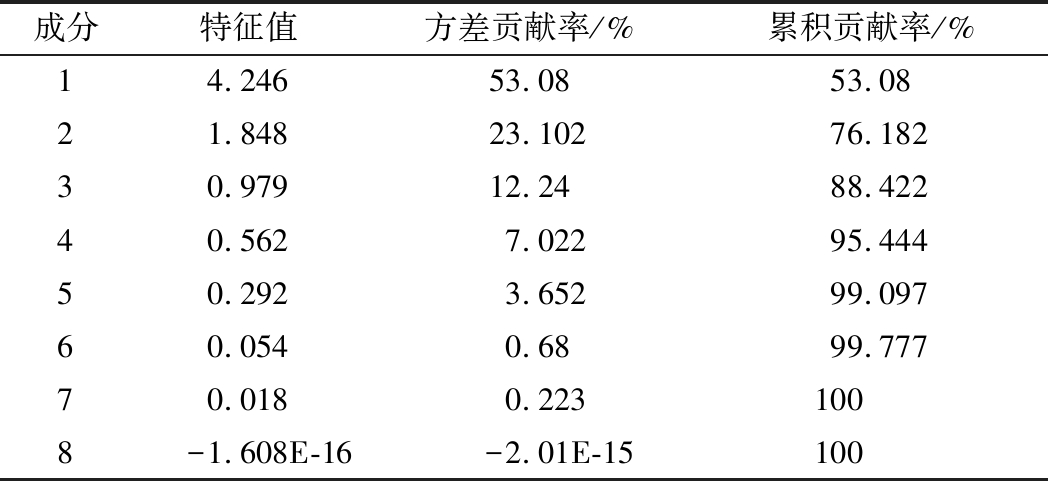
成分特征值方差贡献率/%累积贡献率/%14.24653.0853.0821.84823.10276.18230.97912.2488.42240.5627.02295.44450.2923.65299.09760.0540.6899.77770.0180.2231008-1.608E-16-2.01E-15100
第一主成分和第二主成分对应的特征值大于1,所以提取前两个主成分,方差贡献率分别为53.080%、23.102%,累积贡献率达76.182%,基本可以反映全部指标的信息,第一主成分主要反映烯类、醛类、酮类、酸类及其他类的指标,第二主成分主要反映醇类、酯类和烷类的指标。
第一主成分和第二主成分散点图结果如图6所示。其中第一主成分与脐橙全果汁呈高度正相关;第二主成分胡柚全果汁和胡柚发酵全果汁呈高度正相关。根据距离的远近,蜜桔、胡柚和脐橙全果汁发酵前后挥发性物质变化较大;而春见全果汁发酵前后挥发性物质变化较小。此外,蜜桔全果汁和春见全果汁中挥发性物质比较接近,发酵后两者之间差异性得到增加;而植物乳杆菌L.plantarum 15发酵减弱了脐橙全果汁和春见全果汁中挥发性物质的差异性。这进一步说明柑橘发酵全果汁的挥发性物质主要取决于原料本身,但乳酸菌发酵可在一定程度上影响到其挥发性物质。

图6 柑橘全果汁及其发酵全果汁的主成分散点图
Fig.6 PCA analysis for unfermented and fermented citrus juices
大量研究证实,不同品种的柑橘在理化性质、风味和生物活性等方面存在着很大的差异[12]。本文以蜜桔、胡柚、脐橙和春见为研究对象,利用植物乳杆菌L.plantarum 15对其带果皮果肉的全果汁进行深度发酵。由于酸性环境和氮源营养物质的不足,植物乳杆菌L.plantarum 15在柑橘全果汁中表现出较长的迟滞期(1~2 d),且其生长情况与可溶性糖类、有机酸和总黄酮等起始值并无明显关联;发酵后期依然存在着较高含量的总糖和还原糖,说明植物乳杆菌L.plantarum 15发酵的终止并不是源于可溶性糖类的耗竭,而是由于乳酸大量积累所致;相比于胡柚、脐橙和春见,蜜桔全果汁更适合植物乳杆菌L.plantarum 15的生长发酵。黄酮是柑橘果实中重要酚类物质,一般具有抗氧化、抗癌、防止心血管疾病、消炎镇痛和抗菌等生物活性[24]。随着植物乳杆菌L.plantarum 15发酵的进行,柑橘全果汁的总黄酮含量在前期发生一定程度的下降,但在后期均呈现出增加趋势,尤其是胡柚发酵全果汁;苏卿指出,柑橘中总黄酮与DPPH显著正相关[25],由此推测,乳酸菌深度发酵后柑橘全果汁的抗氧化活性可得到提高,但与原料品种有着密切关联。挥发性物质是影响柑橘果实及其加工制品的重要因素之一,主要以游离态和键合态形式存在。GC-MS表明,蜜桔、胡柚、脐橙和春见全果汁发酵前后的挥发性物质以烯类为主,其中D-柠檬烯占主导地位;经植物乳杆菌L.plantarum 15深度发酵后,β-月桂烯和γ-松油烯相对含量得到提高,可增强发酵全果汁的柑橘特征香气,己醛、辛醛和癸醛等相对含量降低甚至消失在一定程度上减弱其青草风味,但并不能增加醇、酯、酮、酸等挥发性物质种类和含量。PCA分析也说明柑橘发酵全果汁的挥发性物质主要取决于原料本身,仅在一定程度上受乳酸菌发酵的影响。
[1] KHAN M K,HUMA Z E,DANGLES O.A comprehensive review on flavanones, the major citrus polyphenols[J].Journal of Food Composition and Analysis,2014,33(1):85-104.
[2] MILINA E G,PERLES R D,MORENO D A, et al.Natural bioactive compounds ofCitrus limon for food and health[J].Journal of Pharmaceutical and Biomedical Analysis,2010,51(2):327-345.
[3] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010:176-177.
[4] 周开隆,叶荫民.中国果树志柑橘卷[M].北京:中国林业出版社,2010:7-8.
[5] 李汴生,卢嘉懿,阮征.植物乳杆菌发酵不同果蔬汁风味品质研究[J].农业工程学报,2018,34(19):293-299.
[6] 赖婷,刘汉伟,张名位,等.乳酸菌发酵对果蔬中主要活性物质及其生理功能的影响研究进展[J].中国酿造, 2015,34(3):1-4.
[7] 高寅,李汴生,林伟锋,等.干酪乳杆菌对柑橘汁发酵的工艺研究[J].现代食品科技,2011,27(8):946-948;934.
[8] 束文秀,吴祖芳,刘连亮,等.胡柚汁益生菌发酵挥发性风味特征[J].食品科学,2018,39(4):59-65.
[9] 曹雪丹,郭小,陈林呈,等.益生菌发酵瓯柑汁及主要抗氧化成分研究[J].食品研究与开发,2017,38(17):105-108.
[10] 陈学先.柑橘全果低苦制醋及柑橘醋饮料的研制[D].长沙:湖南农业大学,2013:11-12.
[11] 苏东林,单杨,李高阳.全果柑橘利口酒的加工技术研究[J].食品与发酵工业,2007,33(7):95-98.
[12] 付陈梅.柑桔果实品质和类黄酮的含量特征及橙汁掺假检测的研究[D].重庆:西南大学,2008:50-105.
[13] 陈婷婷,周志钦.5个宽皮柑桔品种果肉特征香气物质的确定[J].中国南方果树,2018,47(3):23-29.
[14] 陈娟,唐俊妮,王文娟.三种猕猴桃酒发酵过程中挥发性香气成分的变化[J].食品工业科技,2019,40(3): 242-248.
[15] 田殿梅,霍丹群,张良,等.3种不同品种高粱发酵酒糟及基酒品质的差异[J].食品与发酵工业,2013,39(7):74-78.
[16] RATCHADAPORN K, ORAPIN K, NATTA L, et al.Changes in physico-chemical, astringency, volatile compounds and antioxidant activity of fresh and concentrated cashew apple juice fermented withLactobacillus plantarum[J].Journal of Food Science and Technology,2018,55(10):3 979-3 990.
[17] 杨冲,彭珍,熊涛.南丰蜜桔汁乳酸菌发酵过程中品质的变化[J].食品工业科技,2018,39(11):1-5;11.
[18] KAAREL A, SIGNE K, TIIU-MAIE L, et al.The effect of temperature and pH on the growth of lactic acid bacteria: A pH-auxostat study[J].International Journal of Food Microbiology,2003.85(1):171-183.
[19] 王凯旋.基于乳酸菌转化的桑椹加工工艺优化及桑椹果片的研制[D].镇江:江苏科技大学,2013:41-49.
[20] 李志华.产β-葡萄糖苷酶乳酸菌菌株的特性研究[D].延吉:延边大学,2014:1-29.
[21] REN Jingnan,TAI Yanan,DONG Man, et al.Characterisation of free and bound volatile compounds from six different varieties of citrus fruits[J].Food Chemistry,2015,185:25-32.
[22] 林雯雯,楼舒婷,孙玉敬,等.柑橘汁中糖苷键合态香气物质的研究进展[J].食品工业科技,2014,35(17):395-399.
[23] CAGNOTRD, SURICORF, PARADISO A, et al.Effect of autochthonous lactic acid bacteria starters on health-promoting and sensory properties of tomato juices[J].International Journal of Food Microbiology,2009,128(3):473-483.
[24] 单杨.柑橘类黄酮的分离、结构鉴定、化学修饰及生物活性研究[D].长沙:中南林业科技大学,2007:8-13.
[25] 苏卿.中国特有柑橘属植物生理落果和疏果酚类物质组成及其抗氧化活性评价研究[D].重庆:西南大学,2014:60-63.