小茴香又名怀香,属于伞形科茴香属(Foeniculum vulgare Mill)植物成熟后干燥的果实。是多年生草本植物,具有强烈的香气[1]。它是一种特有的药食两用的香辛料[2]。在我国大部分省市均有栽培[3],其主产区为西北地区的甘肃[4]、宁夏、新疆等省市[5]。果实具有丰富的挥发油、脂肪酸、氨基酸、黄酮、甾醇及糖苷等营养成分[6],还含有三萜、鞣质、生物碱、挥发性碱等多种类型的化合物[7]。
近年来研究表明,小茴香挥发性化合物种类和含量会根据地理区域和含量而变化。张禄捷等[8]对10个产地的小茴香挥发性化合物进行分析,均含有反式茴香脑、爱草脑、α-蒎烯、β-月桂烯、茴香醛、柠檬烯等物质。RARTHASARATHR等[9]对甜茴香籽的挥发性物质进行测定后,其主要由苯丙素和单萜类化合物构成。并且反式茴香脑含量越高、茴香酮含量越低,则小茴香的品质更好,具有更愉快的气味[10]。在抗氧化研究方面,小茴香的黄酮也具有较强的抗氧化性,且稳定性较强[11]。其中籽的抗氧化能力与其黄酮类、鞣质类、皂苷类、苯酚类和多糖类等的含量有关[12]。但小茴香的挥发性化合物、功能性成分及抗氧化性能之间的关系还未见报道。
不同品种的果实香气及籽粒形状和品质之间存在较大的差异,而有关该方面的研究也未见报道。其中籽的挥发性成分是人们可直观感知的品质特性,而抗氧化性能和多酚、黄酮含量不具备可感知特性,利用相关性和主成分分析方法将二者联系起来,用挥发性物质含量描述抗氧化指标和多酚、黄酮含量高低,为商业判断抗氧化指标和多酚、黄酮含量提供简便方法的可能性,同时也为科学评价和利用不同品种小茴香果实品质优点的精深加工提供技术支持。所以利用顶空固相微萃取-气质联用(HS-SPME/GC-MS)分析小茴香果实中的挥发性物质,测定其甲醇萃取物的多酚、黄酮含量和体外抗氧化性能力,来分析比较不同品种间的含量差异并判断其指标间的相关性。
材料:本实验所用小茴香果实为:低杆小茴香①、小高杆小茴香②、土茴香③、大高杆小茴香④、和高杆小茴香⑤。其中样品①、②、③和⑤均采自于甘肃省玉门市玉门黄花农场;样品④采自于甘肃省武威市民勤县东湖镇冬固村。
试剂:福林-酚试剂、没食子酸(GAE)、芦丁(RE)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)、2,4,6-三吡啶基三嗪(TPTZ)、水溶性维生素E(Trolox)、吐温20,北京索莱宝科技有限公司;甲醇、丙酮、乙酸乙酯、FeCl3、Na2CO3、过硫酸钾、氯仿溶液、亚油酸,均为国产分析纯;正己烷(HPLC纯)、C6~C30系列正烷烃(GC纯),上海Sigma公司;实验室提取及分析用水均为超纯水。
SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;HWS12电热恒温水浴锅,上海一恒科技有限公司;Spectrophotometer 1510酶标仪,美国Chemical Scientific公司;wk-200b小型高速粉碎机,青州市福尔康制药机械有限公司;TDL-5型低速台式离心机,上海隆拓仪器设备有限公司;MH-200G调温型电热套,北京科伟永兴仪器有限公司;GC6890N-MS5973N型气相色谱-质谱联用仪,安捷伦科技有限公司。
1.3.1 HS-SPME/GC-MS分析条件
参照罗静等[13]的方法,并做适当修改。准确称取样品1.50 g,加入到15 mL萃取瓶中,放入80 ℃水浴锅平衡20 min,后插入经活化的CAR/DVB/PDMS萃取头在60 ℃水浴条件下顶空萃取,萃取时间为45 min, 再插入进样口解脱附3 min。色谱条件:采用TG-WAX弹性石英毛细管柱(60 m×0.25 mm×0.25 μm); 进样口温度为230 ℃、ECD检测器温度为230 ℃;载气为高纯氦气,纯度> 99.999%,流速1.0 mL/min; 柱温起始为40 ℃,保持5 min,以3 ℃/min升至180 ℃/min,保持2 min,再以10 ℃/min升至230 ℃,保持3 min。质谱条件:EI电离能量为70 eV;质量扫描范围为50~500 amu;离子源温度为230 ℃;四极杆温度为150 ℃;质谱传输线温度为220 ℃。
1.3.2 多酚含量测定
称取5.00 g小茴香果实,粉碎60 目置于锥形瓶中,加入50 mL甲醇溶液,于40 ℃水浴锅中提取40 min, 过滤并定容于50 mL的容量瓶,作待测液用。
参照EBRAHIMABADI等[14]和CHEN等[15]的方法并做适当修改。吸取0.1 mL待测液置于10 mL容量瓶中,加5 mL蒸馏水和1 mL稀释5倍的福林-酚试剂,摇匀后加入3 mL 7.5%(质量分数)Na2CO3溶液。室温下避光显色2 h,在765 nm处测定吸光度。标准曲线用没食子酸(10~60 μg/mL)标准溶液绘制,结果以mg GAE/g表示。
1.3.3 黄酮含量测定
参照CHEN等[16]的方法并做适当修改。吸取上述0.2 mL待测液于10 mL的离心管中,加0.4 mL 5%(质量分数)NaNO2溶液摇匀放置6 min,再加入0.4 mL 10%(质量分数)Al(NO3)3 溶液摇匀放置6 min, 再加入4 mL 4%(质量分数)NaOH溶液,最后用甲醇定容至10 mL,测定在510 nm处的吸光度值。标准曲线用芦丁(0.05~1 mg/mL)标准溶液绘制,结果以mg RE/g表示。
1.3.4 抗氧化能力
1.3.4.1 DPPH自由基清除能力测定
参考WU等[17]的方法并略作改进。吸取150 μL的小茴香待测液,按实验步骤测定在515 nm处的吸光度值。并以Trolox(100~250 mg/L)作为标准,以每克样品中含有的Trolox当量(mg TE/g)来表示。
1.3.4.2 FRAP法还原能力的测定
亚铁离子还原能力的测定参考BENZIE等[18]的方法,并略加修改。取0.2 mL稀释的样液,加入2.8 mL TPTZ工作液,37 ℃下避光水浴反应30 min,测定波长为593 nm处的吸光度值。标准曲线以Trolox(200~1 000 μmol/L)代替提取液测定吸光度值,结果表示为达到同样吸光度所需的Trolox的物质的量(mg TE/g)。
1.3.4.3 ABTS自由基清除能力测定
参照YUN等[19]和ZHAO等[20]的方法并略作修改。取2.85 mL ABTS溶液与0.15 mL适当稀释的样液混合,在室温避光下反应6 min,在734 nm处测定吸光度值。并以Trolox(50~800 μmol/L)代替提取液测定吸光度值。结果表示为每克样品清除ABTS自由基的能力相当于Trolox的物质的量(g TE/g)表示。
1.3.4.4 β-胡萝卜素漂白实验
参照CHEN等[21]和VELIOGLU等[22]的方法,并略作修改。将0.4 mL的β-胡萝卜素-氯仿溶液(质量浓度1 mg/mL), 添加到含有40 mg亚油酸和400 mg吐温-20的圆底烧瓶中。旋转蒸发除去氯仿,缓慢加入100 mL蒸馏水并乳化15 min,取0.2 mL样品溶液和5 mL乳化液体混合,60 ℃浴中进行反应,测定在0~100 min间隔20 min在470 nm处的吸光度值。以80%(质量分数)甲醇做空白对照。BHT、生育酚(质量浓度50 mg/mL)分别作为阴性、阳性对照。结果以在孵育100 min后参考对照的抗氧化活性抑制百分比(AA/%)表示(式1)。并通过公式计算β-胡萝卜素残留百分比(式2)。
![]()
(1)
式中:DRC=对照的抑制漂白速率=AC0-AC100;AC0:0 min 时初始吸光度,AC100:100 min处的吸光度。DRS=样品的抑制漂白速率=AS0-AS100;AS0:0 min 的吸光度,AS100:100 min时的吸光度。
β-胡萝卜残留![]()
(2)
式中:As(t=x)和As(t=0)分别是样品在t=x min和t = 0 min时的吸光度。
本研究通过Excel进行实验数据的汇总处理;用Metabo-Analyst进行主成分分析和相关性分析;用Duncan’s法进行多重显著性分析和标准偏差(±SE)计算(P<0.05);用Origin 9.1进行数据图表绘制。
对5个不同品种小茴香挥发性成分进行分析(表1),共鉴定出75种香气物质,共有的化学成分有41种。
表1 五种小茴香挥发性成分及含量比较
Table 1 Volatile components and relative content of seeds of five fennel cultivars

保留指数挥发性化合物相对含量/%低杆小茴香小高杆小茴香土茴香大高杆小茴香高杆小茴香醇类1 262桉叶油醇0.660.660.780.530.791 7601-甲基-4-(1-甲基乙烯基)环己醇0.040.030.060.080.091 915芳樟醇0.070.070.160.080.161 953顺式-4-(异丙基)-1-甲基环己-2-烯-1-醇0.010.010.020.010.021 964葑醇0.01/0.010.010.012 031(-)-4-萜品醇0.070.10.12/0.192 080反式-1-甲基-4-(1-甲基乙烯基)环己-2-烯-1-醇0.02/0.01/0.032 210α-松油醇0.030.030.030.020.072 505香芹醇0.020.020.01/0.012 231甲基丁香酚////0.022 415顺式-甲基异丁香油酚0.020.02/0.02/4 6004-异丙基苯酚0.01////合计0.960.941.20.751.39醛类2 3744-异丙基苯甲醛0.020.030.030.010.04萜烯类1 0192-蒎烯0.840.711.31.241.671 062莰烯0.020.030.040.060.041 109β-蒎烯0.090.090.130.110.141 127桧烯0.490.520.670.460.711 184月桂烯0.280.330.560.450.621 189α-水芹烯0.260.240.320.30.321 211α-萜品烯0.030.030.040.030.041 241双戊烯8.8710.2710.216.0512.771 259β-水芹烯0.320.50.720.40.771 271马鞭草烯0.05////1 300罗勒烯1.051.131.670.91.741 319γ-松油烯2.863.42.712.331.861 370p-伞花烃0.820.840.560.480.351 385萜品油烯0.080.070.110.090.11 539α-环氧蒎烷0.010.010.010.01/1 570别罗勒烯0.010.010.020.010.011 723柠檬烯氧化物0.020.020.020.010.031 749(+)-反式-柠檬烯 1,2-环氧化物0.010.020.03/0.031 469反式-环氧罗勒烯0.020.020.010.010.011 480α-可巴烯0.030.040.040.020.051 871樟脑0.060.050.070.150.071 528毕澄茄烯0.010.020.02/0.021 582榄香烯0.010.010.010.010.01
续表1
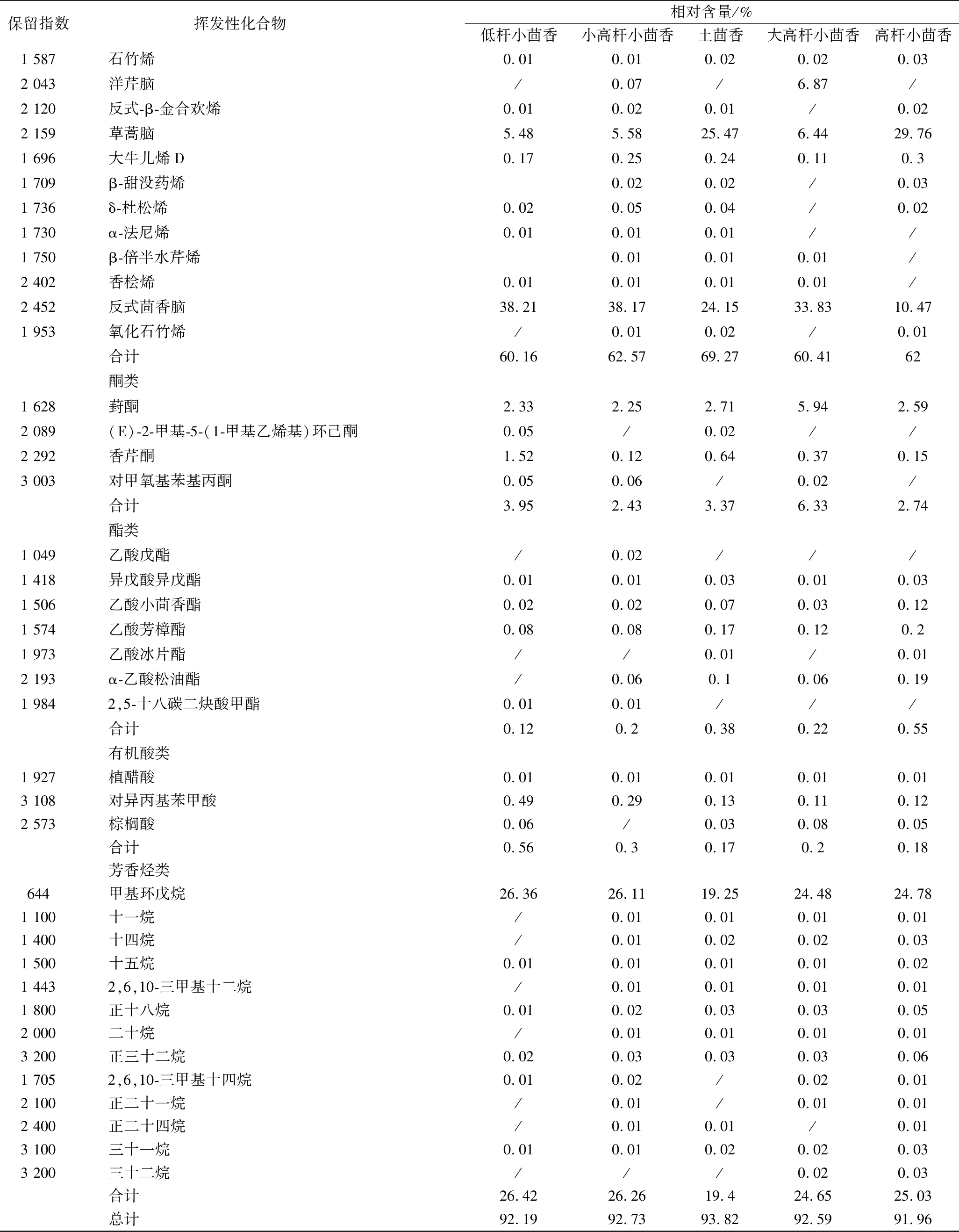
保留指数挥发性化合物 相对含量/%低杆小茴香小高杆小茴香土茴香大高杆小茴香高杆小茴香1 587石竹烯0.010.010.020.020.032 043洋芹脑/0.07/6.87/2 120反式-β-金合欢烯0.010.020.01/0.022 159草蒿脑5.485.5825.476.4429.761 696大牛儿烯D0.170.250.240.110.31 709β-甜没药烯0.020.02/0.031 736δ-杜松烯0.020.050.04/0.021 730α-法尼烯0.010.010.01//1 750β-倍半水芹烯0.010.010.01/2 402香桧烯0.010.010.010.01/2 452反式茴香脑38.2138.1724.1533.8310.471 953氧化石竹烯/0.010.02/0.01合计60.1662.5769.2760.4162酮类1 628葑酮2.332.252.715.942.592 089(E)-2-甲基-5-(1-甲基乙烯基)环己酮0.05/0.02//2 292香芹酮1.520.120.640.370.153 003对甲氧基苯基丙酮0.050.06/0.02/合计3.952.433.376.332.74酯类1 049乙酸戊酯/0.02///1 418异戊酸异戊酯0.010.010.030.010.031 506乙酸小茴香酯0.020.020.070.030.121 574乙酸芳樟酯0.080.080.170.120.21 973乙酸冰片酯//0.01/0.012 193α-乙酸松油酯/0.060.10.060.191 9842,5-十八碳二炔酸甲酯0.010.01///合计0.120.20.380.220.55有机酸类1 927植醋酸0.010.010.010.010.013 108对异丙基苯甲酸0.490.290.130.110.122 573棕榈酸0.06/0.030.080.05合计0.560.30.170.20.18芳香烃类644甲基环戊烷26.3626.1119.2524.4824.781 100十一烷/0.010.010.010.011 400十四烷/0.010.020.020.031 500十五烷0.010.010.010.010.021 4432,6,10-三甲基十二烷/0.010.010.010.011 800正十八烷0.010.020.030.030.052 000二十烷/0.010.010.010.013 200正三十二烷0.020.030.030.030.061 7052,6,10-三甲基十四烷0.010.02/0.020.012 100正二十一烷/0.01/0.010.012 400正二十四烷/0.010.01/0.013 100三十一烷0.010.010.020.020.033 200三十二烷///0.020.03合计26.4226.2619.424.6525.03总计92.1992.7393.8292.5991.96
注:/表示未检出。
其中低杆小茴香、小高杆小茴香、土茴香、大高杆小茴香、高杆小茴香分别检出60、66、64、57和64种香气物质,各占挥发性化学物总峰面积的92.19%、92.73%、93.82%、92.59%和91.96%。不同品种的小茴香含有各类化合物的数目、含量差异较大。其中萜烯类化合物的含量最高,为主要的挥发性化合物,主要为反式茴香脑、草蒿脑、双戊烯、γ-松油烯,特别是反式茴香脑(茴香、辛香料、甘草的气味[23])在低杆小茴香、小高杆小茴香、土茴香、大高杆小茴香的含量最高,而草蒿脑和反式茴香脑互为同分异构体,所以高杆小茴香表现为类似的香味特征。酮类物质共检出了4种,在大高杆小茴香中相对含量最高(6.33%),葑酮(樟脑和甜香气味[24])含量最多;醇类化合物中含量最多的为桉叶油醇,在高杆小茴香的含量最高(0.79%); 酸类、醛类和酯类物质在一定程度上反映出了香气品质的高低,各样品分别占到挥发性物质的0.7%、0.53%、0.58%、0.43%、0.77%;烷烃类化合物主要来源于脂肪酸烷氧自由基的断裂产生,其含量的差别可能与前体脂肪酸的含量有关。
为了准确描述,根据化学结构式重新将挥发性化合物分为单萜烯类、氧化单萜烯类、倍半萜烯类、氧化倍半萜烯类、萜烯类衍生物和非萜烯类化合物六大类(表2)。
表2 五种小茴香各类挥发性物质的相对含量 单位:%
Table 2 The contents of various classes of volatiles in seeds of five fennel cultivars
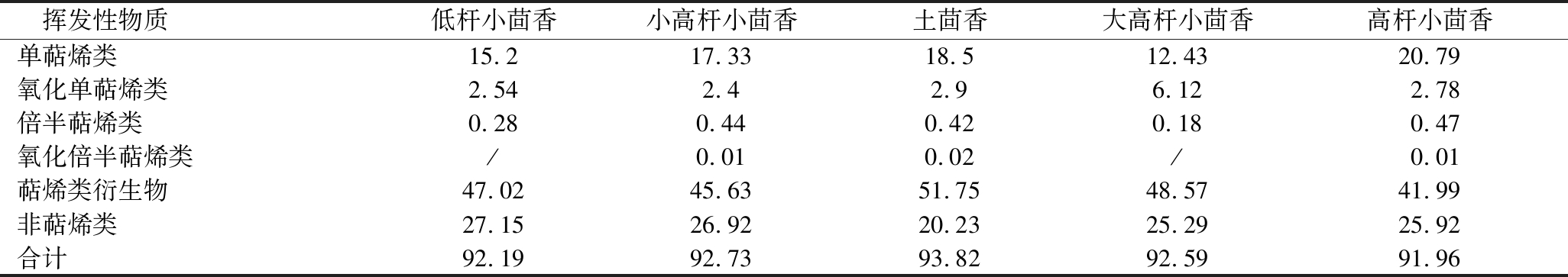
挥发性物质低杆小茴香小高杆小茴香土茴香大高杆小茴香高杆小茴香单萜烯类15.217.3318.512.4320.79氧化单萜烯类2.542.42.96.122.78倍半萜烯类0.280.440.420.180.47氧化倍半萜烯类/0.010.02/0.01萜烯类衍生物47.0245.6351.7548.5741.99非萜烯类27.1526.9220.2325.2925.92合计92.1992.7393.8292.5991.96
注:/表示未检出。
其中本地茴香萜烯类衍生物的含量最高(51.75%),且以草蒿脑和反式茴香脑为主。其中5个品种的总单萜烯类含量高于总倍半萜烯类,以单萜烯类化合物含量最高,主要以双戊烯和γ-松油烯为主。其中氧化倍半萜烯类中只检测出氧化石竹烯,仅在小高杆小茴香、茴香和高杆小茴香中被检测出。朱金霞等[25]对宁夏省种植的不同品种的小茴香检测,结果表明不同品种小茴香具有相同挥发性化合物成分,但含量均有差异。AKGÜL等[26]在种植在土耳其的小茴香中检测出反式茴香脑、葑酮和α-蒎烯为小茴香的主要成分。DIAO等[27]在四川省小茴香检测出反式茴香脑占68.53%为主要成分,和草蒿脑(10.42%), 柠檬烯(6.24%),葑酮(5.45%)等其他成分。郑甜田等[28]对产自不同省的10个小茴香进行分析,确定反式茴香脑为主要成分,这均与本研究得出的反式茴香脑为主要成分相一致,但其含量确略有差异,表明地域、品种不同其挥发性化合物成分和含量均不同。
由图1可知,不同品种小茴香的多酚和黄酮含量有明显的差别。

A-多酚;B-黄酮
图1 5种小茴香多酚和黄酮的含量
Fig.1 The total phenolic and flavonoids contents of seeds of five fennel cultivars
注:不同字母代表显著性差异(P<0.05)。
小茴香总多酚的含量均高于6 mg GAE/g,总黄酮 均高于2.28 mg/g,其中大高杆小茴香的多酚(9.048 9 mg/g)、黄酮(2.359 3 mg/g)含量均高于其他样品。这与王强等[29]报道的小茴香甲醇溶剂萃取物测得的多酚含量高于黄酮含量相一致。而与MOTAMED等[30]报道的伊朗小茴香多酚含量明显低于黄酮的含量不同,这可能与小茴香产地、测定方法的不同有关。由于酚类化合物具有电子供体或氢供体,具有一定的抗氧化活性[14]。而研究发现总酚与大多数抗氧化能力具有显著相关性[31]。
在细胞代谢过程中会产生具有高度活性的自由基,这些物质能诱导发生氧化反应并引起细胞膜的损伤,使得生物体代谢紊乱,并最终导致各种疾病的发生[32]。如图2所示,不同品种的小茴香都具有抗氧化能力。其中大高杆小茴香抗氧化活性能力最强。
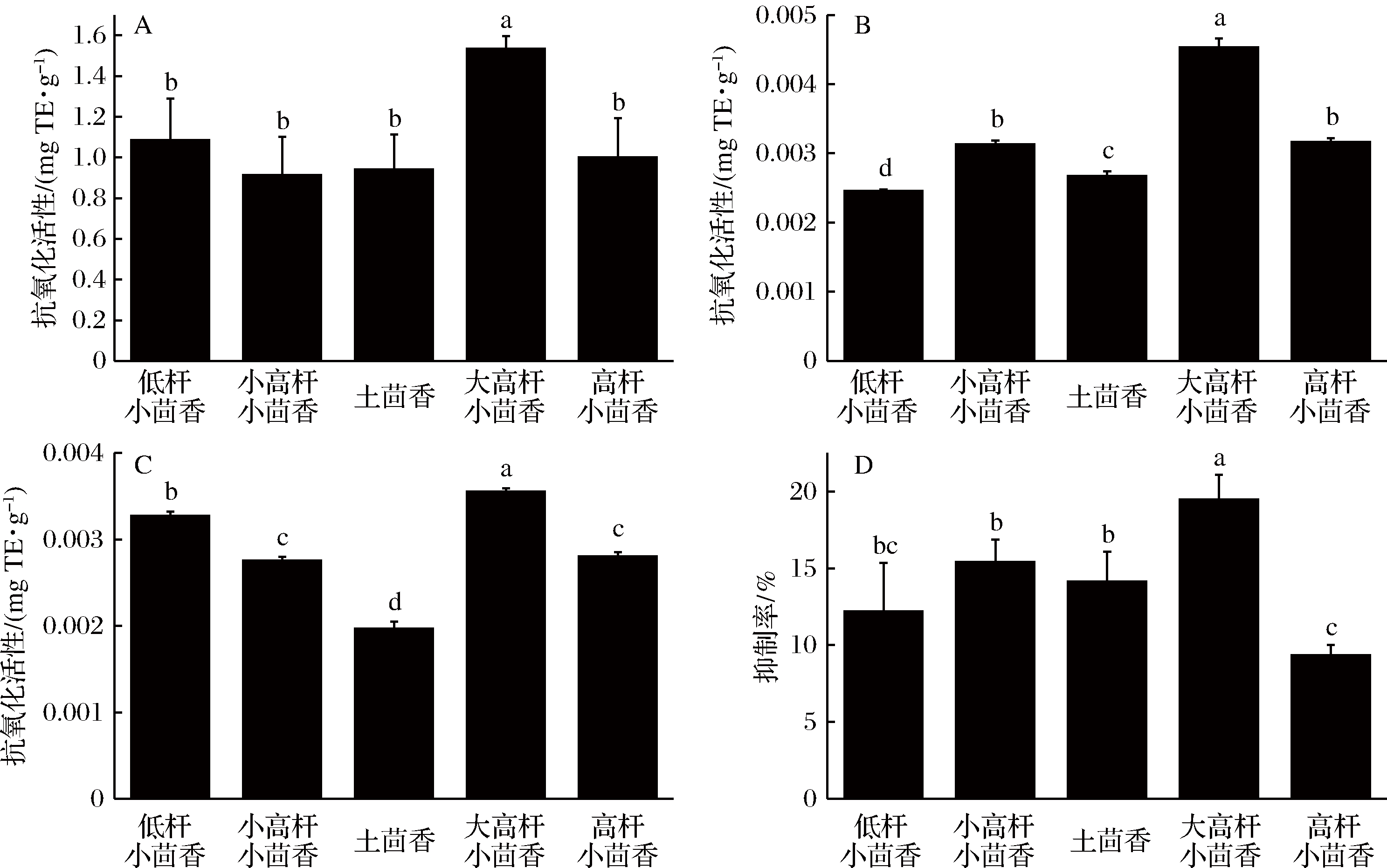
A-对DPPH自由基清除能力测定;B-采用FRAP法对还原能力的测定; C- 对ABTS自由基清除能力测定; D- 对β-胡萝卜素漂白能力测定
图2 5种小茴香不同抗氧化活性的比较
Fig.2 Comparison of antioxidant activities of seed extracts of five fennel cultivars
注:不同字母代表显著性差异(P<0.05)。
OKTAY等[33]报道的小茴香的水、醇提取物都具有较强的抗氧化性,几乎与相同剂量的BHT和BHA抗氧化性能一样好。对比图2-A、图2-B、图2-C,5个品种的小茴香对DPPH自由基的清除活性最强,其次是对铁离子氧化还原能力、对ABTS+自由基清除能力,这与MIRALIAKBARI等[34]所报道的坚果油和RUFINO等[35]报道的巴西的18种非热带坚果的抗氧化能力相一致。不同品种的小茴香抗氧化能力有明显的差异,可能是由于当地温度、光强、土壤等对不同品种的小茴香作用的不同。而SALAMA等[36]也指出利用有机肥料和生物-有机肥料种植小茴香的抗氧化能力不同。
β-胡萝卜素漂白实验是用来评估抗氧化剂的脂质过氧化抑制活性[37]。抑制率取决于抗氧化剂溶解度的差异,其疏水性的抗氧化剂在β-胡萝卜素漂白试实验中比亲水性的抗氧化剂更能有效地通过脂质相和脂-水界面,从而能直接抑制β-胡萝卜素的氧化[38]。而且氯仿、甲醇萃取液能提取较高水平的疏水性成分[39]。实验结果表明,各样品的抑制率存在明显差异,可能是由于不同小茴香中亲脂性化合物含量的差异所致。为更好地诠释不同品种的抑制率,图3中表示系统中各种样品的β-胡萝卜素残留百分比与时间之间的关系。将这种抑制程度通过一级动力学模型来描述(式3)。

●-低杆小茴香;○-小高杆小茴香;
▼-土茴香;△-大高杆小茴香;
■-高杆小茴香;□:空白;■-α-tocopherol;+:BHT
图3 5种小茴香β-胡萝卜素漂白
Fig.3 Antioxidant activity of seeds distilled residue of five fennel cultivars assayed by the β-carotene bleaching method
y1=y0e-Rx
(3)
式中:x:反应时间,R:速率常数,y1和y0表示在t=x min和t=0 min时β-胡萝卜素的残留百分比。
由表3可以看出,不同样品均减缓了β-胡萝卜素的漂白,且模型适用于对非线性曲线进行拟合分析。其中每条曲线相关系数![]() 全部符合效果,且达到显著水平(P<0.001)。漂白速率以R来表示,R值越高,说明β-胡萝卜素被漂白的越多。得出高杆小茴香(R=0.107 5)的β-胡萝卜素漂白速率最大,表明其抗氧化能最弱。其样品的抗氧化能力效果从强到弱依次为大高杆小茴香>小高杆小茴香>土茴香>低杆小茴香>高杆小茴香。
全部符合效果,且达到显著水平(P<0.001)。漂白速率以R来表示,R值越高,说明β-胡萝卜素被漂白的越多。得出高杆小茴香(R=0.107 5)的β-胡萝卜素漂白速率最大,表明其抗氧化能最弱。其样品的抗氧化能力效果从强到弱依次为大高杆小茴香>小高杆小茴香>土茴香>低杆小茴香>高杆小茴香。
表3 5种小茴香在β-胡萝卜素漂白实验中的拟合函数的系数和方差分析
Table 3 Coefficients and ANOVA of seeds of five fennel cultivars in β-carotene bleaching assay

样品 R2R2Adj系数方差分析y0RP值显著性低杆小茴香0.949 0270.965 4296.674 860.010 360.000 014∗∗小高杆小茴香0.980 8040.987 1299.272 350.009 540.000 002∗∗土茴香0.971 5650.980 8697.462 950.009 690.000 003∗∗大高杆小茴香0.976 6640.984 3298.057 390.008 690.000 002∗∗高杆小茴香0.963 2470.975 1997.093 550.010 750.000 008∗∗甲醇0.915 7490.942 1694.131 330.012 80.000 064∗∗α-生育酚0.981 1010.987 3298.271 230.013 850.000 006∗∗BHT0.986 2630.990 899.673 10.013 860.000 004∗∗
注:显著性:“*”表示0.01<P<0.05; “**”表示P<0.01。
为进一步探究挥发性化合物类别、功能成分和抗氧化活性三者之间的关系,进行相关性分析(表4)。
表4 抗氧化活性、功能性成分及挥发性成分相关性分析
Table 4 Correlation analysis of antioxidant activity, functional components and volatile compounds
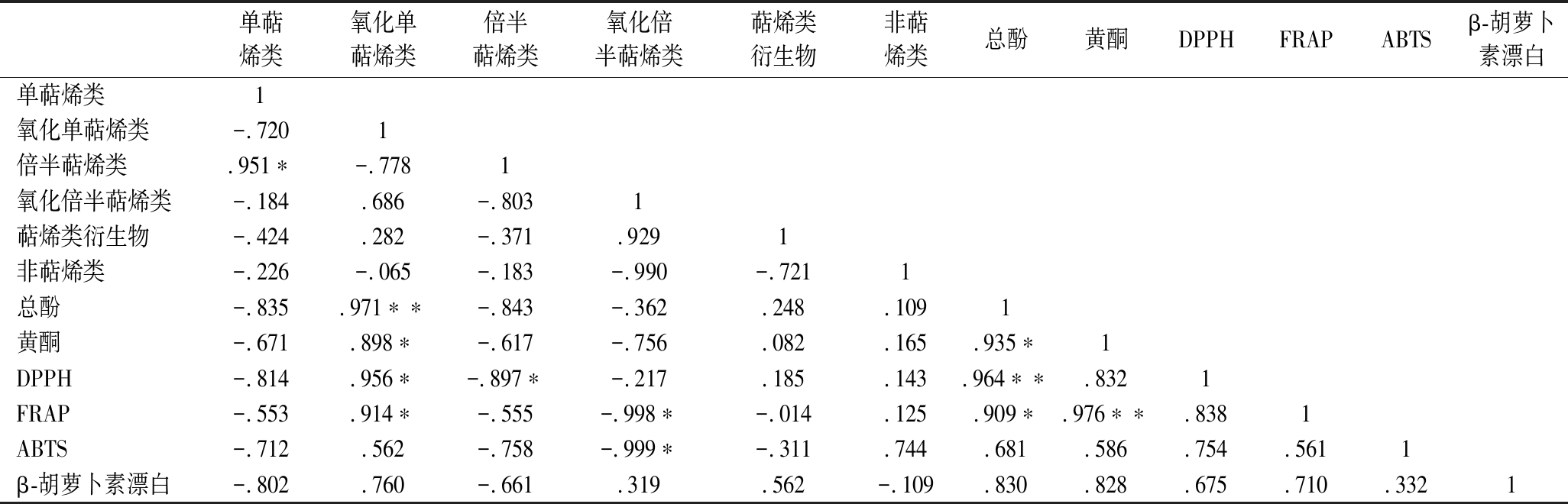
单萜烯类氧化单萜烯类倍半萜烯类氧化倍半萜烯类萜烯类衍生物非萜烯类总酚黄酮DPPHFRAPABTSβ-胡萝卜素漂白单萜烯类1氧化单萜烯类-.7201倍半萜烯类.951∗-.7781氧化倍半萜烯类-.184.686-.8031萜烯类衍生物-.424.282-.371.9291非萜烯类-.226-.065-.183-.990-.7211总酚-.835.971∗∗-.843-.362.248.1091黄酮-.671.898∗-.617-.756.082.165.935∗1DPPH-.814.956∗-.897∗-.217.185.143.964∗∗.8321FRAP-.553.914∗-.555-.998∗-.014.125.909∗.976∗∗.8381ABTS-.712.562-.758-.999∗-.311.744.681.586.754.5611β-胡萝卜素漂白-.802.760-.661.319.562-.109.830.828.675.710.3321
注:*表示在0.05 水平(双侧)上显著相关;**表示在0.01水平(双侧)上显著相关。
结果表明,总酚、黄酮含量与对铁离子氧化还原能力之间存在显著正相关(P<0.001),与对DPPH自由基清除能力存在极显著相关(P<0.01),表明影响不同品种小茴香抗氧化性的主要因素是总酚含量,且黄酮与对铁离子氧化还原能力之间存在极显著正相关(P<0.01)。与ZHAO等[20]对啤酒大麦的总酚与对DPPH自由基清除能力、ABTS自由基清除活性和还原能力具有显著相关性相一致。且与水稻中测定的总酚、类黄酮和抗氧化能力三者间存在相关性相一致[19]。并且可得氧化单萜烯类与黄酮、对DPPH自由基清除能力和对铁离子氧化还原能力值均存在显著正相关关系,且与多酚存在极显著正相关。氧化倍半萜烯类与对铁离子氧化还原能力值和ABTS自由基清除能力存在显著的负相关,为判定小茴香的品质提供了另一种可能,即可以通过氧化倍半萜烯类、氧化单萜烯类化合物含量的评价间接判定抗氧化活性的强弱。
为进一步挖掘小茴香品种间的差异,用主成分分析对5种小茴香挥发性化合物类别、功能成分和抗氧化活性指标进行降维处理(图4)。共提取出2个主成分,累计方差贡献率达到80.4%,主成分1(PC1)和主成分2(PC2)分别解释总方差的61.3%和19.1%。
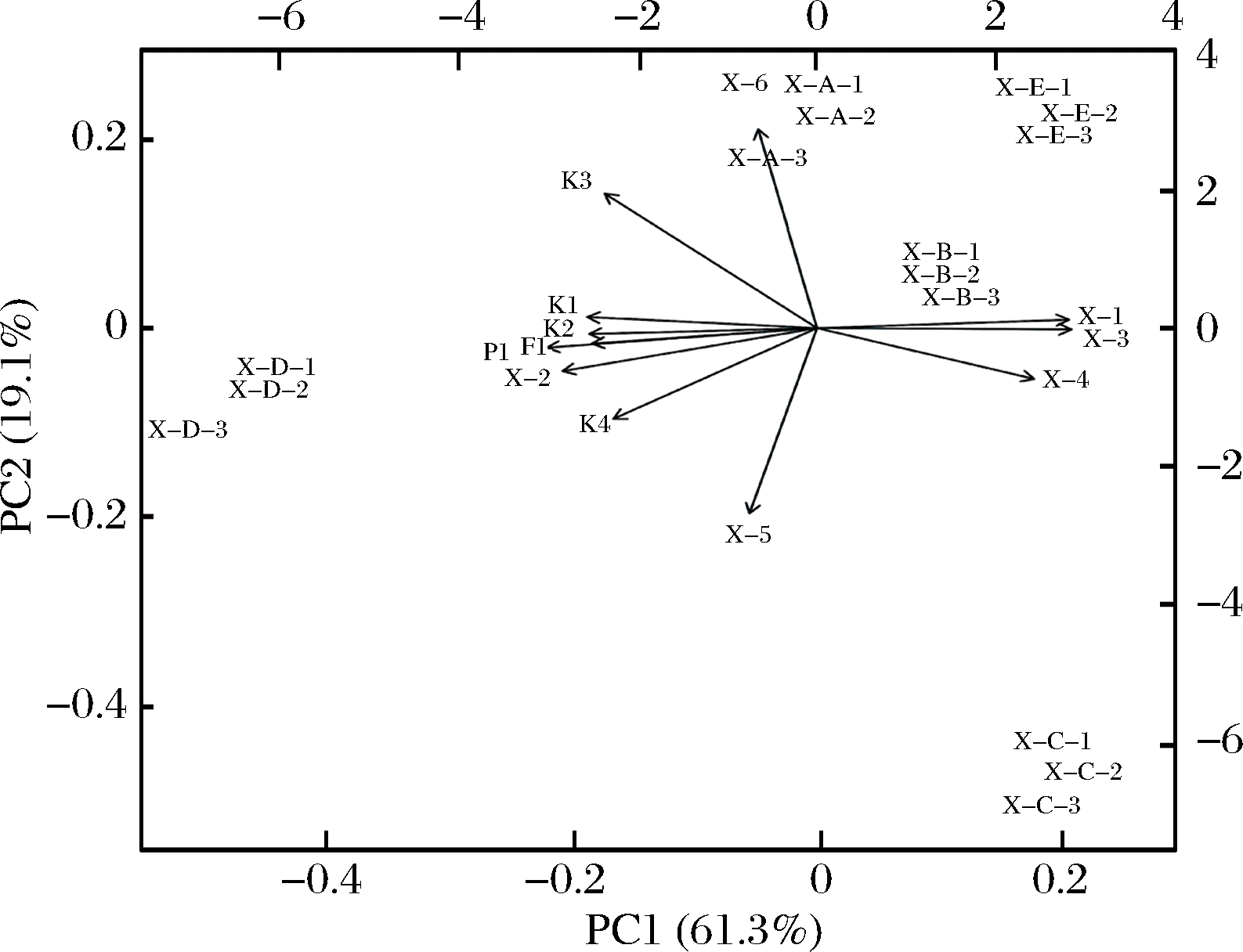
X-A:低杆小茴香;X-B:小高杆小茴香;X-C:土茴香;
X-D:大高杆小茴香;X-E:高杆小茴香
X1:单萜烯类;X2:氧化单萜烯类;X3:倍半萜烯类;
X4:氧化倍半萜烯类;X5:萜烯类衍生物;X6:非萜烯类;
P1:多酚;F1:黄酮;K1:DPPH;K2:FRAP;K3:ABTS;
K4:β-胡萝卜素漂白
图4 各指标在主成分上的载荷及样品分布图散点图
Fig.4 Diagram of loading and factor distribution based on principal component analysis
根据主成分分析可将5个品种小茴香样品进行分类,根据空间离散点的距离PC1和PC2能明显地将其划分为三大类,低杆小茴香、小高杆小茴香和高杆小茴香聚为第一类,大高杆小茴香聚为第二类,土茴香聚为第三类。其中低杆小茴香、小高杆小茴香和高杆小茴香处于PC1和PC2正向端;土茴香处于PC1的正向端,PC2的负向端;大高杆小茴香处于PC1和PC2的负向端。其中土茴香和高杆小茴香的PC1的正向载荷高,单萜烯类、倍半萜烯类和氧化倍半萜烯与PC1具有较高的正相关,因此,表现为具有较高含量的总倍半萜烯类化合物,而萜烯类衍生物与PC2成负相关,表现为土茴香会随着PC2的减小,萜烯类衍生物含量会增加的特性;低杆小茴香的PC2的正向载荷高,而PC2与非萜烯类具有正相关性,因此表现为具有较高含量的反式茴香脑;由于PC1与对DPPH自由基清除能力、对铁离子氧化还原能力值、氧化单萜烯类、多酚和黄酮呈显著负相关,所以大高杆小茴香会随着PC1含量的减小,表现为单萜烯类、倍半萜烯类和氧化倍半萜烯类物质含量降低,抗氧化活性和多酚、黄酮含量增加的特性。近年来研究表明[40],萜烯类结构特征与其物质抗氧化能力有关。对于单萜类,其结构中含有亚甲基和具有酚类结构的含氧类型具有最高的抗氧化活性。倍半萜烯化合物中,烯丙醇类结构具有较强的抗氧化性能。而含有一些二萜类如酚醛类的酚类结构的二萜烯类,抗氧化活性较强,有较强的清除性能。
5个品种小茴香挥发性成分检测共鉴定出75种挥发性物质,品种间挥发性成分的种类和相对含量存在差异,但都含有较多的萜烯类化合物,土茴香的萜烯类化合物含量高达69.27%。5种小茴香的萜烯类衍生物的含量最高,主要以反式茴香脑和草蒿脑为主;总单萜烯物质次之,且总单萜烯物质中主要以单萜烯类物质为主,而氧化倍半萜烯含量最少,仅仅检测出氧化石竹烯1种物质。通过相关性分析和主成分分析表明,抗氧化性能与多酚、黄酮的含量间存在显著正相关性,氧化单萜烯类与总酚、黄酮、对DPPH自由基清除能力和对铁离子氧化还原能力值间表现为正相关性,并利用主成分分析将5种小茴香划分成3类,低杆小茴香、小高杆小茴香和高杆小茴香聚为第一类,表现为单萜烯类、倍半萜烯类和氧化倍半萜烯且非萜烯类较高的特性;大高杆小茴香聚为第二类,表现为单萜烯类、倍半萜烯类和氧化倍半萜烯类物质含量低,而抗氧化活性能高的特性;土茴香聚为第三类,表现出总倍半萜烯类化合物和萜烯类衍生物的含量较高,特别是芳樟醇含量较高的特性,为区分不同小茴香品种间的品质差异提供了数据支持。通过将挥发性成分和多酚、黄酮含量及抗氧化性能指标关联起来,为利用挥发性成分的种类及含量来判断、描述抗氧化指标和多酚、黄酮含量提供可能性,并同时为科学评价和利用不同品种小茴香果实品质特性提供技术支持。
[1] 贺伟平. 中药小茴香的化学成分和生物活性研究[D]. 福州:福建中医药大学, 2012: 5-8.
[2] 付起凤,张艳丽,许树军,等. 小茴香化学成分及药理作用的研究进展[J]. 中医药信息, 2008, 25(5):24-26.
[3] 蒋军辉,徐小娜,杨慧仙,等. GC-MS结合直观推导式演进特征投影法(HELP)分析大茴香和小茴香挥发性化学成分[J]. 南华大学学报(自然科学版), 2011, 25(4):91-96.
[4] 何金明,肖艳辉,王羽梅,等. 钾浓度对茴香植株生长发育、精油含量和组分的影响[J]. 生态环境学报, 2013(3):417-422.
[5] 王晓敏,李军,高艳明,等. 茴香的研究进展[J]. 河北农业科学, 2013(5):37-40.
[6] 朱金霞,郭生虎,郑国保. 紫外分光光度法测定小茴香不同器官中总黄酮[J]. 北方园艺, 2010(19):33-34.
[7] 高莉. 小茴香化学成分的初步研究[D]. 乌鲁木齐:新疆大学, 2005: 20-28.
[8] 张禄捷,刘韬,李荣,等. 天然调味香料小茴香挥发油的研究进展[J]. 中国调味品, 2015(3):117-120.
[9] PARTHASARATHY V A. Chemistry of Spices[M]. CABI, 2008:227-241.
[10] NAJDOSKA M, BOGDANOV J, ZDRAVKOVSKI Z. TLC and GC-MS analyses of essential oil isolated from Macedonian Foeniculi fructus[J]. Macedonian Pharmaceutical Bulletin, 2010, 56(1-2): 29-36.
[11] 李蜀眉,王丽荣,陈永青,等. 小茴香中黄酮类化合物提取及抗氧化性研究[J]. 中国调味品, 2016, 41(12):29-32.
[12] 杨洋,韦小英,阮征. 国内外天然食品抗氧化剂的研究进展[J]. 食品科学, 2002, 23(10):137-138.
[13] 罗静,钟永科,李明明,等. 小茴香储存过程中挥发性成分的变化[J]. 中国调味品, 2016, 41(3):49-52.
[14] EBRAHIMABADI A H, DJAFARIBIDGOLI Z, MAZOOCHI A, et al. Essential oils composition, antioxidant and antimicrobial activity of the leaves and flowers ofChaerophyllum macropodum Boiss[J]. Food Control, 2010, 21(8):1 173-1 178.
[15] CHEN L Y, CHENG C W, LIANG J Y. Effect of esterification condensation on the Folin-Ciocalteu method for the quantitative measurement of total phenols[J]. Food Chemistry, 2015, 170(12):10-15.
[16] CHEN G L, CHEN S G, XIAO Y, et al. Antioxidant capacities and total phenolic contents of 30 flowers[J]. Industrial Crops & Products, 2018, 111:430-445.
[17] WU G, JOHNSON S K, BORNMAN J F, et al. Changes in whole grain polyphenols and antioxidant activity of six sorghum genotypes under different irrigation treatments[J]. Food Chemistry, 2017, 214:199-207.
[18] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: The FRAP assay[J]. Analytical Biochemistry, 1996, 239(1):70-76.
[19] YUN S, LIANG J, PENG X, et al. Total phenolics, flavonoids, antioxidant capacity in rice grain and their relations to grain color, size and weight[J]. Journal of Cereal Science, 2009, 49(1):106-111.
[20] ZHAO H, FAN W, DONG J, et al. Evaluation of antioxidant activities and total phenolic contents of typical malting barley varieties[J]. Food Chemistry, 2008, 107(1):296-304.
[21] CHEN Q, GAN Z, ZHAO J, et al.In vitro, comparison of antioxidant capacity of cumin (Cuminum cyminum L.) oils and their main components[J]. LWT - Food Science and Technology, 2014, 55(2):632-637.
[22] VELIOGLU Y S, MAZZA G, GAO L, et al. Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products[J]. Journal of Agricultural & Food Chemistry, 1998, 46(10):4 113-4 117.
[23] 李峰,程侠,叶荣飞,等. 在线热裂解/气相色谱-质谱联用技术研究八角茴香油的热裂解行为[J]. 分析测试学报, 2015, 34(4):448-452.
[24] 李源栋,段焰青,王红霞,等. GC/MS法结合保留指数分析鼠尾草油中香味成分[J]. 粮食与油脂, 2016, 29(3):65-68.
[25] 朱金霞,郭生虎,李苗,等. 海原小茴香优良品种筛选及挥发油化学成分比较研究[J]. 种子, 2009, 28(9):47-49.
[26] AKGÜL A, BAYRAK A. Comparative volatile oil composition of various parts from Turkish bitter fennel (Foeniculum vulgare varvulgare)[J]. Food Chemistry, 1988, 30(4):319-323.
[27] DIAO W R, HU Q P, ZHANG H, et al. Chemical composition, antibacterial activity and mechanism of action of essential oil from seeds of fennel (Foeniculum vulgare Mill.)[J]. Food Control, 2014, 35(1):109-116.
[28] 郑甜田,陶永生,张敏,等. 10种产地小茴香果实挥发油成分分析[J]. 昆明医科大学学报, 2017(11):19-24.
[29] 王强,殷超,彭秧. 比较研究新疆小茴香不同溶剂提取物的抗氧化活性[J]. 中国酿造, 2012, 31(6):95-97.
[30] MOTAMED S M, NAGHIBI F. Antioxidant activity of some edible plants of the Turkmen Sahra region in northern Iran[J]. Food Chemistry, 2010, 119(4):1 637-1 642.
[31] HINNEBURG I, HJD D, HILTUNEN R. Antioxidant activities of extracts from selected culinary herbs and spices[J]. Food Chemistry, 2006, 97(1):122-129.
[32] 张翠利,付丽娜,杨小云,等. 活性氧自由基与细胞衰老关系的研究进展[J]. 广州化工, 2015(19):5-7.
[33] OKTAY M, GULCIN I, KUFREVIOGLU O I. Determination of in vitro antioxidant activity of fennel (Foeniculum vulgare) seed extracts[J]. LWT - Food Science and Technology, 2003, 36(2):263-271.
[34] MIRALIAKBARI H, SHAHIDI F. Antioxidant activity of minor components of tree nut oils[J]. Food Chemistry, 2008, 111(2):421-427.
[35] RUFINO M D S M, ALVES R E, BRITO E S D, et al. Bioactive compounds and antioxidant capacities of 18 non-traditional tropical fruits from Brazil[J]. Food Chemistry, 2010, 121(4):996-1 002.
[36] SALAMA Z A, BAZ F K E, GAAFAR A A, et al. Antioxidant activities of phenolics, flavonoids and vitamin C in two cultivars of fennel (Foeniculum vulgare Mill.) in responses to organic and bio-organic fertilizers[J]. Journal of the Saudi Society of Agricultural Sciences, 2015, 14(1):91-99.
[37] GACHKAR L, YADEGARI D, REZAEI M B, et al. Chemical and biological characteristics ofCuminum cyminum andRosmarinus officinalis essential oils[J]. Food Chemistry, 2007, 102(3):898-904.
[38] FRANKEL E N, MEYER A S. The problems of using one-dimensional methods to evaluate multifunctional food and biological antioxidants[J]. Journal of the Science of Food & Agriculture, 2000, 80(13):1 925-1 941.
[39] MIRALIAKBARI H, SHAHIDI F. Antioxidant activity of minor components of tree nut oils[J]. Food Chemistry, 2008, 111(2):421-427.
[40] GONZ LEZ-BURGOS E, G
LEZ-BURGOS E, G MEZ-SERRANILLOS M P. Terpene compounds in nature: A review of their potential antioxidant activity[J]. Current Medicinal Chemistry, 2012, 19(31):5 319-5 341.
MEZ-SERRANILLOS M P. Terpene compounds in nature: A review of their potential antioxidant activity[J]. Current Medicinal Chemistry, 2012, 19(31):5 319-5 341.