 KTA Prime Plus蛋白纯化系统,GE生命科学;Aglient 6410质谱仪,安捷伦科技;iMark酶标仪,伯乐生命医学;JY92-IIN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;T100TM PCR仪,伯乐生命医学;NANODROP 2000,赛默飞世尔科技。
KTA Prime Plus蛋白纯化系统,GE生命科学;Aglient 6410质谱仪,安捷伦科技;iMark酶标仪,伯乐生命医学;JY92-IIN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;T100TM PCR仪,伯乐生命医学;NANODROP 2000,赛默飞世尔科技。琼胶是一种红藻来源的海洋多糖[1],因其胶凝性及凝胶稳定性,目前被广泛应用于食品、生物工程、医药等行业[2]。琼胶的主要组分为琼脂糖,结构由(1-3)-O-β-D-吡喃半乳糖残基(G残基)及(1-4)-O-3,6-内醚-α-L-吡喃半乳糖残基(LA残基)交替组成[3]。由琼胶降解得到的琼胶寡糖已被证实具有多种生理调节功能,如抑菌性[4]、抗氧化性[5]、抗病毒[6]等,在功能食品开发方面展现出巨大的应用潜力。
琼胶酶是一类可特异性降解琼胶中的琼脂糖组分生成琼胶寡糖的水解酶,根据水解位置的差异,琼胶酶分为识别α-1,3糖苷键的α-琼胶酶及识别β-1,4糖苷键的β-琼胶酶[7]。根据氨基酸序列,目前发现的β-琼胶酶分属于4个糖苷水解酶(glycoside hydrolyase,GH)家族,即GH16、GH50、GH86及GH118家族,其中GH16家族β-琼胶糖因具有良好的酶学性质及高催化效率受到广泛关注[8]。
本研究拟以微生物基因组出发,以生物信息学及分子生物学的手段获取新型琼胶酶。实验室前期分离到1株海洋细菌Wenyingzhuangia fucanilytica CZ1127T[9-10],并完成了该细菌的全基因组测序,初步的生物信息学分析表明,该细菌的基因组中含有多条GH16家族糖苷水解酶基因,并在其中发现了1条潜在的β-琼胶酶基因aga16A(WP_068828902.1)。本研究拟对该序列进行生物信息学分析、分子克隆及异源表达,进一步考察其编码蛋白Aga16A_Wf的酶学性质、动力学常数、作用方式及降解产物,以期为琼胶寡糖的制备及后续研究与应用寻找新工具。
海洋细菌Wenyingzhuangia fucanilytica CZ1127T,实验室筛选并保存; TLC 硅胶60F254 薄层色谱板,默克生命科学技术;琼胶底物(REGULAR AGAROSE G-10),BIOWEST;磁珠法基因组DNA抽提试剂盒,生工生物工程(上海)股份有限公司;切胶回收试剂盒,OMEGA;高纯质粒小量快速提取试剂盒(离心柱型)、BL21(DE3)感受态细胞,北京博迈德基因技术有限公司;pET-28a(+)质粒,安诺伦(北京)生物科技;限制性内切酶BamHI/XhoI,赛默飞世尔科技;HiPrepTM 26/10 Desalting、HisTrapTM HP、Superdex peptide 10/300 GL色谱柱,GE生命科学;BCA蛋白浓度测定试剂盒(增强型),碧云天生物技术;预染蛋白分子量标准,赛默飞世尔科技;其他化学试剂均为分析纯。
 KTA Prime Plus蛋白纯化系统,GE生命科学;Aglient 6410质谱仪,安捷伦科技;iMark酶标仪,伯乐生命医学;JY92-IIN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;T100TM PCR仪,伯乐生命医学;NANODROP 2000,赛默飞世尔科技。
KTA Prime Plus蛋白纯化系统,GE生命科学;Aglient 6410质谱仪,安捷伦科技;iMark酶标仪,伯乐生命医学;JY92-IIN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;T100TM PCR仪,伯乐生命医学;NANODROP 2000,赛默飞世尔科技。
1.2.1 生物信息学分析
利用dbCAN[11]及SignalP 4.1[12]等软件对蛋白序列Aga16A_Wf可能存在的蛋白结构域进行预测,采用ExPASy[13]对蛋白的理论分子质量进行预测,使用BLASTP[14]、ClustalX2[15]与MEGA6[16]对Aga16A_Wf与已知GH16家族β-琼胶酶序列的相似度及进化关系进行分析。
1.2.2 Aga16A_Wf的克隆表达
将W.fucanilytica CZ1127T接种于2216E液体培养基中,收集菌体并提取基因组DNA。利用PCR对去除信号肽后的目的基因进行扩增,并在序列的N端添加6×His标签。上下游引物序列分别为5’-GACACGGATCCGCAAGTGATTCGGTAGCCA-3’、5’-GACACCTCGAGTTATTTACTTTTTAACTTCC-3’。使用限制性内切酶BamH I/XhoI对PCR扩增产物及pET-28a(+)载体进行酶切,并将处理后的目的片段和载体连接。将构建好的表达载体转化至BL21(DE3)感受态细胞中。将转化的大肠杆菌接种于含30 ng/μL卡那霉素的LB培养基中,并于37 ℃、180 r/min 培养,至菌液OD600值达到0.4时,添加终浓度为0.5 mmol/L 的异丙基β-d-硫代半乳糖苷,之后17 ℃诱导培养18 h。
1.2.3 酶的分离纯化及纯度检测
收集诱导培养后的菌体,以20 mmol/L磷酸氢二钠-磷酸二氢钠缓冲液(pH 7.0)重悬,超声破碎后离心获取上清液。以HisTrapTM HP色谱柱对上清液中的目标蛋白进行亲和层析纯化,平衡流动相为含0.3 mol/L NaCl的20 mmol/L磷酸氢二钠-磷酸二氢钠(pH 7.0),洗脱梯度为0~0.5 mol/L咪唑。收集酶活组分,并以HiPrepTM 26/10 Desalting色谱柱脱盐,流动相为20 mmol/L 磷酸氢二钠-磷酸二氢钠缓冲液(pH 7.0)。纯化后蛋白的纯度及分子量通过SDS-PAGE进行分析,分离胶质量浓度为120 g/L,染色剂为考马斯亮蓝R-250。
1.2.4 β-琼胶酶酶活测定
除特殊说明外,酶活测定体系均为:750 μL 2 mg/mL 底物溶液(20 mmol/L pH 7.0磷酸氢二钠-磷酸二氢钠缓冲液溶解,含0.1 mol/L NaCl)与750 μL适当稀释的酶液混合,50 ℃反应10 min后于100 ℃金属浴处理5 min以灭活。采用pHBH法[17-18]表征酶解反应前后还原糖增量,以D-半乳糖作为标准品。酶活单位(1 U)定义为酶液1 min内水解底物产生1 μmol 还原糖的活力。蛋白浓度由BCA试剂盒测定。
1.2.5 酶学性质研究
1.2.5.1 温度对Aga16A_Wf的影响
将底物与酶混合后置于15~70 ℃下反应10 min,检测Aga16A_Wf在不同温度下的酶活。将酶液分别于4、25、40、50 ℃放置24 h,间隔一定时间取样测定酶活,以放置0 h时的酶活力为100%,计算Aga16A_Wf在不同温度下的酶活残余率(%)。
1.2.5.2 pH对Aga16A_Wf的影响
以不同pH值的缓冲液溶解底物或置换酶液中的溶剂(pH 4.0~7.0:20 mmol/L柠檬酸-磷酸氢二钠缓冲液;pH 6.5~9.0:20 mmol/L磷酸氢二钠-磷酸二氢钠缓冲液;pH 9.0~11.0:20 mmol/L碳酸钠-碳酸氢钠缓冲液),将对应pH值的酶与底物混合,测定不同pH值下酶的活力。以不同pH值的缓冲液置换酶液中的溶剂,将酶液于4 ℃放置1 h后,将pH值调至7.0并测定酶活,将未经任何处理的酶液的活力定义为100%,计算酶液在不同pH下的酶活残余率(%)。
1.2.5.3 金属离子及化学试剂对Aga16A_Wf的影响
配制不同NaCl质量浓度的2 g/L琼胶底物,使反应体系中的NaCl浓度为0~1 mol/L,考察Na+浓度对酶活的影响。向反应体系中分别添加金属离子K+、Mg2+、Zn2+、Cd2+、Ca2+、Mn2+、Hg2+及化学试剂EDTA-2Na、SDS与β-巯基乙醇,使其终浓度为1 mmol/L, 将未添加金属离子的酶活力定义为100%,计算酶活比率(%)。
1.2.5.4 动力学常数的测定
将酶液与不同质量浓度的琼胶溶液混合(反应体系中的底物质量浓度为0.01~0.20 g/L),测定不同底物浓度下的酶活。依据Michaelis-Menten方程,计算Aga16A_Wf的动力学常数Km、Kcat。
1.2.6 作用方式研究
将1 U Aga16A_Wf加入至50 mL 2 g/L琼胶底物溶液(20 mmol/L pH 7.0磷酸盐缓冲液溶解),25 ℃ 反应至24 h,间隔取样后100 ℃灭活5 min,取15 μL以薄层色谱(TLC)对寡糖成分进行分析。TLC展开剂组分的体积比为V(正丁醇)∶V(冰乙酸)∶V(水)=2∶1∶1,显色剂为含体积分数10%硫酸的乙醇。
为制备降解终产物,取1、30、50、100 U的Aga16A_Wf分别与50 mL质量浓度2 g/L琼胶进行反应,25 ℃酶解24 h后以TLC分析寡糖组成。
使用Superdex peptide 10/300 GL色谱柱对上述1 U Aga16A_Wf酶解24 h产物进行分离,收集各寡糖组分冻干后加入体积分数25%乙腈(含50 mmol/L甲酸铵)复溶,以质谱仪进行分析。质谱分析的流动相为体积分数25%乙腈(含50 mmol/L甲酸铵),离子源为负离子模式,源温为300 ℃,毛细管电压为4 000 V,分子质量扫描范围为100~2 000 u。
1.2.7 数据统计
各实验重复3次,结果以平均值±标准偏差表示。显著性差异以SPSS 16.0软件进行分析,采用Duncan’s ANOVA检测,以P<0.05作为显著性差异的判断标准。
Aga16A_Wf由324个氨基酸组成,SignalP 4.1与dbCAN预测该序列包含1段C端信号肽及1个GH16家族结构域(如图1所示)。
利用BLASTP程序对Aga16A_Wf以及GH16家族的已知蛋白序列进行局部比对,发现Aga16A_Wf与Catenovulum agarivorans YM01产β-琼胶酶相似度最高,但仅为66%(覆盖率为85%),表明Aga16A_Wf是1个较为新颖的酶。

图1 Aga16A_Wf结构域分布
Fig.1 Domain structure of Aga16A_Wf
GH16家族除β-琼胶酶外,还包括κ-卡拉胶酶、β-紫菜多糖酶、地衣多糖酶及海带多糖酶等多种糖苷水解酶。Aga16A_Wf与已知GH16家族β-琼胶酶序列构建的系统发育树如图2所示,结果表明Aga16A_Wf处于β-琼胶酶的系统发育树中,预示该序列具有GH16家族β-琼胶酶活力。
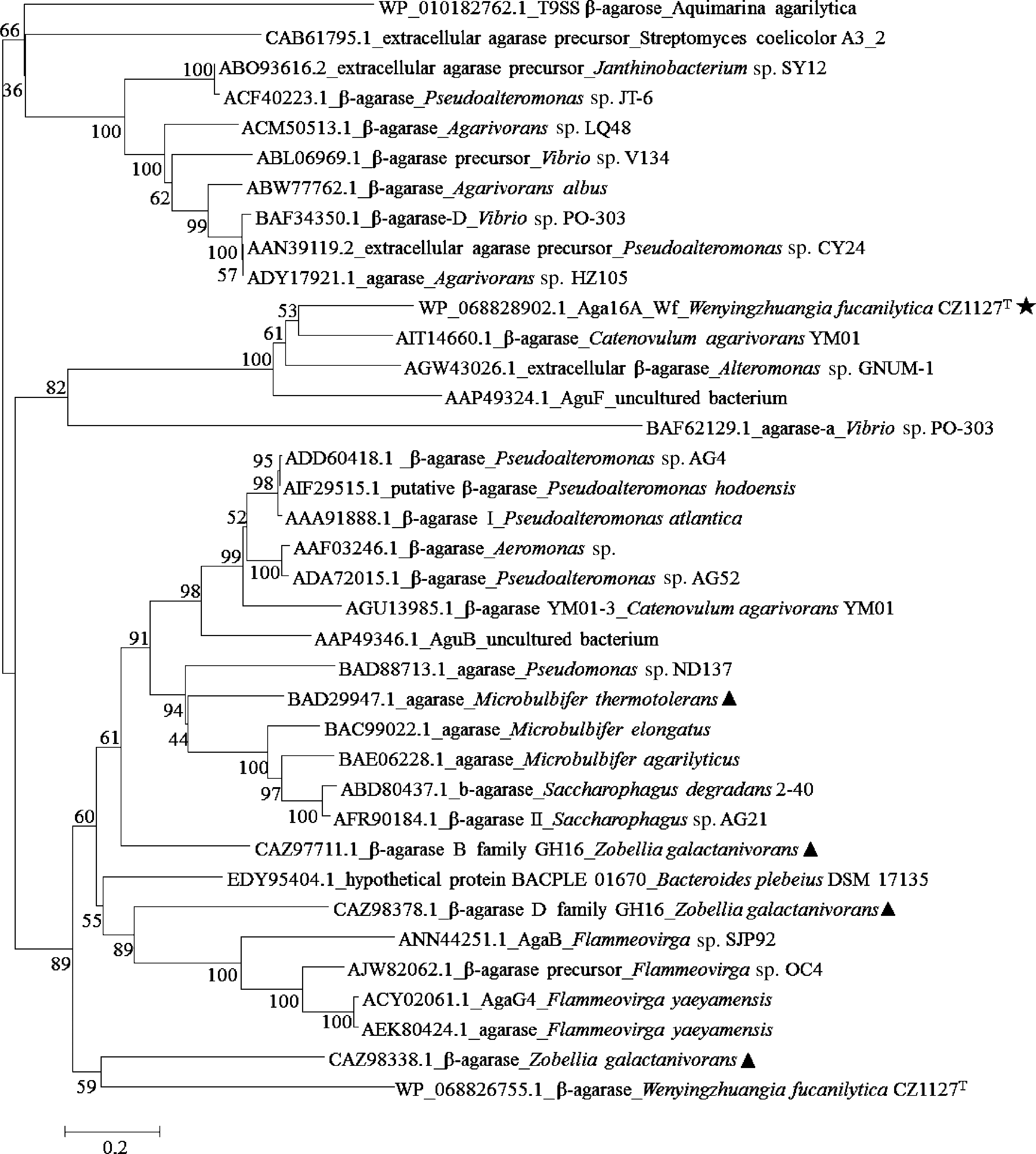
图2 Aga16A_Wf与已知GH16家族β-琼胶酶构建的系统发育树
Fig.2 Phylogenetic tree of Aga16A_Wf and all characterized GH16 β-agarase sequences
注:星号标识为Aga16A_Wf,三角形标识为晶体结构已知的GH16家族β-琼胶酶;各序列信息按照GenBank收录号、
蛋白名称及菌种来源依次标注。
将Aga16A_Wf与具有明确晶体结构的GH16家族β-琼胶酶序列进行多序列比对,结果如图3。据报道,AgaA_Zg的关键催化位点包括E147及E152[19],其中E147为催化亲和位点,E152为质子供体,上述关键催化位点在目前得到酶活确认的GH16家族β-琼 胶酶序列中均严格保守。Aga16A_Wf在上述2个位点与比对序列表现出一致性(图3),进一步提示该酶具有潜在的β-琼胶酶活力。
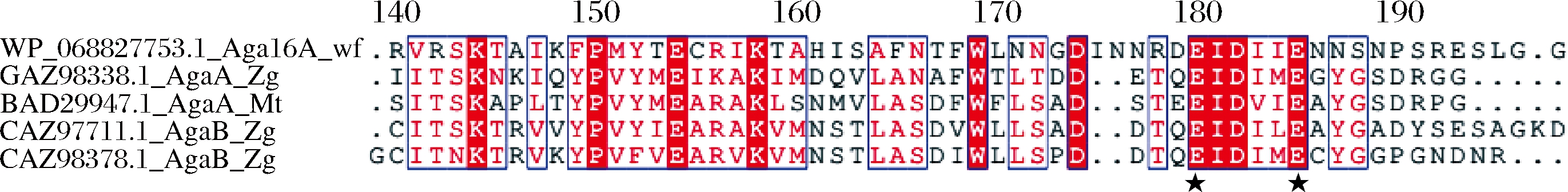
图3 Aga16A_Wf序列比对结果
Fig.3 Multiple sequence alignment of Aga16A_Wf
注:星号标注的位点为GH16家族β-琼胶酶的关键催化位点。
将超声破碎后的胞内上清酶液,使用亲和层析进行分离纯化,0.25 mol/L咪唑洗脱组分表现出β-琼胶酶活力。纯化后酶的活力为23.67 U/mg,酶活回收率为57%。SDS-PAGE分析结果显示,纯化后酶蛋白为单一条带,表明其纯度良好。根据SDS-PAGE,重组表达的Aga16A_Wf的分子质量约为40 ku,与预测分子质量(38.1 ku)吻合。上述结果证实Aga16A_Wf为β-琼胶酶,aga16A为β-琼胶酶基因(图4)。

M-预染蛋白分子质量标准
图4 纯化后Aga16A_Wf的SDS-PAGE电泳图
Fig.4 SDS-PAGE of purified Aga16A_Wf
2.3.1 温度对酶活的影响
不同的反应温度对Aga16A_Wf酶活的影响如图5-A所示,该酶的最适反应温度为50 ℃。琼胶具有凝胶性,Aga16A_Wf的最适反应温度高于琼胶的凝胶温度(约40 ℃)[20-21],在此温度(50 ℃)下,琼胶可保持溶液状态,因此酶解反应将在均相条件下进行,从而保证了反应效率,有利于寡糖的高效制备。此外,Aga16A_Wf在较低温度下也表现出较高活力,15 ℃ 及20 ℃时的活力分别为最适温度时的68.1%与69.9%,说明此酶具有适冷性。
Aga16A_Wf的热稳定性情况如图5-B。该酶在25 ℃下放置24 h,酶活残余率为80%;此外,在不加任何保护剂的情况下,Aga16A_Wf在4 ℃时酶活基本保持不变,且至少可稳定保存15 d。然而,该酶在高温下的稳定性较差,50 ℃放置5 h酶活仅剩22%,这一现象与多数海洋来源的酶类似[22-24]。
尽管Aga16A_Wf的酶活在最适反应条件下损失较快,但本研究证实1U该酶在50 ℃下酶解5 mL体积分数为2%琼胶溶液,15 min内即可使琼胶失去凝胶能力,之后转为低温或室温下反应,借助该酶的适冷性,酶解反应的速率仍较高,并可减少反应的热能消耗。
2.3.2 pH对酶活的影响
反应体系pH值对Aga16A_Wf酶活的影响如图5-C所示,结果表明该酶的最适反应pH值为7.0,并在pH 6~8展现出较高活力,偏中性的最适反应pH值与大多数已报道的GH16家族β-琼胶酶相似[25-28]。Aga16A_Wf的pH值稳定性如图5-D,Aga16A_Wf在pH 6.5~9.0下基本能保持稳定(酶活残余率>80%)。
2.3.3 NaCl、金属离子及化学试剂稳定性
NaCl对Aga16A_Wf酶活的影响如图6。Aga16A_Wf在未添加NaCl的反应体系中可展现出活力;但相较NaCl添加量为0的反应体系,0.05 mol/L NaCl可使Aga16A_Wf的酶活提高2.5倍。NaCl显著促进酶活的现象与多种海洋细菌来源的β-琼胶酶相一致[23, 29-30],NaCl可能通过改变底物的物理状态或构象从而影响酶活[31-32]。
如表1所示,Ca2+、Mn2+、Zn2+、Mg2+、Cd2+及SDS对酶活无显著影响;EDTA-2Na与Hg2+显著降低了酶活,可能由于EDTA-2Na与催化相关的金属离子螯合从而影响了活力,Hg2+可能破坏催化中心
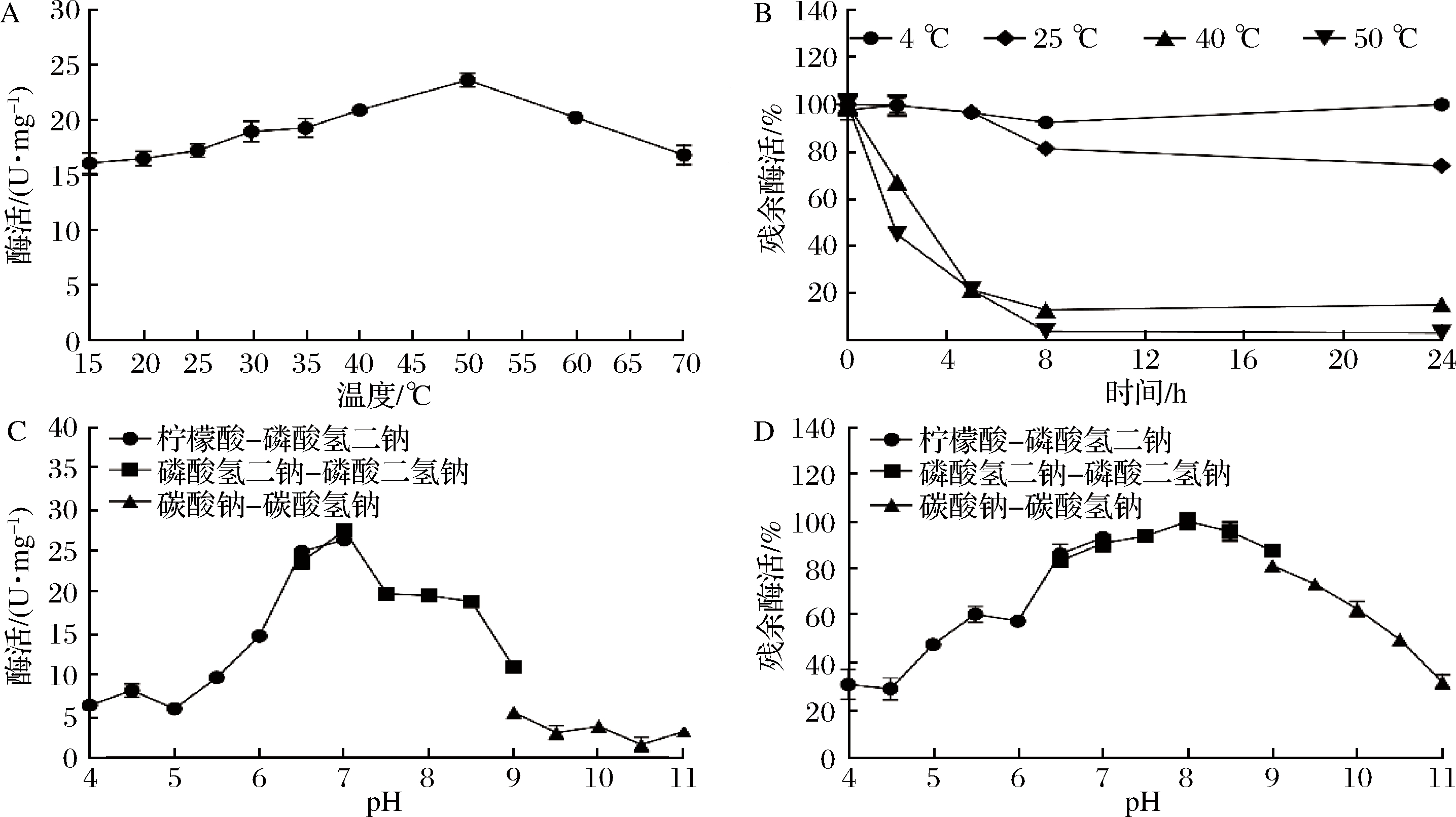
A-最适反应温度;B-温度稳定性;C-最适反应pH值; D-pH值稳定性
图5 Aga16A_Wf酶学性质
Fig.5 Biochemical characteristics of Aga16A_Wf
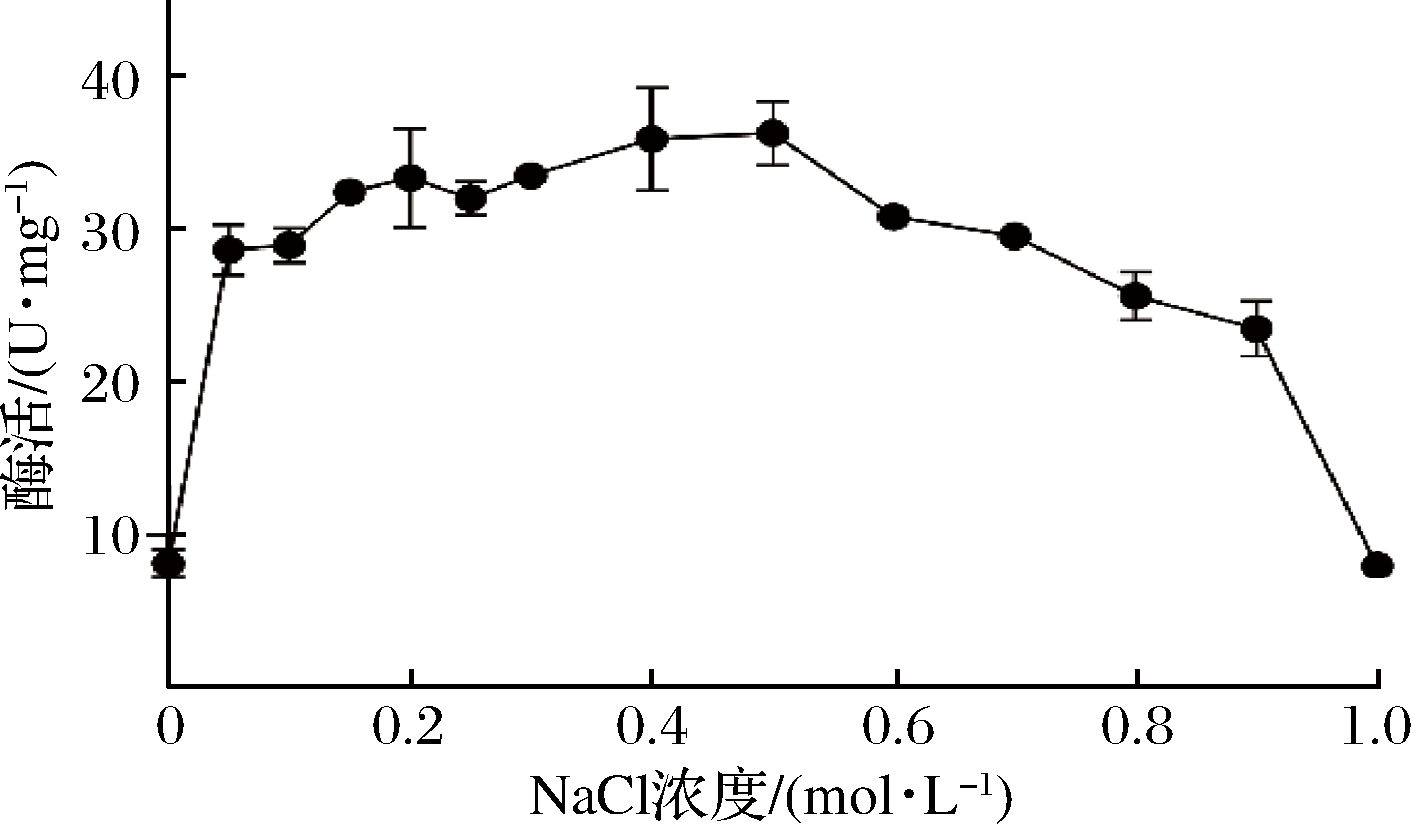
图6 NaCl对酶活的影响
Fig.6 The influence of NaCl on Enzyme Activity
的巯基从而使活性显著降低;K+显著提高了酶活,此现象与NaCl对酶活的影响结果相类似,说明一价金属阳离子可增加酶解效率。
表1 金属离子和化学试剂对Aga16A_Wf酶活的影响
Table 1 Effect of metal ions and chemicalson the activity of Aga16A_Wf

离子/化学试剂酶活残余/%离子/化学试剂酶活残余/%无100000Mg2+96.53±3.09K+151.09±6.26Cd2+106.54±3.70Zn2+91.01±1.87Mn2+97.96±2.32Ca2+95.10±6.22EDTA-2Na63.83±3.73Hg2+51.10±3.99β-巯基乙醇85.49±2.48SDS96.12±4.31
2.3.4 动力学常数
以0.01~0.20 g/L的琼胶为底物,反应体系溶液环境为20 mmol/L pH 7.0磷酸氢二钠-磷酸二氢钠缓冲液(含0.05 mol/L NaCl),50 ℃下测定Aga16A_Wf的酶促动力学常数,测得Km为3.6 g/L,Kcat为287.88 s-1。
1 U Aga16A_Wf酶解50 mL、2 g/L的底物5 min 后,即检测到不同聚合度寡糖的生成(图7-A),证明Aga16A_Wf为内切型降解酶;随着反应时间的延长,高聚合度的寡糖明显减少,2 h后延长反应时间未见寡糖组成明显变化(图7-A)。随加酶量的增大(1~100 U),组分Ⅱ不断减少而组分I逐渐增多,始终未检测到较组分Ⅰ更小的降解产物出现(图7-B),表明Aga16A_Wf的最小作用底物为组分Ⅱ,最小产物为组分Ⅰ。
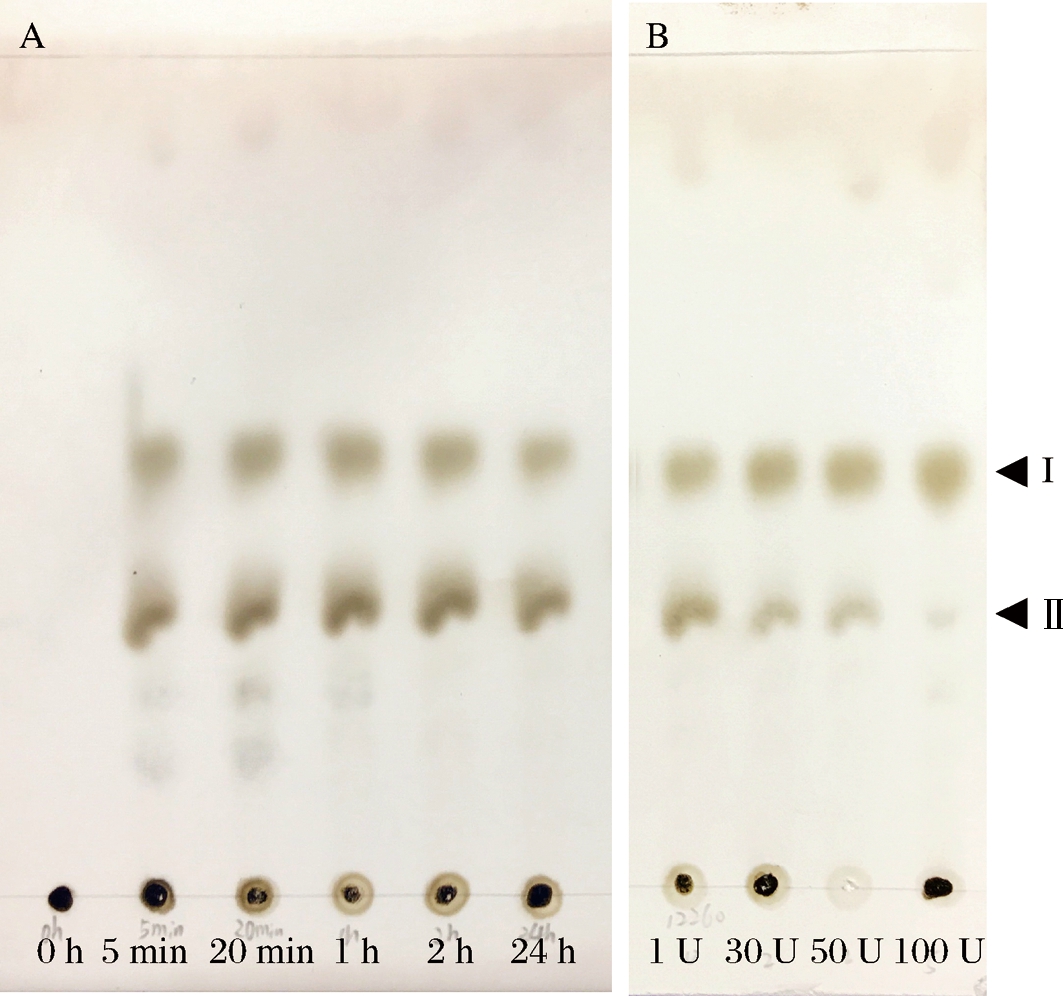
A-不同反应时间酶解产物;B-不同加酶量酶解产物
图7 Aga16A_Wf酶解产物的TLC分析
Fig.7 TLC analysis of the hydrolysis products of Aga16A_Wf
为进一步确认降解产物的化学组成,利用电喷雾质谱技术对组分Ⅰ与组分Ⅱ进行鉴定。如图8-A,组分Ⅰ的分子离子峰[M-H]-的质荷比为323,表明其为二糖LA-G(324 u);如图8-B,组分Ⅱ的分子离子峰[M-H]-的质荷比为629,表明其为四糖[LA-G]2(630 u)。综合TLC与质谱鉴定的结果,Aga16A_Wf的最小作用底物为四糖,最小产物为二糖。

A-组分Ⅰ;B-组分Ⅱ
图8 组分Ⅰ及组分Ⅱ的质谱鉴定结果
Fig.8 The mass spectra of fractions Ⅰ and Ⅱ generated by Aga16A_Wf
本研究从海洋细菌W.fucanilytica CZ1127T的基因组出发,运用生物信息学方法寻找到1个新颖的GH16家族β-琼胶酶Aga16A_Wf,成功在大肠杆菌中实现其外源表达,并系统研究了其酶学性质、动力学参数及作用方式。Aga16A_Wf的最适反应温度为50 ℃ 且展现出适冷性,最适pH为7.0,在pH 6.5~9.0及室温以下的环境中具有较好的稳定性。其动力学常数Km为3.6 g/L,Kcat为287.88 s-1;该酶以内切形式降解琼脂糖,最小作用底物为四糖,最小产物为二糖。Aga16A_Wf具有最适反应温度高、适冷性、内切型降解的特点,可作为高效制备琼胶寡糖的工具。
[1] FU Xiaoting, KIM S M. Agarase: Review of major sources, categories, purification method, enzyme characteristics and applications[J]. Marine Drugs, 2010,8(1):200-218.
[2] 汪春牛,时杰,葛思思,等. 卡拉胶与琼胶提取工艺的研究进展[J]. 海洋科学, 2012, 36(6):122-126.
[3] DUCKWORTH M, YAPHE W. The structure of agar: Part I. Fractionation of a complex mixture of polysaccharides[J]. Carbohydrate Research, 1971,16(1):189-197.
[4] GIORDANO A, ANDREOTTI G, TRAMICE A, et al. Marine glycosyl hydrolases in the hydrolysis and synthesis of oligosaccharides[J]. Biotechnology Journal, 2006,1(5):511-530.
[5] WU Shaochi, WEN Tuannan, PAN Chorngliang. Algal-oligosaccharide-lysates prepared by two bacterial agarases stepwise hydrolyzed and their anti-oxidative properties[J]. Fisheries Science, 2005,71(5):1 149-1 159.
[6] MAZUMDER S, GHOSAL P K, PUJOL C A, et al. Isolation, chemical investigation and antiviral activity of polysaccharides fromGracilaria corticata (Gracilariaceae, Rhodophyta)[J]. International Journal of Biological Macromolecules, 2002,31(1-3):87-95.
[7] 黄能平, 阮灵伟,施泓.Flammeovirga sp. SJP92琼脂酶的分离纯化及其酶学性质[J]. 应用海洋学学报, 2016,35(1):116-121.
[8] 崔方元.嗜琼胶卵链菌比较基因组学研究及系列琼胶酶基因的克隆表达[D]. 青岛:中国海洋大学, 2015.
[9] CHEN Feng, CHANG Yaoguang, DONG Shujun, et al.Wenyingzhuangia fucanilytica sp. nov., a sulfated fucan utilizing bacterium isolated from shallow coastal seawater[J]. International Journal of Systematic and Evolutionary Microbiology, 2016,66(9):3 270-3 275.
[10] CHANG Yaoguang, XUE Changhu, TANG Qingjuan, et al. Isolation and characterization of a sea cucumber fucoidan-utilizing marine bacterium[J]. Letters in Applied Microbiology, 2010,50(3):301-307.
[11] YIN Yanbin, MAO Xizeng, YANG Jincai, et al. dbCAN: A web resource for automated carbohydrate-active enzyme annotation[J]. Nucleic Acids Research, 2012,40(W1):W445-W451.
[12] PETERSEN T N, SØREN B, HEIJNE G V, et al. SignalP 4.0: Discriminating signal peptides from transmembrane regions[J]. Nature Methods, 2011,8(10):785-786.
[13] WILKINS M R, GASTEIGER E, BAIROCH A, et al. Protein identification and analysis tools in the ExPASy server[J]. Methods in Molecular Biology, 1999,112:531-552.
[14] ALTSCHUL S F, MADDEN T L, SCHAFFER A A, et al. Gapped BLAST and PSI-BLAST: A new generation of protein database search programs[J]. Nucleic Acids Reseaech, 1997,25(17):3 389-3 402.
[15] THOMPSON J D, GIBSON T J, FRÉDÉRIC P, et al. The CLUSTAL_X windows interface: Flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997,25(24):4 876-4 882.
[16] TAMURA K, STECHER G, PETERSON D, et al. MEGA6: Molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013,30(12):2 725-2 729.
[17] LEVER M. A new reaction for colorimetric determination of carbohydrates[J]. Analytical Biochemistry, 1972,47(1):273-279.
[18] 张翠玉, 薛长湖,于龙,等. 基于pHBH法的岩藻聚糖硫酸酯酶酶活测定方法[J]. 中国食品学报, 2013,13(7):200-206.
[19] ALLOUCH J, JAM M, HELBERT W, et al. The three-dimensional structures of two beta-agarases[J]. Journal of Biological Chemistry, 2003,278(47):47 171-47 180.
[20] 史升耀, 张燕霞,刘万庆,等. 江蓠琼胶产率、物理性质和化学组成的季节变化[J]. 海洋与湖沼, 1983,14(3):272-278.
[21] ALI A, EVA-MAR A G D P, FABRA M J, et al. Agarose-based freeze-dried capsules prepared by the oil-induced biphasic hydrogel particle formation approach for the protection of sensitive probiotic bacteria[J]. Food Hydrocolioids, 2019,87:487-496.
A G D P, FABRA M J, et al. Agarose-based freeze-dried capsules prepared by the oil-induced biphasic hydrogel particle formation approach for the protection of sensitive probiotic bacteria[J]. Food Hydrocolioids, 2019,87:487-496.
[22] CUI X, JIANG Yuechen, CHANG Liuyi, et al. Heterologous expression of an agarase gene inBacillus subtilis, and characterization of the agarase[J]. International Journal of Biological Macromolecules, 2018,120(Pt A):657-664.
[23] CUI Fangyuan, DONG Sujie, SHI Xiaochong, et al. Overexpression and characterization of a novel thermostable beta-Agarase YM01-3, from marine bacteriumCatenovulum agarivorans YM01(T)[J]. Marine Drugs, 2014,12(5):2 731-2 747.
[24] AN Ke, SHI Xiaochong, CUI Fangyuan, et al. Characterization and overexpression of a glycosyl hydrolase family 16 beta-agarase YM01-1 from marine bacteriumCatenovulum agarivorans YMO1(T)[J]. Protein Expression and Purification, 2018,143:1-8.
[25] LI Renkuan, CHEN Zeng, YING Xijuan, et al. A novel GH16 beta-agarase isolated from a marine bacterium,Microbulbifer sp. BN3 and its characterization and high-level expression in Pichia pastoris[J]. International Journal of Biological Macromolecules, 2018,119:1 164-1 170.
[26] ZHANG Weiwei, SUN Li. Cloning, characterization, and molecular application of a beta-agarase gene fromVibrio sp. strain V134[J]. Applied and Environmental Microbiokogy, 2007,73(9):2 825-2 831.
[27] OHTA Y, HATADA Y, NOGI Y, et al. Enzymatic properties and nucleotide and amino acid sequences of a thermostable beta-agarase from a novel species of deep-seaMicrobulbifer[J]. Applied Microbiology and Biotechnology, 2004,64(4):505-514.
[28] OHTA Y, NOGI Y, MIYAZAKI M, et al. Enzymatic properties and nucleotide and amino acid sequences of a thermostable beta-agarase from the novel marine isolate, JAMB-A94[J]. Bioscience Biotechnology and Biochemistry, 2004,68(5):1 073-1 081.
[29] MEI Jianfeng, TANG Zhongxiu, YI Yu, et al. Purification and characterization of beta-agarase fromPaenibacillus sp.[J]. Food Science and Biotechnology, 2014,23(5):1 605-1 609.
[30] 杨光.海洋来源琼胶酶及其基因的克隆与表达[D]. 福州:福州大学, 2015.
[31] CHAUHAN P S, SAXENA A. Bacterial carrageenases: An overview of production and biotechnological applications[J]. 3 Biotech, 2016,6(2):146.
[32] SCHEFER L, USOV I, MEZZENGA R. Anomalous stiffening and ion-induced coil-helix transition of carrageenans under monovalent salt conditions[J]. Biomacromolecules, 2015,16(3):985-991.