益生菌(probiotics)是指具有维持人体内菌群平衡,对人体健康产生有益作用的微生态制剂。口服足量活性益生菌有助于缓解急慢性胃肠炎、治疗腹泄、改善消化,缓解乳糖不耐症等症状[1]。Science和Cell等国际顶级期刊发表论文指出,特定益生菌及肠道菌群在减少病原菌在肠内定植和生长、提升免疫力、缓解神经发育障碍等方面具有显著功能[2-3]。常见益生菌主要源自革兰氏阳性的乳酸杆菌属、乳酸球菌属、双歧杆菌属及部分酵母,其菌体制剂分为液体制剂和固体制剂。前者是通过传统发酵培养并最终获得益生菌菌液作为制剂产品,后者则由益生菌经增殖后,通过冻干、喷雾干燥或包埋等手段加工成固体制剂形式。液态制剂随着保藏时间延长易受污染或菌种退化,使用前需活化培养和扩大培养,而固态菌剂可直投,发酵前不需扩大培养,保藏费用较低。目前,益生菌固体制剂工艺常有真空冷冻干燥、喷雾干燥、流化床干燥、微波真空干燥等。真空冷冻干燥适用热敏性益生菌干燥,菌体亚细胞损伤少、活菌率高,但易受预冻温度、冷冻速度和真空度等因素影响,耗时长、费用高;流化床干燥干燥时间较长,当物料停留时间不均匀时,存在干燥不均匀等情况;微波真空干燥通过极性分子(如菌体水分)随微波频率做同步高速旋转,物料瞬时产生摩擦热,导致物料表面和内部同时升温,使大量菌体水分子逸出,实现干燥,但存在微波分布不均匀,温度一致性不好等问题,且无法实现规模化操作。喷雾干燥是直接将制备好的菌悬液经过雾化装置喷雾成雾状,并在干燥室内与高温空气直接接触进行传热传质,干燥时间极短,物料温度较低,产品分散性和溶解性较好,过程简单,设备成本相对较低,特别适用于工业化连续生产,在药品、食品领域被广泛使用[4]。本文回顾了益生菌喷雾干燥的基本原理,对影响喷雾干燥因素进行系统而全面的分析,并提出益生菌喷雾干燥工艺优化策略,以期促进喷雾干燥技术在益生菌干燥中的应用。
喷雾干燥法是将拟干燥的益生菌菌体雾化成非常细微的雾滴,并依靠干燥介质(如热空气)与益生菌雾滴均匀混合,通过热质交换使溶剂气化从而获得干燥的益生菌菌体。典型生产工艺如图1所示[4]。

图1 典型喷雾干燥器的结构示意图
Fig.1 Typical structure sketch of spray dryer
具体喷雾干燥过程如下:经增殖培养的益生菌菌体经预处理后由料泵从塔顶进入喷雾干燥塔,由喷头雾化为直径约20~100 μm的益生菌液滴并与热空气(120~180 ℃)接触。进入喷雾干燥塔的热空气经除湿、加热后由干燥塔顶端进入塔内并与雾化的益生菌液滴进行顺流干燥。由于益生菌菌体微小,具有极大的比表面积,与热空气有良好的热质交换,可在几秒至几十秒内迅速脱水干燥,从而制备成益生菌菌粉;益生菌菌粉随后进入袋式过滤器,废空气则由过滤器顶端排出,实现空气与益生菌干菌体的分离。菌体由袋式过滤器收集后直接制备成益生菌菌粉。部分益生菌菌体经袋式过滤器分离后水分达不到质量要求,可进入流化床干燥器进一步除去水分,再制备成益生菌菌粉。喷雾干燥作为一种常用的干燥技术,在条件优化情况下,可进行几十毫升至几吨的物料干燥。
研究益生菌菌体存活率的影响因素对保护益生菌和减少益生菌生理功能的损失具有重要作用[5]。
益生菌在极端条件或受热条件下可诱导产生热激蛋白,与益生菌菌体热耐受性有重要关系。一般对数生长末期和稳定期菌体的热耐受性较好,通过预处理可提高益生菌菌体耐受性。DESMOND等将L.rparacasei NFBC338用0.3 mol/L NaCl预处理30 min增强了菌体耐受性[6];陆英等[7]将7 h菌龄的酪乳杆菌L.casei BD- Ⅱ50 ℃预处理45 min,菌体热耐受性提高了2.11倍;TEIXEIRA等[8]对处于不同生长阶段的L.bulgaricus进行热激处理并研究了存活率,发现稳定期菌体热耐受性比对数生长期菌体要好,对数生长期菌体存活率相对稳定期要低[9]。GOLOWCZYC等在相同喷雾干燥条件下对CIDCA 83114、L.kefir CIDCA 8348和S.lipolytica CIDCA 812三株乳酸菌耐热性进行对比分析,研究发现,3株乳酸菌表现不同耐热性,其热耐受性存在显著差异[10];CORCORAN等[11]对比分析了L.rhamnosus E800、L.salivarius UCC500和L.rhamnosus GG的耐热性,发现益生菌菌体热耐受性存在差异,L.rhamnosus E800热耐受性最好;YANG等[12]对比分析了Mg2+对益生菌L.rhamnosus GG,L.casei Zhang和L.plantarum P-8热耐受性的影响,研究发现,Mg2+能提高这3株乳酸菌的热耐受性,特别是L.rhamnosus GG,Mg2+在20 mmol/L条件下,L.rhamnosus GG存活率提高了近100倍,且热诱导热激蛋白时间明显缩短。由此可见,由于菌株生理特点不同导致菌体热耐受性有一定区别,菌体热耐受性可通过不同方式进行热诱导来提升。
在益生菌培养基中添加特定成分(如糖、氨基酸等)可提高益生菌菌体存活率,主要是由于在高热和低水分条件下微生物可产生可溶性物质来减少因渗透压改变造成的亚细胞损伤。需注意的是,乳酸菌无法合成这类可溶性物质,在乳酸菌培养过程中添加这些物质可减少乳酸菌细胞膜亚细胞结构的热损伤。CARVALHO等[13]和SILVA等[14]认为在培养基中添加乳糖和蔗糖可增强菌株热耐受性和提高喷雾干燥过程中活细胞耐热性和存活率。不同糖类代谢产物对益生菌保护作用有显著差异。如P.aeruginosa发酵蔗糖和果糖产生的甘露醇在低水分条件下可减少益生菌菌体受到热损伤;乳酸菌可利用乳糖和蔗糖等产生表多糖(EPS)黏附在细胞壁上减少乳酸菌热氧化损伤[15]。KETS等[16]认为,在培养基中添加甜菜碱可增强益生菌的耐热性,能减少高温和干燥脱水对亚细胞结构的损伤。CORREA等[17]研究了L.rhamnosus CRL1505的热耐受性,在磷酸缓冲溶液中55 ℃热诱导20 min比60 ℃热诱导5 min能更好地提高菌体的热耐受性,在含10%脱脂奶粉的培养基中加入KH2PO4, Na2HPO4, MnSO4和MgSO4等无机盐能提高菌体存活率,并利用TEM监测了细胞形态的变化。研究认为,在无机盐和高浓度多磷酸盐存在情况下,能提高益生菌菌体对热激的耐受性。
在喷雾干燥过程中添加保护剂是益生菌菌粉制备中的常用策略,可分为单一型保护剂(如葡萄糖、果糖、乳糖、甘露糖、蔗糖、山梨糖醇、海藻糖、枸杞多糖等)和复合型保护剂(如蔗糖+麦芽糊精等)。由于海藻糖在失水部位以氢键和磷脂极性端相连,防止膜相变和复水时渗漏,可起到保护益生菌的作用;AGUDELO等[18]以乳清分离蛋白和麦芽糖糊精作为载体,对比研究了胶囊化的L.rhamnosus益生菌在有蔗糖或海藻糖保护剂及无保护剂的条件下的生存活性,研究认为,在蔗糖或海藻糖的保护作用下,益生菌的生存活性明显得到改善。复合型保护剂如蔗糖+麦芽糖糊精可将L.bulgaricus喷雾干燥后菌株存活率由0.01%提高到7.8%[19]。复合型保护剂成分一般为脱脂乳、阿拉伯胶、谷氨酸钠和淀粉等[20]。SALAR-BEHZADI等发现,以阿拉伯胶+明胶或果胶作为复合型保护剂时,可提高B.bifidum BB-12存活率[21]。因为阿拉伯胶+果胶可增强细胞膜中磷脂氢键稳定性,明胶可在干燥后形成热可逆凝胶膜,保护菌体免受高温脱水伤害;SANTIVARANGKNA等研究发现,菊粉+果糖可增强B.bifidum BB-12耐热性,并能抵御口服后胃液对益生菌定植的影响,但不宜过量,否则会因糖分过高造成干燥困难[22];ANANTA等[5]研究了脱脂奶粉对益生菌LGG(标准株53103)喷雾干燥的保护作用,研究认为,以复合保护剂低聚果糖+聚葡萄糖代替部分脱脂奶粉能提高益生菌存活率。张建峰等[23]研究了不同保护剂对益生菌酿酒活性干酵母活菌率的影响,研究发现,以20 g/L司班-60+20 g/LTween- 80作为保护剂时活菌率达77.89%,以50 g/L海藻糖+20 g/L司班-60+20 g/LTween-80作为生产用保护剂,活菌率可达(83.52±1.87)%。
将益生菌进行微胶囊化能提高益生菌的细胞稳定性和生产率[24]。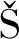 IPAILIENÉ[25]认为在微胶囊化过程中,益生菌存活率受微胶囊化方法、壁材、菌体类别、温湿度、水分活度、pH、氧气和压力等诸多因素的影响,微胶囊的表面结构对于益生菌的存活率也存在一定的影响。KAILASAPATHY等[24]认为,微胶囊化能提高菌体的存活率,但在微胶囊化时,需考虑食品基质对存活率的影响,此外,食品pH、食品基质的组织结构以及脂肪含量等对于增强菌体存活有重要影响。SHORI[26]将益生菌微胶囊化,可增强益生菌抗胃酸破坏能力,有利于益生菌在胃肠道的定植;SURONO等[27]研究认为,微胶囊化能提高益生菌L.plantarum IS-10506的存活率;黄乐天等[28]研究了微胶囊化的蜡样芽孢杆菌喷雾干燥工艺参数,在优化条件下,存活率高达81%;李宁等[29]以明胶为壁材,优化了双歧杆菌(B.bifidus BBM)喷雾干燥工艺参数,优化条件下微胶囊产率为65.7%,活菌存活率为53.5%,活菌数超过了1×1010CFU/g;谭文乐等[30]研究了醋酸菌喷雾干燥工艺,当进风温度为107.7 ℃、进样速度为11.09 mL/min、 壁材β-环糊精与阿拉伯胶之比为8.7∶1.3(质量比)、 壁材质量浓度为75.9 g/L时,醋酸菌存活率为23.1%, 醋酸菌的活菌数为3.8×109 CFU/g;罗佳琦等[31]采用喷雾干燥技术将嗜酸乳杆菌制成微胶囊,通过正交实验得到最佳的处理条件,在进风温度140 ℃,进料速度14.58 mL/min时,以配比为1∶10(质量比)的阿拉伯胶和麦芽环糊精为壁材,添加浓度为200 g/L条件下,嗜酸乳杆菌微胶囊活菌数达到了108 CFU/mL,存活率达到了63%;BUSTAMANTE等[32]考察了植物黏液、麦芽糊精与可溶性蛋白质作为微胶囊化壁材对B.infantis和L.plantarum 喷雾干燥后菌体生存活性的影响,研究认为,这2株益生菌在复合载体的保护作用下,保存期间生存率超过98%。
IPAILIENÉ[25]认为在微胶囊化过程中,益生菌存活率受微胶囊化方法、壁材、菌体类别、温湿度、水分活度、pH、氧气和压力等诸多因素的影响,微胶囊的表面结构对于益生菌的存活率也存在一定的影响。KAILASAPATHY等[24]认为,微胶囊化能提高菌体的存活率,但在微胶囊化时,需考虑食品基质对存活率的影响,此外,食品pH、食品基质的组织结构以及脂肪含量等对于增强菌体存活有重要影响。SHORI[26]将益生菌微胶囊化,可增强益生菌抗胃酸破坏能力,有利于益生菌在胃肠道的定植;SURONO等[27]研究认为,微胶囊化能提高益生菌L.plantarum IS-10506的存活率;黄乐天等[28]研究了微胶囊化的蜡样芽孢杆菌喷雾干燥工艺参数,在优化条件下,存活率高达81%;李宁等[29]以明胶为壁材,优化了双歧杆菌(B.bifidus BBM)喷雾干燥工艺参数,优化条件下微胶囊产率为65.7%,活菌存活率为53.5%,活菌数超过了1×1010CFU/g;谭文乐等[30]研究了醋酸菌喷雾干燥工艺,当进风温度为107.7 ℃、进样速度为11.09 mL/min、 壁材β-环糊精与阿拉伯胶之比为8.7∶1.3(质量比)、 壁材质量浓度为75.9 g/L时,醋酸菌存活率为23.1%, 醋酸菌的活菌数为3.8×109 CFU/g;罗佳琦等[31]采用喷雾干燥技术将嗜酸乳杆菌制成微胶囊,通过正交实验得到最佳的处理条件,在进风温度140 ℃,进料速度14.58 mL/min时,以配比为1∶10(质量比)的阿拉伯胶和麦芽环糊精为壁材,添加浓度为200 g/L条件下,嗜酸乳杆菌微胶囊活菌数达到了108 CFU/mL,存活率达到了63%;BUSTAMANTE等[32]考察了植物黏液、麦芽糊精与可溶性蛋白质作为微胶囊化壁材对B.infantis和L.plantarum 喷雾干燥后菌体生存活性的影响,研究认为,这2株益生菌在复合载体的保护作用下,保存期间生存率超过98%。
2.5.1 出口温度
喷雾干燥可分为恒定干燥和降速干燥2个连续的干燥阶段,第一阶段益生菌菌体含水量高,干燥过程对益生菌亚细胞结构损伤较少;第二阶段菌体含水量较低(外高内低),益生菌微粒表面形成“玻璃体”,干燥速度变得十分缓慢,若喷雾干燥的出口温度过高,将会对菌体产生热胁迫,造成亚细胞结构和生物大分子的损伤[33]。BOZA等研究了出口温度对Beijerinckia sp.菌体存活的影响,研究发现降低出口温度有利于减轻对菌体亚细胞结构的损伤,菌体存活率与出口温度呈负相关[34];郭云等[35]将发酵乳杆菌KLDS1.0709用脱脂牛奶作为基质制备得到菌悬液,并添加不同比例的蔗糖与海藻糖研究喷雾干燥出口温度对菌体存活的影响,结果表明,出口温度的升高降低了菌体存活率,以100 g/L脱脂乳+50 g/L海藻糖+50 g/L蔗糖为基质进行喷雾干燥,菌体存活率高达73.90%;PARASTIWI等[36]为优化喷雾干燥操作和提高干燥效率,研究了喷雾干燥出口温度的自动控制系统,以出口温度作为评价参数与反馈控制变量,通过改变热空气流速或进口温度等方式间接调节益生菌菌悬液的湿度,通过微控制器可较好地实现喷雾干燥出口温度的调节。
除了出口温度外,进料流速、气流速度、物料浓度和干燥时间等对出口温度有重要影响,但目前未发现有研究这些参数与出口温度变化关系的文献报告。对喷雾干燥过程参数进行优化可减少菌体亚细胞结构与生物大分子的损伤,提高益生菌菌体的存活率。值得注意的是,出口温度不能过低,否则干燥不彻底,影响菌体的保存与菌体形貌。
2.5.2 喷雾压力与离心盘转速
压力喷雾干燥法的喷雾压力和离心喷雾干燥法的离心转盘转速对喷雾干燥有重要影响。对于压力喷雾干燥来说,降低喷雾压力,益生菌的亚细胞结构与生物大分子损伤减少,能保持较高的存活率。RIVEROS等[37]研究了喷雾压力对L.acidophilu益生菌存活率的影响。研究发现,喷雾压力由100 kPa降低至50 kPa时,存活率可提高10%。主要原因是由于喷雾压力降低,作用于益生菌菌体的剪切作用力减弱,从而对亚细胞结构损伤明显降低;KIM等[38]和ZHOU等[39]也得到类似的研究结论。但需注意的是,喷雾压力不能过小,否则益生菌菌悬液无法实现良好的雾化,从而形成菌团,使干燥时间延长。对于离心喷雾干燥来说,雾化效果与离心盘转速有直接关系,离心盘转速快时,雾化效果较好。但值得注意的是,离心盘转速过快容易对益生菌菌体产生极大的剪切作用力,在热胁迫的协同作用下,对益生菌细胞壁和细胞膜等亚细胞结构及胞内生物大分子均可造成可逆或不可逆损伤,影响了菌体存活率。为平衡离心力与干燥效果的关系,常控制离心转盘转速在3 000~20 000 r/min较为理想。离心转盘转速也不宜过低,否则雾化效果较差,易形成菌团,干燥时间较长。
2.5.3 联合其他干燥工艺
当单独采用喷雾干燥无法达到质量要求时,可考虑与其他干燥工艺联用,这样可以适当降低喷雾干燥的出口温度,从而减少对益生菌菌体的热胁迫和热氧化损伤,提高菌体存活率。DONZ等[40]采用喷雾干燥与流化床联用进行菌体喷雾干燥(工艺过程如图1),结果表明,该工艺得到的菌体分散性较好。这种联用干燥工艺比单纯采用喷雾干燥效果要好,是目前应用较为广泛的益生菌干燥策略。
益生菌菌粉使用之前需复水才能恢复其生物活性,复水条件对益生菌菌体存活率有重要影响,复水温度是最为关键的参数,而复水介质对益生菌菌体影响较少[41]。WANG等研究了L.bulgaricus的复水条件,发现复水温度由4 ℃提升到50 ℃可明显提高菌体存活率和益生菌数量;TEIXEIRA等[42]也得到类似的结论,复水温度的提高,能提高S.thermophilus和B.longum活菌数。需注意的是,复水温度不宜太高,否则会造成菌体生物大分子变性,影响菌体活菌数。
菌体在低温条件下可降低其生理活性,有利于菌种的保存,贮藏温度对益生菌存活有重要影响[43]。MORGAN等[44]研究了抗氧化剂(VC和谷氨酸钠)在低温条件下对L.delbrueckii ssp. Bulgaricus抗氧化的影响,结果表明,低温条件下可减少细胞膜脂肪酸氧化和过氧化物产生,保护细胞内生物大分子,有利于菌体生物活性的保存[5];益生菌存活率与贮藏时间也有一定的关系。通常情况下,随着贮藏时间的延长,益生菌的存活率有不同程度的下降;益生菌包装方式对存活率也有影响,采取隔绝氧气保存(如充入惰性气体N2或真空保存)能提高益生菌的存活率,特别是真空保存效果更佳。
为提升喷雾干燥后益生菌菌体存活率,可从以下3个方面进行优化:提升益生菌菌体热耐受性,优化喷雾干燥参数和使用保护性载体进行保护。
由于种属的差异性或同种属益生菌的生理差异,在相同喷雾干燥条件下常表现不同的耐受性并表现不同的存活率。如乳杆菌L.rhamnosus在相同喷雾干燥条件下,菌株GG比E800表现更强的热耐受性[45];双歧杆菌属的婴儿双歧杆菌B.infantis和长型双歧杆菌B.longum在相同喷雾条件下也表现2倍差异的存活率[46];HUANG等[47]用300 g/L甜乳清培养L.casei 与P.freudenreichii并对耐受性相关成分进行分析,结果发现,甜乳清既可作为培养基质,还可起保护作用。在实验室规模和小试喷雾干燥过程中,菌体存活率可接近100%,对P.freudenreichii进行耐受性分析发现,喷雾干燥过程中应激蛋白呈现高水平表达,表现较好的热耐受性;DIJKSTRA等[48]研究了温度、pH、溶氧和盐浓度等对L.lactis胁迫的影响,发现不同菌体热胁迫和氧化胁迫有3个数量级区别。基因转录分析发现,溶氧改变可诱导Met和Cys代谢相关基因的高通量表达[48]。
对菌体进行亚致死剂量胁迫预处理可诱导菌体应激蛋白的表达。DESMOND等[49]将L.paracasei于52 ℃预处理15 min后并将菌体于60 ℃热处理,菌体存活率提高了300~700倍,喷雾干燥后菌体存活率提高了18倍;高渗透性预处理也可以提高菌体对胁迫的耐受性,并与热胁迫有交叉保护的作用。需注意的是,对菌体进行热胁迫或渗透压胁迫虽能提高菌体耐受性,但要注意热胁迫时的温度与渗透胁迫的渗透压,否则可能造成益生菌菌体不可逆损伤;已进行过热预处理的菌株是否还能继续进行热胁迫仍需深入研究,目前未见文献报道,对胁迫机理研究目前也鲜有报道。开展菌体耐受性机制研究有利于更深入地了解喷雾干燥对菌体的亚细胞结构及生物大分子的损伤,从而有利于优化喷雾工艺并获得高活性的益生菌菌体。
研究喷雾干燥对菌体亚细胞结构及生物大分子的影响,优化喷雾干燥参数是益生菌喷雾干燥的重要研究内容,也是正确设定喷雾干燥工艺参数的关键所在。喷嘴类型、进口温度、热空气流速、进料液流量、出口温度等对菌体存活率有重要影响。普遍认为,喷雾干燥出口温度过高对于保持菌体高存活率有负面影响[50];出口温度受进口温度、热空气流速、益生菌菌液的流速等综合影响[38]。在保证益生菌干粉回收率的前提下,降低喷雾干燥出口温度有利于提高菌体存活率;改变雾化液滴大小、空气进风分布、进料液流量等可降低出口温度[4]。若菌体颗粒较大或水分含量过高,无法通过喷雾干燥达到质量标准时,可与其他干燥技术联用,如先采用喷雾干燥形成颗粒,移除大部分水分,再通过流化床干燥移除残存水分。ADOLFO等[51]采用喷雾干燥与流化床干燥联用进行了益生菌菌粉制备研究,结果表明,多级干燥可达到近100%的菌体存活率。
在喷雾干燥过程中,加入特定的载体可以实现对益生菌的保护,其保护机制有[4]:
(1)提高益生菌亚细胞结构稳定性和改善菌体耐受性[52]。包埋在保护载体内的益生菌可减少胁迫对菌体的损伤。海藻糖就是常见的保护性载体。HERDEIRO等通过改变S.cerevisiae培养条件使细胞内积累海藻糖,能提高存活率,因为海藻糖可在热胁迫下保护酵母核糖体等亚细胞结构稳定性,还能减少氧化胁迫造成细胞膜脂质过氧化[53];金属阳离子(如Ca2+、Mg2+)能提高益生菌热胁迫耐受性。ZHENG等[54]研究了Ca2+在乳糖与海藻糖保护剂存在的情况下对益生菌的保护机制。乳糖+Ca2+能极大改善益生菌热耐受性。海藻糖+Ca2+得到相反结论,并认为单纯海藻糖能起到更好的保护作用;Mg2+也能起到良好的保护作用,因为Mg2+能较好地降低核糖体在喷雾干燥热胁迫中的损伤,对菌体内稳态维持有重要作用[12]。YANG[12]研究了Zn2+、Na+和Mg2+对益生菌L.rhamnosus GG,L.casei Zhang和L.plantarum P-8热耐受性的影响,研究发现,10~50mmol/L浓度的Mg2+能提高乳酸菌株的热耐受性,20 mmol/L的Mg2+能提高约100倍的L.rhamnosus GG存活率,且能缩短热诱导期。
(2)使用保护载体。目前,主要应用的保护载体为牛奶蛋白质,主要是由于牛奶蛋白质可在益生菌菌体表面形成保护膜,能“隔绝”外界不利因素对益生菌菌体的胁迫[48]。SONG等[55]在脱脂奶粉中加入Ca2+并采用热处理使牛奶蛋白质变性凝聚。结果发现,相对于未处理的脱脂奶粉,脱脂奶粉加入Ca2+并进行热凝聚可提高益生菌2个数量级的存活率;WANG等[56]也发现钙凝聚牛奶作为干燥载体也具有优秀的保护作用;KHEM等[57]发现分离乳清蛋白也可起到良好的保护作用,主要是由于蛋白质分子与细胞表面疏水键结合形成保护层,可以紧密包埋益生菌菌体[54]。此外,也发现其他材料也可作为喷雾干燥的保护性载体,如酪蛋白酸钠、甘油、明胶、氨基酸等也可作为菌体活性保护剂,但其抗热保护效果目前研究较少。目前,几乎所有微生物细胞干燥都添加了保护载体。保护剂可改变微生物干燥时的物理、化学环境,减轻或防止干燥或复水对细胞的损害,尽可能保持微生物原有的各种生理生化特性和生物活性。保护剂不仅影响益生菌存活率,还影响益生菌储存期间的生产稳定性。为提高益生菌的保护效果,常使用复合型保护载体。范娜等[58]选取海藻糖、明胶和甘油作为保护剂,研究其对嗜酸乳杆菌和双歧杆菌混合菌体的抗热保护效果。结果表明,3种保护剂之间存在交互作用,复合使用时的抗热保护效果比单独使用时好,最佳复合配方为海藻糖160 g/L、甘油60 g/L、明胶1.4 g/L, 菌体存活率可达16.58%,活菌数为1.66×108 CFU/mL。
[1] FLOCH M H. The role of prebiotics and probiotics in gastrointestinal disease[J]. Gastroenterol Clin North Am, 2018, 47(1): 179-191.
[2] PAMER E G. Resurrecting the intestinal microbiota to combat antibiotic-resistant pathogens[J]. Science, 2016, 352(6 285): 535-538.
[3] GILBERT J A, KRAJMALNIKBROWN R, PORAZINSKA D L,et al. Toward effective probiotics for autism and other neuro- developmental disorders[J]. Cell, 2013, 155(7): 1 446-1 448.
[4] 傅楠, 陈晓东. 益生菌在喷雾干燥过程中的活性变化与保护策略[J].化工进展, 2018, 37(5): 1 633-1 645.
[5] ANANTA E,VOLKERT M,KNORR D.Cellular injuries and storage stability of spray-driedLactobacillus rhamnosus GG[J]. International Dairy Journal, 2005, 15(4): 399-409.
[6] DESMOND C,ROSS R P,O′CALLAGHAN E O,et al. Improved survival ofLactobacillus paracasei NFBC 338 in spray-dried powders containing gum acacia[J]. Journal of applied microbiology, 2010, 93(6): 1 003-1 011.
[7] 陆英,陈卫,田丰伟,等. 利用热激处理提高益生菌Lactobacillus casei BD-Ⅱ抗热性的研究[J]. 中国乳品工业, 2006, 34(7): 17-19.
[8] TEIXEIRA P, CASTRO H, KIRBY R. Inducible thermotolerance inLactobacillus bulgaricus[J]. Letters in applied microbiology, 2010, 18(4): 218-221.
[9] TRIPATHI M K, GIRI S K. Probiotic functional foods: Survival of probiotics during processing and storage[J]. Journal of Functional Foods, 2014, 9(9): 225-241.
[10] GOLOWCZYC M A, SILVA J, ABRAHAM A G,et al. Preservation of probiotic strains isolated from kefir by spray drying[J]. Letters in applied microbiology, 2010, 50(1): 7-12.
[11] CORCORAN B M, ROSS R P, FITZGERALD G F,et al. Comparative survival of probiotic lactobacilli spray-dried in the presence of prebiotic substances[J]. Journal of applied microbiology, 2010, 96(5): 1024-1 039.
[12] YANG YI, HUANG SONG, WANG JUAN,et al. Mg2+ improves the thermotolerance of probioticLactobacillus rhamnosus GG,Lactobacillus casei Zhang andLactobacillus plantarum P-8[J]. Letters in applied microbiology, 2017, 64(4): 283-288.
[13] CARVALHO A S, SILVA J, HO P, et al. Effect of various growth media upon survival during storage of freeze-driedEnterococcus faecalis andEnterococcus durans[J]. Journal of Applied Microbiology, 2010, 94(6): 947-952.
[14] SILVA J, CARVALHO A S, PEREIRA H, et al. Induction of stress tolerance inLactobacillus delbrueckii ssp. bulgaricus by the addition of sucrose to the growth medium[J]. Journal of Dairy Research, 2004, 71(1): 121-125.
[15] MOZZI F, ROLL N G,DE GIORI G S,et al. Effect of galactose and glucose on the exopolysaccharide production and the activities of biosynthetic enzymes inLactobacillus casei CRL 87[J]. Journal of applied microbiology, 2010, 91(1): 160-167.
[16] KETS E, TEUNISSEN P, DE BONT J. Effect of compatible solutes on survival of lactic acid bacteria subjected to drying[J]. Appl Environ Microbiol, 1996, 62(1): 259-261.
[17] CORREA DEZA M A,GRILLO-PUERTAS M,SALVA S,et al. Inorganic salts and intracellular polyphosphate inclusions play a role in the thermotolerance of the immunobioticLactobacillus rhamnosus CRL 1505[J]. Plos One, 2017, 12(6): e0179242.
[18] AGUDELO J, CANO A,GONZ LEZ-MART
LEZ-MART NEZ C,et al. Disaccharide incorporation to improve survival during storage of spray driedLactobacillus rhamnosus in whey protein-maltodextrin carriers[J]. Journal of Functional Foods, 2017(37): 416-423.
NEZ C,et al. Disaccharide incorporation to improve survival during storage of spray driedLactobacillus rhamnosus in whey protein-maltodextrin carriers[J]. Journal of Functional Foods, 2017(37): 416-423.
[19] LESLIE S B, ISRAELI E, LIGHTHART B,et al. Trehalose and sucrose protect both membranes and proteins in intact bacteria during drying[J]. Applied and environmental microbiology, 1995, 61(10): 3 592-3 597.
[20] BROECKX G,VANDENHEUVEL D, CLAES I J J,et al. Drying techniques of probiotic bacteria as an important step towards the development of novel pharmabiotics[J]. International journal of pharmaceutics, 2016, 505(1-2): 303-318.
[21] SALAR-BEHZADI S, WU SHENGQIAN, TOEGEL S,et al. Impact of heat treatment and spray drying on cellular properties and culturability ofBifidobacterium bifidum BB-12[J]. Food Research International,2013, 54(1): 93-101.
[22] SANTIVARANGKNA C, KULOZIK U, FOERST P. Alternative drying processes for the industrial preservation of lactic acid starter cultures[J]. Biotechnology Progress, 2010, 23(2): 302-315.
[23] 张建峰,耿宏伟,王丕武.酿酒活性干酵母生产工艺优化及干燥剂的选择[J]. 食品科学,2011,32(9): 213-216.
[24] KAILASAPATHY K. Protecting probiotics by microencapsulation[J]. Materials Transactions, 2018, 37(4): 738-742.
![]()
 A, PETRAITYT
A, PETRAITYT S. Encapsulation of probiotics: Proper selection of the probiotic strain and the influence of encapsulation technology and materials on the viability of encapsulated micro- organisms[J]. Probiotics Antimicrob Proteins, 2018, 10(1): 1-10.
S. Encapsulation of probiotics: Proper selection of the probiotic strain and the influence of encapsulation technology and materials on the viability of encapsulated micro- organisms[J]. Probiotics Antimicrob Proteins, 2018, 10(1): 1-10.
[26] SHORI A B. Microencapsulation improved probiotics survival during gastric transit[J]. Hayati Journal of Biosciences, 2017,24(1):1-5.
[27] SURONO I,VERHOEVEN J, VERBRUGGEN S, et al.Microencapsulation increases survival of the probioticLactobacillus plantarum IS-10506, but notEnterococcus faecium IS-27526 in a dynamic, computer controll- ed in vitro model of the upper gastrointestinal tract[J]. Journal of applied microbiology, 2018, 124(6): 1 604-1 609.
[28] 黄乐天,曹丁,黄魁英,等.微囊化蜡样芽孢杆菌的喷雾干燥工艺优化[J].安徽农业科学,2014(20):6 546- 6 548.
[29] 李宁,田洪涛,吴蕊,等. 双歧杆菌微胶囊喷雾干燥工艺的影响因素研究[J].食品与发酵工业,2007,33(8): 89-91.
[30] 谭文乐,肖更生,吴继军,等. 醋酸菌喷雾干燥工艺的研究[J].现代食品科技, 2010, 26(3): 272-276.
[31] 罗佳琦, 于晓晨, 于才渊. 嗜酸乳杆菌喷雾干燥技术的研究[J]. 干燥技术与设备, 2008(6): 273-278.
[32] BUSTAMANTE M, OOMAH B D, RUBILAR, MóNICA,et al. EffectiveLactobacillus plantarum andBifidobacterium infantis encapsulation with chia seed (Salvia hispanica L.) and flaxseed (Linum usitatissimum L.) mucilage and soluble protein by spray drying[J]. Food Chemistry, 2017, 216:97-105.
[33] EMILIE L, STÉPHANE G, CAROLINE P,et al. Cellular injuries inCronobacter sakazakii CIP 103183T andSalmonella enterica exposed to drying and subsequent heat treatment in milk powder[J]. Frontiers in Microbiology, 2018, 9:475
[34] BOZA Y, BARBIN D,SCAMPARINI A R P. Effect of spray-drying on the quality of encapsulated cells of Beijerinckia sp[J]. Process Biochemistry, 2004, 39(10): 1 275-1 284.
[35] 郭云,孟祥晨.喷雾干燥对发酵乳杆菌KLDS1.0709存活影响的研究[J].食品工业科技,2011,32(2):109- 111.
[36] PARASTIWI ANDRIANI,EKOJONO.Design of spray dryer process control by maintaining outlet air temperature of spray dryer chamber[C]∥2016 International Seminar on Intelligent Technology and Its Applications [ISITIA]. IEEE, 2016: 619- 622
[37] RIVEROS B, FERRER J, B RQUEZ R. Spray drying of a vaginal probiotic strain ofLactobacillus acidophilus[J]. Drying Technology, 2009, 27(1): 123-132.
[38] KIM D H, LEE S B, PARK H D. Effect of air-blast drying and the presence of protectants on the viability of yeast entrapped in calcium alginate beads with an aim to improve the survival rate[J]. Applied Microbiology & Biotechnology, 2017, 101(1): 93-102.
[39] ZHOU X, DONG J, GAO J,et al. Activity-loss characteristics of spores ofBacillus thuringiensis during spray drying[J]. Food & Bioproducts Processing, 2008, 86(1): 37-42.
[40] DONZ E,BOIRON P,COURTHAUDON J L. Characterization of industrial dried whey emulsions at different stages of spray-drying[J]. Journal of Food Engineering, 2014, 126(1): 190-197.
[41] MENG X C, STANTON C,FITZGERALD G F,et al. Anhydrobiotics: The challenges of drying probiotic cultures[J]. Food Chemistry, 2008, 106(4): 1 406-1 416.
[42] TEIXEIRA P, CASTRO H, KIRBY R. Spray drying as a method for preparing concentrated cultures ofLactobacillus bulgaricus[J]. Journal of applied microbiology, 2010, 78(4): 456-462.
[43] ABE F, MIYAUCHI H, UCHIJIMA A,et al. Effects of storage temperature and water activity on the survival of bifidobacteria in powder form[J]. International Journal of Dairy Technology, 2010, 62(2): 234-239.
[44] MORGAN C A, HERMAN N, WHITE P A, et al. Preservation of micro-organisms by drying: A review[J]. J Microbiol Methods, 2006, 66(2): 183-193.
[45] SUNNY-ROBERTS E O, KNORR D. Protective effect of monosodium glutamate on survival ofLactobacillus rhamnosus GG andLactobacillus rhamnosus E-97800 (E800) strains during spray-drying and storage in trehalose-containing powders[J]. International Dairy Journal, 2009, 19(4): 209-214.
[46] LIAN W C, HSIAO H C, CHOU C C. Survival of bifidobacteria after spray-drying[J]. International journal of food microbiology, 2002, 74(1-2): 79-86.
[47] HUANG SONG,CAUTY C, DOLIVET A,et al. Double use of highly concentrated sweet whey to improve the biomass production and viability of spray-dried probiotic bacteria[J]. Journal of Functional Foods, 2016, 23: 453-463.
[48] DIJKSTRA A R, ALKEMA W, STARRENBURG M J,et al. Fermentation-induced variation in heat and oxidative stress phenotypes ofLactococcus lactis MG1363 reveals transcriptome signatures for robustness[J]. Microbial Cell Factories, 2014, 13(1): 1-11.
[49] DESMOND C, STANTON C, FITZGERALD G F, et al. Environmental adaptation of probiotic lactobacilli towards improvement of performance during spray drying[J]. International Dairy Journal, 2002, 12(2-3): 183-190.
[50] GARDINER G E,O'SULLIVAN E, KELLY J,et al.Comparative survival rates of human-derived probioticLactobacillus paracasei andL.salivarius strains during heat treatment and spray drying[J]. Applied and environmental microbiology, 2000, 66(6): 2 605-2 612.
[51] BUCIO A, HARTEMINK R, SCHRAMA J W,et al. Survival ofLactobacillus plantarum 44a after spraying and drying in feed and during exposure to gastrointestinal tract fluidsin vitro[J]. Journal of General and Applied Microbiology, 2005, 51(4): 221-227.
[52] REYES V, CHOTIKO A, CHOULJENKO A,etal. Influence of wall material on production of spray driedLactobacillus plantarum NRRL B-4496 and its viability at different storage conditions[J]. Drying Technology, 2018,36 (14): 1 738-1 748.
[53] HERDEIRO R S, PEREIRA M D, PANEK A D,et al. Trehalose protectsSaccharomyces cerevisiae from lipid peroxidation during oxidative stress[J]. BBA-General Subjects, 2006, 1 760(3): 340-346.
[54] ZHENG Xufeng, FU Nan, DUAN Manlei,et al. The mechanisms of the protective effects of reconstituted skim milk during convective droplet drying of lactic acid bacteria[J]. Food Research International, 2015,76(Pt 3): 478-488.
[55] SONG Huang, YI Yang, NAN Fu,et al. Calcium-aggregated milk: A potential new option for improving the viability of lactic acid bacteria under heat stress[J]. Food & Bioprocess Technology, 2014, 7(11): 3 147-3 155.
[56] WANG J, HUANG S, FU N,et al. Thermal aggregation of calcium-fortified skim milk enhances probiotic protection during convective droplet drying[J]. Journal of Agricultural & Food Chemistry,2016,64(30): 6 003.
[57] KHEM S,SMALL D M,MAY B K.The behaviour of whey protein isolate in protectingLactobacillus plantarum [J]. Food chemistry, 2016(190): 717-723.
[58] 范娜, 陈雪峰. 益生菌抗热保护剂的研究[J]. 食品研究与开发, 2011, 32(4): 94-98.