
麦芽四糖淀粉酶具有外切酶活性,属于GH13家族的淀粉水解酶类,从淀粉的非还原末端,特异的依次切割第4个α-1,4糖苷键,生成以麦芽四糖为主的麦芽低聚糖。麦芽四糖是由4个α-D型葡萄糖基以α-1,4糖苷键连接成的直链麦芽低聚糖,是一种功能性食品,其甜度低、黏度高、保湿性好,具有易消化吸收、低渗透压等特点和抑制肠内腐败菌、保持肠道健康、促进人体对Ca2+吸收等功能,主要应用于食品与医疗领域。
1971年,ROBYT和ACKERMAN首次报道了Pseudomonas stutzeri NRRL B-3389来源的麦芽四糖淀粉酶[1],此后相继在Pseudomonas saccharophila IAM1504[7]、Pseudomonas stutzeri MO-19[2]、Pseudomonas sp.IMD 353[5]、Pseudomonas stutzeri AS22[6]等菌株中发现麦芽四糖淀粉酶。1989年,FUJITA等在大肠杆菌中克隆表达Pseudomonas stutzeri MO-19来源的麦芽四糖淀粉酶[4]。MAALEJ等用Pseudomonasstutzeri AS22发酵产酶可达6.9 U/mL[6]。FOGARTY等用Pseudomonas sp.IMD 353发酵产酶可达13 U/mL,是目前报道的最高水平[5]。2014年,韦云萍等在枯草芽孢杆菌1A747中克隆表达了Pseudomonas saccharophila IAM1504来源的麦芽四糖淀粉酶,并证明其水解淀粉生成的产物以麦芽四糖为主[22]。
2011年,LEE等使用Bacillus licheniformis来源的麦芽四糖淀粉酶能够从液化淀粉中产生>45%的麦芽四糖[13]。2013年,杰能科公司钱莹等对Pseudomonas saccharophila来源的改造后的新型麦芽四糖淀粉酶的反应pH、温度、底物浓度及与普鲁兰酶的协同作用进行探究,最终生成麦芽四糖的转化率最高可达54%,是目前报道的最高水平[24]。
Pseudomonas saccharophila来源的麦芽四糖淀粉酶水解淀粉生成的产物以麦芽四糖为主。本研究采用前期构建的Pseudomonas saccharophila来源的麦芽四糖淀粉酶重组枯草芽孢杆菌,通过对培养基中氮源和碳源优化,降低发酵成本。并利用重组麦芽四糖淀粉酶制备麦芽四糖,对制备条件进行加酶量、温度、pH、底物浓度和反应时间的优化,提高麦芽四糖转化率。
Bacillus subtilis WS11(含有本实验室改造的高效表达载体pHY300PLK-g4)。
SHA-1102C空气恒温摇床,上海精密仪器仪表有限公司;Agilent 1200高效液相色谱,美国Agilent公司;FE28-Standard pH计,瑞士Mettler-Toledo公司;UV-1700紫外可见分光光度计,日本Shimadzu公司;HZ-9212SB恒温水浴摇床,太仓市华利达实验设备有限公司。
LB培养基(g/L):酵母粉5,蛋白胨10,NaCl 10。
TB培养基(g/L):酵母粉24,蛋白胨12,甘油5,K2HPO4 12.54,KH2PO4 2.31。
1.2.1 摇瓶发酵生产麦芽四糖淀粉酶
种子培养:从-80 ℃保藏的甘油管中接25 μL的菌液至10 mL的LB培养基,37 ℃、200 r/min,培养8~10 h。
摇瓶发酵:将种子液以5%的接种量接入TB培养基(无甘氨酸),37 ℃、200 r/min,培养至OD600约为1.5(约2 h),降温至33 ℃进行重组蛋白的诱导表达,培养48 h。转速为8 000 r/min,离心15 min收集上清,即为麦芽四糖淀粉酶粗酶液。
1.2.2 重组麦芽四糖淀粉酶酶活的测定
测定体系为15 mL,以1 mL的10 g/L的可溶性淀粉为底物,加入0.9 mL的缓冲液(50 mmol/L 的Na2HPO4-柠檬酸,pH 7.0),空白对照加入1.0 mL的缓冲液,在55 ℃水浴保温10 min,加入0.1 mL的酶液,反应10 min,加入3 mL DNS溶液,沸水浴7 min,冰水冷却,定容至15 mL,在OD540下测吸光度值。酶活定义:每分钟生成1 μmol麦芽四糖所需要的酶量定义为1个酶活单位(U)。
1.2.3 麦芽四糖淀粉酶的摇瓶优化
氮源种类及浓度优化:按照上述摇瓶发酵的方法用豆粕粉、玉米浆、工业蛋白胨、大豆蛋白胨、牛蛋白胨、鱼蛋白胨替换TB培养基中的氮源酵母粉和蛋白胨,终质量浓度均为35 g/L,探究单一氮源对发酵的影响,并在此基础上考察组合氮源及不同浓度配比对重组菌的生长及发酵产酶的影响。
碳源种类及浓度优化:在上述基础上用甘油、葡萄糖、麦芽糖、蔗糖、玉米糊精和可溶性淀粉替换TB培养基中的碳源甘油,终质量浓度均为5 g/L,探究最优碳源并在此基础上考察不同浓度的碳源对重组菌的生长及发酵产酶的影响,设置碳源质量浓度为1~25 g/L。
1.2.4 制备麦芽四糖的反应条件优化
pH值对酶反应的影响:以150 g/L麦芽糊精(DE 5~7)为底物,分别用pH 6.0、7.0、8.0、 9.0的50 mmol/L的Na2HPO4-柠檬酸缓冲液溶解底物,加酶量30 U/g底物,置于转速为150 r/min、温度为50 ℃的水浴摇床中,转化12 h,用高效液相色谱(high performance liquid chromatography,HPLC)检测麦芽四糖生成量。
温度对酶反应的影响:以150 g/L麦芽糊精(DE 5~7)为底物,用50 mmol/L的Na2HPO4-柠檬酸缓冲液(pH为7.0)溶解底物,加酶量30 U/g底物,置于转速为150 r/min、温度分别为40、45、50、55、60 ℃的水浴摇床中,转化12 h,用HPLC检测麦芽四糖生成量。
加酶量对酶反应的影响:以150 g/L麦芽糊精(DE 5~7)为底物,用50 mmol/L的Na2HPO4-柠檬酸缓冲液(pH为7.0)溶解底物,加酶量分别为10、20、30、40、50 U/g,置于转速为150 r/min、温度为50 ℃的水浴摇床中,转化12 h,用HPLC检测麦芽四糖生成量。
底物浓度对酶反应的影响:分别以质量浓度为150、 200、 250、 300 g/L麦芽糊精(DE 5~7)为底物,用50 mmol/L的Na2HPO4-柠檬酸缓冲液(pH 7.0)溶解底物,加酶量30 U/g底物,置于转速为150 r/min、温度为50 ℃的水浴摇床中,转化12 h,用HPLC检测麦芽四糖生成量。
反应时间对酶反应的影响:以250 g/L麦芽糊精(DE 5~7)为底物,用50 mmol/L的Na2HPO4-柠檬酸缓冲液(pH 7.0)溶解底物,加酶量30 U/g底物,置于转速为150 r/min、温度为50 ℃的水浴摇床中,转化2、4、8、12、18 h,用HPLC检测麦芽四糖生成量。
1.2.5 HPLC检测含量
酶反应后的样品经过加热20 min灭酶后,12 000 r/min 离心10 min,取上清用去离子水适当稀释,再用乙腈共沉淀,放置2 h后,12 000 r/min离心10 min,取上清过膜备用。HPLC检测条件是:Agilent 1 200 HPLC色谱仪,Agilent自动进样器,色谱柱4.6 mm×250 mm×5 μm Syncronis Amino Column;Aginent示差检测器;流动相为V(乙腈):V(水)=70∶ 30,超声脱气20 min,流速为0.8 mL/min;柱温35 ℃。
枯草芽孢杆菌的发酵常用TB培养基,但在工业化大规模生产中要求培养基成分廉价且利于菌株生长和产酶。使用TB培养基发酵产麦芽四糖淀粉酶的成本较高,对此分别优化氮源种类及浓度、碳源种类及浓度。
2.1.1 重组菌TB培养基发酵
将重组菌株进行摇瓶发酵,测定粗酶液的酶活,麦芽四糖淀粉酶胞外酶的酶活为147 U/mL,破壁上清的酶活为0.6 U/mL,这表明99%的酶都分泌到了胞外,即重组菌成功表达麦芽四糖淀粉酶。
2.1.2 氮源种类及浓度优化
菌体生长及产酶需要消耗氮源来合成自身所需的营养物质,不同种类氮源的含氮量不同,选择合适的氮源对发酵过程十分重要。酵母类氮源,例如:酵母粉、酵母浸膏等价格普遍昂贵,不适合应用于工业化的生产当中,为了降低成本,本研究不选取此类氮源。选取价格较廉价的豆粕粉、玉米浆、工业蛋白胨、大豆蛋白胨、牛蛋白胨、鱼蛋白胨,探究最优的单一氮源。
由图1可以看出只有工业蛋白胨的产酶效果略好于TB培养基,酶活力可达174 U/mL。玉米浆和豆粕粉对菌体的生长有利,两者对应的OD600值分别为8.8和8.3。综合考虑,选取工业蛋白胨、玉米浆、豆粕粉作为单一氮源,进一步探究氮源浓度对发酵的影响。

图1 氮源种类对重组菌生长和发酵产酶的影响
Fig.1 Effects of the different nitrogen sources on cell growth and recombinant G4-amylase activity
分别在培养基中添加15、25、35 g/L的上述氮源替代TB中的氮源,从表1中可以看出工业蛋白胨浓度为25和35 g/L时,酶活力基本一致,从降低成本的角度出发可选取25 g/L。
表1 氮源浓度对重组菌生长和发酵产酶的影响
Table 1 Effects of the concentration of nitrogen sources on cell growth and recombinant G4-amylaseactivity
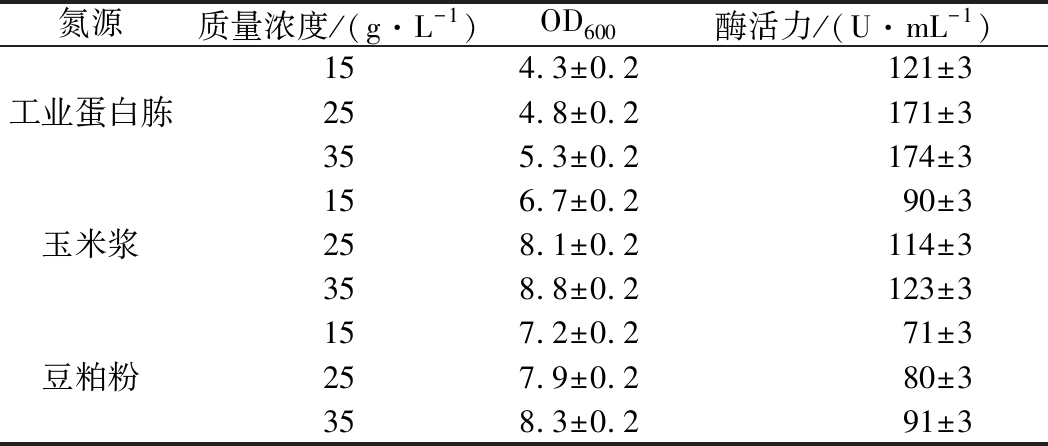
氮源质量浓度/(g·L-1)OD600酶活力/(U·mL-1)154.3±0.2121±3工业蛋白胨254.8±0.2171±3355.3±0.2174±3156.7±0.290±3玉米浆258.1±0.2114±3358.8±0.2123±3157.2±0.271±3豆粕粉257.9±0.280±3358.3±0.291±3
随着玉米浆和豆粕粉质量浓度的增加,酶活逐渐升高,当玉米浆质量浓度为35 g/L时,酶活力可达123 U/mL,当豆粕粉质量浓度为35 g/L时,酶活力可达91 U/mL。工业蛋白胨的价格高于玉米浆,豆粕粉价格最低,可以用工业蛋白胨分别与玉米浆和豆粕粉复配,进一步探究组合氮源对发酵的影响。
以上述结果为基础,初步考察复合氮源的不同比例,设定工业蛋白胨的质量浓度5 g/L为固定值,分别与5、15、25、35和45 g/L的玉米浆和豆粕粉复配。从图2中可以看出,当玉米浆质量浓度为45 g/L时,酶活力为131 U/mL,低于豆粕粉质量浓度为15 g/L时的酶活力(143 U/mL),并且玉米浆价格高于豆粕粉。综合考虑,选取豆粕粉与工业蛋白胨组合进一步考察不同配比的影响。利用正交表做2因素3水平实验,从表2中可以看出,当工业蛋白胨质量浓度为25 g/L和豆粕粉质量浓度为25 g/L时,酶活力可高达225 U/mL。

a-豆粕粉;b-玉米浆
图2 氮源组合对重组菌生长和发酵产酶的影响
Fig.2 Effects of complex nitrogen sources on cell growth and recombinant G4-amylase activity
表2 氮源组合对重组菌生长和发酵产酶的影响
Table 2 Effects of complex nitrogen sources on cell growth and recombinant G4-amylase activity

氮源及质量浓度/(g·L-1)OD600酶活力/(U·mL-1)TB5.8±0.2152±3工业蛋白胨5+豆粕粉56.7±0.2115±3工业蛋白胨5+豆粕粉158.1±0.2138±3工业蛋白胨5+豆粕粉258.9±0.2158±3工业蛋白胨15+豆粕粉56.5±0.2166±3工业蛋白胨15+豆粕粉158.3±0.2181±3工业蛋白胨15+豆粕粉259.1±0.2192±3工业蛋白胨25+豆粕粉57.1±0.2191±3工业蛋白胨25+豆粕粉158.7±0.2219±3工业蛋白胨25+豆粕粉259.6±0.2225±3
2.1.3 碳源种类及浓度优化
碳源不仅可以提供菌体生长所需的细胞结构物质,更重要的是提供合成次级代谢产物所需要的碳及能量。培养基中碳源的浓度过低会导致菌体衰老和自溶,过高会抑制菌体生长及产酶。合适的碳源有利于菌体的快速吸收和利用,选取常见的碳源甘油、葡萄糖、麦芽糖、蔗糖、玉米糊精、可溶性淀粉探究最优的单一碳源。
从图3中可以看出以麦芽糖为单一碳源时,酶活力最高可达211 U/mL,以玉米糊精或甘油为单一碳源时,酶活均为209 U/mL,考虑到工业化生产过程中的成本问题,甘油较其他2种碳源更廉价,综合考虑,选取甘油作为单一碳源,进一步探究碳源浓度对发酵的影响。

图3 碳源种类对重组菌生长和发酵产酶的影响
Fig.3 Effects of the different carbon sources on cell growth and recombinant G4-amylase activity
分别在培养基中添加0、1、5、10、15、20、25 g/L甘油替代TB中的碳源,从图4中可以看出当甘油浓度为5 g/L时,酶活力最高可达236 U/mL,此时OD600值为12.5。

图4 碳源浓度对重组菌生长和发酵产酶的影响
Fig.4 Effects of the concentration of carbon sources on cell growth and recombinant G4-amylase activity
此后,随着碳源浓度的增加,酶活呈下降趋势,这是因为高浓度的碳源引起分解代谢物阻遏效应,使胞内的cAMP水平下降,不足以使分解物激活蛋白CAP的构象发生变化成为激活状态,无法结合到启动子上游,从而导致RNA聚合酶不能与启动基因结合,抑制对营养物质的利用,不利于菌体生长和产酶。
2.2.1 反应初始pH优化
如图5所示,酶催化生成的麦芽四糖随着pH值的增加变化较明显,当pH 7.0时,麦芽四糖的得率达到最大68.9%。过高的pH值会使麦芽四糖的得率下降,这是因为pH会改变酶活性中心的基团的解离状态,从而影响酶与底物分子的结合效率,这一趋势与酶学性质相匹配。所以,麦芽四糖淀粉酶转化麦芽糊精过程中的最适pH值为7.0。

图5 初始pH对麦芽四糖酶反应的影响
Fig.5 Effect of initial pH on the enzymatic conversion
2.2.2 反应温度优化
在上述优化的基础上对反应温度进行优化,如图6所示,温度对麦芽四糖的得率影响较大,当温度为50 ℃时,麦芽四糖的得率达到最大69.6%。此后继续提高温度,麦芽四糖的得率开始下降。从前期对麦芽四糖淀粉酶酶学性质的研究可知,当温度高于55 ℃ 时,该酶的热稳定性逐渐变差。由于高温使酶的稳定性变差,因而半衰期缩短,催化效率降低,从而麦芽四糖的得率下降。所以,麦芽四糖淀粉酶转化麦芽糊精过程中的最适温度为50 ℃。
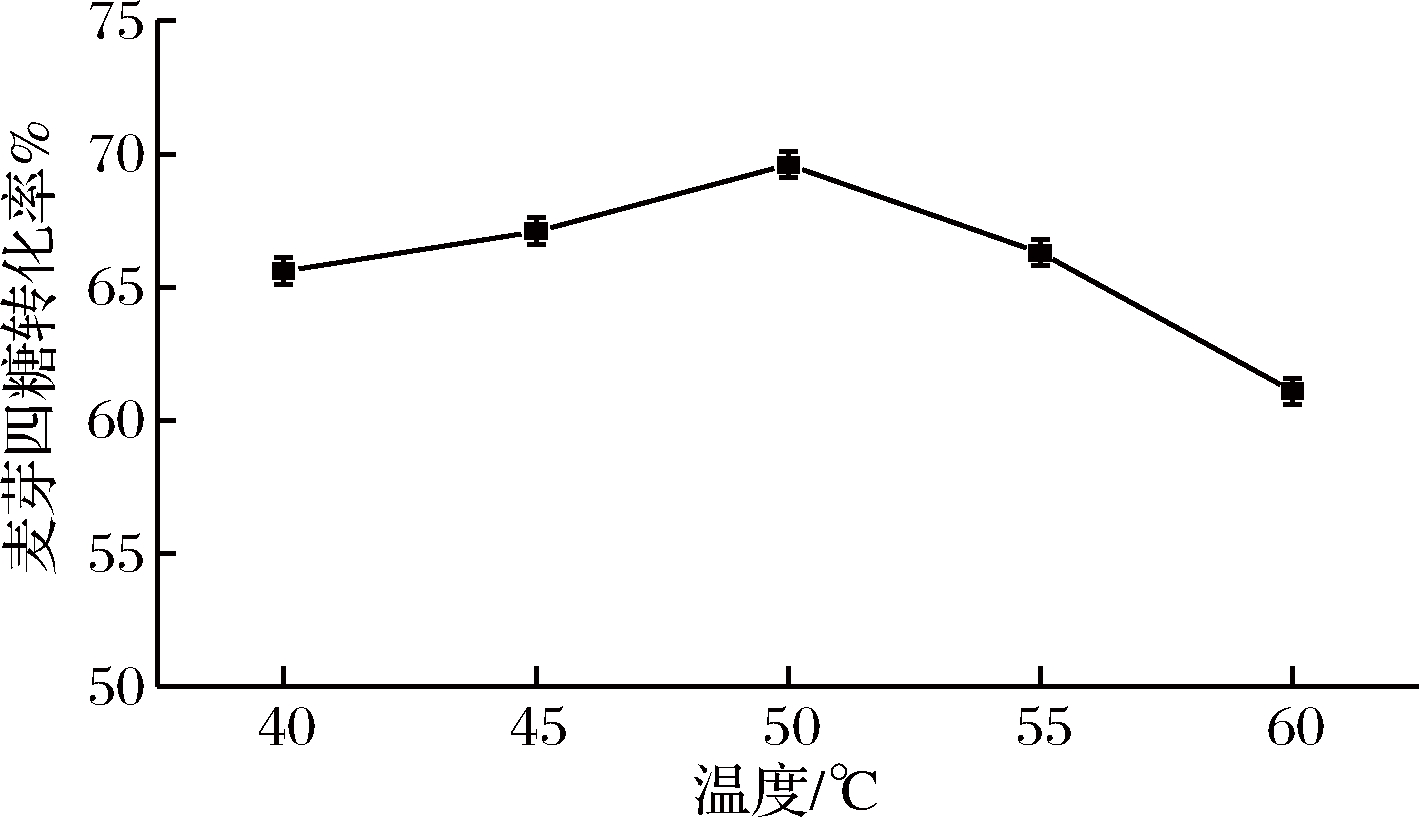
图6 温度对麦芽四糖酶反应的影响
Fig.6 Effect of temperature on the enzymatic conversion
2.2.3 加酶量优化
在上述优化的基础上对反应所需加酶量进行优化,如图7所示,麦芽四糖的产量随着加酶量的增加而升高,当加酶量为30 U/g时,麦芽四糖的得率达到最大69.7%。此后继续提高加酶量,麦芽四糖的得率略有下降。这是因为,加酶量的增加使底物有更多的机会与酶分子结合从而提高得率,当加酶量达到一定值后,酶与底物的结合达到饱和状态,再提高加酶量也不会有多余的底物与酶分子结合,反而会使酶团聚在一起从而降低得率。所以,麦芽四糖淀粉酶转化麦芽糊精过程中的最适加酶量为30 U/g。
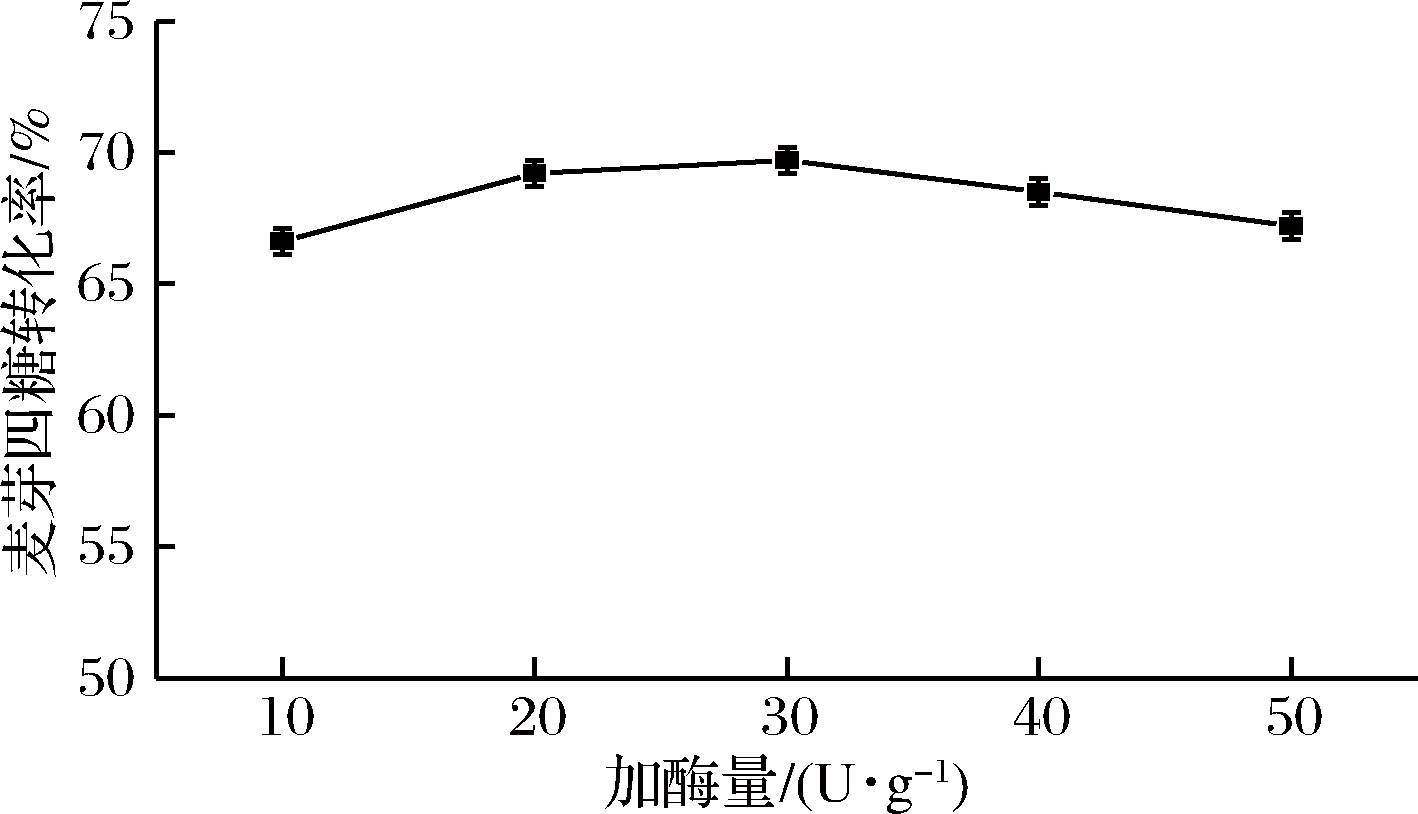
图7 加酶量对麦芽四糖酶反应的影响
Fig.7 Effect of enzyme dosage on the enzymatic conversion
2.2.4 底物浓度优化
在上述优化的基础上对反应的底物浓度进行优化,高底物浓度有利于大规模工业化生产,如图8所示,当底物质量浓度为250 g/L时,麦芽四糖的得率达到最大73%。浓度过高时,麦芽四糖的得率下降明显。这可能是因为底物浓度增加到最大后,所有的酶分子都与底物结合,处于饱和状态,再提高底物浓度反而会使糊精分子相互聚集,减少底物与酶分子的接触从而降低得率。同时,底物浓度过高也会使底物抑制作用明显。所以,麦芽四糖淀粉酶转化麦芽糊精过程中的最适底物质量浓度为250 g/L。

图8 底物浓度对麦芽四糖酶反应的影响
Fig.8 Effect of substrates concentration on the enzymatic conversion
2.2.5 反应时间优化
在上述优化的基础上对反应的时间进行优化,如图9所示,在酶反应12 h时麦芽四糖的得率达到最大值73%,12 h后得率开始下降。酶反应过程中,起始的2 h内酶催化反应速率是整个反应过程中的最大值。在2 h到12 h内,催化反应速率逐渐减小。因此,麦芽四糖淀粉酶转化麦芽糊精合成麦芽四糖的最适反应时间为12 h。
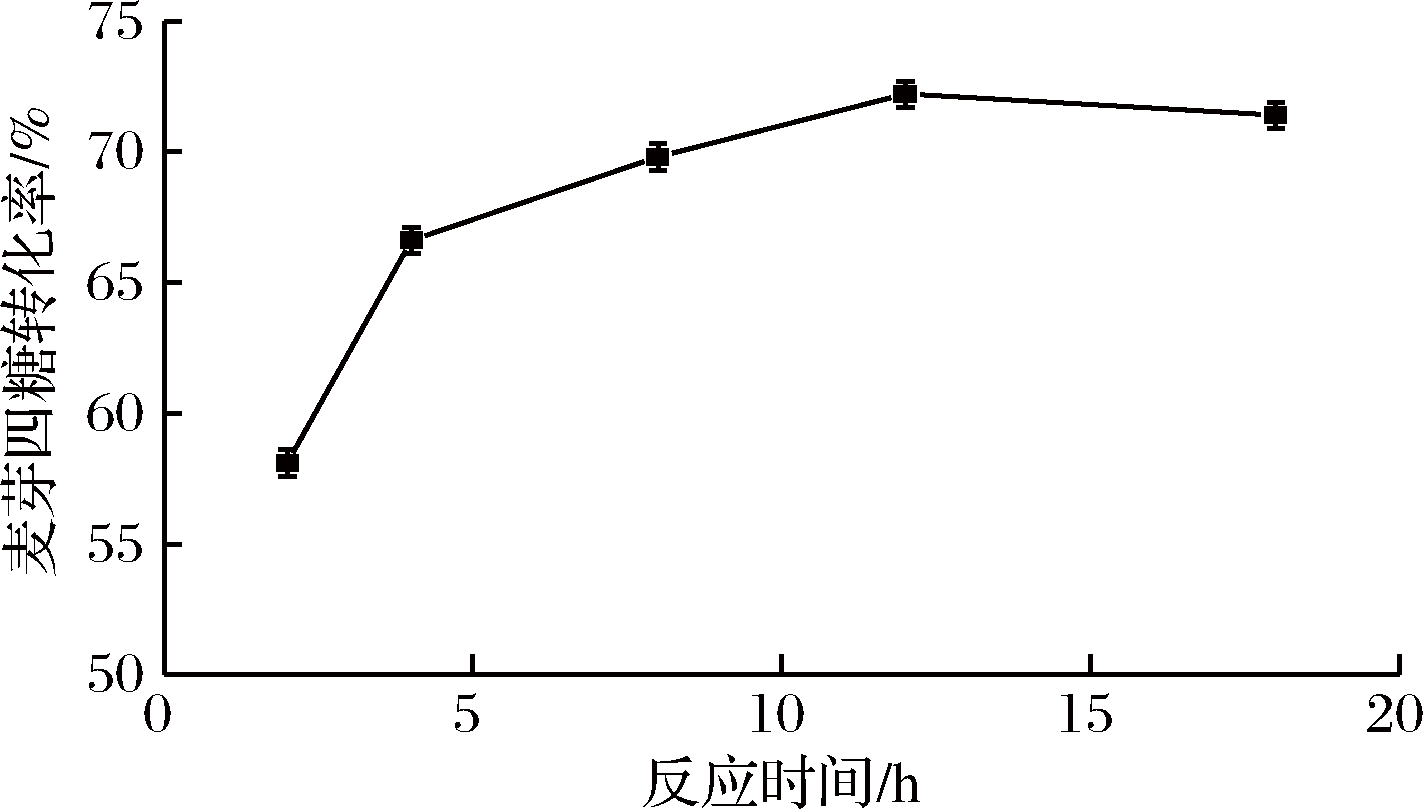
图9 反应时间对麦芽四糖酶反应的影响
Fig.9 Effect of transform time on the enzymatic conversion
在前期获得了能够分泌表达麦芽四糖淀粉酶的重组枯草芽孢杆菌菌株的基础上,本实验初步试验表明重组菌发酵上清液中麦芽四糖淀粉酶的酶活力可达147 U/mL。之后进一步探讨了重组菌在摇瓶中产酶的最适培养基,当使用豆粕粉和工业蛋白胨为氮源,甘油为碳源时,麦芽四糖淀粉酶的酶活力最高可达236 U/mL。利用廉价的培养基获得了相对较高的酶活,比Pseudomonas sp.IMD 353来源的该酶的最高产酶水平13 U/mL[5]高18倍,比培养基优化前的酶活高约1倍。采用该麦芽四糖淀粉酶探究了酶法生产麦芽四糖的工艺条件,结果表明,反应pH值为7.0,温度为50 ℃,加酶量为30 U/g底物,底物麦芽糊精质量浓度为250 g/L,转化时间12 h,麦芽四糖的转化率可达73.2%,比目前已有报道的最高水平54%[19]高19%,为工业化生产麦芽四糖提供了研究基础。
本研究使用经过载体和宿主菌改造而得到的高表达重组菌,完成了其在摇瓶中的优化及在制备麦芽四糖中的应用。重组菌高密度发酵的培养基及发酵条件有待优化,提高酶活的同时降低发酵成本,以实现麦芽四糖淀粉酶的大规模工业化生产。
[1] ROBYT J F, ACKERMAN R J. Isolation,purification and characterization of a maltotetraose-producing amylase fromPseudomonas stuzeri[J]. Archives of Biochemistry and Biophysics, 1971, 145(1): 105-114.
[2] SAKANO Y, KASHIWAGI Y, KOBAYASHI T, et al. Purification and properties of an exo-α-amylase fromPseudomonas stutzeri[J]. Agricultural and Biological Chemistry, 1982, 46: 639-646.
[3] SAKANO Y, KASHIWAGI Y, KOBAYASHI T. Purification of a maltotetraose-forming exo-amylase ofPseudomonas stutzeri: Two-forms of the amylase and their enzymatic properties[J]. Agricultural and Biological Chemistry, 1982,46(3):639-646
[4] FUJITA M, TORIGOE K, NAKADA T, et al. Cloning and nucleotide sequence of the gene (amyP) for maltotetraose-forming amylase fromPseudomonas stutzeri MO-19[J]. Journal of Bacteriology, 1989, 171(3): 1 333-1 339.
[5] FOGARTY W M, KELLY C T, BOURKE A C, et al. Extracellular maltotetraose-forming amylase ofPseudomonas sp. IMD 353[J]. Biotechnology Letters, 1994, 16(5): 473-478.
[6] MAALEJ H, HMIDET N, GHORBEL-BELLAAJ O, et al. Purification and biochemical characterization of a detergent stable α-amylase fromPseudomonas stutzeri AS22[J]. Biotechnology and Bioprocess Engineering, 2013, 18(5): 878-887.
[7] KOBAYASHI S, OKEMOTO H, HARA K, et al. Preparation and some properties of a novel maltotetraose-forming enzyme ofPseudomonas saccharophila[J]. Journal of the Japanese Society of Starch Science, 1991, 38(1): 27-36.
[8] SCHMIDT J, JOHN M. Starch metabolism inPseudomonas stutzeri. I. Studies on maltotetraose-forming amylase[J]. Biochimica et Biophysica Acta, 1979, 566(1): 88-99.
[9] ZHOU Jianhua, TAKANO T, KOBAYASHI S. Cloning of exo-maltotetraohydrolase gene fromPseudomonas saccharophila inEscherichia coli[J]. Agricultural and Biological Chemistry, 1989, 53(1): 301-302.
[10] MORISHITA Y, HASEGAWA K, MATSUURA Y, et al. Crystal structure of a maltotetraose-forming exo-amylase fromPseudomonas stutzeri[J]. Journal of Molecular Biology, 1997, 267(3): 661-672.
[11] MEZAKI Y, KATSUYA Y, KUBOTA M, et al. Crystallization and structural analysis of inact maltotetraose-forming exo-amylase fromPseudomonas stutzeri[J]. Bioscience, Biotechnology, and Biochemistry, 2001, 65(1): 222-225.
[12] ZHOU Jianhua, BABA T, TAKANO T, et al. Properties of the enzyme expressed by thePseudomonas saccharophila maltotetraohydrolase gene(mta) inEscherichia coli[J]. Carbohydrate Research, 1992, 223(2): 255-261.
[13] BAE W, LEE S H, YOO S H, et al. Utilization of a maltotetraose-producing amylase as a whole wheat bread improver:Dough rheology and baking performance[J]. Journal of Food Science, 2014, 79(8): 1 535-1 540.
[14] JIA Xianbo, GUO Yonghua, LIN Xinjian, et al. Fusion of a family 20 carbohydrate-binding module (CBM20) with cyclodextrin glycosyltransferase ofGeobacillus sp. CHB1 improves catalytic efficiency[J]. Journal of Basic Microbiology, 2017, 57(6): 471-480.
[15] SHIVLATA L, SATYANARAYANA T. Characteristics of raw starch-digesting α-amylase ofStreptomyces badius DB-1 with transglycosylation activity and its applications[J]. Applied Biochemistry and Biotechnology, 2017, 181(4): 1 283-1 303.
[16] VAJRAVIJAYAN S, PLETNEVA N. Structural insights on starch hydrolysis by plant β-amylase and its evolutionary relationship with bacterial enzymes[J]. International Journal of Biological Macromolecules, 2018, 113: 329-337.
[17] 赵云. 麦芽四糖淀粉酶基因克隆表达及活性研究[D]. 上海:华东师范大学, 2013.
[18] 韦云萍. 运用体外分子进化的方法提高麦芽四糖淀粉酶活性的研究[D]. 上海:华东师范大学, 2014.
[19] 赵云, 朱蓓霖,汪正华,等. 麦芽四糖淀粉酶基因优化表达及酶学性质分析[J]. 中国生物工程杂志, 2013,33(5): 100-106.
[20] 朱明. 用麦芽四糖淀粉酶生产麦芽四糖[J]. 无锡轻工大学学报, 1997(4): 36-39.
[21] 朱明, 吴嘉根. 麦芽四糖的性质及在食品中的应用[J]. 冷饮与速冻食品工业, 1999,5(4): 23-24.
[22] 韦云萍, 赵云,张金龙,等. 嗜糖假单胞菌麦芽四糖淀粉酶的枯草芽孢杆菌表达及酶学性质分析[J]. 食品与发酵工业, 2014, 40(5): 70-76.
[23] 唐玉, 孙俊良,梁新红,等. 麦芽四糖研究新进展[J]. 河南科技学院学报, 2013, 41(4): 14-16;21.
[24] 钱莹, 段钢. 新型麦芽四糖酶及其应用[J]. 食品与生物技术学报, 2013, 32(1): 100-104.
[25] 信成夫, 景文利,于丽,等. 麦芽四糖生产工艺的研究[J]. 中国食品添加剂, 2016(10): 149-153.