自然界的氮循环有8条途径,其中6条是由微生物完成的[1]。在这6条途径中有2条是在亚硝酸还原酶的作用下分解亚硝酸盐,分别是反硝化作用和亚硝酸氨化作用[2]。微生物反硝化作用使亚硝酸盐转化成NO、N2;微生物的亚硝酸氨化作用使亚硝酸盐转化为![]() 亚硝酸盐对环境和人类均造成了严重危害[3]。亚硝酸盐能形成具有强致癌作用的亚硝胺类物质,长期摄入可诱发癌变[4-5]。当亚硝酸盐的摄入量达到0.2~0.5 g时即可引起中毒,超过3 g时可致人死亡[6-9]。当水中的亚硝酸盐质量浓度积累到0.1 mg/L后,亚硝酸盐即可对水体产生危害,并造成水中养殖的鱼、虾、蟹生长不良或停止生长。当水中的亚硝酸盐质量浓度积累到2 mg/L后,则会造成养殖动物死亡[10-12]。因此严格控制亚硝酸盐的含量非常重要。目前,降解亚硝酸盐的方法有物理降解法、化学降解法和微生物降解法。微生物降解法比物理降解法和化学降解法更为高效、健康[13]。因此,可以利用生物法(微生物或其产生的亚硝酸还原酶)来降解饮食及环境中的亚硝酸盐,以消除亚硝酸盐的危害[14-15],而乳酸菌对亚硝酸盐有较强的降解能力[16-18]。
亚硝酸盐对环境和人类均造成了严重危害[3]。亚硝酸盐能形成具有强致癌作用的亚硝胺类物质,长期摄入可诱发癌变[4-5]。当亚硝酸盐的摄入量达到0.2~0.5 g时即可引起中毒,超过3 g时可致人死亡[6-9]。当水中的亚硝酸盐质量浓度积累到0.1 mg/L后,亚硝酸盐即可对水体产生危害,并造成水中养殖的鱼、虾、蟹生长不良或停止生长。当水中的亚硝酸盐质量浓度积累到2 mg/L后,则会造成养殖动物死亡[10-12]。因此严格控制亚硝酸盐的含量非常重要。目前,降解亚硝酸盐的方法有物理降解法、化学降解法和微生物降解法。微生物降解法比物理降解法和化学降解法更为高效、健康[13]。因此,可以利用生物法(微生物或其产生的亚硝酸还原酶)来降解饮食及环境中的亚硝酸盐,以消除亚硝酸盐的危害[14-15],而乳酸菌对亚硝酸盐有较强的降解能力[16-18]。
利用方差分析、相关性分析等数据分析方法,张庆芳等[19]推导出了乳酸菌对亚硝酸盐的降解分为NiR降解和酸降解 2个阶段。在发酵的前期,培养液pH>4.5时,乳酸菌对亚硝酸盐降解以NiR降解为主;发酵后期,由于乳酸菌本身产生酸,使培养液pH值降低,pH<4.0后,亚硝酸盐的降解主要以酸降解为主。由于乳酸杆菌产酸能力强于乳酸球菌,乳酸杆菌降解亚硝酸盐能力大于乳酸球菌,而在发酵前期(pH>4.5),杆菌与球菌降解亚硝酸盐并无差别。
Lactobacillus plantarum、Lactobacillus brevis、Lactobacillus rhamnosus是食品中常见乳酸菌种,在发酵食品中常被分离、鉴定得到的益生菌[20-23],又常作为复合菌剂的菌种应用在食品生产中。根据乳酸菌的实际应用价值、研究状况及大数据调查分析[19-23],Lactobacillus plantarum、Lactobacillus brevis、Lactobacillus rhamnosus是全球关注度较高及乳酸菌中降解![]() 研究比较多的模式菌种,本文从这3株乳酸菌降解亚硝酸盐能力、发酵产酸特性、基因等方面进行综合分析,探讨其对亚硝酸盐降解差异性的原因,对生产实践及科学研究给予理论指导。
研究比较多的模式菌种,本文从这3株乳酸菌降解亚硝酸盐能力、发酵产酸特性、基因等方面进行综合分析,探讨其对亚硝酸盐降解差异性的原因,对生产实践及科学研究给予理论指导。
1.1.1 试验菌种
Lactobacillus brevis1508;Lactobacillus plantarum1407;Lactobacillus rhamnosus1.11,以上菌株为本研究室保藏。
1.1.2 蔬菜原料
大连市郊区甘蓝。
1.1.3 培养基及培养液配方
MRS固体培养基(g/L):葡萄糖20、蛋白胨10、酵母粉4、K2HPO4 2、牛肉粉8、MgSO4 0.1、乙酸钠5、柠檬酸三铵2、MnSO4 0.05、吐温-80 1、琼脂20、pH 7.2。
液体培养基:不加琼脂,其他成分同MRS固体培养基。
含![]() 的液体培养基:液体培养基中添加入100 mg/L的
的液体培养基:液体培养基中添加入100 mg/L的![]()
1.1.4 菌种活化
菌种活化培养基为MRS液体培养基。一次活化:取纯化后穿刺保藏的各菌种试管,分别穿刺3针接于10 mL液体培养基试管中,重复3次,30 ℃培养48 h。二次活化:取一次活化各菌种菌液,按10%接种量接种于液体培养基扩大培养,30 ℃培养48 h。
1.1.5 仪器与设备
HD-1360超净工作台,北京悦泰行科技发展有限公司;THZ-312台式恒温振荡器,上海精胜科学仪器设备有限公司;280型轻便手提压力蒸汽消毒器,成都一科仪器设备有限公司;BZ-01显微镜,德国徕卡;UV-120-02紫外可见分光光度计,上海珂淮仪器有限公司;pHB-4p酸度计,上海升隆公司。
1.1.6 蔬菜发酵工艺流程
甘兰→清洗→烫漂→沥水→切段→装瓶→压石→注盐水→接种→密封→发酵
1.1.7 测定指标及方法
将二次活化后的L.rhamnosus、L.plantarum、L.brevis 3种乳酸菌液,按等量菌数接入pH值为7.2的液体MRS培养基中,30 ℃恒温培养,定时测定培养液总酸及pH值。在含有![]() (初始质量浓度为 100 mg/L)的MRS液体培养基中,分别接入等量菌数的3种不同乳酸菌种,于30 ℃恒温培养,定时测定发酵液中pH值及
(初始质量浓度为 100 mg/L)的MRS液体培养基中,分别接入等量菌数的3种不同乳酸菌种,于30 ℃恒温培养,定时测定发酵液中pH值及![]() 的含量。分别接种3种乳酸菌进行蔬菜发酵,定时测定发酵液中pH值、总酸和挥发酸及菜种总酸
的含量。分别接种3种乳酸菌进行蔬菜发酵,定时测定发酵液中pH值、总酸和挥发酸及菜种总酸![]() 的含量。
的含量。
菌株的16S rDNA序列下载自NCBI核酸数据库,包括L.bifermentans [M58809.1],L.brevis [NR_044704.1],L.composti [NR_041509.1],L.coryniformis [NR_044705.2],L.plantarum [D79210.1],L.rhamnosus [M58815.1],L.similis [KJ547681.1]。
乳杆菌的亚硝酸盐还原酶蛋白序列下载自NCBI蛋白数据库,包括L.bifermentans [WP_057904912.1],L.brevis [WP_035444188.1],L.composti [WP_057003017.1],L.coryniformis [EJN56181.1],L.plantarum [AKC01517.1],L.similis [WP_057151639.1]。此外,经详细搜索比对发现,菌株L.rhamnosus的亚硝酸盐还原酶基因在网上数据库中无序列信息。
GenBank数据库:核酸序列数据库,包含基因核酸与蛋白序列、非编码序列、基因组序列等,由美国国立生物技术信息中心(NCBI)建立并维护;BLAST(序列局部比对工具,有blastp、blastn、blastx、tblastn、tblastx五种比对方法);Clustal X2(多序列比对工具),MEGA5(系统发育分析软件),BioEdit(序列比对与分析工具),蛋白保守结构域由NCBI的CDD预测。
将L.rhamnosus、L.plantarum、L.brevis 的菌液,分别按等量菌数接种到不含![]() 的MRS培养液、含
的MRS培养液、含![]() (初始质量浓度为100 mg/L)的MRS培养液,及进行蔬菜发酵,定时测定各发酵液的pH值及总酸,结果如图1。
(初始质量浓度为100 mg/L)的MRS培养液,及进行蔬菜发酵,定时测定各发酵液的pH值及总酸,结果如图1。
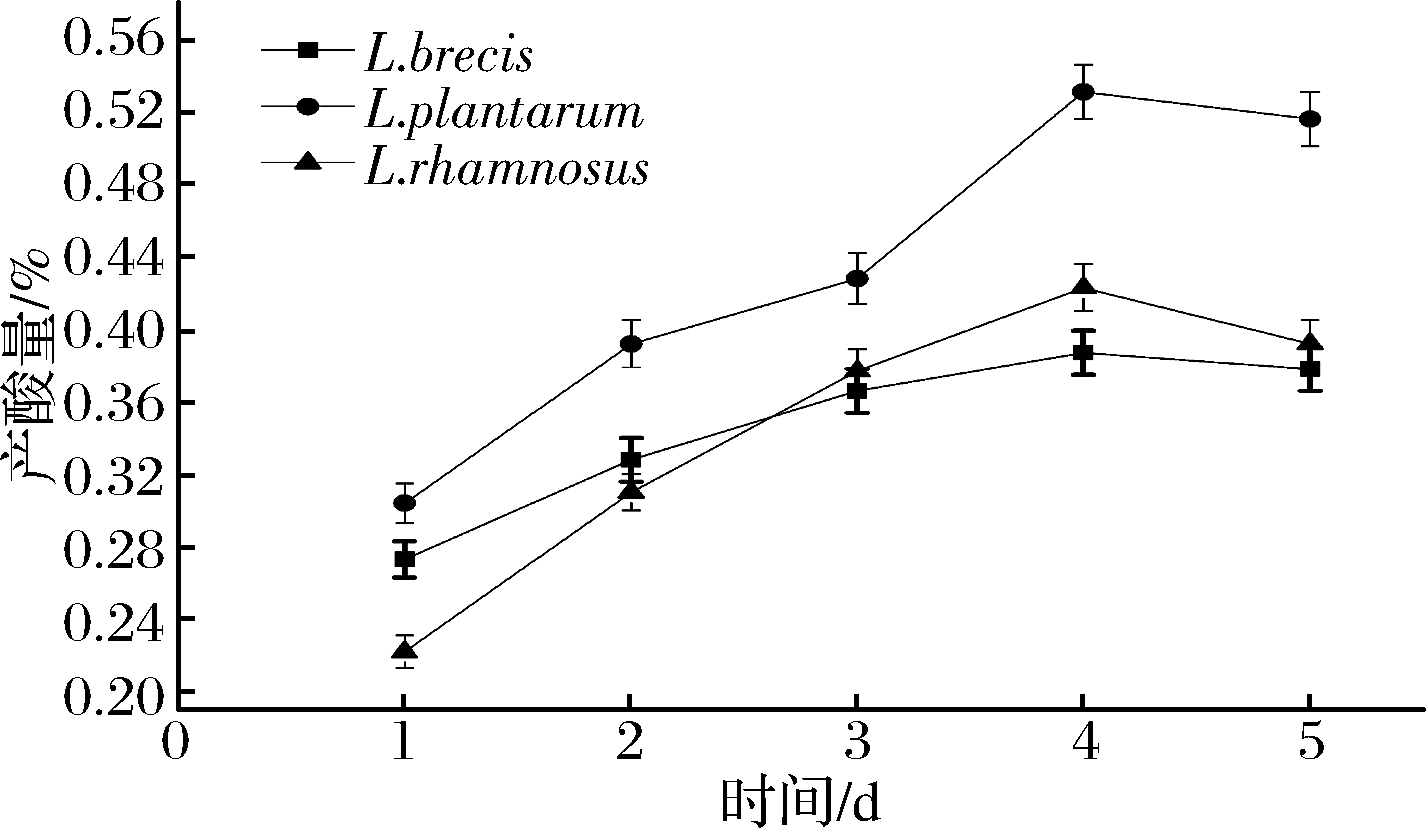
图1 无![]() 培养液中总酸的变化
培养液中总酸的变化
Fig.1 The change of culture medium (without![]() total acid produced
total acid produced
如图1、图2可知,在无![]() 的培养液中,L.plantarum产酸能力最强。由图3可知,在含
的培养液中,L.plantarum产酸能力最强。由图3可知,在含![]() 的培养液中,L.brevis 培养液的pH一直>5.5;而L.plantarum和L.rhamnosus在发酵初期、环境的pH>4.5,发酵中、后期很快降到4.0以下。由图4可知,L.brevis 接种发酵蔬菜,其汤汁pH值一直大于5.0;而L.plantarum与L.rhamnosus接种发酵蔬菜,在发酵初期,汤汁的pH>4.5,在发酵的中、后期,汤汁pH<4.0。 由图5可看出,发酵后期发酵液中挥发酸与总酸比值L.brevis 最大,L.plantarum其次,L.rhamnosus最小;由图6可知,发酵后期发酵菜中L.brevis 总酸最少,L.plantarum其次,L.rhamnosus最多。
的培养液中,L.brevis 培养液的pH一直>5.5;而L.plantarum和L.rhamnosus在发酵初期、环境的pH>4.5,发酵中、后期很快降到4.0以下。由图4可知,L.brevis 接种发酵蔬菜,其汤汁pH值一直大于5.0;而L.plantarum与L.rhamnosus接种发酵蔬菜,在发酵初期,汤汁的pH>4.5,在发酵的中、后期,汤汁pH<4.0。 由图5可看出,发酵后期发酵液中挥发酸与总酸比值L.brevis 最大,L.plantarum其次,L.rhamnosus最小;由图6可知,发酵后期发酵菜中L.brevis 总酸最少,L.plantarum其次,L.rhamnosus最多。

图2 无![]() 培养液中pH值的变化
培养液中pH值的变化
Fig.2 The change of pH in culture medium broth without![]()
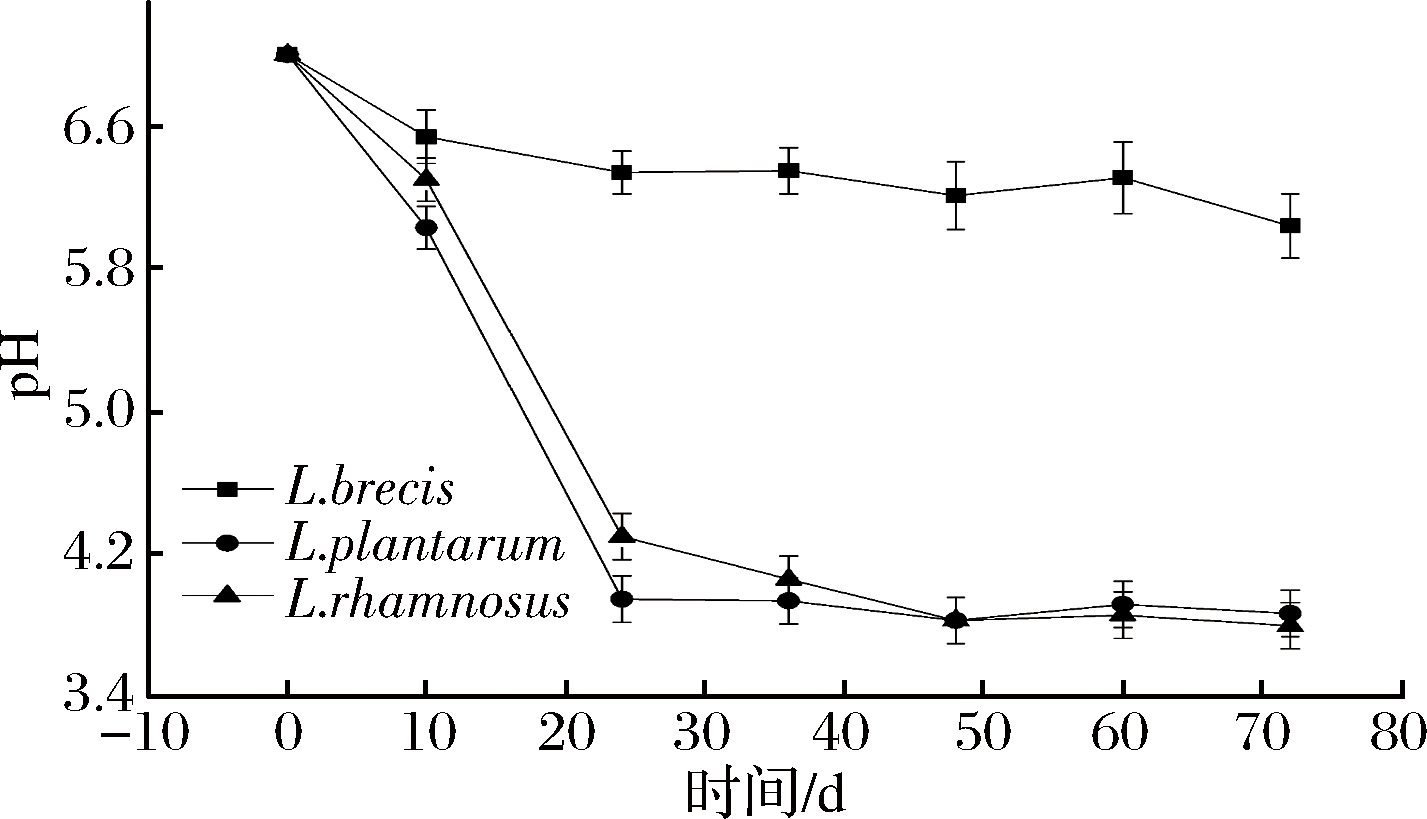
图3 有![]() 培养液中pH值的变化
培养液中pH值的变化
Fig.3 The change of pH in culture medium broth with![]()
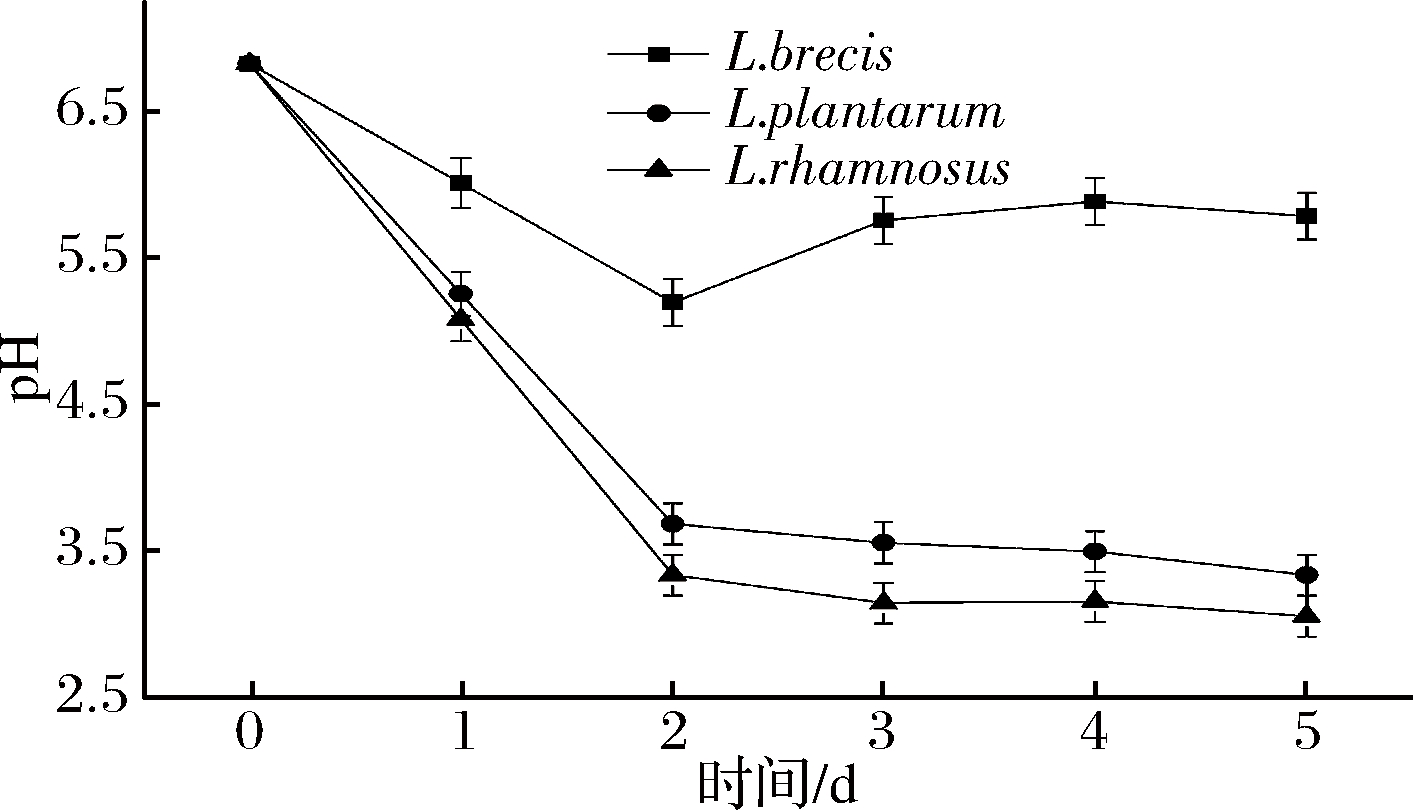
图4 蔬菜发酵液的pH变化
Fig.4 The change of pH in vegetable fermented solution
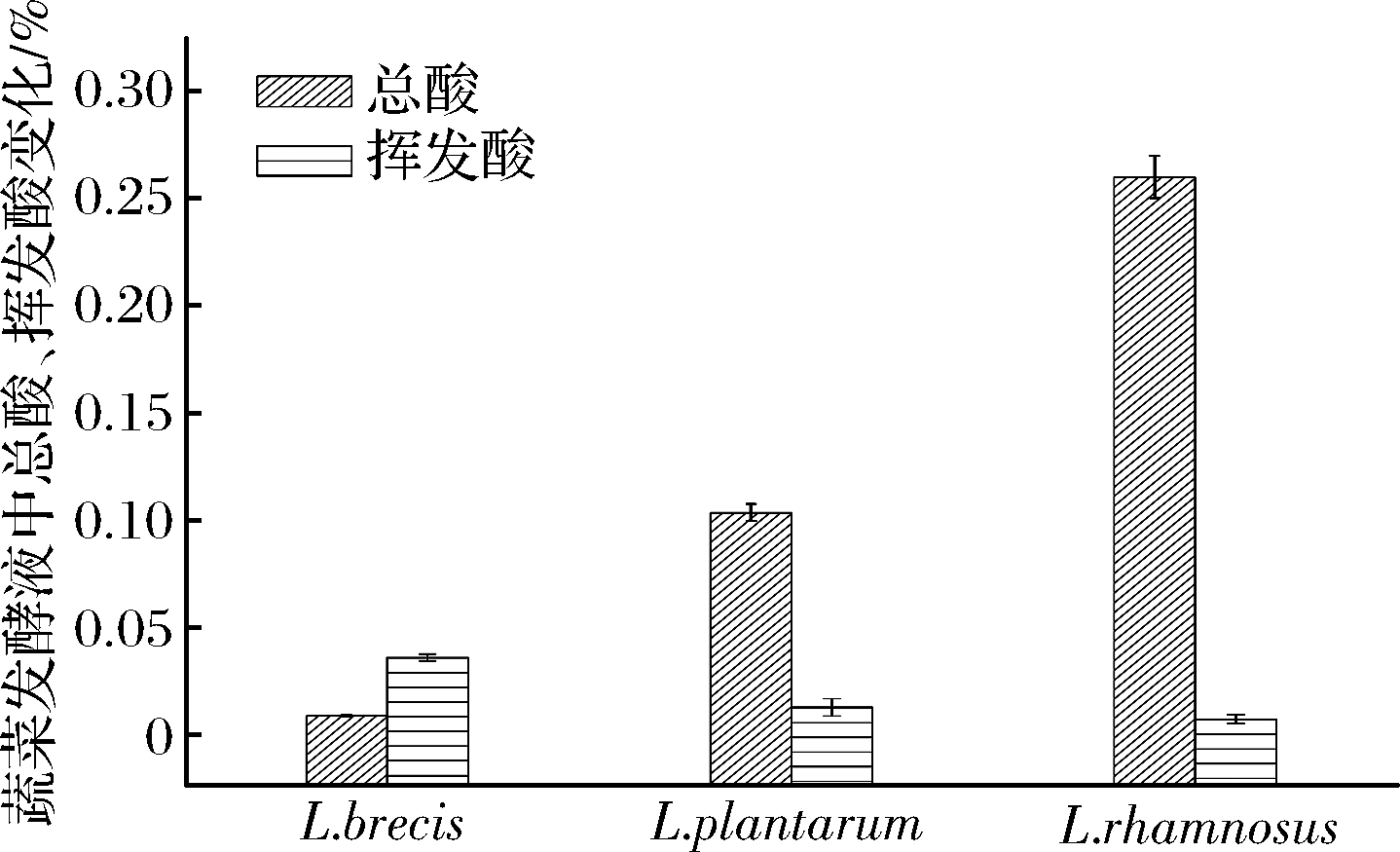
图5 蔬菜发酵液的总酸、挥发酸含量
Fig.5 The change of total acid and volatile acid content of vegetable fermented solution

图6 发酵菜的总酸含量
Fig.6 The change of total acid of vegetable fermented solution
2.2.1 亚硝酸盐还原酶基因的深入分析
基于NCBI数据库,本研究对L.rhamnosus、L.plantarum、L.brevis所有可获得的基因组进行了分析,通过基因组功能注释查找nir基因,并利用BLASTP比对参考序列(NiR蛋白序列),发现L.brevis与L.plantarum菌株中存在nir基因,而L.rhamnosus菌株中未发现该基因。
进一步的多序列比对结果可看出(图7),除L.plantarum 外,其余5株乳杆菌的亚硝酸盐还原酶的蛋白序列的相似性很高(相似性在80%以上),只在蛋白序列的前端与末端存在较高比例的差异氨基酸。蛋白质的保守结构域分析(CDD分析)也表明,乳杆菌(除L.plantarum外)的亚硝酸盐还原酶均包含1个NiR_SIR_ferr超家族结构域,该结构域为亚硝酸盐/亚硫酸盐还原酶的保守结构域家族。而且,该结构域的氨基酸序列(占全酶序列长的86.9%)在6株乳杆菌中是高度保守的,与多序列比对的同源性较高的区域相一致,这表明在历史进化中NiR_SIR_ferr超家族结构域的稳定遗传决定了亚硝酸盐还原酶的稳定存在与功能实现。

图7L.plantarum、L.brevis与其他乳杆菌的亚硝酸盐
还原酶蛋白序列的多序列比对与结构域分析
Fig.7 The multiple sequence alignment of the nitrite reductase protein sequence and the domain analysis ofL.plantarum,L.brevis and otherLactobacillus
2.2.2 系统发育分析
如图8-A所示,基于6株乳杆菌(包括L.rhamnosus)的16S rDNA序列构建的系统发育树分化为2个明显的大分枝,L.rhamnosus与L.bifermentans、L.coryniformis与L.composti在同一大分枝上,L.plantarum、L.brevis 与L.similis在同一大分枝上,而同一大分枝上的菌株的亲缘关系更近,也即L.plantarum与L.brevis亲缘关系更近。
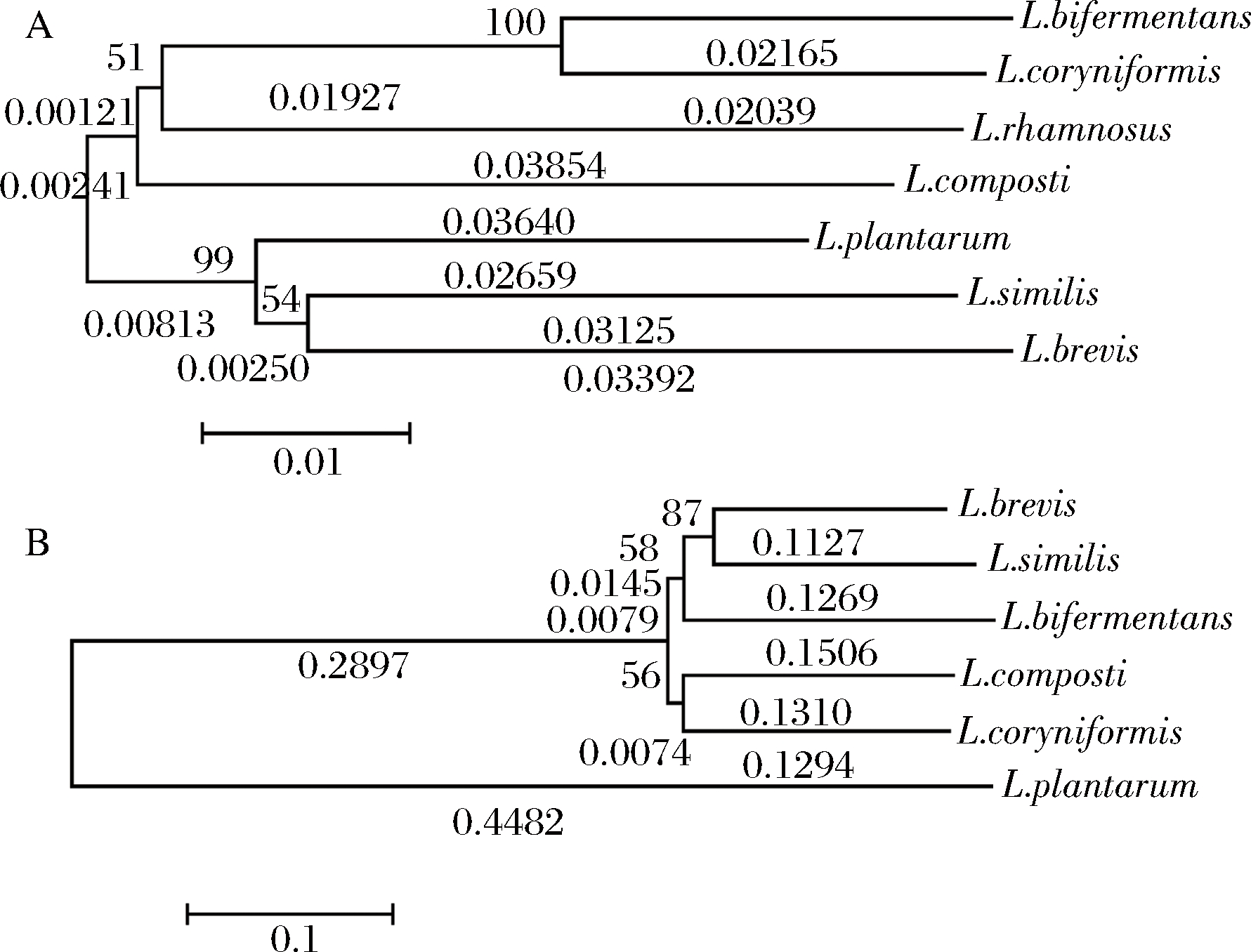
A-16S rDNA序列; B-系统发育树
图8 基于L.plantarum、L.brevis、L.rhamnosus
与其他乳杆菌的16S rDNA序列与亚硝酸盐
还原酶蛋白序列构建的系统发育树
Fig.8 The phylogenetic tree built based onLactobacillus plantarum,Lactobacillus brevis,Lactobacillus rhamnosus and other Lactobacillus 16S rDNA sequences and the nitrite reductase protein sequence
注:系统发育树由MEGA5构建,采用Neighbor-Joining方法,
重复500次建树,进化距离由p-distance方法运算获得。
然而,基于亚硝酸盐还原酶蛋白序列构建的系统发育树上(图8-B,不包括L.rhamnosus),L.plantarum所在的进化分枝独立于其他菌株,这与16S rDNA序列构建的系统发育树明显不同。而且,由图8-B可知,L.plantarum的亚硝酸盐还原酶基因在历史进化中最先分化,且在长期进化过程中形成了独特的亚硝酸盐还原酶基因结构。
将L.rhamnosus、L.plantarum、L.brevis的菌液,分别按等量菌数接种到不含![]() 的MRS培养液、含
的MRS培养液、含![]() (初始质量浓度为100 mg/L)的MRS培养液,及进行蔬菜发酵,定时测定各发酵液的
(初始质量浓度为100 mg/L)的MRS培养液,及进行蔬菜发酵,定时测定各发酵液的![]() 含量,结果如图9、图10所示。
含量,结果如图9、图10所示。
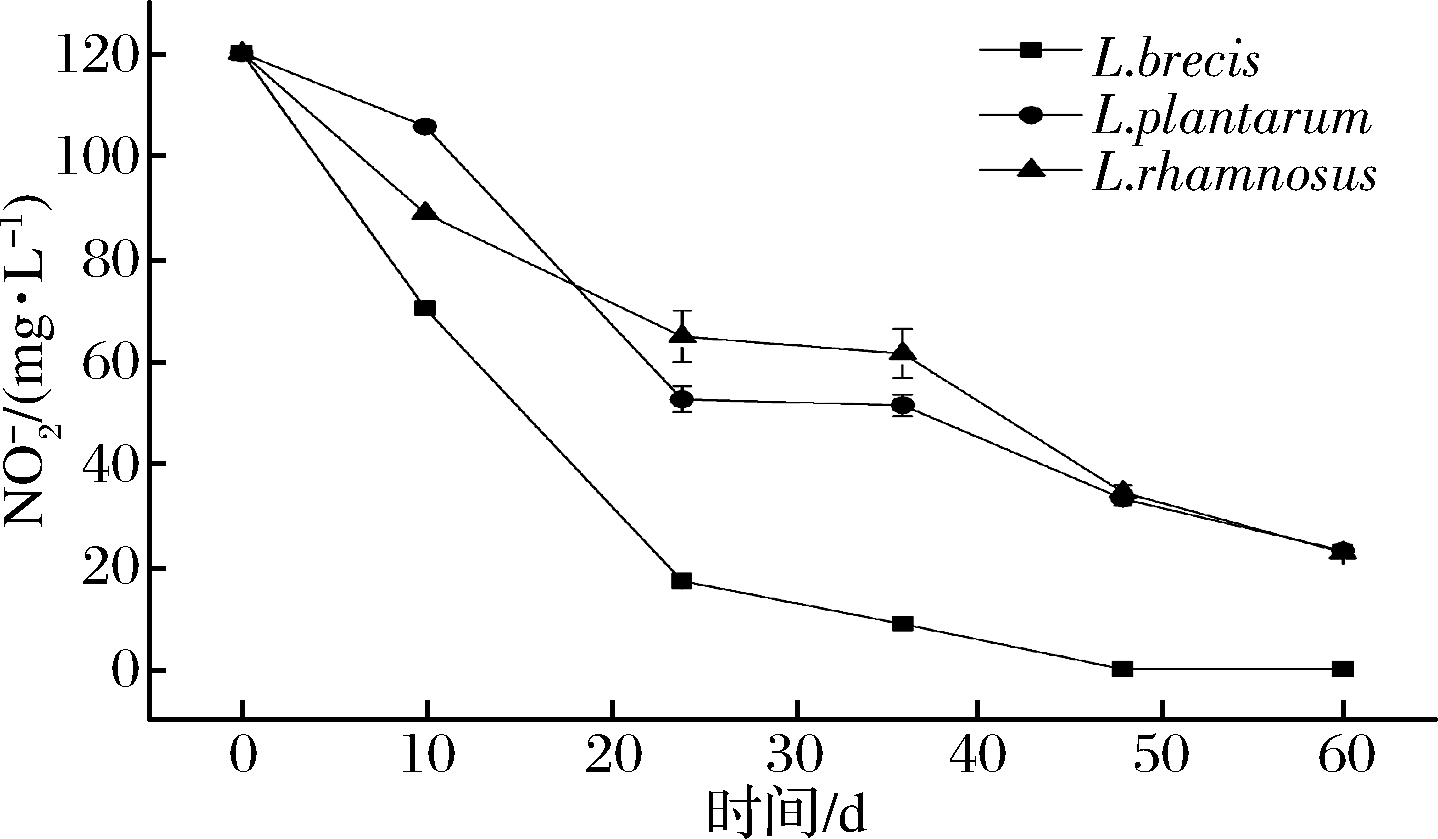
图9 培养液![]() 含量变化
含量变化
Fig.9 The change of content of![]() in culture solution
in culture solution

图10 蔬菜发酵液中![]() 含量变化
含量变化
Fig.10 The change of content of![]() in vegetable fermented solution
in vegetable fermented solution
从图9可以明显看出,含有![]() 培养液中接种3种乳酸菌都能降解
培养液中接种3种乳酸菌都能降解![]() 其中L.brevis 降解
其中L.brevis 降解![]() 能力显著高于其他2种乳酸菌。48 hL.brevis在含有
能力显著高于其他2种乳酸菌。48 hL.brevis在含有![]() 的培养液中降解了全部的亚硝酸盐。由图10可知,接入乳酸菌种不同,蔬菜发酵液中亚硝酸盐变化曲线不同;亚硝峰出现时间基本相同,但峰值不同。其中接种L.brevis 的蔬菜发酵液从第2天开始检测不出亚硝酸盐;L.plantarum接种的蔬菜发酵液的亚硝峰值最高,L.brevis接种的蔬菜发酵液的亚硝峰值最低。图11可知,在发酵蔬菜成熟产品中,硝酸盐被大量分解(原料蔬菜经烫漂后菜中硝酸盐含量为895.23 mg/kg),但仍有剩余(60~150 mg/kg),L.brevis剩余量最多,其次L.plantarum,最少L.rhamnosus;在发酵蔬菜成熟产品中,L.brevis 接种的无亚硝酸盐残留,L.plantarum接种的残留2.02 mg/kg,L.rhamnosus接种的残留1.09 mg/kg。
的培养液中降解了全部的亚硝酸盐。由图10可知,接入乳酸菌种不同,蔬菜发酵液中亚硝酸盐变化曲线不同;亚硝峰出现时间基本相同,但峰值不同。其中接种L.brevis 的蔬菜发酵液从第2天开始检测不出亚硝酸盐;L.plantarum接种的蔬菜发酵液的亚硝峰值最高,L.brevis接种的蔬菜发酵液的亚硝峰值最低。图11可知,在发酵蔬菜成熟产品中,硝酸盐被大量分解(原料蔬菜经烫漂后菜中硝酸盐含量为895.23 mg/kg),但仍有剩余(60~150 mg/kg),L.brevis剩余量最多,其次L.plantarum,最少L.rhamnosus;在发酵蔬菜成熟产品中,L.brevis 接种的无亚硝酸盐残留,L.plantarum接种的残留2.02 mg/kg,L.rhamnosus接种的残留1.09 mg/kg。

图11 发酵菜中![]() 残留量
残留量
Fig.11 Residual of![]()
![]() fermented vegetable
fermented vegetable
L.plantarum与L.brevis 降解![]() 的途径为产NH3途径[26-27];最终产物为NH3。
的途径为产NH3途径[26-27];最终产物为NH3。
张庆芳等[19]推导出了乳酸菌对亚硝酸盐的降解分为NiR降解和酸降解 2个阶段。在发酵的前期,培养液pH>4.5时,乳酸菌对亚硝酸盐降解以NiR降解为主;发酵后期,由于乳酸菌本身产生酸,使培养液pH值降低,pH<4.0后,亚硝酸盐的降解主要以酸降解为主。
Lactobacillus brevis降解亚硝酸盐能力可能是该菌产酸量较低(属于异型乳酸发酵);该菌有nir基因,在环境有![]() 的诱导下,产生NiR;较少的H+中和NiR作用
的诱导下,产生NiR;较少的H+中和NiR作用![]() 生成的氨类物质,使发酵环境一直处于NiR最适作用pH值(5.0~6.0);从而能使
生成的氨类物质,使发酵环境一直处于NiR最适作用pH值(5.0~6.0);从而能使![]() 大量被NiR分解[28-31]。Lactobacillus plantarum与Lactobacillus brevis亲缘关系较近,且也具有nir基因[32],能在环境有
大量被NiR分解[28-31]。Lactobacillus plantarum与Lactobacillus brevis亲缘关系较近,且也具有nir基因[32],能在环境有![]() 的诱导下,产生NiR;环境pH>4.5时,主要是在NiR作用下分解亚硝酸盐;但L.plantarum 属于同型乳酸发酵,产酸能力较强,能快速使环境pH<4.5,从而迅速进入
的诱导下,产生NiR;环境pH>4.5时,主要是在NiR作用下分解亚硝酸盐;但L.plantarum 属于同型乳酸发酵,产酸能力较强,能快速使环境pH<4.5,从而迅速进入![]() 被H+降解的阶段。L.rhamnosus与L.brevis和L.plantarum亲缘关系较远,没有找到nir基因,但L.rhamnosus属于同型乳酸发酵,产酸能力较强,其降解
被H+降解的阶段。L.rhamnosus与L.brevis和L.plantarum亲缘关系较远,没有找到nir基因,但L.rhamnosus属于同型乳酸发酵,产酸能力较强,其降解![]() 机理,可能主要是酸降解。
机理,可能主要是酸降解。
本实验室及其他学者[33-37]均发现L.rhamnosus有降解亚硝酸盐的能力。但经详细搜索基因库发现,菌株L.rhamnosus的亚硝酸盐还原酶基因在网上数据库中无序列信息。可能原因如下:(1)L.rhamnosus有nir基因,但国内外无相关研究。见图9,在亚硝酸盐纯培养液发酵前期(非酸降解阶段)有大量亚硝酸盐被降解;由图10和图11可知,蔬菜原料中有大量硝酸盐被分解使得发酵环境中有大量亚硝酸盐生成,随后亚硝酸盐被大量降解。(2)L.rhamnosus没有nir基因。如图9亚硝酸盐在前期(pH>4.5)又有降解,可能是此菌产生的乳酸菌素[38]等其他物质作用(如乳酸菌素最适作用pH为2~8,涵盖了NiR降解阶段);但此菌降解亚硝酸盐能力较强(见图10),L.rhamnosus是正型发酵,见发酵产酸特性3.1的分析,其产酸能力较强,且降解亚硝酸盐可能是氮代谢途径[39-42](如果有亚硝酸盐还原酶),不能使其发酵环境的pH值回调,使其快速降到4.0以下,进入酸降解阶段。
[1] 贺纪正,张丽梅. 氨氧化微生物生态学与氮循环研究进展[J]. 生态学报,2009,29(1):406-415.
[2] 龚骏,张晓黎. 微生物在近海氮循环过程的贡献与驱动机制[J]. 微生物学通报,2013(1):44-58.
[3] SINDELAR J J,MILKOWSKI A L. Human safety controversies surrounding nitrate and nitrite in the diet[J].Nitric Oxide,2012,26(4):259-266.
[4] BRYANA N S, ALEXANDERB D D, COUGHLINC J R, et al. Ingested nitrate and nitrite and stomach cancer risk:An updated review[J]. Food and Chemical Toxicology,2012,50(10):3 646-3 665.
[5] 皇甫超申,史齐,李延红,等. 亚硝酸盐对人体健康的利害分析[J]. 环境与健康杂志,2010(8):733-736.
[6] 卢尧. 肉制品腌制过程中亚硝酸盐变化规律及生物抗氧化剂对亚硝酸盐的抑制作用研究[D].长春:吉林大学,2016.
[7] 王旭东.16例急性亚硝酸盐中毒的临床分析[J].大家健康(学术版),2013,7(24):137.
[8] 陈志诚,陈立亚,陈素哲.亚硝酸盐中毒31例临床分析[J]. 临床荟萃,2011, 26(4): 329-330.
[9] 赵静,王娜,冯叙桥,等. 蔬菜中硝酸盐和亚硝酸盐检测方法的研究进展[J]. 食品科学,2014,35(8):42-49.
[10] 彭小云. 亚硝酸盐在水产养殖中的危害[J]. 渔业致富指南,2015(12):63-64.
[11] 周平. 氨氮对水产养殖的危害及防治措施[J]. 中国水产,2013(8):63-64.
[12] MONSEES, H, KLATT L, KLOAS W, et al.Chronic exposure to nitrate significantly reduces growth and affects the health status of juvenile Nile tilapia (Oreochromis niloticus L.) in recirculating aquaculture systems[J].Aquaculture Research,2017,48(7):3 482-3 492.
[13] 谢燕丹,刘零怡,楼乔明,等. 加工蔬菜中亚硝酸盐的消除技术研究进展[J]. 食品与发酵工业,2016,42(8):279-286.
[14] 赵慧娟,程旭. 亚硝酸盐降解进展研究[J]. 吉林农业,2016(22):84.
[15] 崔珏,孙会刚,朱兆丽,等.酸菜中降解亚硝酸盐乳酸菌的筛选、鉴定及其在发酵香肠中的应用[J].食品工业科技,2016,37(18):251-255.
[16] 于华,刘有晴,黄丹,等.泡菜中高产酸、高效降解亚硝酸盐的乳酸菌分离鉴定及应用[J].中国调味品,2016,41(6):34-38.
[17] 张庆芳,迟乃玉,郑学仿,等.短乳杆菌(Lactobacillus brevis)去除亚硝酸盐的研究[J].微生物学通报,2004,31(2):55-60.
[18] 柳念,陈佩,高冰,等.乳酸菌降解亚硝酸盐的研究进展[J]. 食品科学,2017(7):290-295.
[19] 张庆芳,迟乃玉,郑艳,等.乳酸菌降解亚硝酸盐机理的研究[J].食品与发酵工业,2002,28(8):27-31.
[20] 李星云. 乳酸菌的分离筛选及在羊肉发酵香肠中的应用[D].呼和浩特:内蒙古农业大学,2010.
[21] 张庆峰,吴祖芳,翁佩芳,等. 浙东腌冬瓜优势乳酸菌的分离及产酶特性分析[J]. 现代食品科技,2016,(3):119-125.
[22] 栗永乐. 酸菜中乳酸菌的分离鉴定以及益生特性的研究[D].呼和浩特:内蒙古农业大学,2012.
[23] 武昕媛,赵云冬,孙丽媛. 东北发酵食物中乳杆菌的研究[J]. 食品工业,2017(5):204-208.
[24] 迟雪梅,张庆芳.食品中常见乳酸菌高效降解![]() 发酵性能评价[J].食品与发酵工业,2017,43(6):78-84.
发酵性能评价[J].食品与发酵工业,2017,43(6):78-84.
[25] 周通,徐波.乳酸菌亚硝酸还原酶代谢调控研究进展[J]. 江西科学,2014,32(2):139-143.
[26] 梁书诚,赵敏,卢磊,等. 好氧反硝化菌脱氮特性研究进展[J]. 应用生态学报,2010,21(6):1 581-1 588.
[27] ZUMFT W G. Cell biology and molecular basis of denitrification[J]. Microbiology and Molecular biology reviews,1997,61(4):533-616.
[28] 龚钢明,吕玉涛,管世敏,等.乳酸菌亚硝酸盐还原酶制备及酶学性质[J].中国酿造,2011(1):58-60.
[29] ADHIKARI U K,RAHMAN M M. Comparative analysis of amino acid composition in the active site ofnirk gene encoding copper-containing nitrite reductase (CuNiR) in bacterial spp.[J].Computational Biology and Chemistry,2017,67:102-113.
[30] 王英,周剑忠,李清,等.植物乳杆菌SD-7的分离鉴定及其亚硝酸盐降解特性[J].中国食品学报,2016,16(7):97-104.
[31] 孔得杨. 微生物氮转化途径综述[J]. 西部皮革,2017(4):42-47.
[32] 何婷婷. 植物乳杆菌亚硝酸盐还原酶编码基因的研究[D].上海:上海师范大学,2012.
[33] 杨丽娜,迟雪梅,迟乃玉,等.常用食品乳酸菌发酵蔬菜的研究[J]. 食品与发酵工业,2017,43(3):134-137;143.
[34] 张庆芳,迟乃玉,孟宪军,等.蔬菜腌渍发酵乳酸菌剂的研究[J].食品与发酵工业,2004,30(1):13-16.
[35] 魏日华,桂荣,塔娜. 牧草中异型发酵乳酸菌的分离与鉴定[J]. 草业科学,2010,27(10):149-153.
[36] 韩宏娇,丛敏,李欣蔚,等.自然发酵酸菜化学成分含量和微生物数量的动态变化及其相关性分析[J/OL].食品工业科技, 2019,40(2):148-153.
[37] 李春,孙迪,刘丽波,等. 鼠李糖乳杆菌降解亚硝酸盐影响因素研究[J]. 中国酿造,2011,30(7):64-66.
[38] 张君超,谢远红,金君华,等. 产乳酸菌素菌株的筛选鉴定及其特性分析[J]. 食品工业科技,2016,37(9):169-174.
[39] 辛玉峰,赵天颖,曲晓华.两类产NO的亚硝酸盐还原酶的分布,结构与序列比较及宏基因组分析[J]. 微生物学报,2017,57(4):597-608.
[40] CUTRUZZOL F. Bcaterial nitric oxide synthesis[J]. Biochimica et biophysica Acta, 1999,1 411(2-3):231-249.
F. Bcaterial nitric oxide synthesis[J]. Biochimica et biophysica Acta, 1999,1 411(2-3):231-249.
[41] COYNE M S, ARUNAKUMARI A L A, AVERILL B A, et al. Immunological identification and distribution of dissimilatory heme cd1 and nonheme copper nitrite reductases in denitrifying bacteria [J]. Applied and Environmental Microbiology, 1989, 55(11): 2 924-2 931.
[42] 贺璟,聂乾忠,邓洁红. 鼠李糖乳杆菌功能特性的研究进展[J]. 农产品加工(学刊),2012(3):117-120.