 等[10]的方法并略做修改。
等[10]的方法并略做修改。血橙(Citrus sinensis L. Osbeck)属于甜橙类,是柑橘中唯一含花色苷的品种[1]。血橙中因含有抗坏血酸,多酚,类黄酮以及羟基肉桂酸等活性化合物而具有较高的营养价值,深受消费者喜欢[2]。但是,血橙着色需要较大的昼夜温差,热带和亚热带气候地区生长的血橙着色普遍不深,且颜色分布不均匀,严重影响其商业价值[3]。采取有效的处理措施保持水果采后良好的品质意义重大。
草酸(oxalic acid,OA)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中,并在不同的生命体中发挥不同的功能[4]。大量研究表明,适宜浓度的草酸处理能够提高果实的抗氧化能力,延缓果实衰老、软化进程,延长贮藏期,从而达到良好的保鲜效果[5-8]。但鲜见采后草酸处理对血橙花色苷积累及糖酸含量影响的报道。
本研究拟通过不同质量浓度草酸对血橙浸泡处理,考察草酸处理对贮藏期间血橙花色苷积累以及糖酸含量变化的影响,筛选出利于提高血橙营养价值的贮藏保鲜方法,以期为血橙采后品质调控提供切实可行的理论依据和技术支持。
血橙:塔罗科,采自重庆市璧山区绿跃血橙种植园,挑选外观着色一致,大小均一,无病虫害、无机械损伤的血橙为试验原料,于2018年1月24日采收后当天运回实验室,先用清水将果实表面洗净后,取出晾干,然后分别用质量浓度为1、2、5 g/L的草酸溶液浸泡果实10 min,以浸泡清水为对照。果实表面的水分风干后,置于6~8 ℃贮藏20 d。每个处理设3次重复,每次重复15个果实,每隔5 d测定相关指标。
高效液相色谱仪,美国安捷伦公司;UMISIL C18色谱柱(260 mm×4.6 mm, 5 μm)、APS-2 HYPERSIL色谱柱(260 mm×4.6 mm, 5 μm),美国Thermo Scientific公司;TU-1901紫外分光光度计,北京普析通用仪器有限公司;H1850R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司。
1.3.1 总花色苷含量分析
参照曹少谦[9]和CRIF 等[10]的方法并略做修改。
等[10]的方法并略做修改。
血橙榨汁后10 000 r/min离心10 min,取2 mL上清液用缓冲液A(0.05 mol/L KCl、 0.15 mol/L HCl,pH=1.0)稀释至10 mL,另取2 mL上清液用缓冲液B(0.4 mol/L CH3COONa、0.24 mol/L HCl,pH=4.5)稀释至10 mL,于510 nm和700 nm处测定吸光值。按公式(1)计算:
花色苷含量![]()
(1)
式中:A=(A510 nm-A700 nm)pH 1.0-(A510 nm-A700 nm)pH 4.5;ε,矢车菊素-3-葡萄糖苷在pH=1.0缓冲液中510 nm下的摩尔吸光系数(24 825);Mw=矢车菊素-3-葡萄糖苷分子质量(484.82);DF,稀释倍数;L,光程,cm。
1.3.2 RNA提取、cDNA制备及荧光定量PCR
按照植物多糖多酚总RNA提取试剂盒Tiangen(天根生化科技北京有限公司)产品说明书进行血橙果肉RNA的提取,提取的RNA立即进行反转录。
以提取的RNA为模板,利用Tiangen FastKing RT Kit (含有gDNase)反转录试剂盒合成cDNA。使用BIO-RAD CFX98TMReal-Time Systerm仪器,荧光定量试剂盒TB GreenTM Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)。在冰上配制PCR反应液,TB GreenTM Premix Ex TaqTM Ⅱ 10.0 μL,PCR正向引物Primer 1 μL,PCR反向引物1 μL,加cDNA模板1.5 μL,ddH2O 补足总体积为20.0 μL。荧光定量PCR反应程序:预变性95 ℃ 30 s,(95 ℃、5 s,58 ℃、30 s)40个循环,95 ℃10 s。 每个模板做3次平行,用平均值表示总RNA的CT值。采用ΔΔCT法对荧光定量PCR扩增数据进行处理,目的基因的相对含量通过计算2-ΔΔCT值来确定。内参基因选用EF-1α(Accession No. XM_015533332),内参基因和CHS的引物参考CRIFO 等[10]。基因PAL、C4H、4CL、CHI、F3H、F3’5’H、DFR、ANS、UFGT、GST和Ruby的引物参考CARMONA等[3]。
等[10]。基因PAL、C4H、4CL、CHI、F3H、F3’5’H、DFR、ANS、UFGT、GST和Ruby的引物参考CARMONA等[3]。
1.3.3 可溶性糖含量分析
参照ALBERTINI等[11]的方法并略做修改。
采用高效液相色谱法。准确称取1 g血橙果肉于研钵中,加入5 mL超纯水研磨成匀浆后倒入15 mL离心管中,用1 mL超纯水刷洗研钵后一并移入离心管中,在4 ℃下,15 000 r/min离心10 min,取上清液定容于10 mL容量瓶,过0.45 μm滤膜。色谱条件:色谱柱为APS-2 HYPERSIL柱(260 mm×4.6 mm, 5 μm);流动相为乙腈和水(体积比70∶30);流速1.0 mL/min;柱温35 ℃;进样量为10 μL;RID示差检测器。
1.3.4 有机酸含量分析
(1)抗坏血酸含量分析。参照江海等[12]的方法并略作修改。
采用高效液相色谱法。准确称取1 g血橙果肉于研钵中,加入5 mL超纯水研磨成匀浆后倒入15 mL 离心管中,用1 mL超纯水刷洗研钵后一并移入离心管中,在4 ℃下,15 000 r/min离心10 min,取上清液定容于10 mL容量瓶,过0.22 μm滤膜。色谱条件:色谱柱为UMISILC18柱(260 mm×4.6 mm, 5 μm);流动相为甲醇和0.1%磷酸(体积比1∶99);流速0.8 mL/min;柱温25 ℃;检测波长为245 nm;进样量为10 μL。
(2)柠檬酸、苹果酸含量分析。参照李云康[13]的方法并略作修改。
采用高效液相色谱法。准确称取1 g血橙果肉于研钵中,加入5 mL 0.05 mol/L的KH2PO4溶液(pH=2.5)研磨成匀浆后倒入15 mL离心管中,在 4 ℃下,15 000 r/min离心10 min,取上清液用0.05 mol/L KH2PO4溶液定容于10 mL容量瓶,过0.22 μm滤膜。色谱条件:色谱柱为Venusil MP C18柱(260 mm×4.6 mm, 5 μm);流动相为甲醇和0.05 mol/L KH2PO4溶液(体积比97∶3),0.05 mol/L KH2PO4溶液用磷酸调pH至2.5;流速1 mL/min;柱温40 ℃;检测波长为210 nm;进样量为20 μL。
总糖、总酸含量及糖酸比按公式(2)、(3)、(4)计算[13]:
总糖含量/(mg·g-1)=M果糖+M葡萄糖+M蔗糖
(2)
总酸含量/(mg·g-1)=M抗坏血酸+M苹果酸+M柠檬酸
(3)
糖酸比![]()
(4)
血橙是典型的因花色苷着色的品种,花色苷的含量决定血橙果肉颜色,是血橙商业价值的重要评价指标[14]。花色苷是一类广泛的存在于植物中的色素,属于类黄酮化合物[15]。花色苷不仅赋予植物鲜艳的颜色以利于授粉和种子传播、抵抗植物虫害以及预防植物的紫外线照射损伤[16],而且对于人类具有许多生理保健功能,如清除体内自由基、抗肿瘤、抗癌、抗炎、抑制脂质过氧化和血小板凝集、保护肝脏、预防糖尿病[17]、减肥[18]、保护视力[19]等。由图1可知,整个贮藏期间,OA处理组与CK组果实花色苷的积累量均呈上升趋势。OA2、OA3处理组果实在贮藏后期(15~20 d) 花色苷积累明显,显著高于CK组(P<0.05)。

OA1-1 g/L草酸;OA2-2 g/L草酸;
OA2-5 g/L草酸;CK-对照,下同。
图1 草酸处理对血橙贮藏期间果汁总花色苷含量的影响
Fig.1 Effects of oxalic acid treatment on total anthocyanin contents in blood orange juice during storage
注:图中标注的不同字母表示在P<0.05的水平上存在显著性差异。
贮藏至20 d,OA处理组果实果汁中的花色苷含量均显著高于CK组,其中OA2、OA3处理组果实果汁花色苷积累量分别是CK组果实果汁的1.81倍和2.06倍。由此可知,适宜浓度的OA处理可以在较短的时间内显著提高血橙中的花色苷含量。这与前人的研究结果相互印证[7, 20-21]。PANNITTERI等[2]报道塔罗科血橙在4 ℃贮藏70 d,果汁中的花色苷含量可以从7.11 mg/L增加到54.44 mg/L,效果明显但所需时间较长。本研究通过OA处理后在6~8 ℃ 贮藏20 d,在较短的时间内迅速增加血橙中的花色苷含量,是一种高效、低廉、具有实际应用前景的新方法。
血橙中花色苷的代谢途径已经研究得较为成熟[3]。首先苯丙氨酸在苯丙氨酸裂解酶(PAL)作用下形成肉桂酸,经肉桂酸羟化酶(C4H)和香豆酞CoA连接酶(4CL)的催化作用生成4-香豆素-CoA,在查尔酮合成酶(CHS)和查尔酮异构酶(CHI)的催化下生成黄烷酮,再由黄烷酮-3-羟化酶(F3H)催化形成二氢黄酮醇,二氢黄酮醇是类黄酮3-羟化酶(F3′H)和类黄酮3,5-羟化酶(F3′5′H)的共同底物,这2种酶所催化的反应产物是合成花色苷的直接前体,二者经二氢黄酮醇-4-还原酶(DFR)催化形成无色矢车菊色素,经花青素合成酶(ANS)合成有色的花青素,最后在类黄酮3,5-糖苷转移酶(UFGT)的作用下催化成稳定的花色苷。花色苷在谷胱甘肽转移酶(GST)的作用下被运输至液泡中。另外,血橙花色苷的生物合成受到复合物R2R3Myb转录因子的调控,BUTELLI等[22]从血橙分离得到R2R3Myb转录因子并命名为Ruby,研究发现Ruby转录因子的表达水平和血橙中的花色苷含量具有显著的相关性。
由图2可知,贮藏至5、10和15 d,OA3处理组果实Ruby转录水平均显著高于CK组果实,OA3处理组果实中多个花色苷合成相关的结构基因(PAL,C4H和F3′5′H)转录水平均高于CK组果实。

图2 草酸处理对血橙贮藏期间花色苷
合成相关基因表达的影响
Fig.2 Effects of oxalic acid treatment on expression of anthocyanins synthesis related genes in blood orange during storage
注:* 表示在P<0.05的水平上存在显著性差异。
血橙果实中花色苷的积累受Ruby转录因子所调控,Ruby通过调控花色苷合成结构基因的表达来影响花色苷的积累[3, 16]。但是,在多个花青苷合成结构基因的转录被明显促进的同时,OA3处理组果实与对照组果实在贮藏过程中4CL,CHS,CHI,F3H,DFR,ANS,UFGT以及GST的转录水平基本没有显著差异,这一点与KEREAMY等[23]的研究结果类似。可见Ruby转录因子对花色苷合成结构基因的表达调控是1个极其复杂的过程。综合分析认为,草酸处理可以促进血橙果实花色苷积累相关的特异调控因子Ruby的转录,进而调节花色苷合成结构基因的表达,且调控的关键点位于包括PAL,C4H和F3′5′H在内的花色苷合成的前期阶段,即将苯丙氨酸转化为二氢黄酮醇的阶段,进而促进果实中花色苷的积累。
2.3.1 果糖、葡萄糖和蔗糖含量
由图3可知,血橙果实中糖组分含量最高的是蔗糖,果糖、葡萄糖和蔗糖的质量比接近1∶1∶2。

图3 草酸处理对血橙果实不同种类糖含量的影响
Fig.3 Effects of oxalic acid treatment on contents of different sugar of blood oranges during storage
注:图中标注的不同字母表示在P<0.05的水平上存在显著性差异。
在整个贮藏期间,OA处理组和CK组血橙果实果糖含量均先上升后下降,且OA处理果实中的果糖含量均高于CK组。贮藏至10 d,OA处理组果实的果糖含量均显著高于CK组;至15 d时,除OA3处理组果实的果糖含量显著高于CK外,其他浓度OA处理的果实果糖含量与CK组差异不显著;贮藏至20 d, OA1和OA3组的果糖含量显著高于CK组,其中OA3处理的果实果糖含量最高,为18.99 mg/g,CK组果实中的果糖含量为17.7 mg/g,OA2处理果实中果糖含量也略高于CK组。可见OA处理延缓了血橙果实中果糖的代谢速率,其中OA3处理组效果最显著。研究表明,草酸处理能够降低果实在贮藏期间的呼吸作用速率[5, 24]。糖作为呼吸作用代谢的底物,其含量越高则越有利于贮藏[25]。WANG等[26]研究发现草酸可以提高杏葡萄糖合成相关酶、果糖合成相关酶的活性从而提高杏中葡萄糖和果糖的含量,因此推测经OA处理的血橙果实贮藏过程中果糖含量高于CK组血橙果实,可能是因为OA处理抑制了果实中的呼吸作用速率从而延缓了果实中果糖的代谢速率,或是因为OA处理提高了果实中果糖合成相关酶的活性。
OA处理组果实葡萄糖含量总体变化趋势与CK组一致,均是先上升后下降。OA处理可使果实葡萄糖含量峰值推迟出现,OA处理组和CK组果实葡萄糖含量分别在贮藏15 d和10 d达到峰值。贮藏至20 d,OA处理组血橙果实葡萄糖含量均显著高于CK组。结果表明,OA处理延缓了血橙果实中葡萄糖的代谢速率,其中以OA3处理组效果最显著,在整个贮藏期间,OA3处理组血橙果肉中的葡萄糖含量均高于CK组。经OA处理的血橙果实贮藏过程中葡萄糖含量高于CK组血橙果实可能是因为OA处理抑制了果实中的呼吸作用速率从而延缓了果实中葡萄糖的代谢速率,或是因为OA处理提高了果实中葡萄糖合成相关酶的活性。
OA处理组蔗糖含量总体变化趋势与CK组一致,均是先上升后下降。OA处理可使果实蔗糖含量峰值推迟出现,OA处理组和CK组果实葡萄糖含量分别在贮藏至15 d和5 d达到峰值。贮藏至20 d,OA3处理组血橙果实蔗糖含量显著高于CK组。可见OA3处理组延缓了血橙果实中蔗糖的代谢速率。经OA处理组的血橙果实贮藏过程中蔗糖含量高于CK组血橙果实,可能是因为OA处理抑制了果实中的呼吸作用速率从而延缓了果实中蔗糖的代谢速率。
2.3.2 总糖含量
由图4可知,贮藏期间OA处理组及CK组的果实总糖含量均先上升后下降,这与前人的研究结果一致[27-28]。产生这种变化趋势的原因可能是果实在贮藏初期水分蒸发,果汁糖分浓缩而暂时有所提高,或是果实逐渐衰老的过程中细胞壁成分的分解引起糖分暂时升高[13],另外果实中的有机酸在代谢过程中产生糖也可能造成果实糖分的暂时增加[29],其后因为呼吸作用消耗,果实糖分不断下降。OA处理可使果实总糖含量峰值推迟出现,OA处理组和CK组果实总糖含量分别在贮藏至15 d和10 d达到峰值。血橙贮藏15 d后,OA处理组果实总糖含量均显著高于CK组;贮藏20 d后,OA1和OA2处理组血橙果肉中的总糖含量与CK组差异不显著,但均略高于CK组,OA3处理组血橙果肉中总糖含量为71.64 mg/g,显著高于CK组果实中的总糖含量(67.15 mg/g)。同时,OA组和CK组血橙果实在贮藏20 d后的总糖含量均高于果实贮藏前的总糖含量,可知贮藏20 d可以很好维持血橙果实的品质。
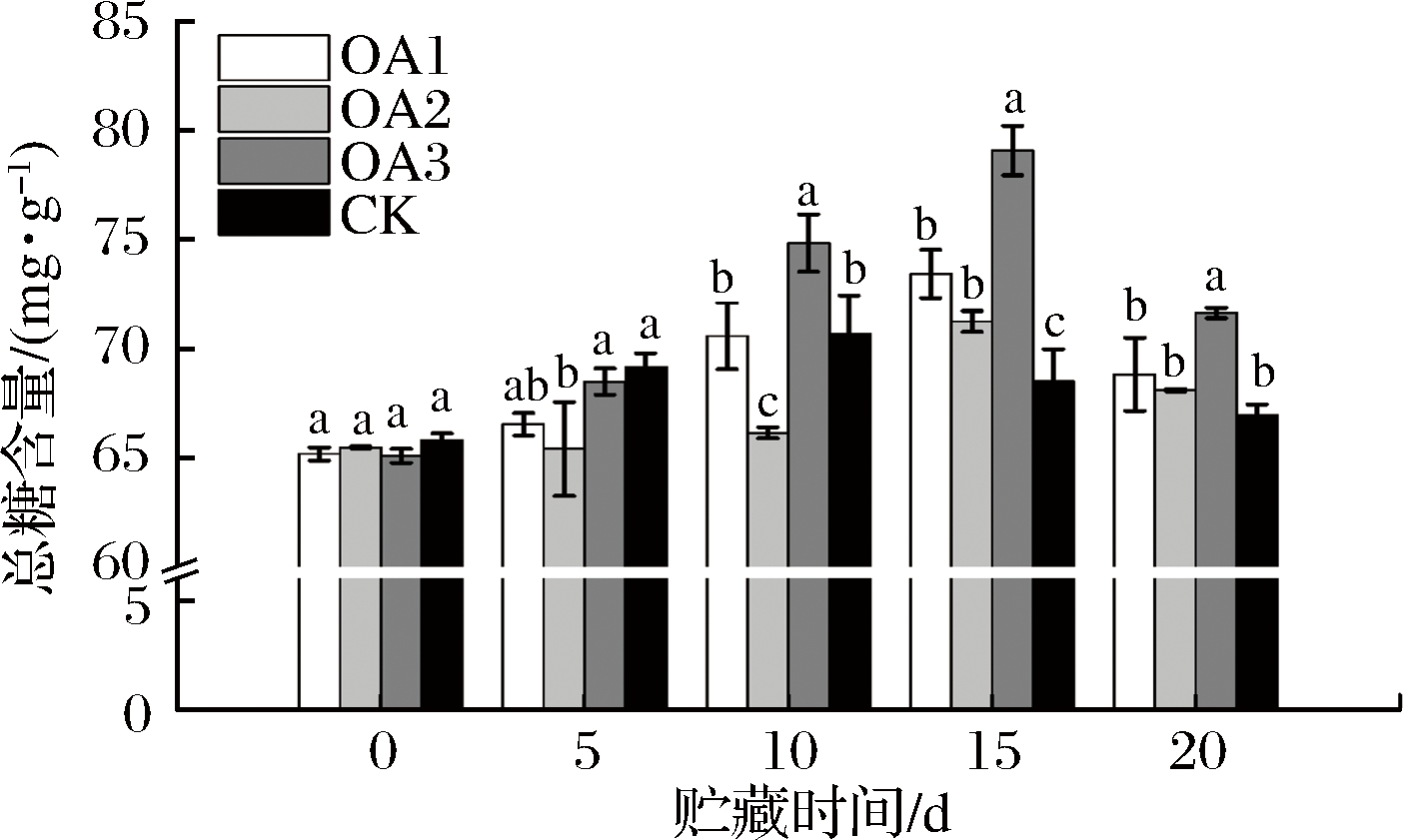
图4 草酸处理对血橙果实总糖含量的影响
Fig.4 Effects of oxalic acid treatment on total sugar contents in blood oranges during storage
注:图中标注的不同字母表示在P<0.05的水平上存在显著性差异。
2.4.1 抗坏血酸、苹果酸、柠檬酸含量
迄今为止,草酸处理对水果贮藏过程中有机酸含量影响的报道较少且机理有待进一步深入研究。薛锡佳等[24]报道草酸处理延缓了杧果果实在低温胁迫下柠檬酸的下降速率,草酸处理对低温胁迫下杧果果实的苹果酸和酒石酸含量影响复杂,有待进一步深入研究。
由图5可知,血橙果实中主要的有机酸是柠檬酸,抗坏血酸和苹果酸均为微量酸。在贮藏期间,OA1、OA3处理组以及CK组血橙果实抗坏血酸含量呈波动状态,OA2处理组血橙果实抗坏血酸含量先升高后降低。贮藏至15 d,OA1处理组血橙果实抗坏血酸含量显著高于CK组,OA2、OA3处理组血橙果实抗坏血酸含量与CK组差异不显著;贮藏至20 d,OA3处理组血橙果实抗坏血酸含量与CK组差异不显著,但略低于CK组,OA1和OA2处理组血橙果实抗坏血酸含量均显著低于CK组。

图5 草酸处理血橙果实不同种类酸含量的影响
Fig.5 Effects of oxalic acid treatment on contents of different organic acids of blood oranges during storage
注:图中标注的不同字母表示在P<0.05的水平上存在显著性差异。
OA2处理组以及CK组血橙果实在贮藏期间苹果酸含量均先升高后降低,OA1处理组血橙果实在贮藏期间苹果酸含量呈波动状态,OA3处理组血橙果实苹果酸含量在贮藏期间一直下降。贮藏至15 d,OA1处理组血橙果实抗坏血酸含量与CK组差异不显著,但含量略低于CK组,OA2和OA3处理组血橙果实抗坏血酸含量显著低于CK组;贮藏至20 d,OA1处理组血橙果实苹果酸含量与CK组差异不显著,OA2和OA3处理组血橙果实苹果酸含量显著低于CK组。可知OA处理可能会在一定程度上加快血橙果实苹果酸的代谢。柑橘在贮藏的过程中有机酸会降解合成糖[29]。因此推测草酸可能是通过增强果糖、葡萄糖合成相关酶的活性促进了果糖、葡萄糖的合成[26]从而间接加速了苹果酸的代谢。
CK组血橙果实柠檬酸含量在贮藏期间先升高后降低,OA处理组血橙果实柠檬酸含量在贮藏期间呈波动状态。贮藏至15 d,OA1处理组血橙果实柠檬酸含量与CK组差异不显著,OA2和OA3处理组柠檬酸含量均显著低于CK组;贮藏至20 d,OA处理组血橙果实柠檬酸含量均高于CK组,其中OA3处理组血橙果实柠檬酸含量显著高于CK组,OA1、OA2处理组与CK组差异不显著。
2.4.2 总酸含量
由图5可知,贮藏期间CK组血橙果实总酸含量先升高后降低,OA处理组血橙果实总酸含量呈波动状态。贮藏至15 d,OA1处理组血橙总酸含量与CK组差异不显著,OA2和OA3处理组血橙果实总酸含量均显著低于CK组;贮藏至20 d,OA处理血橙果实总酸含量与CK组差异均不显著,但略高于CK组。有关OA处理对血橙贮藏过程中有机酸代谢的影响比较复杂,还需进一步的研究。
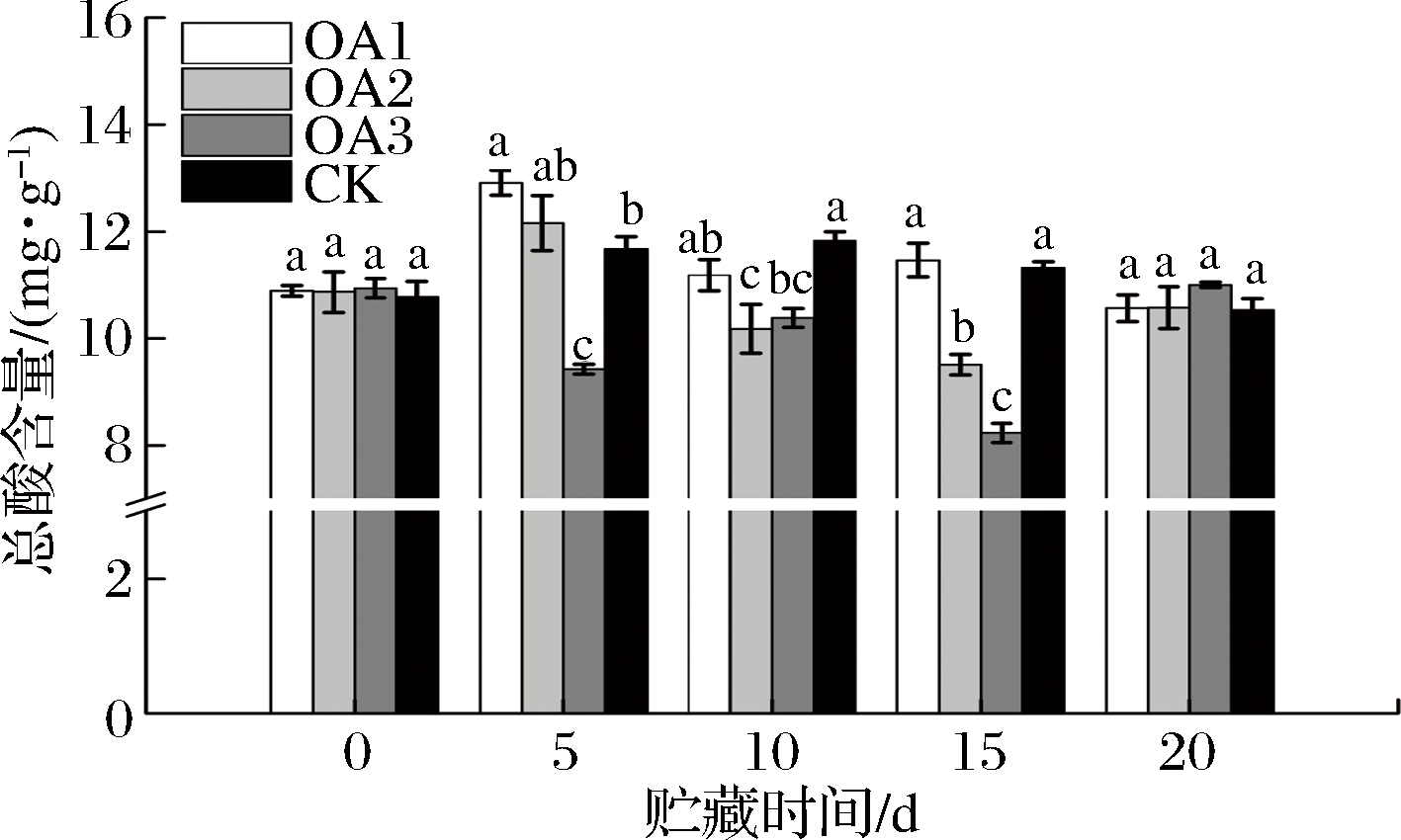
图6 草酸处理对血橙果实总酸含量的影响
Fig.6 Effects of oxalic acid treatment on total acid contents in blood oranges during storagee
注:图中标注的不同字母表示在P<0.05的水平上存在显著性差异。
果实的口感很大程度上取决于糖酸比值。由图7可知,贮藏至15 d,OA2和OA3处理组血橙果实糖酸比均显著高于CK组,OA1处理组血橙果实糖酸比与CK组差异不显著,但略高于CK组;贮藏至第20天,OA处理组血橙果实糖酸比与CK组糖酸比差异不显著,但OA处理组血橙果实糖酸比均略高于CK组。可见,OA处理可以在一定程度上提高血橙在贮藏过程中的糖酸比。
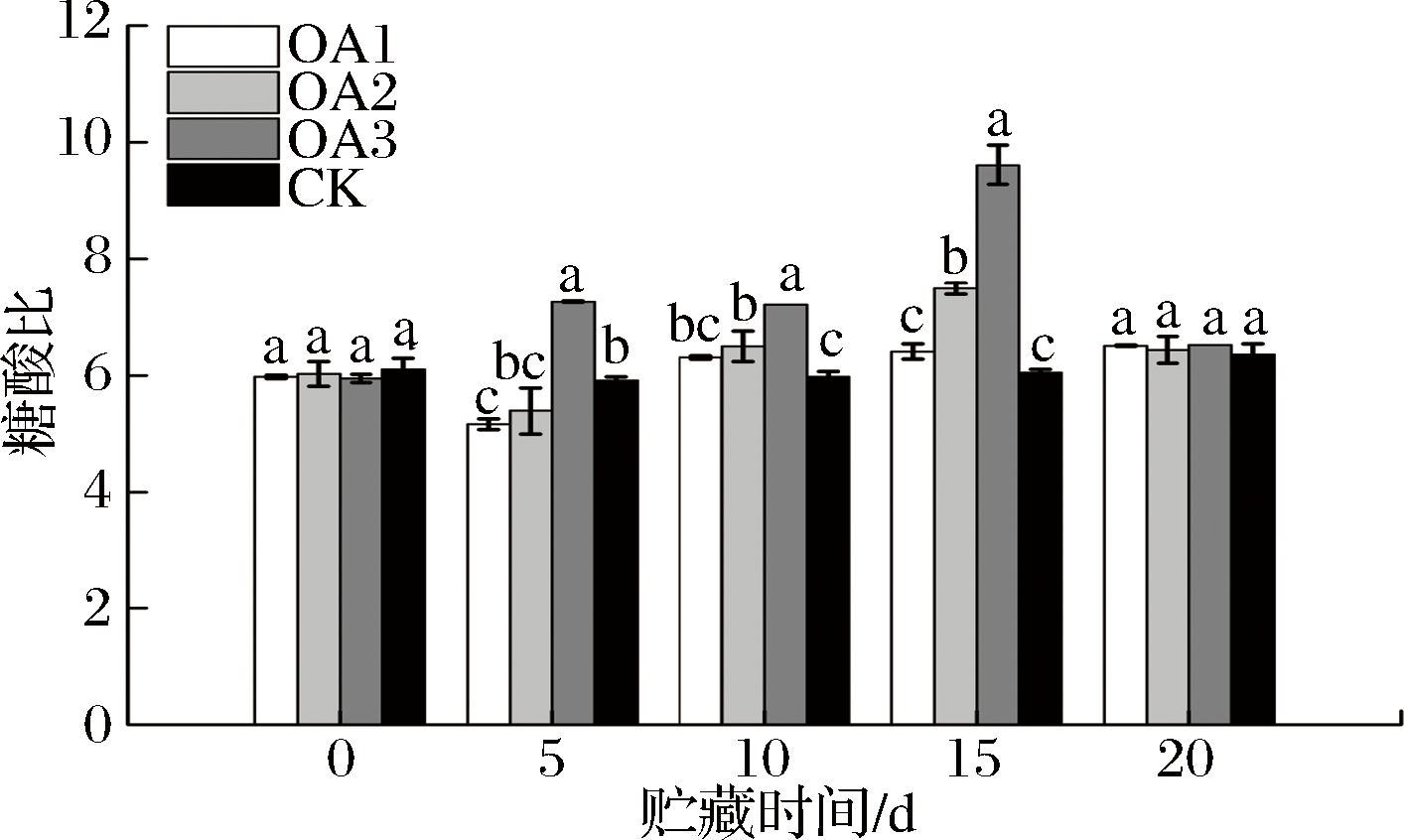
图7 草酸处理对血橙果实糖酸比的影响
Fig.7 Effects of oxalic acid treatment on sugar/acid ratio in blood oranges during storage
注:图中标注的不同字母表示在P<0.05的水平上存在显著性差异。
由表1可知血橙在贮藏过程中果实中的花色苷、可溶性糖、有机酸的相关性。花色苷含量与果糖、总糖的正相关性显著,相关系数分别为0.540和0.463,与葡萄糖、蔗糖的正相关性不显著。
表1 皮尔逊相关系数
Table 1 Pearson correlation
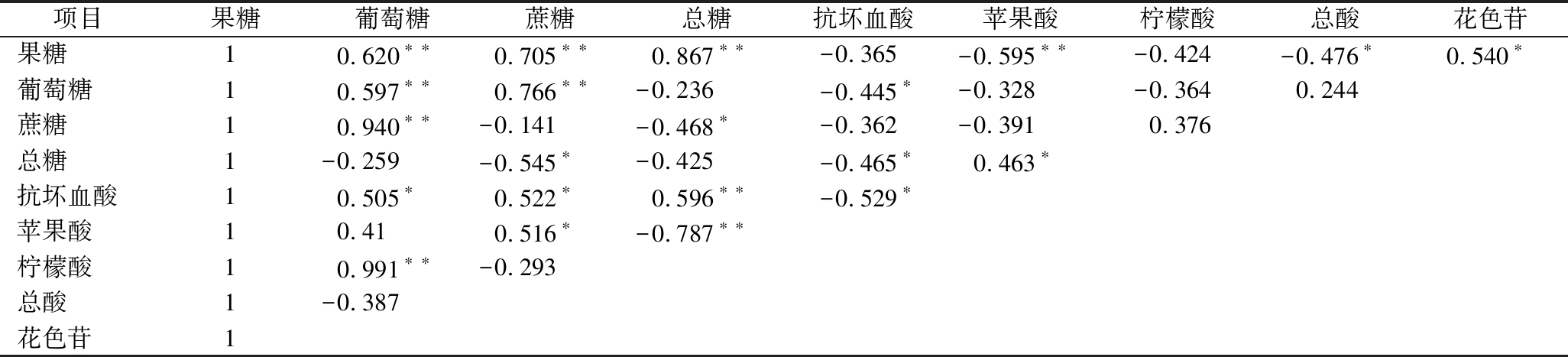
项目果糖葡萄糖蔗糖总糖抗坏血酸苹果酸柠檬酸总酸花色苷果糖10.620∗∗0.705∗∗0.867∗∗-0.365-0.595∗∗-0.424-0.476∗0.540∗葡萄糖10.597∗∗0.766∗∗-0.236-0.445∗-0.328-0.3640.244蔗糖10.940∗∗-0.141-0.468∗-0.362-0.3910.376总糖1-0.259-0.545∗-0.425-0.465∗0.463∗抗坏血酸10.505∗0.522∗0.596∗∗-0.529∗苹果酸10.410.516∗-0.787∗∗柠檬酸10.991∗∗-0.293总酸1-0.387花色苷1
注:**表示在0.01水平(双侧)上显著相关;*表示在0.05水平(双侧)上显著相关。
糖是合成花色苷的原料,不仅可以通过糖代谢途径影响花色苷的合成[30],还作为信号分子,通过特异的信号转导途径调节花色苷合成相关酶基因的表达而影响果实着色[31]。实验证明,蔗糖可通过特异的信号转导途径诱导西兰花芽苗中花色苷合成相关酶基因上调表达从而提高其花色苷的含量[32]。NETA-SHARIR等[33]研究发现糖可通过己糖激酶磷酸化相关的信号转导途径促进矮牵牛花冠中花色苷合成,上调花色苷合成相关酶基因的表达。本研究结果表明,草酸处理能够提高血橙在贮藏过程中的花色苷、果糖、葡萄糖、蔗糖含量,草酸可能是通过提高血橙果实中的蔗糖、葡萄糖、果糖含量使总糖含量增大,进而使果实中合成花色苷的原料增多,或是通过提高血橙中可溶性糖的含量刺激了特异的信号转导途径,诱导Ruby,PAL,C4H和F3′5′H基因的上调表达从而达到增加血橙中花色苷含量的效果。
由表1可知花色苷含量与抗坏血酸含量呈显著负相关关系,相关系数为-0.529,与苹果酸含量呈极显著负相关关系,相关系数为-0.787,与柠檬酸含量和总酸的负相关性不显著。目前关于果实中有机酸与花色苷代谢相关性的研究较少,很多研究集中在pH值与花色苷提取液稳定性之间的关系方面。酸一方面调节液泡的pH,影响花色苷的稳定性,另一方面花色苷合成过程中的各种酶需要在1个合适的pH值条件下起催化作用。细胞内pH值的改变可以使一些酶激活或增加活性[34]。在本研究中,草酸处理会在一定程度上加快血橙果实苹果酸的代谢速率,对柠檬酸和抗坏血酸代谢的影响比较复杂。因为柑橘中主要的酸是柠檬酸,抗坏血酸和苹果酸都是微量酸,因此草酸是否通过降低果实中的苹果酸含量促进血橙果实花色苷的积累还有待进一步验证。
草酸处理能够显著促进血橙贮藏过程中花色苷的积累,诱导花色苷合成相关基因Ruby,PAL,C4H和F3′5′H上调表达,延缓果实果糖、葡萄糖、蔗糖的代谢速率,增加果实中的总糖含量从而改善果实的品质,但是草酸处理会在一定程度上加快血橙果实苹果酸的代谢速率,对柠檬酸和抗坏血酸代谢的影响比较复杂,还需要进一步研究。另外,草酸处理会增大果实在贮藏期间的糖酸比,让果实的口感更佳。草酸处理能够提高果实中花色苷含量可能是因为草酸处理提高了果实中花色苷合成相关基因的表达量,或是因为草酸处理提高了果实中可溶性糖(果糖、葡萄糖、蔗糖)的含量从而间接促进了果实中花色苷的积累。本研究结果对于指导塔罗科血橙贮藏保鲜具有一定的实际意义,同时也为草酸的进一步应用提供了理论支撑。
[1] 曹少谦,潘思轶,姚晓琳,等. 柱层析法分离纯化血橙花色苷[J]. 中国农业科学, 2009,42(5):1 728-1 736.
[2] PANNITTERI C, CONTINELLA A, LO-CICERO L, et al. Influence of postharvest treatments on qualitative and chemical parameters of Tarocco blood orange fruits to be used for fresh chilled juice[J]. Food Chemistry, 2017, 230:441-447.
[3] CARMONA L, ALQUÉZAR B, MARQUES V V, et al. Anthocyanin biosynthesis and accumulation in blood oranges during postharvest storage at different low temperatures[J]. Food Chemistry, 2017,237:7-14.
[4] 刘锴栋,袁长春,敬国兴,等. 外源草酸对采后番荔枝后熟及耐藏性的影响[J]. 食品科学, 2013(14):329-334.
[5] 郑小林. 外源草酸对水果的保鲜效应及其机制研究进展[J]. 果树学报, 2010,27(4):605-610.
[6] ZHENG X, TIAN S, GIDLEY M J, et al. Effects of exogenous oxalic acid on ripening and decay incidence in mango fruit during storage at room temperature[J]. Postharvest Biology and Technology, 2007,45(2):281-284.
[7] SHAFIQUE M, KHAN A S, MALIK A U, et al. Exogenous application of oxalic acid delays pericarp browning and maintain fruit quality of Litchi cv. “Gola”[J]. Journal of Food Biochemistry, 2016, 40(2):170-179.
[8] 梁春强,吕茳,靳蜜静,等. 草酸处理对采后猕猴桃冷害、抗氧化能力及能荷的影响[J]. 园艺学报, 2017(2):279-287.
[9] 曹少谦. 血橙花色苷结构及其在加工过程中的降解机制研究[D]. 武汉:华中农业大学, 2009.
[10] CRIF T, PETRONE G, LO CICERO L, et al. Short cold storage enhances the anthocyanin contents and level of transcripts related to their biosynthesis in blood oranges[J]. Journal of Agricultural and Food Chemistry, 2011,60(1):476-481.
T, PETRONE G, LO CICERO L, et al. Short cold storage enhances the anthocyanin contents and level of transcripts related to their biosynthesis in blood oranges[J]. Journal of Agricultural and Food Chemistry, 2011,60(1):476-481.
[11] ALBERTINI M, CARCOUET E, PAILLY O, et al. Changes in organic acids and sugars during early stages of development of acidic and acidless citrus fruit[J]. Journal of Agricultural and Food Chemistry, 2006,54(21):8 335-8 339.
[12] 江海,吴今人,李新生,等. 陕西柑橘主产区13种推广品种维生素C含量分析[J]. 生物资源, 2014, 36(2):59-63.
[13] 李云康.柑橘特征糖酸组成及其与果汁褐变关系研究[D]. 武汉:华中农业大学, 2006.
[14] LEE H S. Characterization of major anthocyanins and the color of red-fleshed budd blood orange (Citrus sinensis)[J]. Agric Food Chem, 2002, 50(5):1 243-1 246.
[15] WANG J, LIU J, CHEN K, et al. Anthocyanin biosynthesis regulation in the fruit ofCitrus sinensis cv. tarocco[J]. Plant Molecular Biology Reporter, 2016,34(6):1 043-1 055.
[16] LO PIERO A R. The state of the art in biosynthesis of anthocyanins and its regulation in pigmented sweet oranges [(Citrus sinensis) L. Osbeck][J]. Journal of Agricultural and Food Chemistry, 2015,63(16):4 031-4 041.
[17] KONG J, CHIA L S, GOH N K, et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry, 2003,64(5):923-933.
[18] TSUDA T, HORIO F, UCHIDA K, et al. Dietary cyanidin 3-O-β-D-glucoside-rich purple corn color prevents obesity and ameliorates hyperglycemia in mice[J]. Journal of Nutrition, 2003, 133(7):2 125-2 130.
[19] 孙建霞,张燕,胡小松,等. 花色苷的结构稳定性与降解机制研究进展[J]. 中国农业科学, 2009(3):996-1 008.
[20] SAYYARI M, VALERO D, BABALAR M, et al. Prestorage oxalic acid treatment maintained visual quality, bioactive compounds, and antioxidant potential of pomegranate after long-term storage at 2 ℃[J]. Journal of Agricultural and Food Chemistry, 2010,58(11):6 804-6 808.
[21] MART NEZ-ESPL
NEZ-ESPL A, ZAPATA P J, VALERO D, et al. Preharvest application of oxalic acid increased fruit size, bioactive compounds, and antioxidant capacity in sweet cherry cultivars (Prunus avium L.)[J]. Journal of Agricultural and Food Chemistry, 2014,62(15):3 432-3 437.
A, ZAPATA P J, VALERO D, et al. Preharvest application of oxalic acid increased fruit size, bioactive compounds, and antioxidant capacity in sweet cherry cultivars (Prunus avium L.)[J]. Journal of Agricultural and Food Chemistry, 2014,62(15):3 432-3 437.
[22] BUTELLI E, LICCIARDELLO C, ZHANG Y, et al. Retrotransposons control fruit-specific, cold-dependent accumulation of anthocyanins in blood oranges[J]. Plant Cell, 2012, 24(3):1 242-1 255.
[23] KEREAMY A E, CHERVIN C, SOUQUET J M, et al. Ethanol triggers grape gene expression leading to anthocyanin accumulation during berry ripening[J]. 2002,163(3):449-454.
[24] 薛锡佳,李佩艳,宋夏钦,等. 草酸处理减轻杧果采后果实冷害的机理研究[J]. 园艺学报, 2012,39(11):2 251-2 257.
[25] 和银霞,李卫东,叶丽琴,等. 采前喷钙对贮藏期欧李果实腐烂率及糖酸含量的影响[J]. 食品科学, 2016,37(14):247-252.
[26] WANG Zhen, CAO Jiankang, JIANG Weibo. Changes in sugar metabolism caused by exogenous oxalic acid related to chilling tolerance of apricot fruit[J]. Postharvest Biology and Technology, 2016,114:10-16.
[27] MATSUMOTO H, IKOMA Y. Effect of different postharvest temperatures on the accumulation of sugars, organic acids, and amino acids in the juice sacs of Satsuma mandarin (Citrus unshiu Marc.) fruit[J]. Journal of Agricultural and Food Chemistry, 2012,60(39):9 900-9 909.
[28] KAEWSUKSAENG S, URANO Y, AIAMLA-OR S, et al. Effect of UV-B irradiation on chlorophyll-degrading enzyme activities and postharvest quality in stored lime (Citrus latifolia Tan.) fruit[J]. Postharvest Biology and Technology, 2011,61(2-3):124-130.
[29] ECHEVERRIA E, VALICH J. Enzymes of sugar and acid metabolism in stored ‘Valencia’ oranges[J]. Journal of the American Society for Horticultural Science, 1989, 114(3):445-449.
[30] 葛翠莲,黄春辉,徐小彪. 果实花青素生物合成研究进展[J]. 园艺学报, 2012,39(9):1 655-1 664.
[31] 程海燕,李德红. 光、糖与激素影响植物花色素苷合成与积累的研究进展[J]. 亚热带植物科学, 2010(3):82-86.
[32] GUO R, YUAN G, WANG Q. Sucrose enhances the accumulation of anthocyanins and glucosinolates in broccoli sprouts[J]. Food Chemistry, 2011,129(3):1 080-1 087.
[33] NETA-SHARIR I, SHOSEYOV O, WEISS D. Sugars enhance the expression of gibberellin-induced genes in developing petunia flowers[J]. Physiologia Plantarum, 2000,109(2):196-202.
[34] 刘玉莲,车飞,王海,等. 苹果果实中糖、酸和花青苷的组分及含量特征分析[J]. 西北林学院学报, 2016(6):236-242.