黑曲霉SP7-2固态发酵产生淀粉糖化酶工艺优化
朱强1,王瑞鑫2,吴铖迪2,夏艳秋2*
1 (江苏省海洋资源开发研究院,江苏 连云港,222005) 2 (淮海工学院,江苏省海洋生物技术重点建设实验室,江苏 连云港,222005)
摘 要实验以生淀粉糖化酶活力为考察指标,采用单因素实验结合正交设计探索SP7-2固态发酵产生淀粉糖化酶优化工艺。结果表明,麸皮为基质,复配20% (质量分数)豆饼粉,料水比1∶1.1(g∶mL),添加0.3% (质量分数)植酸,初始pH自然,每24 h翻抛1次,双控温培养60 h。上述条件下,30 L固态发酵罐中生淀粉糖化酶活力为7 870 U/g,是优化前的1.31倍。该结果为生料酒曲的制备及生料酿酒提供了一定的实验数据及理论指导。
关键词黑曲霉;生淀粉糖化酶;固态发酵
生料酿酒采用无蒸煮技术,可节约总能耗的30%~40%,是酿酒业实施节能降耗的重要举措[1-2],已引起人们的广泛关注[3-7],必将带来酿酒业的颠覆性变革。生淀粉糖化酶(raw starch-digesting glucoamylase,RSGA)无疑是实现生料酿酒的先决条件也是关键技术[8-9]。现行的生淀粉糖化酶主要由微生物产生[9-26],而适用于生料酿酒的生淀粉糖化酶源只有霉菌,目前已报道的主要有曲霉[16-21]、根霉[22-23]和青霉[24-26],然而在其制曲工艺中,由于多采用恒温培养,未遵循微生物生长代谢规律,未重视促酵剂的使用,对生产实际考虑不周等,导致制曲周期长、成曲酶活力低,严重阻碍其推广应用。黑曲霉SP7-2为课题组通过自然分离结合诱变育种选育获得的酒用生淀粉糖化酶优良菌株[20],其生淀粉糖化酶活力高、复合酶系协同作用强,初步用于黄酒生料酿造显示出一定的优越性,有望成为生料酿酒的重要生产菌株。试验拟通过固态发酵技术探索黑曲霉SP7-2产酶优化工艺,并研究其放大生产性能,旨在为实现对生淀粉糖化酶产生菌生理特征和生料曲制备的深入研究,并进一步推动对现行生料酿酒工艺体系的技术升级和改造以提供试验科学依据。
1 材料与方法
1.1 材料
黑曲霉(Aspergillus.niger)SP7-2:课题组选育,本研究室保藏。
麸皮:市售,当年新鲜小麦麸皮,水分12.3%(质量分数),40~60目。
1.2 方法
1.2.1 种曲制备
麸皮∶水=1∶1.2(g∶mL)配料,添加适量营养盐,拌匀,润料2 h,121 ℃湿热灭菌40 min,冷却至30 ℃,按麸皮质量10%接种SP7-2单孢子悬浮液(悬浮液孢子密度1.0×108CFU/mL),32 ℃培养3 d左右,38~40 ℃ 热风烘干。
1.2.2 固态发酵基础条件[20]
250 mL三角瓶装10 g麸皮,料水比1∶1.2(g∶mL),pH自然,拌匀,润料,灭菌,冷却,按麸皮质量0.3%接种SP7-2种曲(种曲孢子密度1×1010CFU/g),180 r/min、32 ℃培养3 d,烘干。
1.2.3 生淀粉糖化酶活力测定[15]
发酵结束,三角瓶固体培养物中加入100 mL蒸馏水,40 ℃水浴振荡浸提1 h,过滤得粗酶液。5 mL离心管中分别加入1 mL底物(用0.1 mol/L、pH 4.6的醋酸缓冲液新鲜配制的质量分数为2%生玉米淀粉悬浮液)、1 mL适当稀释的酶液,40 ℃、180 r/min水浴振荡反应1 h,加入2 mol/L NaOH溶液0.1 mL终止反应,反应液5 000 r/min 离心10 min,取上清液测定还原糖的量。定义:在上述分析条件下,1 min水解生淀粉产生1 μg还原糖(以葡萄糖计)的酶量为1个酶活力单位(U)。
1.2.4 工艺优化
试验比较碳、氮源,水分,促酵剂(植酸),pH值,温度,通风等因素对SP7-2固态发酵产酶的影响,优化其产酶工艺条件。
1.2.5 放大试验
30 L固态发酵罐,装料系数65%,按照1.2.4优化工艺参数固态发酵,探讨30L固态发酵罐中SP7-2生长繁殖与代谢产酶规律,确定发酵终点,并适当调整工艺参数。
2 结果与分析
2.1 最适培养基质的确定
表1表明,培养基质对SP7-2菌株生长繁殖及产酶的影响较大,其中,最适宜的固态发酵基质是麸皮,其次是大米和小麦。考虑到经济因素,不宜采用大米和小麦。因此,后续试验均采用麸皮为SP7-2菌株固态发酵产RSGA基质。
表1 培养基质对SP7-2固态发酵的影响
Table 1 Effects of different matrixes on SP7-2 by SSF
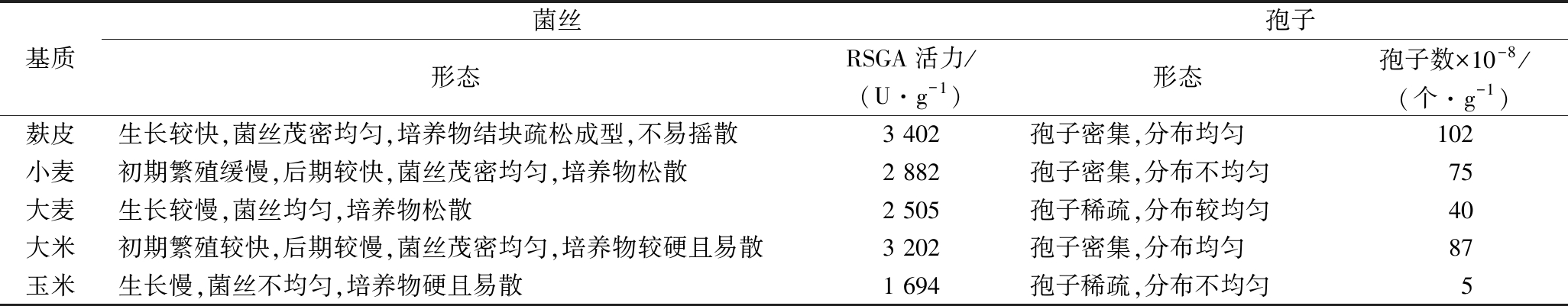
基质菌丝孢子形态RSGA活力/(U·g-1)形态孢子数×10-8/(个·g-1)麸皮生长较快,菌丝茂密均匀,培养物结块疏松成型,不易摇散3 402孢子密集,分布均匀102小麦初期繁殖缓慢,后期较快,菌丝茂密均匀,培养物松散2 882孢子密集,分布不均匀75大麦生长较慢,菌丝均匀,培养物松散2 505孢子稀疏,分布较均匀40大米初期繁殖较快,后期较慢,菌丝茂密均匀,培养物较硬且易散3 202孢子密集,分布均匀87玉米生长慢,菌丝不均匀,培养物硬且易散1 694孢子稀疏,分布不均匀5
2.2 最适料水比的确定
由表2可知,料水比对SP7-2菌株生长繁殖及产酶的影响是显著的。在一定范围内,随料水比的增加,酶活力呈现先增加后降低的趋势,而孢子数却呈现递增趋势。当料水比较低时,营养菌丝生长慢且不发达,培养物中心含有明显的未被消耗的淀粉颗粒,酶活力及孢子数均较低。而料水比过高时,由于营养菌丝前期生长快,使得培养物中心易积聚高温,出现烂心和表面凝结水现象,从而促进气生菌丝及分生孢子产生,导致酶活力急剧下降。因此,后续试验SP7-2菌株固态发酵产RSGA料水比为1∶1.1(g∶mL),制备种子料水比为1∶1.2(g∶mL)。
表2 料水比对SP7-2固态发酵的影响
Table 2 Effects of different water cotents on SP7-2 by SSF

料水比(g∶mL)菌丝孢子 形态RSGA活力/(U·g-1)形态 孢子数×10-8/(个·g-1)1∶0.8生长慢,菌丝不均匀,培养物松散1 863孢子稀疏,分布不均匀51∶0.9生长慢,菌丝较均匀,培养物松散2 245孢子稀疏,分布不均匀241∶1.0生长较慢,菌丝均匀,培养物较松散2 574孢子稀疏,分布较均匀531∶1.1生长较快,菌丝茂密均匀,培养物结块疏松,不易摇散3 624孢子较密集,分布均匀601∶1.2生长较快,菌丝茂密均匀,培养物结块疏松,不易摇散3 402孢子密集,分布均匀1021∶1.3初期生长快,后期慢,菌丝茂密均匀,培养物结块紧密2 031孢子密集,分布均匀116
2.3 复配氮源的确定
由表3可以看出,复配氮源可提高SP7-2菌株RSGA的活力,且有机氮优于无机氮,豆饼粉优于蛋白胨。(NH4)2SO4作为复配氮源,孢子数得到较大提高。
表3 复配氮源对SP7-2固态发酵的影响
Table 3 Effects of different nitrogen sources on SP7-2 by SSF
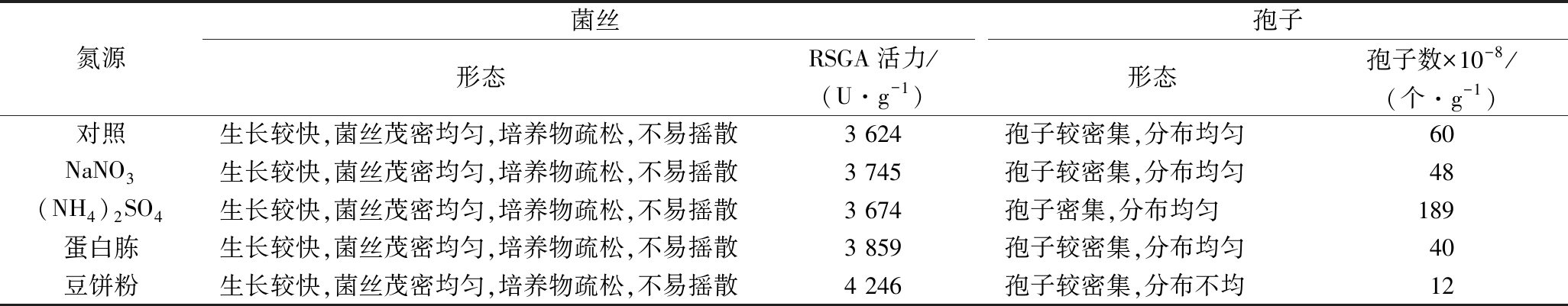
氮源菌丝孢子形态RSGA活力/(U·g-1)形态孢子数×10-8/(个·g-1)对照生长较快,菌丝茂密均匀,培养物疏松,不易摇散3 624孢子较密集,分布均匀60NaNO3生长较快,菌丝茂密均匀,培养物疏松,不易摇散3 745孢子较密集,分布均匀48(NH4)2SO4生长较快,菌丝茂密均匀,培养物疏松,不易摇散3 674孢子密集,分布均匀189蛋白胨生长较快,菌丝茂密均匀,培养物疏松,不易摇散3 859孢子较密集,分布均匀40豆饼粉生长较快,菌丝茂密均匀,培养物疏松,不易摇散4 246孢子较密集,分布不均12
因此,SP7-2菌株固态发酵产RSGA时可适当配比20%~30%(质量分数)豆饼粉,以提高酶活力。制备种子时,则可以酌情补充0.2%~1%(质量分数)(NH4)2SO4,以提高孢子数。
2.4 培养条件的优化
以麸皮∶豆饼粉=1∶0.2(g∶g),料水比1∶1.1(g∶mL),按表4因素水平设计L934正交试验,考察SP7-2菌株固态发酵产RSGA优化的工艺条件,试验结果及方差分析分别见表4和表5。
表4 L934影响因子正交试验因素水平及结果
Table 4 Factors, levels and results of L934 multi-analysis test

实验号因素水平考察指标植酸质量分数/%初始pH培养温度/℃翻抛间隔/hRSGA活力/(U·g-1)11(0.1)1(4.0)1(恒温32)1(12)3 865212(5.0)2(恒温35)2(24)3 652313(6.0)3(双控温)3(36)4 64542(0.2)1233 373522314 749623124 31673(0.3)1325 253832134 374933213 565k14 054.04 163.74 185.04 059.7k24 146.04 258.33 530.04 407.0k34 397.34 175.34 882.34 130.7R343.394.71 352.3347.3
注:双控温指前期10~12 h,恒温32 ℃;中期至培养结束,恒温35 ℃。
表5 L934影响因子正交试验方差分析
Table 5 Analysis of variance of L934 multi-analysis test

因素偏差平方和自由度F比F临界值显著性植酸用量189 510.220.243.1初始pH15 986.920.023.1培养温度2 744 104.223.483.1∗翻抛间隔202 041.620.253.1误差3 151 642.98
注:*代表差异显著,P<0.01。
由表4直观分析可知,SP7-2菌株固态发酵产RSGA工艺条件中,培养温度影响最大(方差分析显示影响显著,见表5),其次为翻抛间隔及植酸用量,初始pH影响最小,正交试验所得优化工艺条件为:采取双控温培养、每24 h翻抛1次,添加0.3%(质量分数)植酸,初始pH 5.0。以此优化工艺固态培养所得RSGA平均值为5594 U/g。
2.5 发酵终点的确定(30 L固态发酵罐)
由图1可明显看出,SP7-2菌株固态发酵过程可分为3个特征阶段:孢子萌发(0~12 h)、菌丝生长繁殖(12~60 h)、产孢子(60~120 h)。在此生长规律下,RSGA活力呈现先增加后降低的趋势。在培养至60 h时,酶活力最高,为7 870 U/g。随着孢子的大量生成,酶活力则急剧下降。据此,确定SP7-2菌株固态发酵产RSGA的发酵终点为60 h。若制备种子,则培养至120 h较佳。
3 结论和讨论
温度通过影响微生物体内酶的表达与分泌,从而影响微生物生长与代谢。由于不同种类微生物生长繁殖所需温度不同,即使同一种微生物在不同的生理时期、对于不同的代谢产物所需温度亦不同。因此,探索适宜的培养温度是微生物培养过程中最重要的工作。试验发现,SP7-2菌株孢子萌发最适温度32 ℃,菌丝生长最适温度35 ℃,孢子形成最适温度37 ℃,与SP7-2菌株生长规律的阶段性特征高度相似。试验还发现,随着菌丝的生长繁殖,SP7-2产RSGA活力亦大幅增加,RSGA活力上升与菌丝生长繁殖回归方程为y=1 033.4x-1 656.6(R2 = 0.822 6,12~60 h,菌丝生长繁殖期,x为孢子数,y为RSGA活力),呈现显著线性关系。
特别值得一提的是,SP7-2菌株菌丝生长到顶囊即将形成时RSGA活力最高。伴随着气生孢子的大量产生,RSGA活力则急剧下降,RSGA活力下降与孢子生成回归方程为y=-50.713x + 7 742.5(R2 = 0.912 2,60~120 h,产孢子期,x为孢子数,y为RSGA活力),呈现极显著线性关系。据此,判断营养菌丝是RSGA的主要来源,气生菌丝或分生孢子梗RSGA活力甚低或根本没有。此判据可作为工业制曲过程中RSGA活力在线检测分析的重要形态指标,从而免去了繁琐的理化指标测定。
以上动力学特征分析表明,RSGA属偶联型产物,其与SP7-2菌株的菌丝生长是同步的。因此,可通过提高SP7-2菌丝生长速度或增加菌体浓度来提高产量。据此,试验采取阶段式双控温培养:前期0~12 h恒温32 ℃促进孢子萌发,中期12~60 h升温至35 ℃间歇翻抛,促进营养菌丝生长及酶的积累,一旦菌丝顶囊即将形成(约60 h),立刻升温至40 ℃热风烘干。结果表明,采用此双控温培养,可显著提高RSGA活力,并能大大缩短产酶周期,且镜检发现菌丝柄比恒温培养的粗短。
麸皮约含20%(质量分数)淀粉,还富含矿物质和维生素等生长因子,不仅为微生物生长繁殖提供必需的营养素,还可作为缓冲成分或促酵剂等维持适宜的生理pH范围或提高酶活力。麸皮疏松透气,作为主要固态发酵基质,结合适时翻抛,可为好氧菌的旺盛繁殖提供足够的氧气,是SP7-2菌株生长繁殖及发酵产酶的优良基质,可单独使用或适当追加氮源等营养。由于麸皮(或与豆饼粉的混合物)自身pH为5.0~6.0, 实际固态发酵过程中,可采取自然pH,从而简化制曲工艺。
特别值得关注的是,在培养基中添加微量的植酸可大大提高SP7-2菌株固态发酵RSGA产量与活力。植酸是一种表面活性剂,其促进酶产量与活力增加的原因主要是通过提高菌丝细胞膜通透性,从而提高氧的传递速度及基质中营养供给与细胞的吸收,进而提高微生物酶的表达与分泌[27]。前期试验发现,植酸作为促酵剂可显著提高黄曲霉糖化酶活力[28],用于黑曲霉SP7-2菌株固态发酵产RSGA亦显示积极效应。
综上,试验确定SP7-2菌株固态发酵产RSGA优化工艺为:麸皮为基质,复配20%(质量分数)豆饼粉,料水比1∶1.1(g∶mL),添加0.3%(质量分数)植酸,初始pH自然,每24 h翻抛1次,采取双控温培养60 h。在此优化工艺条件下,30 L固态发酵罐中RSGA活力为7 870 U/g,是优化前的1.31倍。
黑曲霉SP7-2产RSGA活力的提高无疑给生料酿酒业又提供了一个重要的酶源,然而,其用于生料酿酒还需解决诸多如多菌种协调配比、用量、温控、后处理等重要技术问题。因此,继续采用高新技术研究SP7-2菌株生料曲的制备,探索其生料酿酒工艺对推动生料酿酒业的快速高质发展有重大的现实意义。
参考文献
[1] 黄平,刘义刚,于明华.生料酿酒技术[M].北京:中国轻工业出版社,2001:260-415.
[2] ROBERTSON G H,WONG D W S,LEE C C,et al. Native or raw starch digestion: A key step in energy efficient biorefining of grain[J]. J Agric Food Chem,2006,54(2):353-365.
[3] 李立平,吴冬志,孙伟,等.无蒸煮酒精发酵生产技术探讨[J].轻工标准与质量,2016(6):40;44.
[4] 王洪,罗惠波,廖玉琴,等.多粮生料酿酒工艺的研究[J].中国酿造,2017,36(6):38-41.
[5] 奕水明,钱文捷,钱非,等.生料酿酒在黄酒生产过程中的研究与应用前景[J].酿酒科技,2016(4):111-115.
[6] 王瑛,喻恩森,张捷,等.玉米生料酿酒工艺优化及设备选型的研究[J].湖北农业科学,2014,53(21):5 230-5 233.
[7] 黄壹杨,刘琨毅,王琪,等.基于响应面法优化红豆米酒发酵工艺的研究[J].食品与发酵工业,2018,44(5):130-134.
[8] 王静,翟璐,张销寒,等.融合淀粉酶AmyP-Clo对大米生淀粉的高效降解[J].微生物学报, 2017, 57(8): 1 301-1 307.
[9] 孙海彦,黎娟华,刘恩世,等.Aspergillus niger F-01和Aspergillus niger G-1125生淀粉酶糖化酶基因启动子的克隆与比较分析[J].轻工科技, 2015, 31(2): 17-18.
[10] 段绪果,周素雅,沈镇炎,等.一株产生淀粉酶杆菌Bacillus sp.GEL-09的筛选、鉴定及发酵条件优化[J].微生物学通报,2018,45(6): 1 180-1 189.
[11] 李丽珍,杨键,田新朋,等.深海放线菌生淀粉酶基因的克隆表达及酶学特性研究[J].生物加工过程,2015,13(2):35-40.
[12] 李艳玲,樊鲁玉,侯衍英,等.丹参内生真菌产生淀粉酶菌株的筛选鉴定及酶学性质分析[J].食品工业科技,2017,38(9): 108-112;118.
[13] 杨忠义,杨敬,崔福绵,等.特异腐质霉葡糖化酶催化生淀粉一步糖化的酶学特征[J].菌物学报,2017,36(2):213-219.
[14] 景洁,李鸿梅,董金满,等.罗耳阿太菌源生淀粉糖化酶发酵条件的优化及鉴定[J].西北农林科技大学学报(自然科学版),2017,45(11):122-131.
[15] MARLIDA Y,SAARI N,HASSAN Z,et al. Raw starch-degrading enzyme from newly isolated strains of endophytic fungi[J]. World Journal of Microbiology and Biotechnology,2000,16(6):573-578.
[16] 韦荣霞,张梁,石贵阳.Aspergillus sp.RSD生淀粉糖化酶的分离纯化及酶学性质[J].微生物学通报,2014,41(1):17-25.
[17] 许云萧,郝林.陈醋生高粱糖化菌株的筛选[J].中国酿造,2013,32(6):75-78.
[18] 钟坤,谭德冠,孙雪飘,等.一株木薯生淀粉糖化酶菌株的分离及酶学性质研究[J].热带作物学报,2012,33(7):1 239-1 244.
[19] 黄光文,董清平,沈玉平.甘薯生淀粉糖化酶菌株的分离与诱变育种[J].酿酒科技,2010(10):26-28.
[20] 夏艳秋,朱强,丁秀芹,等.酒用生淀粉糖化酶产生菌的选育及酶学性质研究[J].食品科学,2010,31(1):189-193.
[21] 肖长清, 戚天胜,赵海. 生淀粉糖化酶产生菌Aspergillus niger(6#)的分离筛选及其产酶条件[J]. 应用与环境生物学报,2006,12(1):76-79.
[22] MORTIA H, FUGIO Y. Effect of organic nitrogen sources on raw starch-digesting glucoamylase production ofRhizopus sp. MKU 40[J]. Starch Starke, 2000, 52(1): 19-21.
[23] 吕金芝,张凤英,刘金梅,等.高活性生淀粉糖化酶菌株F7的鉴定及其酶学性质的研究[J].中国调味品,2013,38(8):47-52.
[24] 杨毅,蔡小波,靳艳玲,等.青霉固态发酵生产生淀粉糖化酶的条件优化[J].中国酿造,2010,(7):28-31.
[25] 肖长清.一株产生淀粉糖化酶的拟青霉[J].湖北第二师范学院学报,2008,25(2):42-45.
[26] SUN H Y,GE X Y,ZHANG W G. Production of a novel raw starch-digesting glucoamylase byPenicillium sp. X-1 under solid state fermentation and its use in direct hydrolysis of raw starch[J].World Journal of Microbiology and Biotechnology,2007,23(5): 603-613.
[27] SELMA H A, ABDULLAHI H, NABILA E, et al. Effect of natural fermentation on nutritive value and invitro protein digestibility of pearl millet[J]. Food Chemistry, 2002,78(1):75-79.
[28] 夏艳秋,朱强.植酸对黄曲霉菌糖化酶活力的影响[J].酿酒科技,2003(6):33-35.
Optimized solid fermentation for Aspergillus niger SP7-2 producing glucoamylase
ZHU Qiang1, WANG Ruixin2, WU Chengdi2, XIA Yanqiu2*
1 (Marine Resources Development Institute of Jiangsu,Lianyungang 222005, China) 2 (Jiangsu Provincial Key Laboratory of Marine Biotechnology, HuaiHai Institute of Technology, Lianyungang 222005, China)
Abstract This study aimed to optimize the solid fermentation conditions forAspergillus niger SP7-2 producing raw starch-digesting glucoamylase (RSGA) by single factor experiments combined with orthogonal design. The optimized conditions for RSGA production were as follows: bran as the matrix, 20% bean cake powder prepared with 1∶1.1 water (w/w), 0.3% phytic acid, natural pH. The media was turned over once every 24 h and cultured at double-controlled temperatures for 60 h. Under this condition, the activity of RSGA in a 30 L solid fermenter was 7 870 U/g, which was 1.31 folds of that before optimization. This result provides a theoretical basis for preparing koji and liquor using uncooked materials.
Key words Aspergillus niger; raw starch-digesting glucoamylase; solid fermentation
第一作者:高级实验师(夏艳秋讲师为通讯作者,E-mail:xyq78 412@163.com)。
基金项目:江苏省科技计划项目 (BY2016057-05);江苏省大学生创新创业训练计划项目(SD201811641105006)
收稿日期:2018-08-14,改回日期:2019-01-07
DOI:10.13995/j.cnki.11-1802/ts.018529





