植物乳杆菌常见于工业发酵食品,如奶油、肉类及许多传统蔬菜发酵制品中,也是人类肠道乳酸菌的一种[1],能够通过胃肠道并定殖于肠道发挥益生作用[2]。植物乳杆菌NCU116分离自传统四川泡菜,具有良好的耐酸、耐胆盐和抑菌性能,以及调节肠道菌群、缓解便秘、抑制大鼠血脂紊乱与脂肪肝病变等益生功能[3-5]。目前已被应用于果蔬等植物原料的发酵产品研究、开发与生产,具有较高的研究价值和应用前景。
胆盐耐受能力是益生菌的重要特性之一,有助于益生菌通过胃肠环境并在肠道定殖(正常情况下,人体肠道中的胆盐含量约为0.3%~0.5%[6])。之前的研究大多数侧重于对耐胆盐益生菌株的筛选,对于耐胆盐机制的研究较少,近年来相关研究逐渐受到关注[7]。
随着测序成本的降低,由益生菌全基因组获得的编码基因信息越来越多,也使得通过生物信息学、分子生物学等手段研究益生菌在胆盐环境下的应答机制成为可能[8],FLAHAUT等对粪肠球菌的胆盐胁迫研究发现,其体内有45种蛋白质表达增强[9];BRON等对植物乳杆菌WCFS1使用DNA微阵列研究其胆盐诱导基因,发现分别有62和28个基因转录水平在生长期间下调和上调[10]。乳酸菌中的胆盐水解酶也可将对菌体毒性较高的初级胆盐转化为毒性较低的次级胆盐,从而提高乳酸菌的胆盐耐受能力[11]。但不同乳酸菌菌株受到胆盐胁迫的应激反应不同,影响机制也尚未完全明确,文章以具有多种益生功能的植物乳杆菌NCU116为研究对象,利用RT-qPCR技术研究胆盐胁迫条件下基因表达的变化,并考察了关键生理指标受胆盐胁迫的影响,在一定程度上为NCU116所具有的益生功能提供理论依据。
1 材料与方法
1.1 材料与试剂
菌种:植物乳杆菌NCU116,由南昌大学重点实验室自四川传统泡菜中分离鉴定并保存。
MRS固体培养基(1 L)、RNA prep Pure培养细胞/细菌总RNA提取试剂盒、Real Master Mix(SYBR Green)荧光定量PCR试剂盒,天根生化科技(北京)有限公司;TPrimeScriptTM RT试剂盒,Takara公司。
牛胆盐、溴化丙锭(PI)、磺基水杨酸,均为国产分析纯。
1.2 仪器与设备
LDZX-40Ⅱ型立式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;2720Thermal Cycler型PCR仪器,Applied Biosysterms公司; 752s紫外可见分光光度计,上海棱光技术有限公司; ST16R高速低温离心机,赛默飞世尔科技有限公司;1260高效液相色谱仪,安捷伦公司;荧光定量PCR仪, Applied Biosysterms公司;NanoDrop2000超微量分光光度计,赛默飞世尔科技有限公司; fastPreP-24TM 5G高速裂解样品制备仪,安倍医疗器械贸易(上海)有限公司;DM3000LED荧光显微镜,徕卡公司。
1.3 方法
1.3.1 植物乳杆菌NCU116的耐胆盐测试
将活化3代的稳定期植物乳杆菌NCU116在胆盐质量浓度为0、0.3、0.5、0.7、1 g/100 mL的MRS培养基中37 ℃孵育0 h(将NCU116添加于含胆盐的液体培养基后立即取样,孵育时间小于5 s)和2 h并测定其活菌数。
1.3.2 基于RT-qPCR检测目的基因的转录水平变化
1.3.2.1 总RNA提取
将活化3代的稳定期NCU116在胆盐质量浓度为0、0.3、0.5、0.7、1 g/100 mL的MRS培养基中37 ℃孵育2 h后,按照RNAprep Pure培养细胞/细菌总RNA提取试剂盒说明书提取菌体总RNA。
1.3.2.2 反转录
按照PrimeScriptTM RT试剂盒说明书进行。
1.3.2.3 基因选取与引物设计
选取16S rRNA为管家基因,在GenBank网站查询全部管家基因和目的基因的序列,引物设计软件为Oligo7,管家基因和目的基因引物序列如表1所示。生工生物工程(上海)股份有限公司合成引物,PCR扩增后使用琼脂糖凝胶电泳检测,出现单一条带表明引物具有特异性。
表1 荧光定量PCR引物序列
Table 1 Primers sequence for quantitative PCR
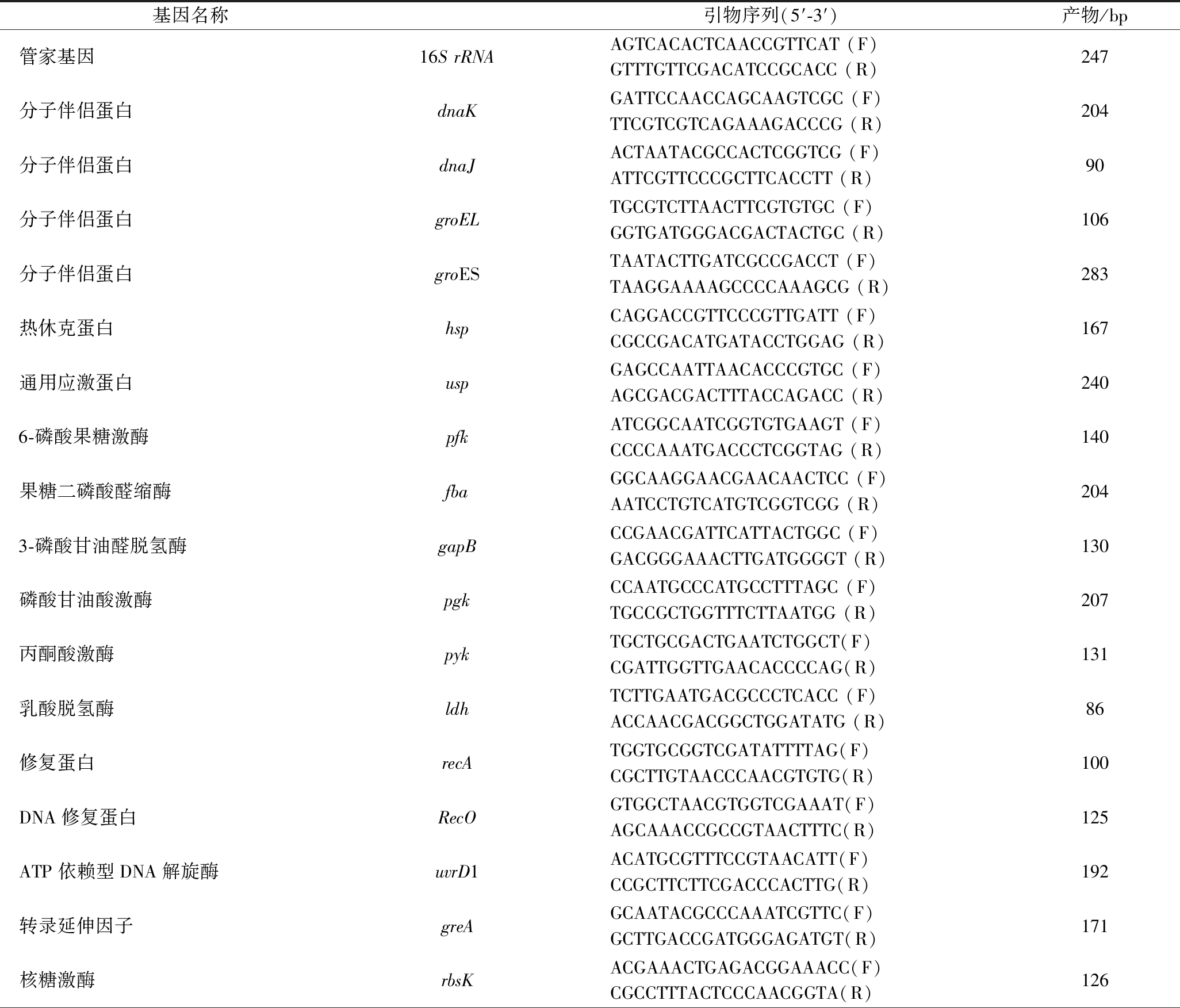
基因名称引物序列(5′-3′)产物/bp管家基因16S rRNAAGTCACACTCAACCGTTCAT (F)GTTTGTTCGACATCCGCACC (R)247分子伴侣蛋白dnaKGATTCCAACCAGCAAGTCGC (F)TTCGTCGTCAGAAAGACCCG (R)204分子伴侣蛋白dnaJACTAATACGCCACTCGGTCG (F)ATTCGTTCCCGCTTCACCTT (R)90分子伴侣蛋白groELTGCGTCTTAACTTCGTGTGC (F)GGTGATGGGACGACTACTGC (R)106分子伴侣蛋白groESTAATACTTGATCGCCGACCT (F)TAAGGAAAAGCCCCAAAGCG (R)283热休克蛋白hspCAGGACCGTTCCCGTTGATT (F)CGCCGACATGATACCTGGAG (R)167通用应激蛋白uspGAGCCAATTAACACCCGTGC (F)AGCGACGACTTTACCAGACC (R)2406-磷酸果糖激酶pfkATCGGCAATCGGTGTGAAGT (F)CCCCAAATGACCCTCGGTAG (R)140果糖二磷酸醛缩酶fbaGGCAAGGAACGAACAACTCC (F)AATCCTGTCATGTCGGTCGG (R)2043-磷酸甘油醛脱氢酶gapBCCGAACGATTCATTACTGGC (F)GACGGGAAACTTGATGGGGT (R)130磷酸甘油酸激酶pgkCCAATGCCCATGCCTTTAGC (F)TGCCGCTGGTTTCTTAATGG (R)207丙酮酸激酶pykTGCTGCGACTGAATCTGGCT(F)CGATTGGTTGAACACCCCAG(R)131乳酸脱氢酶ldhTCTTGAATGACGCCCTCACC (F)ACCAACGACGGCTGGATATG (R)86修复蛋白recATGGTGCGGTCGATATTTTAG(F)CGCTTGTAACCCAACGTGTG(R)100DNA修复蛋白RecOGTGGCTAACGTGGTCGAAAT(F)AGCAAACCGCCGTAACTTTC(R)125ATP依赖型DNA解旋酶uvrD1ACATGCGTTTCCGTAACATT(F)CCGCTTCTTCGACCCACTTG(R)192转录延伸因子greAGCAATACGCCCAAATCGTTC(F)GCTTGACCGATGGGAGATGT(R)171核糖激酶rbsKACGAAACTGAGACGGAAACC(F)CGCCTTTACTCCCAACGGTA(R)126
续表1

基因名称引物序列(5′-3′)产物/bp核糖核酸酶HIrnhAAATTTCTTGCCGCCATTGCT(F)CGCCAGCTCGACACTGAAAG(R)143细胞分裂蛋白ftsZCGCTCTGATGGGTATTGGCT(F)CACCCGTGATGTTCAGCAAG(R)131生物素转运蛋白BioYbioYATTCCCGTCCCGATTGTGTT(F)AGCAACGAGATAGCCACCCG(R)186二价金属阳离子转运蛋白MntHmntHGCAAGACTTAGCACAAGCCA(F)CACGCCGAATGCCAAATCTC(R)224支链氨基酸ABC转运蛋白通透酶livHATCATTGCCGACCCAGTTGT(F)ATTCCAAAACCGCAACCGAG(R)123
1.3.2.4 qPCR实验
按照Real Master Mix(SYBR Green)荧光定量PCR试剂盒说明书进行荧光定量PCR实验,基因相对表达量变化用ΔΔCt法计算,实验设定空白对照的基因表达量为1。
1.3.3 关键生理指标测定
1.3.3.1 菌体表面疏水性和自凝聚能力的测定
菌体表面疏水性测试方法参考ROSENBERG的方法,并作一定的修改[12-13]。具体操作为:不同质量浓度的胆盐胁迫2 h后,离心收集菌体,菌悬液与二甲苯等体积混匀,室温静置30 min后使用紫外分光光度计检测水相于600 nm处吸光值,重复3次。表面疏水性(H%)按公式(1)计算:
![]()
(1)
式中:A0和A2分别为与二甲苯混匀前后水相在600 nm下测得的吸光值。
菌体自凝聚能力测定方法[14]:不同质量浓度的胆盐胁迫2 h后,离心收集菌体,调节菌悬液浓度至108 CFU/mL,涡旋振荡10 s后,37℃静置0、2、4、6及24 h,并分别测其在600 nm处的吸光值,重复3次。自凝聚能力按公式(2)计算:
自凝聚![]()
(2)
式中:A0和At分别为静置0 h和t h时水相在600 nm下测得的吸光值。
1.3.3.2 胞内葡萄糖和乳酸含量的测定
胆盐胁迫2 h后,取1 mL菌液离心去上清,加入1 mL PBS缓冲液,经高速裂解样品制备仪破碎细菌后离心,取上清,过0.22 μm膜后使用1260高效液相色谱仪检测。
1.3.3.3 胞内氨基酸含量的测定
胆盐胁迫2 h后,高速裂解样品制备仪破碎菌体后离心,取上清;加入2%磺基水杨酸9 mL沉淀蛋白质后离心,取上清,经0.22 μm膜过滤后送样。
1.3.4 数据分析
做图软件为Origin 9,分析软件为SPSS 22。
2 结果与分析
2.1 植物乳杆菌NCU116的耐胆盐测试
胆盐具有两亲性,可直接作用于菌体细胞膜结构,引起一些镶嵌在细胞膜中的生物酶类失活,从而导致跨膜转运功能紊乱,胆盐浓度过高则会直接溶解细胞膜中的脂质,使细胞质等内容物从胞内流出,可直接导致菌体死亡,但不同乳酸菌菌株对胆盐的耐受能力不同[15]。一般情况下,乳酸菌在胆盐质量浓度0.3~0.5 g/100 mL下耐受能力较弱,存活率最低可降至31.8%[16-17],在胡斌等的研究中,植物乳杆菌ST-Ⅲ在胆盐质量浓度1 g/100 mL中完全死亡[13]。胆盐对NCU116的生长有一定的抑制作用,但其在0.3 g/100 mL的胆盐胁迫2 h后,活菌数仍可保持在108 CFU/mL以上;随着胆盐质量浓度的提高,NCU116的耐受能力逐渐降低,但其在高达1 g/100 mL的胆盐质量浓度下依然能够保持较高的活性(107 CFU/mL),而益生菌想要在人体发挥作用,只需使其活菌数维持在106CFU/mL以上即可[18]。表明NCU116具有较强的胆盐耐受能力,具有在人体发挥益生功能的潜力(图1)。
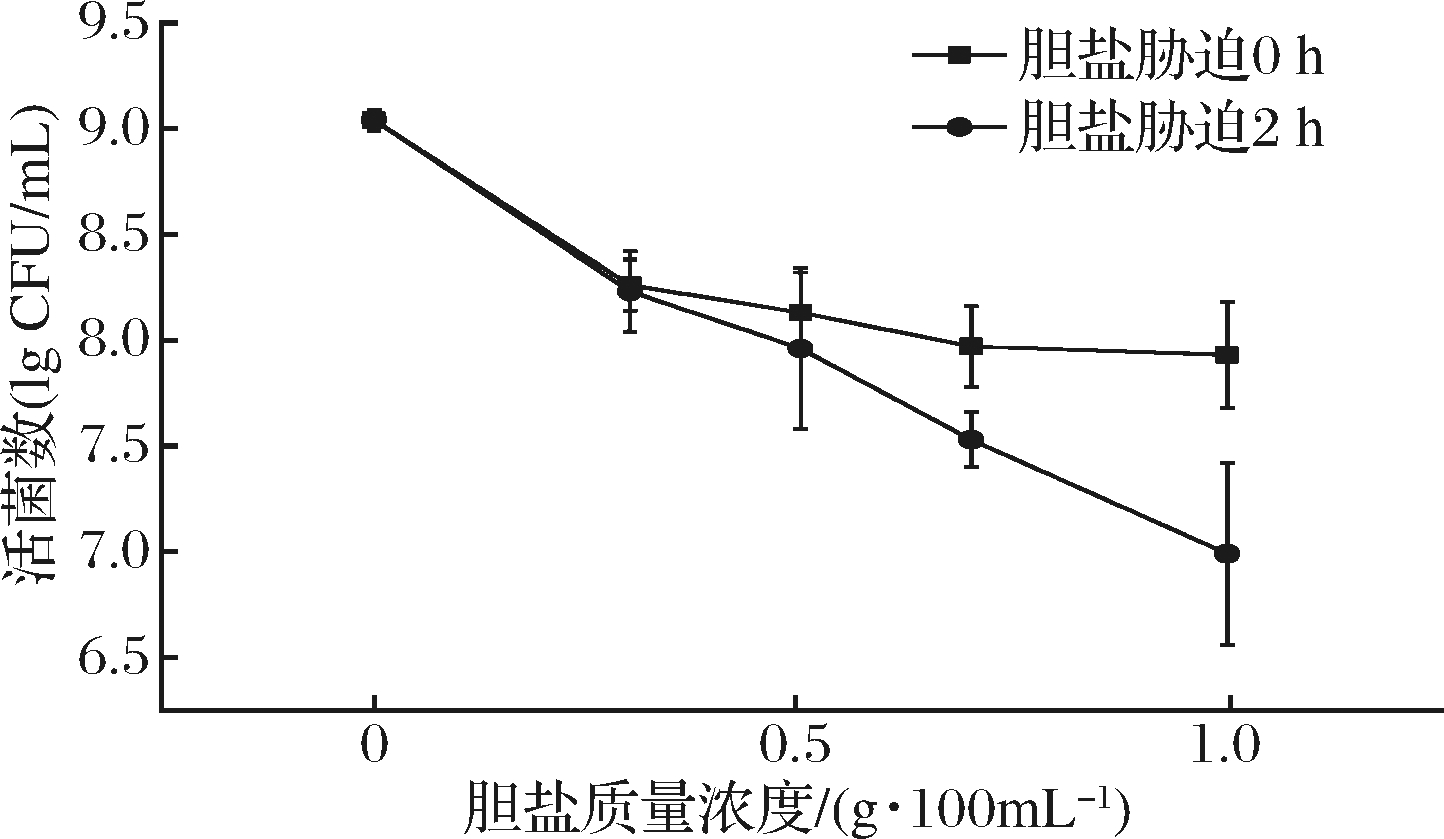
图1 胆盐胁迫下植物乳杆菌NCU116活菌数变化
Fig.1 Changes of viable counts of L. plantarum NCU116 under bile salt stress
2.2 基于RT-PCR检测关键基因的转录水平变化
研究表明,胆盐扩散到胞内,会导致胞内蛋白质受到干扰而错误折叠,当折叠过量时将导致细菌生长停滞甚至死亡[18]。分子伴侣蛋白可有效隔离外源性有害物质,修正蛋白质的错误折叠,维持蛋白质稳态,以及帮助修复细胞跨膜转运以抵御环境胁迫等作用[19]。在刘倩颖等[20]的研究中,植物乳杆菌在高渗透压胁迫时,分子伴侣蛋白基因dnaK、dnaJ、groES、groEL的相对转录水平显著上调;L. casei Zhang在受到胆盐胁迫时,基因groEL、dnaK转录水平也上调[21]。NCU116在胆盐胁迫条件下,基因dnaK和groES转录水平受胆盐诱导显著上调,在胆盐质量浓度高于0.5 g/100 mL时,基因dnaK转录水平分别上调15.0和20.6倍,基因groES转录水平也上调了3.5和4.3倍(P<0.01),但基因dnaJ和groEL无明显变化。通用应激蛋白基因usp和热休克蛋白基因hsp相对转录水平亦分别显著上调6.6~8.6倍和3.8~4.9倍(P<0.05),其可在极端恶劣环境时给予菌体一定的抗性来应对环境伤害[22]。
胆盐对NCU116的葡萄糖代谢过程也产生了较大的影响,糖酵解过程的关键限速酶6-磷酸果糖激酶基因pfk和果糖二磷酸醛缩酶基因fba受胆盐胁迫诱导后基因转录水平显著上调,分别上调2.8~4.0倍和2.2~5.1倍,且随着胆盐质量浓度的上升呈显著上升趋势(P<0.01),这可能是由于扩散到胞内的胆盐对基因pfk和fba等的分子结构造成了一定的破坏,为使糖酵解过程能顺利进行,通过提高其基因的转录水平来适应不利环境的伤害[20]。糖酵解途径中的3-磷酸甘油醛脱氢酶基因gapB的相对转录水平变化不明显,但磷酸甘油酸激酶基因pgk、丙酮酸激酶基因pyk和乳酸脱氢酶基因ldh三种基因的转录水平都有明显下调,分别下调4.4~8.3倍、8.3~10倍和2.5~4.8倍(P<0.05),表明葡萄糖代谢受到较大的抑制,糖酵解的终产物丙酮酸生成量减少,从而生成的乳酸含量也随之减少(见2.3.2)。
扩散到胞内的胆盐还会导致DNA损伤,修复蛋白recA的增加可修复受损的DNA[23],但在NCU116中,基因recA的转录水平并无明显变化,重组修复蛋白基因recO的相对转录水平却下调了2.6~4.4倍(P<0.05)。ATP依赖型DNA解旋酶UvrD1和recA可与修复蛋白UvrA协同作用,以降低核蛋白的损伤[24],在NCU116中基因UvrD1受胁迫诱导,其转录水平分别上调了3.7~5.7倍(P<0.05)。可能是UvrD1的保护作用,降低了胆盐对菌体DNA转录和复制过程的不利影响,从而使得基因recA的转录水平变化不大,基因recO转录水平下调的原因尚不明确。细胞分裂蛋白基因ftsZ受到胆盐胁迫后基因转录水平显著下调了9倍左右(P<0.01),表明胆盐胁迫影响了NCU116的生长代谢。同时转录延伸因子基因greA受到质量浓度0.3 g/100 mL的胆盐胁迫后基因转录水平下调4.3倍,但在胆盐质量浓度高于0.3 g/100 mL时,基因greA转录水平下降的幅度却有所减少,这可能是由于greA在应激反应中的潜在作用[25],通过降低转录水平下降的趋势来应对胁迫。
在胆盐胁迫条件下,NCU116可通过提高分子伴侣蛋白和通用应激蛋白等应激基因的转录水平,同时减缓自身生长代谢来降低胆盐对其的不利影响(图2)。

图2 不同质量浓度胆盐胁迫下植物乳杆菌NCU116基因相对表达量变化
Fig.2 Changes in the genes expression of L. plantarum NCU116 at different concentrations of bile salts
*表示两者之间差异显著,P<0.05;**表示两者之间差异极显著,P<0.01
2.3 关键生理指标的测定
2.3.1 菌体表面疏水性和自凝聚能力的测定
胆盐对菌体细胞的损伤首先体现在对细胞表面特性的影响,表面疏水性与自凝聚集能力是衡量细胞表面特性的重要指标,与益生菌的黏附能力呈正相关性[26],而益生菌只有能够在肠道黏附并定殖才能发挥其益生功能。通过检测菌体表面疏水性与自凝聚能力可检测胆盐对菌体表面的损伤程度,结果如表2所示。与空白对照相比,植物乳杆菌NCU116受到胆盐胁迫后菌体疏水性显著下降(P<0.05),这可能是由于菌体表面的多聚糖等物质的流失导致[27],但在高胆盐浓度处理(>0.3 g/100 mL)的情况下,NCU116的菌体表面疏水性变化不大(P>0.05)。受表面疏水性影响,菌体间相互作用发生了变化,菌体的自凝聚能力受胆盐胁迫后显著下降(P<0.05)。菌悬液静置2 h时,与空白对照相比,0.3 g/100 mL胆盐胁迫后的NCU116的自凝聚能力下降了一半(P<0.05),而在含0.5~1 g/100 mL胆盐的MRS培养基中培养的NCU116自凝聚能力均为0。这可能是由于胆盐同时具有亲水性与亲油性[28],当菌悬液中胆盐质量浓度较高,细菌表面残留的部分胆盐使菌体沉降速度变缓,静置时间较短时,菌体几乎未沉降,因此无法检测此时的自凝聚能力。静置4、6 h时自凝聚集能力变化仍不明显,但此时NCU116的自凝聚能力在高质量浓度胆盐胁迫条件后下降趋势减缓。沉降24 h后,菌体自凝聚能力从空白对照的75%下降至1 g/100 mL胆盐处理下的51.7%(P<0.05)。
表2 胆盐胁迫下植物乳杆菌NCU116表面疏水性及自凝聚能力的变化
Table 2 Changes in surface hydrophobicity and self-aggregation ability of L. plantarum NCU116 under bile salt stress

胆盐质量浓度/(g·100mL-1)疏水性/%自凝聚/%2 h4 h6 h24 h空白37.0±0.5a18.2±2.2a21.9±2.5a33.2±0.5a75.5±1.8a0.315.9±2.4b8.9±1.3b20.9±0.2a26.0±0.2b63.9±0.6b0.59.3±2.2c0c7.5±1.3b9.9±1.7c59.3±2.6c0.710.1±3.1c0c12.2±0.6c12.6±1.7d56.4±0.3c1.013.9±2.4b、c0c16.6±0.4d19.6±0.1e51.7±0.1d
注:同列不同字母表示差异性显著(P<0.05),下同。
2.3.2 胞内葡萄糖和乳酸含量的测定
乳酸菌缺乏完整的柠檬酸循环,因此其生成ATP主要依靠糖酵解和氨基酸代谢[29-30]。检测胆盐胁迫后NCU116胞内葡萄糖和乳酸含量,可表明胆盐对糖代谢的抑制程度,结果如表3所示。当用MRS培养植物乳杆菌NCU116时,培养基中的主要碳源葡萄糖经过糖酵解途径大量生成乳酸并释放ATP,葡萄糖胞内残余量较少;胆盐胁迫后葡萄糖代谢能力受到抑制,碳源利用率降低,胞内葡萄糖含量由空白对照的24.9 μg/mL上升至0.3 g/100 mL胆盐胁迫后的69.7 μg/mL,随着胆盐含量继续增加,胞内残余葡萄糖含量显著上升(P<0.05),用0.5 g/100 mL含量胆盐胁迫后,细菌胞内葡萄糖含量继续上升至289.7 μg/mL;同时,乳酸生成量因乳酸脱氢酶ldh和丙酮酸激酶pyk基因的表达量下调而大幅降低(P<0.05),由空白对照的1 205.3 μg/mL下降至0.3 g/100 mL胆盐胁迫后的789.2 μg/mL,胆盐含量上升至0.5 g/100 mL时,细菌胞内乳酸含量已下降至83.2 μg/mL。
作为MRS中的主要碳源,葡萄糖能显著提高乳酸乳杆菌的胆盐耐受力[31],这可能是由于低分子量碳水化合物较高分子量碳水更容易被菌体吸收利用,且它们更易进入细胞膜的磷脂双分子层[32],对膜结构提供一定的保护作用。因此在胆盐胁迫导致代谢紊乱的同时,存在于胞内和细胞膜中的葡萄糖又为植物乳杆菌NCU116提供保护作用,减轻了胆盐的毒害。随着胆盐质量浓度的继续上升,葡萄糖残余量上升与乳酸生成量降低的趋势都有所减缓,不再出现大幅度的变动。表明植物乳杆菌NCU116有较好的耐受高质量浓度胆盐的能力(表3)。
表3 胆盐胁迫下植物乳杆菌NCU116胞内葡萄糖和乳酸含量的变化
Table 3 Changes of intracellular glucose and lactic acidcontent in L. plantarum NCU116 under bile salt stress
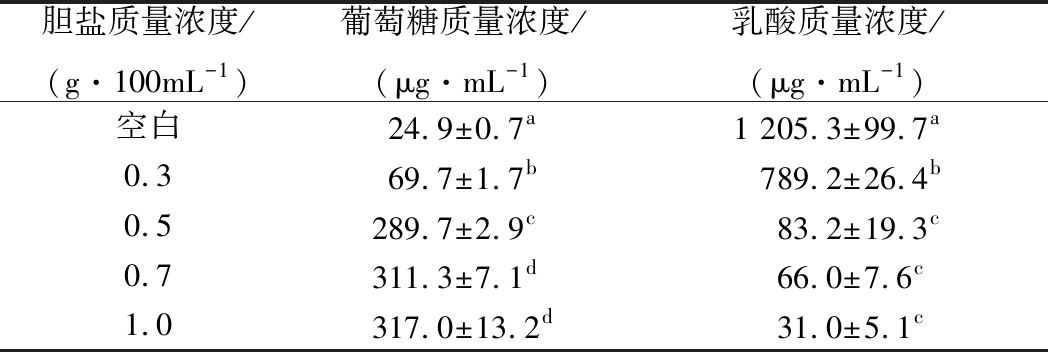
胆盐质量浓度/(g·100mL-1)葡萄糖质量浓度/(μg·mL-1)乳酸质量浓度/(μg·mL-1)空白24.9±0.7a1 205.3±99.7a0.3 69.7±1.7b789.2±26.4b0.5 289.7±2.9c83.2±19.3c0.7 311.3±7.1d66.0±7.6c1.0 317.0±13.2d31.0±5.1c
2.3.3 胞内氨基酸含量的测定
胆盐胁迫除了对菌体表面和代谢产生不利影响,还会给菌体带来一系列其他胁迫的损害,如活性氧/氮状态导致的氧化胁迫、解离释放H+引起的酸胁迫等[33]。氨基酸作为1种主要的氮源,可通过代谢产生能量供给细菌正常生殖代谢,还能产氨以调节胞内pH值以及提供营养成分的合成前体等,来应对某些环境胁迫[29]。
在菌体受到外界影响的情况下,胞内苏氨酸可与丙酮酸经酶催化生成缬氨酸、亮氨酸和异亮氨酸,用于增强菌体细胞膜的稳定性[34]。在表4中,受到胆盐胁迫后,胞内苏氨酸含量显著降低(最高降低4.6 μg/mL,P<0.01),同时缬氨酸、亮氨酸和异亮氨酸含量升高(P<0.05),有助于NCU116维持稳定的细胞膜;甘氨酸与谷氨酸是菌体的必须氨基酸,在缺少这2种必须氨基酸的情况下,菌体生长代谢将减缓甚至停滞[35],NCU116受胆盐胁迫后,这2种必须氨基酸的含量降低较少(仅降低约1~2 μg/mL),有助于维持稳定的生长代谢;同时,胞内丝氨酸、酪氨酸受胆盐胁迫后含量均显著增加(P<0.01),从外界吸收的丝氨酸可被优先利用于合成其他必需氨基酸,如半胱氨酸等,以满足细胞生殖代谢的需要,酪氨酸在细菌胞内存在多种代谢通路,其代谢产物主要是蛋白质、多巴胺等重要大分子物质的前体物质[34],可在一定程度上有利于保持胆盐胁迫导致的胞内大分子物质稳定性;苯丙氨酸含量上升也较为明显(P<0.01),其可在胞内产生多种中间代谢产物,如苯丙酮酸、2-羟基-3-苯基丙酸酯等,可直接进入糖酵解过程,以维持糖酵解过程的稳定[34]。在所有胞内游离氨基酸中含量最高的是精氨酸(高达10 μg/mL以上),受到胆盐胁迫后也有一定的上升,精氨酸可通过ADI途径(精氨酸脱亚胺酶途径)或精氨酸脱羧酶-尿素酶路转化为氨以调控胞内pH值,同时增加胞内ATP浓度来应对环境胁迫的伤害[36]。
在受到胆盐胁迫后,植物乳杆菌NCU116可通过积累游离氨基酸来稳定细胞膜,稳定必须氨基酸的含量,并利用氨基酸的产能代谢以维持基本代谢,还可通过脱羧酶作用产氨以平衡胞内pH值(表4)。
表4 胆盐胁迫下植物乳杆菌NCU116胞内氨基酸含量的变化
Table 4 Changes of intracellular amino acid content of L. plantarum NCU116 under bile salt stress
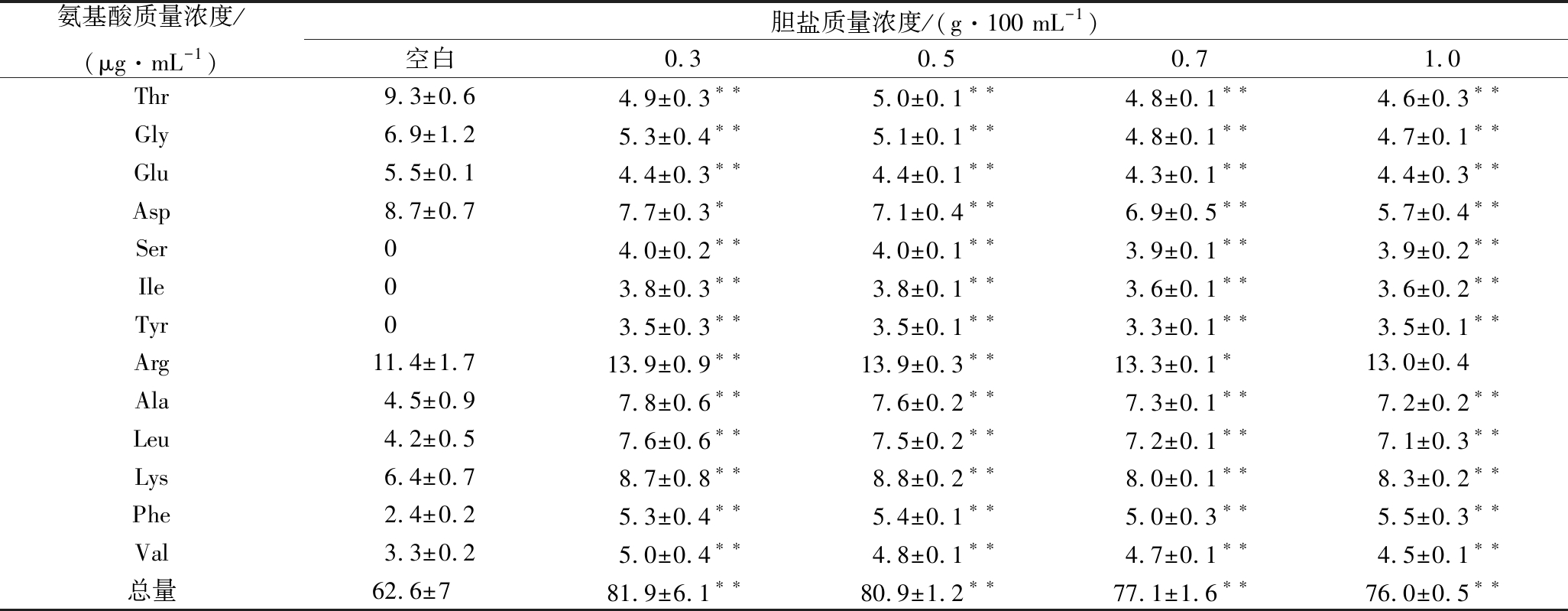
氨基酸质量浓度/(μg·mL-1)胆盐质量浓度/(g·100 mL-1)空白0.3 0.5 0.7 1.0 Thr9.3±0.64.9±0.3∗∗5.0±0.1∗∗4.8±0.1∗∗4.6±0.3∗∗Gly6.9±1.25.3±0.4∗∗5.1±0.1∗∗4.8±0.1∗∗4.7±0.1∗∗Glu5.5±0.14.4±0.3∗∗4.4±0.1∗∗4.3±0.1∗∗4.4±0.3∗∗Asp8.7±0.77.7±0.3∗7.1±0.4∗∗6.9±0.5∗∗5.7±0.4∗∗Ser04.0±0.2∗∗4.0±0.1∗∗3.9±0.1∗∗3.9±0.2∗∗Ile03.8±0.3∗∗3.8±0.1∗∗3.6±0.1∗∗3.6±0.2∗∗Tyr03.5±0.3∗∗3.5±0.1∗∗3.3±0.1∗∗3.5±0.1∗∗Arg11.4±1.713.9±0.9∗∗13.9±0.3∗∗13.3±0.1∗13.0±0.4Ala4.5±0.97.8±0.6∗∗7.6±0.2∗∗7.3±0.1∗∗7.2±0.2∗∗Leu4.2±0.57.6±0.6∗∗7.5±0.2∗∗7.2±0.1∗∗7.1±0.3∗∗Lys6.4±0.78.7±0.8∗∗8.8±0.2∗∗8.0±0.1∗∗8.3±0.2∗∗Phe2.4±0.25.3±0.4∗∗5.4±0.1∗∗5.0±0.3∗∗5.5±0.3∗∗Val3.3±0.25.0±0.4∗∗4.8±0.1∗∗4.7±0.1∗∗4.5±0.1∗∗总量62.6±781.9±6.1∗∗80.9±1.2∗∗77.1±1.6∗∗76.0±0.5∗∗
注:*表示与对照组差异显著,P<0.05;**表示与对照组差异极显著,P<0.01。
3 结论
胃肠道环境中的胆盐会对进入人体的乳酸菌带来胁迫伤害,甚至会溶解细胞膜导致乳酸菌死亡[15]。为使乳酸菌在胃肠道中较好地存活并发挥益生功能,近年来对乳酸菌的耐胆盐机制研究越来越受到人们的关注[7]。本实验分别用不同含量的胆盐培养基处理植物乳杆菌NCU116,对其基因转录水平变化和关键生理指标的检测表明,NCU116受到胆盐胁迫后细胞膜出现破损,菌体表面疏水性和自凝聚能力下降,葡萄糖代谢受一定程度的抑制,乳酸生成量减少。但随着胆盐含量的上升,NCU116受到的影响趋势明显减缓。同时,NCU116可通过调控应激蛋白基因和修复蛋白基因的转录水平来应对胆盐胁迫导致的蛋白质过量、错误折叠和对转录、复制过程的不利影响,调控糖酵解关键酶基因的转录水平保证糖代谢的顺利进行,积累胞内氨基酸含量来稳定细胞膜、调控胞内pH值及产能维持代谢等,并通过降低自身生长代谢来缓解胁迫带来的紊乱。在高胆盐胁迫条件下,NCU116能保持较高的活菌数,表明植物乳杆菌NCU116有较好的耐高浓度胆盐的能力,可在胃肠道发挥其益生功能。本研究初步探讨了NCU116的耐胆盐机制,但对给予NCU116胆盐抗性的基因,其具体功能还未十分明确,以及基因RecO转录水平下调的原因和基因greA应对胁迫伤害的机理和功能等,都有待进一步的研究。
[1] CCEDIL,ATALOLUK O, GOGEBAKAN B. Presence of drug resistance in intestinal lactobacilli of dairy and human origin in Turkey[J]. Fems Microbiology Letters, 2004, 236(1):7-12.
[2] VRIES M C D, VAUGHAN E E, KLEEREBEZEM M, et al. Lactobacillus plantarum— survival, functional and potential probiotic properties in the human intestinal tract [J]. International Dairy Journal, 2006, 16(9):1 018-1 028.
[3] 熊涛. 直投式发酵泡菜益生乳酸菌的选育与菌剂制备及其益生特性研究[D]. 南昌:南昌大学, 2012.
[4] 谢俊华. 植物乳杆菌NCU116对肠道健康的影响[D].南昌:南昌大学, 2016.
[5] 李川. 植物乳杆菌NCU116的益生功能及其作用机制[D]. 南昌:南昌大学, 2015.
[6] RUIZ L, MARGOLLES A, S NCHEZ B. Bile resistance mechanisms in Lactobacillus and Bifidobacterium[J]. Frontiers in Microbiology, 2013, 4(396):396.
NCHEZ B. Bile resistance mechanisms in Lactobacillus and Bifidobacterium[J]. Frontiers in Microbiology, 2013, 4(396):396.
[7] LAUBER W M, CARROLL J A, DUFIELD D R, et al. Mass spectrometry compatibility of two-dimensional gel protein stains[J]. Electrophoresis, 2001, 22(5):906-918.
[8] 赵小茜, 魏旭丹,陈戴玲,等. 乳酸菌耐酸耐胆盐机制研究进展[J]. 乳业科学与技术, 2017, 40(3):33-36.
[9] FLAHAUT S, HARTKE A, GIARD J C, et al. Alkaline stress response in Enterococcus faecalis: Adaptation, cross-protection, and changes in protein synthesis[J]. Applied & Environmental Microbiology, 1997, 63(2):812-814.
[10] BRON P A, MOLENAAR D, VOS W M D, et al. DNA micro-array-based identification of bile-responsive genes in Lactobacillus plantarum[J]. Journal of Applied Microbiology, 2010, 100(4):728-738.
[11] 毕洁. 胆盐水解酶提高乳酸菌胆盐耐受能力的酶学与生理学机制研究[D]. 无锡:江南大学, 2016.
[12] ROSENBERG M, GUTNICK D, ROSENBERG E. Adherence of bacteria to hydrocarbons: A simple method for measuring cell-surface hydrophobicity[J]. FEMS Microbiology Letters, 1980, 9(1):29-33.
[13] 胡斌. 植物乳杆菌胆盐耐受评价及内在影响因素分析[D]. 无锡:江南大学, 2015.
[14] BAO Y, ZHANG Y, LI H, et al. In vitro screen of Lactobacillus plantarum, as probiotic bacteria and their fermented characteristics in soymilk[J]. Annals of Microbiology, 2012, 62(3):1 311-1 320.
[15] HEUMAN D M, BAJAJ R S, LIN Q. Adsorption of mixtures of bile salt taurine conjugates to lecithin-cholesterol membranes: implications for bile salt toxicity and cytoprotection [J]. Journal of Lipid Research, 1996, 37(3):562-573.
[16] 陈欣, 潘素华,胡黎黎,等. 人源乳酸杆菌耐酸耐胆盐能力的测定和鉴定[J]. 现代预防医学, 2006, 33(3):278-279.
[17] 李洋, 赵欣,张玉,等. 牦牛酸乳中耐酸耐胆盐乳酸菌的分离筛选和鉴定[J]. 食品与机械, 2018, 34(7):23-28;33.
[18] BERNSTEIN H, PAYNE C M, BERNSTEIN C, et al. Activation of the promoters of genes associated with DNA damage, oxidative stress, ER stress and protein malfolding by the bile salt, deoxycholate[J]. Toxicology Letters, 1999, 108(1):37-46.
[19] AKERFELDT, KARIN. Guidebook to molecular chaperones and protein-folding catalysts\r. mary-jane gething[J].The Quarterly Review of Biology, 2000, 75(1):48-49.
[20] 刘倩颖. 基于RT-PCR技术对植物乳杆菌耐盐分子机理的研究[D]. 沈阳:沈阳农业大学, 2014.
[21] 乌日娜. 益生菌Lactobacillus casei Zhang蛋白质组学研究[D]. 呼和浩特:内蒙古农业大学, 2009.
[22] GEIS A, DEMERDASH H A M E, HELLER K J. Sequence analysis and characterization of plasmids from Streptococcus thermophilus[J]. Biochemistry, 2006, 50(1):53-69.
[23] CONNOLLY J P R, ROE A J. Intracellular D-serine accumulation promotes genetic diversity via modulated induction of RecA in enterohemorrhagic Escherichia coli[J]. Journal of Bacteriology, 2016, 198(24):3 318-3 328.
[24] SINGH P, PATIL K N, KHANDUJA J S, et al. Mycobacterium tuberculosis UvrD1 and UvrA proteins suppress DNA strand exchange promoted by cognate and noncognate RecA proteins[J]. Biochemistry, 2010, 49(23):4 872.
[25] RHODIUS V A, SUH W C, NONAKA G, et al. Conserved and variable functions of the σE stress response in related genomes[J]. Plos Biology, 2006, 4(1):e2.
[26] 杨振泉, 靳彩娟,张咪,等. 高粘附性戊糖片球菌的筛选、标记及其表面疏水与自凝聚性特征[J]. 食品与生物技术学报, 2015, 34(9):926-934.
[27] DIAO M, NGUYEN T A, TARAN E, et al. Effect of energy source, salt concentration and loading force on colloidal interactions between Acidithiobacillus ferrooxidans cells and mineral surfaces[J]. Colloids & Surfaces B Biointerfaces, 2015, 132:271-280.
[28] NOH D O, GILLILAND S E. Influence of bile on cellular integrity and β-galactosidase activity of Lactobacillus acidophilus[J]. Journal of Dairy Science, 1993, 76(5):1 253-1 259.
[29] FERN NDEZ M,
NDEZ M, ![]()
 IGA M. Amino acid catabolic pathways of lactic acid bacteria[J]. Critical Reviews in Microbiology, 2006, 32(3):155.
IGA M. Amino acid catabolic pathways of lactic acid bacteria[J]. Critical Reviews in Microbiology, 2006, 32(3):155.
[30] POOLMAN B. Energy transduction in lactic acid bacteria[J]. Fems Microbiology Reviews, 1993, 12(1-3):125-147.
[31] 曾东, 倪学勤,胡晓玲,等. 玉米、豆粕和麦麸提取物对4株乳酸杆菌胆盐耐受力的影响[J]. 浙江大学学报(农业与生命科学版), 2009, 35(6):659-664.
[32] KOSTER K L, LEI Y P, ANDERSON M, et al. Effects of vitrified and nonvitrified sugars on phosphatidylcholine fluid-to-gel phase transitions[J]. Biophysical Journal, 2000, 78(4):1 932-1 946.
[33] BEGLEY M, GAHAN C G, HILL C. The interaction between bacteria and bile[J]. Fems Microbiology Reviews, 2010, 29(4):625-651.
[34] 黄珊. 基于转录组学与代谢组学的Streptococcus thermophilus TF96氨基酸代谢机制研究[D]. 哈尔滨:东北农业大学, 2017.
[35] 刘岩, 王慧,史吉平,等. 微生物法生产L-丝氨酸代谢工程研究进展[J]. 生物技术通报, 2015, 31(8):44-49.
[36] CHRISTENSEN J E, DUDLEY E G, PEDERSON J A, et al. Peptidases and amino acid catabolism in lactic acid bacteria[J]. Antonie van Leeuwenhoek, 1999, 76(1-4):217-246.