糖尿病是危害人类健康的最重要的非传染性疾病之一[1]。2017年,国际糖尿病联盟发布的报告显示,全球糖尿病患者达4.25亿,中国是糖尿病患者最多的国家达到1.14亿,预计2035年糖尿病患者将达到5.92亿[2]。糖尿病发病率逐年上升,已成为全球关注的公共卫生问题之一[3-5]。目前用于治疗糖尿病的药物大多是合成药物,这些药物的使用会诱发一些副作用[6-7],不能满足人们对健康的渴求,因此必须找到新一类有效的副作用较小的化合物。
控制糖尿病就必须控制血糖[8],但糖尿病患者由于代谢紊乱,葡萄糖不能被机体正常吸收[9],导致餐后血糖的上升。α-淀粉酶抑制剂可以通过抑制α-淀粉酶的活性,抑制淀粉的分解,将葡萄糖的吸收速率降低,从而抑制了餐后血糖升高。马艳丽等[10]研究发现,随着大米粥中白芸豆α-淀粉酶抑制剂添加量的增加,大米粥的淀粉水解率不断下降。因此α-淀粉酶抑制剂可作为平衡血液中的葡萄糖浓度和限制餐后高血糖一种新的有效药物[11-13],且淀粉酶抑制剂不会产生有害的副作用[14-15]。
抗性淀粉较其他淀粉难降解[16],从而在体内缓慢释放葡萄糖,具有较低的胰岛素反应,可控制餐后血糖平衡并可以让糖尿病患者减少饥饿感,特别适宜糖尿病人群食用。抗性淀粉对降糖有一定的作用,有研究显示[17-18],摄入高抗性淀粉可以有效改善糖尿病患者的胰岛素抵抗。另有研究表明[19-24],抗性淀粉可使餐后葡萄糖浓度显著降低。
淀粉有大量的羟基,如以结构简单α-淀粉酶抑制因子对交联淀粉加以修饰,将得到具有抑制α-淀粉酶活性基团的变性淀粉,其降糖效果在变性及抑制α-淀粉酶活性的双重作用下将会成倍提高。这样既可让糖尿病患者享受“饱餐”的幸福,又不用担心餐后血糖的升高,从而达到药食同源的目的。但目前尚未见这方面的研究报道。
闵玉涛等[25]以土豆淀粉为原料,环氧氯丙烷为交联剂,制得了一种具有降糖活性的抗性淀粉(环氧氯丙烷交联淀粉),其消化性能比原淀粉降低了34.5%。宋彦显等[26]发现,五倍子中有结构相对简单的α-淀粉酶抑制因子——月桂酸、肉豆蔻酸和棕榈酸。本文以上述抑制因子作为活性基团,修饰环氧氯丙烷交联淀粉的羟基,制备新型抗性淀粉,以得到具有双重降糖活性的功能性淀粉,为糖尿病病人开发出新型高效的降糖食品基料,开拓抗性淀粉在食品及医药领域中的新应用。
1 材料与方法
1.1 材料与试剂
猪胰脏α-淀粉酶,自制,比活力 856 U/mg;土豆淀粉,购于郑州市种子批发市场;十二酸,分析纯,天津市科密欧化学试剂开发中心;十四酸,分析纯,天津市光复精细化工研究所;十六酸,分析纯,天津市光复精细化工研究所。氯化亚砜,化学纯,西陇化学试剂厂;苯,分析纯,上海华彭实业有限公司;吡啶,分析纯,上海华彭实业有限公司。其余试剂均为国产分析纯。
1.2 仪器与设备
Multiscan MK3酶标仪,芬兰;723可见分光光度计,上海第三分析仪器厂;HH-S11-2电热恒温水浴锅,北京长安科学仪器厂;TGL-18C高速冷冻离心机,上海安亨科学仪器厂;TLJ-2定时增力电动搅拌,江苏省姜堰市天力医疗器械厂;SHZ-D(Ⅲ)循环水式真空泵,巩义市英峪予华仪器厂;Nicolet170SXFT-IR傅立叶红外光谱仪,Thermofisher。
1.3 实验方法
1.3.1 棕榈酸交联淀粉酯的合成
1.3.1.1 棕榈酰氯的合成方法
在150 mL三颈烧瓶中加入0.1 mol棕榈酸,水浴加热至溶解(67 ℃),搅拌下滴加0.16 mol(11.6 mL)氯化亚砜,30 min滴完,继续搅拌4 h。停止反应后,减压蒸馏回收剩余氯化亚砜,得到脂肪酰氯将反应液倾入干燥的100 mL滴液漏斗中,混匀,密闭备用。
1.3.1.2 土豆交联淀粉的制备
参考闵玉涛等[25]的方法制备土豆交联淀粉。称取50 g土豆淀粉,溶解于75 mL碱性NaCl溶液(3.75 g NaCl和0.75 g NaOH溶于125 mL蒸馏水中配制而成)中,置于50 ℃恒温水浴锅中。搅拌5 min后逐滴加入含有环氧氯丙烷的碱液(碱性NaCl溶液12.5 mL,环氧氯丙烷1 mL),搅拌下反应6 h。反应完毕,用稀HCl调pH值至7.0,静置30 min后,离心(1 000×g,10 min,4次),去上清液,将底部沉积物转移到搪瓷盘中,置于干燥箱中,55 ℃下干燥,研磨,得土豆交联淀粉。
1.3.1.3 棕榈酸交联淀粉酯的合成
在装有搅拌器和回流冷凝水的三口烧瓶中,依次加入一定量的土豆交联淀粉和吡啶,搅拌使其充分分散,95 ℃下活化反应1 h后,调节反应温度,滴加棕榈酸酰氯,30 min滴完,反应一定时间,冷却,将产物加入到无水乙醇中,搅拌,将酯化产物沉析,抽滤,用乙醇及苯洗涤,最后用水多次洗涤,滤饼经70 ℃真空干燥24 h,即得粉末状不溶于水的棕榈酸交联淀粉酯。
1.3.2 月桂酸、豆蔻酸淀粉酯的制备
参照棕榈酸淀粉酯的制备方法制备月桂酸、豆蔻酸淀粉酯。
1.3.3 产物表征(傅立叶红外测试)
样品真空干燥24 h后,用溴化钾(KBr)混合压片法,在Nicolet170SXFT-IR型红外光谱仪上进行测试,连续60次扫描,仪器分辨率4 cm-1,分析范围400~4 000 cm-1,波数精度0.01 cm-1。
1.3.4 消化性能研究
按宋彦显等[27]构建的淀粉仿生消化消化法测定新型酯化淀粉的消化性能,取干净的透析袋,加入1 mL 0.5 %淀粉糊,0.5 mL稀释好的α-淀粉酶,封口后放入装有200 mL磷酸盐缓冲溶液(pH 6.9)的塑料瓶中(预先在37 ℃恒温水浴中保温)。继续37 ℃保温,不时摇动,每30 min取透析液0.5 mL于1支试管中,共3 h,6支试管分别编号1、2、3、4、5、6,另取1支试管(编号0),加入0.5 mL缓冲溶液,作为空白对照。向每支试管中分别加入0.6 mL苯酚和4 mL浓硫酸并摇匀,沸水浴加热30 min,流水冷却至室温,于485 nm下测定吸光度值,并记录数据,根据这些数据绘制时间与吸光度值曲线图。最后对它们的消化性能加以比较,以考察脂肪酸链的长短对淀粉的抑制强度及对消化性能的影响。
1.3.5 酯化度的测定
精确称取淀粉酯0.5 g,放入250 mL碘量瓶中,加入20 mL乙醇,振荡。加20 mL 0.2 mol/L NaOH标准溶液,盖紧瓶口,磁力搅拌60 min进行皂化反应,加1~2滴1%酚酞指示剂。将已皂化含过量碱的溶液用0.1 mol/L HCl标准溶液滴定至粉红消失,同时做空白。
酯化度(每100个葡萄糖单元上连有的酸的个数)的计算如公式(1)所示:
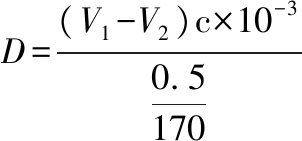
(1)
其中:V1,空白消耗的HCl标准溶液的体积,mL;V2,样品消耗的HCl标准溶液的体积,mL;c,HCl标准溶液的浓度(0.1mol/L);0.5/170,0.5 g淀粉含有葡萄糖单元物质的量,mol。
2 结果与讨论
2.1 棕榈酸交联淀粉酯的合成
2.1.1 酰氯的制备
原料氯化亚砜和产物酰氯均易水解,因此反应系统必须干燥无水。用氯化亚砜与制备的酰氯,副产物都是气体,易于纯化。
2.1.2 棕榈酸交联淀粉酯的合成
对比环氧氯丙烷交联淀粉的红外谱(图1)和酯化后产物的红外图谱(图2),发现酯化产物在1 742 cm-1处出现尖锐而明显吸收峰,这是由酯键中C![]() O伸缩振动产生的,在2 925、2 863 cm-1处有属于饱和碳链(C—C)的吸收峰。分析表明,该产物为酸淀粉酯,即酯化反应已成功进行。
O伸缩振动产生的,在2 925、2 863 cm-1处有属于饱和碳链(C—C)的吸收峰。分析表明,该产物为酸淀粉酯,即酯化反应已成功进行。
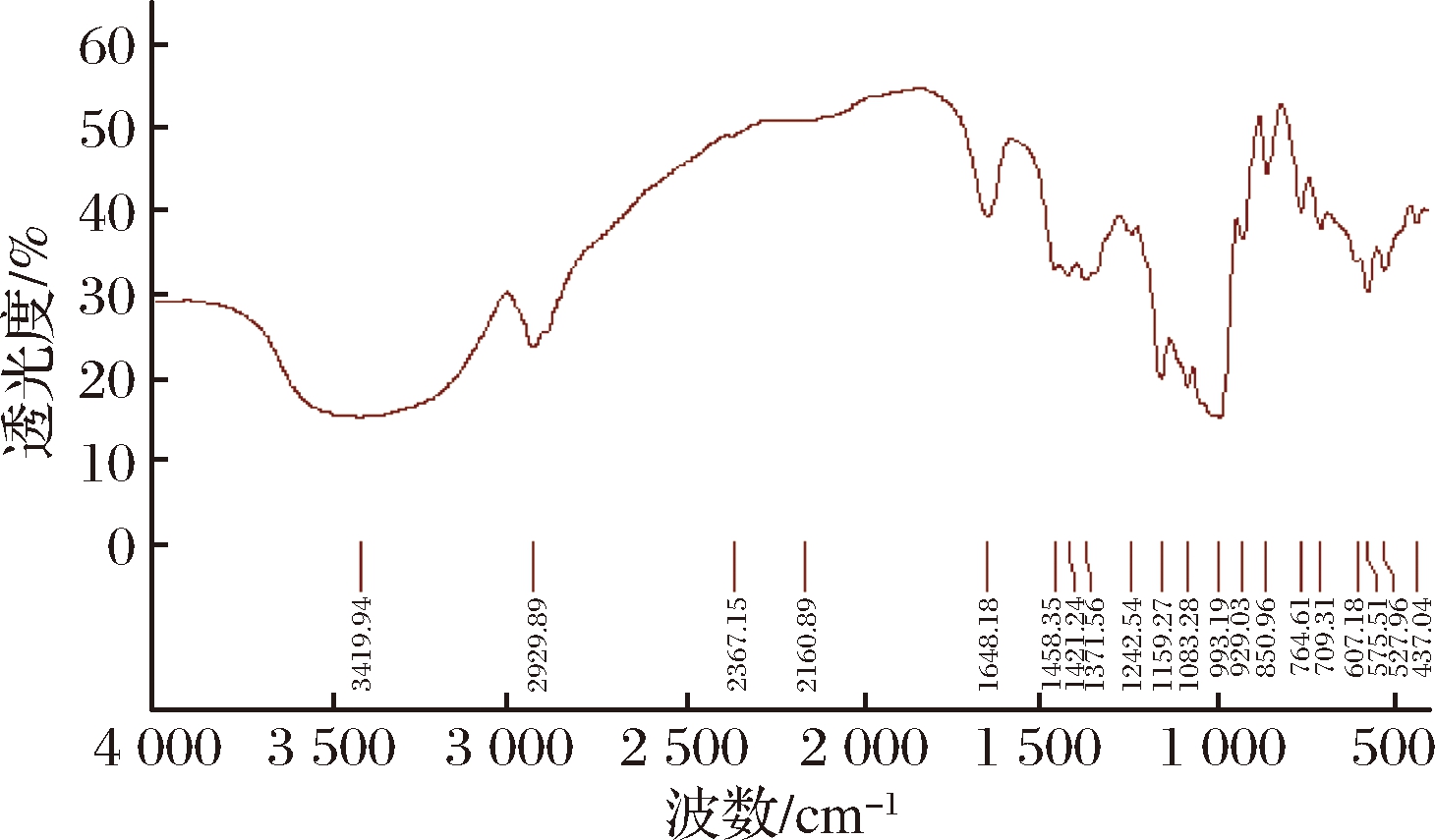
图1 环氧氯丙烷土豆交联淀粉的红外图谱
Fig.1 Infrared spectrum of epoxy chloropropane cross-linked potato starch
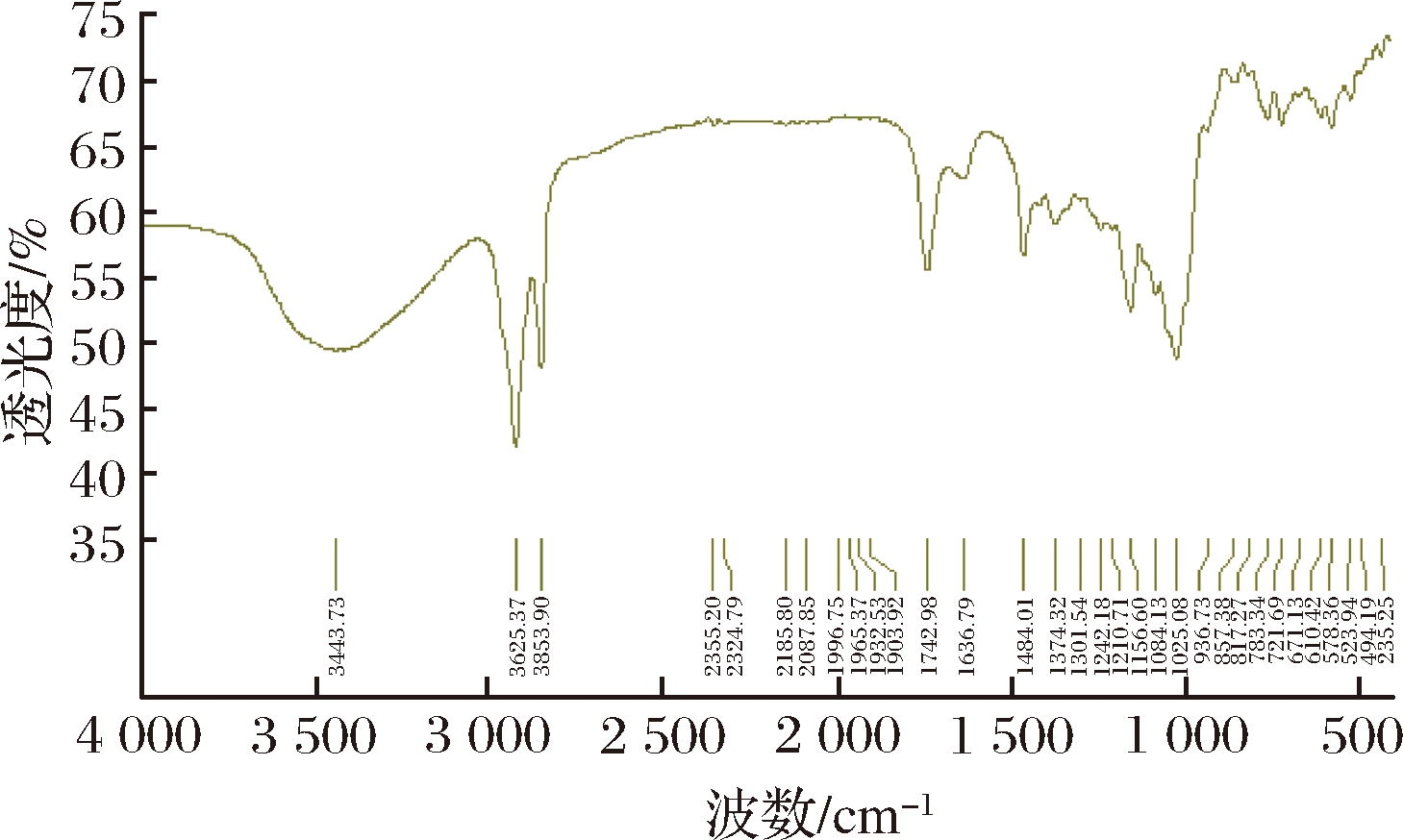
图2 棕榈酸交联淀粉酯红外图谱
Fig.2 Infrared spectrum of palmitate crosslinked starch ester
2.2 月桂酸及肉豆蔻酸酯化淀粉的制备
图3和图4在1 747 cm-1处(酯键中C![]() O伸缩振动产生)都有明显吸收峰,说明存在酯键,由于制备过程中未反应的酸已被乙醇洗涤除去,所以断定月桂酸和肉豆蔻酸已经与交联淀粉分子发生酯化反应,形成酯键。
O伸缩振动产生)都有明显吸收峰,说明存在酯键,由于制备过程中未反应的酸已被乙醇洗涤除去,所以断定月桂酸和肉豆蔻酸已经与交联淀粉分子发生酯化反应,形成酯键。
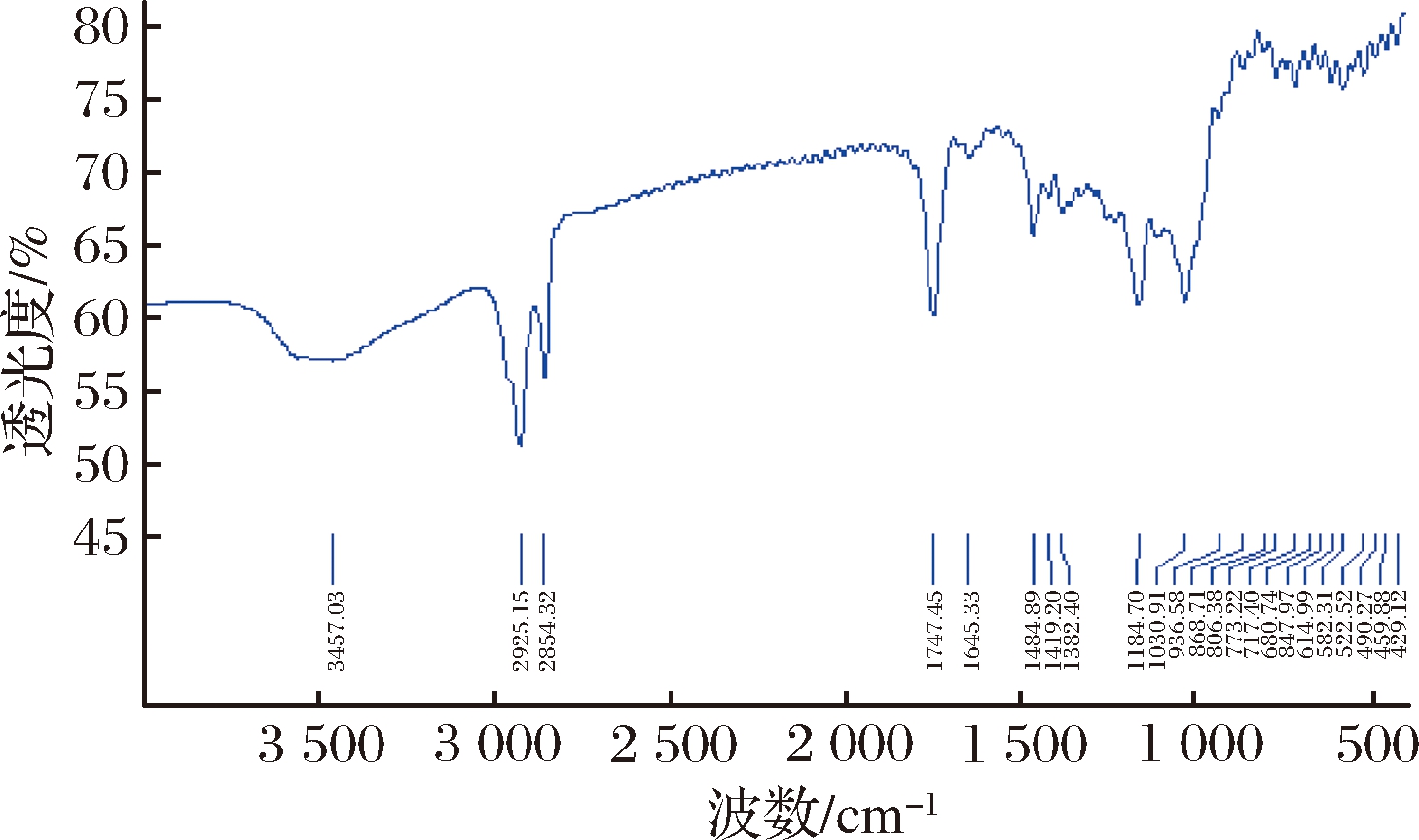
图3 月桂酸交联淀粉酯的红外图谱
Fig.3 Infrared spectrum of lauric acid crosslinked starch ester

图4 肉豆蔻酸交联淀粉酯的红外图谱
Fig.4 Infrared spectrogram of the crosslinked starch ester of nutmeg acid
2.3 酯化度的测定
经测定它们的酯化度分别为:月桂酸淀粉酯2.49、肉豆蔻酸淀粉酯2.43、棕榈酸淀粉酯2.38。它们的酯化度稍有差别,这可能是3种酸随碳链的增长反应活性降低所致。
2.4 三种酯化淀粉消化性能比较
3种酯化淀粉消化性能都比原交联淀粉有很大程度的降低(月桂酸淀粉酯80.4%、肉豆蔻酸淀粉酯76.6%、棕榈酸淀粉酯75.5%)。它们的消化性能差别不大,但仍然可以看出一些规律,3种酯化淀粉消化性能与3种酸对α-淀粉酶的抑制强度有一定关系(月桂酸,肉豆蔻酸和棕榈酸对α-淀粉酶抑制率分别为34.34%、31.71%和31.01%)[26],抑制率越大,酯化后的淀粉消化性能越差,但这也可能是因为它们酯化度差别的影响,酯化度越高,消化性能越差(图5)。

图5 三种交联酯化淀粉的消化性能
Fig.5 In vitro digestive properties of three cross-linked esterified starch
3 结论
用α-淀粉酶抑制因子月桂酸和肉豆蔻酸和棕榈酸对环氧氯丙烷土豆交联淀粉酯化后,得到的具有α-淀粉酶抑制活性基团的新型抗性淀粉,他们的消化性能都比原交联淀粉有很大程度地降低(月桂酸淀粉酯80.4%、肉豆蔻酸淀粉酯76.6%、棕榈酸淀粉酯75.5%)。新型抗性淀粉的消化性能与α-淀粉酶抑制因子对α-淀粉酶的抑制强度及酯化反应的酯化度有一定关系,抑制率越大,酯化度越高,生成的新型抗性淀粉消化性能越差。
[1] 中华医学会糖尿病学分会.中国型糖尿病防治指南[J].中国糖尿病杂志, 2014, 22(8):3.
[2] International Diabetes Federation. [J].International Diabetes Federation, 2013, 6(6):8.
[3] FLORENCE N T, BENOIT M Z,ALEXANDRA T,et al. Antidiabetic and antioxidant effects of Annona muricata (Annonaceae),aqueous extract on streptozotocin-induced diabetic rats[J]. Journal of Ethnopharmacology, 2014, 151(2):784-790.
[4] 《中国医院院长》编辑部.中国2013年糖尿病患病人数达9840万人[J].中国医院院长, 2013, 23(1):23.
[5] MARCOVECCHIO M, MOHN A, CHIARELLI F, et al. Type 2 diabetes mellitus in children and adolescents[J].Journal of Endocrinological Investigation, 2005, 28(11):853-863.
[6] POSUWAN J, PRANGTHIP P, LEARDKAMOLKARN V, et al. Long-term supplementation of high pigmented rice bran oil (Oryza sativa L.) on amelioration of oxidative stress and histological changes in streptozotocin-induced diabetic rats fed a high fat diet; Riceberry bran oil[J]. Food Chemistry, 2013, 138(1):501-508.
[7] CHARPENTIER G, RIVELINE J P, VARROUD-VIAL M. Management of drugs affecting blood glucose in diabetic patients with renal failure[J]. Diabetes Metab, 2000, 26(4):73-85.
[8] LORDAN S, SMYTH TJ, SOLER-VILA A, et al. The alpha-amylase and alpha-glucosidase inhibitory effects of Irish seaweed extracts[J].Food Chemistry, 2013, 141(3):2 170-2 176.
[9] PANDEY A, NIGAM P, SOCCOL, C R, et al. Advances in microbial amylases[J].Biotechnology and Applied Biochemistry, 2000, 31(2):135-152.
[10] 马艳丽, 让一峰,赵伟,等. 白芸豆α-淀粉酶抑制剂在低方便粥中的应用[J].江苏大学学报自然科学版, 2018, 39(1):45-48.
[11] LOW L C, MBCHB M D, FRCPCH, et al. The epidemic of type 2 diabetes mellitus in the Asia-Pacific region[J].Pediatric Diabetes, 2010, 11(4):212-215.
[12] SUBRAMANIAN R, ASMAWIM Z, SADIKUN Z. In vitro α-glucosidase and α-amylase enzyme inhibitory effects of Andrographis paniculata extract and andrographolide [J].Acta Biochimica Polonica, 2008, 55(2):391-395.
[13] RIDA S M, EL-HAWASH S A, FAHMY H T, et al. Synthesis and in vitro evaluation of some novel benzofuran derivatives as potential anti-HIV-1,anticancer,and antimicrobial agents[J].Archives of Pharmacal Research, 2006, 29(1):16-25.
[14] MATSUI T, TANAKA T, TAMURA S, et al. Glucosidase inhibitory profile of catechins and theaflavins[J].Journal of Agricultural and Food Chemistry, 2007, 55(1):99-105.
[15] HEO SJ, HWANG J Y, CHOI J I, et al. Diphlorethohy droxycarmalol isolated from Ishige okamurae,a brown algae, a potent α-glucosidase and α-amylase inhibitor, alleviates postprandial hyperglycemia in diabetic mice[J].European Journal of Pharmacology, 2009, 615(1):252-256.
[16] 王洁,徐同成,刘丽娜,等.马铃薯淀粉消化性能研究进展[J].中国食物与营养, 2016, 22(5):34-37.
[17] 王蕾蕾, 何芳,樊慧茹,等.高抗性淀粉大米血糖生成指数测定及对糖尿病患者血糖调控的干预研究[J].营养学报, 2017, 39(2):197-199.
[18] KEENAN M J, ZHOU J, HEQSTED M, et al. Role of resistant starch in improving gut health, adiposity, and insulin resistance[J].Advances in Nutrition, 2015, 6(2):198-205.
[19] HEDEMANN M S,HERMANSEN K,PEDERSEN S,et al. Resistant starch but not enzymatically modified waxy maize delays development of diabetes in zucker diabetic fatty rats[J].Journal of Nutrition, 2017, 147(5):825-834.
[20] BODINHAM C L, SMITH L, THOMAS E L, et, al. Efficacy of increased resistant starch consumption in human type 2 diabetes[J].Endocr Connect, 2014, 3(2):75-84.
[21] 姜余梅, 杨艳,陈晓姗,等.灵芝孢子和抗性淀粉对糖尿病大鼠糖脂代谢及氧化应激的协同干预[J].食品科学, 2014, 35(23):288-291.
[22] LIN C H, CHANG D M, WU D J, et al. Assessment of blood glucose regulation and safety of resistant starch formula-based diet in healthy normal and subjects with type 2 diabetes[J].Medicine (Baltimore), 2015, 94(3):1 332.
[23] SUN Hui, MA Xiaohan, ZHANG Shiqi, et al. Resistant starch produces antidiabetic effects by enhancing glucose metabolism and ameliorating pancreatic dysfunction in type 2 diabetic rats[J].International Journal of Biological Macromolecules, 2018, 110(3):2 776-2 784.
[24] WANG Qi, ZHENG Yafeng, ZHUANG Weijing, et al.Genome-wide transcriptional changes in type 2 diabetic mice supplemented with lotus seed resistant starch[J]. Food Chemistry, 2018, 264(4):427-434.
[25] 闵玉涛, 宋彦显,马庆一,等.环氧氯丙烷交联淀粉的制备及其体外消化性能的研究[J].食品工业科技, 2011, 32(8):261-263.
[26] 宋彦显, 闵玉涛,徐凤才,等.五倍子中α-淀粉酶抑制因子的研究[J].食品科学, 2011, 32(19):116-119.
[27] 宋彦显, 闵玉涛.淀粉仿生消化法的建立及其应用[J].食品研究与开发, 2012, 33(11):68-71.