牛樟芝(Antrodia cinnamomea,Antrodia camphorata,Taiwanofungus camphoratus)是我国台湾特有的珍稀食用与药用真菌。牛樟芝素有“神芝”、“森林中的红宝石”之称[1-2]。现代研究发现,牛樟芝具有抗癌、保肝、抗炎、抗病毒、抗氧化、调节免疫以及降血脂等多种生物活性。目前,从牛樟芝子实体及菌丝体中分离得到100多种化合物,主要包括三萜、多糖、泛醌类衍生物以及马来酸和琥珀酸衍生物等[3-7]。其中,泛醌衍生物是牛樟芝中特有的生物活性物质,具有显著的抗癌活性和较强的抗炎活性。迄今为止,在牛樟芝分离鉴定了12种新的泛醌衍生物,其中包括antroquinonol, antroquinonol B, antroquinonol C, antroquinonol D, antroquinonol L, antroquinonol M, antrocamol LT1, antrocamol LT2, antrocamol LT3, 4-acetyantroquinonol B, 4-acetylantrocamol LT3以及antrocinnamone[8-12]。其中,antroquinonol因其具有极佳的生物活性被国内外学者广泛关注。LEE等[8]研究发现,antroquinonol对胰腺癌、肝癌、非小细胞型肺癌以及阿尔茨海默病等具有显著的抑制作用[13-20],目前,antroquinonol已完成了美国FDA二期临床实验[21],是具有优良前景的抗癌化合物。
牛樟芝野生子实体生长极其缓慢,且价格昂贵,无法满足社会需求。为了改善野生牛樟芝子实体供不应求的现状,人们对牛樟芝的人工培养进行了大量研究。目前主要有3种人工培养方式:段木栽培法、固态发酵法(包括皿培法)和液态发酵法[5, 22]。相对于液态发酵法,固态发酵牛樟芝菌丝体中活性成分含量较高、种类较多[23]。相较于段木栽培法,固态发酵周期具有时间更短,生产原料不受限制等优点。目前,国内外学者对antroquinonol的研究多集中在药理活性研究,而对于通过发酵条件的优化和代谢调控等方式来提高樟芝菌发酵中antroquinonol产量的研究却鲜有报道。目前,仅有以大米为基质进行牛樟芝固态发酵条件研究的报道[24-26],其中路瑞秋等[25]通过对樟芝菌体的细胞通透性和代谢进行调控,最终antroquinonol的产量相对于对照组提升了232.1%,达865.3 mg/kg,为目前已有报道的较高水平。
然而在丝状真菌的固态发酵过程中,有很多因素会对菌丝的生长以及次级代谢产生较为显著的影响[27]。其中,固态发酵基质作为菌丝生长的支撑物以及营养供应具有很重要的作用[28]。有研究报道发现,不同的谷物基质对固态发酵的次级代谢产物的类型以及产量均有影响,其中SRIANTA等[29]研究发现,不同基质上的菌丝生长以及红曲色素产量具有很大的差异,其中大米为最适的红曲色素生产基质。TAKESHITA等[30]研究发现用黑米和贝尼曲所酿造的酒精饮料对DPPH自由基的清除活性较好。YANG等[31]研究发现,生长在燕麦上的牛樟芝菌丝体的甲醇提取物具有更强的抗氧化性。
由此可见,固态发酵基质的类型和发酵条件的筛选能显著影响丝状真菌固态发酵过程中活性物质的合成水平。本研究对牛樟芝固态发酵产antroquinonol的基质进行筛选,并对固态培养时间、初始含水量,接种量以及外加氮源等因素进行优化,在此基础上结合响应面法对发酵条件进行优化筛选。
1 材料与方法
1.1 材料与试剂
牛樟芝菌,本研究室保藏菌种。
葡萄糖(纯度≥99%),上海生工。蛋白胨、酵母浸粉、酵母提取物、玉米浆粉、(NH4)2SO4、NaNO3为生化试剂,其他均为分析纯。
1.2 仪器与设备
电热恒温水浴锅(C-86),广州越秀医疗器械厂;电热恒温培养箱(HH·B11·360),连云港医疗器械设备厂;全温摇床柜(HYG-A),太仓市实验设备厂;高压蒸汽灭菌锅(LDZX-40BI),上海申安医疗器械厂;电热鼓风干燥箱(101-1型),上海博讯医疗设备厂;高效液相色谱(1525),美国waters公司。
1.3 方法
1.3.1 培养基条件
牛樟芝菌接种于加富PDA斜面,28 ℃避光培养7 d,4 ℃保藏。
孢子悬浮液制备:利用无菌水将加富PDA斜面表层的孢子洗下,玻璃珠打散后镜检,使孢子数达到1×106 个/mL。
固态种子培养:葡萄糖20 g/L,玉米浆粉12 g/L,大豆水解液35 mL/L,MgSO4 ·7H2O 1 g/L,K2HPO4 0.5 g/L,柠檬酸0.5 g/L,pH自然,500 mL三角瓶中装120 mL培养基,121 ℃灭菌20 min,接种量为10 mL,28 ℃,130 r/min下培养3 d。
固态发酵培养:谷物类物质100 g,大豆水解液60 mL/L,KH2PO4 0.5 g/L,MgSO4·7H2O 0.5 g/L,初始pH自然,121 ℃灭菌30 min,培养基初始含水量50%,按照体积分数15%进行接种,28 ℃下培养30 d。
大豆水解液制备:称取大豆100 g,清水浸泡24 h,用豆浆机将浸泡后的大豆打磨粉碎后加水定容至1 L,再加入质量分数为0.1%的酶活力为2~3万的中性蛋白酶,50 ℃水浴4 h充分水解后制成质量浓度为100 g/L的大豆水解液(含氮量为6.97%)。
1.3.2 培养条件的优化
在初始固态发酵培养基的基础上,探讨了谷物类型、发酵时间、初始含水量、接种量和外加氮源种类及其添加量等发酵条件对牛樟芝固态发酵antroquinonol产量的影响,为进一步的响应面实验确定最佳的取值。
初始含水量/%=
(1)
1.3.3 Box-Behnken试验设计
在单因素确定的最优的谷物类物质基础上,选取氮源添加量X1、初始含水量X2、接种量X3为自变量,antroquinonol产量Y为响应值,对牛樟芝固态发酵antroquinonol条件进行Box-Behnken试验,设计因素如表1所示。
表1 Box-Behnken试验因素设计
Table 1 Facters in Box-Behnken experiment
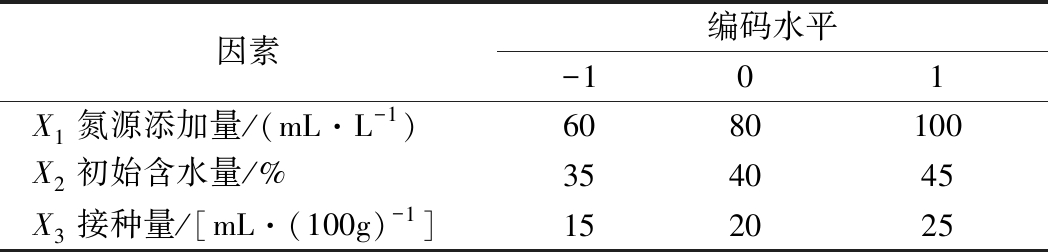
因素编码水平-101X1氮源添加量/(mL·L-1)6080100X2初始含水量/%354045X3接种量/[mL·(100g)-1]152025
1.3.4 检测与分析
1.3.4.1 牛樟芝固态发酵干物质损失的测定
研究发现,在固态发酵中干物质的损失与单位面积内生物量具有高度的相关性,因此可用干物质的损失代替生物量的变化[32-33]。将发酵所得牛樟芝固态谷物类物质在45 ℃烘箱中烘干至恒重并称重,测定最终含水量并计算干物质损失量[34]。
干物质损失![]()
(2)
1.3.4.2 牛樟芝固态发酵antroquinonol的测定
用粉碎机将烘干的谷物类物质打磨成粉末状,在50 mL比色管中按照料液比1∶20(g∶mL)添加95%乙醇并于50 ℃水浴锅中振荡萃取90 min后取出,上下振荡2~3次,冷却至室温后取5 mL用0.22 μm有机微孔滤膜过滤,进行HPLC分析[35]。
1.3.4.3 antroquinonol标准曲线测定
准确称取1mg antroquinonol标准品(由本实验室自制,纯度≥95%)用乙腈溶解配制为质量浓度1 g/L的标准溶液,将其稀释为质量浓度20、40、60、800、100 mg/L的溶液进行HPLC检测,以antroquinonol浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.3.4.4 不同基质颗粒度测定
随机选取至少25颗基质排列成一排,用游标卡尺测定,重复3次,算出不同基质的颗粒度。
1.3.4.5 大米直链淀粉含量测定
参照段传玲等[36]的方法利用紫外分光光度计进行直链淀粉含量测定。
1.3.4.6 数据分析
Box-Behnken设计响应值按照二次多项式回归方程模型进行回归分析[37]
![]()
(3)
式中:Y为响应预测值;xi为自变量;β0为截距;βi为线性系数;βii为平方系数;βij为交互作用系数[38]。所有数据均使用Design-expert 8.06统计分析软件进行回归方差分析。
2 结果与讨论
2.1 牛樟芝固态发酵产antroquinonol基质筛选
如图1所示,在不同的谷物类物质上,牛樟芝产antroquinonol的能力有明显差异,相比于其他的谷物类物质,最适的谷物类基质为小米,antroquinonol的产量达325.0 mg/kg,而以金龙鱼粳米作为固态基质时antroquinonol产量最低,仅有29.6 mg/kg。有文献报道,除了谷物类基质的营养成分不同之外,在固态发酵过程中基质的颗粒度对实验结果也会有显著的影响,颗粒较小导致培养基在培养过程中容易结团,颗粒较大会影响菌体对内部营养物质的利用[39]。如图1所示,在不同米的类型中,小米的颗粒度最小,其次为泰国香米,其余的4种稻米颗粒度相对于这2种都较大,而antroquinonol产量也较低。同种类型的基质中,去皮小麦的颗粒度大于未去皮小麦颗粒度,因此,未去皮小麦中antroquinonol产量高于去皮小麦。但颗粒度与antroquinonol产量关系也存在特殊情况,如图1所示,玉米粒是颗粒度最小的一种谷物类物质,但其antroquinonol产量不是最高的,观察其发酵过程可知,由于其颗粒度过小因而发酵过程中结团较为严重,因此不适合牛樟芝高产antroquinonol。当用黄豆渣作为固态基质的发酵过程中发现,因其吸水性极强,基质结团十分严重,导致牛樟芝菌丝几乎无法生长,因此也几乎无法检测到antroquinonol。另有研究表明,除了颗粒度因素之外,稻米中直链淀粉的含量与米的硬度、黏度以及弹性等均具有密切的关系,直链淀粉含量越高,米粒越硬,黏性越小,米粒干燥而蓬松,色泽灰暗,相反,直链淀粉含量越低,米粒软糯,黏度较大,容易结团[40]。结合图1的实验数据选取几种籼米,粳米和小米进行淀粉含量测定。
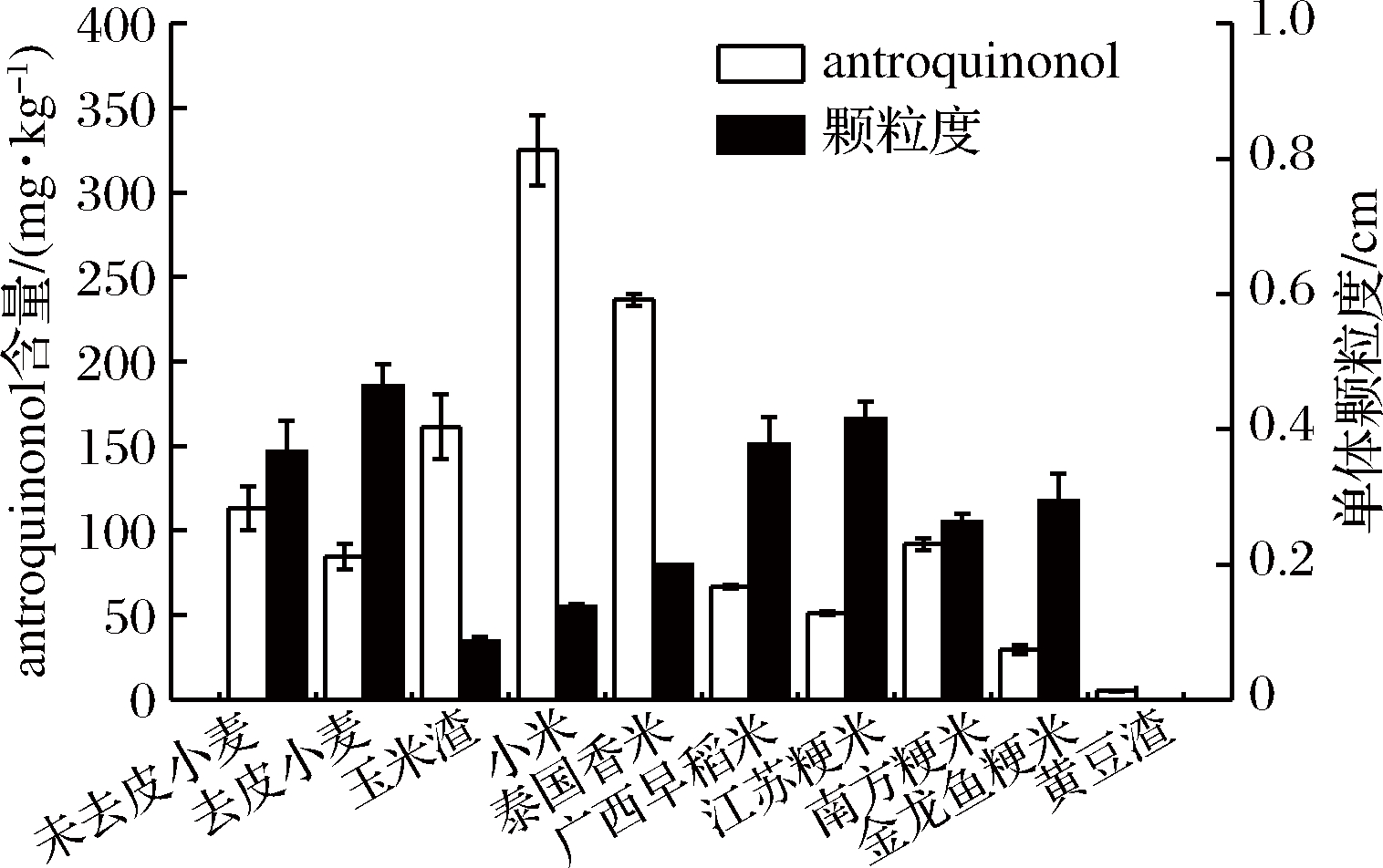
图1 不同固态基质对牛樟芝固态发酵产antroquinonol的影响
Fig.1 Effect of different substrates on the production of antroquinonol in solid-state fermentation of Antrodiacinnamomea
由表2可知,江苏粳米和金龙鱼粳米的直链淀粉含量较低,黏度较大,因此antroquinonol产量也相对较低。而泰国香米和广西早稻米的直链淀粉含量都相对较高,这就导致在固态发酵过程中米粒硬度较大,营养利用不充分,antroiquinonol产量也不高。而小米中直链淀粉的含量处于较为适中的水平,antroquinonol的产量相对较高。除了直链淀粉外,也有研究报道基质中的蛋白含量,C/N比以及维生素含量也会影响丝状真菌的生长以及代谢,其中刘爱英等[41]研究发现,蛋白含量高,C/N比小以及垩白度适中的稻米较适合红曲菌固态发酵产莫纳可林K。
表2 不同米中直链淀粉含量对牛樟芝固态发酵的影响
Table 2 Effect of amylose content in different kinds of rice in solid-state fermentation of Antrodia cinnamomea

谷物类型直链淀粉含量/%实验结果江苏粳米20.2米粒软糯潮湿,黏度大,结团严重,菌丝生长迟缓,antroquinonol产量51.3 mg/kg金龙鱼粳米19.1米粒软糯潮湿,黏度大,结团严重,菌丝生长迟缓,antroquinonol产量29.6 mg/kg泰国香米28.1米粒干燥松散,硬度大,结团较少,菌丝生长迟缓,antroquinonol产量236.6 mg/kg广西早稻米27.5米粒干燥松散,硬度大,结团较少,菌丝生长迟缓,antroquinonol产量66.8 mg/kg小米23.6米粒颗粒适中,有结团但不严重,菌丝生长正常,antroquinonol产量325.0 mg/kg
冯衫等[42]研究表明,在固态基质中添加的维生素对槐耳菌丝生长具有明显促进作用,但结合本实验基质筛选发现,稻米中只有小米和泰国香米对antrqouinonol的产生有明显促进作用,而广西早稻米、江苏粳米、南方粳米、金龙鱼粳米中antroquinonol的产量要少于玉米渣以及2种小麦,这表明不同蛋白以及维生素含量可能也是影响菌体生长和antroquinonol产生的重要因素。因此,选用小米作为最佳的固态发酵基质进行后续实验。
2.2 牛樟芝固态发酵时间对antroquinonol产量的影响
本文在以小米为固态发酵基质的基础上对牛樟芝发酵的周期进行确定。由图2所示,随着发酵时间的增加,基质干物质的损失在不断增加,而在第17天时,固态基质的消耗速率变慢,说明菌丝生长进入了稳定期。相比于干物质消耗,antroquinonol在第12天开始合成,到第25天时产量达到最大,随后随着发酵时间的增加,antroquinonol的产量有所下降。因此,选取最佳发酵时间为25 d,antroquinonol产量为372.6 mg/kg。
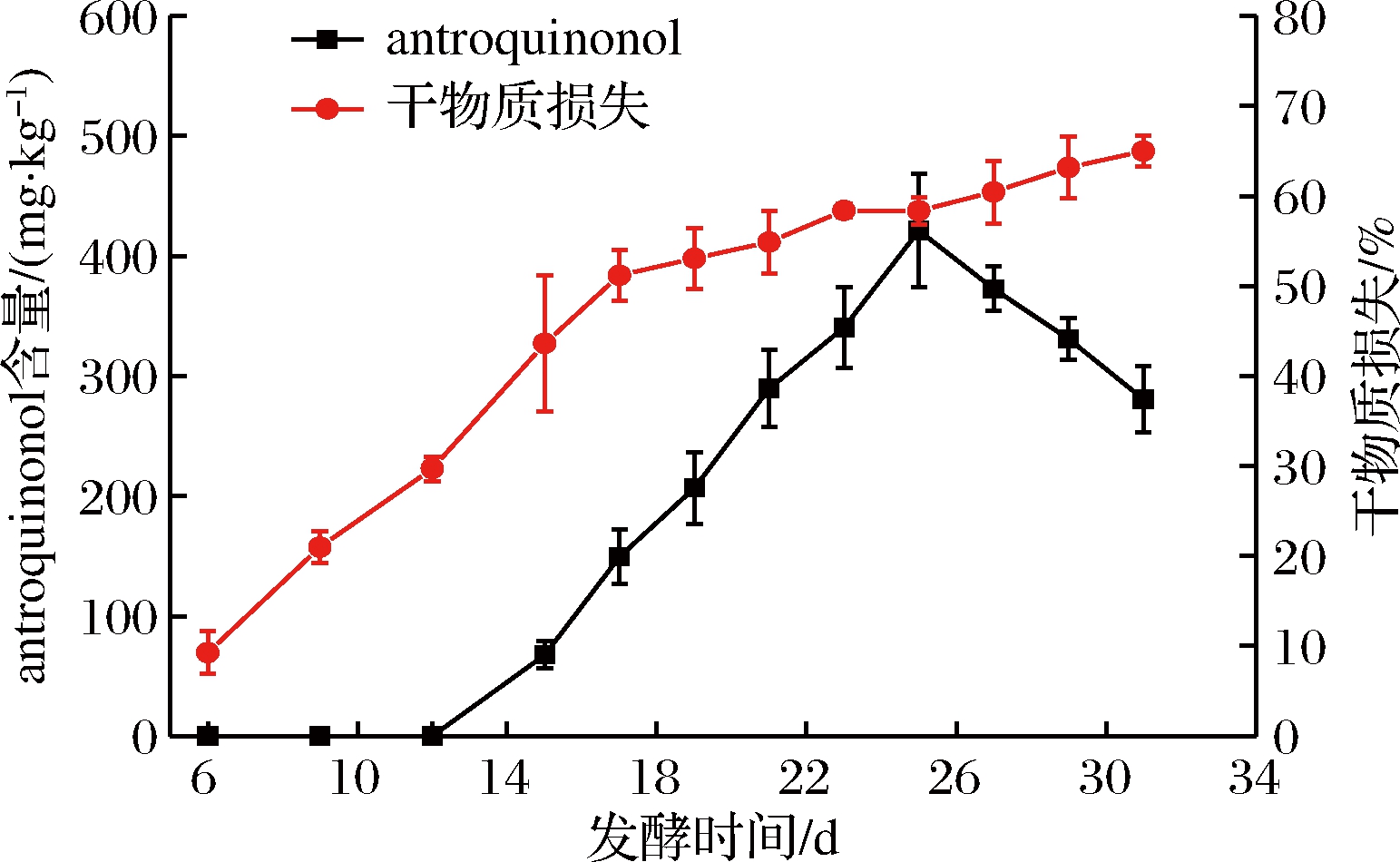
图2 发酵时间对牛樟芝固态发酵产antroquinonol的影响
Fig.2 Effect of fermentation time on the production of antroquinonol in solid-state fermentation of Antrodiacinnamomea
2.3 接种量对牛樟芝固态发酵antroquinonol产量的影响
在固态发酵过程中,接种量会对菌丝的生长和代谢产物的合成有着显著的影响[43]。因此后续选取不同的接种量进行优化实验。由图3所示,随着接种量的增大,基质干物质的损失在逐渐增大,而antroquinonol的产量呈先增大后减少趋势,这说明当接种量超过一定的程度后,大部分的基质会过多地用于牛樟芝菌丝体的生长而不利于antroquinonol的合成。当接种量为20 mL/100g基质,antroquinonol的产量最高,可达952.6 mg/kg。因此,在后续实验中以接种量为20 mL/100g基质进行实验。
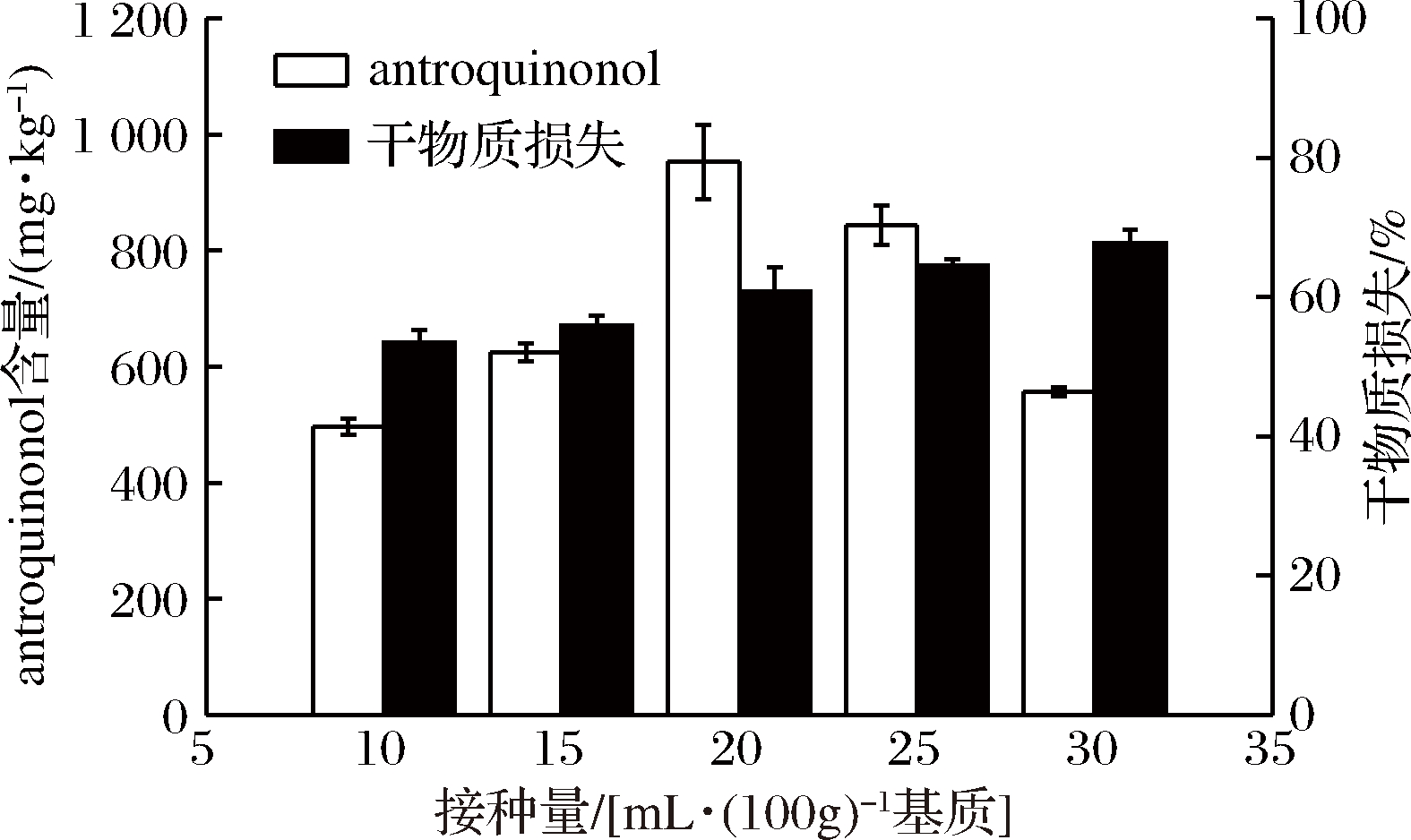
图3 接种量对牛樟芝固态发酵产antroquinonol的影响
Fig.3 Effect of inoculation amount on production on antroquinonol in solid-state fermentation ofAntrodia cinnamomea
2.4 固态发酵初始含水量对牛樟芝固态发酵antroquinonol产量的影响
初始含水量过高或者过低均不利于菌丝生长以及次级代谢的正常进行[44-45]。如图4所示,当初始含水量在40%时,antroquinonol的产量最高,可达1 318.1 mg/kg,而当初始含水量进一步增加或者减少时均不利于antroquinonol的生产。结合干物质损失分析发现,当含水量过高时,小米结团严重,导致基质间的氧传递不足,菌丝无法深入基质内部生长,因此,小米的消耗降低,营养利用不充分,而当含水量过低时,虽基质松散,但因小米本身比较硬,也不利于牛樟芝菌丝的生长。因此后续实验选择40%作为最佳的初始含水量。
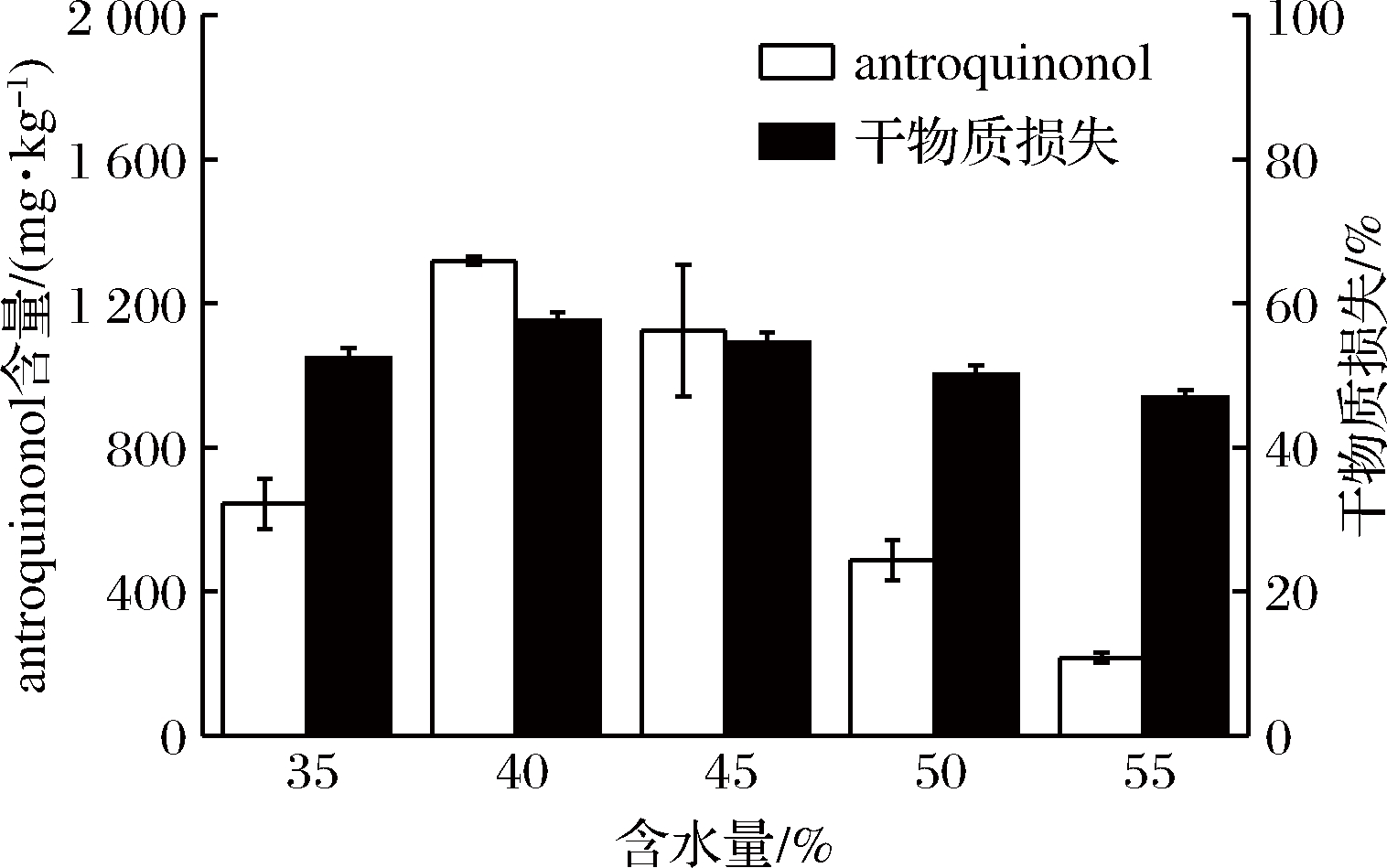
图4 初始含水量对牛樟芝固态发酵产antroquinonol的影响
Fig.4 Effect of initial moisture content on production on Antroquinonol in solid-state fermentation ofAntrodia cinnamomea
2.5 外加氮源对牛樟芝固态发酵antroquinonol产量的影响
在微生物生长过程中,合适的碳氮源是必不可少的,在固态发酵过程中,固态基质可为其提供充足的碳源,而多数情形下,外加氮源可有效地促进菌体的生长和代谢产物的合成[46]。因此,在上述实验结果的基础上,对外加氮源进行筛选和优化。实验过程中选取了6种氮源,其中有机氮源4种:酵母蛋白胨,酵母粉浸膏,大豆水解液,安琪酵母粉;无机氮源2种:硫酸铵,硝酸钠。如图5所示,在不同氮源的条件下,牛樟芝固态发酵产antroquinonol的能力有着显著的差异。
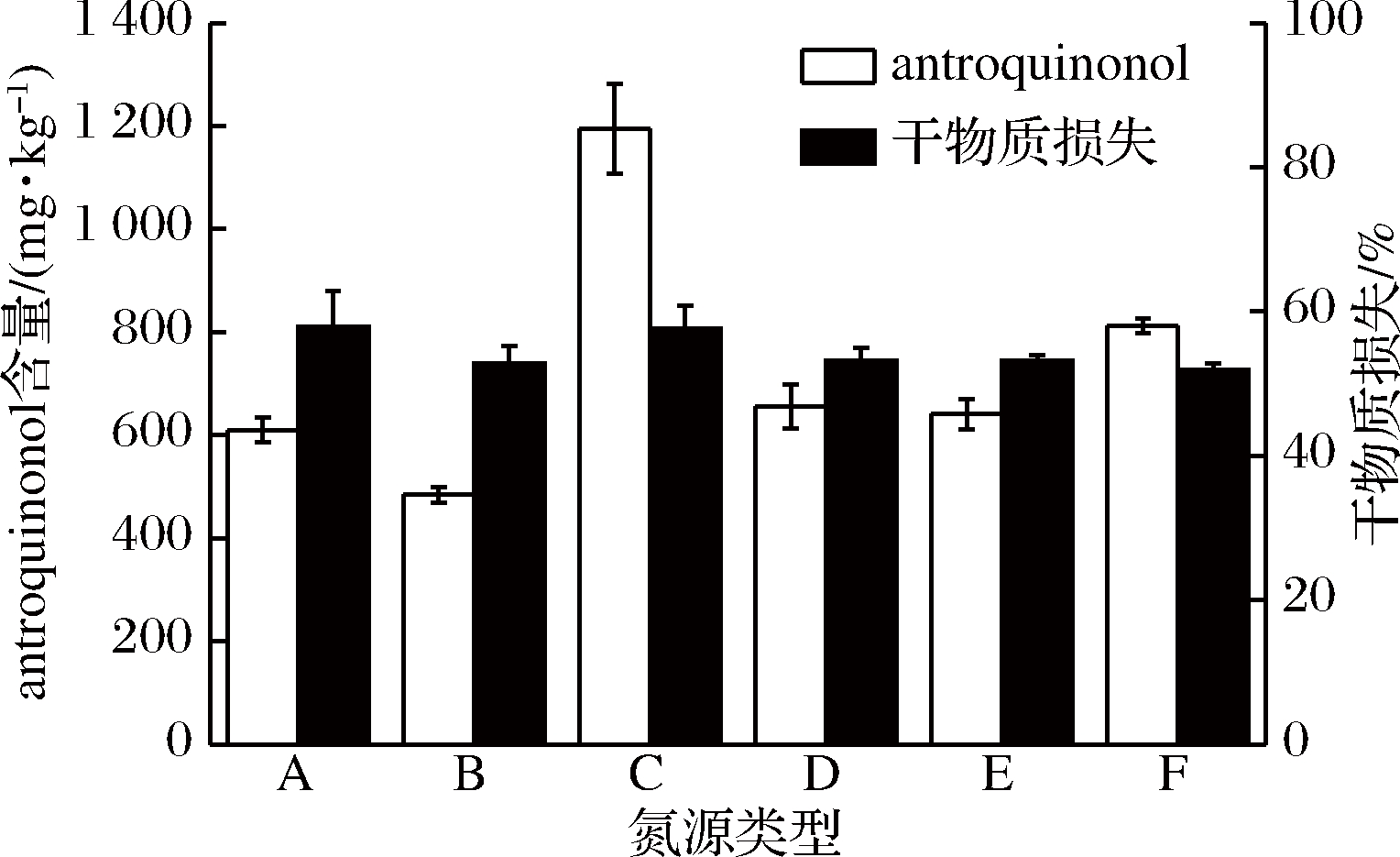
A-F分别为:酵母蛋白胨、酵母粉浸膏、大豆水解液、硫酸铵、安琪酵母粉、硝酸钠
图5 不同氮源对牛樟芝固态发酵产antroquinonol的影响
Fig.5 Effect of different nitrogen sources on production on antroquinonol in solid-state fermentation ofAntrodia cinnamomea
相比于其他几种氮源,大豆水解液中含有大量的水解大豆肽以及氨基酸等,更容易被吸收利用[47-48],因此以大豆水解液为氮源的固态发酵过程中,干物质的损失以及antroquinonol的产量相比于其他几种氮源要高,说明大豆水解液不仅仅能够很好的促进牛樟芝固态基质上菌丝的生长而且可以促进antroquinonol的合成,在此条件下,固态发酵结束后antroquinonol产量约为1194.9 mg/kg。因此后续实验以大豆水解液为最佳氮源。
2.6 外加氮源含量对牛樟芝固态发酵antroquinonol产量的影响
在上述实验基础上,对大豆水解液的添加量进行优化,结果如图6所示。
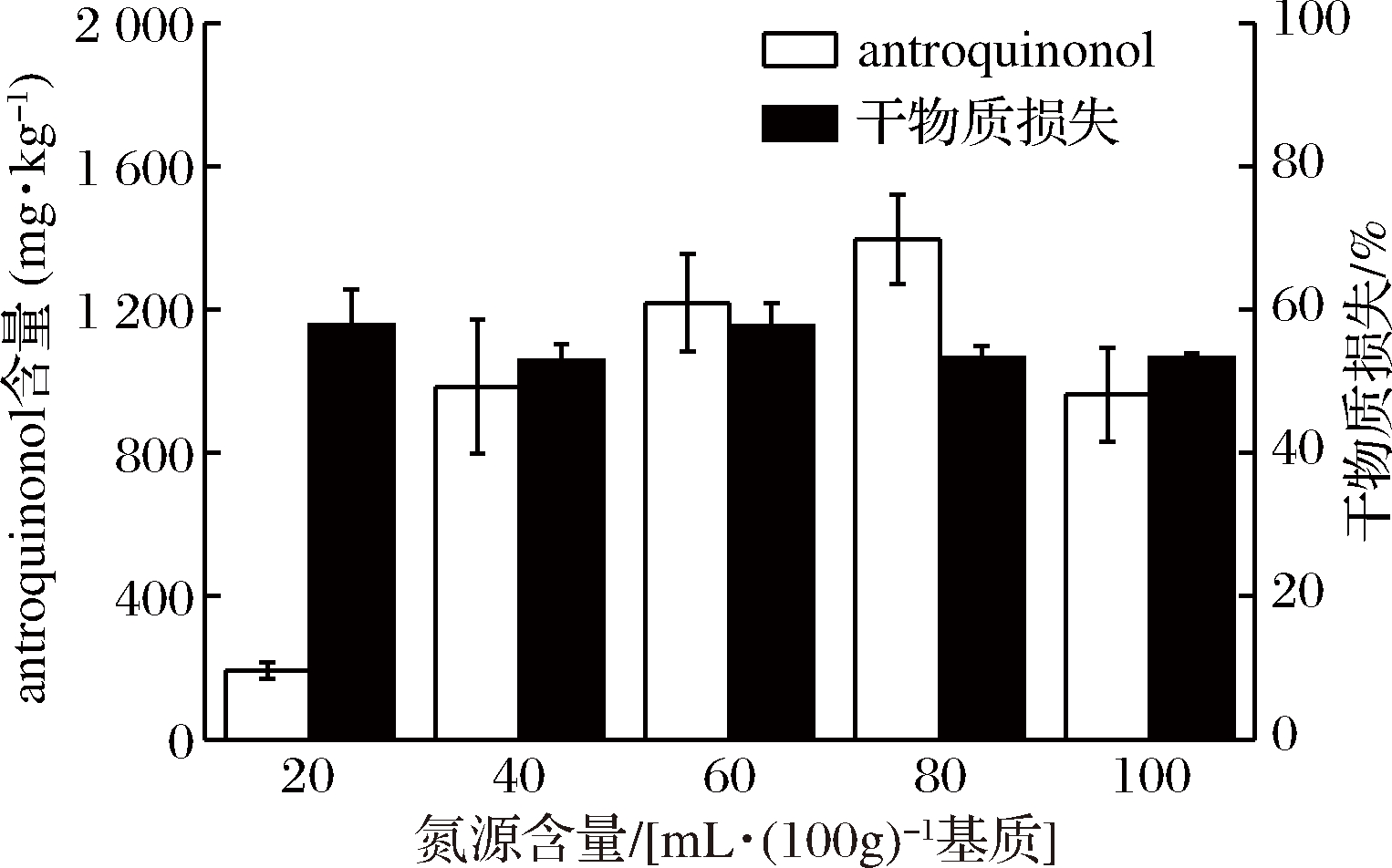
图6 氮源含量对牛樟芝固态发酵产antroquinonol的影响
Fig.6 Effect of nitrogen source on production on antroquinonol in solid-state fermentation ofAntrodia cinnamomea
发现当大豆水解液含量为80 mL/L时,固态发酵牛樟芝菌丝体产antroquinonol的能力最好,最终产量为1 395.8 mg/kg,是未优化的小米固态发酵对照组的4.3倍。
2.7 响应面实验设计结果及分析
根据单因素优化结果,选取外加氮源量(X1),基质初始含水量(X2)以及接种量(X3)为主要影响因素,根据3因素3水平设计17个实验水平,具体如表3所示。
表3 Box-Behnken试验设计和实验结果
表3 Box-Behnken design matrix along with theexperimental values of antroquinonol

试验号因素antroquinonol产量/(mg·kg-1)X1X2X3实验值a预测值偏差b10001 330.71 324.7-0.520-1-11 003.51 007.10.430-111 156.91 190.32.94-1-10958.49942.0-1.751011 227.31 204.4-1.961-101 163.01 172.40.870111 190.21 186.6-0.380001 316.71 324.70.690001 298.71 324.72.01010-1994.11 019.12.511-1101 160.41 181.01.8120001 341.71 324.7-1.313-10-11 009.81 033.62.4141101 104.81 121.41.5150001 335.71 324.7-0.81601-11 232.41 198.9-2.717-1011 016.11 019.20.3
注:a:3次实验平均值;b:偏差(%)=(预测值-实验值)×100/实验值
运用Design-expert 8.0对表3的数据进行二次回归拟合,Box-Behnken试验设计数据回归分析结果见表4。软件拟合牛樟芝固态发酵产antroquinonol回归方程如下:
![]()
由表4可知,本实验所选模型具有高度的显著性(P<0.000 1),失拟项在α=0.05水平上不显著(P=0.074 0>0.05),说明该模型的拟合性显著。Y的变异系数CV较低,仅为2.45%,表明实验操作可信;模型的决定系数![]() 存在较为显著的差异,回归方程相关系数R2=0.979 0,表明该回归方程的拟合度较好,预测值与实际实验所得数据具有高度相关性,偏差较小,因此该模型可以很好的拟合和预测牛樟芝固态发酵产antroquinonol实验。
存在较为显著的差异,回归方程相关系数R2=0.979 0,表明该回归方程的拟合度较好,预测值与实际实验所得数据具有高度相关性,偏差较小,因此该模型可以很好的拟合和预测牛樟芝固态发酵产antroquinonol实验。
表4 Antroquinonol产量回归方程方差分析
Table 4 Analysis of variance for the antroquinonolregression model
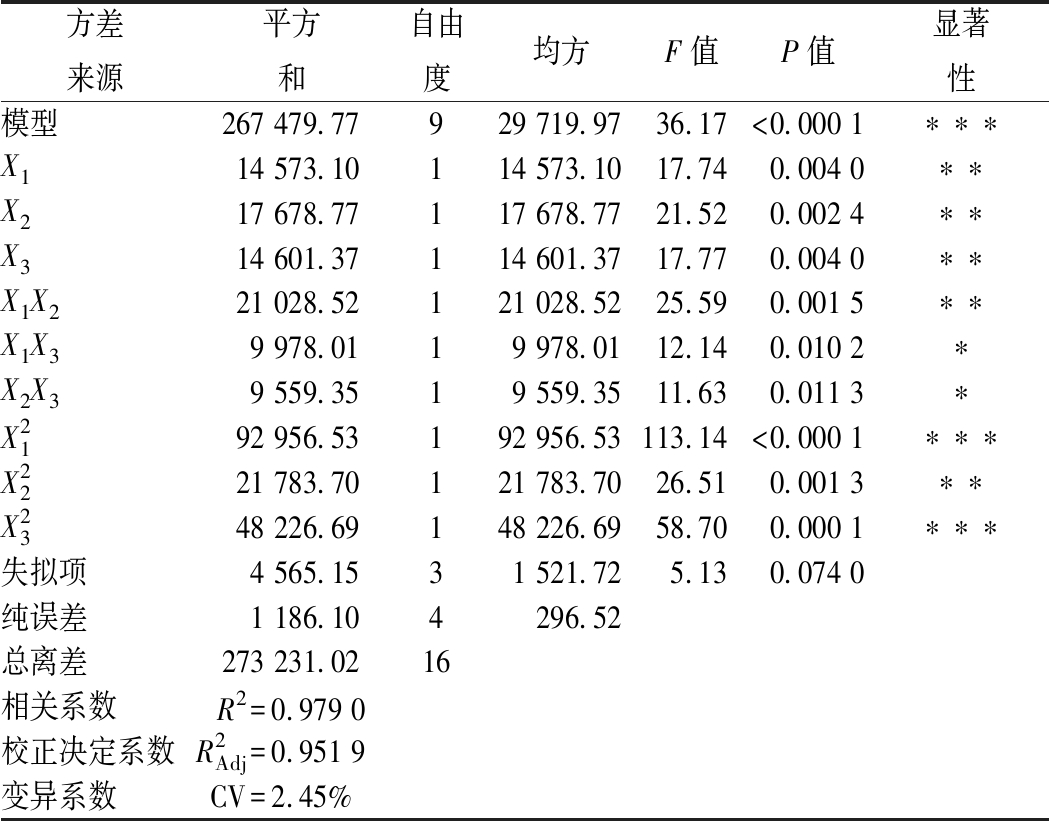
方差来源平方和自由度均方F值P值显著性模型267 479.77929 719.9736.17<0.000 1∗∗∗X114 573.10114 573.1017.740.004 0∗∗X217 678.77117 678.7721.520.002 4∗∗X314 601.37114 601.3717.770.004 0∗∗X1X221 028.52121 028.5225.590.001 5∗∗X1X39 978.0119 978.0112.140.010 2∗X2X39 559.3519 559.3511.630.011 3∗X2192 956.53192 956.53113.14<0.000 1∗∗∗X2221 783.70121 783.7026.510.001 3∗∗X2348 226.69148 226.6958.700.000 1∗∗∗失拟项4 565.1531 521.725.130.074 0纯误差1 186.104296.52总离差273 231.0216相关系数R2=0.979 0校正决定系数R2Adj=0.951 9变异系数CV=2.45%
注:***:P<0.001 差异极显著; **: P<0.01 差异高度显著;*:P<0.05 差异显著
对表4数据进一步分析发现,在α=0.01水平上因素X1,X2和X3对牛樟芝固态发酵产antroquinonol的线性效应高度显著,并且![]() 和
和![]() 对其曲面效应也高度显著,说明外加氮源量,基质初始含水量以及接种量对antroquinonol产量的影响高度显著。不仅如此,在α=0.001水平上,
对其曲面效应也高度显著,说明外加氮源量,基质初始含水量以及接种量对antroquinonol产量的影响高度显著。不仅如此,在α=0.001水平上,![]() 和
和![]() 对其曲面效应为极显著,说明外加氮源量以及接种量对antroquinonol产量的影响高于基质初始含水量。因此,在牛樟芝固态发酵产antroquinonol过程中,需要严格控制外加氮源量以及接种量,基质初始含水量也是一个非常重要的因素。各因素之间的交互作用对牛樟芝固态发酵antroquinonol产量的影响可以通过多元回归方程所作的三维空间的曲面图及等高线图直观地反映出来[49]。当等高线中的中心接近圆形表明因素之间的交互作用不显著,当等高线中心接近椭圆表明两因素交互作用显著[50]。实验所选的3种因素均具有很好的交互作用,且交互作用的强弱分别为X1X2>X1X3>X2X3。
对其曲面效应为极显著,说明外加氮源量以及接种量对antroquinonol产量的影响高于基质初始含水量。因此,在牛樟芝固态发酵产antroquinonol过程中,需要严格控制外加氮源量以及接种量,基质初始含水量也是一个非常重要的因素。各因素之间的交互作用对牛樟芝固态发酵antroquinonol产量的影响可以通过多元回归方程所作的三维空间的曲面图及等高线图直观地反映出来[49]。当等高线中的中心接近圆形表明因素之间的交互作用不显著,当等高线中心接近椭圆表明两因素交互作用显著[50]。实验所选的3种因素均具有很好的交互作用,且交互作用的强弱分别为X1X2>X1X3>X2X3。
通过软件Design Expert 8.06软件求解方程得出,预测的最优条件为X1=0.12,X2=0.2,X3=0.18,即当氮源添加量为82.4 mL/L,初始含水量为41%,接种量20.9%时,antroquinonol产量最大,预测产量为1 336.0 mg/kg。考虑实际实验操作,修正最优条件为氮源添加量为82.4 mL/L,初始含水量为41%,接种量21%。为进一步验证模型可靠性,采用修正后的条件进行验证实验,测得antroquinonol的产量为1 340.7 mg/kg(为3组重复所得平均值),相对于预测值而言,实际值偏差-0.4%,二者基本吻合,因此该优化模型可靠。实验结果是未优化前(325.0 mg/kg)的4.1倍。
3 结论
本实验以牛樟芝中具有显著生理活性的antroquinonol为目标产物,应用响应面分析法探究了在以小米为基质的牛樟芝固态发酵过程中不同因素对antroquinonol产量的影响。首先,通过单因素实验,确定了发酵周期、初始含水量、接种量以及氮源类型和添加量均会对antroquinonol的产量有显著影响。其次,在此基础上,采用3因素3水平的Box-Benhnken中心组合实验原理设计响应面分析实验,得到最佳的发酵条件为:小米100 g,大豆水解液82.4 mL/L,初始含水量41%,接种量21 mL/100 g基质,发酵25 d。在此条件下,牛樟芝固态发酵产antroquinonol为1 340.7 mg/kg,是未优化前(325.0 mg/kg)的4.1倍,为目前已有文献报道中的最高水平。
[1] WU S H,RYVARDEN L,CHANG T T.Antrodia camphorata (niu-chang-chih), new combination of a medicinal fungus in Taiwan[J].Botanical Bulletin-Academia Sinica Taipei,1996,38(4):273-275.
[2] 张东柱.台湾特有珍贵药用真菌牛樟芝[J].食药用菌,2011,19(1):33-34.
[3] AO Z H,XU Z H,LU Z M,et al. Niuchangchih (Antrodia camphorata) and its potential in treating liver diseases[J].Journal of Ethnopharmacol,2009,121(2):194-212.
[4] GEETHANGILI M,TZENG Y M.Review of pharmacological effects of Antrodia camphorata and its bioactive compounds[J]. Evidence-Based Complementray and Alternative Medicine,2011,8(1):1-17.
[5] 张薄博,夏永军,许赣荣.樟芝发酵产品的研究进展[J].食品科技,2012,37(10):89-91.
[6] LU M C,El S M,WU T Y,et al.Recent research and development of Antrodia cinnamomea[J].Pharmacol Therapeut,2013,139 (2):124-156.
[7] 邢宏博,胡永丹,吕俊,等.樟芝活性代谢产物的研究进展[J].生物加工过程,2017,15(4):1-8.
[8] LEE T H,LEE C K,TSOU W L,et al.A new cytotoxic agent from solid-state fermented mycelium of Antrodia camphorata[J]. Planta Medica,2007,73(13):1 412.
[9] YANG S S,WANG G J,WANG S Y,et al.New constituents with iNOS inhibitory activity from mycelium of Antrodia camphorata[J].Planta Medica,2009,75(5):512-516.
[10] LIN Y W,PAN J H,LIU R H,et al.The 4-acetylantroquinonol B isolated from mycelium of Antrodia cinnamomea inhibits proliferation of hepatoma cells[J].Journal of the Science of Food and Agriculture,2010,90(10):1 739-1 744.
[11] YEN I C,YAO C W,KUO M T,et al.Anti-cancer agents derived from solid-state fermented Antrodia camphorata mycelium[J]. Fitoterapia,2015,102:115-119.
[12] YEN I,LEE S Y,LIN K T,et al.In vitro anticancer activity and structural characterization of ubiquinones from Antrodia cinnamomea mycelium[J].Molecules,2017,22(5):747.
[13] KUMAR K J,CHU F H,HSIEN H W,et al.Antroquinonol from ethanolic extract of mycelium of Antrodia cinnamomea protects hepatic cells from ethanol-induced oxidative stress through Nrf-2 activation[J].Journal of Ethnopharmacol,2011,136(1):168-177.
[14] KUMAR V B,YUAN T C,LIOU J W,et al.Antroquinonol inhibits NSCLC proliferation by altering PI3K/mTOR proteins and miRNA expression profiles[J].Mutation Research,2011,707(1-2):42-52.
[15] YU C C,CHIANG P C,LU P H,et al.Antroquinonol, a natural ubiquinone derivative, induces a cross talk between apoptosis, autophagy and senescence in human pancreatic carcinoma cells[J].Journal of Nutritional Biochemistry,2012,23(8):900-907.
[16] HO C L,WANG J L,LEE C C,et al.Antroquinonol blocks Ras and Rho signaling via the inhibition of protein isoprenyltransferase activity in cancer cells[J].Biomedicine and Pharmacother,2014,68(8):1 007-1 014.
[17] CHANG W H,CHEN M C,CHENG I H.Antroquinonol lowers brain amyloid-β levels and improves spatial learning and memory in a transgenic mouse model of Alzheimer’s disease[J].Scientific Reports,2015,5:15 067.
[18] LEE W T,LEE T H,CHENG C H,et al.Antroquinonol from Antrodia camphorata suppresses breast tumor migration/invasion through inhibiting ERK-AP-1 and AKT-NF-kappaB-dependent MMP-9 and epithelial-mesenchymal transition expressions[J].Food Chemical Toxicol,2015,78:33-41.
[19] THIYAGARAJAN V,TSAI M J,WENG C F.Antroquinonol targets FAK-signaling pathway suppressed cell migration, invasion, and iumor growth of C6 glioma[J].PLoS One,2015,10(10):e0141285.
[20] ANGAMUTHU V,SHANMUGAVADIVU M,NAGARAJAN G,et al.Pharmalogical activities of antroquinonol- mini review[J]. Chemico-Biological Interactions,2019,297:8-15.
[21] VILLAUME M T,SELLA E,SAUL G,et al.Antroquinonol A: scalable synthesis and preclinical biology of a phase 2 drug candidate[J].ACS Central Science,2016,2(1):27-31.
[22] 夏永军,张贤芳,许赣荣.牛樟芝培养技术的研究进展[J].食品科学,2012,33(11):185-189.
[23] DORIYA K,JOSE N,GOWDA M,et al.Solid-state fermentation vs submerged fermentation for the production of L-asparaginase[J]. Advances in Food and Nutrition Research,2016,78:115-135.
[24] 喻学淳,夏永军,张欢,等.樟芝固态发酵生产Antroquinonol及萃取Antroquinonl的研究[J].食品工业科技,2013,34(5):164-168.
[25] 路瑞秋,胡永丹,张薄博,等.响应面法优化樟芝固态发酵产安卓奎诺尔[J].食品科学,2015,36(23):150-154.
[26] XIA Y J,WANG Y,HANG B B,et al.Effect of cultural conditions on antrodin C production by basidiomycete Antrodia camphorata in solid-state fermentation[J].Biotechnology and Applied Biochemistry,2015,61(6):724-732.
[27] ABDULLAH B,MAFTUKHAH S,LISTYANINGRUM E,et al.In Effect of some variable in cellulase production by Aspergillus niger ITBCC L74 using solid state fermentation[C],Materials Science and Engineering Conference Series,2018.
[28] HANAI H,ISHIDA S,SAITO C,et al.Stimulation of mycelia growth in several mushroom species by rice husks[J].Bioscience Biotechnology and Biochemistry,2005,69(1):123-127.
[29] SRIANTA I,ZUBAIDAH E,ESTIASIH T,et al.Comparison of Monascus purpureus growth, pigment production and composition on different cereal substrates with solid state fermentation[J].Biocatalysis and Agricultural Biotechnology,2016,7:181-186.
[30] TAKESHITA R,SAIGUSA N,TREAMOTO Y.Production and antioxidant activity of alcoholic beverages made from various cereal grains using Monascus purpureus NBRC 5965[J].Journal of the Institute of Brewing,2016,122(2):350-354.
[31] YANGF C,YANGY H,LU H C.Enhanced antioxidant and antitumor activities of Antrodia cinnamomea cultured with cereal substrates in solid state fermentation[J].Biochemical Engineering Journal,2013,78(37):108-113.
[32] TEREBIZNIK M R,PILOSOF A M R.Biomass estimation in solid state fermentation by modeling dry matter weight loss[J]. Biotechnology Techniques,1999,13(3):215-219.
[33] MAZAHERI D,SHOJAOSADATI S A,ZAMIR S M,et al.Mathematical modeling of ethanol production in solid-state fermentation based on solid medium dry weight variation[J].Preparative Biochemistry and Biotechnology,2018,48(4):372-377.
[34] 丁雪,马晓燕,张先舟,等.降解游离棉酚的热带假丝酵母菌的发酵动力学研究[J].中国酿造,2011,30(6):131-134.
[35] 夏永军,李炜疆,许赣荣.樟芝固态发酵产品活性代谢产物分析[J].食品与发酵工业,2011,37(8):86-90.
[36] 段传玲,兰静,张宏坤.分光光度法测定大米直链淀粉含量的误差分析[J].黑龙江农业科学,2015(4):129-133.
[37] WEUSTER B D.Experimental design for fermentation media development: statistical design or global random search[J]. Journal of Bioscience and Bioengineering,2000,90(5):473-483.
[38] RASHID S S,ALAM M Z,KARIM M I A,et al.Optimization of the nutrient supplients for cellulase production with the basal medium palm oil mill effluent[J].World Academy of Science, Engineering and Technology,2009,60(6):809-815.
[39] 吕腾飞,丁彦蕊,廖祥儒,等.竹黄菌固态发酵产竹红菌素条件的优化[J].食品与生物技术学报,2013,32(8):832-837.
[40] 蔡一霞,朱智伟,王维,等.直链淀粉含量与稻米品质主要性状及米饭质地关系的研究[J].扬州大学学报(农业与生命科学版),2005,26(4):52-55.
[41] 刘爱英,孙伟,梁宗琦,等.不同米质发酵生产红曲对莫纳可林K含量的影响[J].贵州农业科学,2003,31(5):5-7.
[42] 冯杉,江林芡,李赛楠,等.无机盐和维生素对固体培养槐耳菌丝生长影响的研究[J].中南药学,2015,13(6):591-593.
[43] 张帅,陈懿,董基,等.黑曲霉固态发酵橘皮生产纤维素酶及淀粉酶[J].食品科学,2012,33(11):190-193.
[44] LOTONG N,SUWANARIT P.Fermentation of ang-kak in plastic bags and regulation of pigmentation by initial moisture content[J].Journal of Applied Microbiology,2010,68(6):565-570.
[45] LARROCHE C,THEODORE M,GROS J B.Growth and sporulation behaviour of Penicillium roquefortii in solid substrate fermentation: effect of the hydric parameters of the medium[J].Applied Microbiology and Biotechnology,1992,38(2):183-187.
[46] 童爱均,吕旭聪,刘晓艳,等.固体发酵基质和外加碳氮源对红曲霉色素产量的影响[J].中国调味品,2015(5):5-10.
[47] 杨晓婉,张娜,李雪霞,等.大豆蛋白及其水解物在乳粉中的应用及研究进展[J].中国乳品工业,2018,46(4):31-34.
[48] 陶红,梁歧,张鸣镝.热处理对大豆蛋白水解液分子量的影响[J].食品科学,2003,24(11):18-22.
[49] TANYILDIZI M S,ELIBBOL O M.Optimization of α-amylase production by Bacillus sp. using response surface methodology[J]. Process Biochemical,2005,40(7):2 291-2 296.
[50] 鞠兴荣,王雪峰,王立峰,等.混菌固态发酵菜籽粕制备菜籽肽的菌种筛选[J].食品与发酵工业,2011,37(9):104-108.