鲜切净菜是以新鲜蔬菜为原料,经过分拣、清洗、切分、包装等一系列处理后制成的即用或即食的蔬菜制品,在行业内也被称为“最小加工(minimally processed)”产品,具有新鲜、便捷、营养等优点。近年来,我国鲜切蔬菜的消费市场正逐年扩大,但鲜切蔬菜本身含水量较高,又经过切割等程序,导致汁液流失严重,这些受伤的组织为微生物提供营养,使多种微生物群落得以繁殖,导致腐败,这直接限制了产品流通和货架期。腐败菌对鲜切蔬菜产生破坏的症状主要体现在褐变、产生异味、结构丧失以及在较低程度上的软腐,这极大地影响到消费者的购买欲望,国外已有学者指出:在鲜切蔬菜的贮藏过程中,肠杆菌、假单胞菌以及乳酸菌等腐败菌的增长与酸味、褐变、软腐有强相关性[1-2]。目前对鲜切叶菜微生物的研究主要集中在保鲜技术、清洗方式以及致病菌等领域,对鲜切叶菜中特定腐败菌的研究较少[3-4]。
菠菜(Spinacia oleracea L.)是一种绿叶蔬菜,人们常常将其鲜切后置于4 ℃下售卖[5]。鲜切菠菜在贮藏过程中易受微生物的侵袭导致腐败[6]。本研究借助高通量测序技术[7-9],结合传统检测,全面地研究鲜切菠菜在0、4、8 d主要腐败菌及其演替规律,解析腐败菌的组成、生理生化特性、丰度及多样性,以此为指导企业防腐杀菌、产品贮运等工艺提供理论依据。
1 材料与方法
1.1 菠菜的鲜切处理及分组
菠菜:要求大小均一、色泽鲜绿、清洁、无明显缺陷、无病虫毒害。大棚种植,于6月份采摘,采摘时间为上午5时,温度约25 ℃,湿度约70%RH,采后立即配送至实验室。经去离子水清洗后,将样品用已灭菌的不锈钢菜刀距菠菜根部约3 cm处进行鲜切,并在无菌条件下将鲜切菠菜随机分为3大组,每大组分为3小组,每小组分装80 g/盒,放入无菌塑料盒,并用透明保鲜袋包好,置于4 ℃下贮藏备用。
1.2 实验试剂及仪器
1.2.1 实验试剂
平板计数琼脂培养基(PCA)、营养琼脂培养基(NA)、假单胞菌琼脂培养基(CFC)、肠杆菌科琼脂培养基(VRBDA)、葡萄球菌琼脂培养基(MSA)、梭菌鉴别琼脂(DRCA):青岛海博生物技术有限公司;微生物生理生化微量鉴定管:青岛海博生物技术有限公司;E.Z.N.ATM Mag-Bind Soil DNA Kit:M5635-02,OMEGA公司;Qubit3.0 DNA检测试剂盒:Q10212,Life;2×Taq Master Mix:P111-03,Vazyme公司;MagicPure Size Selection DNA Beads:EC401-03,Transgen。
1.2.2 实验仪器
高速冷冻离心机(H-2050R-1型),长沙湘仪离心机有限公司;高温高压灭菌锅(HVE-50),日本Hi-rayama制造有限公司;PCR仪(T100TM)Thermal Cyeler,BIO-RAD;超净工作台(VS-1300L-U),上海康福特环境科技有限公司;恒温培养摇床(KYC-100C),上海圣科仪器设备有限公司;电泳仪(DYY-6C、DYCZ-21型),北京市六一仪器厂。
1.3 实验方法
1.3.1 感官评定
挑选8名经过培训的人员进行感官评定,每人每次评定设为3次。标准参照PAILLART等[10]方法,感官评估分为3步进行:①评估叶条的整体颜色及表观,②对消费者的接受度进行打分,③将叶片平铺在白色背景下观察叶片萎焉程度。以上指标评定后分数越高代表品质越好,每项评定满分为10分,每天评定1次。
1.3.2 腐败菌的分离纯化
(1)在无菌条件下随机准确称取样品10 g,剪碎并混匀,放入90 mL无菌生理盐水(质量浓度为8.5 g/L) 中,充分摇匀之后用1 mL移液枪加入含有9 mL的生理盐水试管中进行10倍递增稀释,稀释成所需浓度,选取合适的稀释浓度,吸取1 mL上述菌悬液,置于表1各个培养基中。
(2)经培养后,从各种培养基中挑取典型生长的、形态不同的菌落,平板划线法反复分离、纯化3次,直至菌落的生长状态和形态特征表现一致时得到纯的菌落,纯菌落斜面接种,培养后于4 ℃保存。
(3)每隔1 d进行上述工作,培养条件见表1。
表1 各种微生物菌相的培养条件
Table 1 Culture conditions of various microorganisms
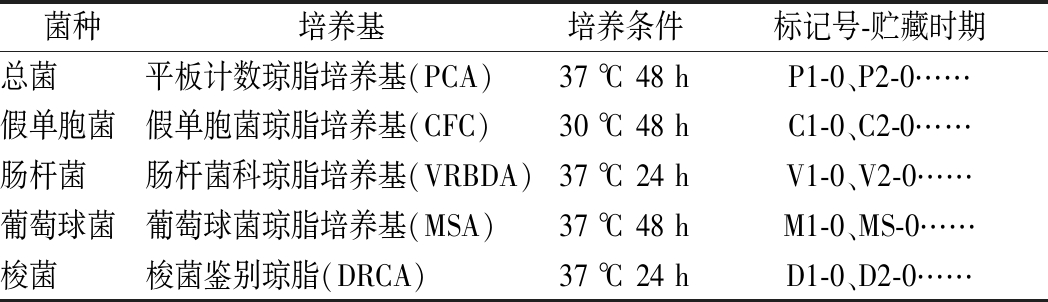
菌种培养基培养条件标记号-贮藏时期总菌平板计数琼脂培养基(PCA)37 ℃ 48 hP1-0、P2-0……假单胞菌假单胞菌琼脂培养基(CFC)30 ℃ 48 hC1-0、C2-0……肠杆菌肠杆菌科琼脂培养基(VRBDA)37 ℃ 24 hV1-0、V2-0……葡萄球菌葡萄球菌琼脂培养基(MSA)37 ℃ 48 hM1-0、MS-0……梭菌梭菌鉴别琼脂(DRCA)37 ℃ 24 hD1-0、D2-0……
1.3.3 菌悬液的制备及保种
用接种环依次挑取经过上述培养基中培养带有明显特征的菌落,标号见表1,分别接种至装有5 mL灭菌营养肉汤培养基的试管内,尽量保证所有数据采集完整,摇床37 ℃、160 r/min振荡过夜。待菌悬液制备后,用移液枪从每支试管内吸取0.1 mL菌液,垂直滴落在已凝固的营养琼脂培养基上,均匀涂布,静置10 min左右,于37 ℃的培养箱内倒置培养24 h,进行保种,待单菌落生成后,置于4 ℃冰箱保藏备用,菌悬液置于冰箱内备用。
1.3.4 菌种的初步鉴定及计数
(1)初步镜检:将已获得纯化的菌株进行革兰氏染色,并用显微镜油镜观察细胞个体形态、排列等,每一处理均设3次重复,挑选最典型的菌落观察。
(2)生理生化鉴定:参照崔慧玲等[11]对鲜切菜品的鉴定图谱,使用相应的微生物生理生化微量鉴定管鉴定后,参考《伯杰细菌鉴定手册》、《常见细菌系统鉴定手册》,各项生理生化试验每一处理均设3次重复,避免假阳性的发生。
(3)选取菌落总数在30~300 CFU范围内的平皿,菌落计数参考GB 4789.2—2016[12]中的平板计数法测定,用PCA培养基测定总菌数量。在以上鉴定的基础上,用选择性培养基CFC、VRBDA、MSA、DRCA根据已观察形态及生理生化的结论初步测定假单胞菌、肠杆菌、微球菌、梭菌的菌落数得出在0、4、8 d的大致比例。
1.3.5 总DNA的提取
参照NIEMINEN等[13]的方法在无菌超净工作台中,随机从不同袋子中选取不同部位的菠菜叶片,保证采集样品的代表性,共称取10 g菠菜叶片,置于无菌均质袋中,加入90 mL的无菌生理盐水(质量浓度为8.5 g/L),剧烈振荡1 min,取出样品,静置10 min后,在10 000 r/min下离心10 min,弃上清,取10 mL沉淀,置于-80 ℃冻存备用。随后按照OMEGA试剂盒的方法操作,提取细菌总DNA,并用 1%的琼脂糖凝胶电泳检测提取效果。
1.3.6 16S rDNA V3-V4区的PCR扩增及Illumina双末端测序
在肖英平等[14]实验方法的基础上稍作改进,以上述提取的总细菌基因组DNA为模板,引物针对16S rRNA基因V3~V4区合成特异引物,利用341F:CCTACGGGNGGCWGCAG;805R:GACTACHVGGGTATCTAATCC引物进行PCR扩增。扩增后的PCR产物进行1%琼脂糖凝胶电泳,利用Qubit3.0 DNA检测试剂盒对回收的DNA精确定量,按照1∶1的等量混合后测序,每个样品DNA量取10 ng,最终上机测序浓度为20 pmol,将检测后合格的样品委托上海生工生物工程有限公司。
1.3.7 生物信息学分析
参照储建军等[15]方法进行数据质控及过滤,包括:去除引物接头序列、序列拼接、质量剪切、去除非扩增区域序列和嵌合体序列,随后进行blastn比对,在97%的相似水平下进行归类,得到分类操作单元(operational taxonomic unit,OTU),以此得出每个OTU分类学信息。随后以随机抽到的序列数与香农指数(Shannon)构制稀释度曲线曲线,评估样品测序数据量的合理性。再者,基于得到的OTUs计算香农指数(Shannon)、菌种丰富度指数(Chao1)、辛普森指数(Simpson)、覆盖率(Coverage)和ACE等常用的Alpha生物多样性指数,衡量样本中物种的多样性[16],并且通过贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,在科、属水平上进行群落丰度统计分析并作图,得到微生物群落结构组成,鉴定优势腐败菌。
2 结果与分析
2.1 感官评定及总菌
图1及图2分别显示了4 ℃下贮藏的鲜切菠菜感官评分、总菌及表观变化。由图可知,随着贮藏时间的增加,鲜切菠菜的感官评价呈下降趋势,在第8天,其感官评分降至5分以下,变得不可接受,叶片出现大面积萎蔫、发黄并出现不同程度的软腐,鲜切
部位出现褐变,打开包装可明显感受到腐臭味;而总菌含量随着贮藏时间的增长而增长,在第8天时,超过6 lg CFU/g,两者指标具有相关性,在第8天,感官和总菌含量皆超出标准,说明已失去商品价值[17]。
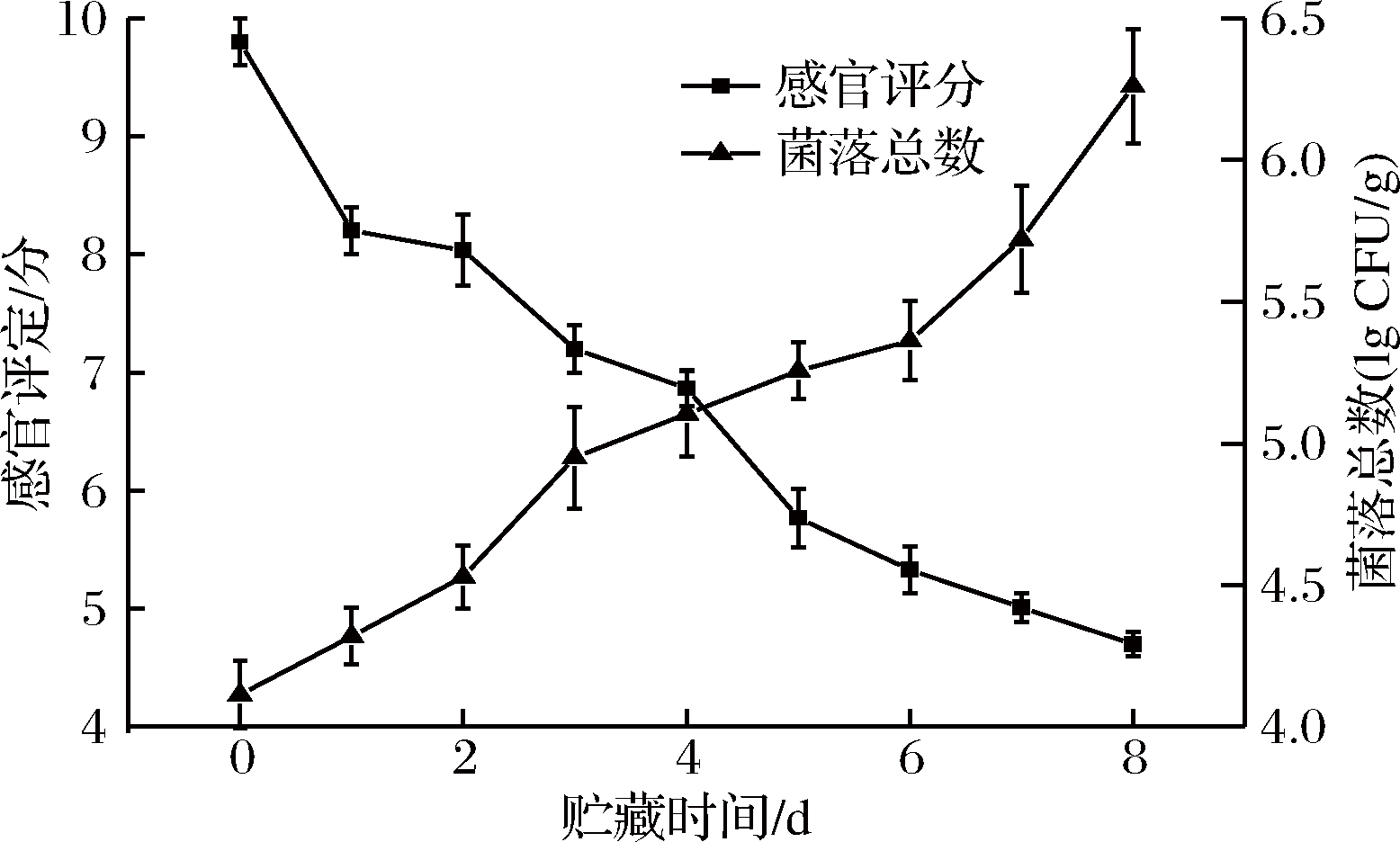
图1 4 ℃下冷藏对鲜切菠菜感官品质和菌落总数的影响
Fig.1 Effects of cold storage at 4 ℃ on sensory quality and colony count of fresh cut spinach

图2 4 ℃冷藏条件下不同贮藏时期鲜切菠菜的品质
Fig.2 Quality of fresh cut spinach at different storage periods under 4 ℃ refrigeration
2.2 腐败菌的初步鉴定
2.2.1 形态学观察及生理生化实验
共挑取特征菌落29个,经革兰氏染色实验,其中18株为革兰氏阴性菌,11株为革兰氏阳性菌,各菌株的镜检及生理生化实验结果见表2。
表2 各个菌株的镜检及生理生化实验结果
Table 2 Microscopic examination and physiological and biochemical results of various strains
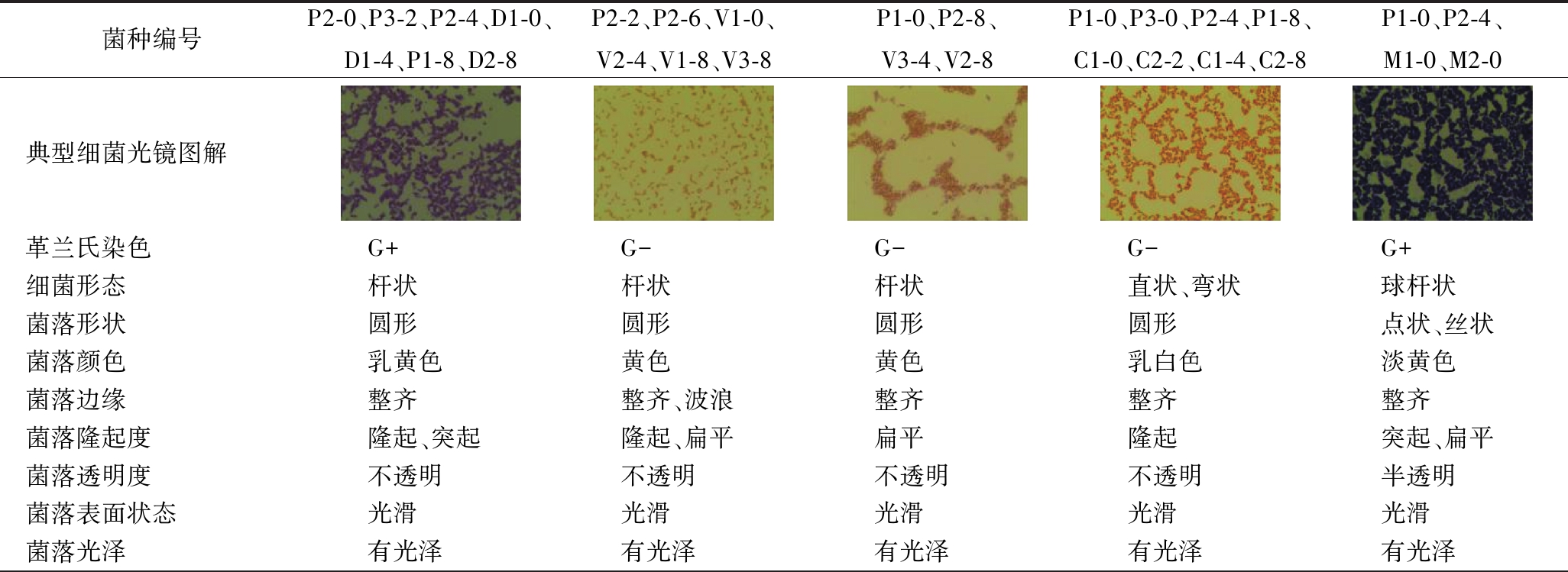
菌种编号P2-0、P3-2、P2-4、D1-0、D1-4、P1-8、D2-8P2-2、P2-6、V1-0、V2-4、V1-8、V3-8P1-0、P2-8、V3-4、V2-8P1-0、P3-0、P2-4、P1-8、C1-0、C2-2、C1-4、C2-8P1-0、P2-4、M1-0、M2-0典型细菌光镜图解革兰氏染色G+G-G-G-G+细菌形态杆状杆状杆状直状、弯状球杆状菌落形状圆形圆形圆形圆形点状、丝状菌落颜色乳黄色黄色黄色乳白色淡黄色菌落边缘整齐整齐、波浪整齐整齐整齐菌落隆起度隆起、突起隆起、扁平扁平隆起突起、扁平菌落透明度不透明不透明不透明不透明半透明菌落表面状态光滑光滑光滑光滑光滑菌落光泽有光泽有光泽有光泽有光泽有光泽
续表2

菌种编号P2-0、P3-2、P2-4、D1-0、D1-4、P1-8、D2-8P2-2、P2-6、V1-0、V2-4、V1-8、V3-8P1-0、P2-8、V3-4、V2-8P1-0、P3-0、P2-4、P1-8、C1-0、C2-2、C1-4、C2-8P1-0、P2-4、M1-0、M2-0菌落干湿度湿润湿润湿润湿润湿润H2O2酶实验-++++氧化酶实验+--++明胶水解+-+++吲哚实验NT+-NTNT葡萄糖利用+++++V-P实验---++O-F实验OFFOF初步结论梭菌肠杆菌肠杆菌假单胞菌葡萄球菌
2.2.2 腐败菌的计数
根据对29株菌株的镜检以及生理生化的鉴定结果,分别对0、4、8 d的样品在不同培养基中的典型菌落进行计数并计算大致比例。由表3可知,在货架期终点假单胞菌占比达到77.89%,为主要优势腐败菌;肠杆菌在贮藏过程中比例下降至21.99%;微球菌、梭菌占比较少,分别为0.55%、0.51%。
表3 4 ℃条件下鲜切菠菜的菌群变化 单位:CFU/g
Table 3 Changes of microflora of fresh cut spinach under 4 ℃

贮藏时间/d总菌数假单胞菌肠杆菌微球菌梭菌01.3×1041.12×104(50.04%)1.07×104(47.82%)1.6×102(0.71%)3.2×102(1.43%)41.6×1056.2×105(60.57%)3.9×105(38.10%)4.2×103(0.41%)9.4×103(0.91%)81.82×1061.7×106(77.89%)4.8×105(21.99%)1.2×104(0.55%)1.1×104(0.51%)
2.3 高通量测序鉴定
2.3.1 数据质控及稀释度曲线
由表4可知,3个样品经过测序后分别得到48 353、62 689、53 046条原始序列,经过质量控制、去除非特异性扩增序列和嵌合体得到44 183、50 954、46 064条有效序列,各个样品的有效序列分别达到91.4%、81.3%、86.8%,片段长度约428 bp,均达到生物信息分析的要求[18]。
表4 测序数据统计结果
Table 4 The statistics results of sequence data
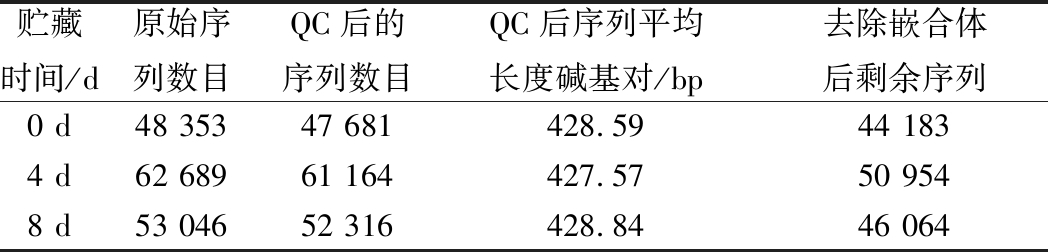
贮藏时间/d原始序列数目QC后的序列数目QC后序列平均长度碱基对/bp去除嵌合体后剩余序列0 d48 35347 681428.5944 1834 d62 68961 164427.5750 9548 d53 04652 316428.8446 064
构建稀释曲线可以反映样本的测序数据量是否合理,本实验中,横坐标代表随机抽取的序列数量,纵坐标代表的是反映物种多样性的Shannon指数,当曲线趋于平坦时,说明测序数据量足够大,可以反映样品中绝大多数的微生物物种信息。图3代表的是不同贮藏时期的3个样品:当测序数目分别达到44 183、50 954、46 064时,Shannon指数达到2.19、2.95、2.57,此时继续增加测序数据量仅产生少量新的OTU,同时稀释度曲线趋于平坦,这表明测序已趋于饱和,具有代表性。
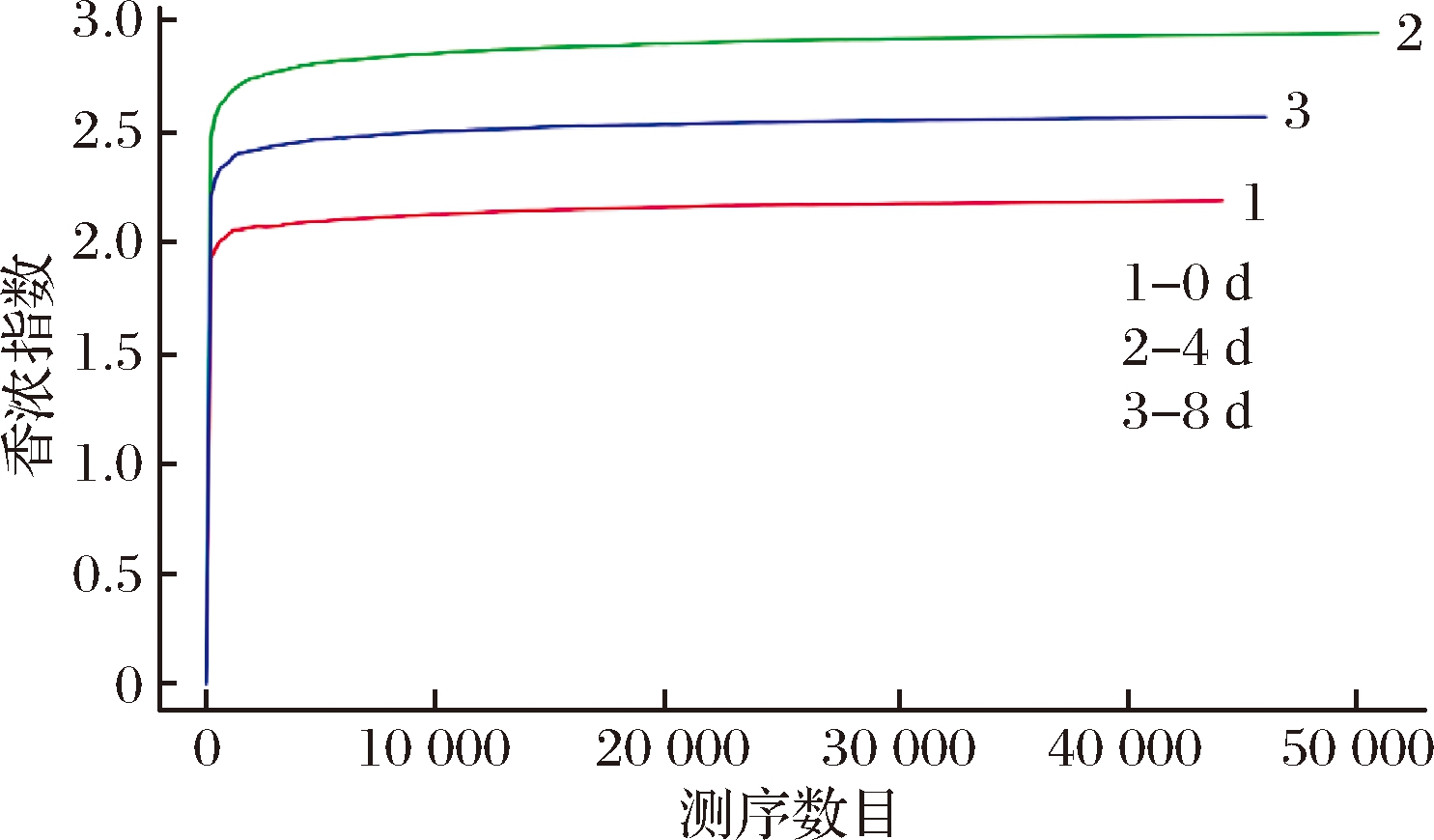
图3 各个样品稀释性曲线
Fig.3 Rarefaction curve of each samples
2.3.2 Alpha多样性分析
在4 ℃条件下,鲜切菠菜贮藏过程中的Alpha多样性指数变化如表5所示。首先,各个样品的Coverage指数均≥0.95,说明本实验的测序数量充分代表样品的真实情况[19];从Chao1、ACE指数来看,贮藏4 d菠菜表面的菌群丰度最高,其次是0 d,最低的是8 d;从Shannon、Simpson指数来看:贮藏4 d菠菜表面的菌群多样性也明显高于0 d及8 d,以上说明:贮存4 d的菠菜样品表面的微生物群落结构最为复杂,这可能是由于在贮存初期(0~4 d)菠菜经过鲜切处理后,导致组织液外渗,为微生物提供了较好的繁殖环境,导致丰度和多样性上升,在贮存后期(4~8 d)优势腐败菌凭借其竞争优势,消耗营养底物,使得环境改变,导致菌群多样性降低。
表5 Alpha多样性指数
Table 5 Alpha diversity index

贮藏时间/d优质序列数目OTU数目ACEChao1ShannonSimpsonCoverage044 1831 65744 610.4117 927.382.190.250.97450 9542 756104 771.3735 506.162.950.130.95846 0641 96456 357.3720 108.342.570.200.96
2.3.3 细菌群落分析
使用RDP classifier以及Blast分析对已得的OTU进行物种分类,共鉴定到10门,15纲,23目,52科,89属。本文在科、属的分类水平上进行分析。
2.3.3.1 基于科分类水平上的分析
经过鉴定,在科的分类标准下,不同贮藏时间的鲜切菠菜表面菌群的丰度情况如图4所示。
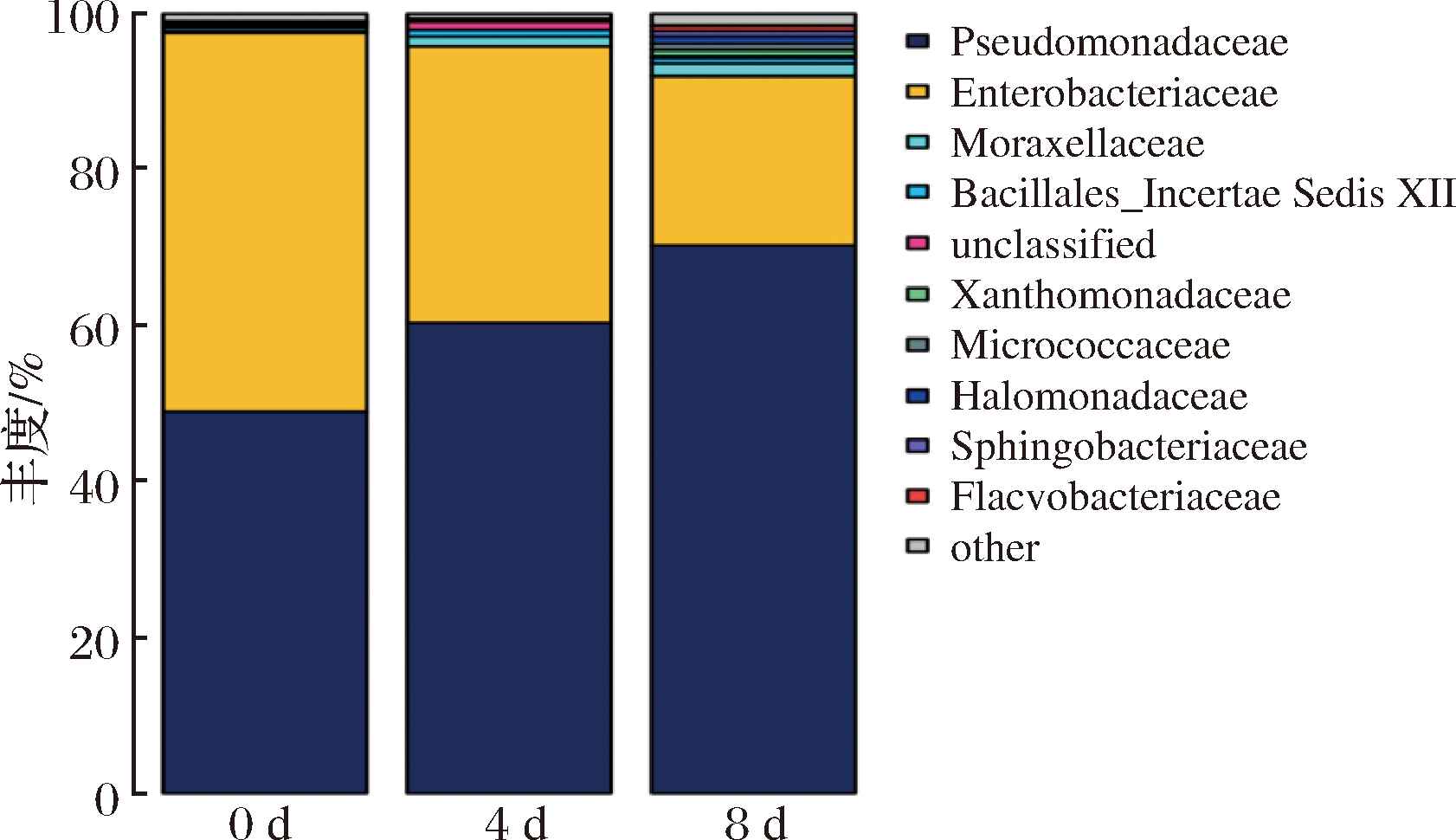
图4 基于科分类水平上的样品菌群分布图
Fig.4 Bacterial distribution based on the family taxonomical level
由图4得出,假单胞菌科和肠杆菌科是在整个贮藏期间的主要菌群结构,两者占比90%以上,为优势腐败菌;而其他分类的菌群丰度较低,都小于2%,这表明菌群的多样性程度较高,而丰度较为集中。从菌群变化的角度来看,随着贮藏时间的推移,假单胞菌科的丰度呈递增趋势,从初始丰度的48.99%到贮藏末期的70.27%;而肠杆菌科则从初始丰度的48.62%不断递减至21.75%,其余菌群的微生物均保持在较低丰度,出现上述现象可能是以下原因导致的:(1)在样品清洗后,假单胞菌科及肠杆菌科的微生物在菠菜叶片表面的黏附强于其他细菌,从而使二者的初始丰度较高[20];(2)鲜切菠菜在4 ℃低温下贮藏会明显抑制肠杆菌的生长[21],而假单胞菌对低温具有一定的耐受力[22],因此,假单胞菌生长速度快于肠杆菌,导致肠杆菌的丰度不断下降,另一方面,二者的增殖会相对抑制其他科微生物的增长。
2.3.3.2 基于属分类水平上的样品菌群分布图
经过鉴定,在不同贮藏时期,鲜切菠菜表面的微生物在属的分类水平下共得到89个属,图5为在属的分类水平下丰度占比前十的菌群分布情况。在科水平下为优势腐败菌的假单胞菌科,在属的分类下包括:假单胞菌属(Pseudomonas)、氮单孢菌属(Azomonas),对于肠杆菌科,在属的分类下主要包括:泛菌属(Pantoea)、欧文氏菌属(Erwinia)、布丘氏菌属(Buttiauxella)、沙门氏菌属(Salmonella)、沙雷氏菌属(Serratia),除了上述几种外,丰度靠前的还有氮单孢菌属(Azomonas)、不动杆菌属(Acinetobacter)、微小杆菌属(Exiguobacterium)、寡养单胞菌属(Stenotrophomonas)等。
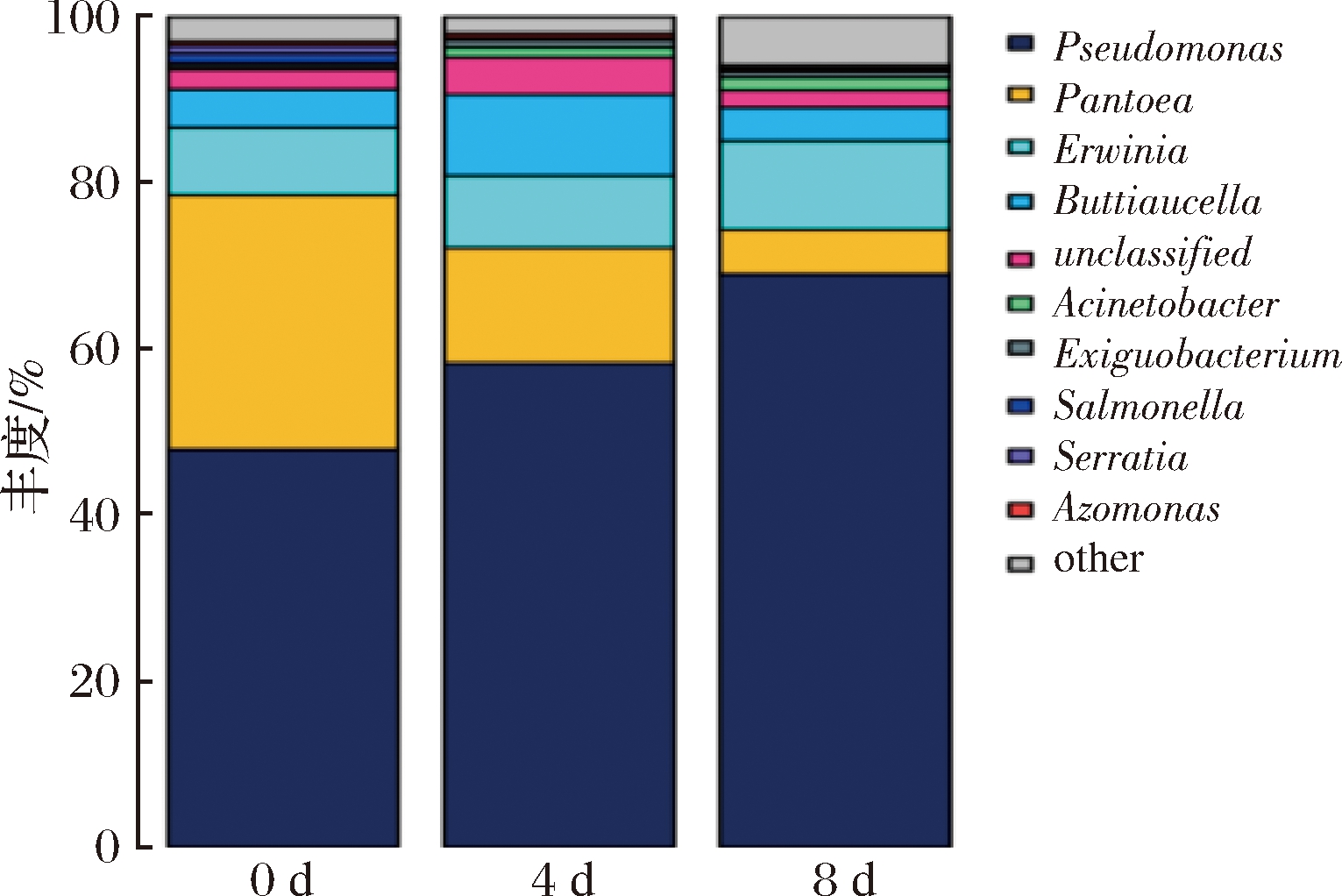
图5 基于属分类水平上的样品菌群分布图
Fig.5 Bacterial distribution based on the genus taxonomical level
由图5可知,假单胞菌属、泛菌属是鲜切菠菜的初始优势菌属,丰度分别达到47.84%、30.7%,而欧文氏菌属、布丘氏菌属为次优势菌属,丰度为8.09%和4.64%;到了贮存中期,假单胞菌属的丰度上升至58.25%,泛菌属丰度下降至13.94%,欧文氏菌属丰度基本保持不变为8.69%、布丘氏菌属丰度小幅上升至9.73%;贮存末期,假单胞菌属占绝对优势,丰度占比68.97%,而泛菌属丰度仅占5.4%,欧文氏菌属占比10.7%,布丘氏菌属占比4%。
已有文献证实,假单胞菌属是许多果蔬植物的腐败菌,由于其营养方式多样性及其生理特性,较为适应鲜切菠菜表面的生长环境[23],其丰度约占腐败菌的50%~90%[24],这和本研究结果一致,在该属中,荧光假单胞菌(P.fluorescens)是引起鲜切菠菜软腐变质的主要细菌[25],具有很强的产氨致腐能力,并且可通过PL编码基因表达产生果胶酸裂解酶(Polygalacturonatelyase,PL),PL的合成不受碳源种类的影响,并且会破坏菠菜叶片组织引起软腐[26]。其次,P. fluorescens表面的鞭毛蛋白对更好地定植于鲜切菠菜表面起到了重要作用[27],以上特点可能是其在整个贮藏期丰度变化的原因,而泛菌属、欧文氏菌属在低于10 ℃下生长缓慢,在加上营养底物被假单胞菌属消耗,间接地抑制其生长。软腐欧文氏菌属除了分泌少量PL外,还会分泌果胶甲基半乳糖醛酸酶(Pectin methyl-galacturonase,PML),有实验证明:PML在软化菠菜组织的作用不明显,但是PME和PL的协同作用下可完全降解菠菜细胞壁上的果胶,从而发生软腐败[28]。
3 结论
本实验借助高通量检测技术结合传统生理生化检测技术探究在4 ℃贮藏条件下,鲜切菠菜不同贮藏时期的菌群变化,结论如下:
鲜切菠菜在不同贮藏时期其微生物的多样性以及丰度存在较大差异,共鉴定到10门,15纲,23目,52科,89属,其中假单胞菌科和肠杆菌科为优势菌科。
在属水平上,假单胞菌属(47.84%)、泛菌属(30.7%)、欧文氏菌属(8.09%)、布丘氏菌属(4.64%)是鲜切菠菜的主要初始菌群结构,到了贮存中后期,假单胞菌属丰度不断上升至68.97%,成为导致鲜切菠菜腐败的主要菌属,泛菌属、欧文氏菌属、布丘氏菌属成为次要腐败菌。
本实验2种方法可进行对比,进一步验证了高通量检测技术的优势,精确地定量了菌群组成比例。
[1] RAGAERT P, DEVLIEGHERE F, DEBEVERE J. Role of microbiological and physiological spoilage mechanisms during storage of minimally processed vegetables[J]. Postharvest Biology and Technology, 2007, 44(3): 185-194.
[2] GUTIERREZ J, BOURKE P, LONCHAMP J, et al. Impact of plant essential oils on microbiological, organoleptic and quality markers of minimally processed vegetables[J]. Innovative Food Science & Emerging Technologies, 2009, 10(2): 195-202.
[3] POIMENIDOU S V, BIKOULI V C, GARDELI C, et al. Effect of single or combined chemical and natural antimicrobial interventions on Escherichia coli O157∶H7, total microbiota and color of packaged spinach and lettuce[J]. International Journal of Food Microbiology, 2016, 220(2): 6-18.
[4] 徐晓霞, 陈安均,桑伟娜,等. 不同温度贮藏鲜切生菜腐败细菌的分离及鉴定[J]. 食品与发酵工业, 2016, 42(1): 53-58.
[5] UFUK M, KASlM REZZAN. Yellowing of fresh-cut spinach (Spinacia oleracea, L.) leaves delayed by UV-B applications[J]. Information Processing in Agriculture, 2017, 4(3): 214-219.
[6] 宋晓雪, 胡文忠,毕阳,等. 鲜切果蔬中致腐微生物污染及其非热杀菌的研究进展[J]. 食品工业科技, 2014, 35(10): 351-354.
[7] 雷振河. 采用高通量测序技术分析清香型白酒酿造微生物[J]. 食品与发酵工业, 2015, 41(9): 164-167.
[8] TASSIOS P T, MORAN-GILAD J. Bacterial next generation sequencing (NGS) made easy[J]. Clinical Microbiology and Infection, 2018, 24(4): 332-334.
[9] 陈泽斌, 李冰,徐胜光,等. 高通量测序分析食用玫瑰花瓣内生细菌多样性[J]. 中国食品学报, 2017, 17(9): 227-235.
[10] PAILLART M J M, et al. Bacterial population dynamics and sensorial quality loss in modified atmosphere packed fresh-cut iceberg lettuce[J]. Postharvest Biology and Technology, 2017, 124: 91-99.
[11] 崔慧玲, 陈安均,罗婵,等. 鲜切生菜贮藏过程中优势腐败细菌的多样性分析[J]. 食品与发酵工业, 2014, 40(7): 223-229.
[12] 中华人民共和国卫生部, 中国国家标准化管理委员会. GB 4789.2—2016, 食品微生物学检验,菌落总数测定[S]. 北京:中国标准出版社, 2016.
[13] NIEMINEN T T, KOSKINEN K, LAINE P, et al. Comparison of microbial communities in marinated and unmarinated broiler meat by metagenomics[J]. International Journal of Food Microbiology, 2012, 157(2): 142-149.
[14] 肖英平, 何祥祥,戴宝玲,等. 采样方法对冷鲜鸡表面细菌DNA提取及高通量测序结果的影响[J]. 食品科学, 2017, 38(24): 260-264.
[15] 储建军, 傅玲琳,王翀,等. 缢蛏冰温保活过程中菌相变化及优势腐败菌生长动力学建模[J]. 食品科学, 2017, 38(1): 110-115.
[16] 李晓然, 李洁,刘晓峰,等.利用高通量测序分析云南豆豉中细菌群落多样性[J]. 食品与生物技术学报, 2014,33(2):137-141.
[17] 雷昊, 谢晶,乔永祥,等. 臭氧水清洗结合气调包装对鲜切杭白菜保鲜效果的研究[J]. 食品与机械, 2017, 33(6): 110-113.
[18] 关统伟, 向慧平,王鹏昊,等. 基于高通量测序的郫县豆瓣不同发酵期细菌群落结构及其动态演替[J]. 食品科学, 2018, 39(4): 106-111.
[19] 余丹, 毛娉,宋颀,等. 基于高通量测序的传统甜面酱自然发酵过程中的微生物群落结构及其动态演替[J]. 微生物学通报, 2018, 45(5): 1 061-1 072.
[20] BOLIN H R, STAFFORD A E, KING A D, et al. Factors affecting the storage stability of shredded lettuce[J]. Journal of Food Science, 2010, 42(5): 1 319-1 321.
[21] 杨秋月. 芽苗菜优势腐败菌生长规律及控制技术研究[D]. 天津:天津科技大学, 2013.
[22] 张一敏, 朱立贤,张万刚,等. 生鲜牛肉中的腐败微生物概述[J]. 食品科学, 2018, 39(13): 289-296..
[23] WELLS J M, LIAO C H. The Diversity of the Pectolytic Fluorescent Pseudomonads[M]. Plant Pathogenic Bacteria. Springer Netherlands, 1987: 273-276.
[24] PINTOA L, IPPOLITOB A, BARUZZIA F. Control of spoiler Pseudomonas spp. on fresh cut vegetables by neutral electrolyzed water [J]. Food Microbiology, 2015, 50: 102-108.
[25] LIAO C H. Cloning of pectate lyase gene pel from Pseudomonas fluorescens and detection of sequences homologous to pel in Pseudomonas viridiflava and Pseudomonas putida[J]. The Journal of Bacteriology, 1991, 173(14): 4 386-4 393.
[26] ZUCKER M, HANKIN L, SANDS D. Factors governing pectate lyase synthesis in soft rot and non-soft rot bacteria [J]. Physiological Plant Pathology, 1972, 2(1): 59-67.
[27] LOCASCIO S J, BARTZ J A, WEINGARTNER D P. Calcium and potassium fertilization of potatoes grown in north Florida. 1. Effects on potato yield and tissue ca-concentration and K-concentrations[J]. American Potato Journal, 1992, 69(2): 95-104.
[28] BARRAS F, HARRIS S. Extracellular enzymes and their role in Erwinia virulence[J]. Methods in Microbiology, 1998, 27: 157-168.