龙眼(Dimocarpus longan Lour.)是最受欢迎的亚热带水果之一,广泛分布于东南亚和我国南部[1]。龙眼果肉通常以新鲜或加工的形式食用,而占水果鲜重约17%的龙眼核,被作为废弃物丢弃或在加工过程中作为燃料燃烧[2-3]。龙眼核作为传统中药具有止血、定痛、理气、化湿的功效,可治疗创伤出血、疝气等[4]。龙眼核提取物含有黄酮类化合物,且对大肠杆菌、金黄色葡萄球菌有抑制作用[5];文良娟等[6]发现龙眼核提取物对DPPH自由基、OH自由基有良好的清除作用。所以龙眼核含有的多种活性物质具有良好的抗菌、抗氧化等生物活性[7-8]。
多酚是在芳环上含有1个或多个羟基的化合物,性质活泼[9],具有抗氧化、抗菌、抗病毒等作用,这种化合物几乎存在于所有植物中[10]。龙眼核中含有丰富的多酚类物质,研究人员采用溶剂萃取法、超声波辅助提取法、微波辅助提取法提取龙眼核多酚,发现其对DPPH自由基、OH自由基有很好的清除作用[11];龙眼核中含有鞣花酸及其衍生物,具有优异的抗氧化性[12]。本文对龙眼核多酚进行分离纯化,探究其中的多酚种类与含量,以明确其中的主要抗氧化成分。
1 材料与方法
1.1 材料与试剂
龙眼核,购自广西玉林。干燥后打粉过60目筛备用。
没食子酸标准品,中国药品生物制品鉴定所;柯里拉京标准品,上海源叶生物有限公司;福林酚试剂:分析纯,国药集团化学试剂有限公司;2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,98%)、2,4,6-三吡啶基三嗪(TPTZ,99%),上海阿拉丁生物科技有限公司;AB-8型大孔吸附树脂,上海摩速科学有限公司;Sephadex LH-20型葡聚糖凝胶树脂,美国GE公司。
1.2 仪器与设备
电热鼓风干燥箱,上海-精宏实验设备有限公司;HC-300T2高速多功能粉碎机,永康市绿可食品机械有限公司;AX224ZH/E电子天平,常州奥豪斯仪器有限公司;RE-S2AA旋转蒸发器,上海亚荣生化仪器厂;SB-5200DTD型数控超声清洗器,宁波新芝生物科技有限公司;HH-1数显恒温水浴锅,金坛市美特仪器有限公司;TU-1901 双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;Tecan Infinite 200 Pro多功能酶标仪,瑞士Tecan公司;MALDI SYNAPT MS超高效液相色谱串联四极杆飞行时间质谱联用仪,美国沃特世公司。
1.3 实验方法
1.3.1 龙眼核多酚的提取及多酚含量的测定
多酚含量测定以没食子酸作为标准品,采用福林酚比色法[13]。准确吸取待测溶液0.5 mL,加入2.5 mL稀释10倍的福林酚溶液,摇匀静置5 min。再加入75 mg/mL Na2CO3溶液2 mL,摇匀后静置2 h,于760 nm处测吸光度。以没食子酸质量浓度为横坐标(x,mg/mL)、吸光度为纵坐标(y),制作标准曲线,方程为y=0.010 97x+0.005 89,R2=0.999 2。
精确称取1 g预先干燥、粉碎过筛的龙眼核粉末置于圆底烧瓶中,加入乙醇水溶液,采用超声波辅助法提取多酚。收集滤液,并用去离子水于1 000 mL容量瓶中定容,用上述方法测定多酚含量。根据标准曲线计算提取液多酚含量,然后按公式(1)计算多酚提取量(mg/g):
多酚提取量![]()
(1)
式中:V1,提取液定容体积,mL;ρ,多酚质量浓度,mg/mL;m0,龙眼核粉末质量,g。
1.3.2 龙眼核多酚提取条件优化
(1)乙醇体积分数的选择:准确称取龙眼核粉末1 g,料液比1∶20(g∶mL)、提取时间60 min、提取温度60 ℃,考察乙醇体积分数为30%、40%、50%、60%、70%条件下龙眼核多酚提取量。
(2) 料液比的选择:准确称取龙眼核粉末1 g,乙醇体积60%,提取时间60 min、提取温度60 ℃,考察料液比为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g∶mL)条件下龙眼核多酚提取量。
(3)提取温度的选择:准确称取龙眼核粉末1 g,乙醇体积60%,提取时间60 min,料液比1∶20(g∶mL),考察提取温度为40、50、60、70、80 ℃条件下龙眼核多酚提取量。
(4)提取时间的选择:准确称取龙眼核粉1 g,乙醇体积60%,提取温度60 ℃,料液比1∶20(g∶mL),考察提取时间为15、30、45、60、75 min条件下龙眼核多酚提取量。
1.3.3 龙眼核多酚的分离纯化
1.3.3.1 有机溶剂萃取
准确称取龙眼核粉末25 g,用上述最优提取条件提取。提取液减压浓缩至约50 mL后,依次用约200 mL的氯仿、乙酸乙酯和正丁醇分别萃取。每种溶剂萃取3次,合并后减压浓缩,并冷冻干燥得到粉末。称重后计算3种萃取相得率并按1.3.1测定多酚含量。
1.3.3.2 大孔吸附树脂分离
将乙酸乙酯相冷冻干燥粉末配制成质量浓度1.5 mg/mL,pH值3.5的溶液。然后将已经处理过的AB-8型大孔树脂湿法装柱,去离子水平衡后,以流速1.7 mL/min上样,共上样120 mL。待大孔树脂吸附完全后,用体积分数60%乙醇以相同流速洗脱,分管收集,每管13 mL。按1.3.1测定计算每管的多酚含量,按公式(2)计算每管的总酚量(mg)。
总酚量=V2·ρ
(2)
式中:V2,每管洗脱液体积,mL;ρ,多酚质量浓度,mg/mL。
1.3.3.3 葡聚糖凝胶树脂纯化
准确称取30 g葡聚糖凝胶Sephadex LH-20,用20%甲醇水溶液充分溶胀后装柱。将1.3.3.2大孔树脂纯化物的冷冻干燥粉末配制成20 mg/mL的溶液,用0.45 μm的微孔滤膜过滤后上样2 mL。分别用250 mL体积分数20%、40%、60%、80%、100%的甲醇水溶液以1.0 mL/min流速洗脱,分管收集,每管10 mL并在280 nm处测定吸光度值。
1.3.4 UPLC-MS分析
1.3.4.1 色谱条件
色谱柱:Waters ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm);柱温:45 ℃;进样量:1 μL;流速0.3 mL/min;流动相A:100%乙腈;流动相B:0.1%甲酸。色谱洗脱条件:0~10 min,流动相A从5%增加至25%;10~15 min,增加至40%;15~20 min,增加至80%;10~25 min,增加至100%。
1.3.4.2 质谱条件
ESI-;毛细管电压,3.0 kV;锥孔电压,30 V;离子源温度,100 ℃;脱溶剂气温度,400 ℃;脱溶剂气流量,700 L/h;锥孔反吹气流量,50 L/h;碰撞能量,6/20 V;探测器电压,1 800 V。
1.3.4.3 柯里拉京标准曲线的测定
精确称取柯里拉京标准品,用无水甲醇定容至10 mL,以柯里拉京质量浓度(x,μg/mL)与峰面积(y)绘制标准曲线方程:y=3.321 4x,R2=1。
1.3.5 抗氧化性能测定
1.3.5.1 ABTS法
用2.45 mmol/L的过硫酸钾溶液将ABTS配制成浓度为7 mmol/L的储备液,使用时用乙醇将储备液稀释至在734 nm处吸光度为(0.700±0.02)的工作液。在96孔板中依次加入190 μL的ABTS工作液和10 μL不同浓度的样品溶液,摇匀,10 min后于酶标仪中测定波长734 nm处的吸光度A734。空白组用pH 4.5醋酸缓冲液代替ABTS工作液,对照组用DMSO代替样品溶液[14]。按公式(3)计算ABTS自由基抑制率:
ABTS自由基抑制率![]()
(3)
1.3.5.2 FRAP法
FRAP工作液:pH值3.6醋酸缓冲液、10 mmol/L TPTZ溶液和20 mmol/L FeCl3溶液按体积比(10∶1∶1)混合,现用现配。在96孔板中依次加入190 μL的FRAP工作液和10 μL不同浓度的样品溶液和FeSO4溶液,摇匀,37 ℃孵育10 min,在酶标仪中测量波长593 nm处的吸光度A593。空白组用pH 3.6 醋酸缓冲液代替FRAP工作液,对照组用DMSO代替样品溶液[15]。以FeSO4的浓度(μmol/L)与吸光度值的关系做标准曲线,根据样品的吸光度值,求得相应的FRAP值。
2 结果与分析
2.1 提取条件的优化
由图1-A可知,随着乙醇含量的增加,龙眼核多酚提取量呈先升后降的趋势,当乙醇体积分数为60%时,多酚的提取量达到最大值。图1-B显示,当料液比在1∶10~1∶25(g∶mL)范围内,总酚提取量有显著增加,但继续提高溶剂用量对多酚提取量无明显影响。故确定最佳料液比为1∶25(g∶mL)。由图1-C和1-D可知,随着提取温度和时间的增加,多酚提取量有明显升高,但继续增加,多酚提取量反而会降低,这是因为温度过高或时间过长,多酚易发生氧化。所以选取70 ℃和60 min为提取温度和时间。
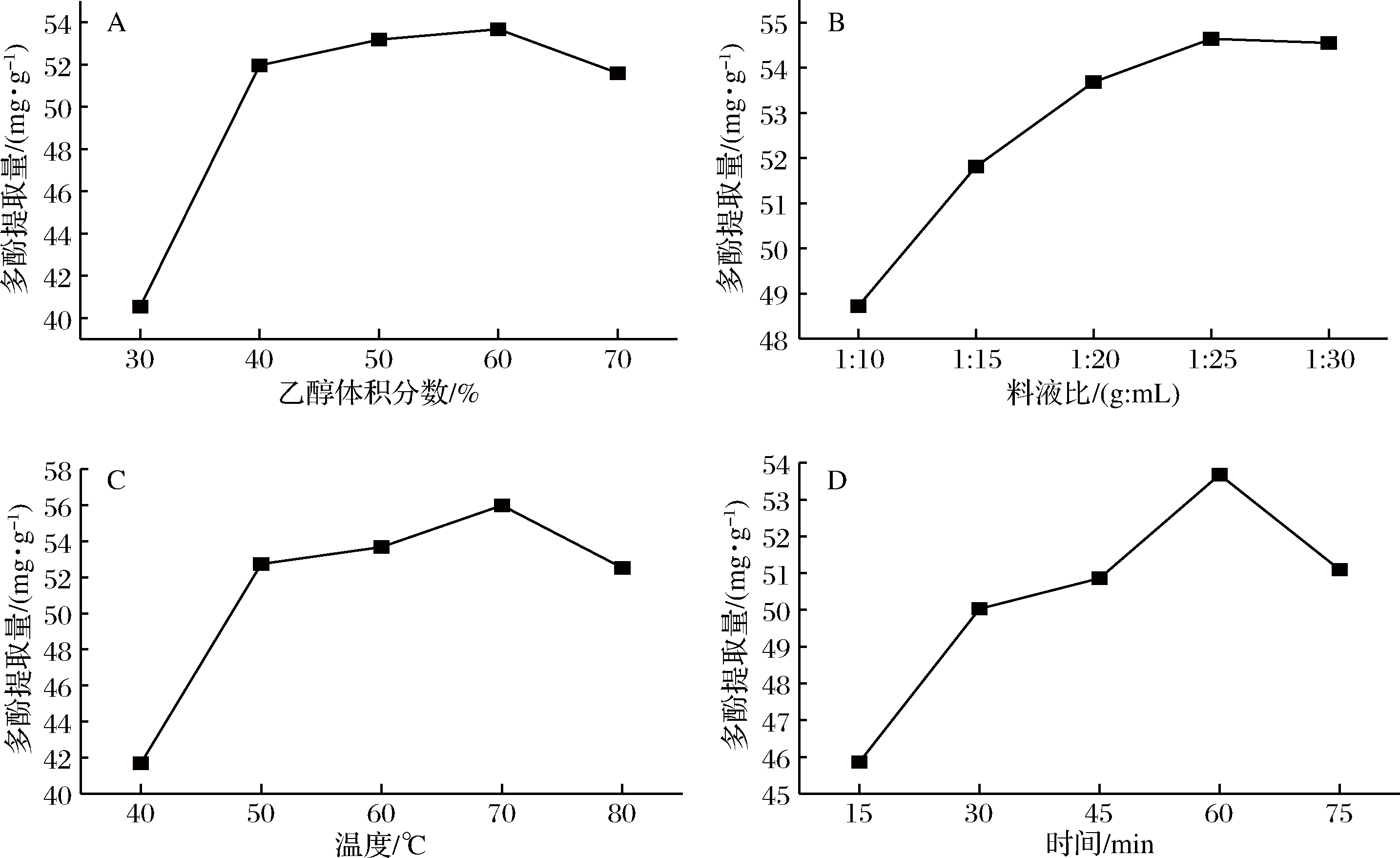
图1 乙醇体积分数、料液比、温度、时间对多酚提取量的影响
Fig.1 Effect of ethanol concentration, solid-to-solvent ratio, temperature and time on extraction yield of polyphenols
综上可知最优提取条件为乙醇体积分数60%、料液比1∶25(g∶mL)、温度70 ℃、时间60 min。该条件下,龙眼核粉末的多酚提取量为53.68 mg/g。
2.2 分离纯化
2.2.1 萃取
表1 3种有机溶剂萃取相的得率及多酚含量
Table 1 Yield and polyphenol content of three organicsolvent extraction phases

指标氯仿相乙酸乙酯相正丁醇相得率/%3.032.804.70多酚含量/(mg·g-1)254.23663.50262.25
为了进一步探究龙眼核中的主要多酚,选择有机溶剂萃取富集多酚。从表1可以看出,3种有机溶剂中乙酸乙酯萃取后得到的多酚含量最高,为663.50 mg/g。
2.2.2 大孔吸附树脂分离与Sephadex LH-20柱纯化
通过AB-8型大孔树脂的吸附与解析作用提高乙酸乙酯相多酚的纯度。从图2可以看出,流出液的多酚主要集中在5~20管中,收集洗脱液并冷冻干燥,进行Sephadex LH-20柱分离。洗脱曲线见图3。根据洗脱液紫外吸光值分布可以将其分为6个组分,其中可以明显的看出具有最高吸光值的组分4为乙酸乙酯相中的主要多酚。组分4的多酚含量为757.75 mg/g,较乙酸乙酯相有较大的提高。
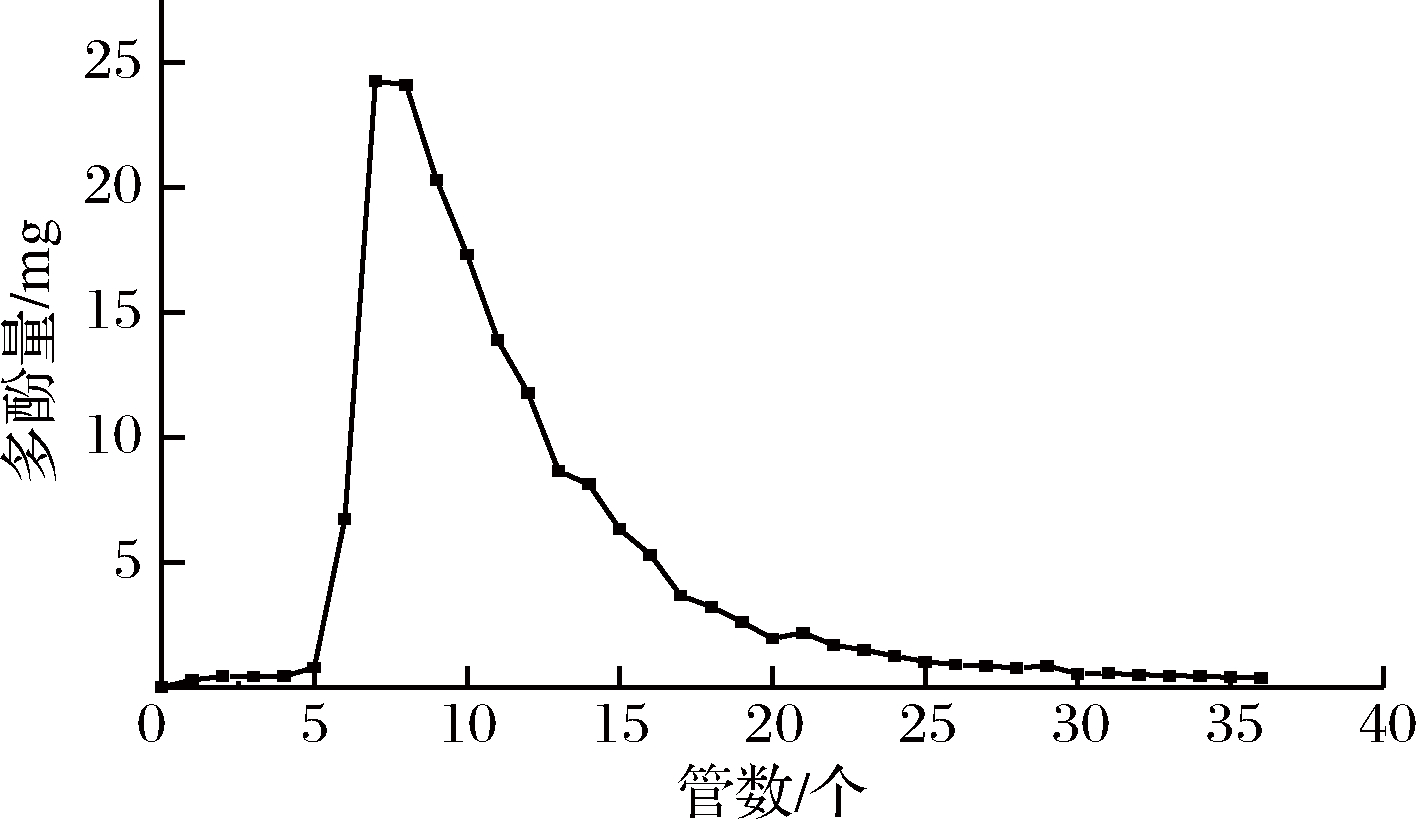
图2 AB-8型大孔树脂洗脱曲线
Fig.2 AB-8 type macroporous resin elution curve
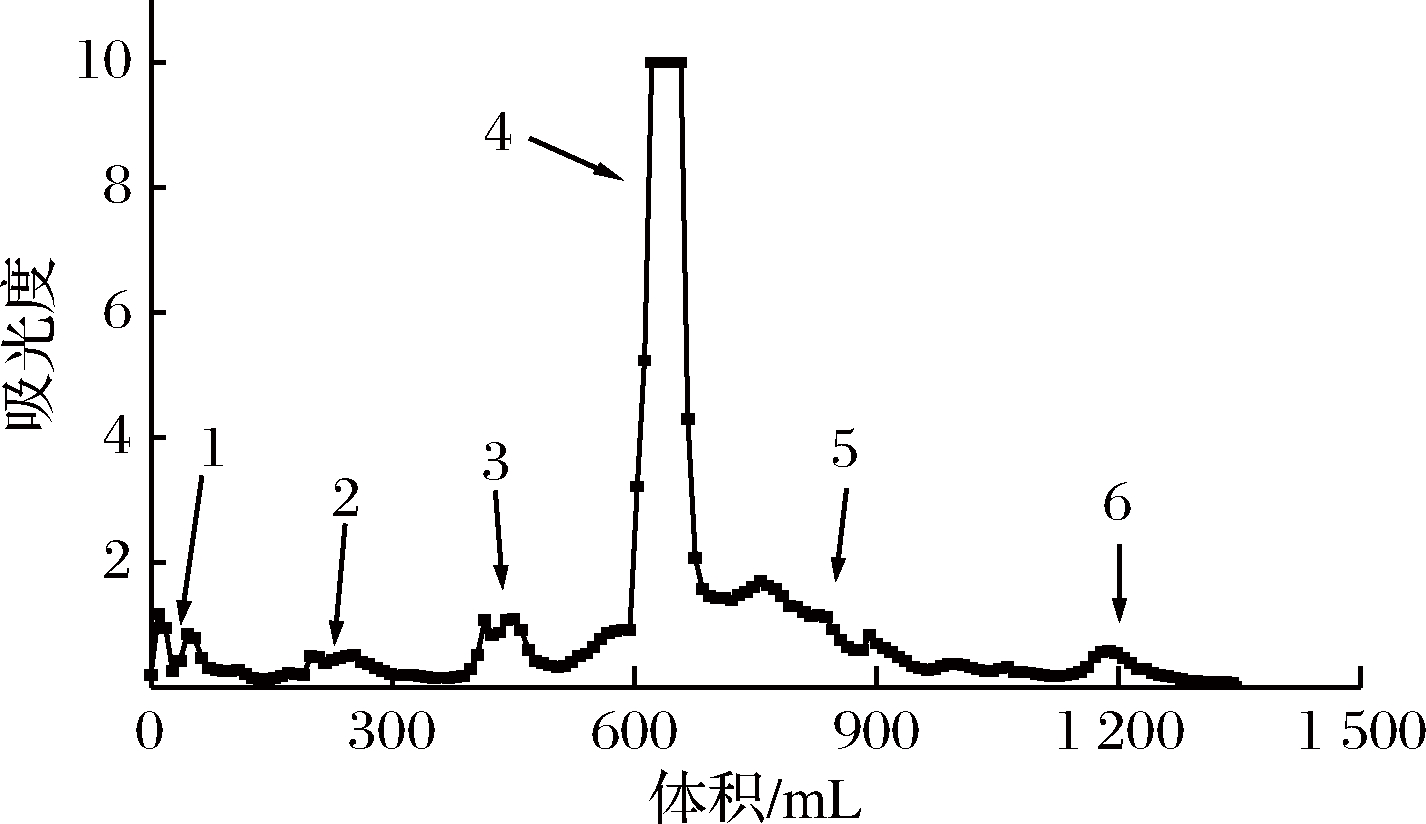
图3 Sephadex LH-20树脂洗脱曲线
Fig.3 Sephadex LH-20 resin elution curve
2.3 UPLC-MS分析
图4-A和图4-C分别为组分4和柯里拉京标准品的UPLC图,组分4主要峰的保留时间与柯里拉京标准品的保留时间一致。

A-组分4的UPLC图;B-组分4的质谱图;
C-柯里拉京的UPLC图;D-柯里拉京的质谱图
图4 组分4与柯里拉京标准品的UPLC-MS图
Fig.4 The UPLC-MS of component 4 and corilagin
对比图4-B和图4-D中的质谱数据,并与PFUNDSTEIN等[16]的研究数据比较,确定组分4中的主要多酚物质为柯里拉京(corilagin),分子式为C27H22O18。根据1.3.4.3中的标准曲线可以得到组分4的柯里拉京含量为631.18 mg/g。
2.4 抗氧化性能的测定
通过测定ABTS自由基清除能力和FRAP值评估龙眼核多酚的抗氧化能力。ABTS法基于ABTS自由基的减少来检测抗氧化剂的抗氧化能力[17]。FRAP法是利用Fe3+被抗氧化物质还原成Fe2+,通过检测Fe2+-TPTZ的生成量反映抗氧化物质的还原能力,FRAP值越大则抗氧化能力越强[18]。从图5-A可以看出,ABTS自由基清除能力的大小为:组分4>乙酸乙酯相>VC>粗提物相>正丁醇相>氯仿相。从图5-B中显示的FRAP值大小为:组分4>VC>乙酸乙酯相>粗提物相>正丁醇相>氯仿相。综上所述,组分4具有优于VC的抗氧化能力。且抗氧化能力随多酚含量提高而上升,说明龙眼核中的主要抗氧化成分为多酚。
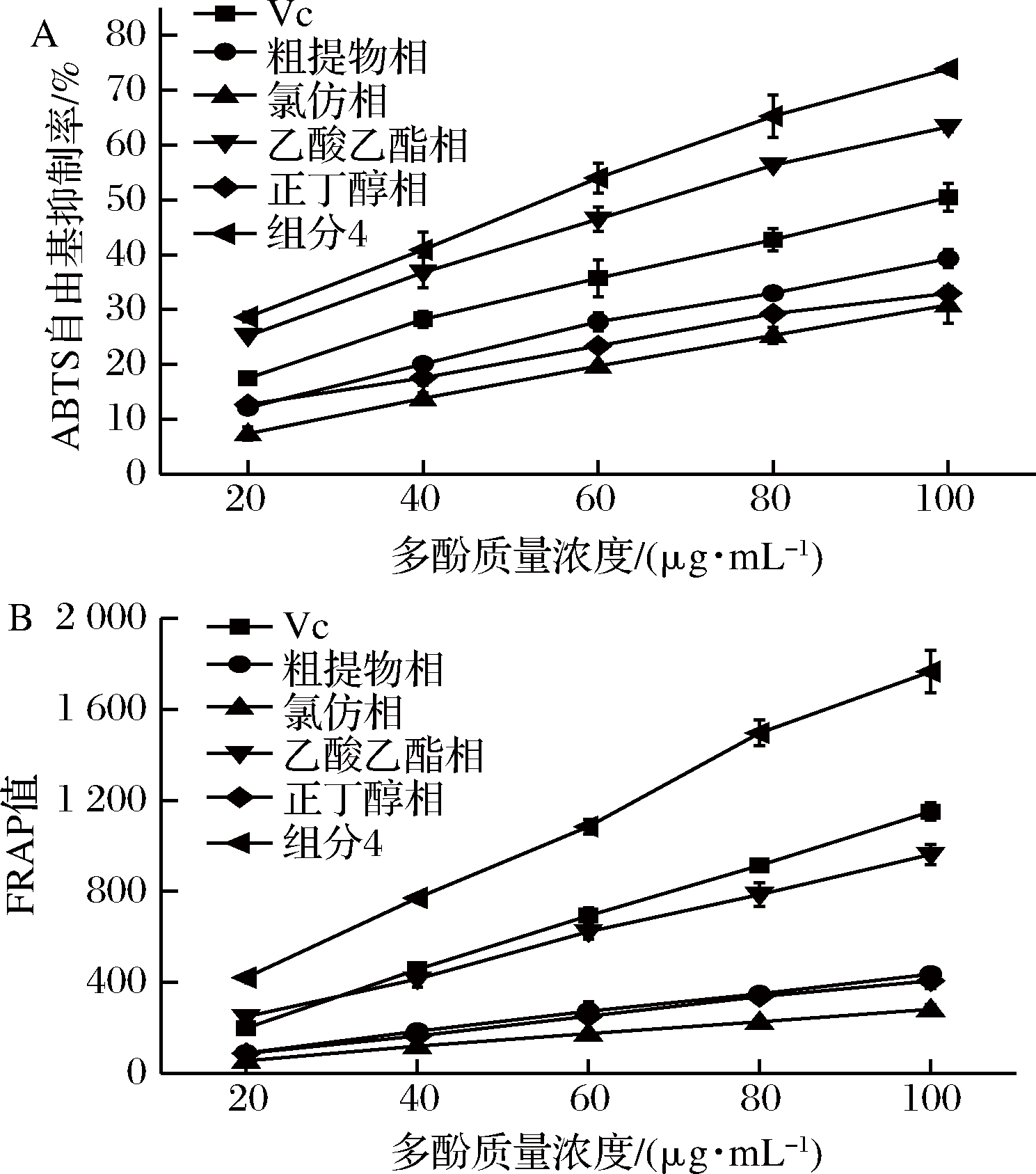
图5 龙眼核多酚的ABTS自由基的抑制率与FRAP值
Fig.5 Inhibition rate of ABTS free radicals and FRAP values of polyphenols in longan seeds
3 结论
本文以来源丰富的龙眼核为原料,优化超声波辅助法提取龙眼核多酚,最佳提取条件为:乙醇体积分数60%、料液比1∶25(g∶mL)、温度70 ℃、时间60 min。在此提取条件下,龙眼核多酚提取量为53.68 mg/g。通过有机溶剂萃取、AB-8型和Sephadex LH-20型树脂的分离与纯化,得到乙酸乙酯相主要的多酚组分4。通过液质联用与标准品对照确定其中主要多酚为柯里拉京,含量为631.18 mg/g。比较ABTS自由基的清除能力与FRAP值,确定了多酚含量较高的组分4具有较强的抗氧化性。
[1] RANGKADILOK N,WORASUTTAYANGKURN L,BENNETT R N,et al.Identification and quantification of polyphenolic compounds in Longan (Euphoria longana Lam.) fruit[J].Journal of Agricultural and Food Chemistry,2005,53(5):1 387-1 392.
[2] RANGKADILOK N,SITTHIMONCHAI S,WORASUTTAYANGKURN L,et al.Evaluation of free radical scavenging and antityrosinase activities of standardized longan fruit extract[J].Food and Chemical Toxicology,2007,45(2):328.
[3] ZHENG Guoming,XU Liangxiong,WU Ping,et al.Polyphenols from longan seeds and their radical-scavenging activity[J].Food Chemistry,2009,116 (2):433-436.
[4] 全国中草药汇编编写组.全国中草药汇编(下册)[M].北京:人民卫生出版社,1978:445.
[5] 黄晓冬.4种龙眼核提取物的总黄酮含量、体外抗菌活性与抗氧化活性[J].食品科学,2011,32(11):43-47.
[6] 文良娟,李英军,毛慧君,等.龙眼核的营养成分及其活性物质的抗氧化性能研究[J].食品科学,2010,31(1):243-246.
[7] 周凯,胡卓炎,周沫霖,等.龙眼核提取物的体外抗氧化及抑菌活性研究[J].食品与机械,2015(4):167-171.
[8] LI Xiangnan,HUANG Jiale,WANG Zidan,et al.Alkaline extraction and acid precipitation of phenolic compounds from longan (Dimocarpus longan L.) seeds[J].Separation & Purification Technology,2014,124(6):201-206.
[9] LIU Yangbin,WANG Pengpu,CHEN Fang, et al. Role of plant polyphenols in acrylamide formation and elimination[J].Food Chemistry,2015,186:46-53.
[10] KEBE M,RENARD C M C G,MAATAOUI M E,et al.Leaching of polyphenols from apple parenchyma tissue as influenced by thermal treatments[J].Journal of Food Engineering,2015,166:237-246.
[11] 唐福才,姚敦琛,关天旺,等.龙眼核中多酚提取及抗氧化活性的研究[J].食品研究与开发,2015(12):5-9.
[12] 陈金玉,曾健,李春美.龙眼核多酚提取工艺的正交试验优化及其分离纯化与结构表征[J].食品科学,2015,36(16):31-37.
[13] SINGLETON V L,ROSSI J A.Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American Journal Enology and Viticulture,1965,16:144-158.
[14] OZGEN M,REESE R N,TULIO A Z,et al.Modified 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid (abts) method to measure antioxidant capacity of Selected small fruits and comparison to ferric reducing antioxidant power (FRAP) and 2,2'-diphenyl-1-picrylhydrazyl (DPPH) methods[J]. Journal of Agricultural and Food Chemistry,2006,54(4):1 151-1 157.
[15] ZHANG Shuting,CUI Yan,LI Lingxi,et al.Preparative HSCCC isolation of phloroglucinolysis products from grape seed polymeric proanthocyanidins as new powerful antioxidants [J].Food Chemistry,2015,188:422-429.
[16] PFUNDSTEIN B,EI DESOUKY S K,HULL W E,et al.Polyphenolic compounds in the fruits of Egyptian medicinal plants (Terminalia bellerica, Terminalia chebula and Terminalia horrida):characterization, quantitation and determination of antioxidant capacities[J]. Phytochemistry,2010,71(10):1 132-1 148.
[17] CHEN J Y, XU Y J, GE Z Z, et al. Structural elucidation and antioxidant activity evaluation of key phenolic compounds isolated from longan (Dimocarpus longan, Lour.) seeds[J]. Journal of Functional Foods, 2015, 17(4):872-880.
[18] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”:The FRAP assay[J]. Analytical Biochemistry,1996,239(1):70-76.