彩色小麦是我国杂交培育的特色小麦,因其较高的营养价值和保健功能[1-2],深受消费者的关注。部分研究证实有色谷物的抗氧化活性高于普通品种,这与谷物籽粒中酚类化合物的存在密切相关[3]。
多酚是植物化学元素的统称,因具有极强的抗氧化能力,能够有效地保护体内生物大分子免受氧化损伤[4-5]。酚类常以不可溶性和可溶性共轭形式存在[6],根据提取方法和结合方式的不同,主要分为游离酚和结合酚[7]。目前已有较多杂粮谷物中酚类的研究,如延莎等[8]证实了不同米色小米多酚对自由基有较好的清除效果。王鹏等[9]研究了杂粮多酚提取物的抗氧化能力,发现酚类含量及结构中酚羟基数量决定抗氧化能力。申迎宾等[10]采用不同溶剂进行青稞多酚提取及抗氧化研究,发现青稞酚含量与抗氧化效果显著相关。当前谷物酚类的研究大多仅关注游离酚的含量及抗氧化活性,往往忽略对结合酚的研究[11-12]。本试验选取彩色小麦中的蓝色和紫色小麦作原料,分别提取游离酚和结合酚,并对其体外抗氧化活性进行研究,以期为彩色小麦资源的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
蓝色小麦(蜀蓝麦1701)、紫色小麦(蜀紫麦1701)、普通小麦(蜀麦969),四川农业大学农学院提供,麦样清洗除杂后置于40 ℃干燥箱中4 h烘干,粉碎过100目筛备用;无水乙醇、甲醇、丙酮、正己烷、浓H2SO4、乙酸乙酯、福林酚试剂、Na2CO3、邻苯三酚、水杨酸等试剂均为分析纯,雅安万科化学试剂;没食子酸,纯度≥ 99%,成都科龙化工试剂;二苯基苦肼基自由基(DPPH),纯度≥ 99%,美国sigma。
1.2 仪器设备
超声波清洗器(410HT),深圳科利尔电子科技有限公司;旋转蒸发器(RE52CS-1),上海亚荣生化仪器公司;冷冻离心机(ST26R),北京联合科力科技有限公司;酶标仪(nfinite M200),瑞士TECAN公司。
1.3 实验方法
1.3.1 游离酚提取[13]
准确称取1 g小麦粉,以60%乙醇、60%甲醇和60%丙酮为溶剂,在料液比1∶20(g∶mL)50 ℃下超声(功率240 W)提取10 min,再经真空抽滤,45 ℃旋蒸后浓缩液于-20 ℃保存待测。
1.3.2 结合酚提取[14]
将已提取过游离酚后的小麦残渣按1∶20(g∶mL)加入正己烷,振荡后离心(4 000 r/min,5 min),弃上清液,加入20 mL质量浓度为10%的硫酸,75 ℃水浴1 h,再分别加入20 mL乙酸乙酯萃取5次,离心(4 000 r/min,5 min),合并萃取相后于45 ℃下旋蒸,将残余物定容,0.45 μm滤膜过滤,得到浓缩液-20 ℃保存待测。
1.3.3 多酚含量测定
福林酚法[15-16]
1.3.4 体外抗氧化实验
1.3.4.1 清除DPPH自由基能力测定
参考文献[17]略修改。将DPPH配成0.2 mmol/L,避光备用。将样品和DPPH按体积比1∶1混匀,室温避光30 min,于517 nm处测吸光值,空白组以DPPH代替样品,对照以无水乙醇代替DPPH,重复测定3次。按公式(1)计算DPPH清除率:
![]()
(1)
式中:I表示自由基清除率,%;A1表示样品吸光度;A2表示对照吸光度;A3表示空白吸光度。
1.3.4.2 清除ABTS自由基能力测定
参考文献[18]略修改。将2.6 mmol/L的过硫酸钾与7.4 mmol/L ABTS溶液按体积比1∶1混合,置于避光室温下16 h,在734 nm下用磷酸盐缓冲液调吸光度为0.7±0.002。将0.1 mL样品与5 mL ABTS混匀,室温避光20 min后,在734 nm下测吸光度值。空白以蒸馏水代替样品,对照以蒸馏水代替ABTS。按式(1)计算ABTS清除率。
1.3.4.3 清除超氧阴离子自由基能力测定
参考文献[19]略修改。 取50 mmol/L的Tris-HCl缓冲液和1 mmol/L的EDTA溶液各1 mL与1.5 mL样品混合,加入1 mL 0.4 mmol/L邻苯三酚,混匀,静置10 min,加入100 mmol/L二硫苏糖醇30 μL终止反应,在1 h内于325 nm下测吸光值,空白以蒸馏水代替样品,对照以蒸馏水代替邻苯三酚溶液。按式(1)计算超氧阴离子清除率。
1.3.4.4 清除羟自由基能力测定
参考文献[20]。
1.3.4.5 总还原力测定
参考文献[21]。
1.3.4.6 数据分析
实验数据为3次重复实验的平均值,以SPSS 19.0软件Duncan法进行差异显著性分析,采用Excel 2016作图。
2 结果与分析
2.1 提取方法对小麦多酚得率的影响
游离酚和结合酚提取结果如图1所示,几种提取溶剂中60%的乙醇溶液对游离酚提取效率高于甲醇和丙酮(图1-a)。根据相似相溶原理,选60%的乙醇作为游离酚提取溶剂,得到蓝色小麦、紫色小麦及普通小麦游离酚含量依次为:(1 000±21)、(950±19)、(758±23) μg/g。将60%乙醇提取过游离酚后收集的麦渣经水解提取结合酚,得到结合酚含量依次为:(1 130±28)、(1 020±26)、(869±20) μg/g (图1-b)。综上,蓝色小麦和紫色小麦的多酚含量显著高于普通小麦,这与ARRANZ[22]和徐元元[23]等结论保持一致。
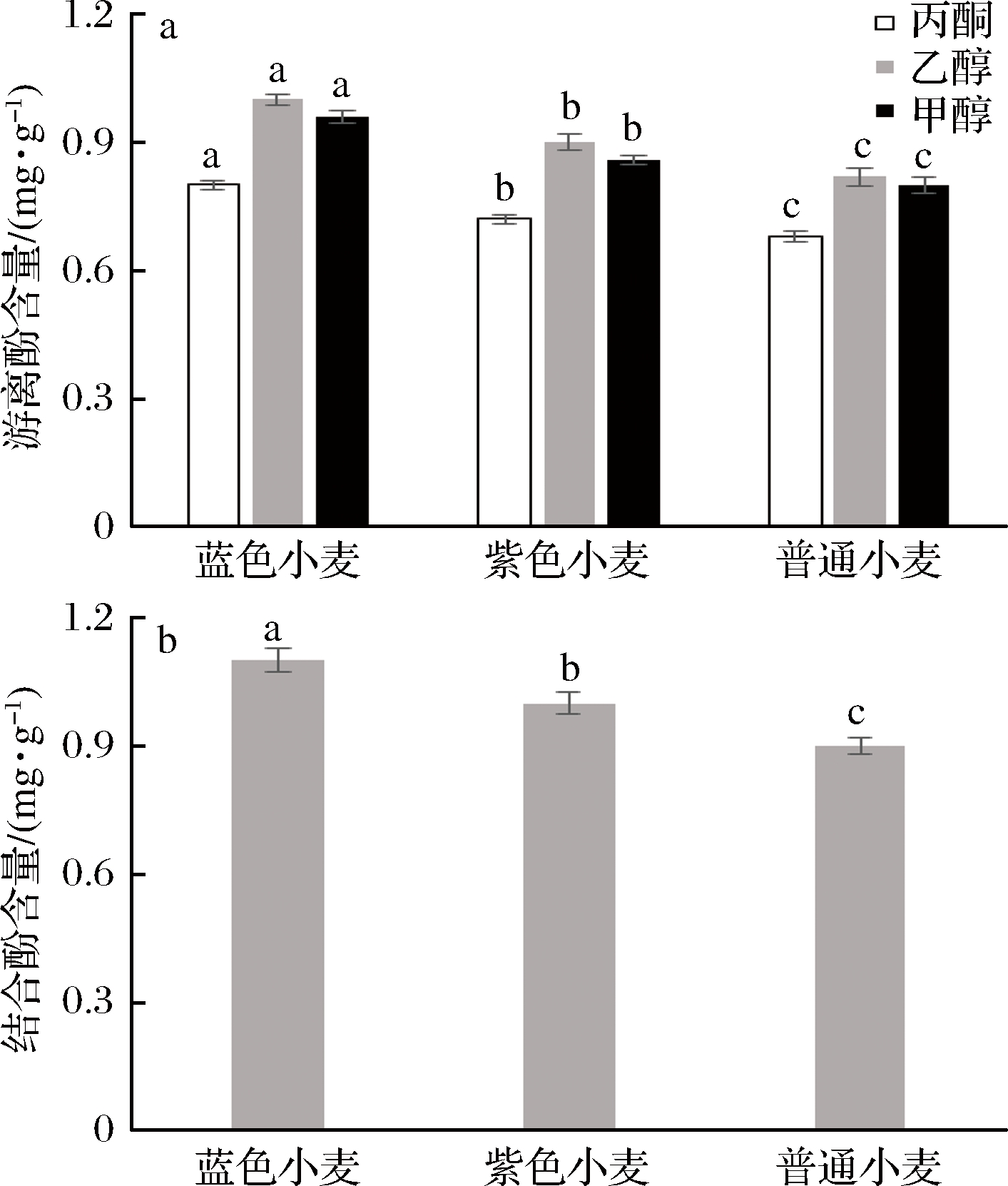
a-游离酚;b-结合酚
图1 小麦样品中酚类含量
Fig.1 Polyphenol contents in wheat
注:不同字母表示差异显著(P<0.05)
2.2 DPPH自由基清除能力
DPPH是性质稳定的自由基,参与生命活动,自由基过量易引起氧化应激,提高发病率。研究表明,抗氧化剂对DPPH清除依赖其供氢能力,DPPH接受抗氧化剂的氢原子使奇数电子的氮原子减少,促使体系中自由基降低[24]。由图2可知,样品中游离酚和结合酚对DPPH均有较好清除效果,随质量浓度增加DPPH清除率增强,清除DPPH强弱顺序为蓝色小麦、紫色小麦、普通小麦。当小麦质量浓度在40 mg/mL时,蓝色小麦、紫色小麦及普通小麦游离酚的DPPH清除率依次为:(77.4±2.9)%、(71.2±3.3)%、(66.1±2.7)%,其IC50值依次为:14.7、24.1、28.5 mg/mL;结合酚DPPH清除率依次为:(90.1±2.2)%、(89.2±1.9)%、(86.3±2.3)%,其IC50值依次为:7.3、8.4、10.1 mg/mL。3组样品中结合酚的IC50值均低于游离酚,说明结合酚对DPPH清除效率更强。杨希娟等[14]通过对不同粒色青稞中游离酚和结合酚的抗氧化活性进行评价,发现酚类化合物对自由基清除具有选择性,结合酚对DPPH可能具备更好的清除效果。
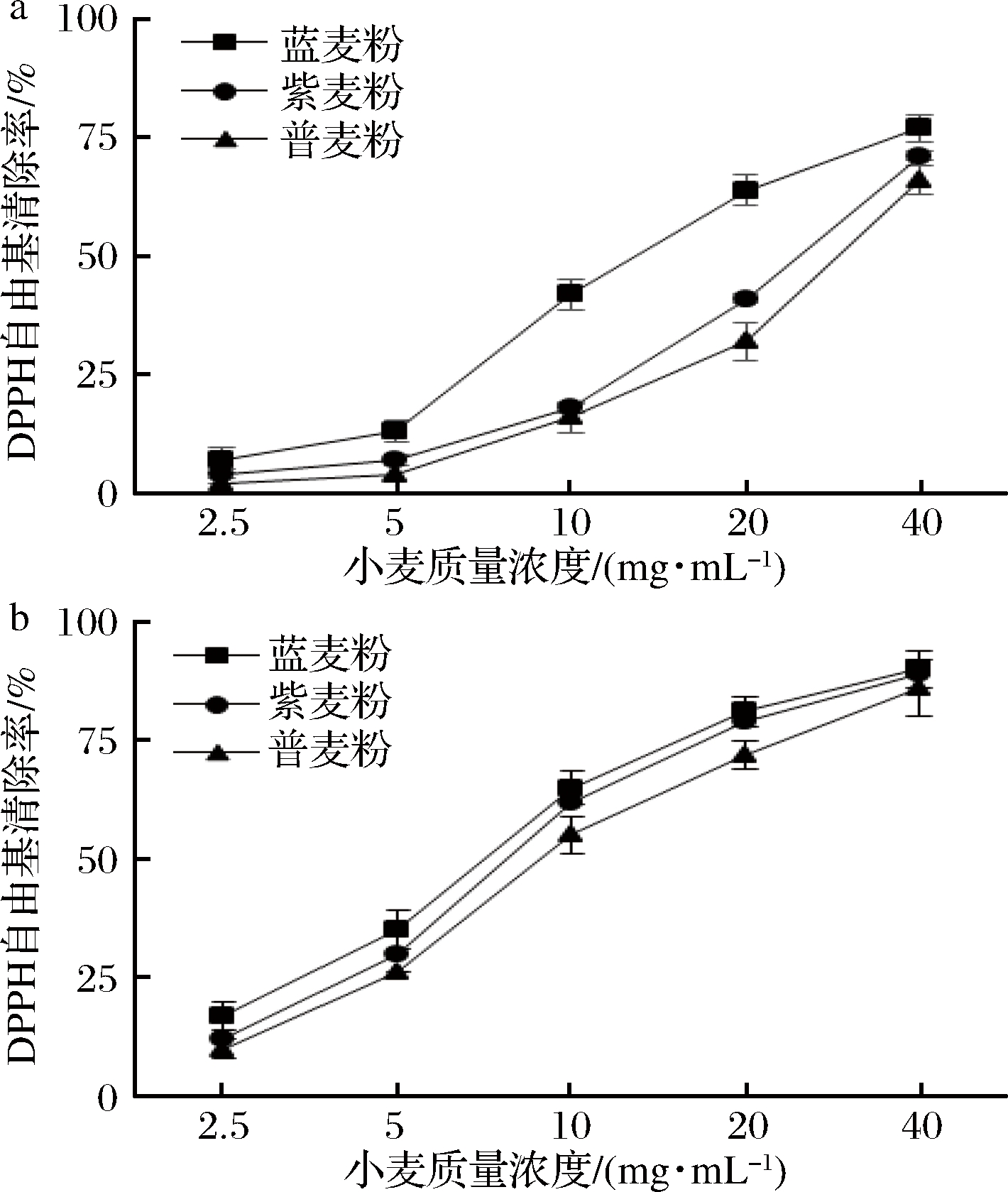
a-游离酚;b-结合酚
图2 DPPH自由基清除能力
Fig.2 Scavenging activity of DPPH free radicals
2.3 ABTS自由基清除能力
由图3可知,样品中游离酚和结合酚对ABTS具有清除效果,随样品量增大ABTS清除率增强。清除ABTS强弱顺序为蓝色小麦、紫色小麦、普通小麦。
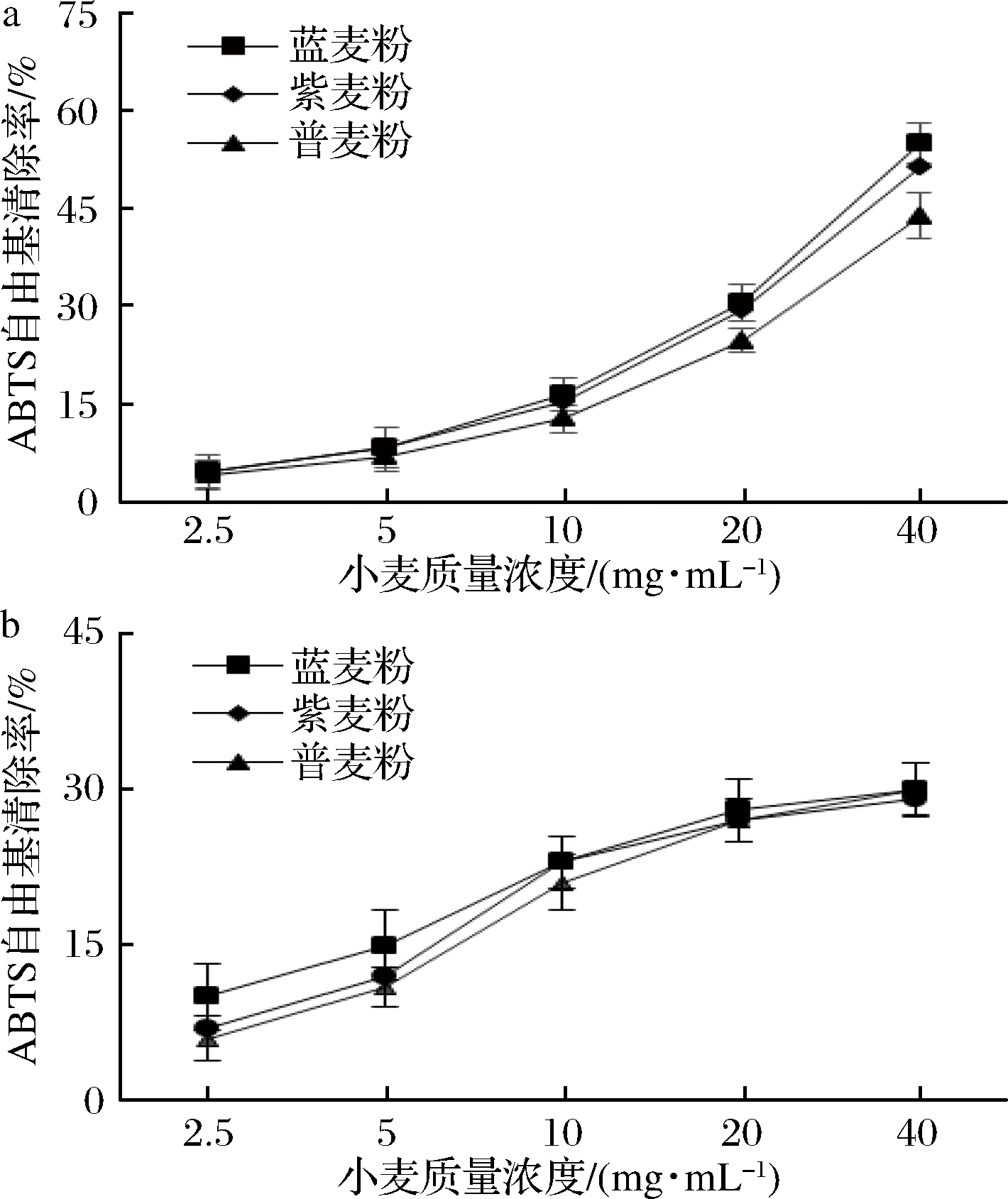
a-游离酚;b-结合酚
图3 ABTS自由基清除能力
Fig.3 Scavenging activity of ABTS free radicals
当小麦质量浓度在40 mg/mL时,游离酚ABTS清除率依次为:(55.2±2.4)%、(51.5±2.3)%、(43.8±1.9)%,蓝色小麦和紫色小麦的IC50值分别为:36.3、40.1 mg/mL;结合酚对ABTS清除率依次为:(30.3±2.5)%、(29.1±2.6)%、(30.2±2.3)%。3组样品中游离酚对ABTS的清除效果强于结合酚。
2.4 超氧阴离子清除能力
超氧阴离子参与机体中生物大分子的氧化损伤反应,过多的超氧阴离子产生强氧化性,易引起机体损伤造成慢性疾病[25-26]。由图4可知,样品中游离酚和结合酚对超氧阴离子均有清除作用,随样品量增大超氧阴离子清除能力增强。清除超氧阴离子强弱顺序为蓝色小麦、紫色小麦、普通小麦。当小麦质量浓度在40 mg/mL时,蓝色小麦、紫色小麦及普通小麦游离酚超氧阴离子清除率依次为:(40.3±1.9)%、(32.0±2.1)%、(23.0±1.7)%;结合酚清除率依次为:(57.3±2.5)%、(53.1±2.6)%、(50.3±2.2)%,IC50值依次为:30.7、35.8、38.8 mg/mL。3组样品中的结合酚对超氧阴离子表现更强的清除作用。
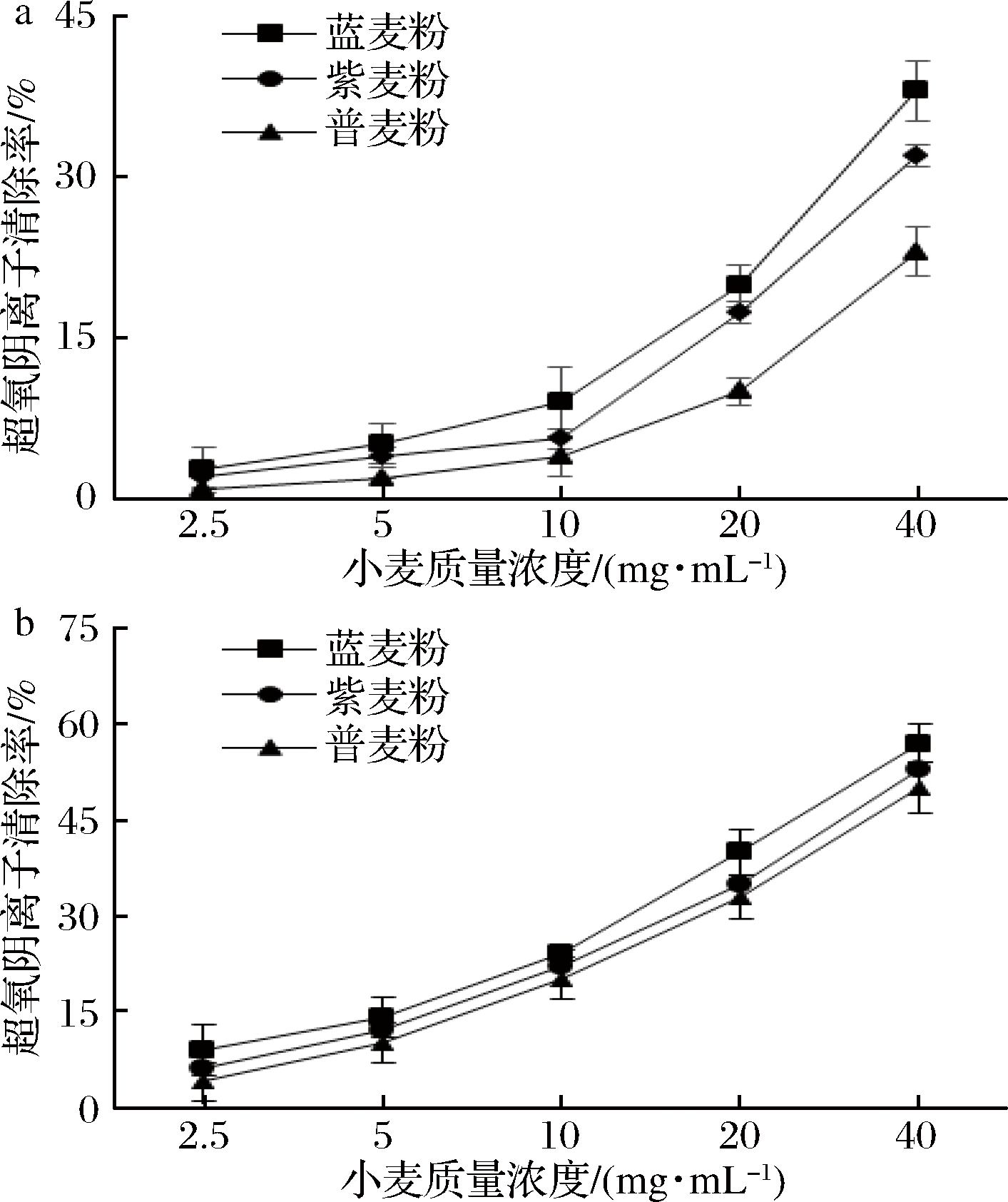
a-游离酚;b-结合酚
图4 超氧阴离子清除能力
Fig.4 Scavenging activity of superoxide free radicals
2.5 羟自由基清除能力
羟自由基的电子能力强,过量的羟自由基会促进细胞氧化,会诱导细胞毒性产生致癌作用。减少此类自由基可预防心血管疾病。研究发现,植物酚类的多羟基具有供电子能力,能够清除羟自由基或阻断Fenten反应,减少羟自由基的产生量[27]。如图5所示,样品中游离酚和结合酚对羟自由基均有清除作用,随样品量增大其清除能力增强。清除羟自由基强弱顺序为蓝色小麦、紫色小麦、普通小麦。当小麦质量浓度在40 mg/mL时,蓝色小麦、紫色小麦及普通小麦的游离酚羟自由基清除率依次为:(51.1±2.1)%、(44.0±2.4)%、(38.2±1.8)%,蓝色小麦IC50值为41.8 mg/mL;结合酚的羟自由基清除率依次为:(88.5±1.8)%、(82.1±1.7)%、(80.0±1.5)%,其IC50值依次为:9.9、12.7、14.5 mg/mL。3组样品结合酚的IC50值均低于游离酚,说明结合酚对羟自由基的清除效率高于游离酚。以上结果与Min等[31]的研究结论一致。

a-游离酚;b-结合酚
图5 羟自由基清除能力
Fig.5 Scavenging activity of hydroxy free radicals
2.6 总还原力清除能力
研究发现还原能力与抗氧化能力密切相关,还原能力可作为抗氧化评价指标。具有还原能力的物质利用氢质子将体系中铁离子还原,从而起到抑制自由基产生,而酚类具有提供氢质子的能力[28]。如图6所示,样品均表现出一定的还原能力,在700 nm下随样品量增大吸光度逐渐上升。清除总还原力强弱顺序为蓝色小麦、紫色小麦、普通小麦。当小麦质量浓度在40 mg/mL时,蓝色小麦、紫色小麦及普通小麦游离酚的总还原力依次为:(0.200±0.003)、(0.149±0.004)、(0.143±0.003);结合酚的还原力依次为(0.188±0.003)、(0.186±0.002)、(0.181±0.003)。3组样品结合酚和游离酚的还原效果接近,说明游离酚和结合酚的还原能力差异不明显,与NAYAK等[5]的研究结论较一致。
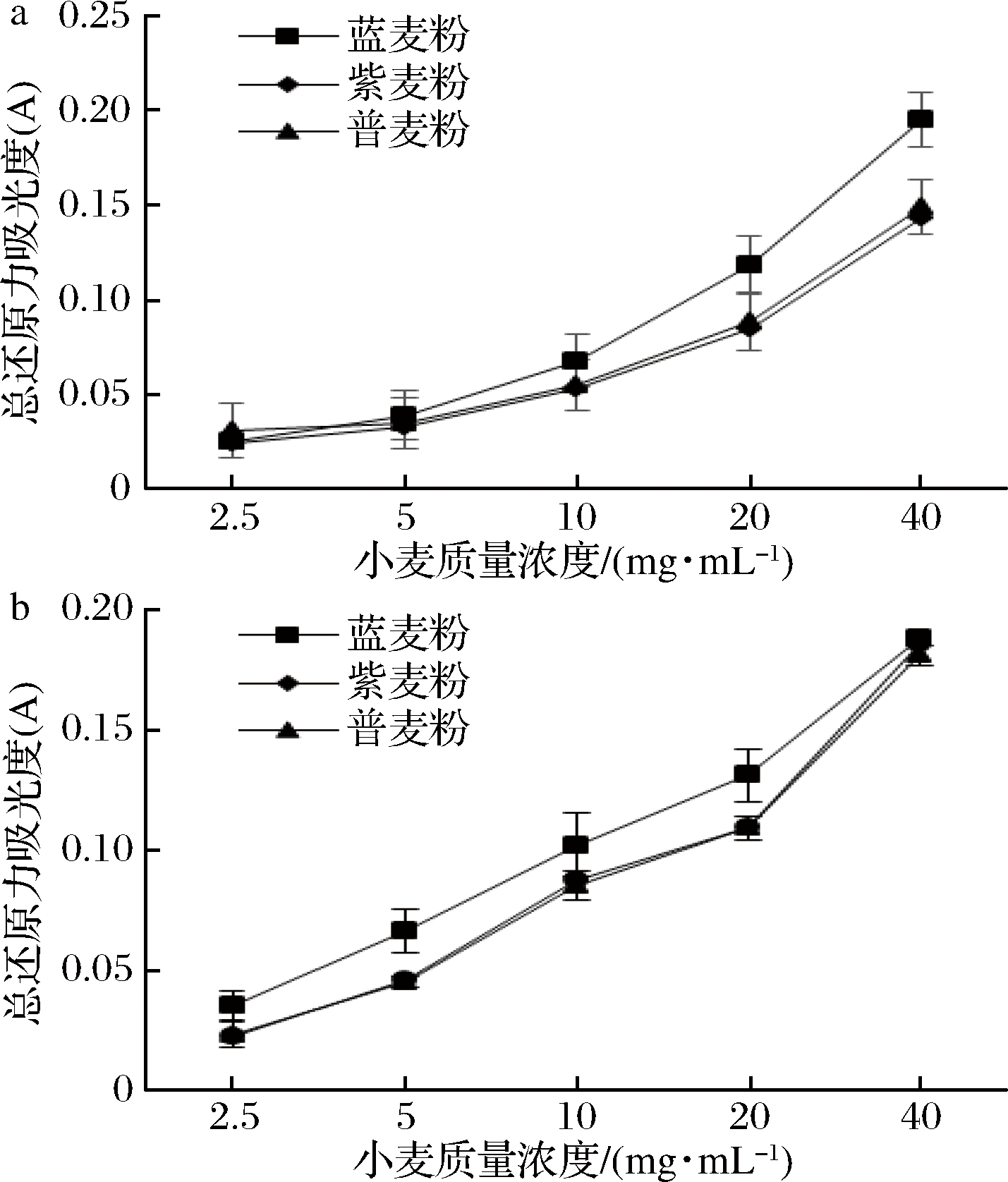
a-游离酚;b-结合酚
图6 总还原能力
Fig.6 Reducing power
3 结论
本研究对蓝色和紫色小麦中的游离酚及结合酚进行提取并评价其抗氧化能力。研究发现蓝色和紫色小麦中酚类含量丰富,样品中结合酚含量高于游离酚,总酚含量表现为:蓝色小麦>紫色小麦>普通小麦。体外抗氧化研究表明,样品中游离酚和结合酚对DPPH自由基及ABTS自由基、超氧阴离子自由基、羟自由基、总还原力均具有较好的清除效果,酚含量与抗氧化效果呈正相关,但游离酚和结合酚对不同自由基清除效果存在差异。抗氧化能力整体表现为蓝色小麦优于紫色小麦优于普通小麦。本试验可为彩色小麦作为保健食品开发利用提供参考依据。
[1] 谷玉娟,陈志成,苏东民.彩色小麦的理化特性及麸皮粉的品质评价[J].食品安全质量检测学报,2015,6(6):2 262-2 268.
[2] 周晓超,刘骏,李林峰,等.彩色粮食的营养价值及其营养成分探析[J].农业科技通讯,2018(7):17-19.
[3] 姚惠,赵彬,崔洁媚,等.4种典型谷物中酚类化合物的抗氧化和抗癌细胞增殖活性[J].食品工业科技,2018,39(14):71-75;93.
[4] 齐岩,檀昕,程安玮,等.葡萄皮和籽中游离酚和结合酚组成及抗氧化活性比较[J].核农学报,2017,31(1):104-109.
[5] NAYAKB,LIU R H,TANG J.Effect of processing on phenolic antioxidants of fruits, vegetables, and grains-a review [J]. Critical Reviewsin Food Science and Nutrition,2015,55 (7): 887-919.
[6] 李晓乐,杨瑞丽,张玉莹,等.6种热带水果多酚组成及其抗氧化活性分析[J].食品研究与开发,2018,39(5):1-7.
[7] NORDKVIST E, SALOMONSSON A C, ÅMAN P. Distribution of insoluble bound phenolic acids in barley grain[J]. Journal of the Science of Food & Agriculture, 1984, 35(6):657-661.
[8] 延莎,祁鹏煜,张苏慧,等.不同米色小米多酚提取物的体外抗氧化活性[J].中国粮油学报,2017,32(10):33-38;44.
[9] 王鹏,侯宪文,赵茂臻,等.杂粮多酚提取物体外抗氧化能力的分析[J].食品科技,2017,42(4):201-206.
[10] 申迎宾,张友维,黄才欢,等.提取溶剂对青稞提取物总酚、黄酮含量及其抗氧化活性的影响[J].食品与机械,2016,32(11):133-136.
[11] LIANG C H, SYU J L, MAU J L. Antioxidant properties of solidstate fermented adlay and rice by Phellinus linteus[J]. Food Chemistry, 2009. 116(4): 841-845.
[12] ACOSTA-E B A, GUTIÉRREZ-URIBE J A, SERNA-SALD VAR S O.Bound phenolics in foods, a review[J]. Food Chemistry, 2014, 152: 46-55.
VAR S O.Bound phenolics in foods, a review[J]. Food Chemistry, 2014, 152: 46-55.
[13] 刘翠,石爱民,刘红芝,等.超声辅助法制备花生红衣的多酚类物质[J].中国食品学报,2016,16(12):141-150.
[14] 杨希娟,党斌,徐菲,等.不同粒色青稞酚类化合物含量与抗氧化活性的差异及评价[J].中国粮油学报,2017,32(9):34-42.
[15] 祖元刚,胡艳,姜守刚.红松多酚物质的提取工艺及其抗炎活性初步研究[J].植物研究,2016,36(4):634-640.
[16] 向莉,王琪,徐远阳,等.Folin-Ciocalteu法测定黑粒小麦麸皮中多酚含量的研究[J].粮食与饲料工业,2012(1):57-60.
[17] 王鹏,郭丽,李杨.不同浸提方式对蒲公英提取液抗氧化活性的影响[J].食品科技,2018,43(2):253-258.
[18] 董红敏.川明参醇提物与多糖的提取、分析及抗氧化活性研究[D].雅安:四川农业大学,2016.
[19] 王霞,吴丹,袁旭寒.人工培植竹荪与野生竹荪抗氧化活性比较研究[J].安徽农业科学,2018,46(6):5-7.
[20] 廖国会,龙家寰,秦立新,等.松乳菇多糖提取工艺优化及抗氧化活性评价[J].食品工业科技,2018,39(4):123-130.
[21] 刘静,李湘利,梁宝东,等.紫甘蓝多酚的体外抗氧化能力及抑菌作用[J].食品工业科技,2017,38(23):49-52;57.
[22] ARRANZ S, SAURA CALIXTO F. Analysis of polyphenols in cereals may be improved performing acidic hydrolysis: A study in wheat flour and wheat bran and cereals of the diet[J]. Journal of Cereal Science, 2010, 51(3): 313-318.
[23] 徐元元,国旭丹,贺丽霞,等.常见6种杂粮与2种主粮的抗氧化活性比较研究[J].食品科学,2012,33(7):20-25.
[24] 刘冉,王振宇,卢静,等.两种松科植物松多酚体外抗氧化活性评价[J].食品工业科技,2013,34(4):159-163.
[25] 杨红叶,杨联芝,柴岩,等.甜荞和苦荞籽中多酚存在形式与抗氧化活性的研究[J].食品工业科技,2011,32(5):90-94;97.
[26] HUNG P V, MORITA N. Distribution of phenolic compounds in the graded flours milled from whole buckwheat grains and their antioxidant capacities[J]. Food Chemistry, 2008, 109(2): 325-331.
[27] ADOM K K, LIU Ruihai. Antioxidant activity of grains[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6 182-6 187.
[28] MINB,GU L, MCCLUNG AM,et al.Free and bound total phenolic concentrations,antioxidant capacities,and profiles of proanthocyanidins and anthocyanins in whole grain rice(Oryza sativa L.)of different bran colours[J]. Food Chemistry, 2012,133(3):715-722.