辣木是产于北印度的多年生速生树种。目前,我国已在云南、福建、广西等省份引进辣木品种并形成种植规模[1]。辣木的叶、种子及根等部分均可食用,富含多种维生素、矿物质元素且具有药理活性,是一种兼具优良保健和治疗作用的药食同源性植物。辣木籽中含有丰富的油脂(约39%)和蛋白质(约36%)[2]。其中,辣木籽油中油酸含量高达68%[3],油酸具有降低胆固醇和调节血脂等作用;辣木籽中蛋白质含量远高于其在茎、叶、籽壳中的含量,且含有人体所需的全部必需氨基酸[4],是一种营养价值较高的蛋白质。因此,研究合适的高效提取方法,分离得到辣木籽的蛋白质、油脂等主要营养成分,在功能食品、医药和化妆品等领域的产品开发方面具有重要意义。
目前,对辣木籽蛋白质的研究主要集中在脱脂辣木籽中蛋白质的分级提取及其在水处理中的效果[3,5],以及水酶法同时提取辣木籽油和蛋白质等方面[6-8]。
蛋白质的传统提取法中所需提取时间较长(通常大于1 h)[9],不利于其提取效率的提高。近年来,超声波辅助法因其在提取蛋白质过程中具有耗时短、纯度高、有利于改善蛋白功能性质等优点而被广泛用于大豆、花生蛋白质的提取[10-11]。目前,已有的报道多集中在利用超声辅助法提取辣木籽油[3]以及辣木叶多酚[12]、黄酮[13]和蛋白质[14]的工艺研究中。然而,关于辣木籽蛋白质的分离提取的研究报道还很少,尤其是利用超声辅助提取辣木籽蛋白质的相关研究尚未见报道。
本文以脱脂辣木籽为原料,采用超声辅助法提取辣木籽蛋白质,考察超声功率、液料比、NaCl浓度、提取pH和提取时间对蛋白质提取率的影响,以期提高辣木籽蛋白质的提取效率以及为其开发与利用提供理论依据与技术支持。
1 材料与方法
1.1 材料与试剂
辣木籽,产于北印度喜马拉雅区,购于昆明中药材市场;石油醚(沸程60~90 ℃),购于重庆川东化工(集团)有限公司;考马斯亮蓝G-250和牛血清蛋白,购于合肥志宏生物技术有限公司;其他试剂均属于分析纯;超纯水,由YSL-RO-T10L/H超纯水系统(Ashland公司)制备。
1.2 实验仪器
GM-K20型加热破壁料理机,佛山市顺德区格明电器实业有限公司;Scientz-800CQ型超声波提取震荡反应器,宁波新芝生物科技股份有限公司;RW20数显型混合顶置式机械搅拌器,德国IKA公司;FD-1A-50型冷冻干燥机,北京博医康实验仪器有限公司;H4-20KR型台式高速冷冻离心机,湖南可成仪器设备有限公司;PB-10 pH计,赛多利斯科学仪器(北京)有限公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 辣木籽蛋白的提取方法
将辣木籽粉碎并过40目筛,用沸程为60~90 ℃的石油醚(m(辣木籽粉)∶v(石油醚)=1∶6)在30 ℃下搅拌(500 r/min,40 min)脱脂,重复提取2次。把经过二次脱脂后的辣木籽粉置于通风橱内至石油醚完全挥发得到脱脂辣木籽粉(蛋白质含量为54.63%)。将脱脂辣木籽粉与一定浓度的NaCl溶液按一定比例混合,用1.00 mol/L的HCL调节混合液pH至一定值后在一定温度下超声搅拌提取。然后,将提取混合液在4 ℃下离心(4 630×g,15 min),过滤,收集上清液;对所得沉淀进行第二次超声提取,最后合并2次超声提取的上清液。
1.3.2 单因素试验
以蛋白质提取率为评价指标,分别考察超声功率(0~240 W)、液料比(10∶1~60∶1,mL∶g)、NaCl浓度(0~1.75 mol/L)、pH(4.00~11.00)及超声提取时间(5~20 min)对辣木籽蛋白质提取率的影响。
1.3.3 响应面优化试验
在辣木籽蛋白质提取的单因素基础上进行响应面优化试验。根据Box-Behnken模型,以液料比、NaCl浓度、pH为自变量,辣木籽蛋白质提取两次的提取率为响应值,设计3因素3水平的响应面分析试验(表1)。
表1 Box-Benhnken试验因子水平编码表
Table 1 Factor coding and levels of Box-Benhnken
experiments
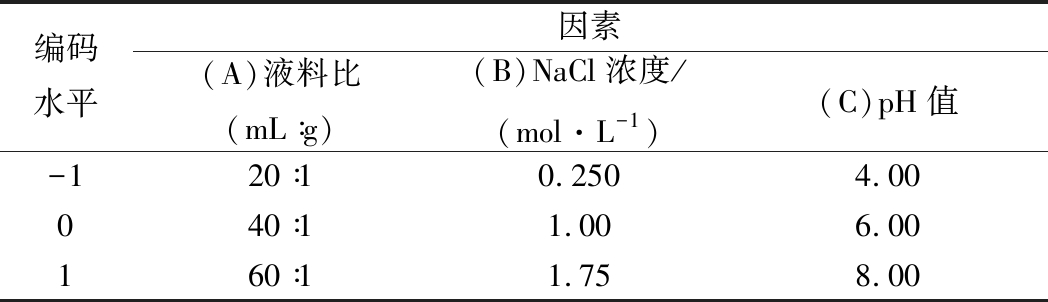
编码水平因素(A)液料比(mL∶g)(B)NaCl浓度/(mol·L-1)(C)pH值-120∶10.2504.00040∶11.006.00160∶11.758.00
1.3.4 蛋白质的沉淀试验
以蛋白质沉淀率为评价指标,考察盐析体系中NaCl浓度(2.56、3.42、4.27 mol/L)对上清液中蛋白质沉淀率的影响。具体操作为:将最佳提取条件下所得的上清液pH调至10.00后加入一定质量的NaCl,在室温下静置2 h后离心(8 230×g,15 min),过滤,收集沉淀,将沉淀透析72 h,透析液冷冻干燥后得到纯化后的辣木籽蛋白粉;同时测定离心后上清液的蛋白质浓度以计算蛋白质沉淀率。
1.3.5 蛋白质相关指标的测定方法
采用凯氏定氮法[15]对脱脂辣木籽粉和盐析纯化后辣木籽蛋白粉中总蛋白质的质量进行测定。采用考马斯亮蓝法[16]对蛋白质提取中上清液蛋白质的质量进行测定;牛血清蛋白浓度与吸光度的标准曲线为y=44.54x+0.019 3,标准曲线相关系数R2=0.998 7。蛋白质提取率、蛋白质纯度和蛋白质沉淀率分别按公式(1)、(2)和(3)计算。
蛋白质提取率![]()
(1)
蛋白质纯度![]()
(2)
蛋白质沉淀率![]()
(3)
1.4 数据处理
各实验重复3次,各样品的指标平行测定至少2次,以平均值±标准偏差表示结果。采用SPSS 18.0软件对数据进行单因素方差分析(P<0.05时判断组间存在显著差异)。
2 结果与分析
2.1 单因素试验结果
2.1.1 超声功率对辣木籽蛋白质提取率的影响
在液料比为30∶1,pH为6.00,提取温度为40 ℃,提取时间为15 min,NaCl浓度为0.500 mol/L,提取2次的条件下,超声功率对辣木籽蛋白质提取率的影响如图1所示。当超声功率从0 W增加到120 W时,辣木籽蛋白质的提取率明显提高了14.54%(P<0.05)。这可能是因为随着超声功率在一定范围内的增加,超声波振荡频率增加,液体中的压力增大,超声波的空气化作用和机械剪切力作用得到增强,脱脂辣木籽细胞壁的破坏速度加快,进而更有利于蛋白质分子展开并与溶剂接触,最终促进了蛋白质溶解于提取液中[17]。然而,当超声功率从120 W增加到240 W时,提取率呈现下降的趋势并趋于平缓。其原因可能是较大超声功率会使空化气泡来不及破裂,空气化作用效率降低,并且会增加散射衰减,形成声屏障,这使蛋白质分子间的黏滞性增强,提取率降低[18-19]。因此,确定辣木籽蛋白质提取的最佳功率为120 W。
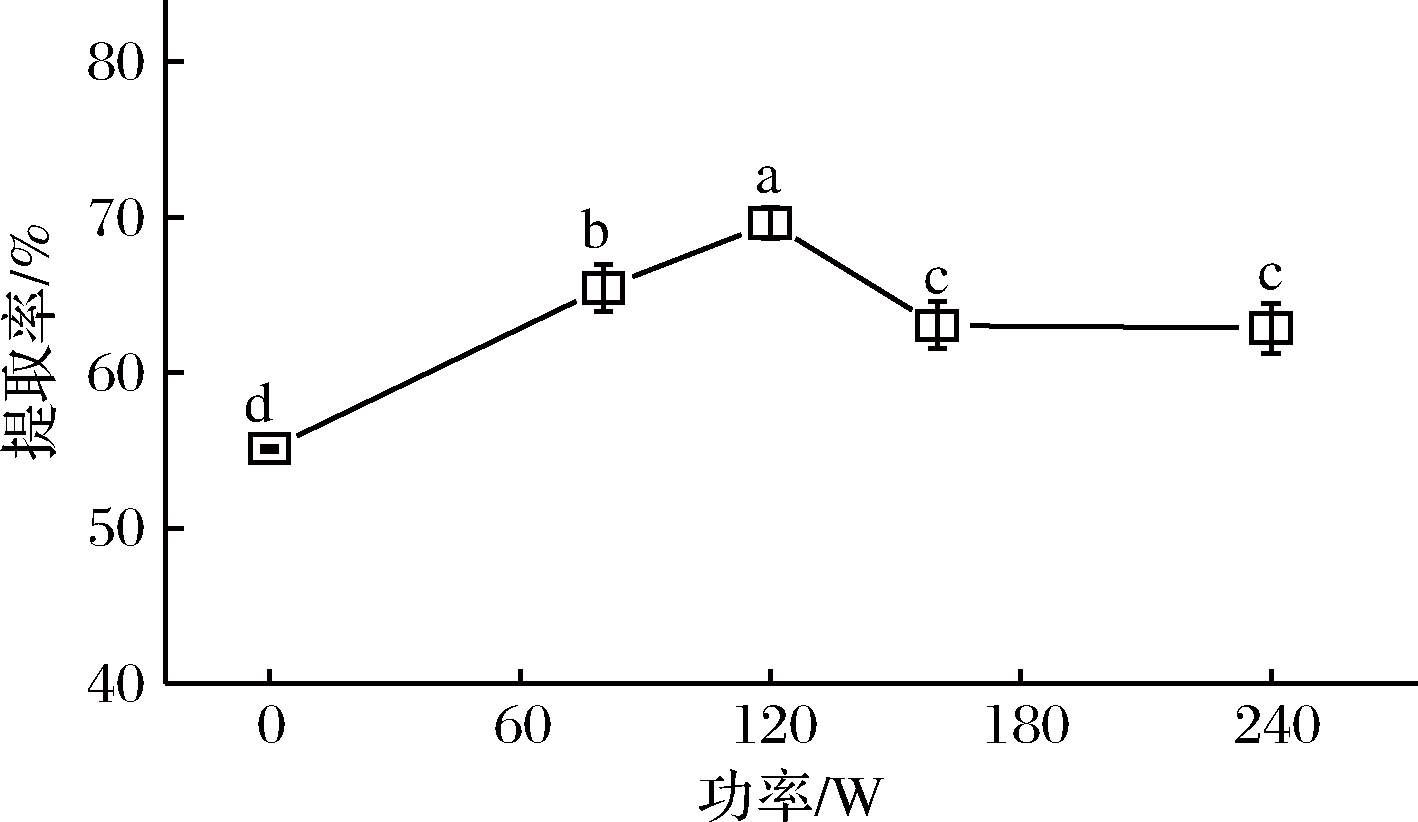
图1 超声功率对辣木籽蛋白质提取率的影响
Fig.1 Effect of ultrasonic power on the extractability of protein from the defatted Moringa oleifera seed flour
2.1.2 液料比对辣木籽蛋白质提取率的影响
在pH为6.00,提取温度为40 ℃,提取时间15 min,提取功率为120 W,NaCl浓度为0.500 mol/L,提取2次的条件下,液料比对辣木籽蛋白质提取率的影响如图2所示。当液料比从10∶1增大到40∶1时,蛋白质的提取率提高较快,增加了29.80%,这可能是由于溶剂的适量增加使得辣木籽在溶剂中的接触面积与分散度增大,扩散作用增强[20]。当液料比大于40∶1后,蛋白质的提取率继续增大,但增长趋势变缓。虽然蛋白质提取率随着液料比的增大(10∶1~60∶1)而不断提高,但是上清液中的蛋白质质量浓度从18.35 mg/mL下降到4.022 mg/mL,浓度太小会增加后续蛋白质浓缩纯化的负担,这在工业生产中尤为明显。因此,不再对更大液料比进行试验探究,选择液料比40∶1为响应面试验的中心点。
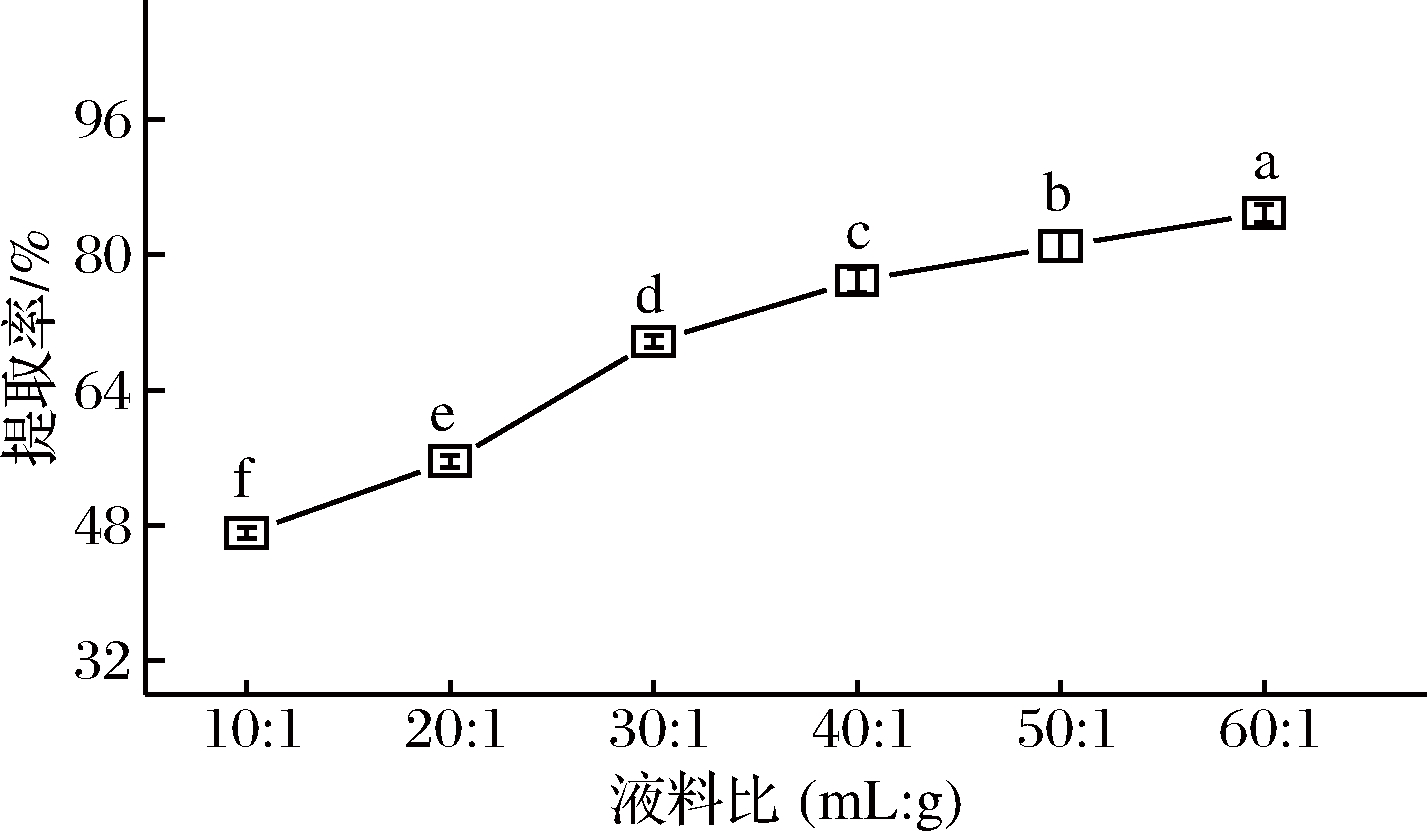
图2 液料比对辣木籽蛋白质提取率的影响
Fig.2 Effect of the liquid-solid ratio on the extractability
of protein from the defatted Moringa oleifera seed flour
2.1.3 NaCl浓度对辣木籽蛋白质提取率的影响
在液料比为40∶1,pH为6.00,提取温度为40 ℃,提取时间15 min,提取功率为120 W,提取2次的条件下,NaCl浓度对辣木籽蛋白质提取率的影响如图3所示。当NaCl浓度从0增大至0.250 mol/L时,辣木籽蛋白质的提取率从7.78%迅速增大至70.68%,这表明了辣木籽蛋白质主要为盐溶性蛋白质。当NaCl浓度增加至1.00 mol/L时,蛋白质提取率缓慢增加至最大值(80.80%),这可能由于较低浓度的NaCl溶液(≤1.00 mol/L)中Cl-与蛋白质分子带电基团发生微弱结合,促进了蛋白质溶解于溶剂中。然而,继续增大NaCl浓度至1.75 mol/L时,辣木籽蛋白质提取率显著下降了9.43%,这可能是在高浓度盐溶液中蛋白质发生了盐析作用,降低了辣木籽蛋白质的溶解度。因此,确定提取辣木籽蛋白质最佳NaCl浓度为1.00 mol/L。
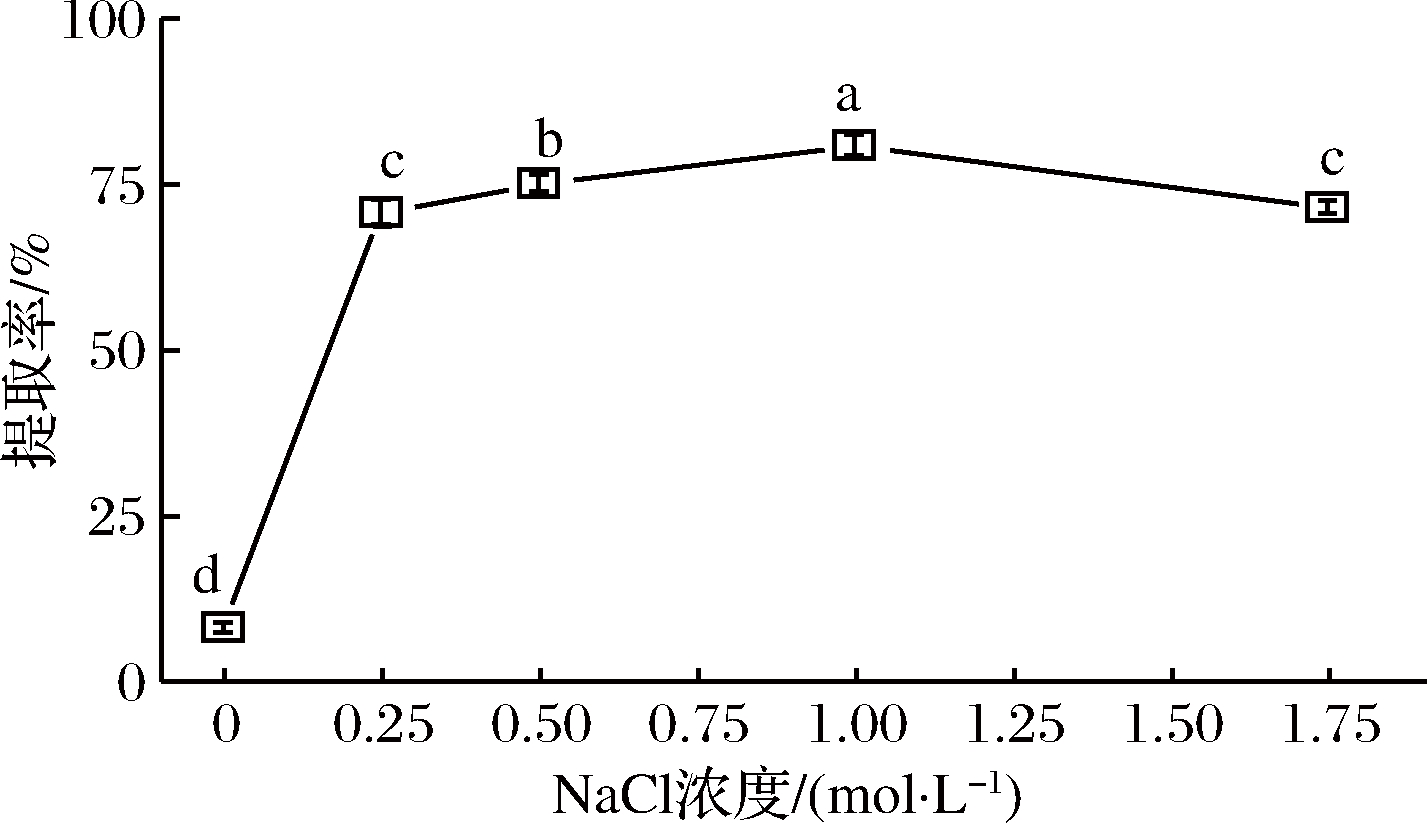
图3 NaCl溶液浓度对辣木籽蛋白质提取率的影响
Fig.3 Effect of NaCl concentration on the extractability of protein from the defatted Moringa oleifera seed flour
2.1.4 pH对辣木籽蛋白质提取率的影响
在液料比为40∶1,提取温度为40 ℃,提取时间为15 min,提取功率为120 W,NaCl浓度为1.00 mol/L,提取2次的条件下,pH对辣木籽蛋白质提取率的影响如图4所示。
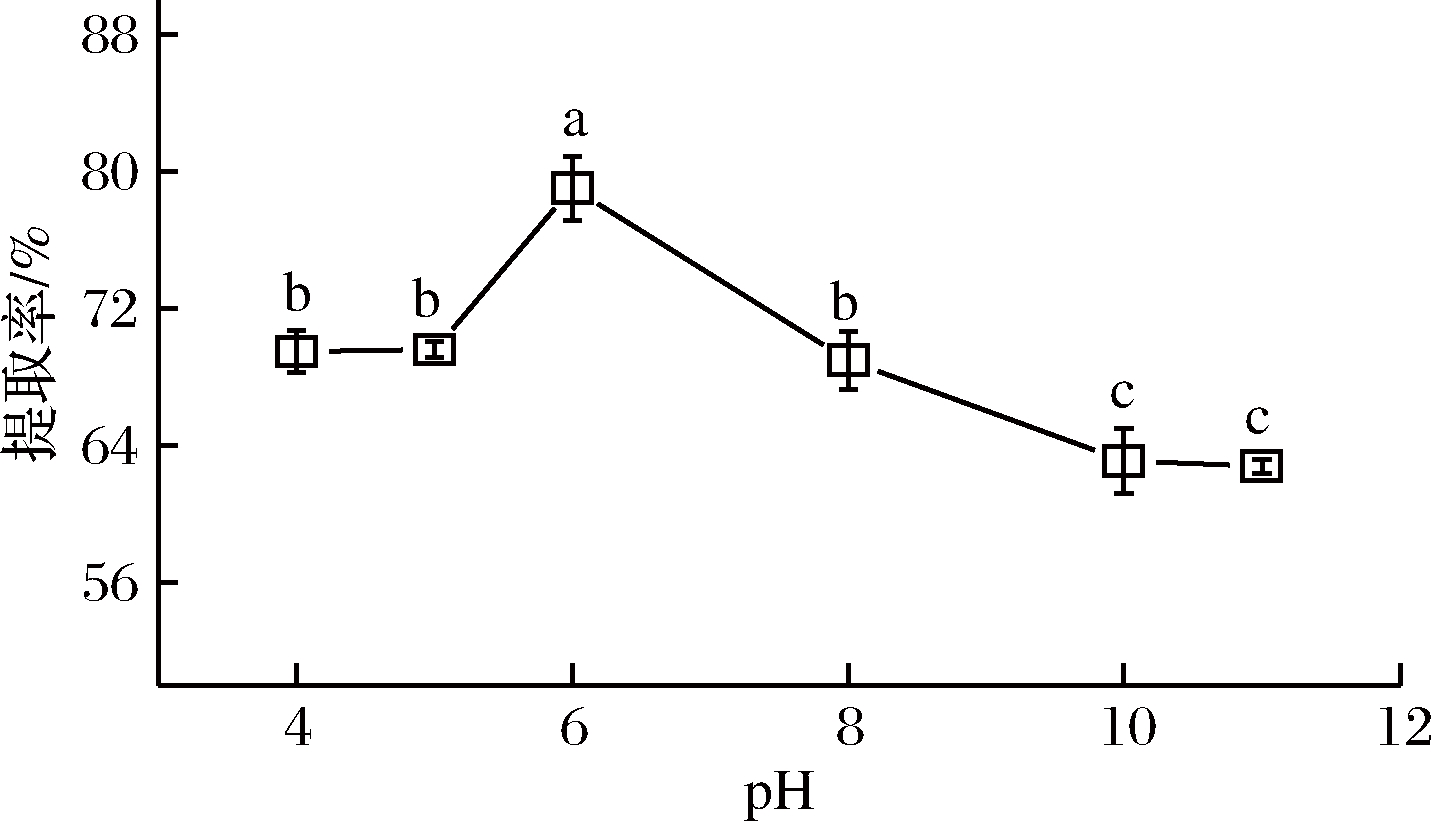
图4 pH对辣木籽蛋白质提取率的影响
Fig.4 Effect of pH on the extractability of protein from the
defatted Moringa oleifera seed flour
辣木籽蛋白质在盐溶体系中性偏酸性条件(pH 6.00)下提取率最高(79.03%),此现象与汪国威等[6]采用水酶法制备辣木籽蛋白质得到最佳pH的结果一致。当提取液的pH大于6.0时,辣木籽蛋白质提取率开始下降,并在pH 10.0和11.0时,蛋白质提取率最低(63.09%和62.79%),这与大多数植物蛋白质在弱碱性(pH 7.50~9.00)条件下随着碱性增强提取率增大的现象[21-22]相反,反映了辣木籽蛋白质中含有较多的碱性蛋白质。在pH为11.00时,提取液开始有腥味产生,这可能是在此强碱性环境下,蛋白质小部分水解产生氨基酸。因此,确定提取辣木籽蛋白质的最佳pH为6.00。
2.1.5 提取时间对辣木籽蛋白质提取率的影响
在液料比为40∶1(mL∶g),pH为6.00,提取温度为40 ℃,提取功率为120 W,NaCl浓度为1.00 mol/L,提取2次的条件下,提取时间对辣木籽蛋白质提取率的影响如图5所示。当提取时间由5 min延长至15 min时,辣木籽蛋白质的提取率由75.63%显著提高至79.04%。这可能是因为辣木籽粉末的溶胀需要一定时间,充分溶胀更有利于蛋白质的溶解[23]。然而,当提取时间延长至20 min时,蛋白质提取率呈现下降趋势,但降低不显著(P>0.05)。这可能是因为蛋白质的空间结构在长时间超声波的空化效应下会被破坏而发生变性沉淀,离心过滤时被去除,所以测出上清液中蛋白质含量偏低[24]。因此,确定提取辣木籽蛋白质的最佳时间为15 min。
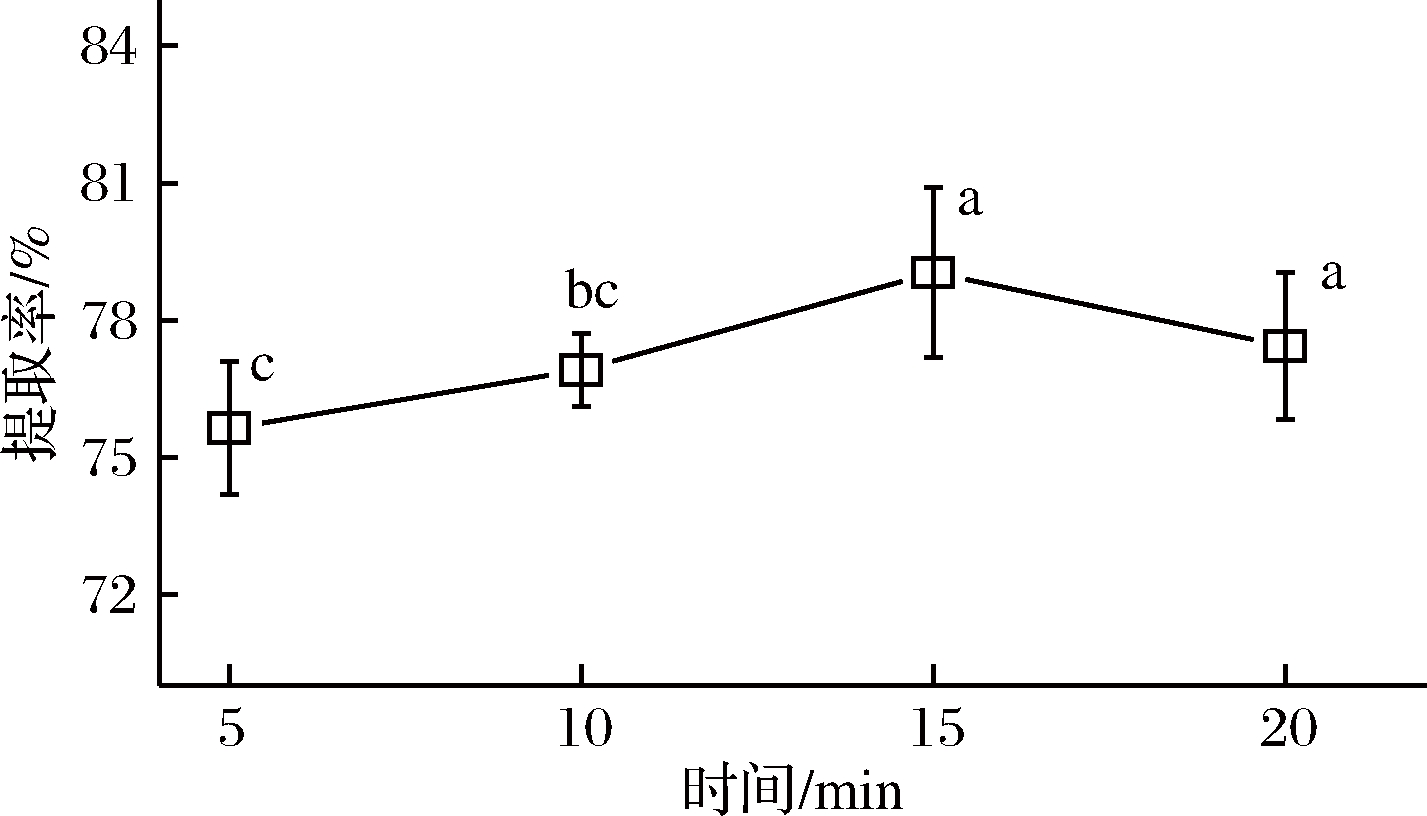
图5 提取时间对辣木籽蛋白质提取率的影响
Fig.5 Effect of extraction time on the extractability of protein from the defatted Moringa oleifera seed flour
2.2 响应面试验结果与分析
考虑到不同因素之间可能存在协同交互作用,因此基于单因素试验选择NaCl浓度、液料比和pH作为Box-Behnken响应面设计的变量,以蛋白质提取率作为响应值进行试验,结果见表2。通过对表2的数据分析计算各项回归系数,建立了以蛋白质提取率(Y)对液料比(A)、NaCl溶液浓度(B)和pH(C)二次回归模型:Y=79.28+9.70A+0.83B+1.29C+0.42AB-1.54AC-1.30BC+0.048A2-5.50B2-7.01C2。
对回归模型进行方差分析,结果见表3。回归模型F=58.30,P<0.000 1,说明回归模型具有高度显著性,表明试验设计可靠。失拟项F=5.72,P=0.063 5>0.05,说明回归模型失拟项不显著,试验点均能用模型描述。模型相关系数R2=0.986 8,说明模型的拟合度较好,回归方程是可靠的。决定系数为0.969 9,说明该模型能够解释96.99%响应值的变化,可以对辣木籽蛋白质提取率进行分析预测。从回归模型显著性系数检验可以看出模型一次项A、二次项B2和C2极显著(P<0.01),一次项C显著(0.01<P<0.05),说明液料比、pH对蛋白质提取率有重要影响,并且这种影响不是简单的线性关系。一次项B、二次项A2、及交互项AB、AC、BC均不显著(P>0.05),说明NaCl浓度对辣木籽蛋白质提取率的影响不大,及各因素之间的交互作用不明显。以此判断出各因素对辣木籽蛋白质提取率的影响程度依次为:液料比>pH>NaCl浓度。
表2 响应面试验设计及结果
Table 2 Box-Behnken experimental design and results
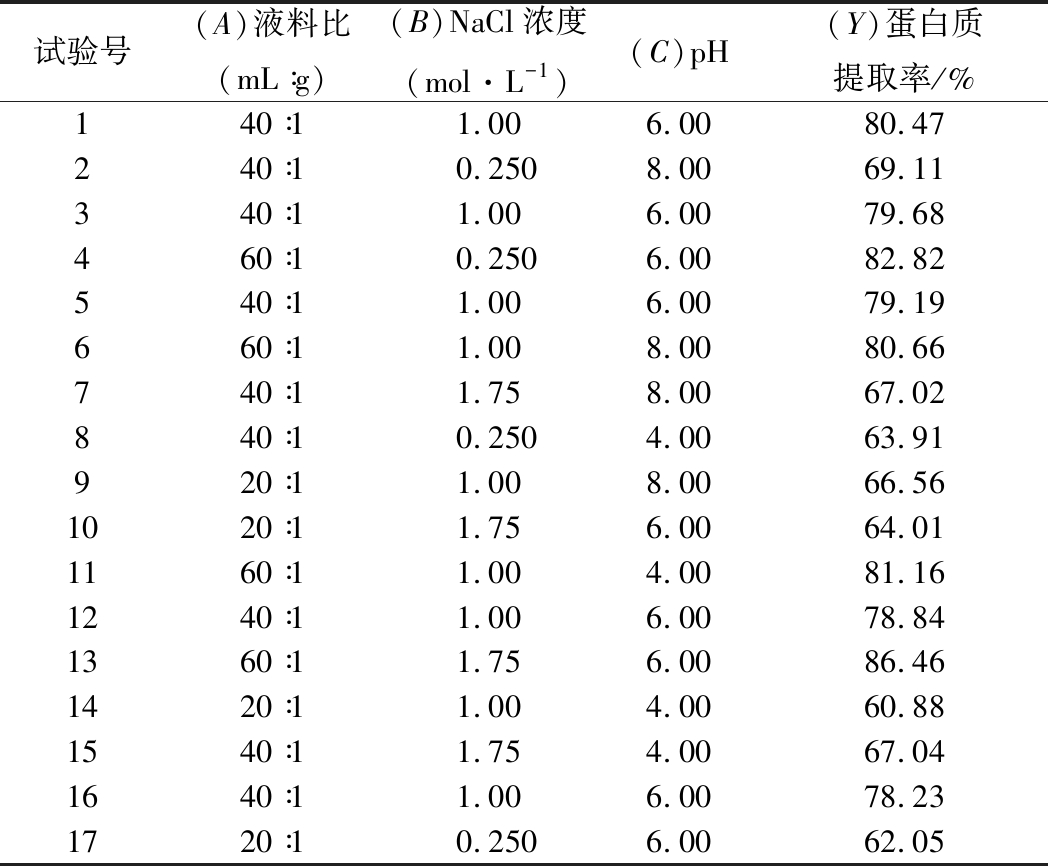
试验号(A)液料比(mL∶g)(B)NaCl浓度(mol·L-1)(C)pH(Y)蛋白质提取率/%140∶11.006.0080.47240∶10.2508.0069.11340∶11.006.0079.68460∶10.2506.0082.82540∶11.006.0079.19660∶11.008.0080.66740∶11.758.0067.02840∶10.2504.0063.91920∶11.008.0066.561020∶11.756.0064.011160∶11.004.0081.161240∶11.006.0078.841360∶11.756.0086.461420∶11.004.0060.881540∶11.754.0067.041640∶11.006.0078.231720∶10.2506.0062.05
因素交互作用对辣木籽蛋白质提取率影响的等高线与响应面图如图6所示。曲面越陡峭说明该因素对辣木籽蛋白质提取率的影响越显著[25]。由图6-a可知,pH为6.00时,相对于NaCl浓度的变化曲面,液料比的变化曲面更陡峭,说明了液料比对辣木籽蛋白质提取率的影响比NaCl浓度影响更显著,这与方差分析的结果(表3)一致。由图6-b可知,当NaCl浓度为1.00 mol/L时,与液料比的变化曲面相比,pH的变化曲面更平缓,说明液料比较pH对辣木籽蛋白质提取率的影响更显著,这与方差分析结果(表3)一致;在pH 4.00~6.00范围内液料比的响应曲面比pH 6.00~8.00的范围内液料比的响应曲面更陡峭,说明在pH 4.00~6.00范围内,液料比对辣木籽蛋白质提取率的影响更为明显。等高线图可以看出两因素间交互作用的显著程度,等高线呈圆形表示两因素间交互作用不显著,呈椭圆形则表明两因素间交互作用显著[26]。
由图6-c可知,液料比为40∶1时,pH与NaCl溶液浓度的等高线呈圆形,说明pH与NaCl浓度间交互作用不显著,这与方差分析的结果(表3)一致。
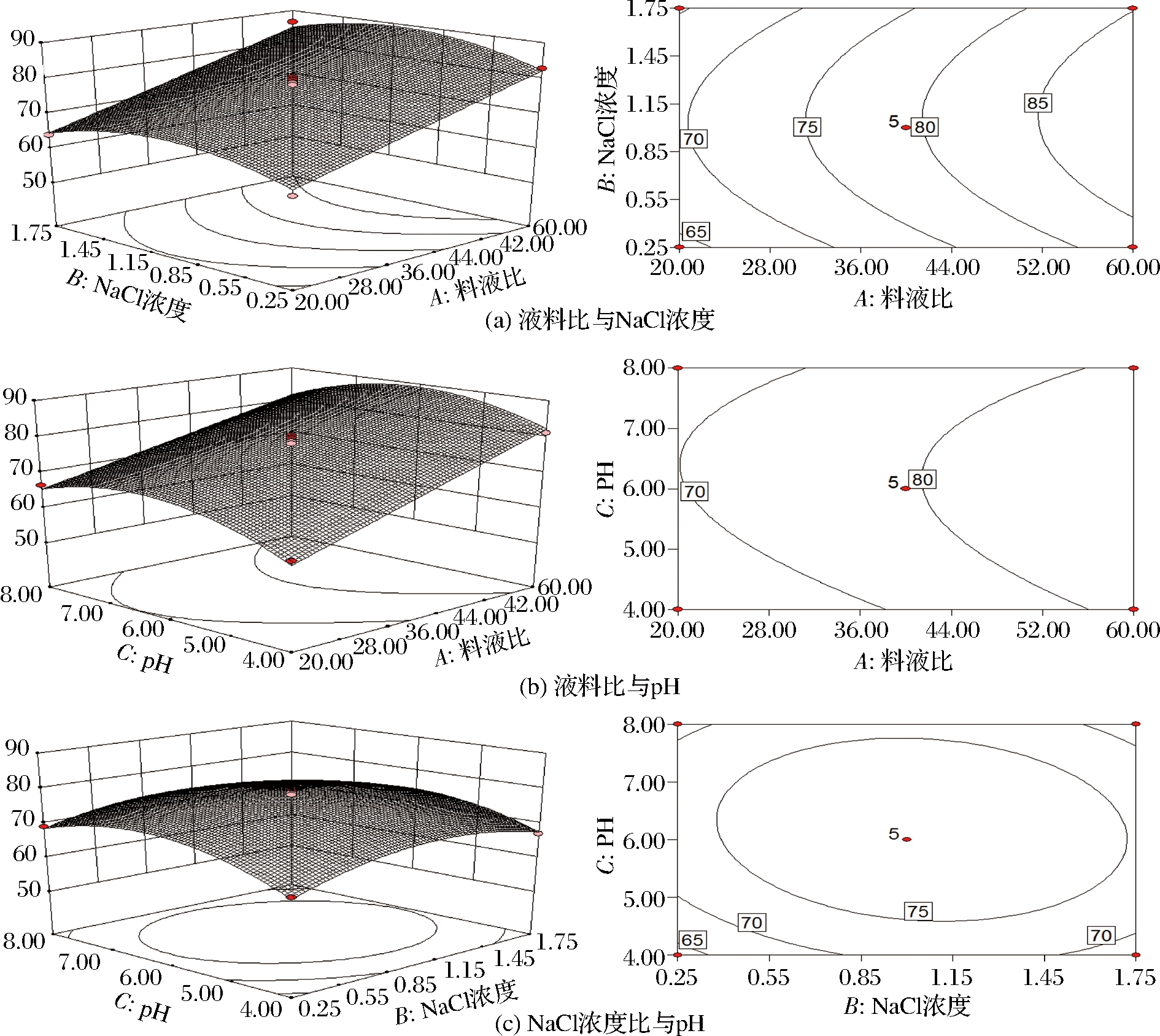
图6 因素交互作用对辣木籽蛋白提取率的等高线和
响应面图
Fig.6 Contour plots and response surface for the effect
of operating parameters on the extractability of protein from
the defatted Moringa oleifera seed flour
2.3 验证试验
根据软件分析情况与实际操作情况确定最终优化反应条件如下:NaCl浓度为1.10 mol/L,pH为6.30,液料比为60∶1,超声功率和超声时间分别为120 W和15 min,重复提取2次。为检验回归模型方程的可靠性,用上述优化条件进行验证试验。验证得该条件下辣木籽蛋白质的提取率为88.09%,与预测值88.89%间的相对误差为0.90%,说明由响应面法得到辣木籽蛋白质最佳提取工艺是可行的。
2.4 蛋白质的纯化
NaCl浓度对辣木籽蛋白质的沉淀率及纯度的影响如表4所示。盐析体系中NaCl浓度从2.56 mol/L增大到4.27 mol/L时,蛋白质沉淀率提高了29.31%,且蛋白质纯度均高达90.00%以上。在NaCl浓度为4.27 mol/L时,蛋白质沉淀率最大(86.80%),该条件下所得的冻干粉中蛋白质纯度为96.22%,这说明4.27 mol/L的NaCl能沉淀上清液中的大部分蛋白质,并且得到的辣木籽蛋白质纯度较高。
表3 回归模型方差分析表
Table 3 Variance analysis of regression equation
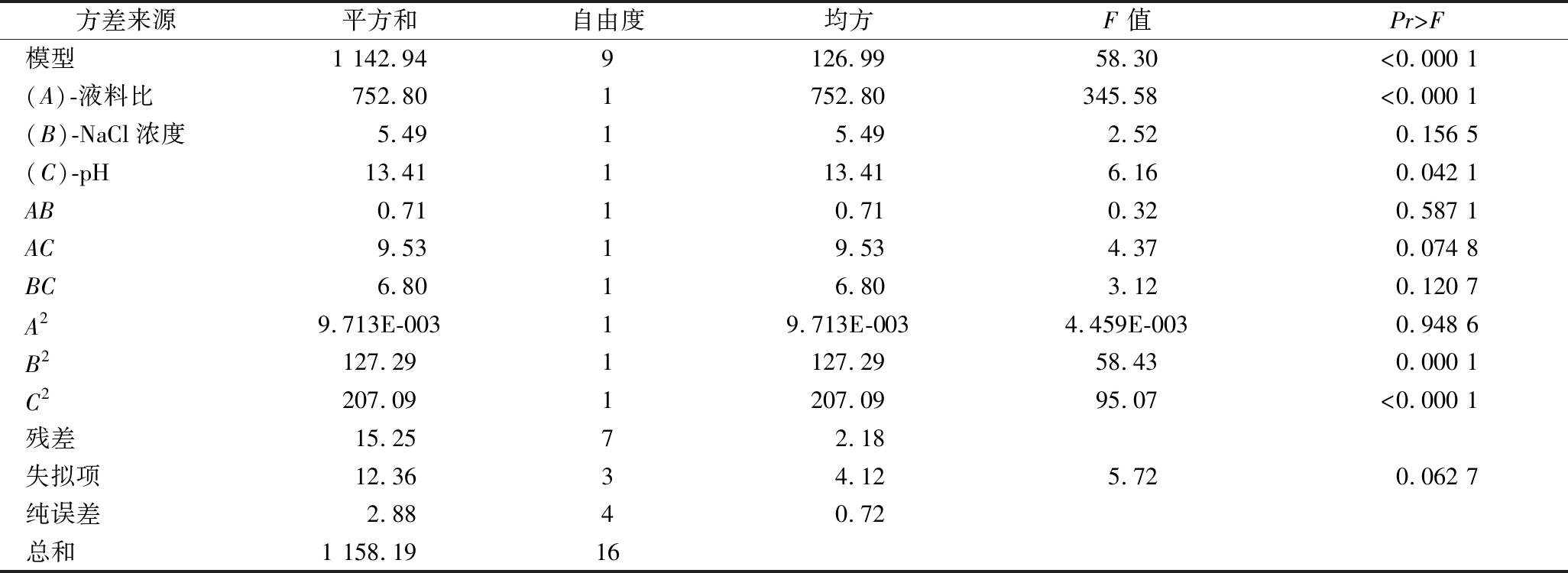
方差来源平方和自由度均方F 值Pr>F模型1 142.949126.9958.30<0.000 1(A)-液料比752.801752.80345.58<0.000 1(B)-NaCl浓度5.4915.492.520.156 5(C)-pH13.41113.416.160.042 1AB0.7110.710.320.587 1AC9.5319.534.370.074 8BC6.8016.803.120.120 7A29.713E-00319.713E-0034.459E-0030.948 6B2127.291127.2958.430.000 1C2207.091207.0995.07<0.000 1残差15.2572.18失拟项12.3634.125.720.062 7纯误差2.8840.72总和1 158.1916
表4 NaCl浓度对辣木籽蛋白质沉淀率及纯度的影响
Table 4 Effect of NaCl concentration on the precipitation
rate and purity of Moringa oleifera protein

NaCl浓度/(mol·L-1)沉淀率/%纯度/%2.5657.49±1.28c90.07±0.59b3.4271.92±0.34b93.20±1.90ab4.2786.80±0.54a96.22±0.77a
3 结论
采用超声辅助法提取辣木籽蛋白质,单因素试验结果显示辣木籽蛋白质主要为盐溶蛋白质,且在弱酸性(pH 6.00)条件下更容易被提取。通过响应面分析得到各因素对辣木籽蛋白质提取率的影响作用依次为:液料比>pH>NaCl浓度。在超声功率为120 W、超声时间为15 min时,液料比为60∶1(mL∶g)、pH为6.30、NaCl浓度为1.10 mol/L条件下重复提取2次,辣木籽蛋白质的最高提取率可达88.09%。将此条件下所得的上清液在pH为10.00,NaCl浓度为4.27 mol/L的盐析体系下进行盐析,沉淀率达86.80%,透析纯化后蛋白质纯度为96.22%。这一系列试验均表明超声波辅助提取法能够提高辣木籽蛋白质的提取效率。
[1] 许敏, 赵三军,宋晖,等. 辣木的研究进展[J]. 食品科学, 2016, 37(23):291-301.
[2] GOPALAKRISHNAN L, DORIYA K, KUMAR D S. Moringa oleifera: A review on nutritive importance and its medicinal application[J]. Food Science and Human Wellness, 2016, 5(2):49-56.
[3] ZHONG Jinfeng, WANG Yonghua, YANG Rong, et al. The application of ultrasound and microwave to increase oil extraction from Moringa oleifera seeds[J]. Industrial Crops and Products, 2018, 120:1-10.
[4] OLIVEIRA J T A, SILVEIRA S B, VASCONCELOS I M, et al. Compositional and nutritional attributes of seeds from the multiple purpose tree Moringa oleifera Lamarck[J]. Journal of the Science of Food and Agriculture, 1999, 79(6):815-820.
[5] CARVALHO M S, ALVES B R R, SILVA M F, et al. CaCl2 applied to the extraction of Moringa oleifera seeds and the use for Microcystis aeruginosa removal[J]. Chemical Engineering Journal, 2016, 304:469-475.
[6] 汪国威, 李明祥,蒋璐,等. 水酶法同时制备辣木籽油和水解蛋白的工艺研究[J]. 食品工业, 2018, 39(1):105-108.
[7] 刘华勇. 水酶法同时提取辣木籽油和抗氧化肽的研究[D]. 广州:华南理工大学, 2016.
[8] 赵翊君, 刘华勇,陈森林,等. 辣木籽酶解产物的蛋白回收率及DPPH·清除能力的研究[J]. 现代食品科技, 2017, 33(12):77-83.
[9] SINGH G R S, OGUNSINA B S, RADHA C. Protein extractability from defatted Moringa oleifera lam seeds flour[J]. Ife Journal of Science, 2011, 13(1):121-127.
[10] PREECE K E, HOOSHYAR N, KRIJGSMAN A J, et al. Pilot-scale ultrasound-assisted extraction of protein from soybean processing materials shows it is not recommended for industrial usage[J]. Journal of Food Engineering, 2017, 206:1-12.
[11] JIANG Lianzhou, WANG Jing, LI Yang, et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J]. Food Research International, 2014, 62:595-601.
[12] RODR GUEZ-PÉREZ C, QUIRANTES-PINÉ R, FERNáNDEZ-GUTIÉRREZ A, et al. Optimization of extraction method to obtain a phenolic compounds-rich extract from Moringa oleifera lam leaves[J]. Industrial Crops and Products, 2015, 66:246-254.
GUEZ-PÉREZ C, QUIRANTES-PINÉ R, FERNáNDEZ-GUTIÉRREZ A, et al. Optimization of extraction method to obtain a phenolic compounds-rich extract from Moringa oleifera lam leaves[J]. Industrial Crops and Products, 2015, 66:246-254.
[13] 岳秀洁, 李超,扶雄. 超声提取辣木叶黄酮优化及其抗氧化活性[J]. 食品工业科技, 2016, 37(1):226-231.
[14] 吕晓亚, 白新鹏,伍曾利,等. 辣木叶水溶性蛋白的超声-微波萃取及其性质研究[J]. 食品工业科技, 2016, 37(5):212-216;221.
[15] 中华人民共和国国家卫生和计划生育委员会国家食品药品监督管理总局. GB 5009.5—2016. 食品中蛋白质的测定[S]. 北京:中国标准出版社, 2016.
[16] 中华人民共和国国家质量监督检验检疫总局. SN/T 3926—2014. 出口乳、蛋、豆类食品中蛋白质含量的测定考马斯亮蓝法[S]. 北京:中国标准出版社, 2014.
[17] 高艳秀, 陈复生,布冠好,等. 超声波辅助SDS反胶束前萃花生蛋白研究[J]. 粮食与油脂, 2012, 25(7):15-19.
[18] 李盼盼, 董海洲,刘传富,等. 超声波辅助提取银杏蛋白工艺条件的优化[J]. 中国食品学报, 2012, 12(6):88-95.
[19] 郭雄, 彭吟雪,何东平,等. 超声波辅助提取橡胶籽粕中粗蛋白的研究[J]. 粮食与油脂, 2017, 30(8):55-60.
[20] 赵玉红, 林洋,张智,王振宇. 碱溶酸沉法提取黑木耳蛋白质研究[J]. 食品研究与开发, 2016, 37(16):32-36.
[21] CUI Qiaoyun, NI Xinghong, ZENG Liang, et al. Optimization of protein extraction and decoloration conditions for tea residues[J]. Horticultural Plant Journal, 2017, 3(4):172-176.
[22] FIRATLIGIL-DURMUS E, EVRANUZ O. Response surface methodology for protein extraction optimization of red pepper seed (Capsicum frutescens)[J]. LWT-Food Science and Technology, 2010, 43(2):226-231.
[23] 刘柏华, 殷钟意,郑旭煦,等. 超声波对牡丹籽粕蛋白质碱提取工艺及氨基酸组成的影响[J]. 食品与发酵工业, 2015, 41(9):215-219.
[24] 饶胜其, 臧祥玉,濮瑜雯,等. 响应面试验优化广昌白莲蛋白提取工艺及其酶解多肽抗氧化活性[J]. 食品科学, 2015, 36(24):63-69.
[25] 陈红梅, 谢翎. 响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J]. 食品科学, 2016, 37(2):45-50.
[26] KUI Zhong, WANG Qiang. Optimization of ultrasonic extraction of polysaccharides from dried longan pulp using response surface methodology[J]. Carbohydrate Polymers, 2010, 80(1):19-25.