假芝(Amauroderma rugosum)属灵芝科、假芝属,主要分布在海南省、广西壮族自治区、广东省、云南省和贵州省等热带和亚热带地区,其子实体受伤后会呈红色伤变,故又叫血芝,据文献报道假芝属共有22个种[1]。假芝属中的皱盖假芝(A. rude)、厦门假芝(A. amoiensis)和假芝(A. rugosum)经现代医学研究表明具有抗肿瘤、抗氧化、抗炎和保肝护肝等功效,其活性成分有多糖、三萜酸、甾醇类、生物碱、有机酸、长链烷烃和酚类等[2-5]。
灵芝多糖是灵芝水提物的主要活性成分,被认为具有“生物反应调节剂”(biological modifier,BRM)的作用,是一种优良的抗氧化活性物质[6],真菌多糖的活性与多糖的溶解度、黏度、分子量、糖苷键类型、单糖组成及摩尔比、支化度和重复单元数量等相关。高级结构指多糖的空间结构,如糖链间的氢键和支链间以非共价键形成的复杂空间构象,目前研究比较困难;初级结构可采用现代光谱手段进行分析,多糖糖苷键主要有α和β构型,相对分子质量从几万到几百万不等,单糖主要有葡萄糖、半乳糖、甘露糖、阿拉伯糖、鼠李糖等,支链的连接方式复杂,这些结构表征被认为与多糖的生物活性有密切关系[7]。近年来,假芝子实体的人工栽培已有报道[8],但对其多糖的结构特征和活性研究鲜有报道,了解假芝多糖的初级结构对深入研究其活性是重要的基础工作。
本研究对产自贵州的野生假芝(A.rugosum)进行了菌丝体的分离和纯化,深层发酵后收集菌丝体,热水浸提多糖,采取红外、气相色谱-质谱、核磁、高效液相凝胶等技术对多糖的结构进行了全面的分析,并对粗多糖和精制多糖的抗氧化活性进行了对比研究,以期促进假芝多糖的深入开发利用。
1 材料与方法
1.1 材料
野生假芝,采集自贵州省册亨县(命名为CHJZ),海拔约879 m处的野生板栗树下,子实体样品及分离纯化菌丝保存于广西民族大学天然产物研究实验室。
1.2 实验试剂
氯化717阴离子交换树脂,索莱宝公司;DEAE-纤维素52、Sephadex G-100,上海瑞永生物科技公司;DPPH和ABTs等抗氧化试剂,麦克林试剂公司;多糖分子量和单糖摩尔比标准品:Dextran,鼠李糖、葡萄糖、木糖、半乳糖、阿拉伯糖、甘露糖(AR),Sigma公司;硫酸、蒽酮、葡萄糖(AR)等,国药集团化学试剂有限公司。
1.3 仪器和设备
旋转蒸发仪RE52-2型,上海亚荣生化仪器公司;安捷伦1200高效液相色谱仪、自动进样器、G1352A RID检测器、安捷伦7890A-5975C 气相色谱-质谱联用仪、DB-5色谱柱(30 m×0.25 mm×0.25 μm)和质谱检测器,安捷伦科技有限公司;真空冷冻干燥机LGJ-10,北京松源华兴科技有限公司;VERTEX 70傅里叶变换显微红外/拉曼光谱仪,德国Bruker公司;ThermoScientific Multiskan FC酶标仪,美国赛默飞公司。
1.4 实验方法
1.4.1 菌丝体分离和分子生物学鉴定
将新鲜子实体分别用无菌水、75%体积分数酒精清洗,用无菌解剖针在超净工作台取菌盖与菌柄中间米粒大小菌肉放置于PDA平板中,26℃恒温静置培养7 d,待长出白色菌丝体,按改良CTAB法提取菌株总DNA[9],通用引物ITS1和ITS4扩增其ITS序列,将ITS产物送深圳华大基因双向测序,将测序结果在GenBank里检索Blast N,并将ITS序列提交GenBank获取登录号。
1.4.2 菌丝体粗多糖的提取
菌丝以10%的量接种于马铃薯葡萄糖液体培养基中,26 ℃,静置培养20 d,取出菌丝体用ddH2O冲洗、烘干后磨成粉待用。取5 g干菌粉以料液比1∶20的比例加入蒸馏水,沸水提取1 h,抽滤,重复1次。合并提取液加入无水乙醇,终浓度调整到75%,4 ℃冰箱过夜沉淀,离心、弃上清经干燥得粗多糖。
1.4.3 精制多糖的分离和纯化
粗多糖复溶于水,采用717阴离子交换树脂脱色,sevage法V(氯仿)∶V(正丁醇)=4∶1脱蛋白,装DEAE-52纤维素柱,用不同浓度的NaCl溶液(0.05、0.1、0.2和0.3 mol/L)洗脱,以洗脱管数为横坐标,蒽酮-硫酸法测定多糖吸光度值为纵坐标,在Excel 2010中作图,收集吸光度值高的均一组分多糖用Sephadex G-100进一步纯化,3 500 Mw的透析袋除盐后经低温冷冻干燥,得精制多糖。
1.4.4 红外和核磁检测
干燥的精制多糖用常规方法压片,采用傅里叶变换红外光谱仪扫描分析(扫描范围400~4 000 cm-1);另取精制多糖10 mg溶于0.5 mL D2O中,内标为TMS,进行1H-NMR和13C-NMR扫描。
1.4.5 分子量测定色谱条件
参照文献[10]的方法,略作修改。TSKgel® G5000PWXL凝胶色谱柱,柱温20 ℃,0.002 mol/L NaH2PO4(含质量浓度0.5 g/L NaN3)为流动相,流速0.6 mL/min,进样量20 μL,运行时间90 min,RI检测器检测。
1.4.6 葡聚糖标准曲线及样品测定
分别称取适量的Dextran标准品,将其配制成质量浓度约3 mg/mL的对照品溶液,之后逐一进行HPLC检测,根据标准糖Mw的保留时间(RT)绘制标准曲线,统计线性关系。称取一定量的精制多糖样品,加入流动相,将其配制成质量浓度约为1 mg/mL的溶液,Millipore 0.45 μm水系滤膜过滤,进样检测。
1.4.7 单糖摩尔比色谱条件及组成检测
参照文献[11]的方法,略作修改。以多糖糖醇乙酸酯衍生物的方法对样品的单糖组成和摩尔比进行测定。色谱柱:HP-5 (30 mm×0.25 mm×0.25 μm);检测器:质谱检测器;进样口温度:250 ℃;检测器温度:280 ℃;氦气流速:0.6 mL/min;分流比:20∶1;进样量:5 μL;升温程序:200 ℃保持2 min,以3 ℃/min的速率升至245 ℃,再以10 ℃/min的速率升至270 ℃,保持2 min。
准确称取样品5 mg,以2 mol/L的TFA溶解,99 ℃水解5 h,旋蒸除酸,加入质量浓度40 g/L的硼氢化钠溶液0.5 mL,室温放置1.5 h,滴加乙酸至无气泡产生,反复浓缩除酸。将浓缩至干的样品真空干燥,加吡啶及正丙胺各1 mL,55 ℃水浴30 min,真空干燥,加吡啶及乙酸酐各0.5 mL,95 ℃水浴1 h,氮气吹干,真空干燥后以氯仿溶解,进行GC-MS分析。
1.4.8 抗氧化活性测定
1.4.8.1 总还原力
将抗坏血酸Vc、粗多糖和精制多糖分别配制成质量浓度0.1、0.2、0.4、0.6、0.8和1 mg/mL样品待用,取各样品100 μL,依次加入250 μL的磷酸缓冲液(0.2 mol/L,pH值6.6),质量浓度10 g/L铁氰化钾250 μL,混匀后50 ℃水浴20 min,取出加入体积分数10%三氯乙酸溶液250 μL终止反应,取250 μL上清液加入等体积质量浓度1 g/L氯化铁,混匀后静置10 min,反应结束取200 μL于96孔酶标板中,700 nm处测定吸光度值,记为Ai,以ddH2O为空白对照,记为Aj,重复3次[12]。
总还原力=Ai-Aj
(1)
式中:Ai表示不同样品的吸光度值,Aj表示空白对照的吸光度值。
1.4.8.2 DPPH自由基清除率
将抗坏血酸Vc、粗多糖和精制多糖分别配制成0.1、0.2、0.4、0.6、0.8和1 mg/mL不同质量浓度样品待用,精确配制0.1 mmol/L的DPPH乙醇溶液。取各样品不同浓度样液100 μL加入300 μL的DPPH乙醇溶液,混匀、避光静置30 min,反应结束后,取200 μL上清液在517 nm波长处测定吸光度值,记作Ai(样品吸光度值);取各样品不同浓度样液100 μL,以无水乙醇代替DPPH溶液,同法测定吸光度值,记作Aj(样品本底吸光度值);取100 μL的ddH2O加入300 μL的DPPH溶液,同法测定吸光度值,记作A0(阴性对照),重复3次[13]。
DPPH自由基清除率![]()
(2)
1.4.8.3 ABTs自由基清除率
将抗坏血酸Vc、粗多糖和精制多糖分别配制成0.1、0.2、0.4、0.6、0.8和1 mg/mL不同质量浓度样品待用,配制7 mmol/L的ABTs水溶液和2.45 mol/L的过硫酸钾水溶液,使用时等体积混合,将工作液浓度的吸光度值调整为0.70±0.05(λ=734 nm)。取各样品不同浓度样液100 μL,加入300 μL的ABTs溶液,混匀、避光静置20 min,反应结束后,取200 μL上清液在734 nm波长处测定吸光度值,记作Ai(样品吸光度值);取各样品不同浓度样液100 μL,以ddH2O代替ABTs溶液,同法测定吸光度值,记作Aj(样品本底吸光度值);取100 μL的ddH2O加入300 μL的ABTs溶液,同法测定吸光度值,记作A0(阴性对照),重复3次[14]。
ABTS自由基清除率![]()
(3)
2 结果和分析
2.1 菌株的分子生物学鉴定
测定的ITS序列提交到GenBank, Blast N表明册亨假芝(CHJZ)以100%的支持率与假芝(KJ654362.1)处于同一个分支,分子生物学鉴定结果表明,该菌属于假芝属的假芝(A. rugosum),获基因登录号MG021113。
2.2 菌丝体多糖的纯化
如图1所示,0.05 mol/mL NaCl洗脱后得到均一组分多糖,命名为ARP,收集这一组分的洗脱液,减压浓缩、透析袋(Mw 3500)除盐、冷冻干燥得棕色粗多糖。120 mg粗多糖用ddH2O复溶,过葡聚糖凝胶柱G-100,进一步纯化后,冷冻干燥得到白色精制多糖40 mg。

图1 ARP的DEAE-纤维素52离子交换柱层析洗脱曲线
Fig.1 The profile of DEAE-cellulose 52 ion exchange column chromatography by ARP
2.3 菌丝体多糖ARP的红外图谱
如图2所示,在3 390.08和2 928.92 cm-1附近有较强的多糖吸收峰,分别由—OH和C—H的伸缩振动引起,1 646.61 cm-1处表明含有C![]() O,1 420.49 cm-1和1 372.89 cm-1处分别是糖类C—H和C
O,1 420.49 cm-1和1 372.89 cm-1处分别是糖类C—H和C![]() O的变角振动吸收峰,1 155.70、1 084.29和1 024.79 cm-1处是糖环上的C—O—C和C—O—H伸缩振动吸收峰,表明存在吡喃环。926.56 cm-1和849.72 cm-1附近吸收峰是(1→4)-α-吡喃糖吸收峰,849.72 cm-1是α型吡喃糖环C—H变角振动特征吸收峰[15],在900 cm-1附近处无明显吸收峰,说明ARP无β型糖苷键,765.95 cm-1处的吸收峰主要由吡喃环对称环伸缩振动引起,充分说明多糖中存在吡喃环糖苷键。
O的变角振动吸收峰,1 155.70、1 084.29和1 024.79 cm-1处是糖环上的C—O—C和C—O—H伸缩振动吸收峰,表明存在吡喃环。926.56 cm-1和849.72 cm-1附近吸收峰是(1→4)-α-吡喃糖吸收峰,849.72 cm-1是α型吡喃糖环C—H变角振动特征吸收峰[15],在900 cm-1附近处无明显吸收峰,说明ARP无β型糖苷键,765.95 cm-1处的吸收峰主要由吡喃环对称环伸缩振动引起,充分说明多糖中存在吡喃环糖苷键。
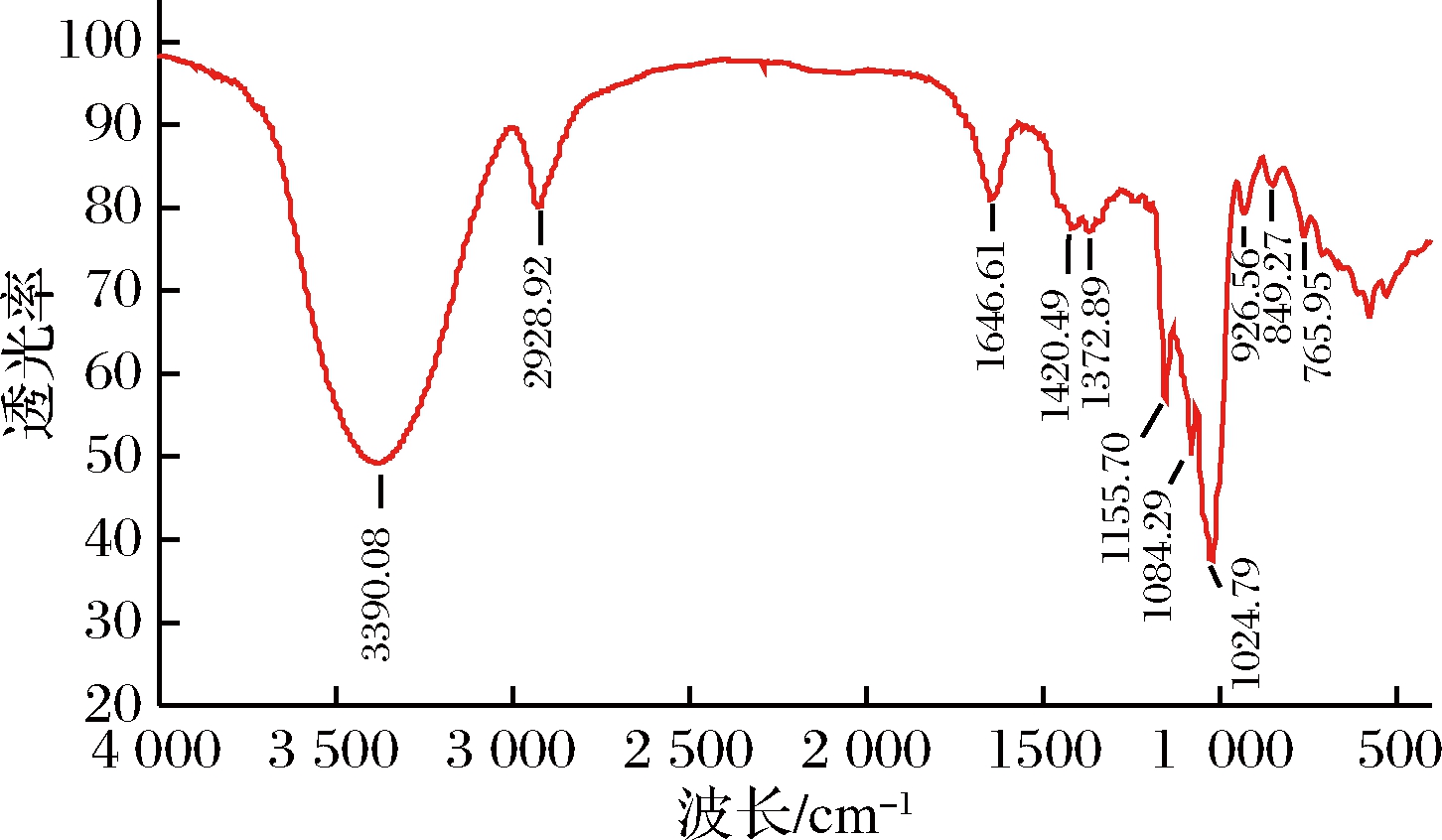
图2 ARP菌丝体多糖的红外图谱
Fig.2 FT-IR spectrum of A.rugosum polysaccharide(ARP)
2.4 假芝菌丝体精制多糖ARP的核磁图谱
核磁分析1H谱和13C谱如图3所示。1H NMR质子信号在δ(3.4~4.1)ppm区间内,是不同糖残基非异头质子的亚甲基和次甲基上的质子共振峰交互重叠产生的多糖信号峰;在异头氢质子区域δ 4.5~δ5.0有3个氢信号,说明有3种单糖,这与ARP的单糖组成分析一致[16];δ 4.65 ppm信号峰为氘代试剂重水质子氢的共振信号峰[17],在δ 5.29 ppm出现信号峰,说明存在α糖苷键,这与红外数据一致。13C NMR信号在异头碳区存在3个δ 102.31、101.32、97.82 ppm峰,说明有3种不同糖基单元的存在,δ102.31 ppm信号属甘露糖,δ101.32 ppm信号属鼠李糖,δ97.82 ppm信号属半乳糖[18-21],这与气相色谱检出ARP单糖组成一致,信号峰在δ 77.36 ppm确证多糖以(1→4)-α-吡喃糖苷键为主链,1H NMR信号δ 1.08 ppm和13C NMR信号δ15.62 ppm说明有(1→6)糖苷键[22],δ15.62 ppm为鼠李糖的C6。
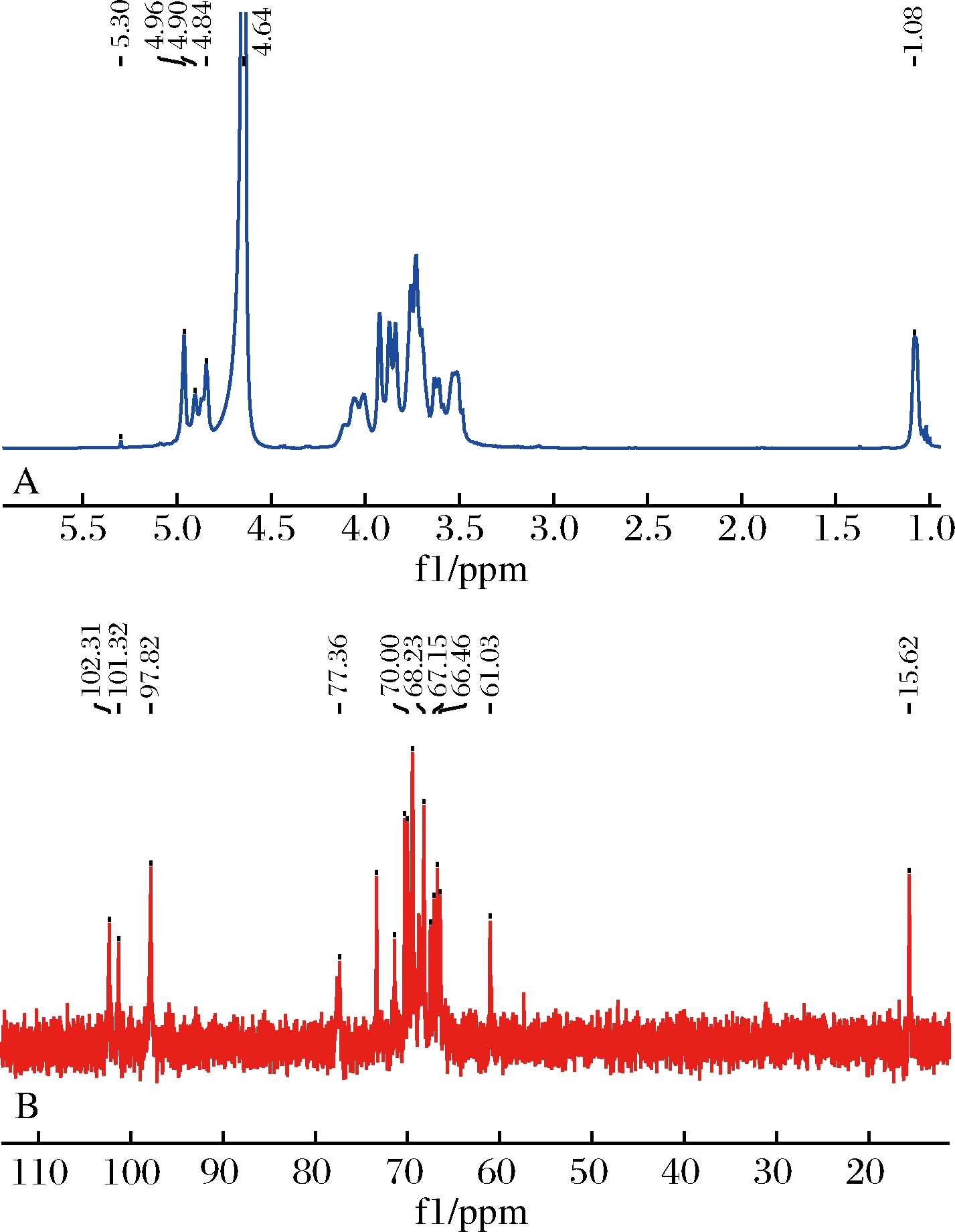
图3 ARP多糖核磁氢谱图(A)和核磁碳谱图(B) Fig.3 1H NMR spectrum(A)and 13C NMR
spectrum(B)of ARP
2.5 假芝菌丝体精制多糖分子量及单糖摩尔比
如图4-A所示,HPLC-GPC呈单一对称峰,保留时间与分子量对数的回归方程为lgMw=-0.42x+10.48,R2=0.998 4,将保留时间t=14.72代入方程,计算得到ARP的平均分子量为1.86×104 Da。
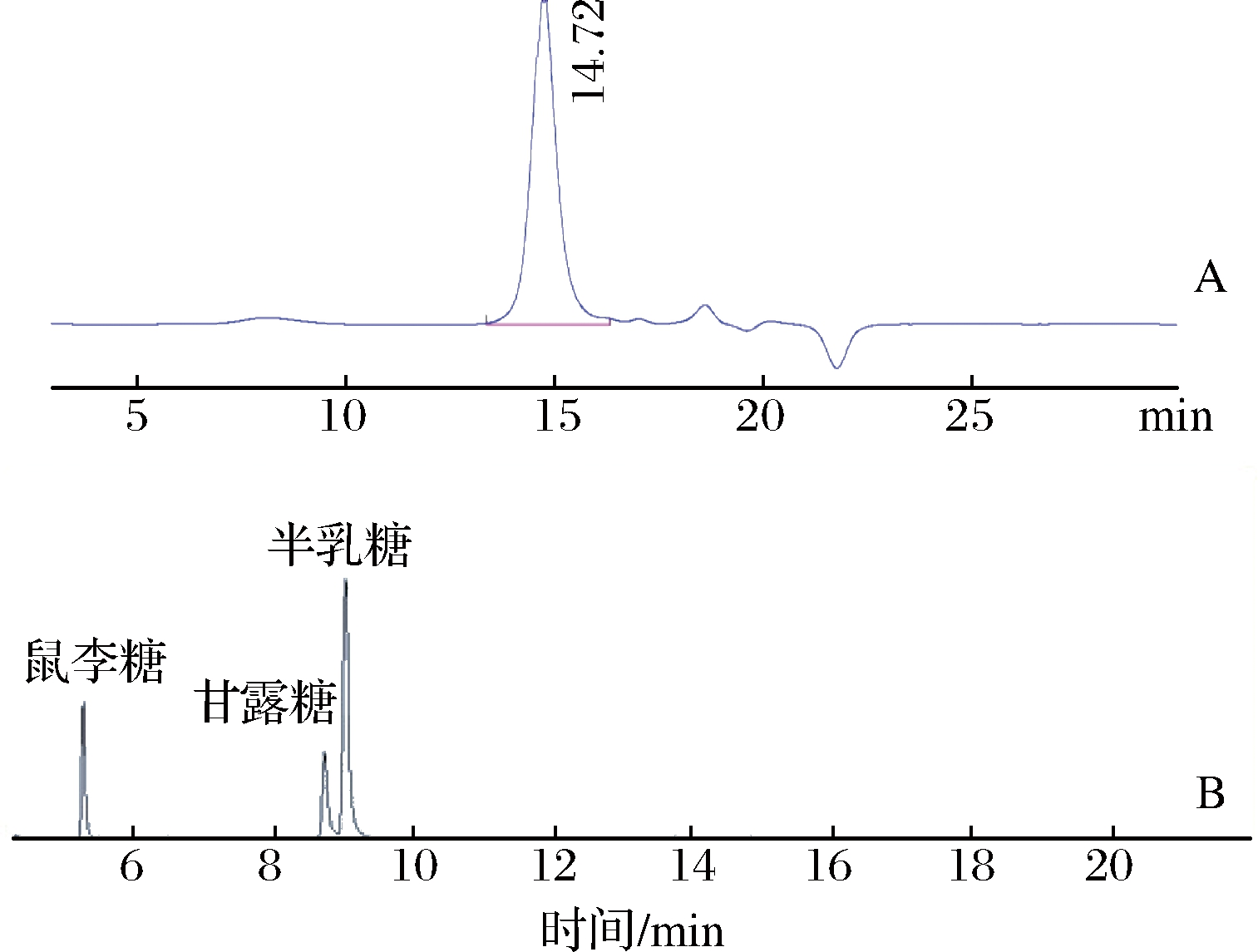
图4 ARP的HPGPC色谱图(A)和ARP的GC-MS
色谱图(B) Fig.4 HPGPC of ARP(A)and GC-MS chromatograph of ARP(B)
如图4-B所示,与标样的保留时间对照后得出ARP含有鼠李糖、甘露糖和半乳糖,3种单糖的摩尔比为1∶1.24∶3.51,ARP是一种以半乳糖为主的多聚糖,一个重复单元约含有21n,鼠李糖、甘露糖及半乳糖的个数分别是4,5和14 n,进一步说明ARP是吡喃糖,其糖苷键为α型,键型为1→4、1→6。
2.6 粗多糖和精制多糖的抗氧化活性比较
2.6.1 总还原力测定
还原能力用于评价抗氧化能力的大小,所测吸光度越大表明该物质抗氧化能力越强。如图5所示,假芝新鲜菌丝体提取的粗多糖和精制后多糖随着质量浓度的增大,吸光度值也增大,吸光度值和质量浓度呈量效关系;在1 mg/mL时,粗多糖的吸光度值是0.70,精制多糖是0.41,粗多糖是精制多糖的1.72倍,粗多糖的吸光度值在假芝菌丝体相同质量浓度下比精制多糖的高,表明粗多糖的抗氧化活性比精制后多糖的活性好。
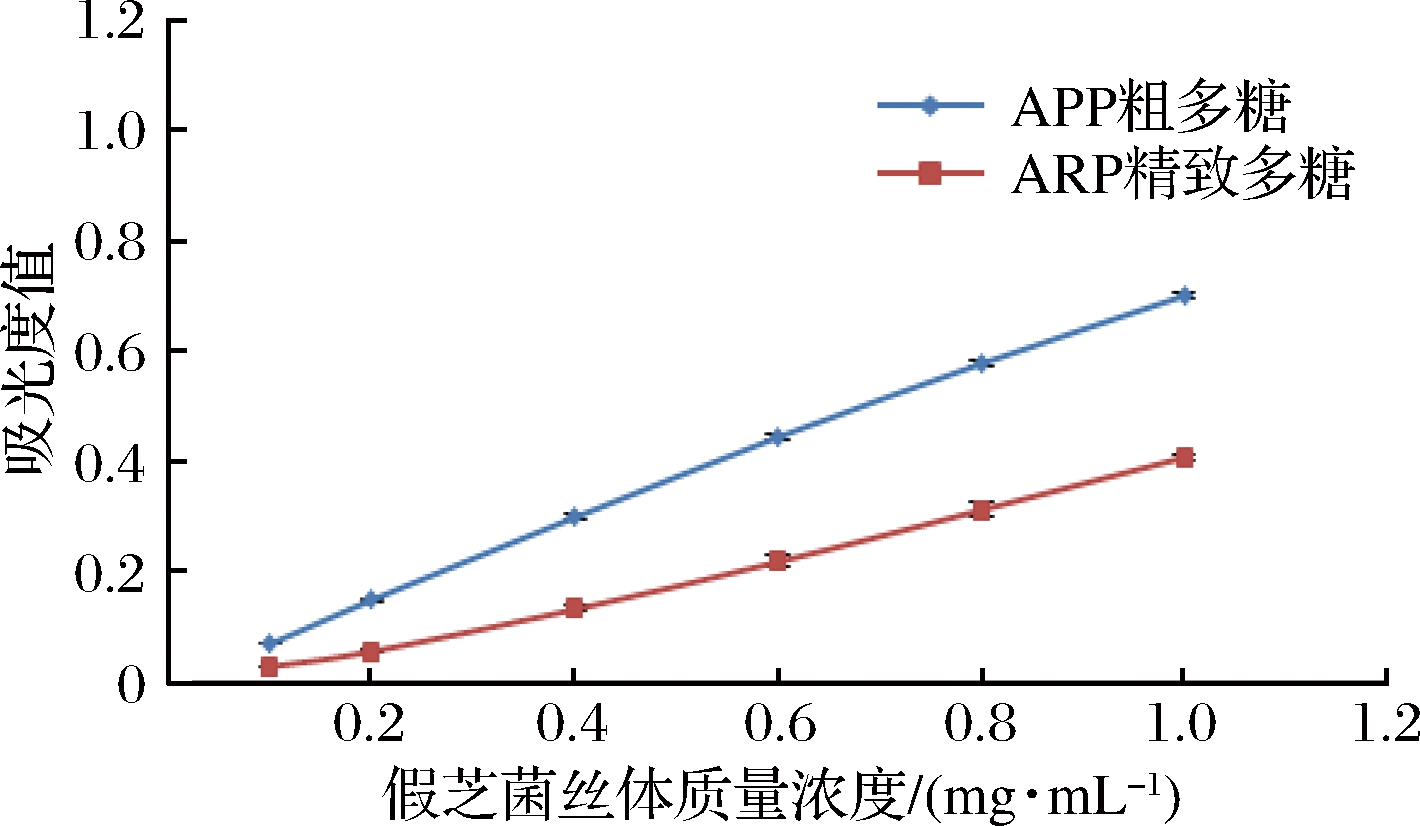
图5 假芝菌丝体粗多糖和精制多糖的总还原力
Fig.5 The total antioxidant capacity of the crude polysac-charide and the fine polysaccharide from strain CHJZ
2.6.2 DPPH抗氧化活性比较
图6所示,假芝菌丝体粗多糖和精制多糖对DPPH自由基清除率均随质量浓度的增加而升高。
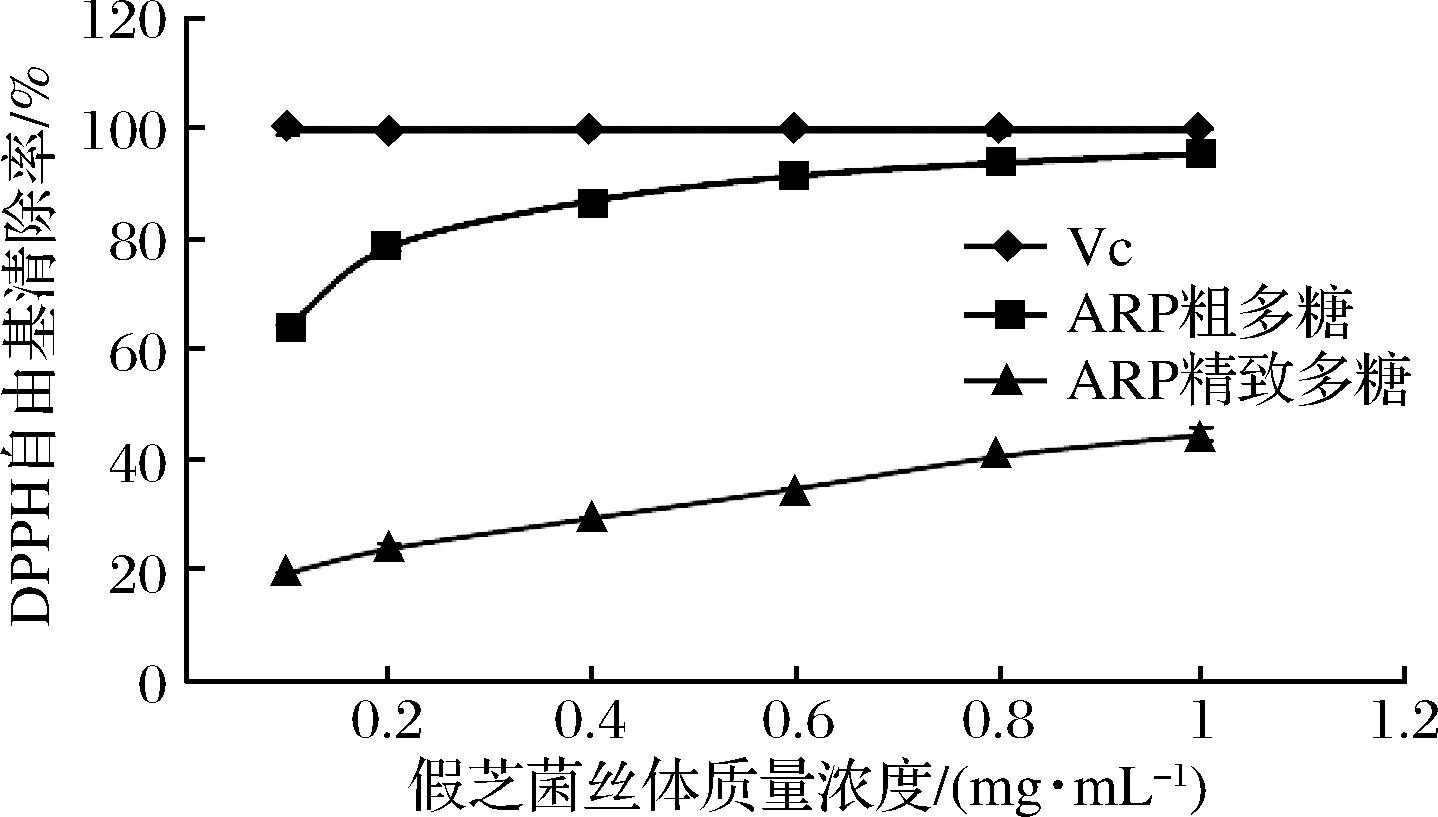
图6 假芝菌丝体粗多糖和精制多糖对DPPH自由基清除能力
Fig.6 The scavenging capacity on DPPH radical of the crude polysaccharide and the fine polysaccharide from strain CHJZ
粗多糖质量浓度在1 mg/mL时,清除率为95.59%,接近于Vc,经各自的拟合曲线计算,粗多糖EC50是0.05 mg/mL,精制多糖EC50是1.15 mg/mL,半浓度值越低,则抗氧化活性越强,表明菌丝粗多糖对DPPH自由基清除效果优于精制多糖。
2.6.3 ABTS自由基清除率测定
如图7所示,假芝菌丝体多糖对ABTS自由基清除率随质量浓度增加而升高,粗多糖的变化明显,在质量浓度0.1~0.4 mg/mL,ABTS自由基清除率上升较快,0.6 mg/mL后放缓,在质量浓度为1 mg/mL时,ABTS自由基清除率接近于Vc。经各自的拟合曲线计算,粗多糖EC50是0.15 mg/mL,精制多糖EC50是1.49 mg/mL,菌丝粗多糖对ABTS自由基清除效果强于精制多糖。
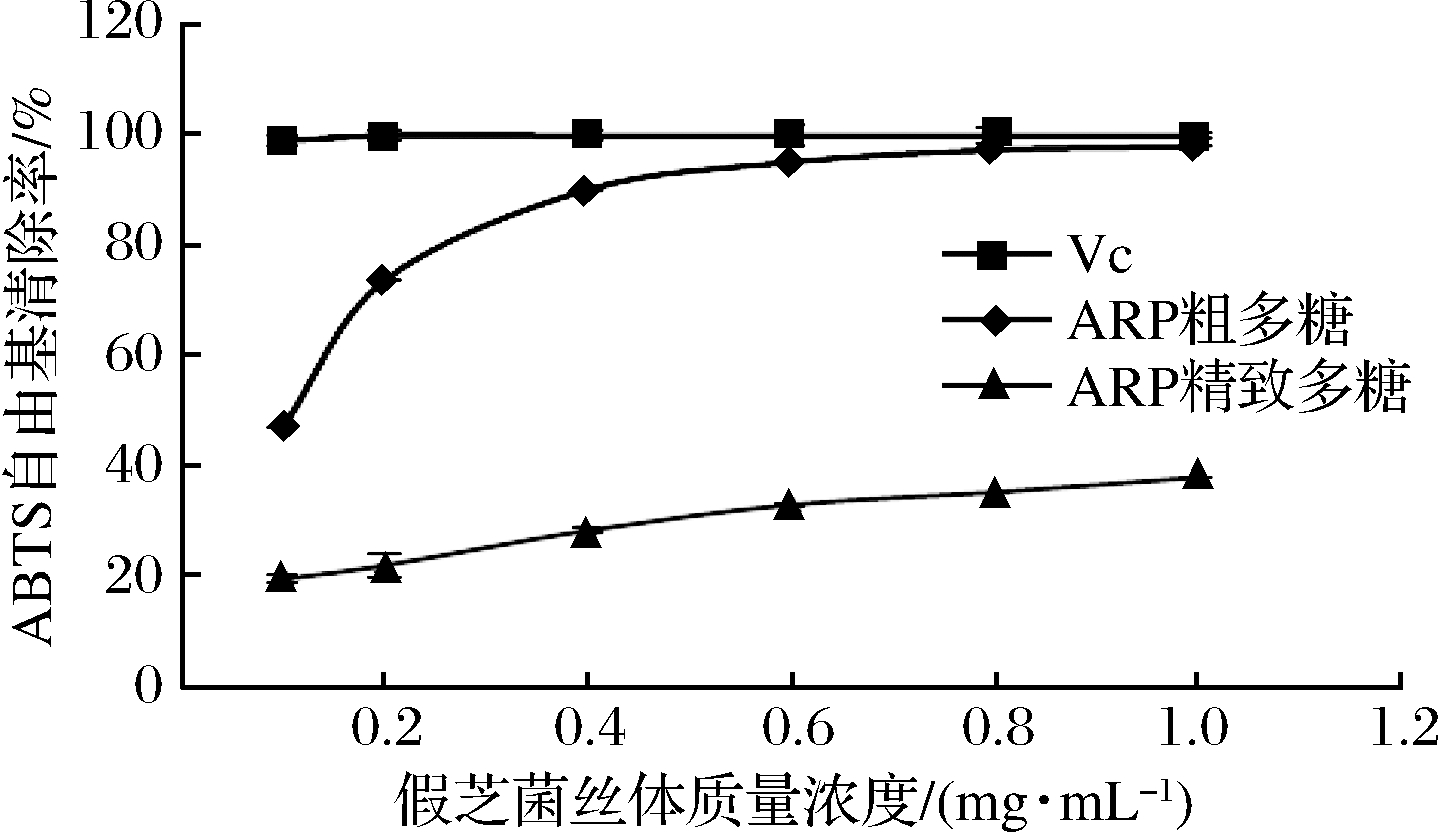
图7 假芝菌丝体粗多糖和精制多糖对ABTS自由基清除能力
Fig.7 The scavenging capacity on ABTS radical of the crude polysaccharide and the fine polysaccharide from strain CHJZ
3 结论与讨论
从野生假芝的深层发酵菌丝体中提取得到胞内多糖,纯化后采用多种色谱手段分析,实验可知ARP含α-糖苷键,键型有1→4,1→6两种,单糖间连接方式是确定多糖一级结构的重要特征;ARP平均分子量为1.86×104 Da,一般认为分子量的大小与多糖活性有关,大分子量多糖和侧链的连接方式对多糖的生物活性有重要的影响,这可确保高级结构的空间构象;ARP单糖组成为鼠李糖、甘露糖和半乳糖,3种单糖的摩尔比为1∶1.24∶3.51,一个重复单元约含有21n个单糖,了解单糖组成有助于对后续分子改性后生物活性的变化进行研究。ARP初级结构的确定,为假芝菌丝体多糖样本库的建立提供了相关数据,也为后续假芝多糖活性与构效关系的深入研究提供参考。
假芝多糖有良好的抗氧化活性,粗多糖具有比精制多糖更好的抗氧化活性,质量浓度为1 mg/mL时,粗多糖总还原力是精制多糖的1.72倍,粗多糖的DPPH和ABTs自由基清除率EC50值均显著小于精制多糖,推测粗多糖中某些小分子物质或多肽可以与多糖起协同作用,有效增强粗多糖的体外抗氧化活性。研究还发现,菌丝越新鲜,提取的多糖抗氧化活性越强,通过对假芝多糖抗氧化活性和初级结构的研究,为进一步全面了解和开发来自假芝的真菌多糖提供了理论依据。
[1] 赵继鼎,张小青.中国真菌志[M].北京:科学出版社,2000:144-148.
[2] 张一帆,谢意珍,杨小兵.假芝功效研究进展[J].食用菌,2018,40(2):1-4.
[3] 谌永蕾,马青云,黄圣卓,等.皱盖假芝子实体的化学成分研究[J].中草药,2016,47(6):881-885.
[4] 黄纪国,韩园园,谢意珍,等.皱盖假芝化学成分分离及其结构鉴定[J].中国食用菌,2016,35(1):42-45.
[5] 张双双. 四种灵芝科真菌和硬柄小皮伞的化学成分及生物活性研究[D].南京:南京农业大学,2015.
[6] 陈爱葵,易广,李爱群.食用菌在提高人体免疫力方面的功效[J].中国食用菌,2004(3):7-9.
[7] 张冬雪,王晓玲,刘高强.灵芝多糖的结构及构效关系[J].食品工业,2015,36(11):258-261.
[8] 肖自添,刘明,何焕清.假芝驯化栽培及其抗氧化活性研究[J].菌物学报,2017,36(3):358-366.
[9] 刘丽,张永军,许长征,等.一种改良的CTAB法提取产多糖真菌DNA[J].中国生物工程杂志,2014,34(5):75-79.
[10] 杨毅,李文燕,郭丽,等.HPGPC联合HPLC-ELSD测定樟芝子实体中多糖分子量、多糖组成和单糖含量[J].中药材,2018(5):1 146-1 148.
[11] 陈传平,吴剑锋,陈乃东.金樱子多糖单糖组成的TMS柱前衍生化/GC-MS研究[J].天然产物研究与开发,2017,29(12):2 063-2 067.
[12] OYAIZU M.Studies on products of browning reactions: antioxidative activities of products of browning reaction prepared from glucosamine[J]. Japanese Journal of Nutrition,1986(44):307-315.
[13] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology, 1995,28(1):25-30.
[14] 钱骅,赵伯涛,陈斌,等.桑黄子实体多糖、黄酮和多酚含量与抗氧化活性相关性[J].食品工业科技,2015,36(12):104-108.
[15] 吴亚林. 几种天然生物活性多糖的化学研究[D].杭州:浙江大学,2007.
[16] 张化朋,张静,南征,等.杏鲍菇多糖WPP2的结构表征及抗肿瘤活性[J].高等学校化学学报,2013,34(10):2 327-2 333.
[17] 宗向坤,朱卫华,赵一洋,等.核磁共振波谱法在双价痢疾多糖结合疫苗中的初步应用[J].中国生物制品学杂志,2015,28(5):531-535.
[18] 王赛贞,丁侃,林树钱,等.赤芝多糖肽GL-PP-3A的分离纯化和结构研究[J].药学学报,2007(10):1 058-1 061.
[19] 牛莉鑫,杨义芳,赵正保.紫芝多糖GS-A-1的结构鉴定与生物活性研究[J].中成药,2012,34(5):968-971.
[20] 崔杰,何正有,毕建军,等.荣保灵芝1号多糖的分离纯化与化学结构初步研究[J].食品科技,2018,43(4):205-211.
[21] 腾海艳,张旭,王博,等.单色云芝多糖的结构研究[J].中国药学杂志,2007(14):1 059-1 062.
[22] 牛莉鑫,杨义芳,赵正保.紫芝多糖GS-A-1的结构鉴定与生物活性研究[J].中成药,2012,34(5):968-971.