白酒糟是白酒生产过程中产生的固体废弃物,我国是白酒生产大国,2015年我国白酒产量达1 312.8万kL,2016年达1 358.4万kL,同比增长3.5%[1]。每生产1 t的白酒,就会产生6~10 t的酒糟[2],按白酒与酒糟1∶8的质量比计算,2016年酒糟达10 000万t。鲜酒糟因其产量大,不易贮藏与运输,目前主要是做废弃物处理或经晾晒后用作粗饲料,但由于价格低廉,经济效益不够明显,造成了资源的巨大浪费和对周围环境的严重污染[3]。酒糟本身由于发酵不完全等原因,仍存有较高的粗纤维、粗灰分、无氮浸出物、粗淀粉、粗蛋白和微量元素等营养物质[4],可广泛应用于饲料、医药、食品等工业[5-7]。而利用酒糟为原料制作生物有机肥,既能解决环保问题,又可为绿色食品的生产提供有机环境,是实现酒糟的大规模资源化利用的有效途径[8-9]。
生物有机肥是指特定功能微生物与以动植物的残骸(如农作物秸秆、家禽粪便等)为主要原料,经过无害化处理达到腐熟的有机物料复合而成的既具有微生物肥效又具有有机肥肥效的新型肥料,它不仅无污染、无公害,而且还适用于发展绿色食品[10]。生物有机肥发酵菌剂多由2种或2种以上的微生物按照一定的比例复合配制而成,在堆肥过程中形成优势菌群,它们之间相互联合协调发挥各自的功能,从而促进堆肥的进程,提高堆肥质量,以实现堆肥快速腐熟的一种微生物菌剂[11]。对新型发酵菌剂的研制主要集中在对农牧业产生的秸秆、粪便和生活有机垃圾等处理方面,以及各种食品生产过程中产生的下脚料处理[12-14]。林金新等[15]以白酒丢糟为主要原料,4种芽孢杆菌、2种霉菌与酿酒酵母为混菌发酵菌株,发酵后腐殖质含量达到17.50%,种子发芽指数(GI)值达到93.2%,E4/E6值为2.19;曹建兰等[14]利用白酒丢糟发酵生产生物有机肥,证明接种功能微生物对酒糟进行二次发酵,生产生物有机肥的方法是可行的,并设计出两步发酵制备酒糟型生物有机肥的新工艺。随着生物技术的快速发展,微生物菌剂因其高效、无污染等优点被越来越多的人关注和使用[16-19]。
高温菌较常温菌具有更高的微生物代谢活性和有机物降解速率[20],在废弃物处理领域具有广泛的应用前景。因此研制高温型菌剂,提高堆肥质量迫在眉睫,而对于高温型生物有机肥复合发酵菌剂的研究目前还少见报道。本试验首先对筛选的高温菌株做拮抗性试验,然后分别制备各菌株的单菌剂,同时结合前期研究的生长特性和降解特性,确定合理的高温菌株复配方案以及复配比例。复配后以一定的接种比例接种到酒糟中进行小规模试验,以堆肥腐熟的各项指标为响应值来确定高温发酵菌剂的最优配比。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
菌种:前期课题组从酱香型白酒糟堆积中分离出来的7株高温优势菌,分别命名为DX[地衣芽孢杆菌(Bacillus licheniformis)]、XX[空气芽孢杆菌(Bacillus aerius)]、DF[产色高温单孢菌(Thermomonospora chromogena)]、M1[微小根毛霉(Rhizomucor pusillus)]、M4[嗜热篮状菌(Talaromyces thermopHilus)]、M5[黑曲霉(Aspergillus niger)]以及M6[肿梗根毛霉(Rhizomucor tauricus)],其中M5和M6的最适生长温度为40 ℃,DX、XX和M1的最适生长温度为45 ℃,M4的最适生长温度为50 ℃,DF的最适生长温度为55 ℃。
可溶性淀粉、NaOH(分析纯),天津市永大化学试剂有限公司;营养琼脂、牛肉膏(BR),北京奥博星生物技术有限责任公司;马铃薯葡萄糖琼脂(PDA)、高氏一号培养基、蛋白胨(BR),上海博微生物科技有限公司;酒糟,取自仁怀市茅台镇某酒厂第7轮次抛糟的酱香型酒糟;生石灰,购于兴安县福阳矿业有限公司;麸皮,过0.9 mm筛,某面粉厂提供。
高氏一号培养基[21];营养琼脂培养基[22];PDA培养基[23]。以上培养基配制好后均调为pH 7.0,121 ℃灭菌20 min。
麸皮固体载体:称取一定量的麸皮,加入60% 的无机盐溶液,均匀搅拌后,静置润料30 min,称取50 g润料完毕的麸皮加入250 mL三角瓶中,包扎,121 ℃灭菌20 min,冷却后打散结块的麸皮以备用。
无机盐溶液:KNO3 1.0 g/L,NaCl 0.5 g/L,K2HPO4·3H2O 0.5 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.01 g/L。
1.1.2 主要仪器设备
ESJ220-4B电子天平,沈阳龙腾电子有限公司;SN-CJ-IF洁净工作台、YXQ-LS-5DS11立式压力蒸汽灭菌器、BSC-150恒温恒湿箱,上海博讯实业有限公司医疗设备厂;DHG-9140B(101-2B)智能型电热恒温鼓风干燥箱、SPX-250B智能型生化培养箱,上海琅玕实验设备有限公司;CH2043微电脑电磁炉,中山市格兰仕生活电器制造有限公司;SHZ-82A恒温振荡器,常州澳华仪器有限公司;HYG-A全温摇瓶柜,金坛市盛蓝仪器制造有限公司。
1.2 试验方法
1.2.1 拮抗性试验
采用平板对峙法。取在平板上活化好的各菌株,将7种菌两两交叉划线接种于普通营养琼脂培养基上[3],在50 ℃恒温恒湿培养箱中培养3 d,观察十字交叉处是否有被抑制而发生菌落萎缩和消失的现象,从而判断各菌株之间是否有拮抗性。
1.2.2 单菌剂制备
(1)细菌、放线菌单菌剂的制备:挑取平板上活化好的菌株1环,接种到250 mL营养琼脂或PDA(细菌接种到营养琼脂;放线菌接种到PDA)液体培养基中,放入全温摇床柜中,45 ℃、120 r/min培养12~36 h(细菌培养12 h,放线菌培养36 h)至菌株进入对数生长期。然后吸取10 mL液体菌剂,加入麸皮固体载体中,45 ℃培养8 h,让麸皮载体充分吸收菌体。最后将培养好的菌剂于45 ℃的烘箱中烘12~24 h,即可得到细菌、放线菌的单菌剂。
(2)霉菌单菌剂的制备:挑取活化好的霉菌1环接种于麸皮中,45 ℃培养,待三角瓶内麸皮结成饼后,进行扣瓶,继续培养24 h,即可得到菌剂。然后将菌剂按10%的接种量加入麸皮固体载体中,混合均匀,再将其均匀地平铺在灭菌的瓷盘中,物料厚1~2 cm。用灭过菌的8层纱布覆盖后在45 ℃恒温恒湿培养箱中培养,每隔12 h在纱布上洒少许的无菌水,总共培养48 h。最后将培养好的菌剂于45 ℃的烘箱中烘12~24 h,即可得到霉菌的单菌剂。
(3)菌剂有效活菌数测定:将固体培养物放在恒温鼓风干燥箱中45 ℃条件下烘至恒重,用粉碎机打散混匀后,称取10 g置于装有玻璃珠和100 mL生理盐水的250 mL三角瓶中,以200 r/min振荡30 min,得到基础液;对细菌、霉菌和放线菌单菌剂,采取10倍稀释法分别稀释至10-9,最后3个连续的稀释梯度取0.1 mL分别涂营养琼脂、PDA、高氏一号平板,每个梯度做3个平行试验,且3种平板都各设置一组涂无菌水的平板作对照。最后单菌剂有效活菌数以平均值表示,复合菌剂的活菌数以数量级最大的数表示。
1.2.3 菌剂复配及条件优化
分别取7株单菌剂按有效活菌数大致为1∶1∶1∶1∶1∶1∶1的比例,按10%的接种量接种到装有500 g预处理过酒糟(即酒糟10.00 g,生石灰0.25 g,无菌水7.00 mL,麸皮3.00 g,并搅拌均匀)的2 L大烧杯中,搅拌均匀后在烧杯口用8层灭过菌的纱布覆盖,自然堆肥,每隔8 h测堆体温度,当温度达到最高时,测其中各菌株的自然比例。
有效菌株确定后,结合拮抗性试验,充分考虑各菌株的特点,同时参考各菌株在预处理过的酒糟中的自然比例(表5),选取细菌DX、XX,霉菌M1、M4、M5、M6和放线菌DF七株功能菌来构建复合菌剂,菌株的构建主要考虑各单菌剂的适宜配比。以菌株DX、XX、M1、M4、M5、M6和DF分别作为Plackett-Burman试验的7个因素,每个因素取高、低2个水平,因素水平表见表1。
表1 Plackett-Burman试验设计因素及编码(n=12)
Table 1 Plackett-Burman test design factors and
coding (n=12)

编码水平-11变量12DX/g12XX/g23M1/g23M4/g0.51.5M5/g23M6/g610DF/g
根据各菌株在酒糟中的自然比例的基础上,选取菌株DX、XX、M1、M4、M5、M6和DF为试验因素,按照Plackett-Burman试验设计了12组方案将单菌剂复配成12组复合菌剂,Plackett-Burman试验设计方案见表2。
表2 Plackett-Burman试验设计方案 单位:g
Table 2 Design scheme of Plackett-Burman test
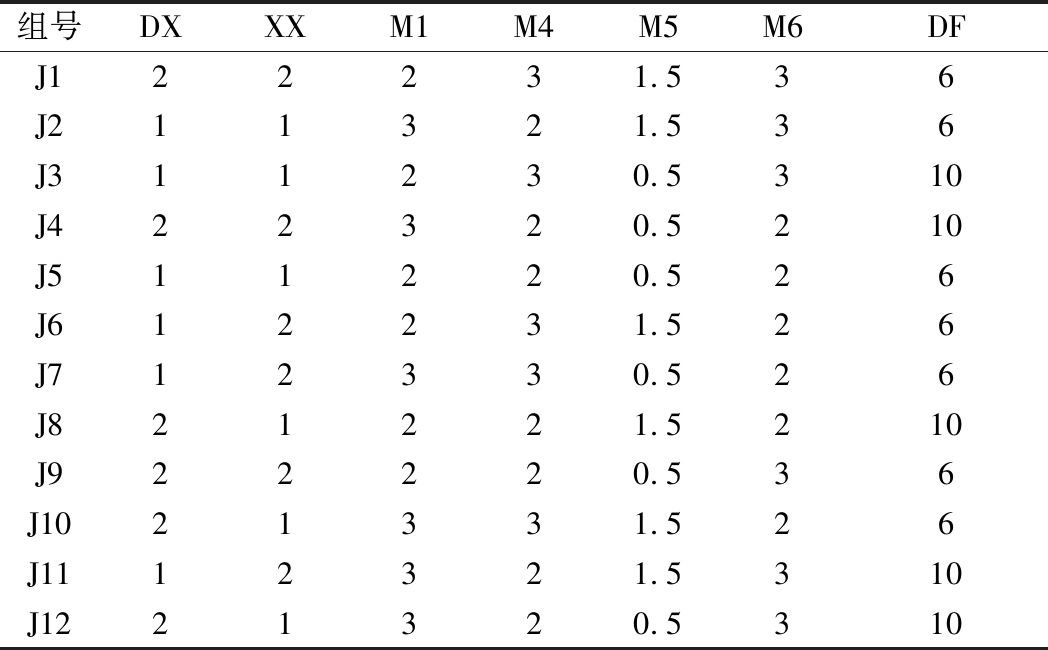
组号DXXXM1M4M5M6DFJ122231.536J211321.536J311230.5310J422320.5210J511220.526J612231.526J712330.526J821221.5210J922220.536J1021331.526J1112321.5310J1221320.5310
菌剂构建后效果的考察主要以菌剂接入酒糟共同处理酒糟的效果为主,同时与现有菌剂(市场上生产的堆肥菌剂:J13和J14)进行对比。分别从12组复合菌剂和2组现有菌剂(J13和J14)中取50 g,加入装有500 g预处理过酒糟的2 L大烧杯中,搅拌均匀后在烧杯口用8层灭过菌的纱布覆盖,将接种有12组复合菌剂的酒糟放入50 ℃的生化培养箱,接种有J13和J14菌剂的酒糟根据其菌剂的最适条件于室温下用泡沫保温,自然发酵。同时设置2个对照组J15和J16(J15放入50 ℃的生化培养箱,J16放入室温条件中并用泡沫保温),对照组不加任何菌剂,其余条件相同。每天分别用无菌玻璃棒搅拌一次,前4 d每隔24 h向堆体中撒入少量蒸馏水,以保持堆体的湿度,待堆体中长出大量菌丝即停止洒水。以颜色变化、气味变化、含水率(R1)、电导率(EC)、pH值、A665nm(腐殖酸在波长665 nm处吸光值)、有效活菌数(R2)、种子发芽指数(GI)为堆肥质量考察指标,7 d后测量,判断各菌剂的堆肥效果和腐熟程度,从而选取菌剂的最优复配方法。
1.2.4 含水率的测定
采用105 ℃恒温干燥法称取新鲜堆肥样品30 g,精确至0.001 g,放入事先称好质量的锡箔纸盒(m0)中,称重记为m1,将装有样品的锡箔纸盒放入105 ℃烘箱中烘干至恒重,然后称重记为m2。每组样品设3个重复,3组数据的平均值作为该样品的值。样品含水率(wH2O)的计算公式:
![]()
(1)
1.2.5 pH值、电导率和A665nm的测定
取新鲜堆肥样品,用蒸馏水按样水比1∶10(g∶mL),在室温条件下,于水浴振荡器下水平振荡提取30 min后,用pH计直接测定pH值;用电导率仪测电导率(EC);用分光光度计测A665nm。每组样品设3个重复,3组数据的平均值作为该样品的值。
1.2.6 种子发芽率(GI)的测定
称取新鲜堆肥样品10 g于100 mL去离子水中,于25 ℃下振荡30 min后过滤,吸取10 mL滤液加入铺有3层滤纸的干净培养皿中,然后在滤纸上均匀播种50粒水萝卜种子,设置3组平行。对照组为蒸馏水,置于25 ℃培养箱中,黑暗培养48 h。以胚根长度达到与种子等长,胚芽长度达到种子长度1/2作为是否发芽的标准。种子发芽指数(GI)按公式(2)计算:
种子发芽指数![]()
(2)
1.3 数据处理
采用Origin 8.6、Excel 2016和Design-Expert 8.0等软件对实验数据进行处理,每个处理组进行3次平行试验。
2 结果与分析
2.1 菌株间拮抗性试验
拮抗性试验是为了防止在复配菌剂的时候菌种之间产生拮抗作用,影响微生物活性,进而影响堆肥效率的提升。对各菌株在固体平板上进行拮抗性试验,两两交叉处无菌落萎缩或消失现象,结果(表3)表明,各菌株之间均无拮抗作用,彼此都能在同一环境下良好生长,可以用于混菌发酵实验。这可能是在平板划线筛选优势菌的时候就挑取了无拮抗现象的优势菌。
表3 50 ℃下的7株优势菌的拮抗试验结果
Table 3 Antagonistic experiment results of 7 dominantbacteria at 50 ℃
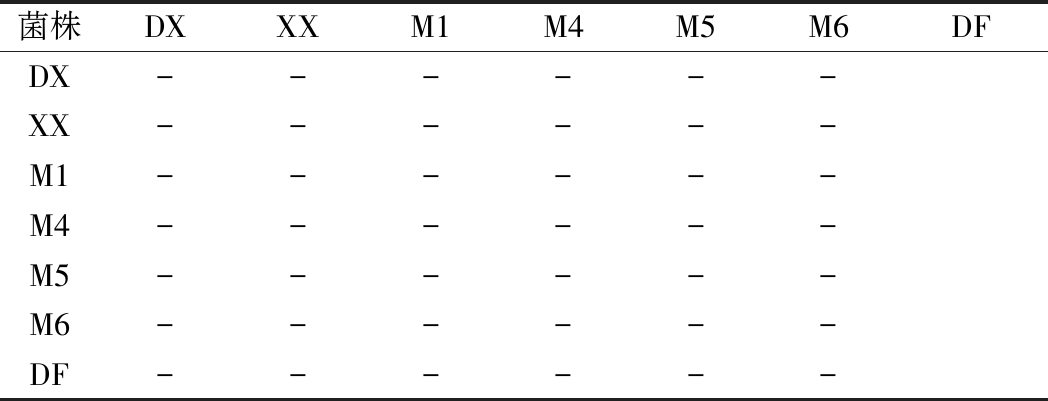
菌株DXXXM1M4M5M6DFDX------XX------M1------M4------M5------M6------DF------
注:“+”表示有拮抗性,“-”表示无拮抗性。
2.2 单菌剂的制备
制备的固体单菌剂中有效活菌数如表4所示。
表4 固体单菌剂中有效活菌数
Table 4 The effective number of living bacteria in solid
single agent
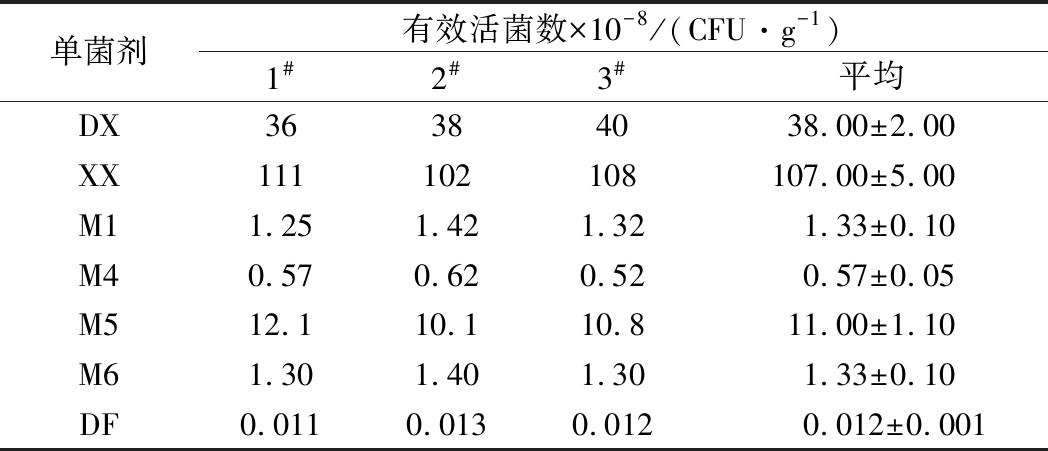
单菌剂有效活菌数×10-8/(CFU·g-1)1#2#3#平均DX36384038.00±2.00XX111102108107.00±5.00M11.251.421.321.33±0.10M40.570.620.520.57±0.05M512.110.110.811.00±1.10M61.301.401.301.33±0.10DF0.0110.0130.0120.012±0.001
由表4可知,各种固体单菌剂除了DF和M4外,有效活菌数均达到亿/g级,尤其是菌剂XX达到了1010 CFU/g,表明制备的每一种单菌剂里面的有效活菌数都比较高。
2.3 菌剂复配
2.3.1 各菌株在酒糟中的自然比例
各高温菌株DX、XX、M1、M4、M5、M6、DF在预处理过的酒糟中自然堆肥,当温度达到最高时,根据各菌株的菌落形态特征,采用平板计数法得到各菌株含量,如表5所示。
表5 各菌株在酒糟中的菌落数
Table 5 The number of colony of strains in vinass
菌株编号DXXXM1M4M5M6DF菌落总数×10-8/(CFU·g-1)73.90±0.5129.60±0.401.64±0.360.69±0.055.30±0.081.66±0.030.05±0.01
通过对表5中各菌株的酒糟中的菌落数换算,各单菌剂的质量分别为:DX 1.5 g,XX 1.5 g,M1 2.5 g,M4 2.5 g,M5 1.0 g,M6 2.5 g,DF 8.0 g。
2.3.2 堆肥7d后各工艺参数
(1)颜色变化。堆肥7 d后,空白对照组J15、J16,颜色未发生变化,市购组J13、J14和实验组J1~J12在堆肥7 d后颜色由灰褐色变成黑褐色,堆体颜色稍微加深,但实验组之间区别不大。由此可看出,对于以酒糟为堆肥原料,用颜色来评价其腐熟程度是无法定量的。
(2)气味变化。空白对照组J15在堆肥7 d后,酒糟味基本消失,这很可能是由于J15处于一个50 ℃的高温、通风环境中,堆体中原本的酒糟味逸散出来,从而使酒糟味变淡,空白对照组J16气味未发生变化。市购组J13、J14和实验组J1~J12在堆肥7 d后气味由酒糟味变成略微泥土霉味和氨味,有泥土霉味可以初步判断堆体已初步腐熟,而氨味是堆体分解蛋白质释放出来的氨气未完全逸散出去,是由于堆体发酵空间较小,搅拌通风效果不是很理想。但实验组之间气味区别不大,由此可看出,对于以酒糟为堆肥原料,用气味来评价其腐熟程度也是无法定量的,可考虑使用气相色谱仪进行定量分析,但用于生产实际过于麻烦,因此依靠气味也无法判断各组菌剂优劣程度,只能初步判定各组菌剂对于酒糟的腐熟是起作用。
(3)含水率。水分是反应微生物活跃程度的重要因素之一,微生物强烈代谢会大量消耗水分,并且使堆肥的温度升高,水分快速蒸发,从而使水分急剧减少[24]。由图1可知,添加了菌剂的实验组J1~J12和市购组J13、J14,在堆肥7 d后含水率较空白对照组J15、J16都低,且都在30%左右。较其他文献猪粪堆肥结束有一定差异[25],可能跟堆肥的原料、通风情况等有关。由此可知,添加了菌剂的堆肥,由于菌剂带来的大量微生物的产热以及剧烈活动,有利于堆体水分的扩散,从而使堆体中含水率降低。
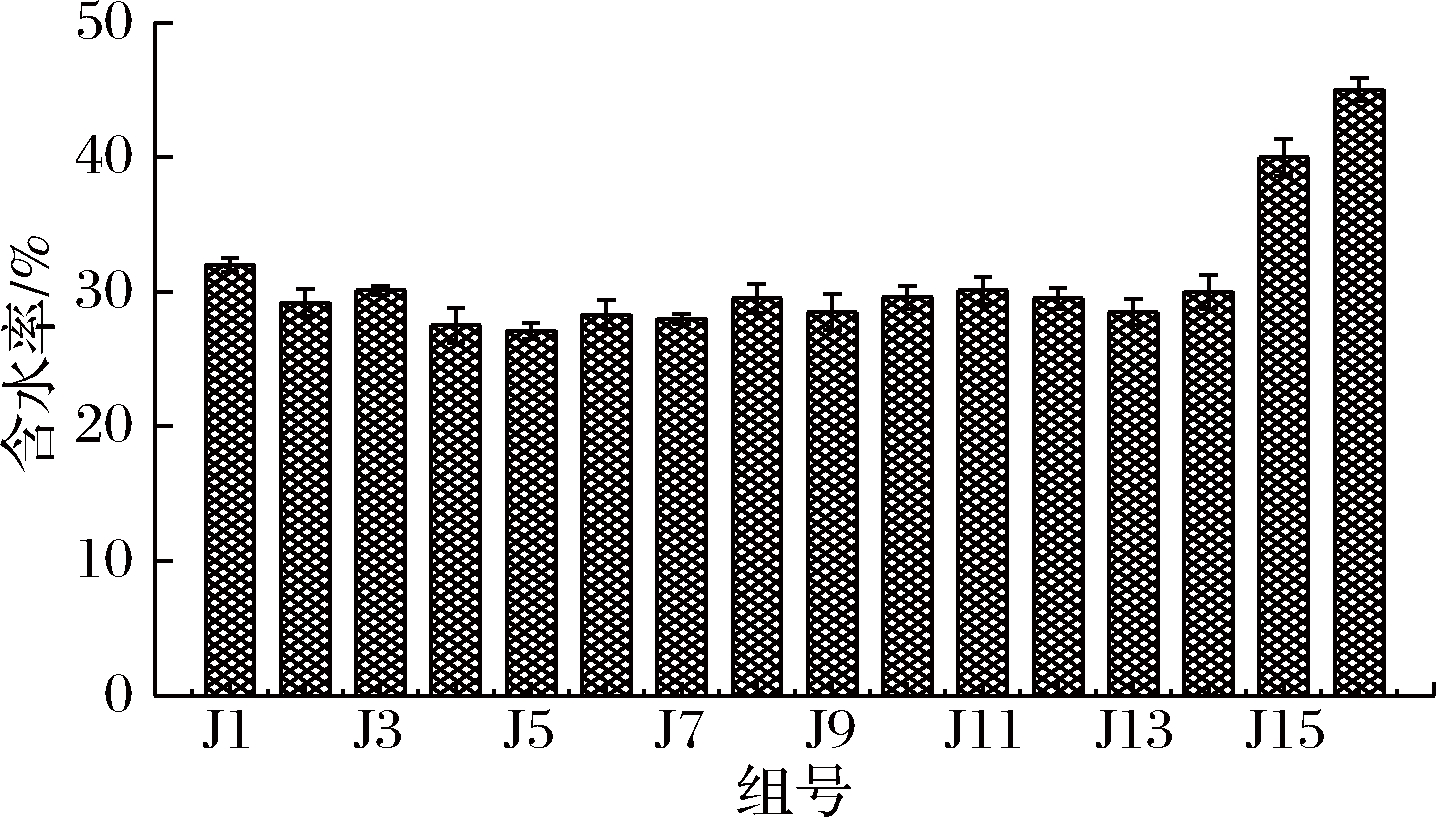
图1 各组堆肥含水率情况
Fig.1 The water content of compost in each group
(4)电导率(EC)。电导率(EC)反映的是堆肥浸提液中的可溶性盐含量,主要由有机酸类和无机盐组成,同时反映了堆肥浸提液对植物毒害的大小,因此电导率的变化反映了堆肥的腐熟程度[26]。一般认为,堆肥的电导率<9.0 ms/cm,不会对种子发芽产生抑制作用[27]。由图2可知,添加了菌剂的实验组J1~J12和市购组J13、J14的堆肥,在堆肥7 d后,J1~J12的电导率小于市购组J13、J14小于对照组J15和J16,且均低于9 ms/cm,由此可看出实验组J1~J12均达到堆肥腐熟的标准。
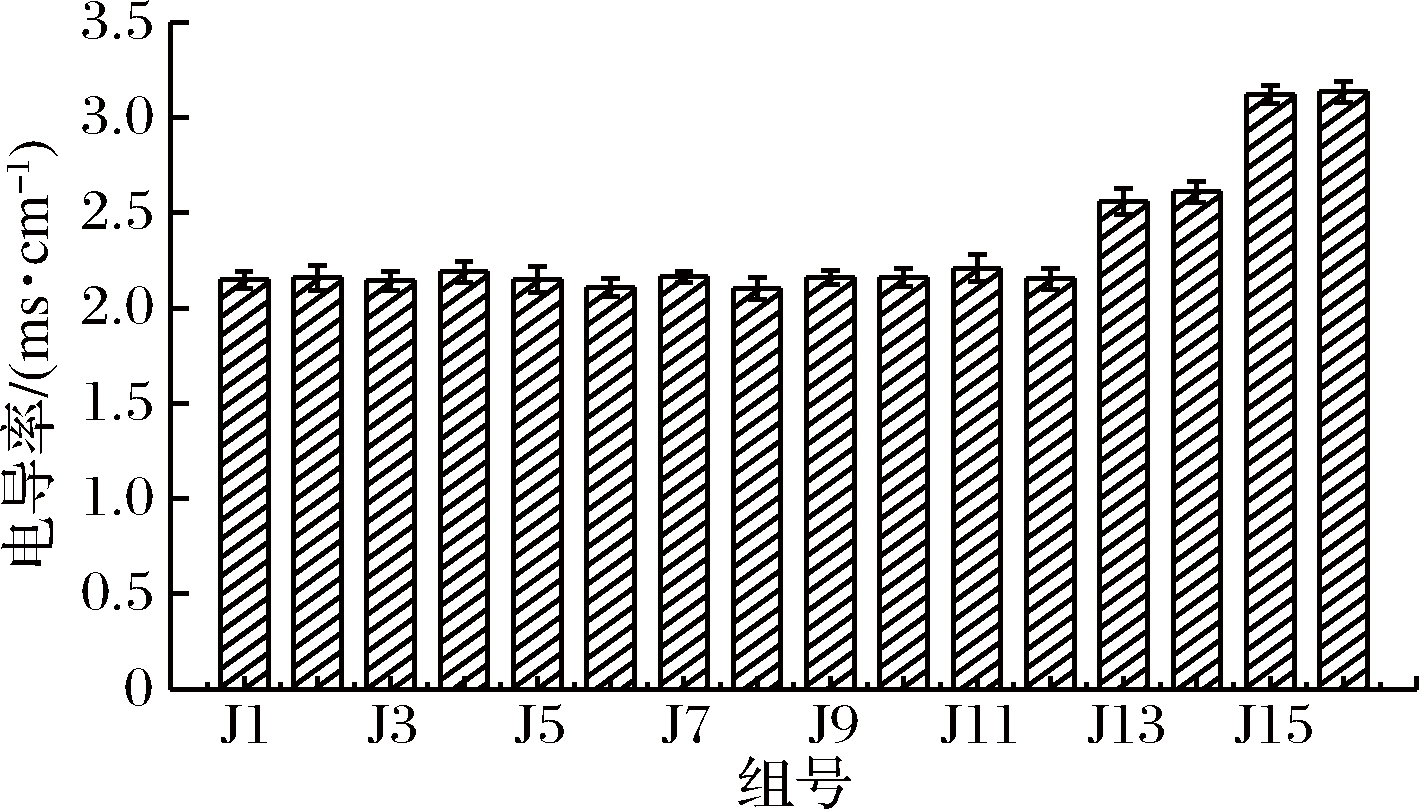
图2 各组堆肥电导率情况
Fig.2 The conductivity of compost in each group
(5)pH值。物料酸碱度是影响微生物生命活动的重要因素之一[28]。通常腐熟的堆肥一般呈弱碱性,pH值在8~9左右,但是由于pH值也受堆肥原料和条件的影响,一般作为堆肥腐熟的一个必要条件,而非充分条件[29]。由图3可知,实验组J1~J12和市购组J13、J14的pH值均在8~9之间,符合堆肥腐熟的必要条件[30]。微生物发酵先经过一个产酸过程,堆体中产生有机酸,pH呈下降趋势;同时含氮有机物分解产生氨,逐渐增加累积引起pH值升高。而对照组J15、J16的pH值未发生较大变化。

图3 各组堆肥pH值情况
Fig.3 The pH value of compost in each group
(6)吸光度值(A665nm)。A665nm与腐殖酸的含量变化相关,因此可用来作为堆肥腐殖化程度的参考指标。一般腐熟堆肥的A665nm<0.008[31]。由图4可知,添加了菌剂的实验组J1~J12和市购组J13、J14在堆肥7 d后,与对照组J15、J16相比,A665nm值均大幅度降低,除了J1、J8和J12组外,其他11组的A665nm均<0.008,达到腐熟标准。
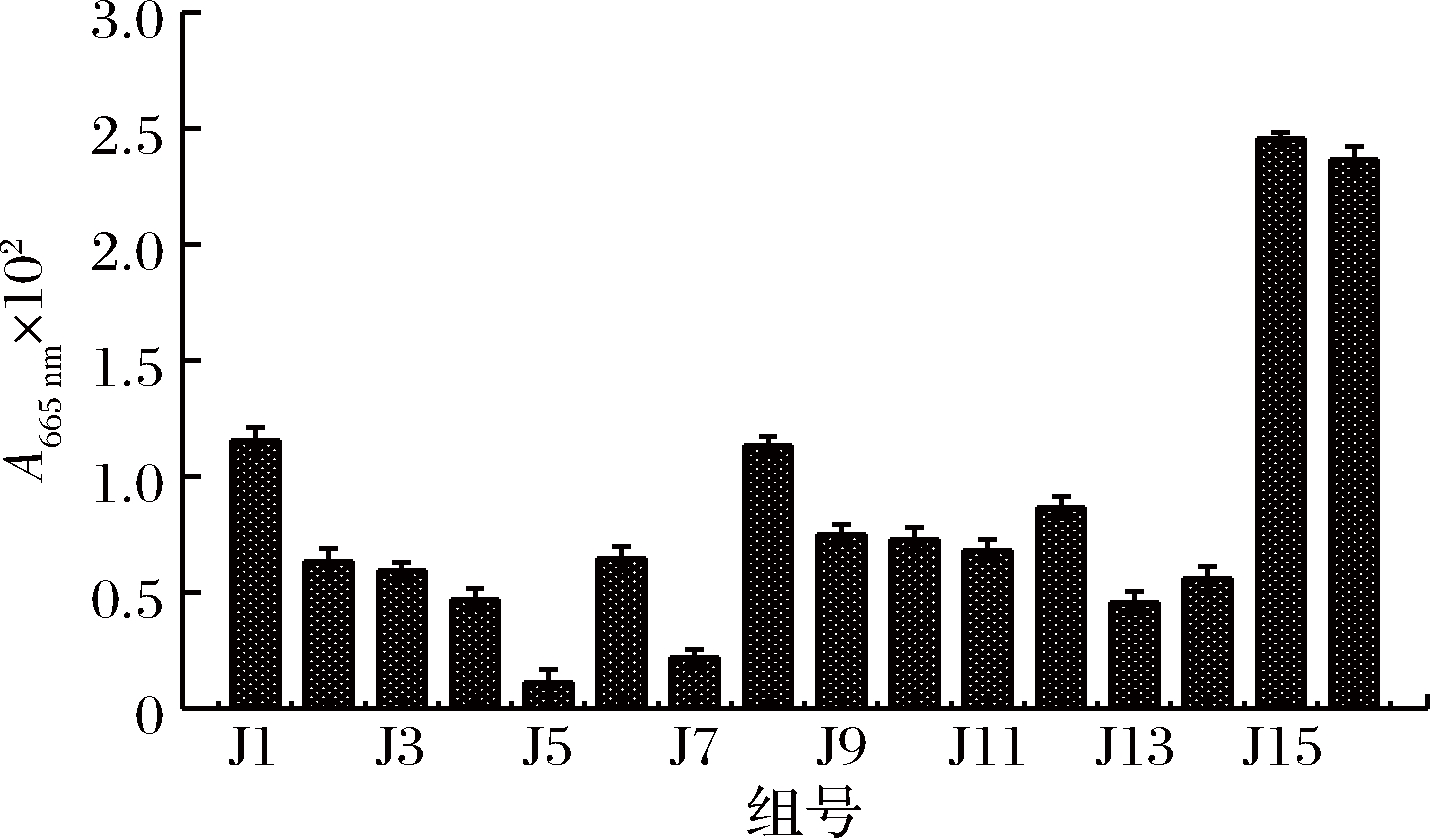
图4 各组堆肥A665nm值情况
Fig.4 The E665 value of composte in each group
(7)有效活菌数。由表6可知,添加了菌剂的实验组J1~J12和市购组J13、J14在堆肥7 d后,有效活菌数均达到109 CFU/g,远超生物有机肥对于颗粒剂型0.20×108 CFU/g标准[32]。而且实验组J1~J12菌剂的活菌数均比市购组J13、J14高,其中最高的为实验组J7,达到了85.32×108 CFU/g,是J14的2.65倍多、J13的1.88倍多,可见在以酒糟为堆肥原料时,本试验研究的菌株在其中的生长活性远超菌剂J13和J14。
表6 各组堆肥有效活菌数目
Table 6 The number of effective living bacteria ineach group
组号活菌数×10-8/(CFU·g-1)组号活菌数×10-8/(CFU·g-1)J180.82±0.31J981.01±0.63J248.01±0.22J1045.52±0.42J357.11±0.31J1166.22±0.23J477.52±0.54J1279.31±0.31J569.23±0.32J1345.32±0.62J670.61±0.13J1432.13±0.53J785.32±0.51J150.034±0.003 2J871.13±0.32J160.053±0.002 1
(8)种子发芽指数(GI)。植物生长的生物量能够表征堆肥的腐熟度,因为未腐熟堆肥会产生植物毒性物质抑制植物的生长,而腐熟堆肥则会促进其生长,种子发芽指数(GI)可以反映堆肥产品对植物的毒性。因此种子发芽指数(GI)是评价堆肥腐熟度的一个指标,考虑到堆肥产品最后用于农业生产中,故植物生长试验应是评价堆肥腐熟度的最终和最具说服力的方法。现在普遍认为:当GI>50%时,就可以认为堆肥中有毒物质的含量降低到了植物可以承受的范围;当GI≥85%时,表示堆肥已经完全腐熟[8, 33-34]。由表7可知,添加了菌剂的实验组J1~J12和市购组J13、J14在堆肥7 d后,种子发芽指数(GI)均超过50%,达到基本腐熟,其中J4组和J7组的GI值≥85%,可说明完全腐熟。而空白对照组J15、J16的种子发芽指数(GI)在10%左右,可见酒糟腐熟是由于菌剂的添加降低了植物有毒物质的含量,且本试验研究的菌剂略优于菌剂J13和J14,说明添加外源微生物菌剂能够明显加速腐熟发酵进程。目前国内外评价有机固体废弃物腐熟度较为公认的指标为种子发芽指数(GI),因为GI值可综合体现堆肥样品的低毒性或高毒性,高毒性和低毒性分别影响种子发芽和根的生长,因此GI被认为最敏感、最可靠、最有效和最能反映堆肥产品植物毒性和判断堆肥无害化和腐熟度参数。
表7 各组堆肥种子发芽指数
Table 7 The seed germination index in each group
组号GI/%组号GI/%J184±0.2J984±0.2J277±0.3J1080±0.3J381±0.1J1184±0.4J485±0.3J1282±0.3J580±0.4J1382±0.2J682±0.2J1479±0.1J786±0.3J1510±0.3J878±0.1J1612±0.2
以种子发芽指数GI为响应值,利用Design Expert 8.0对J1~J12的Plackett-Burman试验数据进行分析,经整理后如表8。
经软件主效分析,XX(P=0.003 7)、M5(P=0.025 9)的效应显著,P值均<0.05,可见XX、M5这2株菌株对于堆肥后种子发芽指数影响显著,其中XX是正影响,M5是负影响。其他4种菌株对种子发芽指数(GI)影响不太大。
表8 Plackett-Burman试验主效应分析
Table 8 Main effect analysis of Plackett-Burmanexperiment
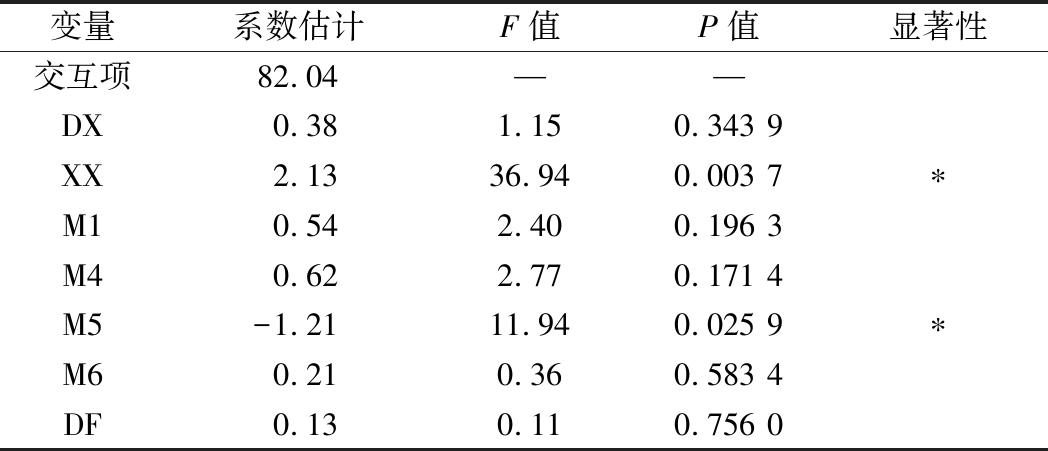
变量系数估计F值P值显著性交互项82.04——DX0.381.150.343 9XX2.1336.940.003 7∗M10.542.400.196 3M40.622.770.171 4M5-1.2111.940.025 9∗M60.210.360.583 4DF0.130.110.756 0
注:*表示0.05水平上的差异。
3 结论
本试验以种子发芽指数(GI)为主要评价指标,结合颜色、气味、含水率、pH值、电导率、吸光度值、有效活菌数等为辅助评价指标,以Plackett-Burman试验设计方案,得到J7组菌剂为最优菌剂,最优质量配比为:m(DX)∶m(XX)∶m(M1)∶m(M4)∶m(M5)∶m(M6)∶m(DF)=1.0∶2.0∶3.0∶3.0∶0.5∶2.0∶6.0,该菌剂有效活菌数为85.32×108 CFU/g,种子发芽指数(GI)为86%。且该高温复合菌剂在堆肥的有效活菌数以及种子发芽指数(GI)方面优于市售高温菌剂J13和J14,说明该高温复合菌剂促进了堆体的腐熟效果。酒糟经过高温复合菌剂堆积发酵之后可以提高肥效,制备成为优质生物有机肥,这对加强酒糟资源的综合利用,改善环境污染,促进白酒产业的健康持续发展都有着积极的作用。
[1] 江源. 2017年贵州白酒产量及预测分析[J]. 酿酒科技,2017(10): 95.
[2] 李觅,刘念,王超凯,等. 固态酿造废弃物规模化利用研究[J]. 酿酒科技,2018(2):113-116.
[3] 焦肖飞,刘建学,韩四海,等. 复合菌生物转化白酒糟发酵条件的优化[J]. 食品科学,2015,36(17):164-168.
[4] 李红. 酒糟综合利用技术研究进展[J]. 中国资源综合利用,2016,34(12):36-39.
[5] 胡德全,漆英,余国华,等. 酒糟饲料在肉牛生产中的应用[J]. 畜禽业,2014(8):44-47.
[6] 李建,叶翔. 酒糟综合利用多元化研究[J]. 中国酿造,2013,32(12):121-124.
[7] 王晓力. 白酒糟生产高蛋白饲料研究进展及前景[J]. 中兽医医药杂志,2013,32(6):34-36.
[8] 王和玉,江友峰,胡旭,等. 复合菌剂对白酒丢糟高温好氧堆肥的影响[J]. 酿酒科技,2015(1):19-22.
[9] 郭夏丽,王兴胜,朱正威,等. 白酒糟高温好氧堆肥过程中氮素转化规律及堆肥周期探究[J]. 郑州大学学报(工学版),2014,35(05):116-119;123.
[10] 任佩佩. 生物有机肥的研究进展[J]. 农村经济与科技,2018(6):300.
[11] 祝虹钰,刘闯,李蓬勃,等. 微生物菌剂的应用及其研究进展[J]. 湖北农业科学,2017,56(5):805-808.
[12] 高云航,勾长龙,王雨琼,等. 低温复合菌剂对牛粪堆肥发酵影响的研究[J]. 环境科学学报,2014,34(12):3 166-3 170.
[13] 王顺利,刘克锋,李荣旗,等. 木质纤维素分解复合菌剂强化牛粪堆肥工艺[J]. 农业机械学报,2014,45(4):201-207.
[14] 曹建兰,王晓丹,龙茜萍,等. 两步发酵法制备固态白酒丢糟生物有机肥[J]. 酿酒科技,2014(2):68-71.
[15] 林金新,蔡少丽,王芳婷,等. 白酒丢糟的多菌种混菌固态发酵制备有机肥[J]. 福建师范大学学报(自然科学版),2017,33(3):69-77.
[16] ZHAO X, WANG W, LI J, et al. Advanced in microbiological agent of straw degradation under low temperature[J]. Biotechnology Bulletin, 2014(11): 55-61.
[17] 徐四新,诸海焘,余廷园,等. 微生物菌剂对茭白秸秆堆肥过程的影响[J]. 上海农业学报,2018,34(1):37-40.
[18] 刘建伟,段粹,刘越. 微生物菌剂处理畜禽养殖场含氨和硫化氢气体技术进展[J]. 黑龙江畜牧兽医,2018(11):72-75.
[19] 陈霞,罗友进,程玥晴,等. 不同微生物菌剂对中药渣堆肥过程及理化性质的影响[J]. 西南农业学报,2017,30(12):2 756-2 763.
[20] 王伟轩,孙志朋,霍文杰,等. 接种高温纤维素菌剂对生活垃圾堆肥理化性质的影响[J].生态科学,2017,36(5):73-79.
[21] 田雪莲,尹显慧,龙友华,等. 猕猴桃溃疡病菌拮抗菌筛选、鉴定及发酵条件优化[J]. 食品科学,2017,38(16):79-85.
[22] 张超,刘双平,邹慧君,等. 黄酒发酵过程中微生物筛选及菌株产香分析[J]. 食品工业科技,2018,39(14):94-102.
[23] 苏畅,窦晓,叶新,等. 基于ITS4/5 rRNA区序列对不同时期大曲中霉菌的分离与鉴定[J]. 现代食品科技,2018,34(3):54-58, 211.
[24] 罗维,陈同斌. 湿度对堆肥理化性质的影响[J]. 生态学报,2004,24(11):2 656-2 663.
[25] 王佳宁. 猪粪堆肥复合菌剂制备及其效果评价[D]. 大连:大连理工大学,2017.
[26] 朴仁哲,姜成,金玉姬,等. 微生物菌群对鸡粪堆肥腐熟中物质变化的影响[J]. 湖北农业科学,2006,45(1):110-113.
[27] 鲁如坤. 土壤-植物营养学原理和施肥[M]. 北京:化学工业出版社,1998.
[28] 黄国锋,钟流举,张振钿,等. 有机固体废弃物堆肥的物质变化及腐熟度评价[J]. 应用生态学报,2003(5):813-818.
[29] 吕凡,章骅,邵立明,等. 基于物质流分析餐厨垃圾厌氧消化工艺的问题与对策[J]. 环境卫生工程,2017,25(1):1-9.
[30] 李洋,席北斗,赵越,等. 不同物料堆肥腐熟度评价指标的变化特性[J]. 环境科学研究,2014,27(6):623-627.
[31] 周普雄. 超高温好氧发酵工艺加速污泥堆肥腐熟过程研究[D]. 福州:福建农林大学,2018.
[32] NY 884—2012,生物有机肥[S].
[33] BERTRAN E, SORT X, SOLIVA M, et al. Composting winery waste: sludges and grape stalks[J]. Bioresource Technology, 2004, 95(2):203-208.
[34] ZUCCONI F, MONACO A, FORTE M, et al. Phytotoxins during the stabilization of organic matter//Gasser J K R. Composting of agricultural and other wastes[M]. London: Elsevier, 1985: 73-86.