肉制品是全球消费最普遍的食品,中国肉制品在2017年产量突破1 600万t,其中,低温肉制品产量达1 072万t,占肉制品总产量的64.3%;中高温肉制品产量达595万t;占肉制品总产量的35.7%[1]。发酵肉制品以其独特的口味和营养价值越来越受到人们青睐,但与发酵肉制品相关的食品安全问题也很突出[2],如加工过的肉和发酵的香肠可能含有对人类有致癌作用的物质,并且据报道会引起结肠直肠癌[3]。因此发酵肉制品的质量可以通过某些化学危害物质如生物胺[4],在高于最大允许毒理学限度的浓度下进行评估。
生物胺(biogenic amines,BA)是一类含氮的具有生物活性的小分子量有机化合物的总称,是生物体合成荷尔蒙、核苷酸、蛋白质的前体,含蛋白质和氨基酸的食品在一定条件下经微生物发酵或者污染较易产生生物胺[5]。生物胺的生理活性主要有生长调节(精胺、亚精胺、尸胺)、神经传导(儿茶酚胺、五羟色胺)、炎症反应的介质(组胺、酪胺)[6]。过量摄入生物胺对人体存在潜在危害[7],生物胺中毒性最大的是组胺,其水平偏高会导致头痛、高血压以及消化障碍;毒性次之的酪胺则易引起偏头痛和高血压等不适反应;生物胺中的尸胺和腐胺虽然毒性较小,但是能抑制组胺和酪胺代谢酶的活性,从而增加组胺和酪胺的毒性[8-10]。腐胺、尸胺、精胺和亚精胺与氮结合会产生亚硝酸盐,并且能反映食品的腐败程度,它们的存在也会增加酪胺和组胺的毒性[11]。发酵食品生产过程中使用的生产菌株或环境微生物,常因具有氨基酸脱羧酶活性而导致产品中生物胺的积累[12-13]。富含蛋白质的发酵肉制品、鱼类、酒类、干酪和豆制品由于易被微生物侵染而可能具有高浓度的生物胺,其中发酵肉制品是世界上公认的生物胺重要来源[14]。
目前,对发酵肉制品中生物胺含量的检测有高效液相色谱法[15-17]、气相色谱法[18]、离子色谱法[19]、毛细管电泳法[20]等多种方法,这些方法具有检测灵敏度高、定量分析准确的特点。国内外对发酵肉制品中的生物胺累积已做了大量的研究,认为生物胺在发酵肉制品中普遍存在,只是不同的发酵肉制品中存在的种类和数量不同。
本研究旨在建立高效液相色谱法(HPLC)测定发酵肉制品中8种生物胺的方法,对市售6种不同类型发酵肉制品中生物胺的种类和含量进行测定,为控制我国发酵肉制品中生物胺含量及确保其安全性提供参考。
1 材料与方法
1.1 材料与试剂
生物胺标准品:组胺、酪胺、色胺、β-苯乙胺、腐胺、尸胺、盐酸吡哆胺和精胺(纯度均>98%),百灵威科技有限公司;衍生试剂丹磺酰氯(DNS-Cl),Sigma-Aldrich公司;常用试剂饱和NaHCO3、NaCl、甲酸、正丁醇、乙酸铵、乙腈(色谱纯),天津市天力化学试剂有限公司;其他试剂丙酮(分析纯)、三氯甲烷(分析纯)、乙醚(分析纯),天津市康科德科技有限公司。
1.2 仪器与设备
LC-20AT HPLC仪,日本岛津公司;IKA Vortex2涡旋振荡器,广州仪科实验室技术有限公司;HAC-36C氮吹仪,天津市恒奥科技发展有限公司;TGL-21M大容量冷冻离心机,上海卢湘仪离心机仪器有限公司;实验室pH计,梅特勒-托利多仪器(上海)有限公司;恒温水浴锅,天津欧诺仪器仪表有限公司;Milli-Q超纯水器,美国Millipore公司;QUINTIX224-1CN电子分析天平,德国赛多利斯公司;0.22 μm滤膜针头滤器,颇尔过滤器(北京)有限公司。
1.3 方法
1.3.1 标准溶液和试剂的配制
准确称取购买的8种生物胺单体标准品,用0.1 mol/L HCl液配制1 000 μg/mL的标准储备溶液。分别量取上述储备溶液,以0.1 mol/L HCl为稀释液,准确稀释配制成质量浓度为0.05、0.1、0.2、0.25、0.5、1、5、10、25、50 μg/mL的梯度标准溶液,以上所配制溶液于4 ℃冰箱避光储存。
丹磺酰氯(DNS-Cl)衍生剂:准确称取1 g丹磺酰氯,加入100 mL丙酮作为溶剂,配制质量浓度为10 mg/mL的溶液,置4 ℃冰箱避光储存。
1.3.2 样品的预处理
1.3.2.1 提取
称取绞碎后的发酵肉制品样品5.0 g于50 mL离心管中,分别加入10 mL 0.1 mol/L HCl,5%的三氯乙酸和0.4 mol/L高氯酸溶液并超声30 min,转移至50 mL具塞离心管中,6 000 r/min离心10 min,转移上清液至50 mL容量瓶中,残渣用20 mL上述溶液再提取1次,合并上清液并稀释至刻度,待净化。
1.3.2.2 净化
除脂肪:移取上述试样提取液10 mL于25 mL具塞试管中,加入0.5 g NaCl涡旋振荡至NaCl完全溶解后加入10 mL正己烷,涡旋振荡5 min,静置分层后弃去上层有机相,下层试样溶液加入10 mL正己烷再除脂1次。
萃取:移取5 mL上述除脂肪后的试样溶液于10 mL具塞离心管中,用5 mol/L NaOH溶液调节pH值至12.0左右。加入5 mL的正丁醇/三氯甲烷(1+1)混合溶液,涡旋振荡5 min,5 000 r/min离心5 min,转移上层有机相于另一个10 mL具塞离心管中,下层样液再萃取1次,合并萃取液,用正丁醇/三氯甲烷(1+1)稀释至刻度。取5 mL萃取液加入200 μL HCl(1 mol/L),混匀后40 ℃水浴下氮气吹干,加入1 mL HCl(0.1 mol/L)涡旋振荡,使残留物完全溶解,待衍生。
1.3.3 丹磺酰氯(DNS-Cl)衍生方法
在上述待衍生的试样溶液中依次加入1 mL饱和NaHCO3溶液、100 μL NaOH溶液(1 mol/L)、1 mL丹磺酰氯溶于丙酮(10 mg/mL)涡旋混匀1 min后置于60 ℃恒温水浴中衍生15 min,取出,分别加入100 μL谷氨酸钠溶液,振荡混匀,60 ℃恒温反应15 min。取出冷却至室温,于每个离心管中加入1 mL水,涡旋混合1 min,40 ℃水浴下氮吹除去丙酮(约1 mL),加入0.5 g NaCl涡旋振荡至NaCl完全溶解后,加入5 mL乙醚,涡旋振荡2 min,静置分层后,吸出上层有机相(乙醚层),再萃取1次,合并乙醚萃取液,40 ℃水浴下氮气吹干。加入1 mL乙腈涡旋振荡使残留物完全溶解,0.22 μm滤膜针头滤器过滤于进样小瓶,待测定。
1.3.4 色谱条件
色谱柱为Waters Symmetry C18色谱柱(柱长250 mm,柱内径4.6 mm,柱填料粒径5 μm),紫外检测波长254 nm,20 μL的进样量,柱温35 ℃,流动相B乙腈与含0.1%乙酸的0.01 mol/L乙酸铵溶液为9∶1(V∶V),流动相A乙腈与含0.1%乙酸的0.01 mol/L乙酸铵溶液比例为1∶9(V∶V),流速0.8 mL/min,梯度洗脱程序见表1。
表1 DNS-Cl法梯度洗脱程序表
Table 1 DNS-Cl gradient elution program
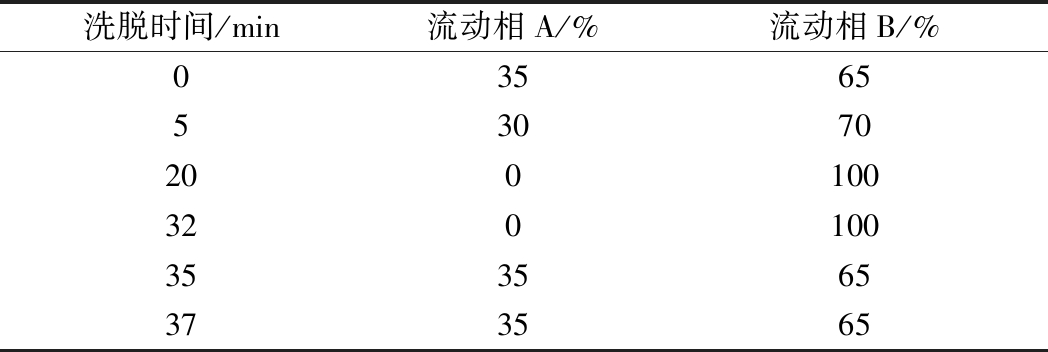
洗脱时间/min流动相A/%流动相B/%0356553070200100320100353565373565
2 结果与分析
2.1 提取剂的选择
提取剂种类的选择与所分析的样品基质特性有关,发酵肉制品中含有蛋白质、脂肪及其他复杂成分,这些成分会影响生物胺的有效成分和定量。对于肉类、水产品及植物性食品中生物胺一般以HCl[21]、高氯酸[22]、三氯乙酸[23]等酸性介质提取,故本实验选取0.1 mol/L的HCl,5%的三氯乙酸和0.4 mol/L高氯酸进行对比,在5.0、10、15 μg/mL三种不同添加水平下对发酵肉制品中8种生物胺进行提取,实验结果见图1。

图1 不同提取剂的加标回收率的测定(n=3) Fig.1 Recoveries of different extractions for eight biogenic
amines from spiked sample
由图1结果表明,使用5%三氯乙酸作为提取剂对8种生物胺的提取回收率显著性高于0.1 mol/L的HCl和0.4 mol/L高氯酸,其回收率为85.1%~94.3%之间,且RSD小于4.3%。因此选择三氯乙酸作为发酵肉制品中8种生物胺的提取剂。
2.2 线性关系与检出限
采用预处理方法结合高相液相色谱法对8种生物胺同时进行检测。本实验采用外标曲线法进行定量研究,以各标准品峰面积为纵坐标,以标准溶液质量浓度为横坐标绘制标准曲线,计算所得标准曲线的回归方程以及相关系数,8种生物胺在0.05~50 μg/mL,该方法具有良好的线性关系,相关系数R2均大于0.998。进一步以3倍信噪比(S/N=3)作为检出限的确定标准,以10倍信噪比(S/N=10)作为定量限标准,8种生物胺的检出限与定量限分别为0.03~0.21 μg/g和0.10~0.69 μg/g,结果见表2。生物胺标准混合溶液的色谱图见图2,发酵肉制品样品中生物胺的色谱图见图3。由图3可知,8种生物胺在37 min内实现完全分离,彼此之间无重叠。
表2 8种生物胺的线性关系、相关系数与检出限
Table 2 The regression equtions and correlation coefficient and LOD of 8 biogenic amines
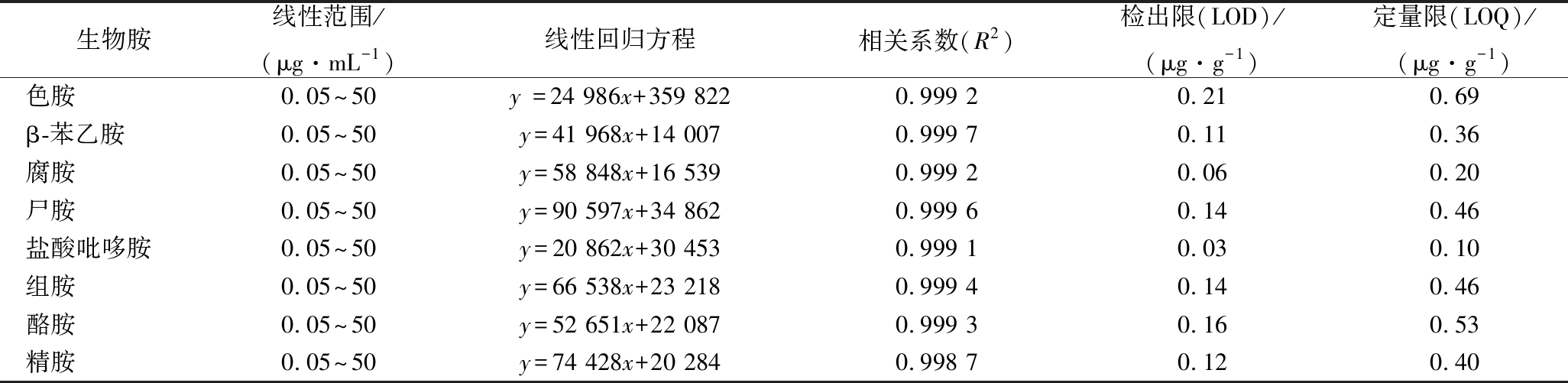
生物胺线性范围/(μg·mL-1)线性回归方程相关系数(R2)检出限(LOD)/(μg·g-1)定量限(LOQ)/(μg·g-1)色胺0.05~50y =24 986x+359 8220.999 20.210.69β-苯乙胺0.05~50y=41 968x+14 0070.999 70.110.36腐胺0.05~50y=58 848x+16 5390.999 20.060.20尸胺0.05~50y=90 597x+34 8620.999 60.140.46盐酸吡哆胺0.05~50y=20 862x+30 4530.999 10.030.10组胺0.05~50y=66 538x+23 2180.999 40.140.46酪胺0.05~50y=52 651x+22 0870.999 30.160.53精胺0.05~50y=74 428x+20 2840.998 70.120.40
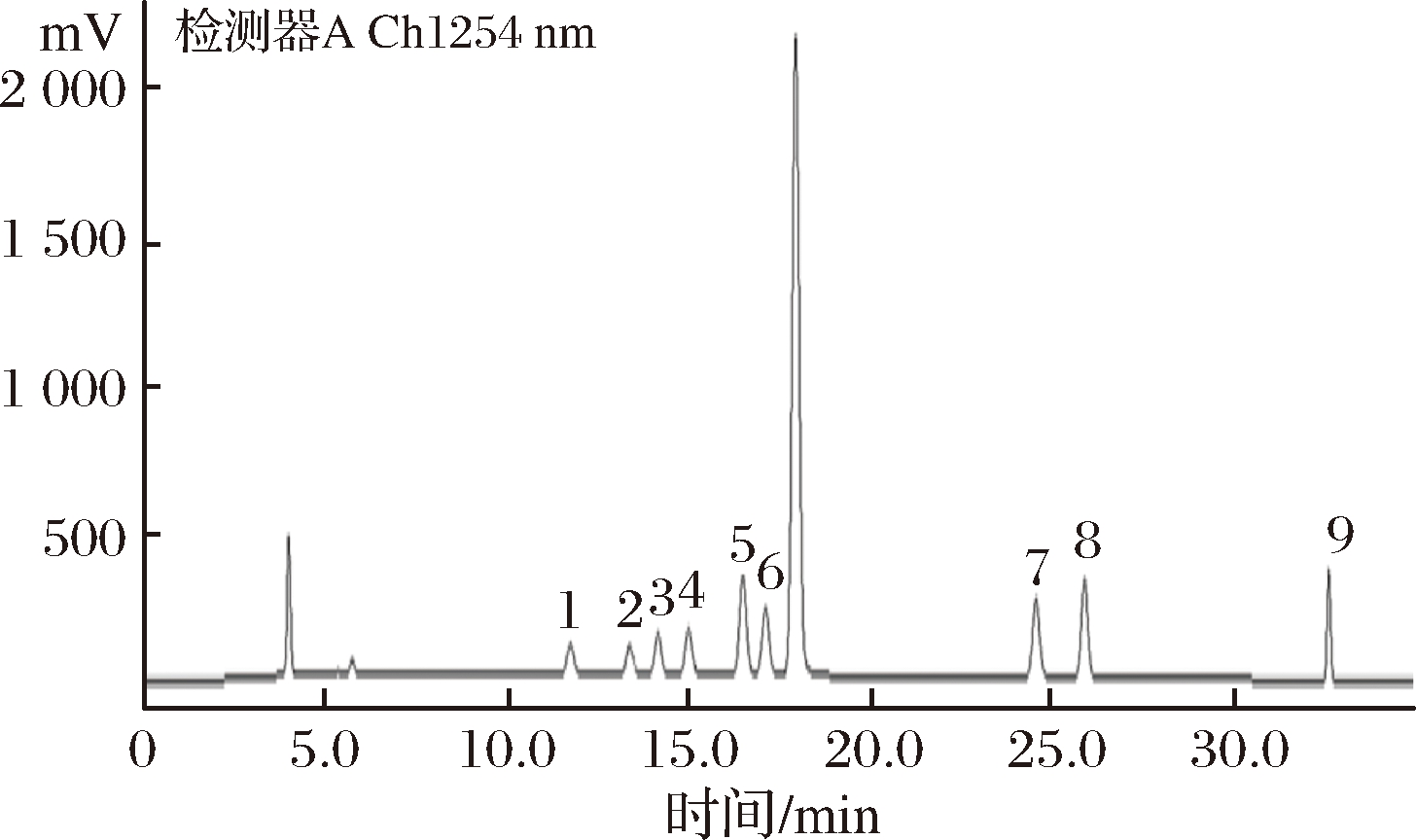
1-色胺;2-β-苯乙胺;3-腐胺;4-尸胺;5-盐酸吡哆胺;6-组胺;7-酪胺;8-精胺
图2 8种生物胺混合标准溶液的液相色谱图
Fig.2 HPLC chromatogram of 8 biogenic amine mixed standards
2.3 发酵肉制品样品分析
从当地超市购买6种不同发酵肉制品为样品,依照本文所建立的方法对发酵肉制品样品进行生物胺含量检测。检测结果见表3。所购买发酵肉制品中含有8种生物胺,且各生物胺含量均有差异。其中色胺和腐胺在猪肉香肠中含量最高,β-苯乙胺和尸胺在腊肉中含量最高,盐酸吡哆胺在红肠中含量最高,组胺和酪胺在腊肠中含量最高,精胺在火腿中含量最高。由测试结果可以看出,不同发酵肉制品的生物胺种类和含量不同,这是由于发酵肉制品生物胺的产生是一个非常复杂的过程,除了与原料肉和所使用的发酵剂有关之外,还与所采用的工艺条件有关,而腊肉等在发酵过程中,大量环境微生物会使发酵过程具有不确定性和随意性,导致生物胺的种类和含量也可能会不同。因此,在正常发酵工艺下要控制每一个环节是很困难的,可综合采用优质的新鲜原料肉、适当的发酵剂,改变加工、贮藏条件和卫生条件来减少食品中生物胺的含量[7]。

a-腊肠;b-猪肉香肠;c-火腿;d-红肠;e-鸡肉香肠;f-腊肉(右图a1~f1为其对应的局部放大图) 1-色胺;2-β-苯乙胺;3-腐胺;4-尸胺;5-盐酸吡哆胺;6-组胺;7-酪胺;8-精胺
图3 8种发酵肉制品样品生物胺色谱图
Fig.3 HPLC chromatogram of biogenic amines of fermented meat products
表3 发酵肉制品中8种生物胺的含量
单位:μg/g
Table 3 Contents of 8 biogenic amines in fermented meat products
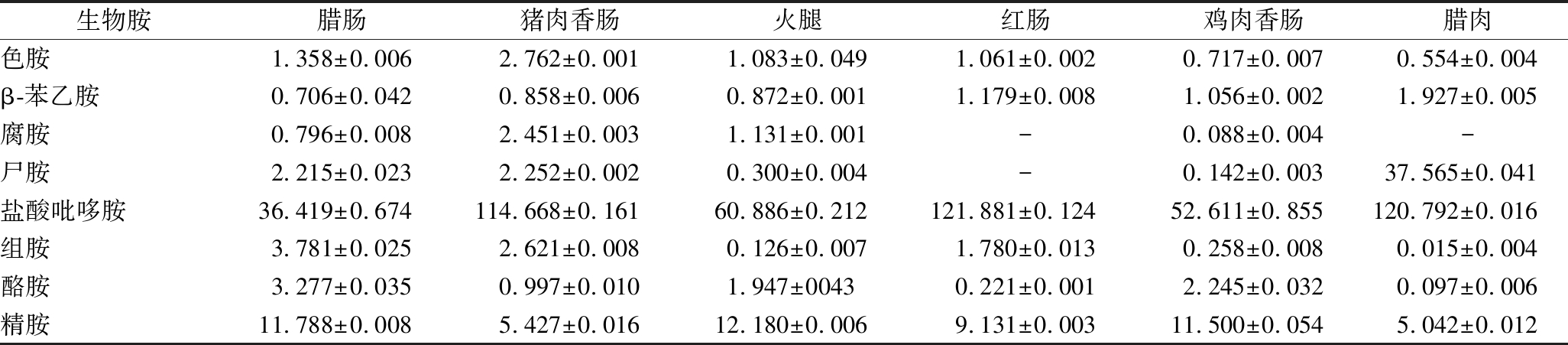
生物胺腊肠猪肉香肠火腿红肠鸡肉香肠腊肉色胺1.358±0.0062.762±0.0011.083±0.0491.061±0.0020.717±0.0070.554±0.004β-苯乙胺0.706±0.0420.858±0.0060.872±0.0011.179±0.0081.056±0.0021.927±0.005腐胺0.796±0.0082.451±0.0031.131±0.001-0.088±0.004-尸胺2.215±0.0232.252±0.0020.300±0.004-0.142±0.00337.565±0.041盐酸吡哆胺36.419±0.674114.668±0.16160.886±0.212121.881±0.12452.611±0.855120.792±0.016组胺3.781±0.0252.621±0.0080.126±0.0071.780±0.0130.258±0.0080.015±0.004酪胺3.277±0.0350.997±0.0101.947±00430.221±0.0012.245±0.0320.097±0.006精胺11.788±0.0085.427±0.01612.180±0.0069.131±0.00311.500±0.0545.042±0.012
注:-表示未检出。
2.4 加标回收的测定
向一种发酵猪肉香肠样品中分别加入1、5、10 μg/g三种浓度水平的生物胺混合标准溶液。应用本实验所建立的样品预处理及高效液相检测方法进行测定,重复测量3次,其结果如表4所示。由表4可以得出,8种生物胺加标回收率在83.34%~111.4%,RSD均低于4.85%,表明所建立的方法对8种生物胺的检测具有较好的准确性和精密度。
3 结论
本实验建立了一种快速测定发酵肉制品中8种生物胺的高效液相色谱法,该方法线性范围广,重复性好,准确性高,能够快速简便地对发酵肉制品中的生物胺进行检测分析,对于发酵肉制品中生物胺的快速批量检测有较大的实际应用前景,对我国开展食品中生物胺的风险技术评估和降低生物胺膳食摄入危险都具有重要参考意义。
表4 8种生物胺的加标回收率的测定
Table 4 Recoveries for 8 biogenic amines

生物胺加标浓度/(μg·g-1)测量值/(μg·g-1)回收率/%RSD/%生物胺加标浓度/(μg·g-1)测量值/(μg·g-1)回收率/%RSD/%色胺15102.386.3111.12102.7999.0397.591.350.983.20盐酸吡哆胺151037.4541.4146.87102.7699.85104.484.850.861.05β-苯乙胺15101.666.1611.1895.00109.10104.704.662.380.28组胺15104.778.6513.9298.7397.36101.370.760.630.58腐胺15101.765.7510.0995.9299.0692.982.230.840.47酪胺15104.158.1011.8787.6996.4785.894.252.741.58尸胺15103.146.3811.2192.9383.3489.904.653.060.87精胺151012.7816.6122.9398.9696.50111.401.962.683.84
[1] 中商产业研究院.中国肉制品行业前景研究报告[R].中国:中商产业研究院,2018.
[2] LEROY F, VERLUYTEN J, VUYST L D. Functional meat starter cultures for improved sausage fermentation[J]. International Journal of Food Microbiology, 2006, 106(3): 270-285.
[3] International Agency for Research on Cancer(IARC). Consumption of red meat and processed meat: IARC Working Group[R]. Lyon: IARC Monogr Eval Carcinog Risks Hum, 2015.
[4] SHALABY A R. Significance of biogenic amines to food safety and human health[J]. Food Research International, 1996, 29(7): 675-690.
[5] BUSTO O, MIRACLE M, GUASCH J, et al. Determination of biogenic amines in wines by high-performance liquid chromatography with on-column fluorescence derivatization[J]. Journal of Chrornatography A, 1997, 757(1-2): 311-318.
[6] TABOR C W, TABOR H. Polyamines[J]. Annual Review of Biochemistry, 1984, 53: 749-790.
[7] 冉春霞,陈光静.我国传统发酵肉制品中生物胺的研究进展[J].食品与发酵工业,2017,43(3):285-294.
[8] HERM NDEZ-ORTE P, LAPE
NDEZ-ORTE P, LAPE A A C, PE
A A C, PE A-GALLEGOA A, et al. Biogenic amine determination in wine fermented in oak barrels: factors affecting formation[J]. Food Research Intertional, 2008, 41(7): 697-706.
A-GALLEGOA A, et al. Biogenic amine determination in wine fermented in oak barrels: factors affecting formation[J]. Food Research Intertional, 2008, 41(7): 697-706.
[9] PARENTE E, MATUSCELLI M, GARDINI F, et al. Evolution of microbial populations and biogenic amine production in dry sausages produced in Southern Italy[J]. Journal of Applied Microbiology, 2001, 90: 882-891.
[10] NOUT, M J R. Fermented foods and food safety[J]. Food Research International, 1994, 27: 291-298.
[11] HERNáNDEZ-JOVER T, IZQUIERDO-PULIDO M, VECIANA-NOGUéS M T, et al. Biogenic amine and polyamine contents in meat and meat products[J]. Journal of Agricultural and Food Chemistry, 1997, 45(6): 2 098-2 102.
[12] GIOVANNA S, FAUSTO G. Biogenic amines in dry fermented sausages: A review[J]. International Journal of Food Microbiology, 2003, 88(1): 41-54.
[13] 张慧,蔡成岗,朱耿杰,等.高效液相色谱法同时测定香肠中6种生物胺[J].中国食品学报,2009,9(4):205-210.
[14] 王颖,邱璠,韩北忠,等.食品中的生物胺及其检测方法[J].中国酿造,2011,10:1-5.
[15] 廖国周,王桂瑛,曹锦轩,等.宣武火腿中生物胺的HPLC测定[J]. 食品与发酵工业,2011,37(12):130-132.
[16] ZARGHAMPOUR F, YAMINI Y, BAHARFAR M, et al. Electromembrane extraction of biogenic amines in food samples by a microfluidic-chip system followed by dabsyl derivatization prior to high performance liquid chromatography analysis[J]. Journal of Chromatography A, 2018, 1 556: 21-28.
[17] LIU S J, XU J J, MA C L, et al. A comparative analysis of derivatization strategies for the determination of biogenic amines in sausage and cheese by HPLC[J]. Food Chemistry, 2018, 266: 275-283.
[18] PAPAGEORGIOU M, LAMBROPOULOU D, MORRISON C, et al. Direct solid phase microextraction combined with gas chromatography-mass spectrometry for the determination of biogenic amines in wine[J]. Talanta, 2018, 183: 276-282.
[19] BORBA B M D, ROHRER J S. Determination of biogenic amines in alcoholic beverages by ion chromatography with suppressed conductivity detection and integrated pulsed amperometric detection[J]. Journal of Chromatography A, 2007, 1 155(1), 22-30.
[20] AN D, CHEN Z Q, ZHENG J C, et al. Determination of biogenic amines in oysters by capillary electrophoresis coupled with electrochemiluminescence[J]. Food chemistry, 2015, 168: 1-6.
[21] KIRSCHBAUM J, REBSCHER K, BRüCKNER H. Liquid chromatographic determination of biogenic amines in fermented foods after derivatization with 3, 5-dinitrobenzoyl chloride[J]. Journal of Chromatography A, 2000, 881(1-2):517-530.
[22] VINCI G, ANTONELLI M L. Biogenic amines: quality index of freshness in red and white meat[J]. Food Control, 2002, 13(8): 519-524.
[23] TRIKI M, JIMéNEZ-COLMENERO F, HERRERO A M, et al. Optimisation of a chromatographic procedure for determining biogenic amine concentrations in meat and meat products employing a cation-exchange column with a post-column system[J]. Food Chemistry, 2012, 130(4): 1 066-1 073.