红景天是在高海拔地区发现的景天科珍稀植物[1],红景天苷(salidroside, SAL)和酪醇(tyrosol, TYR)是所有红景天属植物的主要生物活性成分[2]。由于其具有抗氧化[3]、抗疲劳[4]、抗衰老[5]和适应性[6]等药理作用,被用作食品作物和民间医药。而酪醇和红景天苷含量的高低和抗氧化能力强弱常被作为评价红景天属植物药用价值的指标[7]。
随着酪醇和红景天苷在健康食品、化妆品和制药工业中的需求增加,野生红景天植物被过度开发[8-9]。然而,红景天植物的人工栽培一直受到海拔要求的限制,且种植面积大,生产周期长,活性成分含量低[10-12]。近年来,组织和细胞培养以及化学合成方法已用于SAL和TYR的生产,但这些方法成本高,产量低,对环境污染严重[13-14]。中药的发酵炮制过程实际上是一个生物转化的过程,具有选择性强,反应条件温和,转化效率高,副产物少,有效成分破坏少,毒副作用低,下游处理方便等特点[15-17]。
酪醇的合成途径被认为起源于酪氨酸[18]。微生物转化酪醇及红景天苷靠的是多酶反应,其中酪氨酸脱羧酶作为连接反应中初生代谢与次生代谢之间重要酶类,影响反应的进展与速度[19-20]。
本文利用生物转化的方法合成酪醇,并利用筛选出的菌株发酵红景天,以提高其中的红景天苷含量和抗氧化性。
1 材料与方法
1.1 材料
1.1.1 菌株及培养基
菌株:酵母菌株、乳酸菌菌株,由江南大学实验室保藏。培养基:YPD培养基、MRS培养基;氨基酸脱羧酶选择培养基:蛋白胨5 g/L,酵母浸粉3 g/L,葡萄糖1 g/L,1.6%溴甲酚紫-乙醇溶液1 mL,L-酪氨酸5 g/L,pH 6.8。红景天发酵培养基:红景天粉末50 g/L,KH2PO4 4g/L,尿素4 g/L,(NH4)2SO4 3 g/L,MgSO4 0.25 g/L。
1.1.2 中药及试剂
红景天,无锡市同仁堂药店;酪醇标准品(纯度均为98%)、红景天苷标准品,大连美仑生物技术公司;甲醇、乙腈为色谱纯,其他常用化学试剂均为市售分析纯。
1.2 菌株的筛选
1.2.1 菌种初筛
酪氨酸在酪氨酸脱羧酶的作用下会产生CO2,形成的碱性产物生物胺会使培养基的pH下降,从而使指示剂溴甲酚紫变成紫色[21]。且L-酪氨酸在选择平板中脱羧形成溶于水的产物酪醇,而L-酪氨酸微溶于水,因此在平板上形成透明圈,可以根据透明圈的大小和颜色变化程度来判断微生物转化L-酪氨酸的能力。
1.2.2 复筛
将初筛所得到的菌株接种到50 mL种子液中,培养24 h后按5%(体积分数)接种量接于加入酪氨酸的发酵培养基中,在30 ℃、180 r/min下培养72 h。设置空白对照,不接入菌但加入酪氨酸;将种子液接种到不加入酪氨酸的50 mL的发酵液中,得到菌种对照;发酵3 d后,在4 ℃、10 000 r/min下离心10 min,将上清液旋干后用甲醇沉淀其中的蛋白,离心去除沉淀后再用10 mL甲醇定容,过0.22 μm滤膜,得到待检测的样品。
1.3 转化产物分析
1.3.1 HPLC检测
酪醇标准曲线的绘制:准确称取20 mg酪醇标准品溶于10 mL甲醇中,并依次稀释到质量浓度为50、100、200、400、800 mg/mL。得到标准方程为Y=3.300 1x+3.792,相关系数R2 = 0.997 6。色谱条件及设备:采用SBC-18色谱柱(4.6 mm×150 mm),流动相:A 0.1%磷酸∶B甲醇∶C乙腈=75∶20∶5(V∶V∶V),流速1 mL/min,检测波长276 nm,温度:30 ℃。
1.3.2 液质联用分析
采用HPLC-ESI-MS测定化合物的相对分子量,根据图谱上相对保留时间以及特征碎片离子推断化合物的结构骨架及其断裂方式。
质谱条件:离子方式:ESI-;离子源温度100 ℃;脱溶剂温度400 ℃;毛细管电压3.5 kV;碰撞能量6 V;检测器电压1 800 V;选择离子扫描范围m/z在50~1 500。
1.4 发酵条件优化
酵母菌以YPD为基本培养基,加入蔗糖、麦芽糖、乳糖、葡萄糖、可溶性淀粉等碳源,添加质量浓度分别为15、30、45、60、75 g/L;加入(NH4)2SO4、NH4Cl2、黄豆粉、玉米浆、胰蛋白胨、酵母粉等氮源,添加质量浓度分别为15、30、45、60、75 g/L,测定酪醇的产量,酪氨酸底物添加量为4 g/L。
1.5 应用
1.5.1 红景天发酵
称取红景天2.5 g置于250 mL三角瓶中,加水50 mL,混匀,121 ℃灭菌20 min,即得中药发酵培养基,将所筛选的菌株按接种量(体积分数)10%接种到红景天发酵培养基,酵母菌发酵体系于30 ℃、180 r/min发酵48 h,乳酸菌发酵中药体系于37 ℃恒温静置培养48 h。
1.5.2 总还原力测定
参照AGRAWAL等[22]的方法,略有改动。吸取0.5 mL待测样液,向其中加入0.5 mL 1%铁氰化钾溶液及0.5 mL PBS,混匀并置于50 ℃水浴恒温反应20 min,取出放入冰浴中迅速冷却,再加入0.5 mL 10%三氯乙酸溶液,混匀后离心。取上清液1.0 mL,加入1.0 mL水,再加入1.0 mL 0.1% FeCl3溶液,混匀,室温静置10 min后在700 nm处测定其吸光值,吸光值与待测样品的总还原力呈正相关。
1.5.3 DPPH自由基清除能力测定
参照WANG等[23]方法并加以改进。吸取1.0 mL乙醇溶液,加0.5 mL DPPH自由基乙醇溶液(0.1 mmol/L),加1.0 mL样品溶液,混匀,在室温下避光放置60 min,然后在517 nm下测定吸光度,并计算DPPH自由基清除率[14]。
DPPH自由基清除率![]()
(1)
式中:A0, 溶剂空白管吸光值;Ai,样品管吸光值。
2 结果与分析
2.1 平板初筛
从198株菌株中筛选出80株能使平板变色,并具有菌落透明圈的菌株。其中酵母63株,乳酸菌17株。根据平板变色的时间和深浅初步判断微生物产酪氨酸脱羧酶的能力强弱。试验仅观察平板点种2 d后的平板颜色变化,筛选结果如图1。其中图1-A不能使平板变色,图1-B和图1-C都能使平板变色,图1-C中的菌种长势旺盛,变色范围较1-B图中菌株大。培养2 d后,C图菌株已经能使整个平板变色。初步判断其转化能力较强。
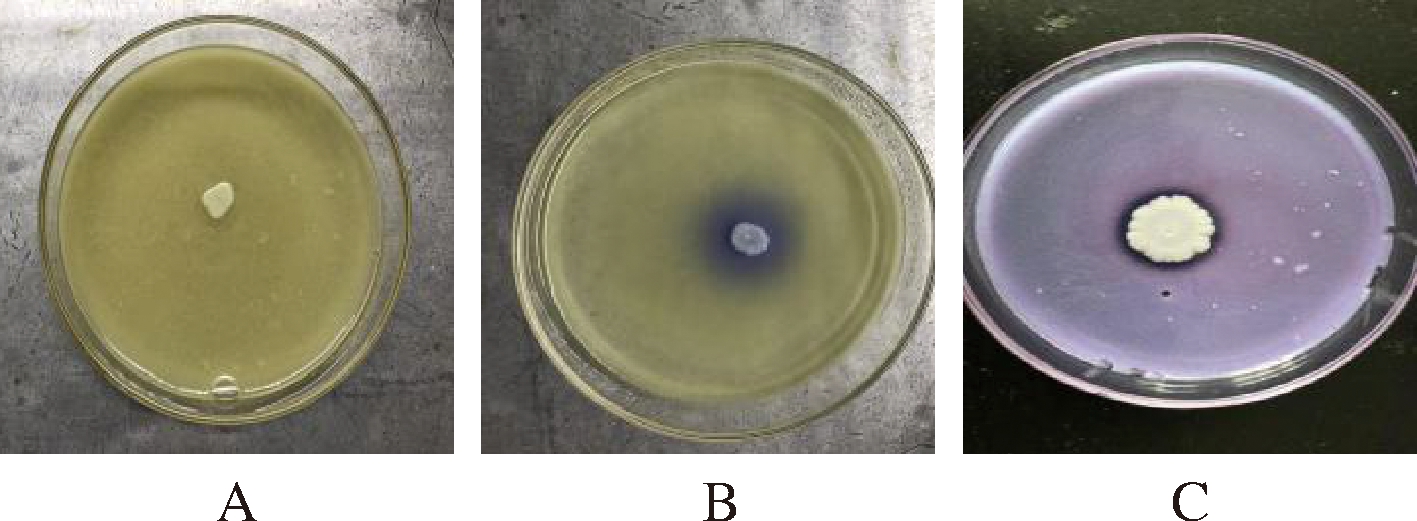
A-不能使平板变色菌株;
B-变色圈小菌株(Y1);
C-变色圈大的菌株(ww0304) 图1 平板筛选转化酪氨酸菌株
Fig.1 Screen screening of transformed tyrosine strains
2.2 HPLC检测
通过高效液相色谱对上述80株菌株是否能够转化成酪醇进行检测分析,其中能够转化成酪醇的有9株,2株为酵母,7株为乳酸菌。并确定了1株转化率最高的菌株WW0304。如图2所示,红景天苷标准品在3.304 min出峰,酪醇保留时间在4.895 min,其中图2-B为空白对照组,即不接入菌种只加入底物酪氨酸,且在4.895 min未检测到吸收峰,而发酵液图2-C和图2-D均在4.895 min处检测到吸收峰,其中图2-D为菌株WW0304发酵液图谱。初步判断该菌能够将底物转化成酪醇和红景天苷。

A-红景天苷标准品;B-空白对照;C-菌株Y1的发酵液;
D-ww0304发酵液;E-酪醇标准品
图2 HPLC对产物的初步鉴定
Fig.2 Preliminary identification of the product by HPLC
2.3 液质联用检测结果
对预处理后的发酵液进行进一步的液质分析,图3为发酵液预处理后在保留时间4.616 min下的一级质谱图。在m/z为137下的离子峰为[M-H]-,m/z为93下的离子峰猜测为离子碎片,为[M-H-COOH]-。

图3 酪醇样品一级质谱图
Fig.3 First-order mass spectrum of tyrosol sample
图4为保留时间4.613 min下的二级质谱图。在能量加大的情况下,物质断裂的更加彻底,137的峰大量断裂。而酪醇上的苯环不易断裂,因此未有新的离子峰出现。
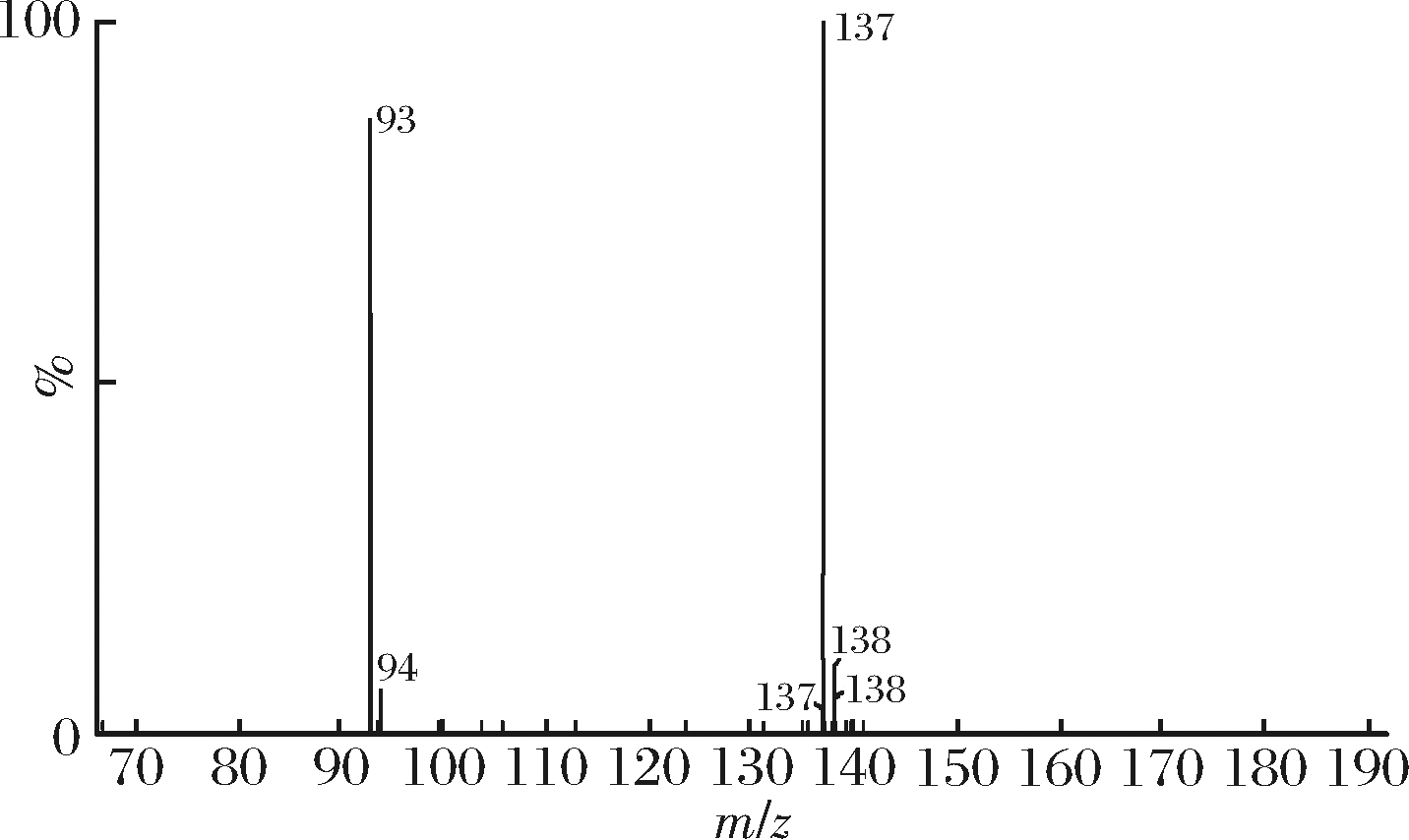
图4 酪醇样品二级质谱图
Fig.4 Secondary spectrum of tyrosol sample
2.4 发酵条件优化
2.4.1 碳源对酪醇产量的影响
碳源对酪醇产量的影响结果如图5所示。当乳糖、淀粉为碳源时,微生物基本不生成酪醇,而当葡萄糖为碳源时,酪醇的产量最高。其原因可能是葡萄糖会促进菌株产酪氨酸脱羧酶,并且对于菌株合成酪醇来说是必不可少的[24]。其中添加质量浓度为20 g/L的葡萄糖,可促使该菌株产酶活性和酪醇的产量最大,为2.3 g/L。
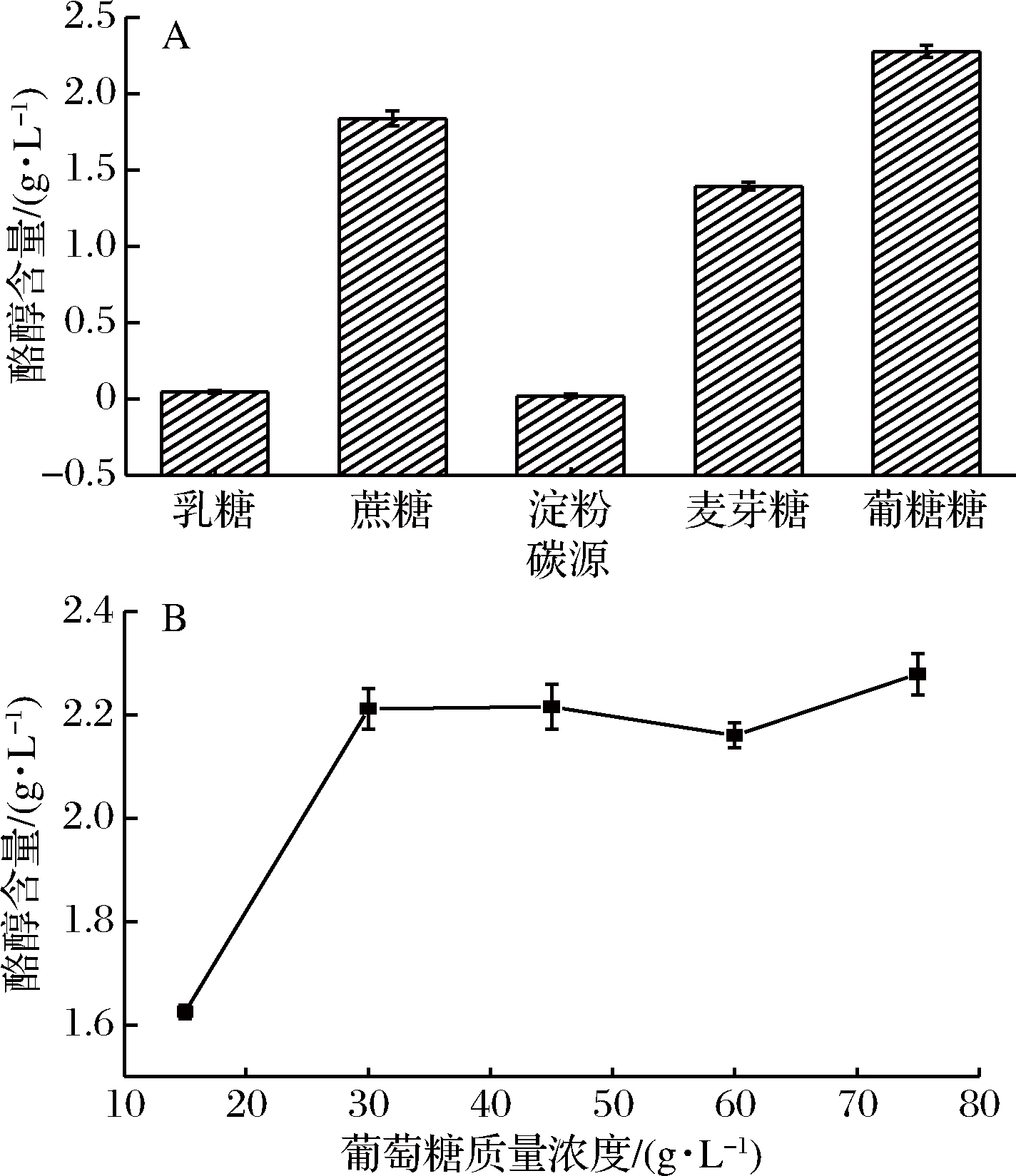
A-不同碳源对酪醇含量的影响;
B-葡萄糖质量浓度对酪醇含量的影响
图5 碳源对酪醇产量的影响
Fig.5 Effect of carbon sources on tyrosol production
2.4.2 氮源对酪醇产量的影响
氮源对酪醇产量的影响结果如图6所示。有机氮源对酪醇的产量有促进作用,当添加质量浓度为30 g/L的玉米浆时,酪醇的产量最高,为2.3 g/L。玉米浆能促进产酶和提高产量,可能是因为其含有大量的维生素和其他微量元素。
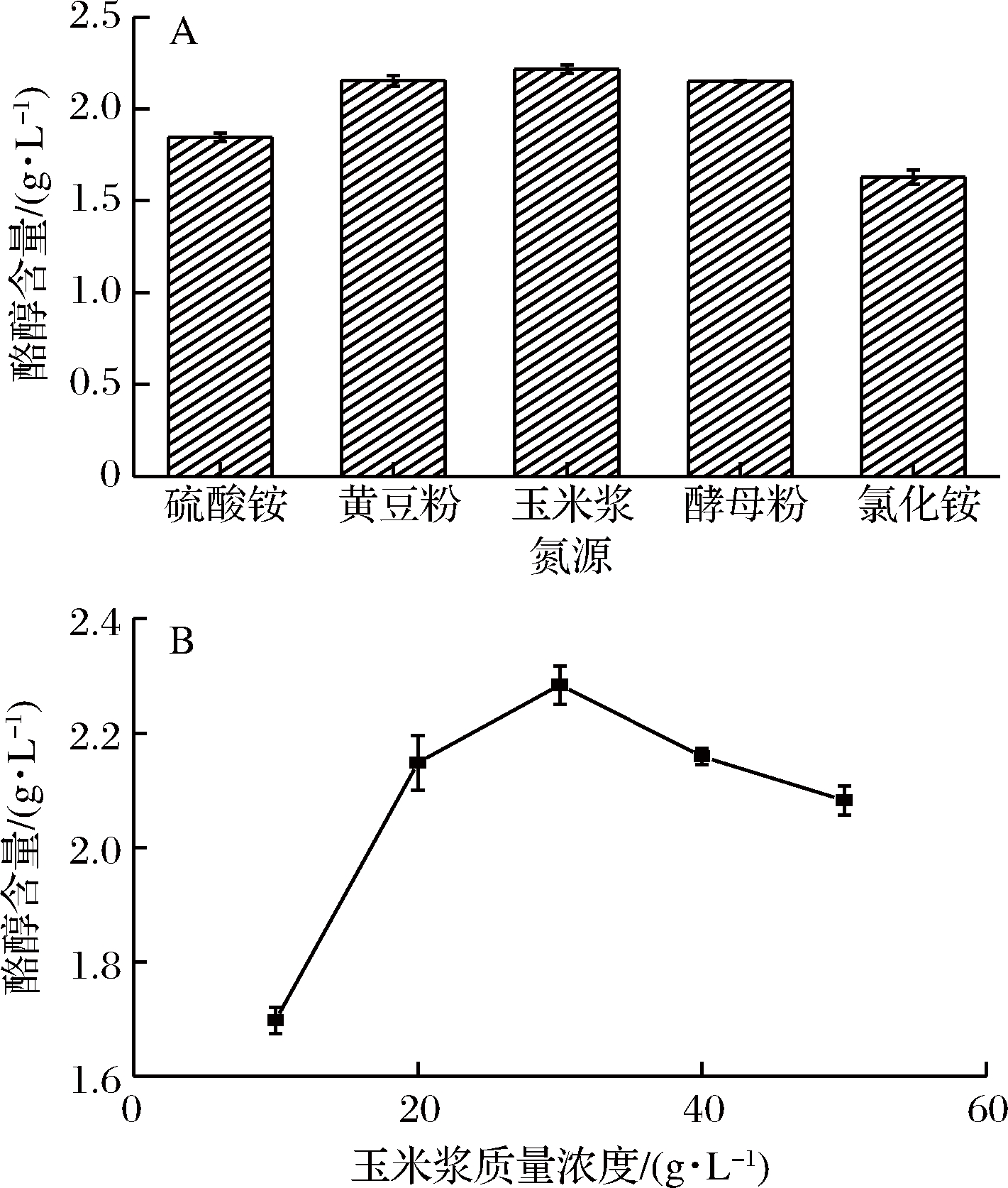
A-不同氮源对酪醇含量的影响;
B-玉米浆浓度对酪醇含量的影响
图6 氮源对酪醇产量的影响
Fig.6 Effect of nitrogen source on tyrosol production
2.5 在红景天发酵中的应用
将9株能够转化酪氨酸的菌株接种到红景天培养基中进行发酵,通过高效液相色谱(图7-A)对其中TRY和SAL进行定量分析。发酵后酪醇和红景天苷含量都得到提高,其中菌株WW0304(图7-B菌株Y2)发酵后总有效成分提高最多,酪醇产量提高235%,红景天苷产量提高了109.9%左右。
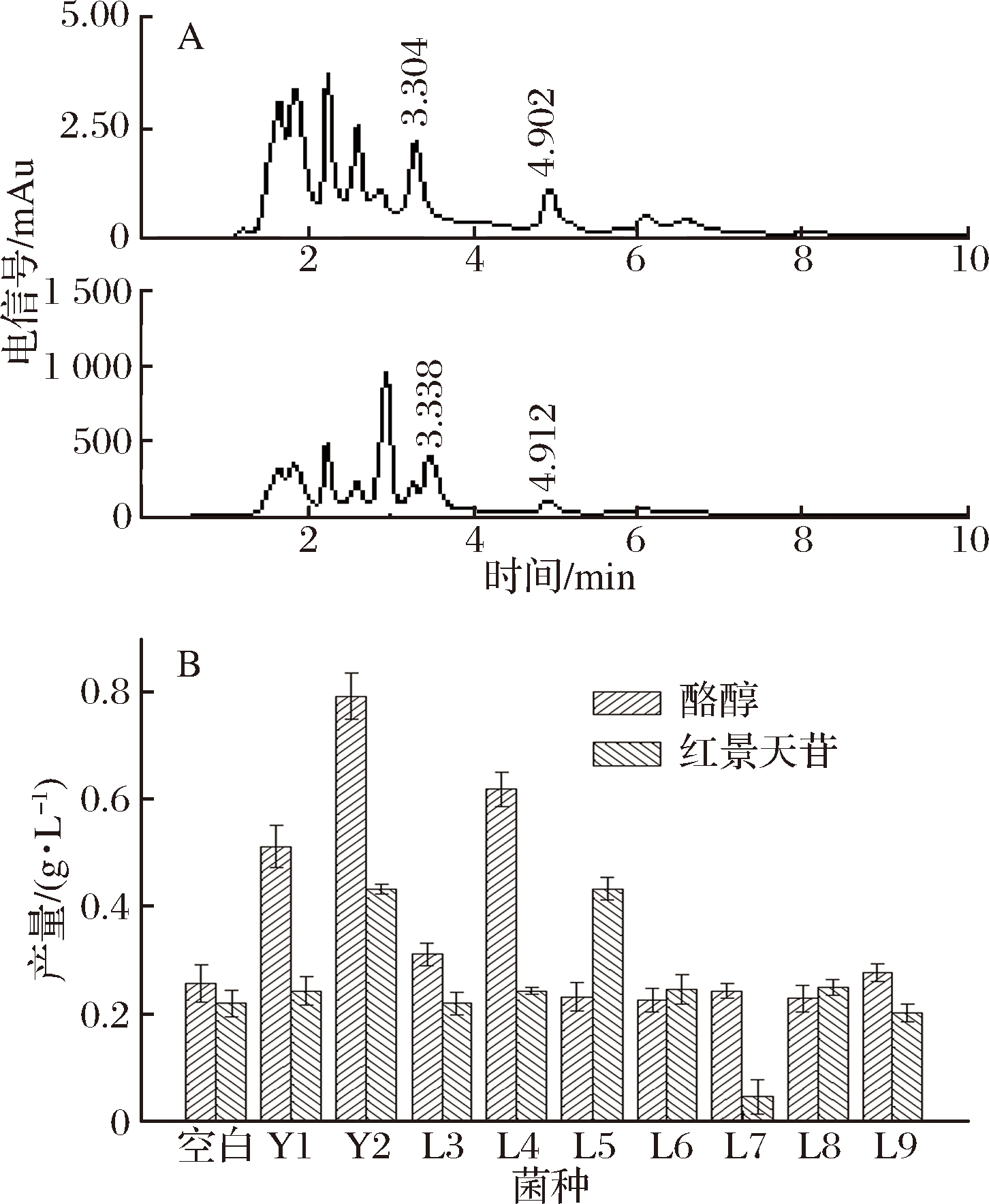
A-发酵液前后液相对比图;B-不同菌种发酵有效成分含量对比
图7 不同菌种发酵液中酪醇和红景天苷含量对比
Fig.7 Comparison of tyrosol and salidroside in fermentation broth of different strains
以维生素C(Vc)作为阳性对照,对红景天水提液及WW0304红景天发酵液的总还原力进行研究(图8)。在不同的质量浓度范围内,红景天发酵液总还原力均明显高于水提液的总还原力。在10.5~52.5 mg/L范围内,相同质量浓度红景天发酵液的总还原力大于Vc溶液的总还原力。
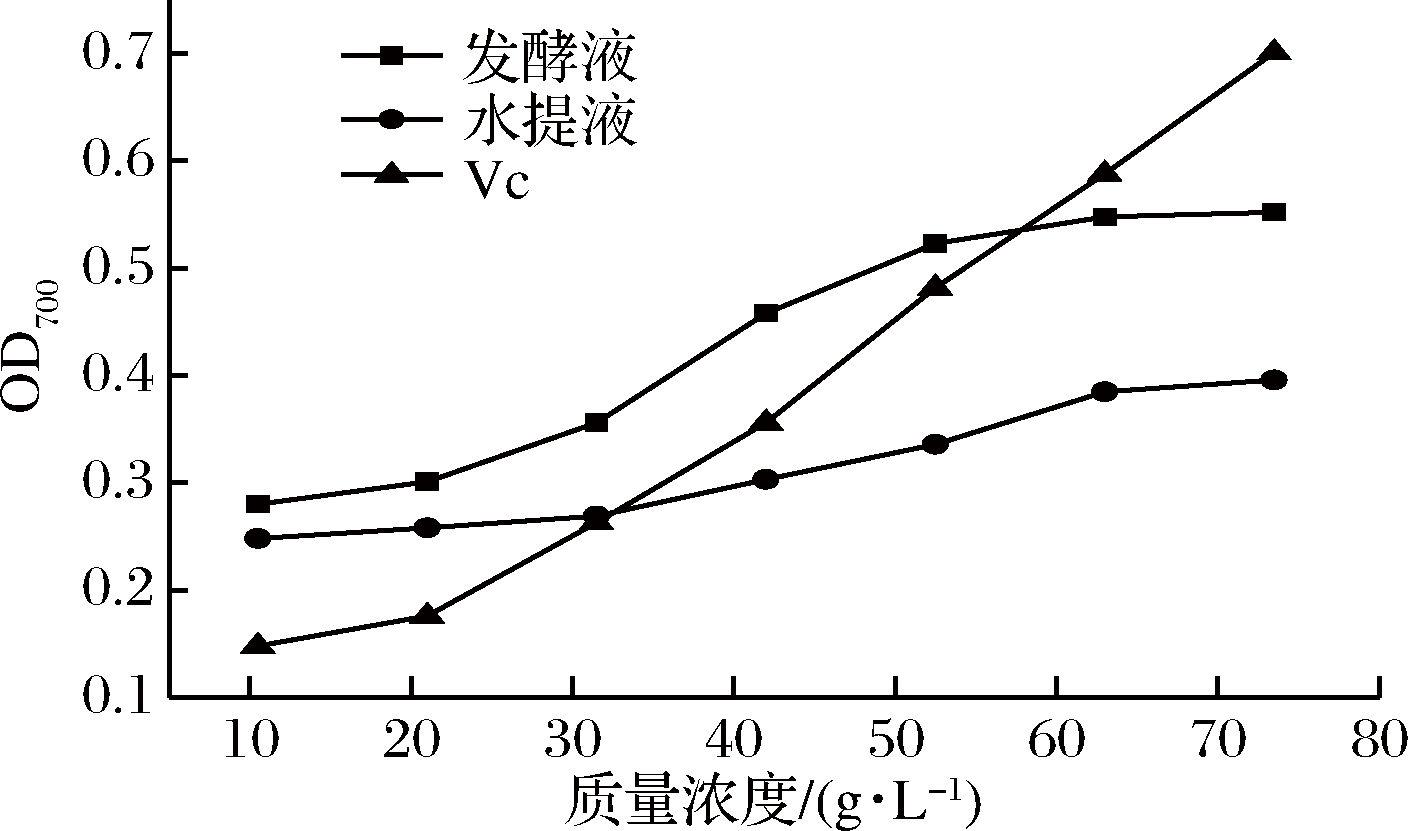
图8 红景天水提液及发酵液还原力对比
Fig.8 Comparison of total reducing power before and after fermentation of Rhodiola
红景天发酵前后的DPPH自由基清除率如图9所示。红景天发酵后其清除DPPH自由基能力增强,抗氧化能力增加。在0.42~1.47 g/L,红景天发酵液的DPPH自由基清除率高于水提液,空白发酵液的DPPH自由基清除能力较差。当质量浓度为0.42 g/L时,发酵液的DPPH自由基清除率为7.98%,而当质量浓度为168 g/L时,红景天发酵液的清除率达到61.01%,在0.42~1.47 g/L随着红景天浓度的增高,DPPH自由基清除能力增强。
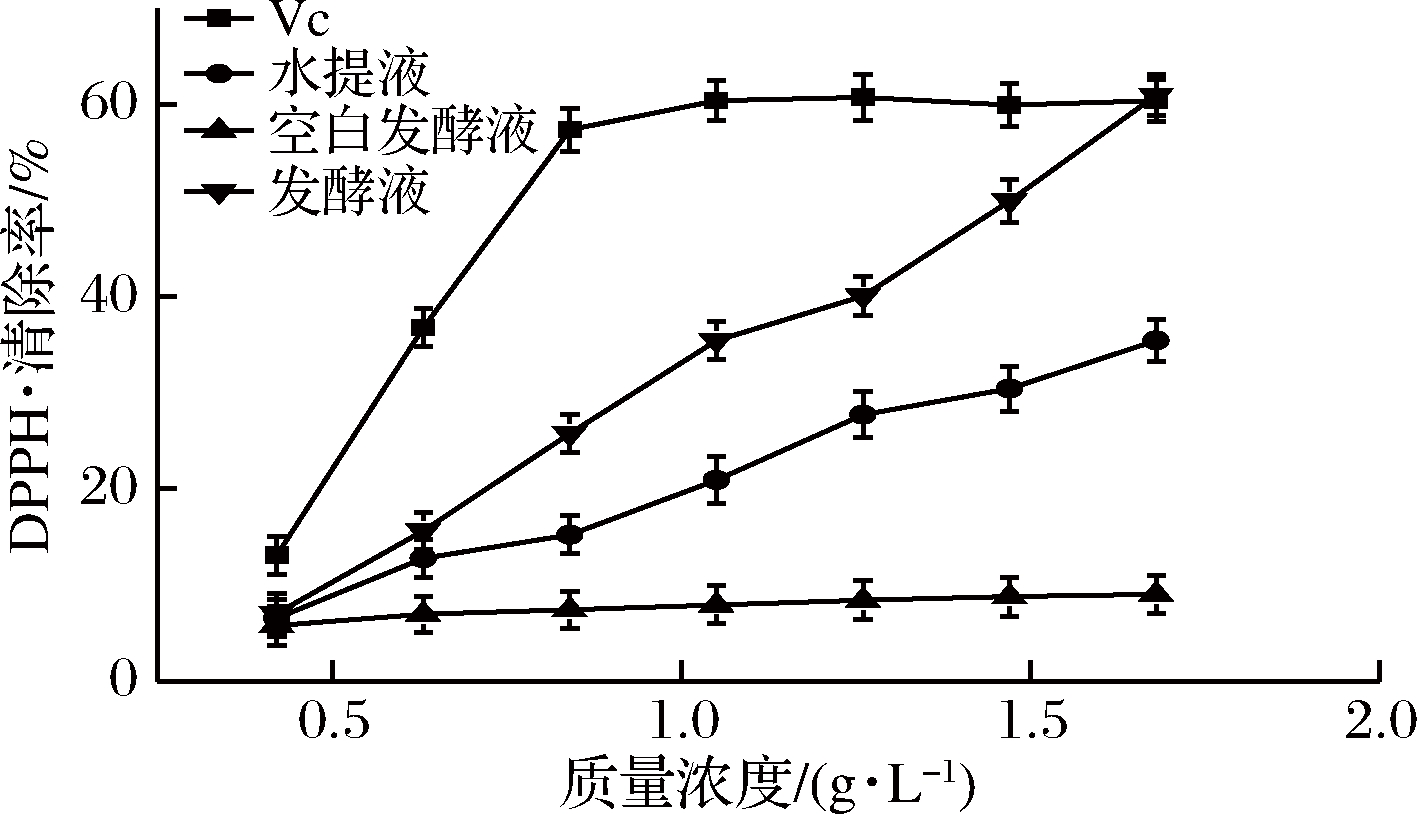
图9 红景天发酵前后DPPH自由基清除率对比
Fig.9 Comparison of DPPH clearance rate before and after fermentation of Rhodiola
3 结论
酪氨酸和红景天苷的微生物转化基于多酶反应,其中酪氨酸脱羧酶在连接反应中作为初级代谢和次级代谢之间的重要酶,影响反应的速度和进程。通过含溴甲酚紫的平板显色试验,筛选出能转化酪氨酸的菌株,并通过摇瓶复筛判定其转化能力。实验确定1株转化率较高的菌株WW0304,以葡萄糖为碳源,玉米粉为氮源,且葡萄糖添加的质量浓度为20 g/L,玉米浆质量浓度为30 g/L时,酪醇产量达到2.3 g/L。最终将筛选到的菌株应用于红景天发酵,酪醇产量由发酵前的0.23 g/L增加为0.78 g/L,提高了235%,红景天苷产量由发酵前的0.21 g/L增加到0.43g/L,提高了109.9%。发酵后的总还原力是发酵前的1.7倍,DPPH自由基清除能力由发酵前的35.45%增加到61.01%。本实验为酪醇的生物合成提供了一种新的思路,并为红景天的开发利用提供了新的方向。
[1] PANOSSIAN A, HAMM R, WIKMAN G, et al. Mechanism of action of Rhodiola, salidroside, tyrosol and triandrin in isolated neuroglial cells: an interactive pathway analysis of the downstream effects using RNA microarray data.[J]. Phytomedicine, 2014, 21:1 325-1 348.
[2] HUNG S K, PERRY R, ERNST E. The effectiveness and efficacy of Rhodiola rosea L.: A systematic review of randomized clinical trials[J]. Phytomedicine, 2011, 18(4):235-244.
[3] CHIANG H M, CHEN H C, WU C S, et al. Rhodiola plants:Chemistry and biological activity[J]. Journal of Food & Drug Analysis, 2015, 23:359-369.
[4] BROWN R P, GERBARG P L, RAMAZANOV Z. Rhodiola rosea: A phytomedicinal overview[J]. Herbalgram, 2002,56:40-52
[5] KELLY G S. Rhodiola rosea: A possible plant adaptogen[J]. Alternative Medicine Review A Journal of Clinical Therapeutic, 2001, 6(3):293-302.
[6] PESCHEL W, PRIETO J M, KARKOUR C, et al. Effect of provenance, plant part and processing on extract profiles from cultivated European Rhodiola rosea L. for medicinal use[J]. Phytochemistry, 2013, 86:92-102.
[7] 李颖, 厍守权,刘刚,等. 发酵红景天中红景天苷的含量测定[J]. 延边大学医学学报, 2013,36(4):270-272.
[8] SCHENCK C A, MAEDA H A. Tyrosine biosynthesis, metabolism, and catabolism in plants[J]. Phytochemistry, 2018, 149:82-102.
[9] 杨欣,曾宪军,丁仁芳,等. 一株红景天内生细菌的筛选及初步研究[J]. 微生物学通报, 2015, 42(10):1 962-1 970.
[10] 纪明江, 李玉锋,杨文韬,等. 红景天苷提取工艺的研究[J]. 药物生物技术, 2014,21(6):554-557.
[11] 冯敏, 蒋春,高雪华,等. 细胞融合构建红景天苷高转化菌株及固态发酵工艺优化[J]. 时珍国医国药, 2010, 21(11):2 868-2 870.
[12] YU H S, MA L Q, ZHANG J X, et al. Characterization of glycosyltransferases responsible for salidroside biosynthesis in Rhodiola sachalinensis[J]. Phytochemistry, 2011, 72(9):862-870.
[13] 许大艳, 康馨元. 红景天中主要成分酪醇的制备[J]. 长春中医药大学学报, 2011, 27(4):669-670.
[14] ZHANG J X, MA L Q, YU H S, et al. A tyrosine decarboxylase catalyzes the initial reaction of the salidroside biosynthesis pathway in Rhodiola sachalinensis[J]. Plant Cell Reports, 2011, 30(8):1 443-1 453.
[15] 张丽霞, 高文远,王海洋. 微生物技术在中药炮制中的应用[J]. 中国中药杂志, 2012, 37(24):3 695-3 700.
[16] NING S U, LIU H M, LIU J, et al. Preparation, efficacy and safety research of fermented Rhodiola liquid cosmetic[J]. Flavour Fragrance Cosmetics, 2017,2:44-48
[17] 宋伟舟, 孙剑峰,刘玉应,等. 双菌株协同发酵提高红景天中苷和酪醇含量的研究[J]. 时珍国医国药, 2010, 21(1):156-159.
[18] TORRENS-SPENCE M P , PLUSKAL, TOM , LI F S, et al. Complete pathway elucidation and heterologous reconstitution of, Rhodiola, Salidroside biosynthesis[J]. Molecular Plant, 2017, 11:1-13.
, LI F S, et al. Complete pathway elucidation and heterologous reconstitution of, Rhodiola, Salidroside biosynthesis[J]. Molecular Plant, 2017, 11:1-13.
[19] 潘立东, 崔香淑. DPPH法对红景天的发酵条件的筛选[J]. 医药前沿, 2014(9):375-376.
[20] 王家明, 闫继平,王盛虔. 红景天的药理作用研究进展[J]. 中医药学报, 2003, 31(4):57-59.
[21] 王雪晶, 谢雪,罗鑫,等. 大株红景天化学成分研究(Ⅰ)[J]. 中草药, 2015, 46(23):3 471-3 474.
[22] AGRAWAL H, JOSHI R, GUPTA M. Isolation, purification and characterization of antioxidative peptide of pearl millet (Pennisetum glaucum) protein hydrolysate[J]. Food Chemistry, 2016, 204: 65-72.
[23] WANG R X, ZHAO Z, ZHONG Y, et al. Synergistic effect of several kinds of whitening agent on inhibition of tyrosinase activity[J]. China Surfactant Detergent & Cosmetics, 2014, 44(10): 572-576.
[24] 宋月英, 韩慧文,郝素云,等. 红景天研究进展[J]. 天津中医药, 2007, 24(1):66-68.