真菌毒素是各种霉菌在适宜的温度、湿度及生长基质上产生的高毒性代谢产物,其中,镰刀菌、青霉、曲霉是产生霉菌毒素的主要霉菌[1]。脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),俗称呕吐霉素,是最常见的真菌毒素之一,属于单端孢霉烯族毒素,主要由禾谷镰刀菌和粉红镰刀菌产生[2]。DON感染农作物时会加重作物赤霉病的发病程度,降低粮食的产量和品质[3];而且具有很强的细胞毒性,即使在DON浓度较低的情况下,长期摄入也会损害人类和动物的健康[4],如发生厌食、呕吐、腹泻、反应迟钝、神经障碍等多种症状[5-7],严重时还可能使造血系统受到损害从而造成死亡[8]。
DON在全世界范围内对粮食的污染都很普遍,特别是在中国、美国、阿根廷等粮食生产区的污染情况更为突出,有的地区其检出含量最高者可达6.496 mg/kg[9]。中国政府规定面粉、大米、玉米等食品中DON的最高限量为1 mg/kg,动物饲料中DON最高限量为5 mg/kg。该毒素是造成粮食污染的重要原因之一,并逐步蔓延至乙醇发酵工业,被污染的粮食谷物经发酵、蒸馏后,大量DON聚集浓缩在发酵糟液中,严重影响了发酵副产品酒糟蛋白饲料(distillers dried grains with soluble,DDGS)的品质[10]。DDGS是一种高营养价值的动物饲料,积累在DDGS中的毒素可通过食物链传递,最终影响动物和人类的健康,因此寻找一种经济有效的DON脱毒方法十分必要。用紫外光照射[11]、臭氧降解[12-13]、微波处理[14]、加压加热[15-16]等方式对DON进行处理,或使用从自然界中筛选的DON降解菌进行生物降解[17],均取得了一定的进展。
ClO2是国际公认的安全、无毒的绿色消毒剂,具有强氧化性及广谱杀菌效力,且不会对环境造成二次污染,无“三致效应”(致癌、致畸、致突变)[18],被广泛地应用于自来水消毒[19-20]、食品保鲜[21]、面粉和纸浆的漂白、医疗灭菌[22]等方面。现已有研究显示,500 mg/L ClO2对黄曲霉毒素B1、玉米赤霉烯酮有较好的降解效果[23],但就ClO2对DON是否具有同样的降解效果,这方面的研究还很少,本文就ClO2对DON纯品及玉米乙醇发酵糟液中的DON的降解效果作了初步研究。
1 材料与方法
1.1 材料与试剂
经发酵蒸馏后的玉米乙醇发酵糟液,取样于四川省资阳市银山鸿展工业有限责任公司酒厂;脱氧雪腐镰刀菌烯醇标准品,美国Sigma公司;色谱甲醇、乙腈,成都蜀都有限公司;ClO2粉末(纯度>98%),北京湘怡源生环保科技有限公司。
1.2 仪器与设备
高效液相色谱系统(Waters 1525-2998PDA),美国Waters科技有限有公司;质谱仪(TSQ Quantum Ultra),赛默飞世纪尔科技有限公司;高速台式冷冻离心机(Centrifuge 5804R),艾本德(Eppendorf)科技有限公司;超声波清洗仪(PS-20),洁康有限公司;Oasis HLB固相萃取柱,沃特世科技(上海)有限公司。
1.3 方法
1.3.1 DON标准储备液及工作液的制备
标准储备液:精确称量5.0 mg的DON标准品于5 mL容量瓶中,色谱甲醇溶解,定容后配制成1.0 mg/mL的DON标准储备液,于0~4 ℃冷藏备用。
标准工作液:将DON标准储备液用超纯水稀释为质量浓度0.10、0.20、0.50、1.00、5.00、10.00、20.00 μg/mL的标准工作液,现配现用。
1.3.2 不同质量浓度ClO2对DON纯品的影响
准确称取25.0 g ClO2粉末于1 L容量瓶中,用超纯水溶解,定容,配制成2 000.0 mg/L的ClO2浓溶液,避光密封保存,备用。
将ClO2浓溶液用超纯水稀释为质量浓度为50.0、100.0、150.0、300.0、600.0、900.0、1 200.0、1 500.0 mg/L的ClO2处理液,并向其中添加DON纯品,使DON的终浓度为5 μg/mL。室温下避光静置处理,并于12、24、36和48 h分别取样检测DON的含量。
1.3.3 ClO2对玉米乙醇发酵糟液中DON的影响
准确称取5.0 g玉米乙醇发酵糟液,向其中加入5 mL质量浓度50.0、100.0、150.0、300.0、600.0 mg/L的ClO2溶液,室温下避光处理12 h。
12 h处理后,加入20 mL V(乙腈)∶V(水)=84∶16提取液,40 ℃恒温下超声提取30 min,8 000 r/min离心5 min,取6 mL上清液于Oasis HLB小柱上样过滤(小柱提前用3 mL甲醇和3 mL去离子水预活化),过滤后用3 mL去离子水淋洗柱,空气抽干小柱,2 mL甲醇洗脱,45 ℃氮气吹干,用1 mL色谱甲醇复溶,经0.22 μm有机滤膜过滤后进样检测。
1.3.4 pH值对DON纯品降解的影响
使用pH计对玉米乙醇发酵糟液以及600.0 mg/L ClO2溶液的pH值进行测定。根据pH值测定结果,将600.0 mg/L的ClO2溶液pH值用1 mol/L的HCl和1 mol/L的NaOH溶液分别调节至3.5、4.5、5.5、6.5、7.5,并向其中添加DON纯品,使DON的终浓度为5 μg/mL。室温下处理12 h,取样检测DON含量。
1.3.5 DON含量的检测
HPLC条件[24]:色谱柱:Waters C18 column(250 mm×4.6 mm, 5 μm);流动相:V(乙腈)∶V(水)=10∶90;柱温:30 ℃;紫外检测波长:218 nm;流速:1.0 mL/min;进样量:20 μL。
质谱条件:扫描模式:负离子场扫描;离子源:电喷雾离子源(ESI);离子源温度:500 ℃;电喷雾电压:4 500 V;雾化气压力:0.28 MPa;气帘气压力:0.21 MPa;辅助气压力:0.28 MPa;扫描范围:m/z 100~600。
1.3.6 统计分析
对于每组处理,均设置3个平行实验,将来自独立重复实验的数据组合并通过平均值±标准偏差计算。使用SPSS软件通过方差分析(ANOVA)和Duncan的多范围检验(P<0.05)分析所有数据。
2 结果与分析
根据标准工作液HPLC检测结果,DON的保留时间为15 min左右,以DON进样浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得到回归方程为Y=18 835x-5 291.1,R2=0.999 9,在0.1~20.0 μg/mL范围类线性关系良好(图1)。
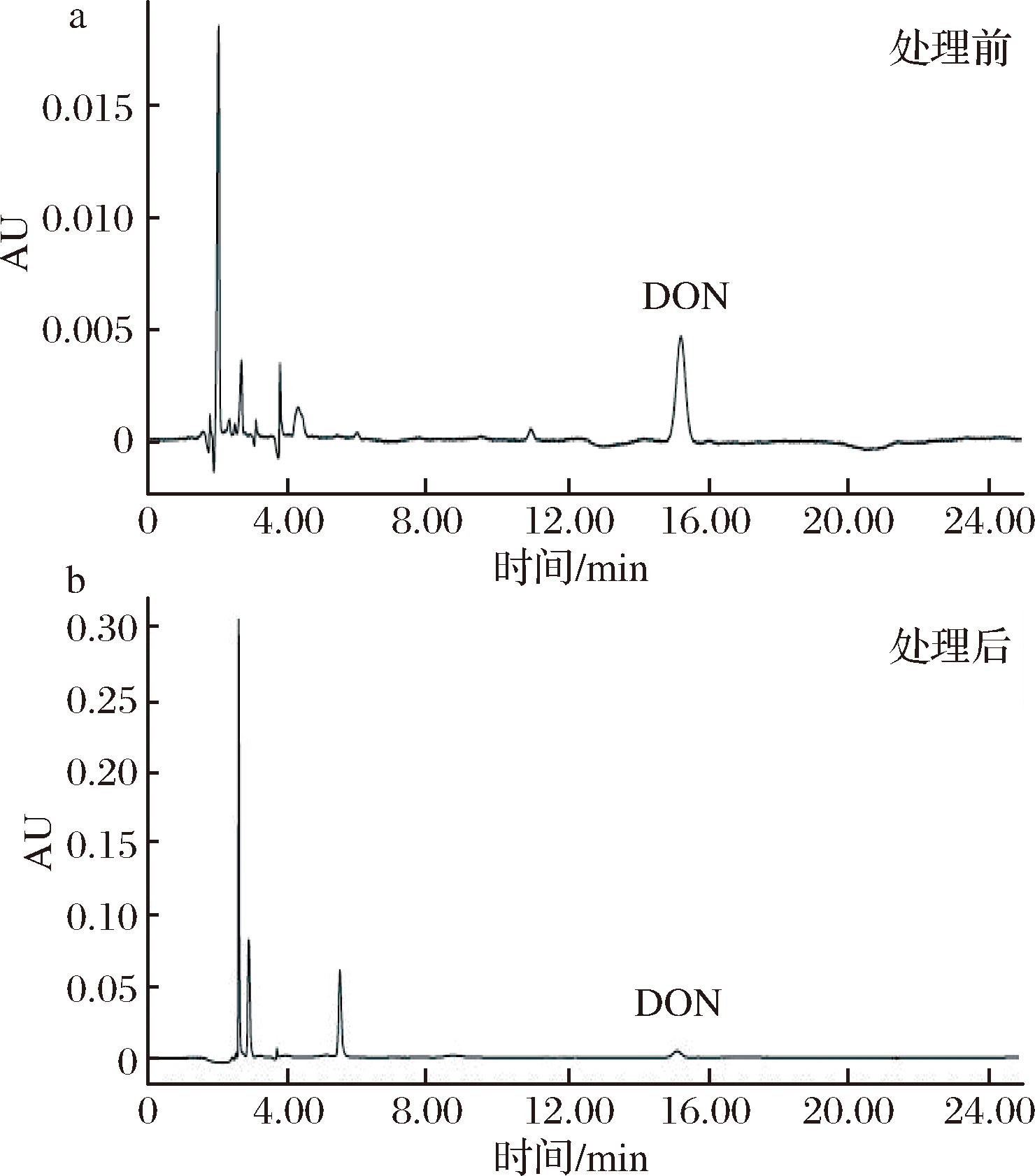
图1 ClO2处理前后的DON纯品HPLC色谱图
Fig.1 HPLC chromatogram of DON pure product before and after ClO2 treatment
2.1 ClO2对DON纯品的影响
用不同浓度ClO2溶液对DON纯品进行处理,DON的降解率随ClO2浓度的提高以及处理时间的延长而提高。如图1-a所示,在处理时间为12 h的条件下,50 mg/L ClO2溶液处理DON纯品,降解率只有2.37%,当ClO2溶液浓度为150 mg/L时,降解曲线斜率最大,降解率增长速度最快,之后逐渐减小,当ClO2溶液质量浓度达到600 mg/L时,降解率为28.23%,当ClO2溶液浓度达到1500 mg/L时,降解率仅为31.97%,降解率增长幅度较小,说明降解曲线逐步趋向平稳,降解率提升缓慢。如图1-b所示,ClO2溶液为质量浓度600 mg/L,处理12 h后降解率为28.23%,处理48 h后降解率提升至38.51%,说明延长时间可以在一定程度上增强对DON的降解效果,但与通过提高ClO2浓度来提高降解率相比,延长时间的效果提升不太明显。因此,综合经济效益及降解效果来看,确定最佳ClO2溶液质量浓度为600 mg/L,处理时间为12 h。

a-处理12 h后不同浓度ClO2对DON的降解;b-不同浓度ClO2在不同处理时间下对DON的降解
图2 不同处理对DON降解的影响
Fig.2 Different treatments on DON
2.2 ClO2对玉米乙醇发酵糟液的影响
由于ClO2的氧化性较强,为了防止过高浓度ClO2溶液以及过长的处理时间影响玉米乙醇发酵糟液的营养成分,结合ClO2对DON纯品的降解效果,选取质量浓度50.0、100.0、150.0、300.0、600.0 mg/L的ClO2溶液对玉米乙醇发酵糟液处理12 h。结果如图3所示,随着ClO2质量浓度的增加,玉米乙醇发酵糟液中DON的降解率逐步提升,当ClO2浓度为100 mg/L时,降解曲线斜率最大;600.0 mg/L的ClO2溶液对其处理12 h后,玉米乙醇发酵糟液中DON含量由13.013 μg/mL降低至7.167 μg/mL,降解率达40.70%,降解效果较好。说明该方法能在一定程度上去除玉米乙醇发酵糟液中的DON。

图3 不同质量浓度ClO2对玉米发酵糟液中DON处理12 h的降解效果
Fig.3 Degradation effect of DON in wet corn distillers
grains by different concentrations of ClO2 for 12 h
注:不同字母表示不同处理组差异显著(P <0.05)。下同。
2.3 pH值对DON纯品降解的影响
根据pH值测定结果显示,600 mg/L ClO2溶液pH值为3.71,而玉米乙醇发酵糟液的pH值为4.82。本文研究了pH值对DON降解的影响实验,结果如图4所示,当DON所处环境溶液pH值小于4.5或大于5.5时,降解率偏低;当DON所处环境溶液pH值为4.5~5.5时,降解效果最佳,降解率最高可达36.78%,但仍低于玉米乙醇发酵糟液中40.70%的DON降解率,说明pH值确实对DON的降解有一定的影响,但pH值不是导致ClO2溶液对玉米发酵糟液中DON的降解效果较好的唯一原因。
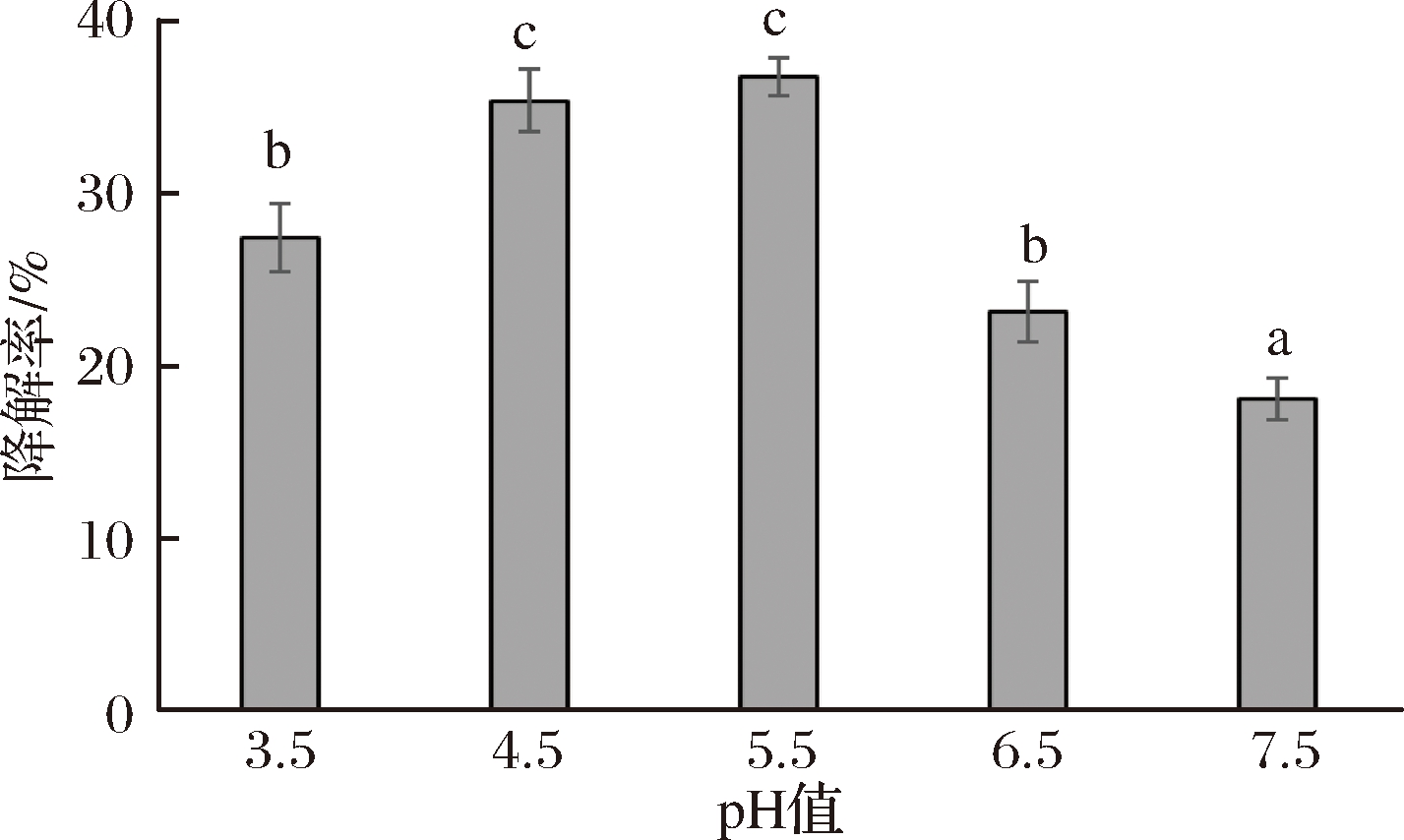
图4 pH值对DON纯品降解的影响。
Fig.4 Degradation effect of pure DON in different pH
2.4 降解产物的初步分析
图5的HPLC-MS图谱所示,DON的质荷比为295.17,经600 mg/L ClO2溶液对DON纯品处理12 h后,DON的相对丰度降低,并产生了2种质荷比为238.96和380.90的新物质,推测应该是DON的降解产物。一般情况下,氧环键的化学性质较为活泼,容易断键开环。YOUNG等[25-26]的研究表明,用强氧化剂O3处理单端孢霉烯族毒素时,O3首先攻击单端孢霉烯族毒素分子的双键部位,并且此氧化作用的效果与C8位上的基团有很大关系,当C8位是酮基时,所需O3的量更少。ClO2具有与O3分子类似的SP2杂化轨道和“V”型分子构型,其在发挥强氧化作用时,很有可能出现与O3类似的降解情况[27]。如图5所示,首先ClO2与DON的双建结构发生反应,形成ClO2-DON中间复合物,最后DON在双键处开环降解。此外,在酸性条件下,强氧化剂可以将环己酮氧化为己二酸[28],ClO2水溶液、玉米乙醇发酵糟液均显示为酸性,在强氧化剂ClO2作用下也可能在酮基处开环形成新的降解产物(图6-d)。
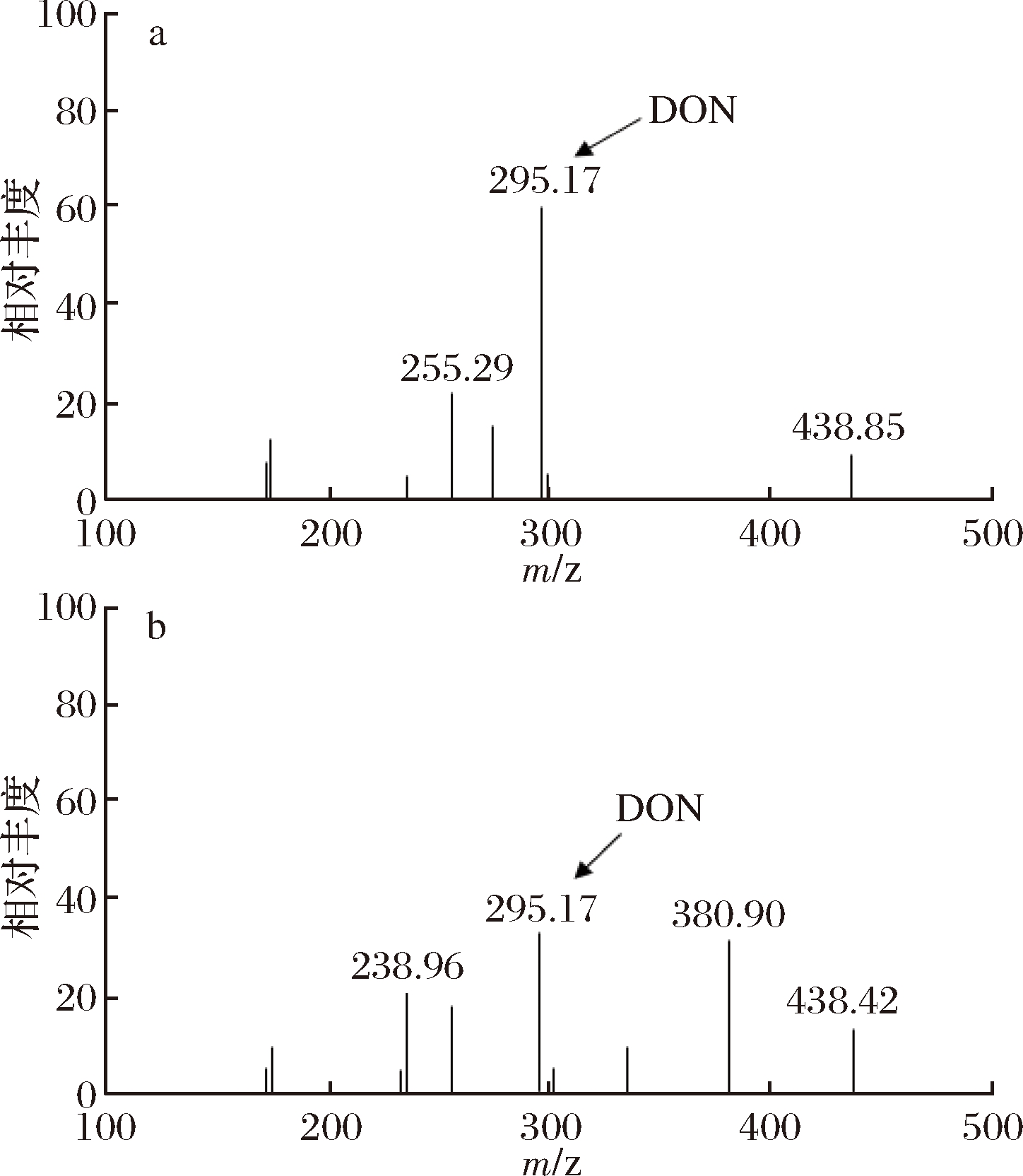
a-降解前;b-降解后
图5 经600 mg/L ClO2处理DON纯品的HPLC-MS图谱分析
Fig.5 HPLC-MS analysis of DON treated with 600 mg/L ClO2
3 结论与讨论
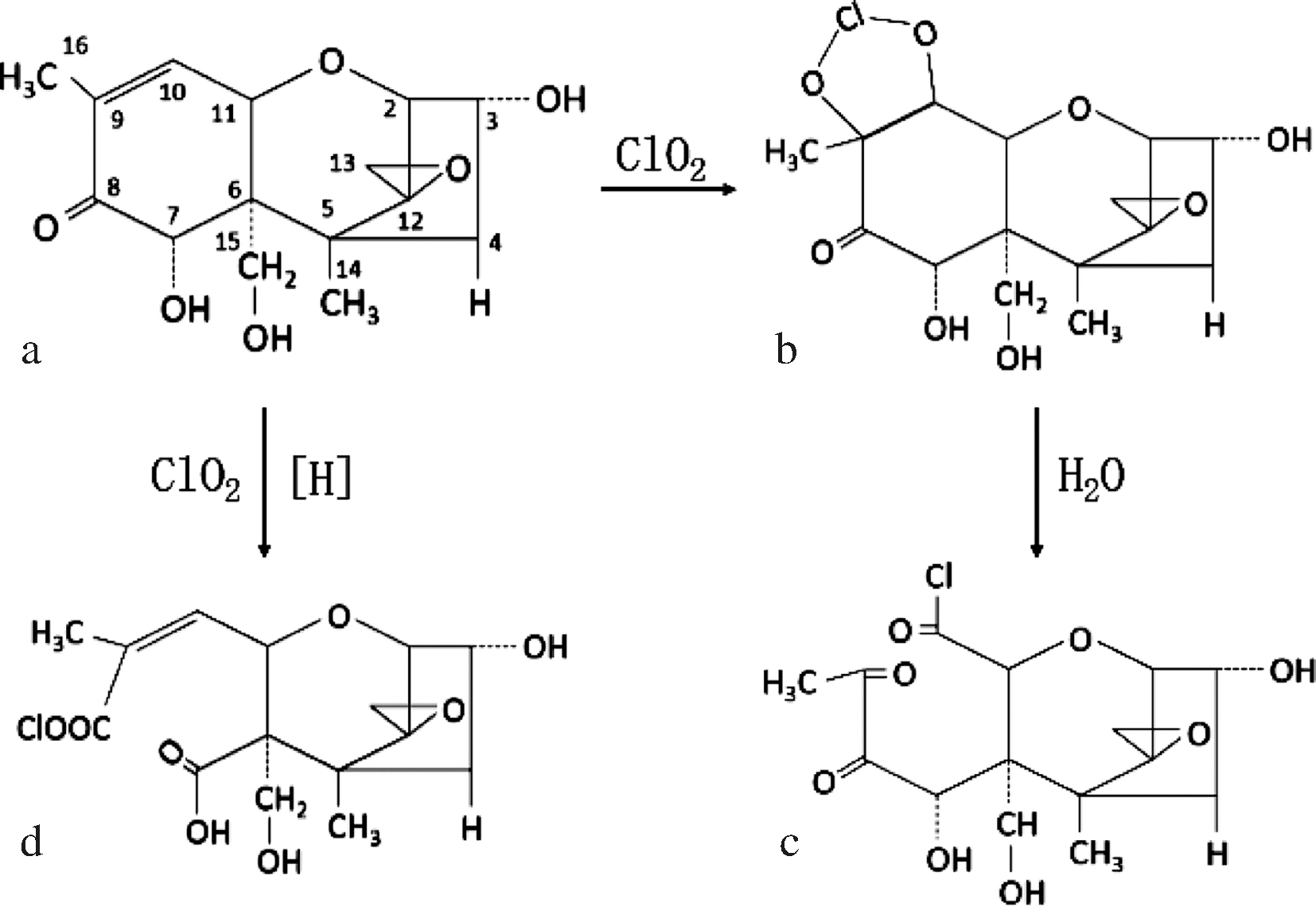
a-DON分子结构;b-ClO2-DON复合物;c-DON碳碳双键处开环降解产物;d-DON酮基处开环降解产物
图6 ClO2处理DON降解产物分析
Fig.6 Analysis of DON degradation products by ClO2 treatment
实验结果表明,ClO2的确对DON有一定的降解效果,结合ClO2对DON纯品以及玉米乙醇发酵糟液的降解情况来看,提高ClO2浓度比延长处理时间的降解效果更佳,ClO2质量浓度为0~600 mg/L时,DON降解率随ClO2浓度提升而提高,之后降解率提升缓慢并逐步趋于稳定。值得注意的是,处于玉米乙醇发酵糟液的环境下,DON的降解效果也较好,推测是玉米乙醇发酵糟液中某种条件促使DON的化学键处于活泼状态,使其容易开环降解,实验结果表明,当DON所处环境pH值为4.5~5.5时,降解率最高,YOUNG[26]的研究表明,当pH值为4~6时,O3对DON氧化效果更好;常晓娇等[23]的研究也显示,pH 7的中性样品中ZEN的降解情况优于pH 3的酸性样品。此外,玉米乙醇发酵糟液中可能含有更活泼的电子接受者,能及时与断开的键结合,防止断开的键复原,以提高降解效果。本文为大规模去除DON提供了一种新的思路,但目前仅ClO2对DON的降解做了初步研究,其中的降解原理以及降解产物的具体结构,还有待进一步研究。此外,二氧化氯具有广泛的氧化作用,可能会降低玉米乙醇发酵糟液中的营养,因此将该DON去毒方法应用到实际中还需要一段时间。
[1] STOEV S D. Foodborne mycotoxicoses,risk assessment and underestimated hazard of masked mycotoxins and joint mycotoxin effects or interaction [J].Environmental Toxicology and Pharmacology,2015,39(2): 794-809.
[2] LARSEN J C, HUNT J, PERRIN I, et al. Workshop on trichothecenes with a focus on DON: summary report [R]. Toxicolgy Letters, 2004, 153(1): 1-22.
[3] HEYNDRICKX E, SIOEN I, HUYBRECHTS B, et al. Human biomonitoring of multiple mycotoxins in the Belgian population: Results of the BIOMYCO study[J]. Environment International, 2015, 84(2): 82-89.
[4] VIDAL A, CANO-SANCHO G, MARINA S, et al. Multidetection of urinary ochratoxin A, deoxynivalenol and its metabolites: pilot time-course study and risk assessment in Catalonia, Spain [J]. World Mycotoxin Journal, 2016, 9(4):1-16.
[5] MURI S D, VANDER V H, BOON P E, et al. Comparison of human health risks resulting from exposure to fungicides and mycotoxins via food [J]. Food and Chemical Toxicology, 2009, 47(12): 2 963-2 974.
[6] PESTKA J J. Mechanisms of deoxynivalenol-induced gene expression and apoptosis [J]. Food Additives and Contaminants, 2008, 25(9): 1 128-1 140.
[7] GRAZIAN F, PUJOL A, NICOLETTI C, et al. The food-associated ribotoxin deoxynivalenol modulates inducible NO synthase in human intestinal cell model [J]. Toxicological Sciences, 2015, 145(2): 372-382.
[8] PESTKA J J, SMOLINSKI A T. Deoxynivalenol: Toxicology and potential effects on humans[J]. Journal of Toxicology and Environmental Health, Part B, Critical Reviews, 2005, 8(1): 39-69.
[9] GUAN S, WANG J Y, LIU S, et al. Occurrence of mycotoxin in Chinese feed and raw materials during 2013 [C]. Collected Papers of International Mycotoxin Conference, 2014.
[10] PIACENTINI K C, ROCHA L O, FINTES L C, et al. Mycotoxin analysis of industrial beers from Brazil: The influence of fumonisin. B1 and deoxynivalenol in beer quality [J]. Food Chemistry, 2017, 218: 64-69.
[11] 邹忠义,黄雯,李洪军. 紫外光辐射对脱氧雪腐镰刀菌烯醇和T-2毒素的去除作用[J]. 食品科学, 2015, 36(19): 7-11.
[12] LU M M, GUAN E Q, BIAN K. Effect of ozone treatment on deoxynivalenol and quality evaluation of ozonised wheat[J]. Food Additives & Contaminants, 2015, 32(4):544-553.
[13] SUN Chao, JI Jian, WU Songling, et al. Saturated aqueous ozone degradation of deoxynivalenol and its application in contaminated grains [J]. Food Control, 2016, 69:185-190.
[14] PARK B J, TAKATORI K, SUGITA K Y, et al. Degradation of mycotoxins using microwave-induced argon plasma at atmospheric pressure [J]. Sueface & Coatings Technology, 2007, 201(9): 5 733-5 737.
[15] CHARLENE E W, LLOYD B B. Heat and pH alter the concentration of deoxynivalenol in an aqueous enviroment [J]. Food Protection, 1998, 61(3): 365-367.
[16] MISHRA S, DIXIT S, DWIVEDI P D, et al. Influence of temperature and pH on the degradation of deoxynivalenol (DON) in aqueous medium: comparative cytotoxicity of DON and degraded product[J]. Food Additives & Contaminants Part A Chemistry Analysis Control Exposure & Risk Assessment, 2014, 31(1):121-131.
[17] 程亮,伍松陵,沈晗,等.脱氧雪腐镰刀菌烯醇降解菌的筛选及鉴定[J].粮油食品科技, 2013, 21(5): 95-97.
[18] 阪田总一郎. 二氧化氯消毒杀菌体系的特征及在食品制造现场的应用[J]. 中国洗涤用品工业, 2016, 1:12-18.
[19] SZABO J, MINAMYER S. Decontamination of biological agents from drinking water infrastructure: a literature review and summary [J]. International Journal of Environmental Research and Public Health, 2014, 72: 119-123.
[20] 马骏,晋日亚,郑璐,等.气体二氧化氯对谷物表面黄曲霉杀菌效果研究[J].粮食与油脂, 2015, 28(6): 63-65.
[21] 耿鹏飞,高贵田,薛敏.气体二氧化氯在果蔬杀菌保鲜方面的研究与应用[J].食品工业科技, 2014, 35(6): 387-391.
[22] ERICKSON M C, ORTEGA Y R. Inactivation of protozoan parasites in food, water, and environmental systems [J]. Journal of Food Protection, 2006, 69(11): 2 786-2 808.
[23] 常晓娇,王军,孙长坡,等.原代霉菌毒素中二氧化氯降解的研究[J].中国粮油学报,2016, 31(9): 113-118.
[24] GB/T 23503—2009,食品中脱氧雪腐镰刀菌烯醇的测定免疫亲和层析净化高效液相色谱法[S].北京:中国标准出版社,2005.
[25] YOUNG J C, ZHU Honghui, ZHOU Ting. Degradation of trichothecene mycotoxins by aqueous ozone [J]. Food and Chemical Toxicology, 2006, 44(3): 417-424.
[26] YOUNG J C. Reduction in levels of deoxynivalenol in contaminated corn by chemical and physical treatment [J]. Journal of Agricultural and Food Chemistry, 1986, 34(3): 465-467.
[27] CHAENKO N V, KORNIENKO G V, SOKOLENKO V A, et al. Redox-mediated oxidation of cyclohexanone to adipic acid on oxide-nickel anode, with active forms of oxygen involved [J]. Russian Journal of Applied Chemistry, 2014, 87(4): 444-449.
[28] 邢其毅. 基础有机化学[M]. 第四版.北京:北京大学出版社,2016.