副溶血性弧菌(Vibrio parahaemolyticus,VP)是一种嗜盐性细菌,又称肠炎弧菌,广泛分布于海水和盐水湖等含盐水域,来源于鱼、虾、贝类等海产品[1-2]。其具有条件致病性,可引起食物中毒,是一种重要的食源性病原微生物,会导致以腹泻、肠痉挛等为主要症状的急性肠胃炎,严重时可引发败血症导致死亡,尤其是在夏秋季节[3-6]。除了已报道的溶血素TDH、TRH和肠毒素等致病因子的作用外,生物膜的形成也能够增强菌株的致病性[7-9]。作为水产品的主要致病菌,副溶血性弧菌在正常的少盐环境中难以存活,但是其引发食物中毒的事件仍频频发生[10],这与细菌在逆境条件下的生物膜形成有关。研究表明,即使食品加工过程中经过严格的清洗消毒工序,在食品接触表面还可能残留微生物并形成生物膜[11-12]。
生物膜(biofilm,BF)是微生物细胞附着在载体表面,通过分泌产生的胞外多聚物(extracellular polymeric substances,EPS),主要是一些胞外多糖、胞外纤维蛋白和脂蛋白等物质,将自身包裹其中而形成细菌聚合物,可以增强微生物细胞对不良环境的抵抗和耐受能力,造成极大的食品安全隐患[13]。同时,生物膜的形成对微生物的抗生素耐受性也具有一定的促进作用,研究表明,副溶血性弧菌具有广谱耐药性,对阿莫西林等抗生素的平均耐药性较其他细菌高50%[14],其耐药性的产生与生物膜形成有关。据报道,细菌以生物膜形式存在时,耐药性可增加10~1 000倍[15],这由于生物膜形成的胞外聚合物将抗生素与微生物细胞隔离,减缓其进入胞内的速度。除了改变微生物细胞对环境的抗逆性外,生物膜的清除难度也促进了微生物的生长繁殖,加重了细菌污染,目前还没有抑制生物膜形成的有效方法。而表面活性剂作为一类两性化合物,既含有亲水基团,又含有疏水基团,其表面带有电荷,与带负电的生物膜相互作用,会影响胞外聚合物的结构和功能,从而影响生物膜的形成[16]。
目前,关于细菌生物膜的形成机制研究,多集中于大肠杆菌和铜绿假单胞菌等模式生物,副溶血性弧菌生物膜的形成特性及其防控措施鲜有报道。因此,本文通过对盐浓度、pH值和几种不同类型的表面活性剂对副溶血性弧菌生物膜形成的作用分析,确定副溶血性弧菌生物膜的形成条件,并综合分析不同类型的表面活性剂对生物膜形成的抑制特性,为副溶血性弧菌的生物膜防治提供理论依据。
1 材料与方法
1.1 材料与仪器
实验菌株:副溶血性弧菌ATCC17802,本实验室保藏;
培养基:胰蛋白胨大豆肉汤培养基(TSB)、硫柠胆蔗琼脂培养基(TCBS),杭州百思生物技术有限公司。
其他相关试剂:胰蛋白胨、琼脂粉、NaCl、酵母粉、葡萄糖、硫酸、苯酚、十二烷基硫酸钠(SDS)、聚乙烯吡咯烷酮(PVP)、柠檬酸二铵,上海国药集团化学试剂有限公司。
仪器:ZQZY-BG摇床,上海知楚仪器有限公司;1510全波长酶标仪,赛默飞世尔(上海)仪器有限公司。
1.2 实验方法
1.2.1 培养基的配制
TSB培养基:溶解30 g粉末于1 000 mL水中,调节到不同pH值,分装,121 ℃灭菌20 min。
1.2.2 副溶血弧菌的活化培养及菌液制备
从TSB斜面培养基上挑取适量菌体,转接至5 mL 3% NaCl的TSB液体培养基中,37 ℃恒温振荡培养12~16 h,再移取200 μL培养菌液至新鲜的5 mL 3%NaCl TSB培养基中,培养12~16 h。
1.2.3 微孔板法
以有盖的无菌24孔细胞培养板进行菌株生物膜的培养,每孔中先加入2.5 mL新鲜TSB培养基,再接入500 μL菌液,平行3次。并以TSB培养基作阴性对照。37 ℃培养72 h后,缓缓移去孔中的培养物,并且每孔用蒸馏水清洗2~3次,晾干后加入3 mL 0.1%结晶紫溶液进行染色,室温静置20 min,倒掉染色剂后再以蒸馏水清洗2~3次,洗去浮色,倒置晾干20 min,除去残余水分,再加入2 mL 33% 乙酸脱色 10 min,并测定OD570nm值。
通常采用OD570nm值来反映生物膜与接触面黏附的牢固程度,为了实验结果的比较分析,以阴性对照孔的平均值加上3倍标准差为界定值(ODC),可对生物膜进行分类:OD≤ODC为无黏附(-),ODC
1.2.4 培养基pH值和NaCl含量对副溶血性弧菌成膜的影响
配制不同质量分数(0、1%、3%、5%)的NaCl溶液和不同pH值(6、7、8、9)的TSB培养基,平行3次,37 ℃培养72 h后,按照方法1.2.3进行实验。
1.2.5 培养温度对副溶血性弧菌成膜的影响
在确定培养基pH值和NaCl含量对菌株成膜性能的前提下,分别在不同温度条件下(4、25、37 ℃)进行菌株的成膜培养,平行3次,按照方法1.2.3进行实验。
1.2.6 不同表面活性剂对副溶血性弧菌成膜的影响
分别配制十二烷基硫酸钠(SDS)、聚乙烯吡咯烷酮(PVP)和柠檬酸二铵母液,然后在24孔中分别加入不同质量浓度的上述3种表面活性剂(表1),将孔板在37 ℃下静置培养72 h,测定OD570nm值,如式(1)所示。
促进率![]()
(1)
表1 不同表面活性剂的终质量浓度
Table 1 Final concentrations of different surfactants

名称加入培养基后终质量浓度/(mg·L-1)SDS02004006008001 0002 000PVP02004006008001 0002 000柠檬酸二铵02004006008001 0002 000
1.2.7 SDS对副溶血性弧菌生长的影响
采用96 孔板测定SDS的最小抑菌浓度(minimum inhibitory concentration,MIC),分别在96孔板中加入SDS母液与培养基混合至终浓度,见表1,每个孔板接10 μL菌液,37 ℃静置培养24 h,以不加SDS的培养基作对照,测定OD600nm值。
1.2.8 葡萄糖标准曲线的绘制
分别吸取葡萄糖标准液0、200、400、600、800 μL,分别置于25 mL比色管中,准确补水至2 mL,加入苯酚2 mL,混匀1 min,小心加入浓硫酸10 mL,再混匀1 min,置沸水浴15 min,冷却后测定OD490nm的值,并绘制葡萄糖标准曲线,如图1所示。
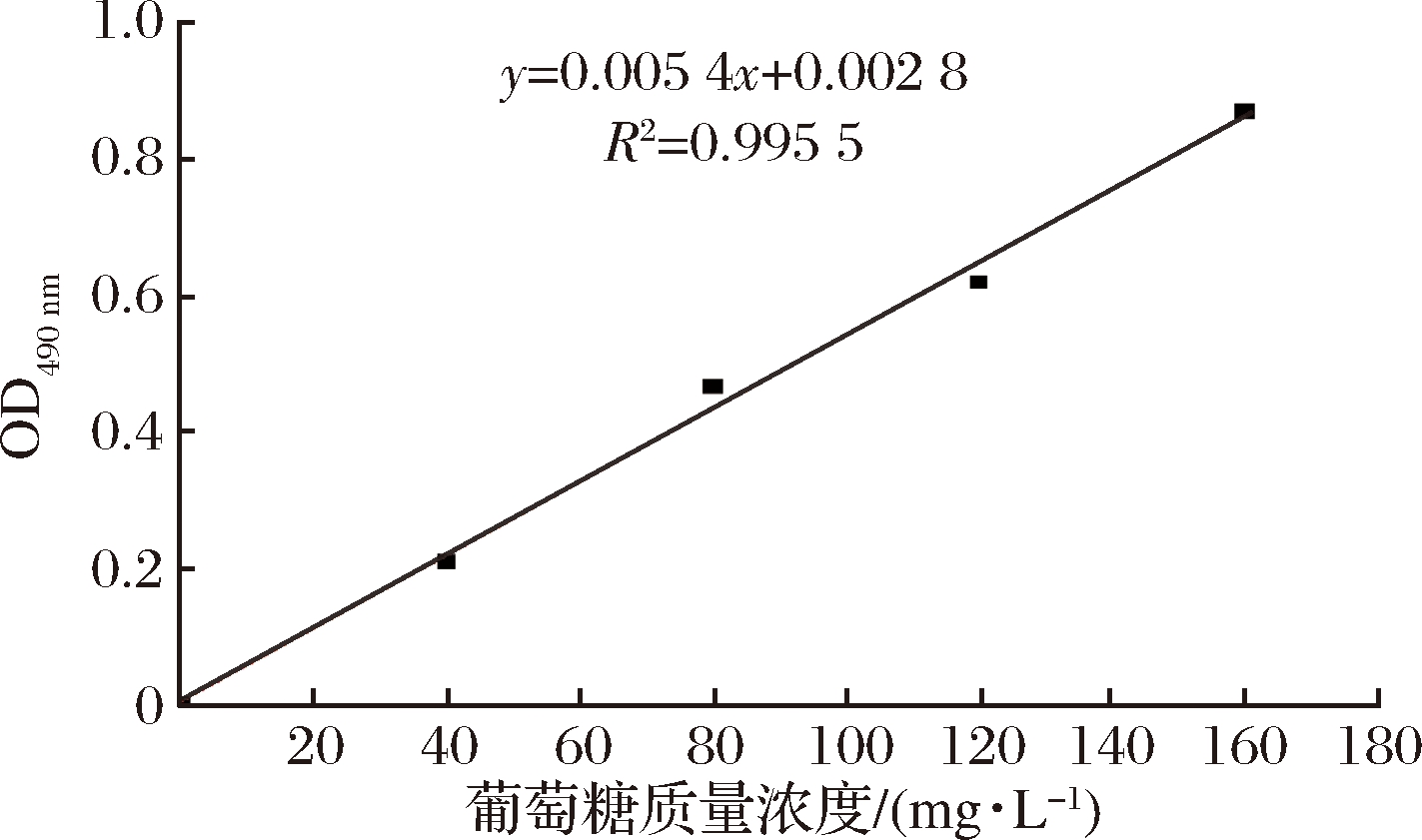
图1 葡萄糖标准曲线
Fig.1 Glucose standard curve
1.2.9 胞外多糖的测定
吸取10 mL培养液至50 mL离心管中,离心取上清液,加入等体积的无水乙醇,混匀5 min,4 000 r/min离心15 min,弃去上清,沉淀用10 mL水溶解,吸取2 mL按照1.2.8的方法测定OD490nm值,从标准曲线中读取葡萄糖含量,计算样品中胞外多糖的的质量浓度[18]。
2 结果与分析
2.1 pH值和NaCl质量分数对副溶血性弧菌生物膜形成的影响
由表2可知,在不同的培养基、pH值及NaCl质量分数条件下,副溶血性弧菌的成膜特性具有明显差异,只有在特定条件下才能够形成生物膜。其中,在NaCl质量分数为1%时,pH 6和pH 7的条件下以及NaCl质量分数5%、pH 8的条件下均能形成中等黏附的生物膜。在NaCl质量分数3%、pH 9的条件下能形成强黏附性生物膜,可能是因为该条件为副溶血性弧菌的培养最佳条件,其菌浓达到最高,大大促进了其生物膜的形成。其他盐浓度和pH条件下的生物膜无黏附。
表2 不同pH值和NaCl含量下副溶血性弧菌生物膜的形成
Table 2 Formation of VP biofilms at different pH valuesand salt concentrations

NaCl质量分数/%pH值67890- (0)-(0)-(0)-(0)1++(1.022)++(1.050)-(1.072)-(1.207)3-(1.243)-(1.297)-(1.249)+++(1.440)5-(0.959)-(1.135)++(1.143)-(1.200)
注:括号中为测定生物膜时的3组平行实验的平均菌浓OD600nm。
细菌生物膜的形成包括定殖、成熟和脱落释放等过程,定殖阶段涉及细胞对介质的黏附以及细胞间的黏附等,与细胞膜的特性有关。副溶血性弧菌是一类阴性嗜盐菌,对培养基中的盐浓度要求较高,Na+对于嗜盐菌细胞壁结构完整性有重要意义[19-20]。过高或过低的Na+浓度都会影响菌株的正常生长。同时,环境pH值也会对细胞膜表面的电荷变化产生影响,从而影响生物膜形成初期的粘附过程。本研究发现,3%质量分数的NaCl条件下,菌株的生长较好,生物膜测定时菌体OD值较高(表2)。另一方面,在pH 9的条件下,细胞膜表面大量负电荷的积累也促进了生物膜的形成和稳定。
2.2 不同温度下副溶血性弧菌生物膜形成
由图2可知,随着温度的升高,不同盐浓度和pH条件下的生物膜形成量也不断升高。在4 ℃下,该菌株生物膜形成量最低,生物膜形成明显受到抑制,与文献报道一致,低温会抑制生物膜的形成[21],这与菌体在低温情况下的生长和代谢速率较低有关。同时,研究结果表明,37 ℃下不同NaCl质量分数与培养基pH条件下的生物膜形成均较好。且在37 ℃温度条件下,质量分数3%NaCl和pH 9是副溶血性弧菌形成最适条件,因此,在后续生物膜培养和分析实验中均采用此条件进行培养。
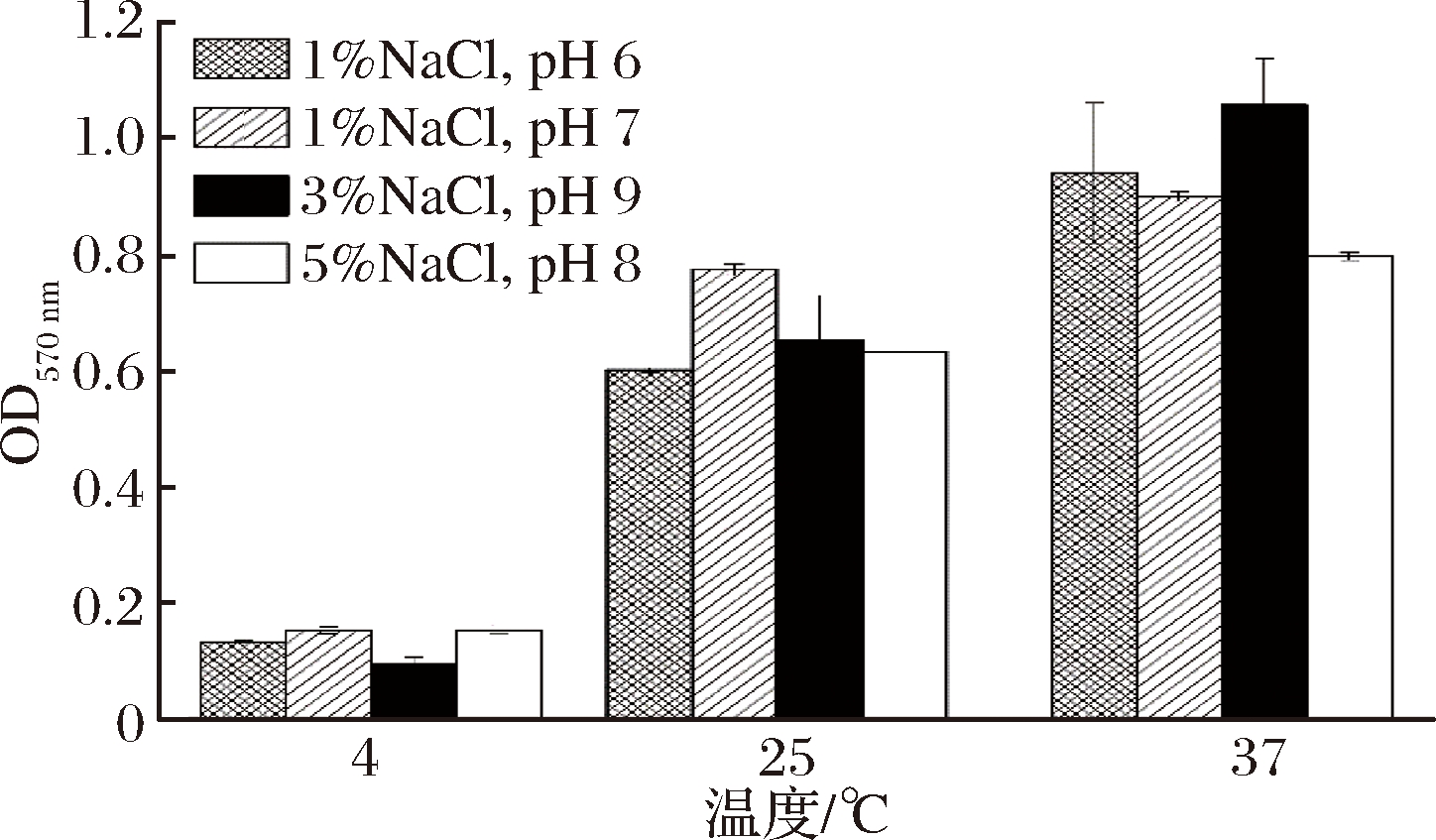
图2 不同温度下副溶血性弧菌生物膜的形成
Fig.2 Formation of VP biofilms at different temperatures
2.3 SDS对副溶血性弧菌生物膜影响
在对副溶血性弧菌生物膜形成条件分析的基础上,对表面活性剂影响生物膜形成的特性进行分析。
首先,对SDS在生物膜形成中的作用进行分析,结果如图3所示。
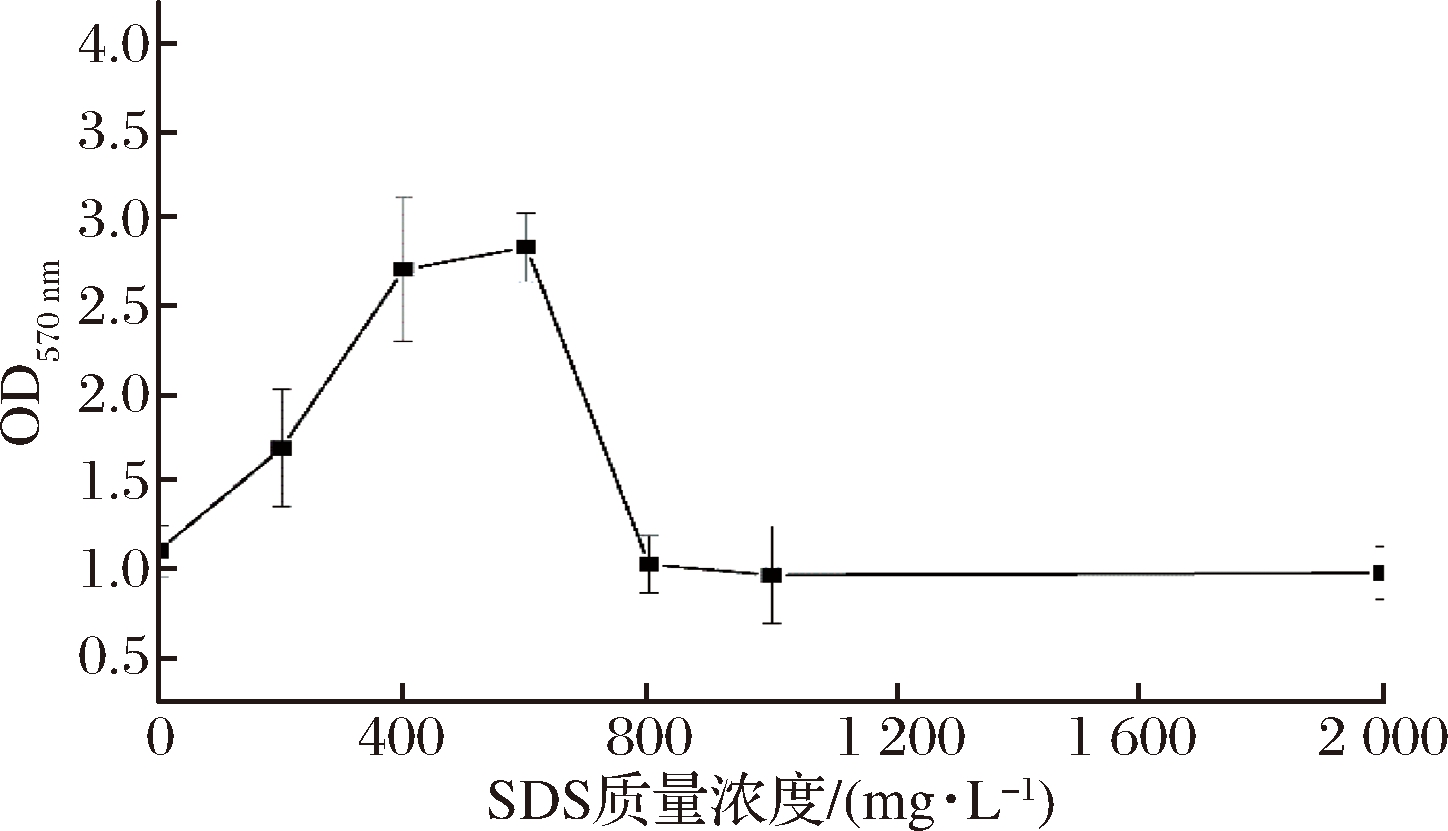
图3 不同SDS质量浓度对副溶血性弧菌生物膜形成的影响
Fig.3 Effect of different SDS concentrations on biofilm formation of VP
随着SDS质量浓度的增加,该菌株生物膜的形成呈现先上升后下降的趋势。在SDS质量浓度小于600 mg/L时,SDS对生物膜的形成具有促进作用,生物膜量随着SDS质量浓度的提高不断增加,在600 mg/L时达到峰值。当SDS质量浓度大于600 mg/L时,SDS会抑制副溶血性弧菌的生长,导致其生物膜形成减弱。IZANO等[22]研究了SDS对伴放线放线杆菌生物膜的形成作用,当SDS质量浓度高于临界胶束浓度时,SDS会破坏蛋白质的折叠,使蛋白质变性,从而影响生物膜的形成,对菌体的生长产生抑制作用。SDS是一种阴离子表面活性剂,低浓度SDS会影响细胞膜的通透性,促进了细胞与细胞间的信号传递,同时,利于胞外蛋白质和多糖等物质的分泌,参与到生物膜的形成过程,当浓度过高时,在抑制菌株生长的同时,也会使胞外蛋白质变性,破坏生物膜的形成。
2.4 PVP对副溶血性弧菌生物膜的影响
由图4可以看出,随着PVP质量浓度的增加,该菌株生物膜的形成呈先上升后下降趋势,当PVP质量浓度小于600 mg/L时,在一定程度上促进了生物膜的形成,但是没有SDS的促进作用明显,在600 mg/L时达到峰值,当PVP质量浓度大于600 mg/L时,抑制生物膜的形成。PVP是一种聚乙烯类非离子型表面活性剂,MARSHALL等[23]认为这种表面活性剂的疏水基会影响初始粘附过程中的高聚物的形成,从而使细菌生物膜成分发生改变,影响生物膜的稳定性,通过激光共聚焦显微镜图像显示,非离子表面活性剂可以将生物膜厚度由5~40 μm减小到5~25 μm。因此,可能是低浓度的PVP改变了细胞的通透性,促进其胞外多糖的分泌,增加生物膜的形成,当PVP浓度过高时,其中的疏水基改变了生物膜的成分,影响其稳定性,从而抑制其生物膜的形成。
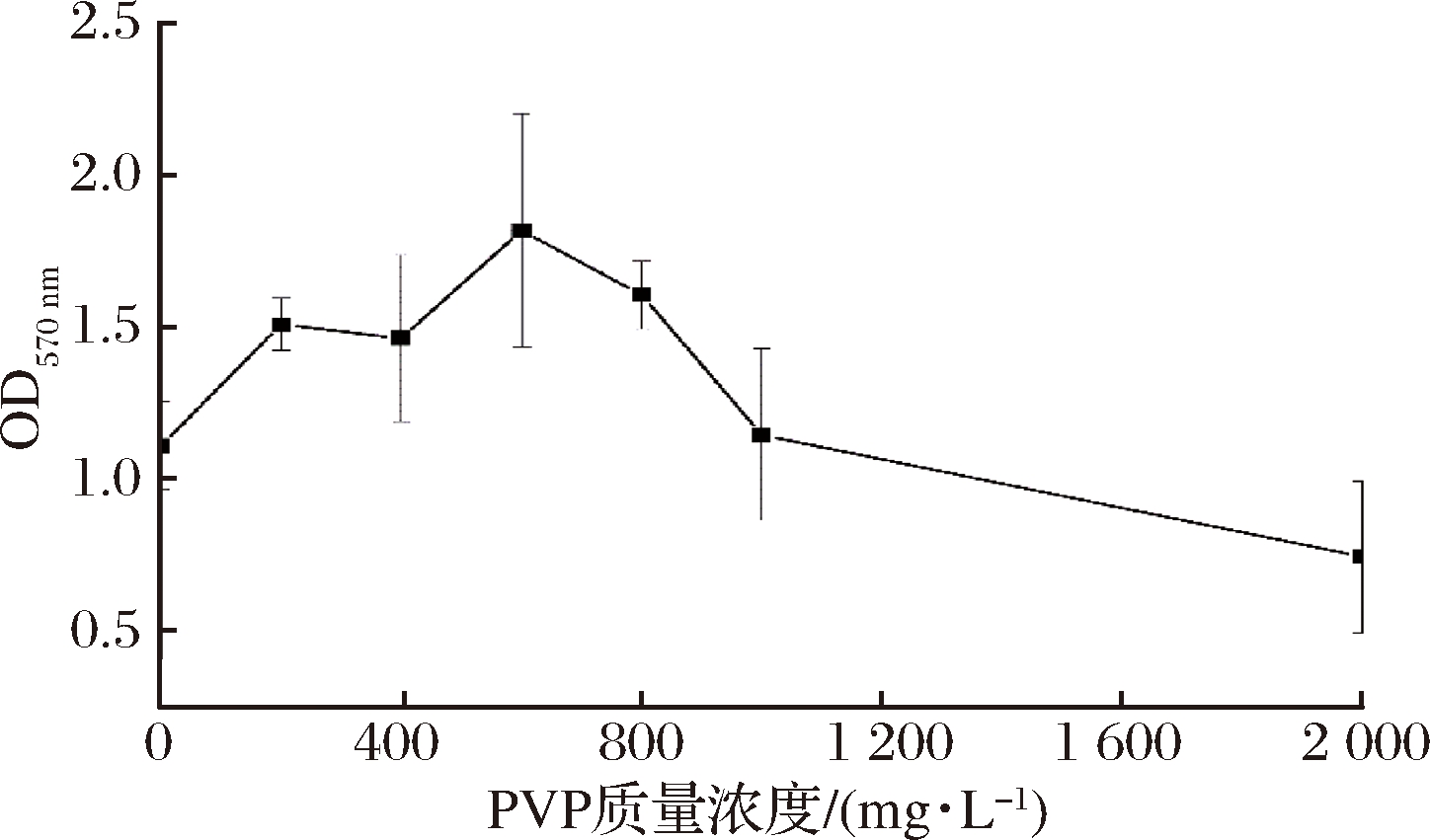
图4 不同PVP质量浓度对副溶血性弧菌生物膜形成的影响
Fig.4 Effect of different PVP concentrations on biofilm formation of VP
2.5 柠檬酸二铵对副溶血性弧菌生物膜的影响
由图5可知,随着柠檬酸二铵质量浓度的增加,可以显著促进生物膜的形成,且呈梯度增加。柠檬酸二铵是1种两性离子表面活性剂,其分子中既带有正电荷,又带有负电荷,可能是柠檬酸二铵具有非极性固体表面单层吸附的能力,增强了副溶血性弧菌与介质的粘附能力,从而促进了副溶血性弧菌生物膜的形成。
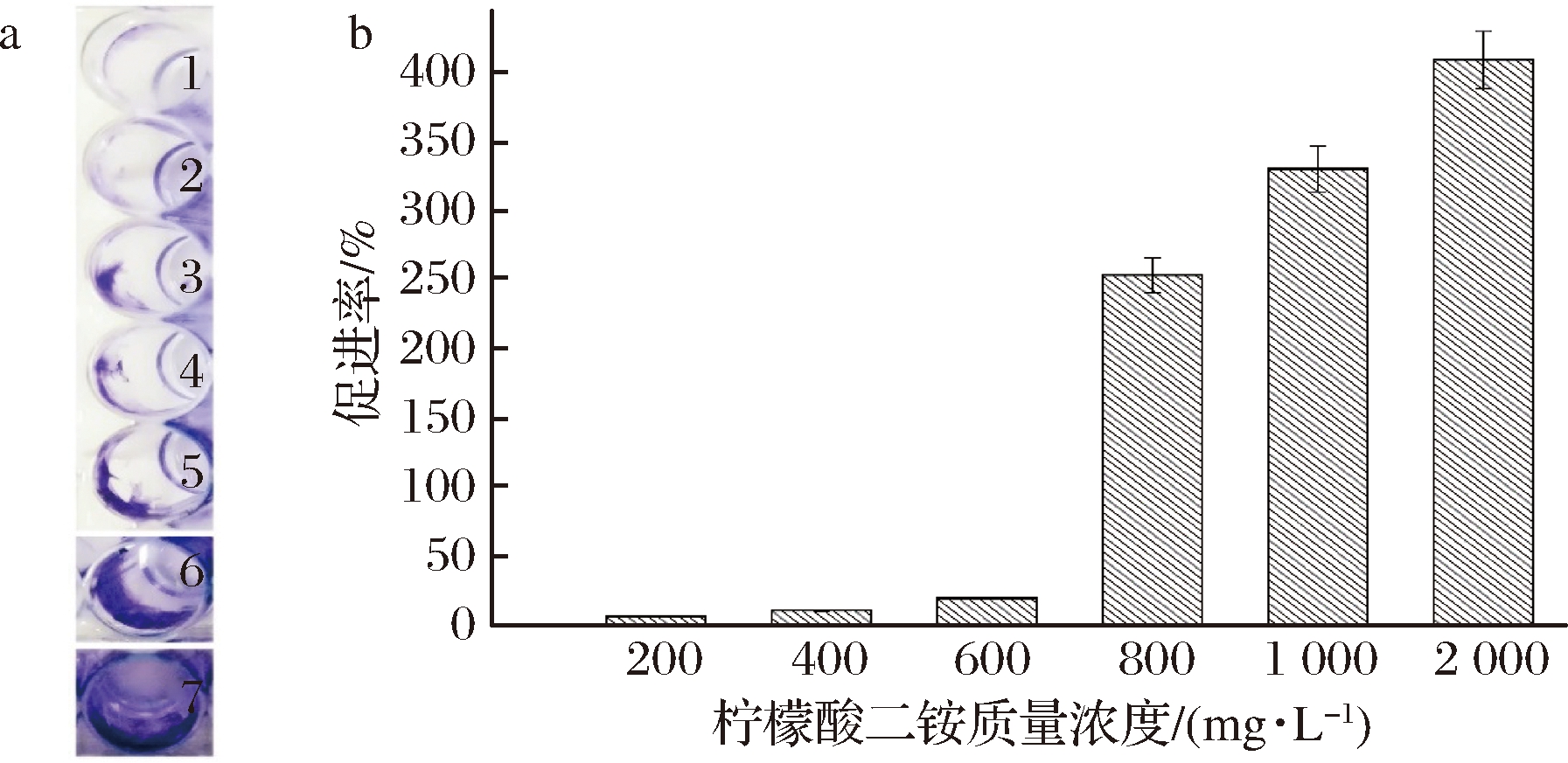
1~7:柠檬酸二铵质量浓度0、200、400、600、800、1 000、2 000 mg/L;a-副溶血性弧菌生物膜形成情况;b-副溶血性弧菌生物膜形成促进率
图5 不同柠檬酸二铵质量浓度对副溶血性弧菌生物膜形成情况和生物膜形成促进率
Fig.5 Different concentrations of diammonium citrate on the biofilm formation and promotion rate of biofilm formation of VP by different concentrations of diammonium citrate
2.6 SDS对副溶血性弧菌的MIC
从图3可以看出,SDS对副溶血性弧菌生物膜的形成影响显著,进而研究了不同质量浓度SDS对副溶血性弧菌生长的影响,由图6可知,随着SDS质量浓度增加,副溶血性弧菌的生物量会不断下降,其生长显著受到抑制,当SDS质量浓度为600 mg/L,培养时间为24 h时,副溶血性弧菌生物量达到最低,是抑制该菌生长的最低浓度,因此,SDS对该菌株的最小抑菌浓度(MIC)为600 mg/L。
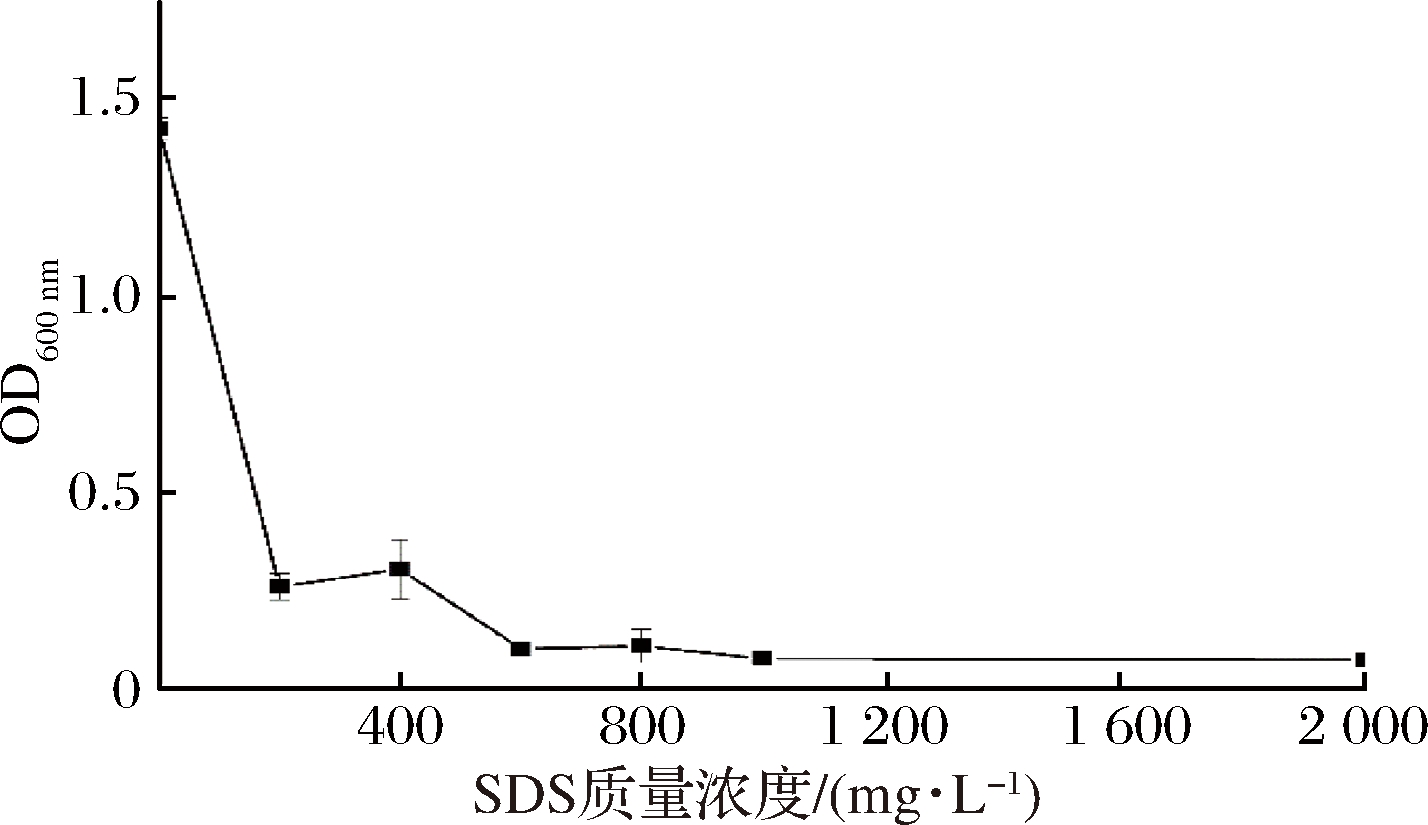
图6 不同SDS质量浓度对副溶血性弧菌生长的影响
Fig.6 Effect of different SDS concentrations on VP growth
2.7 副溶血性弧菌胞外多糖的测定
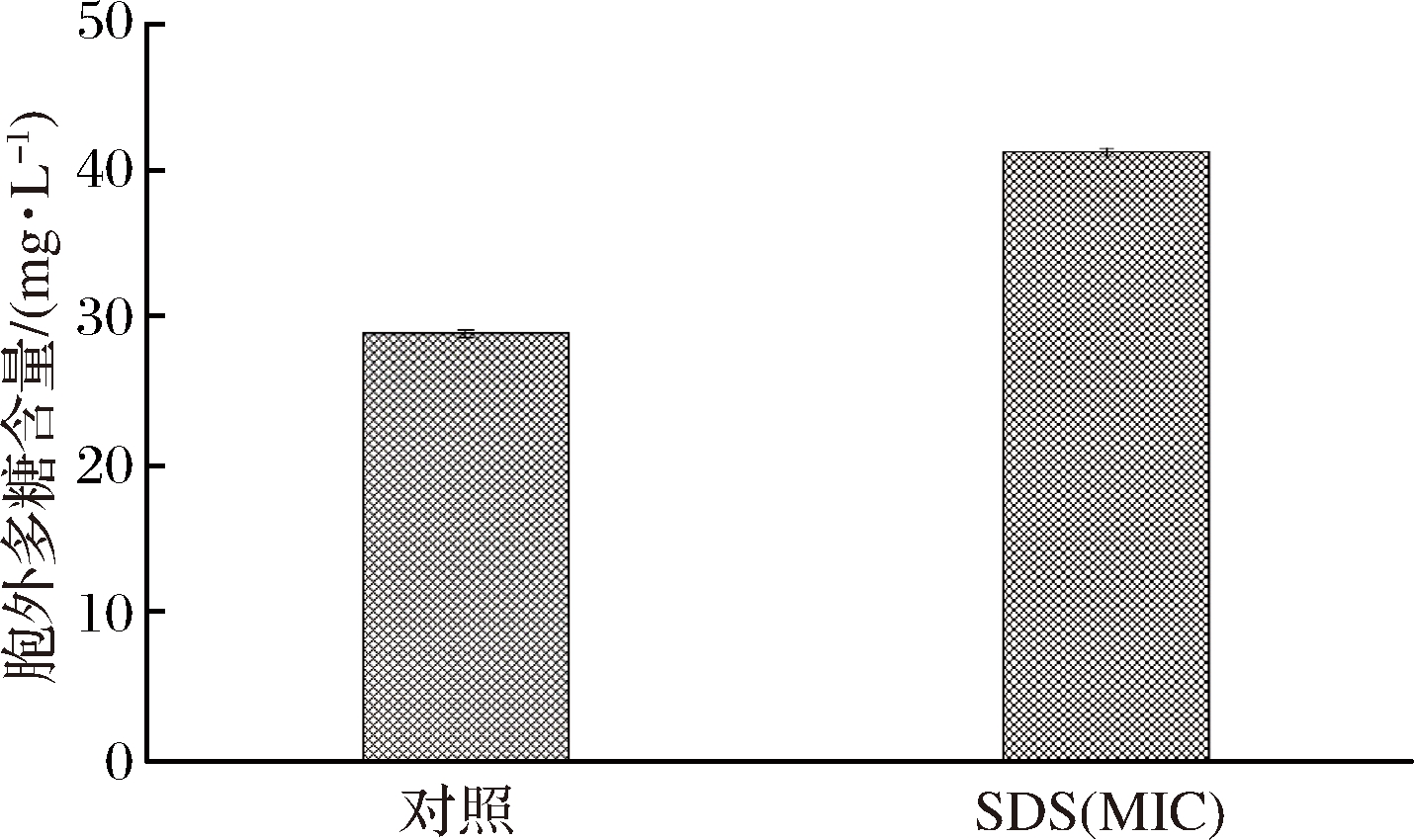
图7 添加SDS的副溶血性弧菌胞外多糖的测定
Fig.7 Determination of extracellular polysaccharides of VP with SDS
由图7可知,添加了SDS的副溶血性弧菌培养液中,终浓度为600 mg/L时,即最小抑菌浓度,其胞外多糖含量达到41.27 mg/L,而对照胞外多糖含量为28.99 mg/L,其含量是对照的1.42倍。因此,当SDS处于临界胶束浓度时,促进了该菌株胞外多糖的分泌从而显著促进生物膜的形成。
3 结论
副溶血性弧菌形成生物膜,增加细胞对环境的抵抗能力得以残存,进而污染食品,造成极大的食品安全隐患[24]。细菌生物膜的形成是由起始到逐步成熟、稳定再到逐渐老化的动态过程,副溶血性弧菌生物形成也经历了这3个阶段,起始生长阶段,菌浓较低,与介质的粘附较弱,随着细胞的生长,菌浓逐渐升高,菌膜逐步成熟,当细胞生长到衰亡期,菌膜老化,伴随胞外多糖分泌减少,菌膜里的菌体逐渐衰亡,导致生物膜结构被破坏进而脱落[25]。
目前,对生物膜的清除方法主要有抗菌剂涂层、多酶清洗剂和表面活性剂等[26],其中表面活性剂是1种两性化合物,因其带有电荷而与生物膜相互作用来达到清除效果,但是,表面活性剂对生物膜的抑制或清除作用具有一定的限制性。因此,本文通过表面活性剂与副溶血性弧菌生物膜的形成作用进行了分析,主要从表面活性剂的种类和用量上展开研究,SDS、PVP、柠檬酸二铵这3种不同类型表面活性剂的影响比较显著,且呈现一定的规律性。结果表明,副溶血性弧菌在不同的条件下形成生物膜的量也不同,培养条件为37 ℃,3%NaCl、pH 9时,形成生物膜的量最多,高盐和高温有助于其生物膜形成。低浓度(小于600 mg/L)的SDS和PVP可以促进副溶血性弧菌生物膜的形成,高浓度的表面活性剂会抑制生物膜的形成,然而随着柠檬酸二铵浓度升高可以促进生物膜的形成。当SDS浓度为副溶血性弧菌的最小抑菌浓度时,即600 mg/L,对其生物膜的促进作用显著,其胞外多糖含量是对照的1.42倍。本研究结果为生物膜的消除和食品安全提供了理论基础,病原微生物形成生物膜残留在食品加工器械表面因其难以清除而导致食品污染,虽然这3种表面活性剂不能作为食品添加剂直接添加到食品中,但是SDS和PVP可以作为新型清洗剂,对食品器械上残留的生物膜达到一个较好的清除作用。
[1] TEY Y H, JONG K J, FEN S Y, et al. Occurrence of Vibrio parahaemolyticus, Vibrio cholerae, and Vibrio vulnificus in the aquacultural environments of Taiwan[J]. Journal of Food Protection, 2015, 78(5):969-976.
[2] KERNELL A B, GUTHRIE L T, MODISE T, et al. OpaR controls a network of downstream transcription factors in Vibrio parahaemolyticus BB22OP[J]. PloS One, 2015, 10(4):e0121863.
[3] AAGESEN A M, CLAUDIA C. H SE. Sequence analyses of type IV pili from Vibrio cholerae, Vibrio parahaemolyticus, and Vibrio vulnificus[J]. Microbial Ecology, 2012, 64(2):509-524.
SE. Sequence analyses of type IV pili from Vibrio cholerae, Vibrio parahaemolyticus, and Vibrio vulnificus[J]. Microbial Ecology, 2012, 64(2):509-524.
[4] PINTO A D, TERIO V, PINTO P D, et al. Detection of Vibrio parahaemolyticus, in shellfish using polymerase chain reaction-enzyme-linked immunosorbent assay[J]. Letters in Applied Microbiology, 2012, 54(6):494-498.
[5] HE D M, ZHU H M, MA C, et al. Comparative study on the phenotypic characteristics and molecular typing of foodborne Vibrio parahaemolyticus in Guangdong province [J]. Chinese Journal of Epidemiology, 2011, 32(12):1 259-1 263.
[6] 韩小龙, 张海燕,曹明秀,等. 我国海产品中副溶血性弧菌的污染现状与控制策略分析[J]. 食品与发酵工业, 2015, 41(7):263-267.
[7] HUANG W S, WONG H C. Characterization of low salinity stress in Vibrio parahaemolyticus[J]. Journal of Polymer Science Part A Polymer Chemistry, 2010, 8(8):231-237.
[8] DAUROS P, BELLO H, DOM NGUEZ M, et al. Characterization of Vibrio parahaemolyticus strains isolated in Chile in 2005 and in 2007 [J]. Journal of Infection in Developing Countries, 2011, 5(7):502-510.
NGUEZ M, et al. Characterization of Vibrio parahaemolyticus strains isolated in Chile in 2005 and in 2007 [J]. Journal of Infection in Developing Countries, 2011, 5(7):502-510.
[9] SERRACCA L, BATTISTINI R, ROSSINI I, et al. Vibrio virulence genes in fishes collected from estuarine waters in Italy[J]. Letters in Applied Microbiology, 2011, 53(4):403-408.
[10] 季霄雷, 许海燕,苏婧,等. 82株副溶血性弧菌毒力基因及耐药性分析[J]. 中华微生物学和免疫学杂志, 2018, 38(1):37-40.
[11] 戚韩英,汪文斌,郑昱,等.生物膜形成机理及影响因素探究[J].微生物学通报,2013,40(4):677-685.
[12] 尹清干, 程俊茗,刘腾飞,等. 环境因子对鳗弧菌生物膜形成的影响[J]. 微生物学通报, 2018, 45(1):138-145.
[13] 陈小雪,陈晶瑜,韩北忠. 食品加工过程中细菌生物被膜的危害及控制[J]. 中国酿造,2016,35(1):1-4.
[14] 叶灵琼, 陈万义,刘卫兵,等. 副溶血弧菌耐药谱及其对头孢类药物抗性分析[J]. 中国食品学报, 2011, 11(7):157-162.
[15] 崔彦超, 侯振江. 国内细菌生物膜耐药性研究进展[J]. 检验医学教育, 2012(2):41-43.
[16] 刘珏玲, 杨伟峰,王毅. 细菌生物膜与表面活性剂抗菌的研究进展[J]. 中国病原生物学杂志, 2016(9):858-860.
![]() S,
S, ![]() D, HOLA V, et al. Quantification of biofilm in microtiter plates: Overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci[J]. Apmis, 2007, 115(8):891-899.
D, HOLA V, et al. Quantification of biofilm in microtiter plates: Overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci[J]. Apmis, 2007, 115(8):891-899.
[18] 周万龙, 焦学,孙亚杰,等. 1株海洋来源鞘氨醇单胞菌胞外多糖的含量测定[J]. 中国海洋药物, 2017, 36(2):27-34.
[19] IMAE Y, ATSUMI T, MCCARTERT L. Polar and lateral flagellar motors of marine Vibrio are driven by different ion-motive forces[J]. Nature (London), 1992, 355(6 356):182-184.
[20] 王伟伟, 唐鸿志,许平,等. 嗜盐菌耐盐机制相关基因的研究进展[J]. 微生物学通报, 2015, 42(3):550-558.
[21] MORIMATSU K, HAMANAKA D, TANAKA F, et al. Effect of temperature fluctuation on biofilm formation with bacterial interaction between Salmonella enterica and Pseudomonas putida[J]. J Fac Agr KyushuU, 2013, 58(1): 125-129.
[22] IZANO E A, WANG H, RAGUNATH C, et al. Detachment and killing of Aggregatibacter actinomycetemcomitans biofilms by Dispersin B and SDS[J]. Journal of Dental Research, 2007, 86(7):618-622.
[23] EDGAR R C. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19):2 460.
[24] JAHID I K, HA S D. A review of microbial biofilms of produce: Future challenge to food safety[J]. Food Science & Biotechnology, 2012, 21(2):299-316.
[25] MIYAWAKI O, TATSUNO M. Thermodynamic analysis of alcohol effect on thermal stability of proteins[J]. Journal of Bioscience & Bioengineering, 2011, 111(2):198-203.
[26] 沈瑾, 段弘扬,邱侠,等. 碱性电解水与医用清洗剂去除细菌生物膜的研究[J]. 中华医院感染学杂志, 2018,28(7):979-982.