氮作为一类重要的污染物,可能导致水体污染、水体富营养化等许多环境污染问题[1]。生物脱氮是废水脱氮最常用、最有效的方法,也是污水处理领域的一个热点[2]。废水中的氮主要以氨氮、硝酸盐氮、亚硝酸盐氮和有机氮的形式存在。在一定条件下,微生物经过氧化分解,可以使得有机氮转化为氨氮[3]。在好氧条件下,氨氮可被硝化细菌氧化为亚硝酸盐氮和硝酸盐氮。污水中的氨氮以![]() 和NH3两种形式存在。这2种组分的比例随水温和pH值的变化而变化,主要存在形式为
和NH3两种形式存在。这2种组分的比例随水温和pH值的变化而变化,主要存在形式为![]() 废水中的亚硝酸盐是不稳定的,在微生物的作用下很容易转化为硝酸盐和氨[5]。排放到水中的氮废水,特别是湖泊的流动缓慢,很容易导致藻类或其他微生物的繁殖和富营养化严重污染[6],最终使水中溶解氧减少,鱼类死亡,甚至湖泊的生态系统遭到严重的破坏。高浓度的硝酸盐和亚硝酸盐会对人体造成健康危害[7],能够形成高铁血红蛋白(尤其是婴儿)从而使血液失去携氧功能,对人体健康造成严重的威胁。因此,控制污水处理中的氮具有重要意义[8]。
废水中的亚硝酸盐是不稳定的,在微生物的作用下很容易转化为硝酸盐和氨[5]。排放到水中的氮废水,特别是湖泊的流动缓慢,很容易导致藻类或其他微生物的繁殖和富营养化严重污染[6],最终使水中溶解氧减少,鱼类死亡,甚至湖泊的生态系统遭到严重的破坏。高浓度的硝酸盐和亚硝酸盐会对人体造成健康危害[7],能够形成高铁血红蛋白(尤其是婴儿)从而使血液失去携氧功能,对人体健康造成严重的威胁。因此,控制污水处理中的氮具有重要意义[8]。
在传统方法中,一般是利用硝化细菌和反硝化细菌[9]来去除污水中的氮。硝化细菌可在有氧条件下将氨氧化成亚硝酸盐或硝酸盐,但是生长速度缓慢。而大多数反硝化细菌是异养厌氧菌,以亚硝酸盐或硝酸盐为电子受体并生成氮气[3],因此传统方法去除氮对设备要求较高,所用时间较长。而脱氮副球菌(Paracoccus denitrificans)具有异养硝化和好氧反硝化一体的特点,具有很好的脱氮能力[10]。为了有效利用资源,通常对细胞进行固定化和回收利用[11]。例如SANJEEVKUMAR使用固定化细胞去除N,N-二甲基甲酰胺(DMF)[12],这些土壤微生物的巨大潜力已被强化用于去除到培养瓶中的DMF[13],在合适的基质中截留的细菌细胞已被证明能提高对多种有毒和顽抗性化合物的耐受性[14]。固定化细胞可以通过更高的细胞载量维持去除速率,易于生物过程维持[12]。因此,固定化细胞可作为生物修复环境的一种较好的选择[15]。由于这些明显的优点,固定化细胞已被用于去除水体中的许多污染物[16-17],固定化细胞还被用于食品工业[18],生物转化[19],生物乙醇生产[20]和微生物净化水体[21]。
本研究探究了海藻酸钠(sodium alginate,SA)与几种不同的二价金属阳离子络合形成的水凝胶在污水处理中的效果。通过正交试验确定固定化条件,并测定了固定化细胞使用的循环次数,最终目的是加快P.denitrificans在废水处理中的推广和应用,特别是对含氮量较高的废水的处理。
1 材料与方法
1.1 菌种和培养基
脱氮副球菌P.denitrificans DYTN-1(菌种编号CCTCC 2016741)来自中国典型培养物保藏中心。富集培养基(g/L):NaCl 10.0,蛋白胨10.0,酵母提取物5.0。模拟污水培养基(g/L)[22]: KNO3 0.25,(NH4)2SO4 0.154,NaNO2 0.16,KH2PO4 0.05,K2HPO4 0.05,NaCl 3.0,C6H12O6 2.5,微量元素溶液1 mL/L。微量元素溶液(g/L):MgSO4·7H2O 10.0,ZnSO4·7H2O 2.2,CaCl2·2H2O 7.3,MnCl2·4H2O 2.5,CoCl2·6H2O 0.5,(NH4)6Mo7O24·4H2O 0.5,FeSO4·7H2O 5.0,CuSO4·5H2O 0.2,EDTA-2Na 20.0。模拟污水培养基pH值调节至7.0。
1.2 脱氮副球菌DYTN-1的富集
脱氮副球菌DYTN-1在富集培养基中进行富集[23],并且当游离细胞的OD600nm=4.0时对细胞进行固定化。7 500 r/min离心10 min,收集菌体,并用磷酸缓冲液洗涤2次供下一步使用[12]。
1.3 固定化脱氮副球菌DYTN-1
采用海藻酸钠对细胞DYTN-1进行固定化,用磁力搅拌器将一定浓度的海藻酸钠与离心后的菌体混合均匀。使用注射式造粒机将上述混合物滴落至二价金属阳离子的溶液中,置于2~4 ℃环境中交联3~5 h以形成珠粒(直径为3~4 mm)。形成的珠粒用无菌水洗涤3~5次,置于4 ℃冰箱中供下一步使用。将固定化后的细胞放入污水中,测定固定化细胞是否对污水中的总氮具有去除效果。如果对污水中的总氮没有去除效果,则说明固定化细胞已经失活。
1.4 测定方法
采用碱性过硫酸钾消解紫外分光光度法[24]测定TN。以TN含量(mg/L)为横坐标,对应的Ar值为纵坐标,绘制校准曲线。
Ab=Ab220-2Ab275
(1)
As=As220-2As275
(2)
Ar=As-Ab
(3)
式中:Ab,零浓度(空白)溶液的校正吸光度;Ab220,零浓度(空白)溶液于波长220 nm处的吸光度;Ab275,零浓度(空白)溶液于波长275 nm处的吸光度;As,标准溶液的校正吸光度;As220,标准溶液于波长220 nm处的吸光度;As275,标准溶液于波长275 nm处的吸光度;Ar,标准溶液校正吸光度与零浓度(空白)溶液校正吸光度的差。
配制硝酸钾标准使用液,按照碱性过硫酸钾消解紫外分光光度法[24]测定TN,并绘制标准曲线,如图1所示。

图1 TN标准曲线
Fig.1 TN standard curve
由图1可以看出,所得的标准曲线R2=0.999 3,因此可以进行TN的测定。
1.5 设计正交试验
为了找到固定化细胞去除废水中总氮的最佳条件,设计正交试验来研究以下4个因素对固定化细胞的影响:海藻酸钠浓度,海藻酸钠与菌株的比例,交联剂的浓度和固定的时间。
2 结果与分析
2.1 游离状态下脱氮副球菌DYTN-1去除工业污水中的总氮
为了研究游离状态下脱氮副球菌DYTN-1对去除污水中总氮的影响,分别设置DYTN-1的接种量为1%、2%、3%和4%,置于30 ℃,200 r/min的条件下培养。按照国家标准方法[24]测定污水中总氮的含量,实验结果表明,总氮的去除效果与脱氮副球菌DYTN-1的接种量呈显著的正相关。接种量为1%~2%需48 h才能将总氮含量降低至国家排放标准[25](图2-a和图2-b)。但当接种量为3%~4%时,污水中的总氮在24 h内总氮含量达到国家排放标准,总氮含量在接下来的48 h内变化不大(图2-c和图2-d)。基于以上研究可以看出,脱氮副球菌DYTN-1在处理废水方面具有很大的潜力。为了能够有效循环利用脱氮副球菌DYTN-1,采用细胞固定化技术对DYTN-1进行固定化。
2.2 不同二价金属离子与海藻酸钠交联对固定化细胞去除污水中总氮的影响
海藻酸钠是从褐藻类的海带或马尾藻中提取碘和甘露醇之后的副产物,其分子由β-D-甘露糖醛酸(β-D-mannuronic,M)和α-L-古洛糖醛酸(α-L-guluronic,G)按(1→4)键连接而成,是固定化细胞的理想载体,对微生物无毒性[26]。
2.2.1 测试不同的二价金属离子作为交联剂对固定化细胞的影响
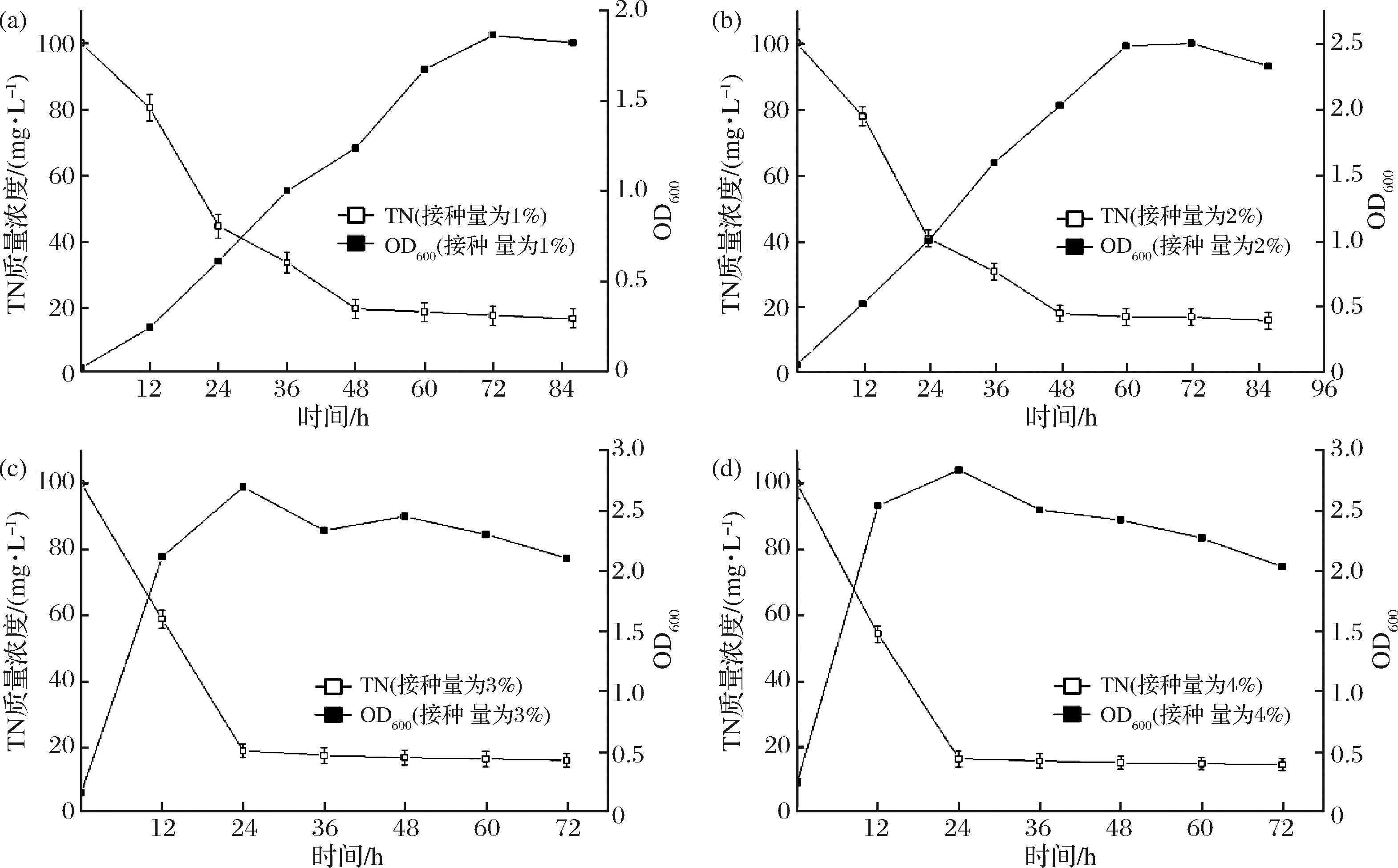
(a)至(d)-DYTN-1的接种量分别为1%,2%,3%和4%
图2 不同接种量的DYTN-1对去除污水中总氮的影响
Fig.2 Effect of different inoculation amount of DYTN-1 on removal TN from wastewater
分别采用Ca2+、Zn2+、Ba2+、Cu2+、Co2+和Mg2+作为交联剂,研究上述6种二价金属离子与海藻酸钠交联生成的水凝胶是否具有细胞活性(表1)。发现Mg2+作为交联剂不能形成水凝胶,而Zn2+、Cu2+和Co2+分别作为交联剂能够形成水凝胶,但没有细胞活性。只有以Ca2+和Ba2+为交联剂形成的水凝胶具有细胞活性,能有效去除废水中的总氮。
表1 不同二价金属阳离子作为交联剂的比较
Table 1 Different two valence cations are used ascrosslinking agents
Ca2+Zn2+Ba2+Cu2+Co2+Mg2++-+--∗
注:+:形成的水凝胶具有细胞活性;-:形成的水凝胶无细胞活性;*:未能形成水凝胶
2.2.2 测定具有活性的固定化细胞对污水中总氮的去除效果
使用2种不同的二价金属阳离子Ca2+和Ba2+作为交联剂,并测定了固定化细胞去除废水中总氮的效果。发现固定化细胞的去除效率比游离细胞的去除效率更高,使用Ca2+、Ba2+作为交联剂,所形成的水凝胶能够分别在4、8 h内将废水中的总氮含量降低至10 mg/L以下(图3)。
2.3 固定化脱氮副球菌DYTN-1去除污水中总氮的最佳条件
2.3.1 两种不同交联剂形成水凝胶循环使用的次数
为了测定2种不同交联剂形成的水凝胶的循环使用次数,分别将Ca2+、Ba2+作为交联剂形成的水凝胶放入模拟的污水培养基中,并测定使得污水中的总氮含量达到国家排放标准时重复使用的次数。将上述2种水凝胶放入模拟的污水中,当污水中总氮含量达到国家排放标准时,用纱布将水凝胶截留下来,并注入新的污水,直至水凝胶破裂,对这2种交联剂形成的水凝胶循环使用的次数进行确认。结果表明,Ba2+作为交联剂形成水凝胶的使用次数为9次,明显高于Ca2+(5次)。
2.3.2 固定化脱氮副球菌DYTN-1去除污水中总氮的最佳条件
设计正交实验来考察海藻酸钠浓度,海藻酸钠与菌株的比例,交联剂的浓度以及固定化时间对固定化细胞的影响。结果表明,不同条件下形成的水凝胶在去除效率上存在显著差异。在实验1、实验4和实验8中(表2),总氮去除率均高于80%。实验8的去除效果显著,去除率为87.6%,而实验9则没有明显的去除效果,去除率几乎为零。因此,不同条件下形成的水凝胶对去除污水中总氮的影响很大。由表2可以看出,各因素影响的主次为SA与菌种比例>固定化时间>氯化钡浓度>SA含量,通过效应曲线(图4),得到最佳的实验条件:SA含量为3%,SA与菌种比例为1∶1,氯化钡浓度为0.1 mol/L,固定化时间为5 h。

a-钙离子作为交联剂;b-钡离子作为交联剂
图3 不同二价金属离子交联对固定化细胞去除废水中总氮的影响
Fig.3 Effect of cross-linking of different divalent metal ions on removal TN from wastewater by immobilized cells
表2 正交实验测定结果
Table 2 The content and determination results oforthogonal test

影响因素SA浓度/%SA与菌种比例Ba2+浓度/(mol·L-1)固定化时间/h去除率/%实验111∶10.10 1182.322 3实验2∗11∶30.1530实验313∶10.20 522.735 5实验431∶10.15 584.636 4实验531∶30.20 163.644 6实验633∶10.10315.545 5实验751∶10.20330.917 4实验851∶30.10587.611 6实验953∶10.1514.388 4K10.3500.6600.6180.501K20.5460.5040.2970.155K30.4100.1420.3910.650极差R0.1960.5180.3210.495
注: *,实验2中,由于海藻酸钠与菌种浓度过低未能形成水凝胶,因此设定其去除率为0
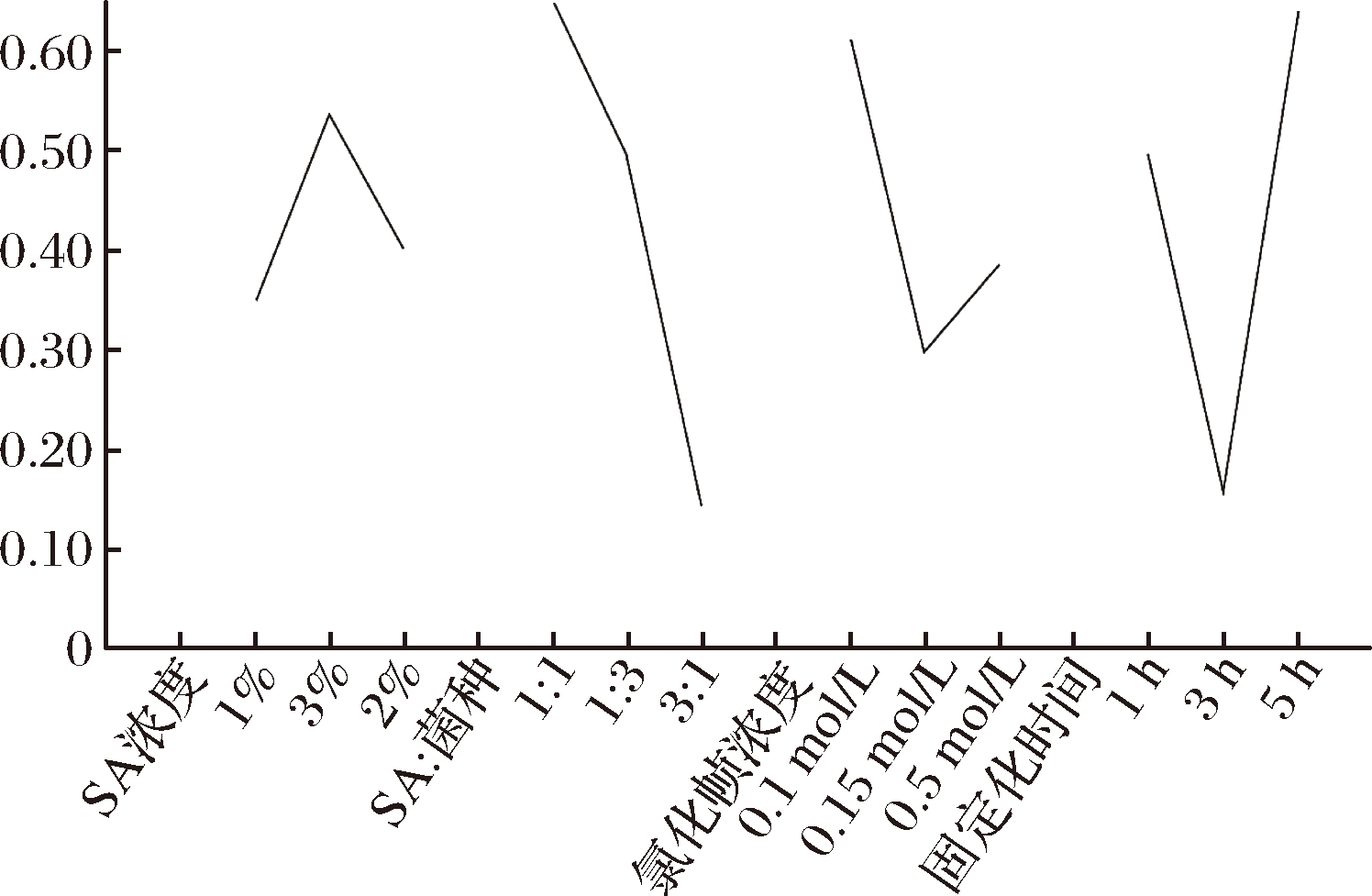
图4 固定化DYTN-1细胞最佳条件的效应曲线
Fig.4 The effective curve of the optimum conditions for
immobilization DYTN-1 cells
为了验证正交实验结果,在上述最佳的条件下对脱氮副球菌进行了固定化,并测定了固定化细胞去除污水中总氮的效果。从第3批污水开始,固定化的脱氮副球菌DYTN-1细胞可在3 h内将废水中总氮的浓度降低至20 mg/L以下(图5)。第1批废水中总氮含量达到国家排放标准需要8 h。第2批次总氮的去除速度明显加快,运行至第4 h时总氮含量已低于20 mg/L。在处理第3批污水时,总氮含量在2.5 h后达到标准,比第2批缩短37.5%,比第1批缩短68.75%。到第4批时,污水中总氮达到国家排放标准所需时间为2 h,比第一批所用的时间缩短了6 h。处理第5批污水时,仅1 h时内污水中总氮含量已经低于20 mg/L。在后面的批次中,基本在1 h内使得污水中总氮含量达到排放标准,由于固定化细胞可以通过更高的细胞载量维持去除速率,易于生物过程维持,固定化后形成的水凝胶里面的细胞数量不断增加,对污水的总氮利用效率不断提高,所用的时间不断减少。在最佳条件下固定化细胞能够循环使用12次,与在一般条件下固定化的细胞(9次)相比,循环次数增加了33.3%。
3 结论
本研究确定了1株可用于去除污水中总氮的脱氮副球菌DYTN-1。为了进一步提高脱氮副球菌DYTN-1对污水中总氮的去除效率,以海藻酸钠为载体,以Ba2+为交联剂对脱氮副球菌DYTN-1进行细胞固定化。固定化的最佳条件为:SA含量为3%,SA与菌种比例为1∶1,BaCl2浓度为0.1 mol/L,固定化时间为5 h。结果表明,固定化细胞能够明显提高废水中总氮的去除效率,显著降低运行周期,而且固定化后的细胞可多次重复使用。因此,本研究为去除废水中的总氮提供了一种经济有效的方法。
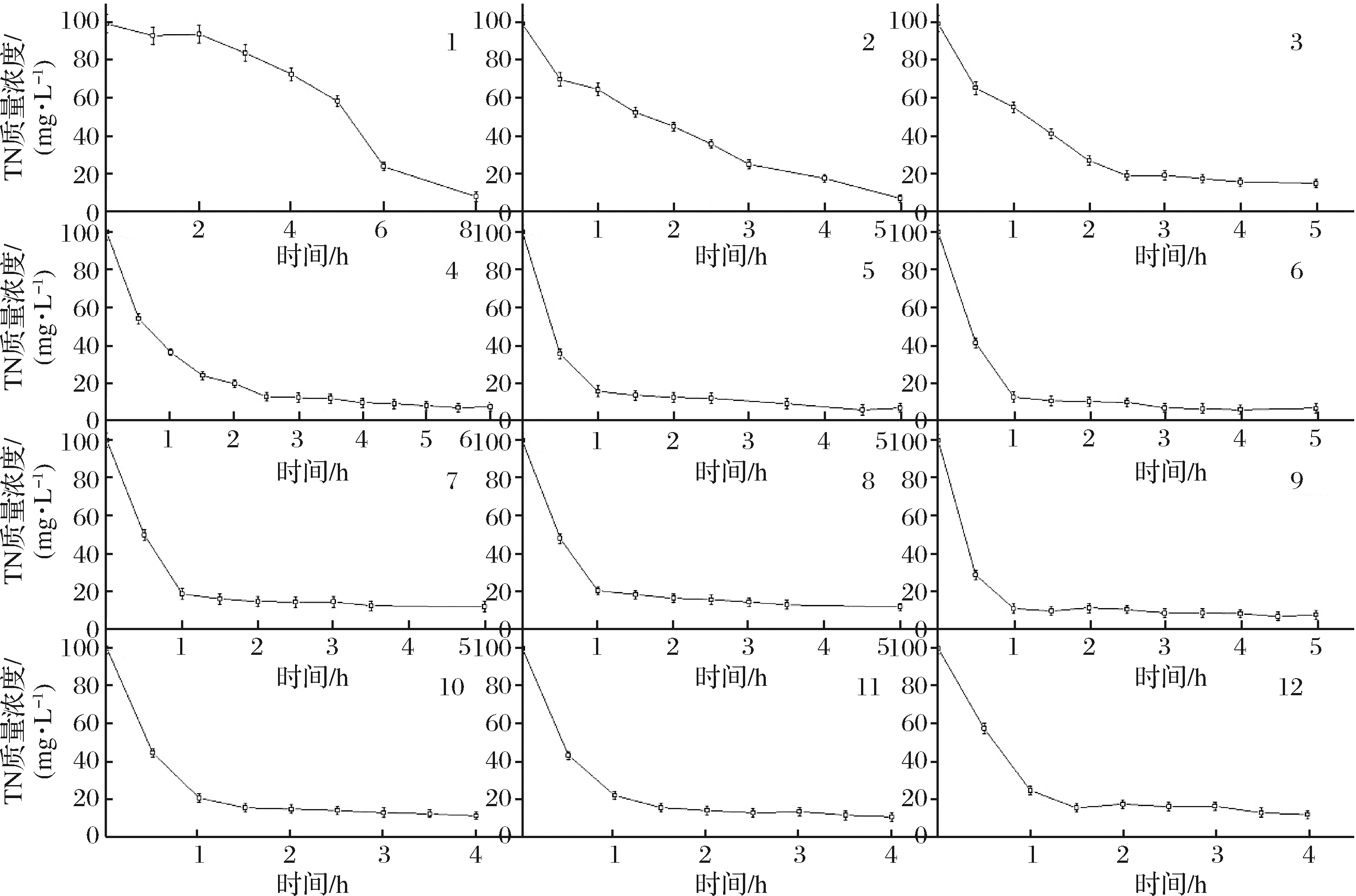
图5 固定化细胞在最佳条件下去除污水中的总氮
Fig.5 Immobilized cells remove TN from wastewater under optimal conditions. Error bars represents the standard deviations
注:图中数字表示循环次数
[1] 黄廷林, 赵金亚,张海涵,等. 一株异养硝化-好氧反硝化菌JY78的筛选及其脱氮特性研究[J]. 安全与环境学报, 2016, 16(4): 325-331.
[2] 余润兰, 苗雷. 异养硝化细菌Alcaligenes sp.S3除氮特性及动力学[J]. 环境工程学报, 2012, 6(3): 869-872.
[3] SCHMIDT I, SLIEKERS O, SCHMID M, et al. New concepts of microbial treatment processes for the nitrogen removal in wastewater[J]. Fems Microbiol Rev, 2003, 27(4): 481-492.
[4] STEINLE P, THALMANN P, H HENER P, et al. Effect of environmental factors on the degradation of 2,6-dichlorophenol in soil[J]. Environ Sci Technol, 2000, 34(5): 771-775.
[5] 佘健, 彭聃. 污水新型生物脱氮技术研究综述[J]. 化工管理, 2016(35): 228-229.
[6] 聂玉华. 微曝气强化生态浮床对污水中氮元素的去除效果研究[D]. 成都:西南交通大学, 2015.
[7] 赵佩文. 不同氮污染水体中微生物对环境的生态响应[D]. 武汉:华中农业大学, 2016.
[8] XU Y, HE T, LI Z, et al. Nitrogen removal characteristics of pseudomonas putida Y-9 capable of heterotrophic nitrification and aerobic denitrification at low temperature[J]. BioMed Research International,2017, 17(10): 142-148.
[9] 程芸. 外源信号分子对脱氮副球菌反硝化过程调控作用的研究[D]. 合肥:中国科学技术大学, 2016:16.
[10] ROBERTSON L A, NIEL E W J V, TORREMANS R A M, et al. Simultaneous nitrification and denitrification in aerobic chemostat cultures of Thiosphaera pantotropha[J]. Applied & Environmental Microbiology, 1988, 18(4): 305-315.
[11] 彭虹. 固定化微生物技术在环境工程中的应用分析[J]. 资源节约与环保, 2017,21 (11): 63-64.
[12] SANJEEVKUMAR S, NAYAK A S, SANTOSHKUMAR M, et al. Paracoccus denitrificans SD1 mediated augmentation with indigenous mixed cultures for enhanced removal of N,N -dimethylformamide from industrial effluents[J]. Biochem Eng J, 2013, 79(2): 1-6.
[13] DZIEWIT L, DMOWSKI M, BAJ J, et al. Plasmid pAMI2 of Paracoccus aminophilus JCM 7686 carries N,N-dimethylformamide degradation-related genes whose expression is activated by a luxR family regulator[J]. Appl Environ Microbiol, 2010, 76(6): 1 861-1 869.
[14] SARMA S J, PAKSHIRAJAN K. Surfactant aided biodegradation of pyrene using immobilized cells of Mycobacterium frederiksbergense[J]. Int Biodeter Biodegr, 2011, 65(1): 73-77.
[15] 陈晓国, 陈博,胡帆, 等. 固定化降解菌去除原水中微囊藻毒素[J]. 武汉理工大学学报, 2011(7): 112-115.
[16] PATIL N K, VEERANAGOUDA Y, VIJAYKUMAR M H, et al. Enhanced and potential degradation of o- phthalate by Bacillus sp. immobilized cells in alginate and polyurethane[J]. Int Biodeter Biodegr, 2006, 57(2): 82-87.
[17] SASAKI H, NONAKA J, SASAKI T, et al. Ammonia removal from livestock wastewater by ammonia-assimilating microorganisms immobilized in polyvinyl alcohol[J]. J Ind Microbiol Biotechnol, 2007, 34(2): 105-110.
[18] JEONG S K, CHO J S, KONG I S, et al. Purification of aquarium water by PVA gel-immobilized photo synthetic bacteria during goldfish rearing[J]. Biotechnology & Bioprocess Engineering, 2009, 14(2): 238-247.
[19] VEJVODA V, KAPLAN O, KLOZOV J, et al. Mild hydrolysis of nitriles by Fusarium solani strain O1[J]. Folia Microbiol, 2006, 51(4): 251-256.
[20] REBRO M, ROSENBERG M, GROSOV Z, et al. Ethanol production from starch hydrolyzates using Zymomonas mobilis and glucoamylase entrapped in polyvinylalcohol hydrogel[J]. Applied Biochemistry & Biotechnology, 2009, 158(3): 561-570.
M, ROSENBERG M, GROSOV Z, et al. Ethanol production from starch hydrolyzates using Zymomonas mobilis and glucoamylase entrapped in polyvinylalcohol hydrogel[J]. Applied Biochemistry & Biotechnology, 2009, 158(3): 561-570.
[21] 左昌平. 固定化细胞技术在废水处理中的运用分析[J]. 环境与发展, 2017, 29(6): 120-121.
[22] 赵诣. 三株异养硝化细菌的分离、特征及其对水产养殖废水脱氮作用研究[D]. 杭州:浙江大学, 2010.
[23] NEIDHARDT F C, BLOCH P L, SMITH D F. Culture medium for enterobacteria[J]. J Bacteriol, 1974, 119(3): 736-747.
[24] 水质总氮的测定碱性过硫酸钾消解紫外分光光度法颁布新标准[J]. 给水排水, 2012(5): 139-142.
[25] 城镇污水处理厂污染物排放标准[C]. 稀土环保、放射防护及劳动卫生学术交流会暨稀土环保与新技术论坛,2011.
[26] 酒卫敬, 汪苹,李奥搏, 等. 海藻酸钠作为固定化细胞包埋剂的研究[J]. 科技创新导报, 2011 (2): 12-13.