海带(Laminaria japonica Aresch)是一种重要食品、肥料、饲料及工业原料,有着很高的经济价值。据统计,2017年,我国经济海藻养殖总量达223.5万t,其中海带(鲜品)年产量达148.7万t[1]。而目前国内对海带的加工方式还是以自然晒干、烘干、盐渍等简单加工为主,无论哪种方式,都面临着环境污染严重、高耗能、劳动密集、附加值低等严峻问题。
近年来,海带提取物相关技术、产品陆续涌现,尤其是在农业[2]、食品[3]、化妆品[4]、保健品[5]、医药[6]等领域表现出了广阔的应用前景。工业上,海带的提取加工方法主要有化学法、物理法、生物法等[7-8]。化学法和物理法存在能耗高、污染环境的缺点;而生物发酵降解技术是利用微生物产生的褐藻胶裂解酶、纤维素酶、蛋白酶、淀粉酶等来降解藻体,是海带提取加工产业的创新应用,具有反应条件温和、节约能耗、绿色环保等特点,是海带及其他经济海藻提取加工的新技术。目前,国内外对海带的生物降解方法仍以生物酶解技术为主[9-10],存在降解得率低、资源浪费大、酶制剂成本高等问题。只有少量文献报道利用复合菌株对海带进行发酵降解[11-12],而已报道的产酶菌株种类较少,且产酶较单一,产酶能力低[13-15],难以满足工业生产的需求。
皱纹盘鲍主要以海带为食,其肠道内含有多种益生菌及产褐藻胶裂解酶的菌株[16-18],但从鲍鱼肠道内筛选应用于降解海带的微生物尚未见报道。本试验从鲍鱼肠道中,以筛选产褐藻胶裂解酶菌株为出发点,进一步筛选能够对海带进行发酵降解的海洋源菌株,最大程度地提取和利用以褐藻胶为主的海带有效成分,提高海带降解得率。
1 材料与方法
1.1 材料与试剂
成熟鲍鱼:威海长青海洋科技股份有限公司;褐藻胶裂解酶:1 000 U/mL,国家海产贝类工程技术研究中心;复合酶:20 000 U/mL,诺维信创新与发展中心;血液琼脂基础,脱纤维羊血:青岛高科园海博生物技术有限公司;细菌基因组DNA提取试剂盒:宝日医生物技术(北京)有限公司。
褐藻酸钠,MgSO4·7H2O,FeSO4·7H2O,(NH4)2SO4,KH2PO4,K2HPO4,蛋白胨,酵母粉,可溶性淀粉,FePO4,KCl,CuSO4,MgCl2:分析纯,国药化学试剂有限公司。
1.2 仪器与设备
AL104分析天平,梅特勒-托利多仪器有限公司;L535-1低速离心机,湖南湘仪实验室仪器开发有限公司;UV2800S紫外分光光度计,上海舜宇恒平科学仪器有限公司,HFsafe-1200生物安全柜,上海力申科学仪器有限公司;DHZ大容量恒温振荡培养箱,上海精宏实验设备有限公司;SHP-250型生化培养箱,上海森信实验仪器有限公司;STTIK高压灭菌锅,施都凯仪器设备(上海)有限公司;BIOER XP基因扩增仪,杭州博日科技有限公司;SC80S凝胶成像系统,上海山富科学仪器有限公司。
1.3 培养基
富集培养基:褐藻酸钠5 g,蛋白胨2 g,MgSO4·7H2O 0.01 g,FeSO4·7H2O 0.5 g,过滤海水1 000 mL,调节初始pH至7.2,121 ℃灭菌20 min。
筛选培养基:褐藻酸钠5 g,(NH4)2SO4 2 g,KH2PO4 3 g,K2HPO4 7 g,NaCl 30 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.05 g,琼脂15 g,蒸馏水1 000 mL,调节初始pH至7.0,121 ℃灭菌20 min。
液体发酵培养基:见参考文献[19]。
血平板:配制100 mL的血液琼脂基础培养基于121 ℃灭菌15 min,冷却至50 ℃,无菌操作加入10 mL无菌的脱纤维羊血,摇匀,倾注平板,凝固后,4 ℃保存备用。
蛋白酶培养基:脱脂奶粉30 g,琼脂15 g,陈海水1 000 mL,调节培养基初始pH至7.6,121 ℃灭菌20 min。
淀粉酶培养基、纤维素酶培养基:见参考文献[20]。
1.4 菌株的筛选
1.4.1 菌种富集及初筛
取鲜活的鲍鱼肠道作为实验样品,用研钵研磨后,加入装有100 mL富集培养基的三角烧瓶中,于25 ℃下富集培养16 h,将富集后的样品梯度稀释至10-4,取各梯度下样品100 μL涂布筛选培养基,25 ℃下培养2~5 d。
1.4.2 溶血素的产生
将2216E培养基过夜培养的待测菌株点种于血平板上,25 ℃培养24 h,根据菌落周围的溶血圈情况,来判断溶血素的产生。
1.4.3 产酶能力筛选
用接种环挑取纯化后的菌株单菌落,分别点种于蛋白酶培养基、淀粉酶培养基和纤维素酶培养基,25 ℃培养24~48 h。菌落周围产生透明圈的菌株为阳性,不产透明圈的菌株为阴性。
淀粉酶培养基显色:轻轻刮下菌苔,用蒸馏水或1 mol/L NaCl溶液冲洗培养基表面,用卢戈氏碘液染色5 min。
纤维素酶培养基显色:轻轻刮下菌苔,用蒸馏水或1 mol/L NaCl溶液冲洗培养基表面,用0.1%刚果红染液染色30 min,再用1 mol/L NaCl溶液洗脱1~2次,每次浸泡20 min。
1.5 菌种鉴定
1.5.1 菌株菌落形态观察
菌株在筛选平板上25 ℃培养48 h后,观察平板上菌落形态,并进行革兰氏染色,观察细菌形态。
1.5.2 16S rRNA分子鉴定
以提取菌株的总DNA为模板,以27F和1 492R为引物[21],进行Touchdown-PCR扩增反应,反应条件为94 ℃预变性5 min,94 ℃变性30 s,60 ℃下退火30 s,72 ℃延伸1 min 30 s,每个循环降低1 ℃,共进行15个循环;再进行94 ℃变性30 s,45 ℃下退火30 s,72℃延伸1 min 30 s,共进行25个循环;最后在72 ℃下延伸10 min。凝胶回收目的片段后,送样测序。
将得到的测序结果在EzBioCloud网站上进行序列比对,并找出与之同源性接近的不同菌株序列,应用MeGA 5.0软件进行聚类与同源性分析。遵循邻接法(neighbor-joining method)原则,并通过自举分析(boostrap)进行置信度检测,自举数据集为1 000次,构建分支系统发育树。
1.6 褐藻胶裂解酶酶活力的测定
25 mL比色管中加入2 mL含1.5% NaCl的0.5% 褐藻酸钠溶液,在30 ℃水浴中放置10 min,再加入10~100 μL酶液,振荡混匀后于30 ℃水浴中反应30 min,加入3 mL DNS试剂混匀,沸水浴5 min后立即冷却至室温,定容至25 mL,在540 nm处检测光吸收值。根据葡萄糖标准曲线确定产生还原糖的量。酶活力单位定义为:30 ℃下每分钟产生1 μg的还原糖所需要的酶量。发酵液酶活力定义为:1 mL发酵液含酶活单位(U/mL)。
1.7 菌体生长和产酶曲线的绘制
在液体发酵培养基中接种3次传代后的菌株,在预实验最佳的培养条件下培养,在菌株生长过程中每间隔5 h取样1次,测定发酵液的OD600值及酶活力值大小,绘制出菌株的生长和产酶曲线。
1.8 褐藻胶裂解酶酶学性质研究
利用硫酸铵分级盐析法制备粗酶,并用20 mmol/L Tris-HCl缓冲液(pH 7.5)溶解。
最适温度的测定:在25、30、35、40、45、50 ℃下测定酶活力,其中底物浓度5‰,反应pH 7.0。
最适pH的测定:在pH 6.5、6.8、7.0、7.3、7.5、8.0、8.5下测定酶活力,其中底物浓度5‰,酶解温度是35 ℃。
金属离子对酶活力的影响:在反应体系中加入K+(KCl)、Fe2+(FeSO4·7H2O)、Cu2+(CuSO4)、Na+(NaCl)、Mg2+(MgCl2)、Ca2+(CaCl2)下测定酶活力,其中底物浓度5‰,酶解温度是35 ℃,反应pH 7.5。
1.9 海带降解得率
选取100目海带粉,海带粉与水的料液质量比为1∶12,在菌株产生的褐藻胶裂解酶最佳酶解条件下,利用菌株发酵液、褐藻胶裂解酶、复合酶对海带发酵降解6 h,并计算海带降解得率。
海带降解得率是指干海带发酵后溶于水中的可溶性固形物占干海带的百分含量,按公式(1)计算:
![]()
(1)
式中:w,海带发酵得率,%;c,海带发酵上清液的可溶性固形物的百分含量,%;m,发酵后所得海带发酵上清液质量,g;m0,发酵用的干海带质量,g。
2 结果与分析
2.1 海带降解菌株的筛选
通过以褐藻酸钠为唯一碳源的选择性培养基初筛,从鲍鱼肠道中筛选得到100多株菌,其中有12株是产褐藻胶裂解酶的菌株,通过摇床振荡发酵培养,测定不同菌株发酵上清液的酶活力大小,结果如表1所示。其中YY7菌株的酶活力最高,且经过多次传代培养后,其遗传稳定性及产酶活力稳定,因此,将此菌株进行菌种鉴定及酶学性质研究。
表1 不同菌株产褐藻胶裂解酶活力对比
Table 1 The alginate lyase activity in different strains
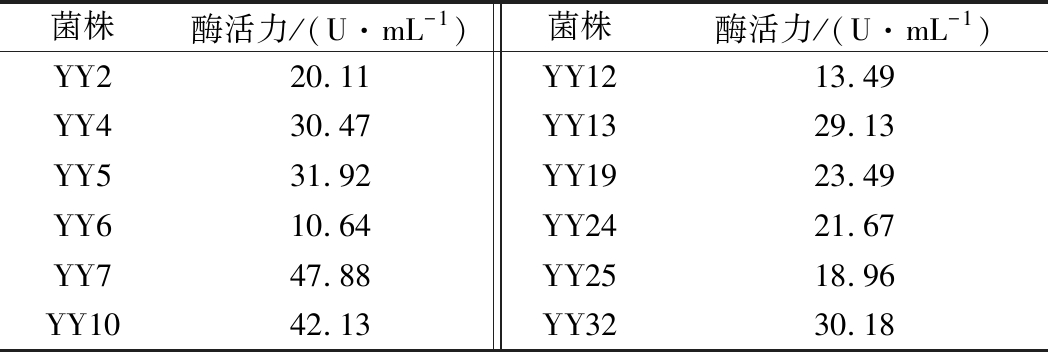
菌株酶活力/(U·mL-1)菌株酶活力/(U·mL-1)YY220.11YY1213.49YY430.47YY1329.13YY531.92YY1923.49YY610.64YY2421.67YY747.88YY2518.96YY1042.13YY3230.18
2.2 菌种的鉴定
菌株YY7在筛选平板上培养48 h后,菌体周围产生明显水解透明圈,单菌落呈现不透明圆形,边缘整齐,颜色微白,直径约1.5 mm,边缘整齐,表面光滑、湿润,稍有隆起,显微镜下观察为弯杆状,革兰氏阴性菌。
通过分子生物学手段,鉴定菌株YY7的16S rRNA基因序列为1 476 bp,在EzBioCloud网站上经过序列比对,发现其16S rRNA与弧菌属Vibrio algivorus的SA2(T)菌株的相似性最高,为99.72%,依据16S rRNA序列构建系统发育树聚类分析(图1),结合菌株的形态学特征观察,初步鉴定为弧菌属菌株,并命名为Vibrio sp. YY7。

图1 YY7菌株的16S rRNA序列系统发育树
Fig.1 Phylogenetic tree based on 16S rRNA sequence
of YY7 stains
将YY7菌株点种于血平板上培养,并没有产生溶血现象,表明YY7菌株不具有潜在致病性。通过其他培养基鉴定YY7菌株的产酶情况后,发现YY7菌株在蛋白酶培养基(图2-a)和淀粉酶培养基(图2-b)上均有透明圈,说明菌株YY7还具有蛋白酶和淀粉酶活性。水产动物益生菌的筛选大多通过体外筛选产酶菌株获得[22],因此推断YY7菌株可能是鲍肠道内的潜在益生菌。
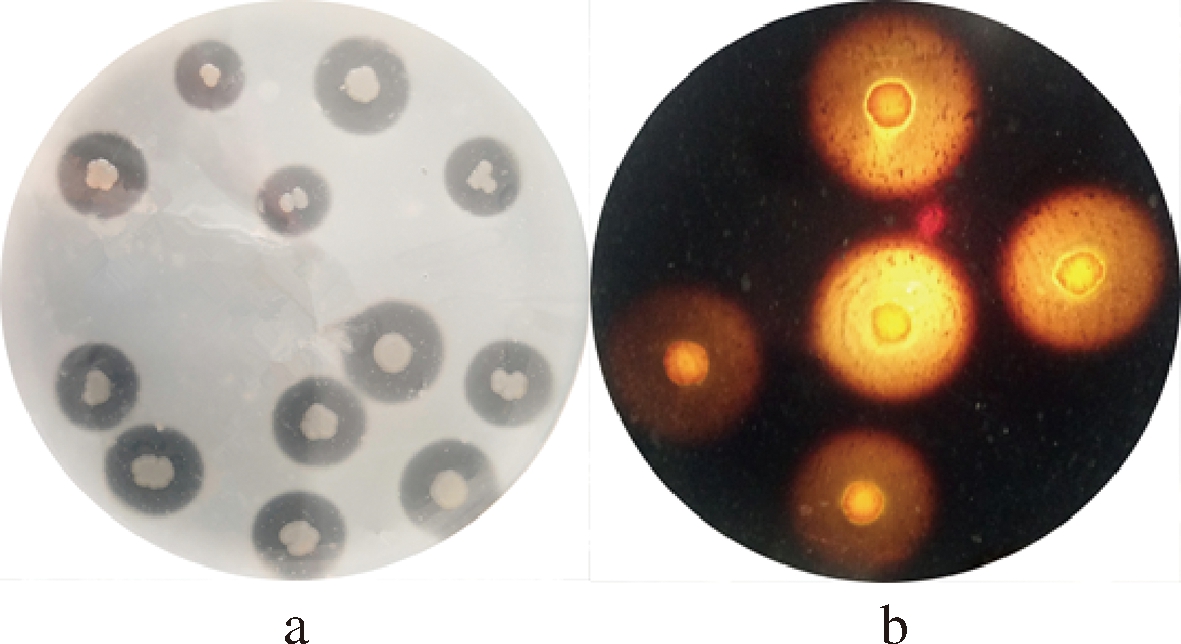
a-蛋白酶培养基; b-淀粉酶培养基
图2 YY7菌株在蛋白酶培养基和淀粉酶培养基的产酶情况
Fig.2 The enzyme production of YY7 strains on protease medium and amylase medium
2.3 菌体生长曲线和产酶曲线的绘制
对YY7菌株进行生物量监测和产褐藻胶裂解酶曲线的绘制,如图3。由图3可见,菌体的生长随时间的延长逐渐升高,在18 h后开始进入稳定生长期,菌株生物量接近最大值,酶活力在20 h达到最高值,为54.31 U/mL,与已报道的弧菌Vibrio sp. QY107[14]、Vibrio sp. SS-1[18]等菌株相比,菌株YY7的发酵产酶周期更短,生产速度较快,在工业化生产中,极大缩短了发酵时间,从而降低杂菌污染的风险,节约了生产成本,具有极大的生产优势。
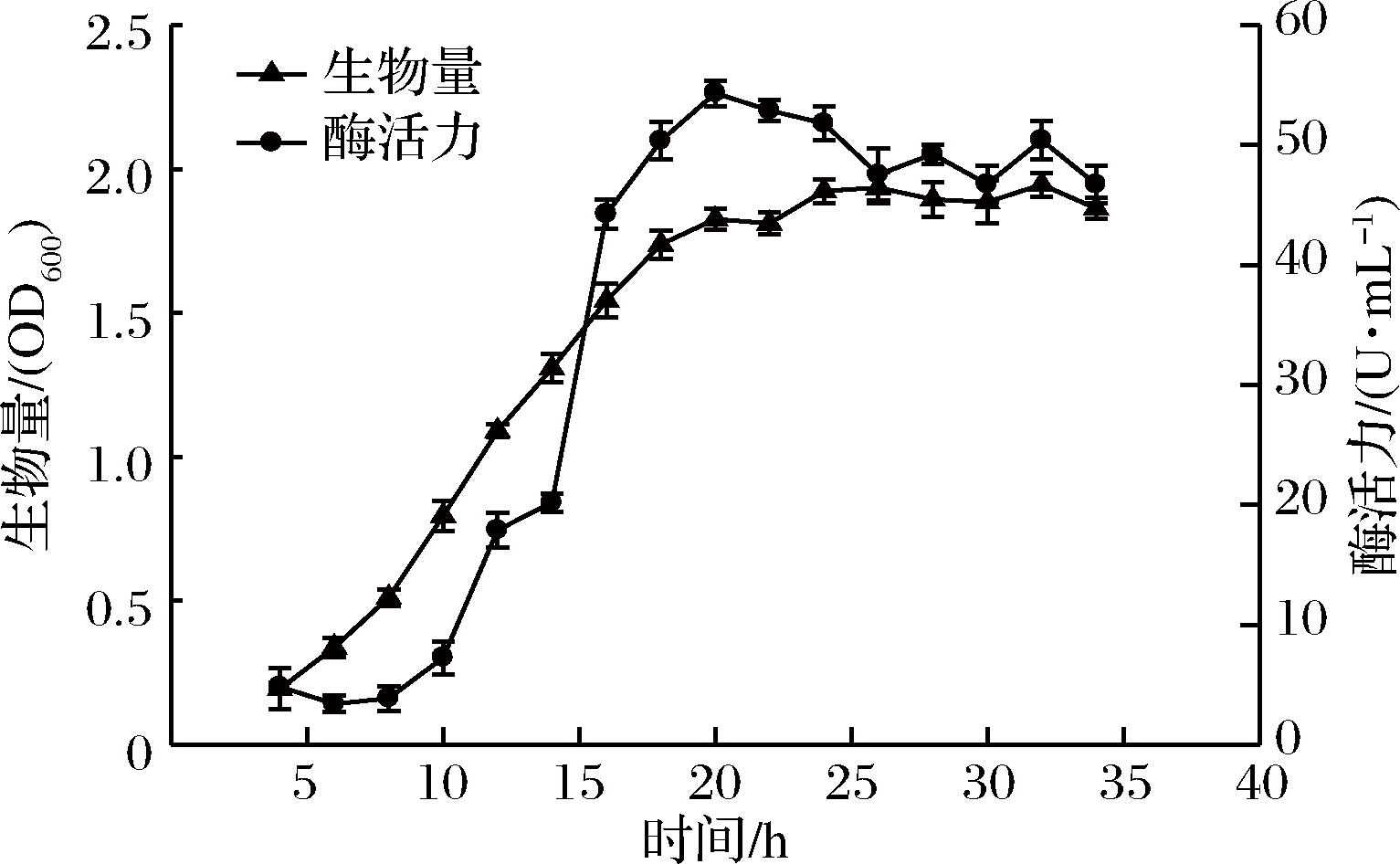
图3 YY7菌株的生长曲线及酶活力曲线
Fig.3 Growth curve and enzyme activity curve of YY7 strains
2.4 褐藻胶裂解酶酶学性质研究
2.4.1 褐藻胶裂解酶最适反应温度的确定
将酶反应体系分别置于25、30、35、40、45、50 ℃的水浴中反应,测定不同温度下褐藻胶裂解酶的活力,结果见图4。从图4可以看出,随着温度升高,酶活力逐渐升高,35 ℃达到最高值,40 ℃时酶活力略有降低,之后温度越高,酶活力逐渐降低,可能是温度越高,对酶的破坏越大,从而活力逐渐降低。故该酶的最适反应温度为35 ℃。
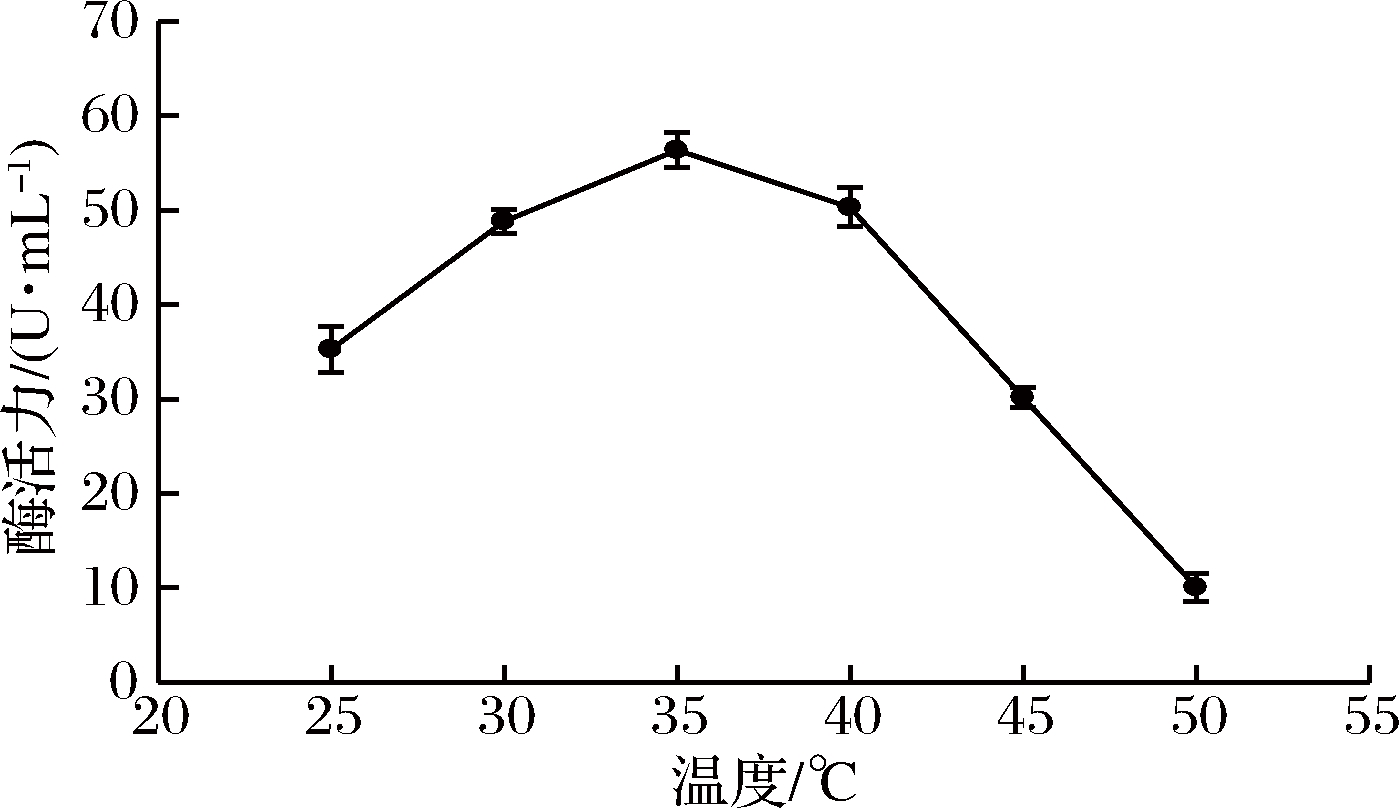
图4 温度对酶活力的影响
Fig.4 Effect of temperature on enzyme activity
2.4.2 褐藻胶裂解酶最适pH确定
酶解反应体系中pH是影响酶的结构和稳定性的重要因素,同时也影响底物和酶的解离状态[23]。为探究反应体系pH对褐藻胶裂解酶活力的影响,选取pH 6.5、6.8、7.0、7.3、7.5、8.0、8.5七个梯度进行酶活力测定,结果见图5。由图5可知,褐藻胶裂解酶活力随着体系pH的增大呈现先增大后减小趋势,在pH 7.5附近达到最大值,继续增大pH,褐藻胶裂解酶活力反而下降,可能是碱性环境影响了酶与底物的结合,也可能是在碱性环境下酶蛋白的结构和稳定性都遭到了破坏。因此该酶的最适反应pH为7.5。

图5 pH对酶活力的影响
Fig.5 Effect of pH on enzyme activity
2.4.3 金属离子对褐藻胶裂解酶酶解反应的影响
选取5种金属离子研究它们对褐藻胶裂解酶活力的影响,结果见图6。从图6可以看出Na+、Mg2+、K+、Ca2+对酶活力都有不同程度的促进作用,此结果与李丽妍[24]的结果一致,各金属离子对酶活力的促进作用由高到低依次为Na+>Mg2+>K+>Ca2+,Na+对酶活力的促进作用最大,可能与产酶菌株来自高盐的海洋环境有关[24],且褐藻胶裂解酶对Na+的依赖性较高[25]。而Fe2+和Cu2+对褐藻胶裂解酶活力起抑制作用。因此,在褐藻胶裂解酶的应用过程中,可以根据需求在反应体系中添加Na+、Mg2+、K+、Ca2+,提高酶活力。

图6 金属离子对酶活力的影响
Fig.6 Effect of metal ion on enzyme activity
2.5 海带降解效果分析
2.5.1 海带发酵过程中总糖及还原糖含量变化
海带粉与水按1∶12比例搅拌均匀,将反应体系pH调至7.5±0.1后,加入1 000 U发酵液或酶,于35 ℃下酶解6 h。YY7发酵液降解海带过程中总糖及还原糖含量的变化情况见图7。由图7可见,海带在酶解发酵过程中,反应体系中的总糖和还原糖含量逐渐升高,这可能与菌株YY7发酵液中各种酶的作用有关,海带中褐藻胶、海藻淀粉、海藻多糖等大分子物质都有可能被部分降解。
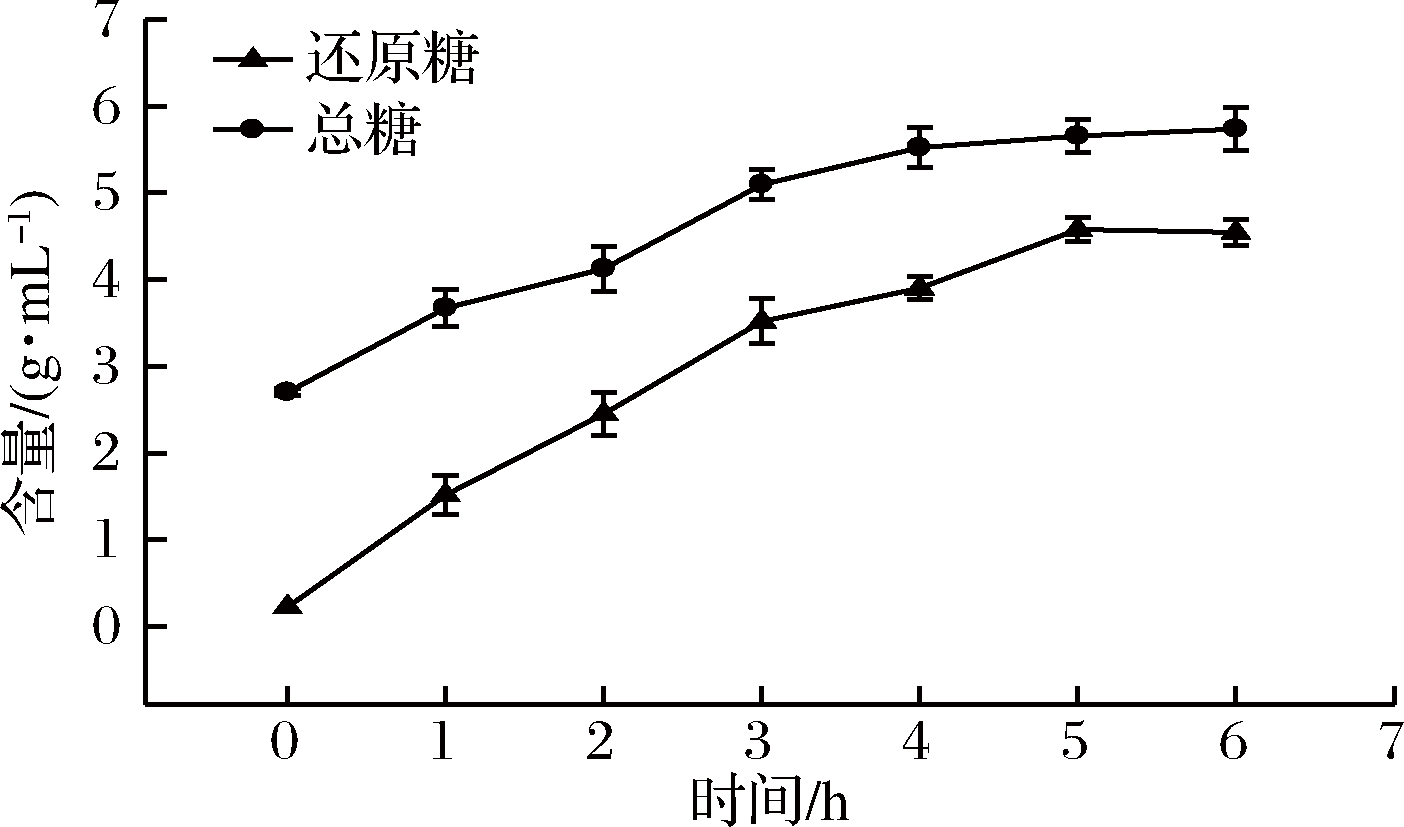
图7 海带发酵过程中总糖及还原糖含量变化
Fig.7 Content changes of total sugar and reducing sugar during fermentation of Laminaria japonica Aresch
2.5.2 海带降解得率对比分析
海带降解得率反应海带降解效果,海带降解得率对比见图8。与褐藻胶裂解酶和复合酶相比,YY7发酵液对海带的降解效果最佳,海带降解得率可达到65%以上,表明YY7发酵液对海带降解具有较好的效果。
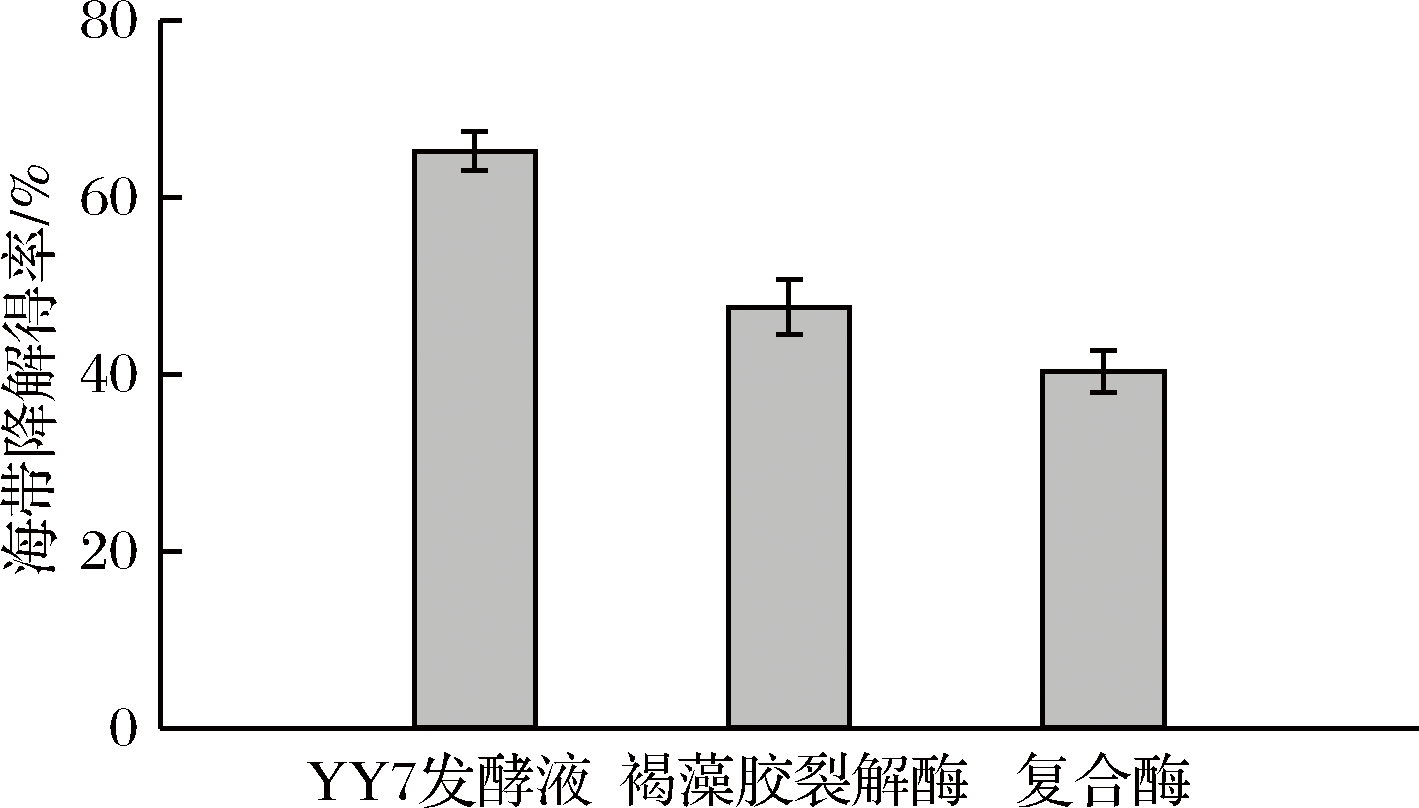
图8 不同酶对海带降解得率的影响
Fig.8 Effect of different enzymes on degradation yield ofLaminaria japonica Aresch
2.5.3 海带降解前后的显微结构差异
海带粉通过YY7发酵液降解前后,海带粉的显微结构发生明显的变化,结果见图9。

图9 海带粉降解前后的显微照片
Fig.9 Photomicrographs before and after degradation of kelp powder
从图9中可以看出,海带粉降解前,海带的细胞结构较明显,完整的细胞结合较紧密;而海带粉降解后,其细胞结构明显被降解,完整的细胞也被分散开。这可能是由于海带粉经过YY7菌株产生的褐藻胶裂解酶、蛋白酶、淀粉酶等降解后,细胞间结合变得松散,细胞壁、细胞膜等组织结构也被部分降解。
3 结论
从皱纹盘鲍肠道中,以褐藻酸钠为唯一碳源,筛选出产褐藻胶裂解酶菌株12株,其中酶活力最高的是YY7菌株,通过16S rRNA初步鉴定YY7菌株与弧菌属Vibrio algivorus的SA2(T)菌株的相似性最高,为99.72%;通过培养基鉴定发现,YY7菌株不具有溶血性,同时还产蛋白酶和淀粉酶。根据YY7菌株的生长曲线和产酶曲线可知,YY7菌株的生长速度快,其褐藻胶裂解酶活力在20 h可达到最高54.31 U/mL,最适温度为35 ℃,最适pH 7.5,Na+、Mg2+、K+、Ca2+对褐藻胶裂解酶活力具有促进作用,Fe2+和Cu2+起抑制作用。最后利用YY7发酵液对海带粉进行降解处理发现,海带降解得率可达65%以上,降解效果佳。本研究结果表明,该菌株适合应用于海带的加工利用,对于提高海带利用率具有非常重要的作用。下一步还将继续优化YY7菌株的发酵培养基及发酵条件,并进行放大培养,探索其在海带精深加工的应用研究。
[1] 农业农村部渔业渔政管理局,全国技术推广总站,中国水产学会.中国渔业统计年鉴[M].北京:中国农业出版社,2018,50.
[2] 程丽林,聂小宝,王庆国,等. 海带多糖复合涂膜对辣椒保鲜效果的研究[J]. 食品工业科技, 2015, 36(7): 342-345.
[3] 臧盈盈,陈丽娇,陈继承,等. 海带降血压活性肽面条的工艺优化[J]. 食品工业科技, 2017, 38(4): 203-208.
[4] 徐睿. 海带和菲律宾蛤仔提取物对酪氨酸酶活性和黑素生成影响的研究[D]. 青岛:中国海洋大学, 2010:58-63.
[5] 王世英,陈政强. 发酵海带对刺参生长和免疫及消化生理的影响[J]. 集美大学学报, 2016, 21(6): 410-419.
[6] 赵雨茜,熊何健,吴靖娜,等. 具有降低尿酸功效的海洋天然活性物质研究进展[J]. 渔业研究, 2018, 40(3): 242-248.
[7] 吴信,王志朋,付晓婷,等. 利用海带渣制备乙醇的可行性分析及高效水解技术的研究[J]. 农产品加工(学刊), 2013(4): 4-6.
[8] 谢瑾,林宗毅,王智荣,等. 海带多糖酶法降解及其产物生物活性的研究[J]. 食品研究与开发,2016, 37(20): 23-27.
[9] 常丽荣,赵祥忠,姚艳艳,等. 海带快速液化工艺优化及其产物分析[J]. 食品与机械,2017, 33(10): 169-173.
[10] SHARMA S, HORN SJ. Enzymatic saccharification of brown seaweed for production of fermentable sugars[J]. Bioresource Technology, 2016, 213:155-161.
[11] 郭丽琼,郭心悦,储炫,等. 海带益生菌发酵条件的优化和营养成分分析[J]. 现代食品科技, 2015, 31(8): 280-285.
[12] 柏超. 海带降解复合菌的选育及其功能研究[D]. 杭州:浙江大学, 2012:27-35.
[13] 许超,熊亚茹,卢明倩,等. 一株具有褐藻胶降解能力的海洋细菌的筛选鉴定及其多糖利用能力研究[J]. 生物技术通报, 2017, 33(4): 198-204.
[14] 郭恩文,王亚,于文功,等. 产双功能褐藻胶裂解酶菌株的筛选与初步研究[J]. 现代生物医学进展,2013, 13(29): 5 606-5 609.
[15] 杨晓雪,董学前,张永刚,等. 复合酶法高效提取海带中褐藻糖胶[J].食品工业科技, 2017, 38(6):142-146.
[16] 姜海峰. 皱纹盘鲍肠道益生菌的筛选与应用研究[D]. 杨凌:西北农林科技大学, 2012:20-32.
[17] 凌宇恒,吴淑妃,柯才焕,等. 鲍肠道益生菌芽孢杆菌A3440菌株培养基及发酵条件优化[J]. 厦门大学学报(自然科学版),2016, 55(3): 336-342.
[18] 李云涛,汪立平,张孟,等. 鲍鱼来源褐藻胶裂解酶菌株的筛选及发酵条件优化[J]. 大连海洋大学学报,2017, 32(5): 574-583.
[19] 侯保兵. 褐藻胶裂解酶产生菌的筛选、发酵优化及其酶学特性研究[D]. 杭州:浙江工业大学, 2009:18.
[20] 孙雪莹. 虾夷扇贝幼体及育苗池水体细菌群落动态及潜在益生菌筛选[D]. 大连:大连海洋大学, 2016:43.
[21] 李昭,乔延路,范晓阳,等. 南太平洋环流区底层水可培养细菌多样性研究[J]. 中国海洋大学学报(自然科学版), 2014(6): 52-59.
[22] 姜海峰. 皱纹盘鲍肠道益生菌的筛选与应用研究[D].陕西:西北农林科技大学, 2012:31.
[23] 时岩玲,于文功,路新枝,等. 海洋紫色杆菌β-琼胶酶的分离纯化及性质[J]. 武汉大学学报(理学版), 2008, 54(4):497-502.
[24] 李丽妍. 褐藻胶裂解酶系的酶化学、产物分析及应用研究[D]. 青岛:中国海洋大学, 2011:48-49.
[25] 付晓婷. 海洋细菌(Agarivorans albus YKW-34)产生的褐藻胶裂解酶及琼胶酶的研究[D]. 青岛:中国海洋大学, 2008:38.