啤酒老化是啤酒行业亟待解决的问题,不仅对啤酒风味及风味稳定性产生严重的不利影响,还降低啤酒的新鲜度和缩短其货架期。风味稳定性是评价啤酒质量的重要指标之一,其中SO2是啤酒中最有效的风味稳定剂和抗氧化剂之一,通过与H2O2反应清除啤酒中的氧自由基,从而有效提高啤酒抗氧化能力[1-3]。乙醛是啤酒中含量最高的羰基化合物,与啤酒老化直接相关[4],其形成过程与酵母的能量代谢密切相关。过高的乙醛含量给啤酒带来生青味和腐烂苹果味等不良风味,同时影响啤酒的风味稳定性。
啤酒酵母是啤酒酿造的核心,发酵过程中产生的SO2和乙醛直接影响成品酒的风味稳定性。发酵过程中,酵母细胞还原![]() 产生
产生![]() 后,经Ssu1p运输至胞外形成
后,经Ssu1p运输至胞外形成![]() 其中,
其中,![]() 还原途径是关键的含硫氨基酸合成途径,受到蛋氨酸和半胱氨酸的反馈抑制[5-7]。据文献报道,增加麦汁中苏氨酸
还原途径是关键的含硫氨基酸合成途径,受到蛋氨酸和半胱氨酸的反馈抑制[5-7]。据文献报道,增加麦汁中苏氨酸![]() 和Zn2+均可增加啤酒酵母SO2产量[8-9]。乙醛则在丙酮酸脱羧酶和乙醇脱氢酶II作用下形成[10-12]。研究表明,SO2与乙醛存在一定的联系但仍不清楚。首先,SO2可与羰基化合物进行反应[13],尤其是醛类和酮类物质,而啤酒中乙醛约占总醛类的60%。在体外实验中,SO2及其与乙醛反应生成的复合物均能抑制乙醇脱氢酶活性[14]。此外,葡萄汁中添加
和Zn2+均可增加啤酒酵母SO2产量[8-9]。乙醛则在丙酮酸脱羧酶和乙醇脱氢酶II作用下形成[10-12]。研究表明,SO2与乙醛存在一定的联系但仍不清楚。首先,SO2可与羰基化合物进行反应[13],尤其是醛类和酮类物质,而啤酒中乙醛约占总醛类的60%。在体外实验中,SO2及其与乙醛反应生成的复合物均能抑制乙醇脱氢酶活性[14]。此外,葡萄汁中添加![]() 后,葡萄酒酵母乙醛产量显著提高[15-17]。与此相似是,在高浓度乙醛刺激下,酵母通过增强胞内
后,葡萄酒酵母乙醛产量显著提高[15-17]。与此相似是,在高浓度乙醛刺激下,酵母通过增强胞内![]() 还原途径来抵抗外界乙醛的毒性[18]。
还原途径来抵抗外界乙醛的毒性[18]。
与硫代谢相关的蛋氨酸、半胱氨酸和苏氨酸对啤酒酵母产SO2存在一定的影响,而对乙醛产量的影响报道甚少。为探究啤酒酵母中总SO2和乙醛产量的影响因素及两者产量之间的关系,本研究将这3种氨基酸添加于麦汁中,分析其对啤酒酵母总SO2和乙醛产量的变化情况,同时利用BiWort和BiGGY平板来定性分析3种氨基酸引起啤酒酵母SO2产量变化的原因。
1.1.1 菌株与培养基
啤酒酵母(Saccharomyces pastorianus)菌株D-A-14(保藏号:CGMCC No.6822)![]() 和S189为本实验室保藏的工业啤酒酵母菌株。
和S189为本实验室保藏的工业啤酒酵母菌株。
YEPD培养基(g/L):酵母浸出粉10,蛋白胨20,无水葡萄糖20,115 ℃下灭菌15 min。
BiGGY培养基(g/L):酵母浸出粉1,甘氨酸10,无水葡萄糖20,Na2SO3 1,柠檬酸铋铵1,琼脂粉16,115 ℃下灭菌15 min。
麦汁培养基:12 °P自制麦汁,105 ℃下灭菌10 min。
BiWort培养基(g/L):12 °P自制麦汁,柠檬酸铋铵1,琼脂粉16,105 ℃下灭菌10 min。
1.1.2 试剂
酵母浸出粉、蛋白胨、琼脂粉,生工生物工程(上海)股份有限公司;无水葡萄糖、甘氨酸、蛋氨酸、半胱氨酸、苏氨酸、亚硫酸钠,国药集团化学试剂有限公司;柠檬酸铋铵、乙醛(色谱纯),阿拉丁试剂(上海)有限公司;3-庚酮(色谱纯),Sigma-Aldrich公司;麦芽,中粮集团有限公司。
阿贝折光仪,上海豫光仪器有限公司;紫外可见分光光度计(UV-2000),尤尼柯(上海)仪器有限公司;高压灭菌锅(HVE-50),日本Hirayama公司;自动顶空进样气相色谱仪(GC-2010),日本岛津(Shimadzu)公司;台式冷冻离心机(5804 R),德国Eppendorf公司;生化培养箱(SPX-250),上海跃进医疗器械有限公司;生化培养箱(BSP-250),上海博讯实业有限公司。
1.3.1 啤酒发酵实验
挑取一环啤酒酵母菌株于10 mL 12 °P麦汁试管中,28 ℃培养36 h后转接1 mL菌液于9 mL 12 °P麦汁试管中,25 ℃培养36 h后转接入70 mL 12 °P麦汁,23 ℃培养48 h后转接入300 mL 12 °P麦汁,接种量为1×107 CFU/mL。摇匀后扣上发酵栓,用无菌水密封发酵栓后11 ℃发酵7 d。为研究蛋氨酸、半胱氨酸和苏氨酸对啤酒酵母总SO2和乙醛产量的影响,在麦汁中分别添加质量浓度为100 mg/L和200 mg/L三种氨基酸。
1.3.2 盐酸副玫瑰苯胺法测定发酵液中总SO2含量
参照文献[19]中盐酸副玫瑰苯胺法测定发酵液中总SO2含量。将发酵液在5 000×g离心5 min后取上清液,上清液中SO2与5%甲醛和盐酸副玫瑰苯胺发生反应产生紫色络合物,在550 nm波长处检测其吸光值,其总SO2的标准曲线方程为y=0.028 88x-0.007 23 (R2=0.999 2)。
1.3.3 顶空气相色谱法测定发酵液中乙醛含量
将发酵液离心后取上清,参照文献[20]中方法进行发酵液中乙醛的检测。分别添加4 mL发酵液、1 mL 30 mg/L 3-庚酮内标和1.8 g NaCl于顶空瓶。检测条件为:FID检测器温度为250 ℃;色谱柱由初始温度40 ℃以10 ℃/min升至180 ℃。
1.3.4 比重瓶法测定发酵液中乙醇含量
取经滤纸过滤后的发酵液100 mL,并加入50 mL去离子水于圆底烧瓶进行蒸馏,将100 mL馏出物进行比重瓶法测定,计算比值后查阅GB/T 4928—2008啤酒分析方法,其对应值为发酵液中乙醇体积分数(φ)。
1.3.5 蛋氨酸、半胱氨酸和苏氨酸对啤酒酵母S2-产量和![]() 还原酶活性影响
还原酶活性影响
为定性检测蛋氨酸、半胱氨酸和苏氨酸对啤酒酵母S2-产量和![]() 还原酶活性的作用,分别添加200 mg/L三种氨基酸于BiWort和BiGGY平板中,置于28 ℃下培养后观察菌落颜色。其中,菌落颜色越深则说明该菌株S2-产量更高或
还原酶活性的作用,分别添加200 mg/L三种氨基酸于BiWort和BiGGY平板中,置于28 ℃下培养后观察菌落颜色。其中,菌落颜色越深则说明该菌株S2-产量更高或![]() 还原酶活性更高[21-23]。
还原酶活性更高[21-23]。
啤酒发酵过程中,啤酒酵母乙醛生成量在3~35 mg/L范围内[24],对成品啤酒的风味及其稳定性有着重要的影响。包装啤酒中SO2含量一般在8~9 mg/L时可保持其风味稳定性,但啤酒酵母SO2产量少,不能满足其抗氧化功能[25]。选取实验室保藏的4株典型的啤酒酵母进行为期7 d,11 ℃发酵后,测定发酵液中总SO2和乙醛含量。由表1所示,菌株D-A-14总SO2产量最低(1.84 mg/L),约为菌株![]() 的18.0%。此外,菌株D-A-14乙醛产量也最低,为5.91 mg/L,是菌株
的18.0%。此外,菌株D-A-14乙醛产量也最低,为5.91 mg/L,是菌株![]() 的51.8%。虽然有研究表明提高酵母产SO2能力的同时乙醛产量也随之增加[26-28],但其两者产量关系仍不明确。在选定的4株啤酒酵母中,总SO2和乙醛产量存在着一定的相关性。
的51.8%。虽然有研究表明提高酵母产SO2能力的同时乙醛产量也随之增加[26-28],但其两者产量关系仍不明确。在选定的4株啤酒酵母中,总SO2和乙醛产量存在着一定的相关性。
表1 典型啤酒酵母菌株中总SO2和乙醛产量
Table 1 The production of total SO2 and acetaldehydein brewer’s yeasts

菌株总SO2/(mg·L-1)乙醛/(mg·L-1)D-A-141.84±0.10d5.91±0.17bG-037.43±0.01b7.25±0.27bM1410.20±0.02a11.41±1.36aS1894.00±0.33c6.79±0.81b
注:同一行不同字母代表显著性差异(P<0.05)。
菌株D-A-14是由菌株![]() 突变得到的低产乙醛菌株,2种菌株具有相类似的遗传背景[29]。前期研究发现,发酵结束后菌株D-A-14和
突变得到的低产乙醛菌株,2种菌株具有相类似的遗传背景[29]。前期研究发现,发酵结束后菌株D-A-14和![]() 中主要在糖代谢、蛋白质代谢和氨基酸代谢途径发生变化,其中包括与含硫氨基酸代谢中的半胱氨酸和蛋氨酸合成代谢、苏氨酸分解代谢及乙醛代谢等[30]。菌株
中主要在糖代谢、蛋白质代谢和氨基酸代谢途径发生变化,其中包括与含硫氨基酸代谢中的半胱氨酸和蛋氨酸合成代谢、苏氨酸分解代谢及乙醛代谢等[30]。菌株![]() 中糖酵解途径PGK1、GPM1、GPM2、GPM3、ENO2及PDC1、PDC5基因表达水平上调可能引起其乙醛产量增加,而
中糖酵解途径PGK1、GPM1、GPM2、GPM3、ENO2及PDC1、PDC5基因表达水平上调可能引起其乙醛产量增加,而![]() 还原途径的通量下调则暗示着该菌株SO2产生能力的增加(图1)[30]。据文献报道,含硫化合物代谢过程中间代谢物半胱氨酸和苏氨酸均可提高其SO2产量,而蛋氨酸对酵母总SO2产量的影响依赖于酵母菌种的遗传背景[9, 28, 31]。本研究以菌株D-A-14和
还原途径的通量下调则暗示着该菌株SO2产生能力的增加(图1)[30]。据文献报道,含硫化合物代谢过程中间代谢物半胱氨酸和苏氨酸均可提高其SO2产量,而蛋氨酸对酵母总SO2产量的影响依赖于酵母菌种的遗传背景[9, 28, 31]。本研究以菌株D-A-14和![]() 为例,通过添加3种氨基酸分析其对菌株SO2以及乙醛产量的影响,并探索菌株SO2与乙醛产量之间的关系,为选育高产SO2低产乙醛的抗老化啤酒酵母提供一定的理论基础和策略。
为例,通过添加3种氨基酸分析其对菌株SO2以及乙醛产量的影响,并探索菌株SO2与乙醛产量之间的关系,为选育高产SO2低产乙醛的抗老化啤酒酵母提供一定的理论基础和策略。
加黑代表啤酒酵母菌株![]() 中表达上调,浅色代表啤酒酵母菌株
中表达上调,浅色代表啤酒酵母菌株![]() 中表达下调
中表达下调
图1 啤酒酵母中含硫氨基酸和乙醛代谢图
Fig.1 Sulfur amino acid and acetaldehyde metabolism in brewer’s yeast
2.2.1 外源蛋氨酸对啤酒酵母总SO2和乙醛产量的影响
蛋氨酸是酵母细胞生长所需重要的含硫氨基酸之一,麦汁中蛋氨酸含量较高,质量浓度超过50 mg/L[32]。蛋氨酸可抑制细胞内![]() 还原途径中基因的表达,从而影响啤酒酵母SO2产量[5, 7]。研究发现,蛋氨酸对2种菌株总SO2和乙醛产量的作用效果不同。菌株
还原途径中基因的表达,从而影响啤酒酵母SO2产量[5, 7]。研究发现,蛋氨酸对2种菌株总SO2和乙醛产量的作用效果不同。菌株![]() 中,外源添加100 mg/L和200 mg/L蛋氨酸均可抑制SO2的生成,使总SO2产量分别降低至原来的57.0%和48.6%。同时乙醛产量也相应显著降低(P<0.05),分别降至原来的49.2%和40.7%。而菌株D-A-14中,蛋氨酸的添加引起总SO2和乙醛产量略微增加(表2)。添加200 mg/L蛋氨酸后,其总SO2产量增加了16.3%,同时乙醛含量也增加了19.3%。尽管其影响效果不同,但2种菌株中2种物质的调整趋势是一致的。此外,蛋氨酸的添加明显降低了菌株D-A-14的乙醇产量(表2)。
中,外源添加100 mg/L和200 mg/L蛋氨酸均可抑制SO2的生成,使总SO2产量分别降低至原来的57.0%和48.6%。同时乙醛产量也相应显著降低(P<0.05),分别降至原来的49.2%和40.7%。而菌株D-A-14中,蛋氨酸的添加引起总SO2和乙醛产量略微增加(表2)。添加200 mg/L蛋氨酸后,其总SO2产量增加了16.3%,同时乙醛含量也增加了19.3%。尽管其影响效果不同,但2种菌株中2种物质的调整趋势是一致的。此外,蛋氨酸的添加明显降低了菌株D-A-14的乙醇产量(表2)。
表2 外源添加蛋氨酸对啤酒酵母产总SO2、乙醛和乙醇的影响
Table 2 Effects of methionine on total SO2, acetaldehyde and ethanol production in brewer’s yeasts D-A-14 and ![]()

蛋氨酸/(mg·L-1)总SO2/(mg·L-1)乙醛/(mg·L-1)乙醇/%M14D-A-14M14D-A-14M14D-A-14010.20±0.02a1.84±0.10b11.41±1.36a5.91±0.17c5.64±0.04a4.45±0.05a1005.81±0.02b1.99±0.16ab5.62±0.68b6.69±0.08b5.24±0.08b2.85±0.03b2004.96±0.14c2.14±0.02a4.64±0.99b7.05±0.06a5.27±0.01b2.61±0.03c
注:同一列不同字母代表显著性差异(P<0.05)。
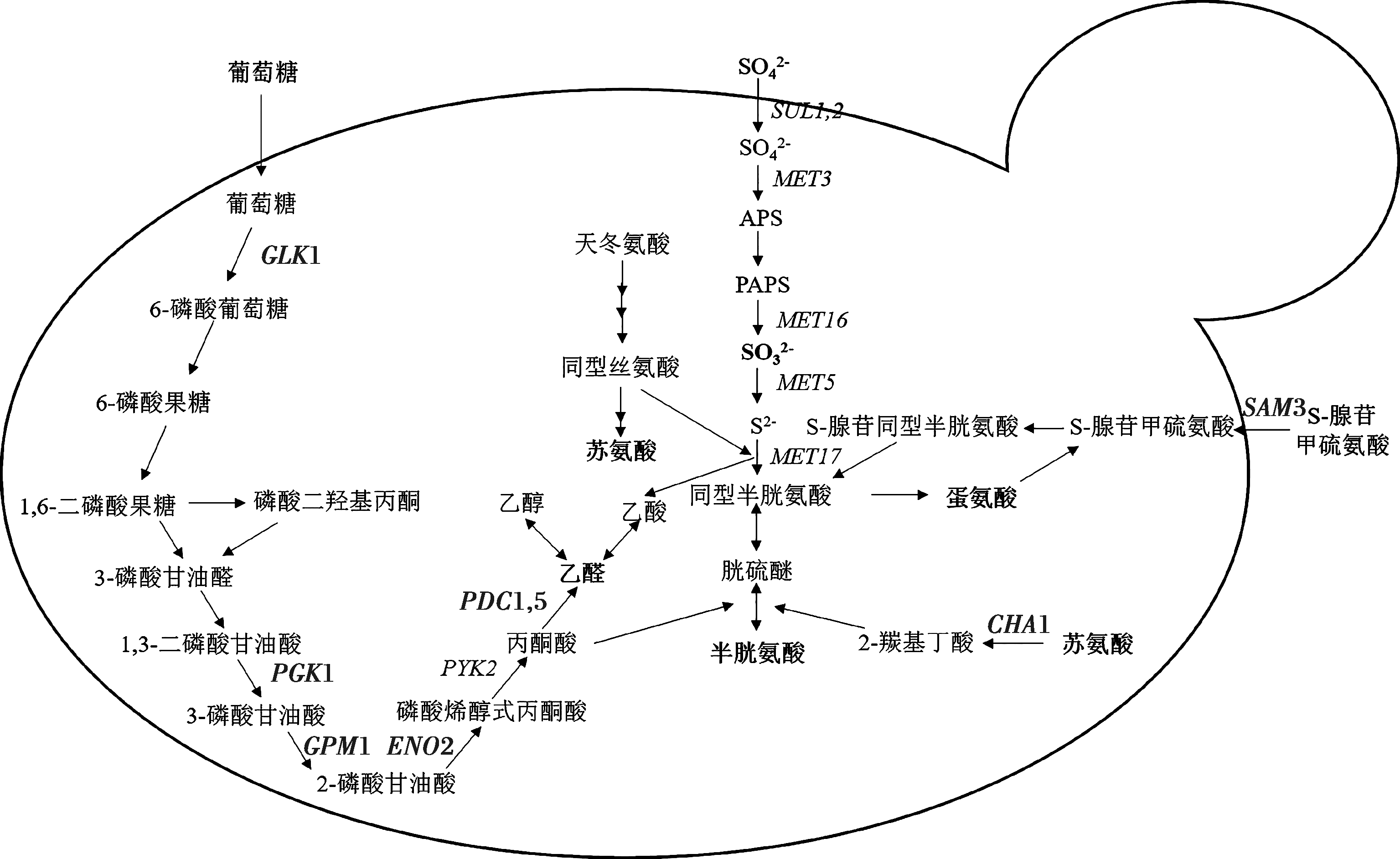
![]() 还原酶是酵母硫代谢途径中的重要酶之一,为探究蛋氨酸对2种菌株SO2产量不同影响的原因,在BiGGY平板中添加蛋氨酸来研究其对菌株
还原酶是酵母硫代谢途径中的重要酶之一,为探究蛋氨酸对2种菌株SO2产量不同影响的原因,在BiGGY平板中添加蛋氨酸来研究其对菌株![]() 还原酶活性的影响
还原酶活性的影响![]() 还原酶将
还原酶将![]() 还原成S2-以供胞内含硫化合物的生成[5],S2-与柠檬酸铋铵反应生成黑色物质,根据菌落颜色可分析判定酵母细胞中
还原成S2-以供胞内含硫化合物的生成[5],S2-与柠檬酸铋铵反应生成黑色物质,根据菌落颜色可分析判定酵母细胞中![]() 还原酶活性[21-23]。在Na2SO3为唯一硫源的BiGGY平板中,菌株
还原酶活性[21-23]。在Na2SO3为唯一硫源的BiGGY平板中,菌株![]() 菌落颜色明显浅于菌株D-A-14(图2),表明其
菌落颜色明显浅于菌株D-A-14(图2),表明其![]() 还原酶活性较低,推测是菌株
还原酶活性较低,推测是菌株![]() 高产SO2的主要原因。BiWort平板可用于判定在麦汁培养基条件下酵母产S2-的能力。由图3可发现,菌株D-A-14和
高产SO2的主要原因。BiWort平板可用于判定在麦汁培养基条件下酵母产S2-的能力。由图3可发现,菌株D-A-14和![]() 在麦汁条件下产生的S2-量相当。添加蛋氨酸后,BiWort+Met平板中2菌株菌落颜色均变浅且程度相似,表明2种菌株产S2-能力均被抑制,蛋氨酸的存在会抑制
在麦汁条件下产生的S2-量相当。添加蛋氨酸后,BiWort+Met平板中2菌株菌落颜色均变浅且程度相似,表明2种菌株产S2-能力均被抑制,蛋氨酸的存在会抑制![]() 还原途径中基因的表达[5, 7],因此本研究在培养基中添加的蛋氨酸可能抑制了
还原途径中基因的表达[5, 7],因此本研究在培养基中添加的蛋氨酸可能抑制了![]() 还原途径中相关基因的表达,从而造成黑色物质生成量降低。研究发现,啤酒酵母中S2-可来源于
还原途径中相关基因的表达,从而造成黑色物质生成量降低。研究发现,啤酒酵母中S2-可来源于![]() 和
和![]() 因此外源蛋氨酸的存在使2种菌株中
因此外源蛋氨酸的存在使2种菌株中![]() 到S2-通量均发生显著下调[5, 7, 33]。蛋氨酸对2种菌株
到S2-通量均发生显著下调[5, 7, 33]。蛋氨酸对2种菌株![]() 还原酶活性却有不同的影响,BiGGY+Met平板中菌株
还原酶活性却有不同的影响,BiGGY+Met平板中菌株![]() 的
的![]() 还原酶活性基本不受影响,而
还原酶活性基本不受影响,而![]() 至S2-的通量显著降低,因此菌株
至S2-的通量显著降低,因此菌株![]() 中
中![]() 产生量显著降低。菌株D-A-14菌落颜色明显变浅,表明蛋氨酸显著抑制其
产生量显著降低。菌株D-A-14菌落颜色明显变浅,表明蛋氨酸显著抑制其![]() 还原酶活性,同时
还原酶活性,同时![]() 至S2-的通量降低,因此菌株D-A-14中总SO2产量变化较小,甚至略有增加。
至S2-的通量降低,因此菌株D-A-14中总SO2产量变化较小,甚至略有增加。
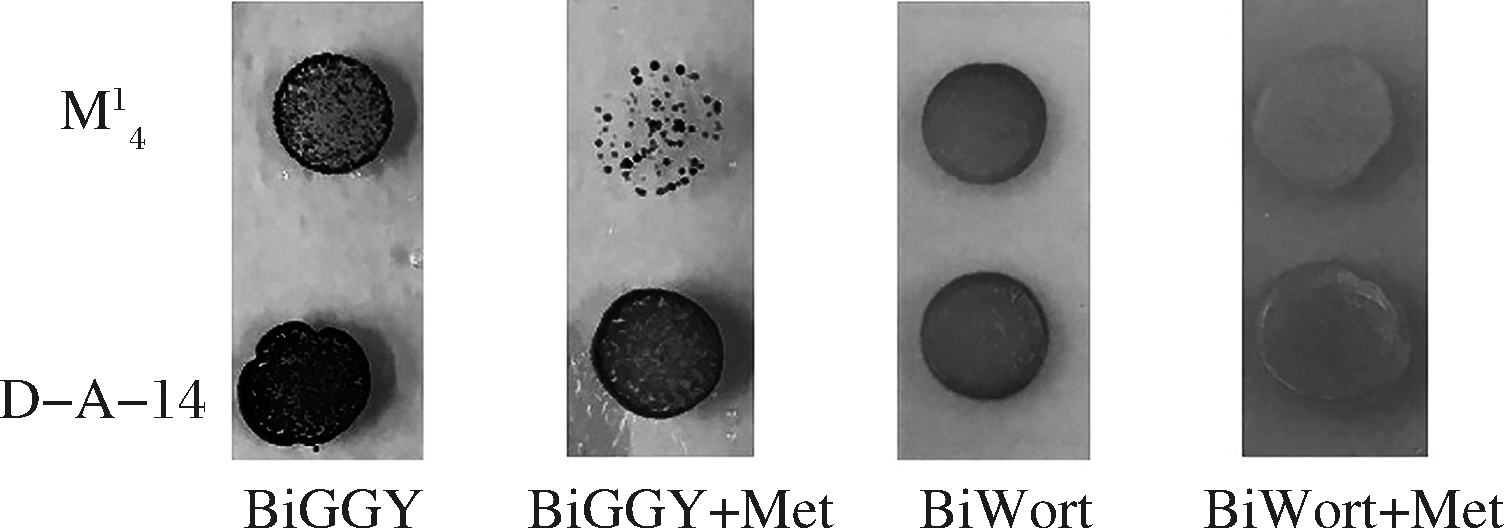
图2 蛋氨酸对啤酒酵母D-A-14和![]() 中
中![]()
还原酶活性和S2-产量的作用
Fig.2 Effects of methionine on sulfite reductase activity
and sulfide production in brewer’s yeasts D-A-14 and ![]()
2.2.2 外源半胱氨酸对啤酒酵母总SO2和乙醛产量的影响
相比于蛋氨酸,麦汁中半胱氨酸含量较少。因此,酵母细胞需要通过自身相应的代谢途径来合成半胱氨酸,![]() 还原途径则是半胱氨酸合成中最关键的途径。总体上,半胱氨酸对2种菌株总SO2、乙醛和乙醇产量的影响均较小(表3)。
还原途径则是半胱氨酸合成中最关键的途径。总体上,半胱氨酸对2种菌株总SO2、乙醛和乙醇产量的影响均较小(表3)。
表3 外源添加半胱氨酸对啤酒酵母产总SO2、乙醛和乙醇的影响
Table 3 Effects of cysteine on in total SO2, acetaldehyde and ethanol production in brewer’s yeasts D-A-14 and ![]()

蛋氨酸/(mg·L-1)总SO2/(mg·L-1)乙醛/(mg·L-1)乙醇/(%Vol.)M14D-A-14M14D-A-14M14D-A-14010.20±0.02a1.84±0.10b11.41±1.36a5.91±0.17c5.64±0.04a4.45±0.05a1009.10±0.19b2.03±0.09ab8.45±0.78b7.32±0.01a5.46±0.04b3.98±0.16b2009.61±0.02c2.14±0.04a9.68±0.74ab6.58±0.16b5.31±0.01c3.83±0.01b
注:同一列不同字母代表显著性差异(P<0.05)。
添加200 mg/L半胱氨酸可促进菌株D-A-14中总SO2产量的提高,其总SO2产量增加了16.3%,同时乙醛含量也增加了11.3%。而在菌株![]() 中,添加100 mg/L半胱氨酸对总SO2和乙醛产量的影响比添加200 mg/L更大,总SO2和乙醛产量分别下降了10.8%和25.9%。尽管如此,两者产量的变化趋势相一致。另外,从乙醇产量来看,添加不同含量的半胱氨酸均降低2种菌株的乙醇产量。
中,添加100 mg/L半胱氨酸对总SO2和乙醛产量的影响比添加200 mg/L更大,总SO2和乙醛产量分别下降了10.8%和25.9%。尽管如此,两者产量的变化趋势相一致。另外,从乙醇产量来看,添加不同含量的半胱氨酸均降低2种菌株的乙醇产量。
研究报道高浓度半胱氨酸会抑制![]() 还原途径中MET基因[7]。将半胱氨酸添加至麦汁中,BiWort平板中显示其颜色均有一定变浅,则表明S2-产量在2种菌株中均下降。由图3可知,菌株
还原途径中MET基因[7]。将半胱氨酸添加至麦汁中,BiWort平板中显示其颜色均有一定变浅,则表明S2-产量在2种菌株中均下降。由图3可知,菌株![]() 中S2-产量下降且幅度比菌株D-A-14小,但添加半胱氨酸于BiGGY平板后2种菌株
中S2-产量下降且幅度比菌株D-A-14小,但添加半胱氨酸于BiGGY平板后2种菌株![]() 还原酶活性均下降且菌株D-A-14下降幅度更大。
还原酶活性均下降且菌株D-A-14下降幅度更大。
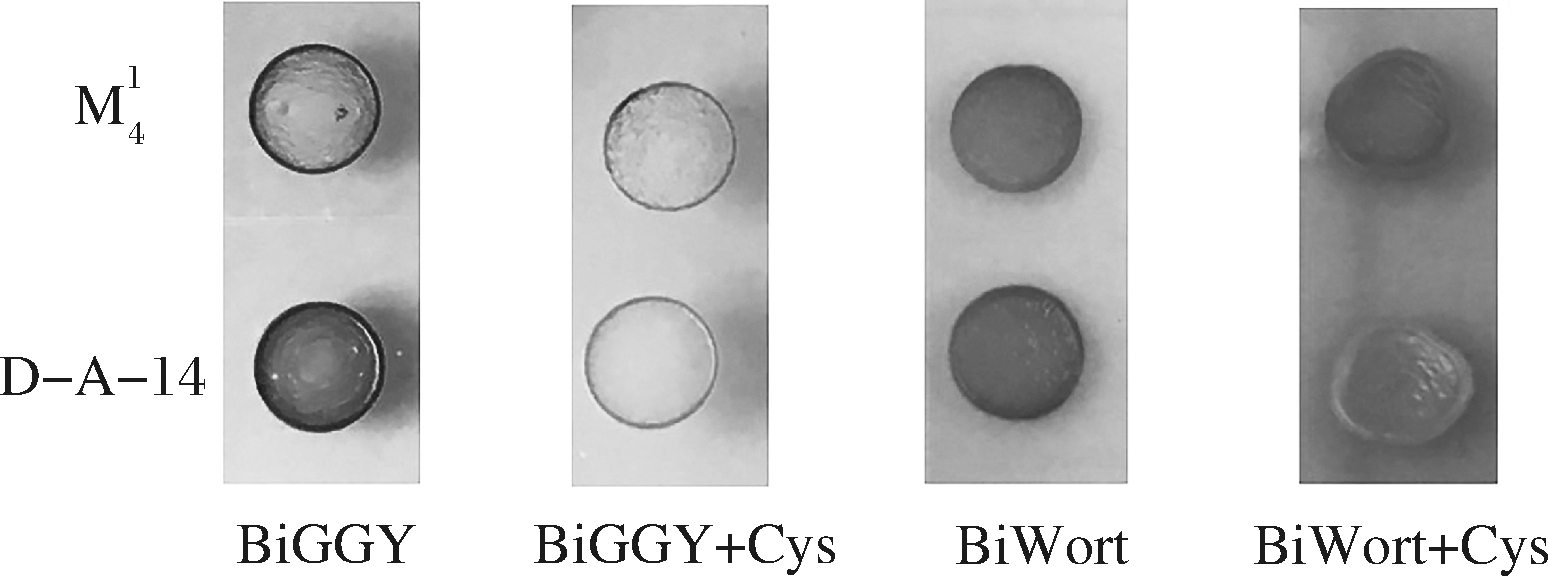
图3 半胱氨酸对啤酒酵母D-A-14和![]() 中
中![]() 还原酶活性和S2-产量的作用
还原酶活性和S2-产量的作用
Fig.3 Effects of cysteine on sulfite reductase activity and sulfide production in brewer’s yeasts D-A-14 and ![]()
因此,虽然菌株D-A-14中S2-产量有所下降,但![]() 还原酶活性显著下降可能使其总SO2产量略微上升。而菌株
还原酶活性显著下降可能使其总SO2产量略微上升。而菌株![]() 中
中![]() 至S2-通量下降可能导致其产量略微下降(0.61 mg/L)。
至S2-通量下降可能导致其产量略微下降(0.61 mg/L)。
2.2.3 外源苏氨酸对啤酒酵母总SO2和乙醛产量的影响
苏氨酸不仅影响![]() 还原途径,也可参加胞内蛋氨酸和半胱氨酸的转硫过程(图1)[8, 34]。由表4可知,外源添加苏氨酸显著提高了2种菌株的总SO2产量。添加200 mg/L苏氨酸后,菌株
还原途径,也可参加胞内蛋氨酸和半胱氨酸的转硫过程(图1)[8, 34]。由表4可知,外源添加苏氨酸显著提高了2种菌株的总SO2产量。添加200 mg/L苏氨酸后,菌株![]() 中总SO2产量分别增加了5.58 mg/L。然而由于SO2产量大幅度增加,其与乙醛之间的化学反应可能导致菌株
中总SO2产量分别增加了5.58 mg/L。然而由于SO2产量大幅度增加,其与乙醛之间的化学反应可能导致菌株![]() 中乙醛含量略微下降,但并不显著。在菌株D-A-14中,随着苏氨酸添加量的增加,总SO2和乙醛产量也逐渐升高,添加200 mg/L苏氨酸时发酵后总SO2产量增量最大,但仅为0.83 mg/L,乙醛产量却是未添加的2.07倍。此外,苏氨酸对2种菌株乙醇的产量影响均较小。
中乙醛含量略微下降,但并不显著。在菌株D-A-14中,随着苏氨酸添加量的增加,总SO2和乙醛产量也逐渐升高,添加200 mg/L苏氨酸时发酵后总SO2产量增量最大,但仅为0.83 mg/L,乙醛产量却是未添加的2.07倍。此外,苏氨酸对2种菌株乙醇的产量影响均较小。
表4 外源添加苏氨酸对啤酒酵母产总SO2、乙醛和乙醇的影响
Table 4 Effects of threonine on total SO2, acetaldehyde and ethanol production in brewer’s yeasts D-A-14 and ![]()

苏氨酸/(mg·L-1)总SO2/(mg·L-1)乙醛/(mg·L-1)乙醇/(%Vol.)M14D-A-14M14D-A-14M14D-A-14010.20±0.02c1.84±0.10b11.41±1.36a5.91±0.17c5.64±0.04a4.45±0.05a10013.66±0.19b2.46±0.19a9.73±0.00a8.85±1.51b5.35±0.01c4.39±0.05a20015.78±1.20a2.67±0.00a10.73±0.23a12.24±0.25a5.52±0.02b4.13±0.03b
注:同一列不同字母代表显著性差异(P<0.05)。
将苏氨酸分别添加于BiWort和BiGGY平板中,发现2种菌株菌落颜色均明显变深,表明外源苏氨酸可促进胞内![]() 还原酶活性和S2-产量(图4)。BiGGY+Thr平板中,菌株
还原酶活性和S2-产量(图4)。BiGGY+Thr平板中,菌株![]() 菌落颜色变深且与菌株D-A-14颜色相似,这表明2种菌株
菌落颜色变深且与菌株D-A-14颜色相似,这表明2种菌株![]() 还原酶活性相似。苏氨酸通过反馈抑制HOM3基因编码的天冬氨酸激酶,降低胞内O-乙酰高丝氨酸产生量[8],使S2-的分解代谢通量显著下调,因而2种菌株中S2-产量增加。但相比于菌株D-A-14,BiWort+Thr平板中菌株
还原酶活性相似。苏氨酸通过反馈抑制HOM3基因编码的天冬氨酸激酶,降低胞内O-乙酰高丝氨酸产生量[8],使S2-的分解代谢通量显著下调,因而2种菌株中S2-产量增加。但相比于菌株D-A-14,BiWort+Thr平板中菌株![]() 菌落颜色更深,表明其S2-产量更大,这意味着该菌株中总SO2增量更为显著。
菌落颜色更深,表明其S2-产量更大,这意味着该菌株中总SO2增量更为显著。
图4 苏氨酸对啤酒酵母D-A-14和![]() 中
中![]() 还原酶活性和S2-产量的作用
还原酶活性和S2-产量的作用
Fig.4 Effects of threonine on sulfite reductase activity and sulfide production in brewer’s yeasts D-A-14 and ![]()
添加3种氨基酸后,对2种菌株总SO2和乙醛产量的变化情况进行Pearson相关性分析。如图5所示,发现两者产量具有显著正相关性,其相关系数r为0.502(P<0.01)。啤酒中的风味物质主要由啤酒酵母代谢所产生,其种类繁多且代谢途径复杂[35],影响其风味物质产量的因素也较多。其中,SO2和乙醛之间强烈的化学亲和力可能导致两者产量的同时增加或减少。越来越多研究也表明,乙醛和含硫氨基酸代谢途径存在一定的关联,NOBLE等[28]发现,葡萄酒酵母中MET2和SKP2基因可同时影响其![]() 还原途径和乙醛的产量。此外,胞内
还原途径和乙醛的产量。此外,胞内![]() 还原途径将无机硫源S2-转化为有机硫化合物并伴随着乙酸的生成,同时含硫氨基酸转硫过程中也需要丙酮酸的参与,这都将影响胞内乙醛的产生[5, 36]。
还原途径将无机硫源S2-转化为有机硫化合物并伴随着乙酸的生成,同时含硫氨基酸转硫过程中也需要丙酮酸的参与,这都将影响胞内乙醛的产生[5, 36]。

图5 啤酒酵母中添加3种氨基酸后总SO2和乙醛产量的相关性分析
Fig.5 Correlation analysis between total SO2 and
acetaldehyde production by addition of three amino acids in brewer’s yeast
通过添加蛋氨酸、半胱氨酸和苏氨酸研究其对啤酒酵母产总SO2和乙醛的影响,研究发现苏氨酸对菌株D-A-14和![]() 总SO2产量提高幅度最大,而蛋氨酸显著降低菌株
总SO2产量提高幅度最大,而蛋氨酸显著降低菌株![]() 中乙醛和SO2产量。SO2和乙醛之间的强化学亲和力可能导致两者产量的正相关,而两者代谢途径的相关性也可能是影响其产量存在相关性更为重要的原因。啤酒老化是啤酒行业一直存在的重要问题,通过调整相关氨基酸含量能够显著调整SO2与乙醛的含量,为解决啤酒老化问题提供了一定的理论基础和解决方案。
中乙醛和SO2产量。SO2和乙醛之间的强化学亲和力可能导致两者产量的正相关,而两者代谢途径的相关性也可能是影响其产量存在相关性更为重要的原因。啤酒老化是啤酒行业一直存在的重要问题,通过调整相关氨基酸含量能够显著调整SO2与乙醛的含量,为解决啤酒老化问题提供了一定的理论基础和解决方案。
[1] ANDERSON M L,HENRIK O,SKIBSTED L H.Potential antioxidants in beer assessed by ESR spin trapping[J].Journal of Agricultural and Food Chemistry,2000,48(8):3 106-3 111.
[2] ELIAS R J,WATERHOUSE A L.Controlling the fenton reaction in wine[J].Journal of Agricultural and Food Chemistry,2010,58(3):1 699-1 707.
[3] LUND M N,KRAEMER A C,ANDERSON M L.Antioxidative mechanisms of sulfite and protein-derived thiols during early stages of metal induced oxidative reactions in beer[J].Journal of Agricultural and Food Chemistry,2015,63(37):8 254.
[4] SAISON D,SCHUTTER D P,UYTTENHOVE B,et al.Contribution of staling compounds to the aged flavour of lager beer by studying their flavour thresholds[J].Food Chemistry,2009,114(4):1 206-1 215.
[5] THOMAS D,SURDINKERJAN Y.Metabolism of sulfur amino acids in Saccharomyces cerevisiae[J].Microbiology and Molecular Biology Reviews,1997,61(4):503-532.
[6] HANSEN J,JOHANNESEN P F.Cysteine is essential for transcriptional regulation of the sulfur assimilation genes in Saccharomyces cerevisiae[J].Molecular and General Genetics Mgg,2000,263(3):535-542.
[7] DONALIES U E,STAHL U.Increasing sulphite formation in Saccharomyces cerevisiae by overexpression of MET14 and SSU1[J].Yeast,2002,19(6):475-484.
[8] YOSHIDA S,IMOTO J,MINATO T,et al.Development of bottom-fermenting Saccharomyces strains that produce high SO2 levels, using integrated metabolome and transcriptome analysis[J].Applied and Environmental Microbiology,2008,74(9):2 787.
[9] 周梅,李红,杜金华.啤酒酵母代谢形成SO2影响因素的研究[J].食品与发酵工业,2010(4):122-125.
[10] KELLERMANN E,SEEBOTH P G,HOLLENBERG C P.Analysis of the primary structure and promoter function of a pyruvate decarboxylase gene (PDC1) from Saccharomyces cerevisiae[J].Nucleic Acids Research,1986,14(22):8 963-8 977.
[11] HOHMANN S.Characterization of PDC6, a third structural gene for pyruvate decarboxylase in Saccharomyces cerevisiae[J].Journal of Bacteriology,1991,173(24):7 963-7 969.
[12] CIRIACY M.Genetics of alcohol dehydrogenase in Saccharomyces cerevisiae[J].Molecular and General Genetics Mgg,1975,138:157-164.
[13] LEA A G,FORD G D,FOWLER S.Analytical techniques for the estimation of sulphite binding components in ciders and wines[J].International Journal of Food Science and Technology,2010,35(1):105-112.
[14] MAIER K,HINZE H,LEUSCHEL L.Mechanism of sulfite action on the energy metabolism of Saccharomyces cerevisiae[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics,1986,848(1):120-130.
[15] PARK H,HWANG Y S.Genome-wide transcriptional responses to sulfite in Saccharomyces cerevisiae[J].Journal of Microbiology,2008,46(5):542-548.
[16] NADAI C,TREU L,CAMPANARO S,et al.Different mechanisms of resistance modulate sulfite tolerance in wine yeasts[J].Applied Microbiology and Biotechnology,2015,100(2):797-813.
[17] LI E,MIRA O R.Acetaldehyde kinetics of enological yeast during alcoholic fermentation in grape must[J].Journal of Industrial Microbiology and Biotechnology,2016,44(2):1-8.
[18] ARANDA A,OLMO M.Exposure of Saccharomyces cerevisiae to acetaldehyde induces sulfur amino acid metabolism and polyamine transporter genes, which depend on MET4p and HAA1p transcription factors, respectively[J].Applied and Environmental Microbiology,2004,70(4):1 913-1 922.
[19] ANONYMOUS.ASBC Methods, Beer 21-Total sulphur dioxide[C]. 9th Edition, American Society of Brewing Chemists,The Society:St.Paul,MN,2004.
[20] 张媛媛,魏良鑫,佟婷婷,等.顶空进样气相色谱法检测啤酒中乙醛[J].分析试验室,2011,30(9):26-29.
[21] LINDERHOLM A,DIETZEL K,HIRST M,et al.Identification of MET10-932 and characterization as an allele reducing hydrogen sulfide formation in wine strains of Saccharomyces cerevisiae[J].Applied and Environmental Microbiology,2010,76(23):7 699.
[22] COST G J,BOEKE J D.A useful colony colour phenotype associated with the yeast selectable/counter-selectable marker MET15[J].Yeast,1996,12(10):939-941.
[23] CORDENTE A G,HEINRICH A,PRETORIUS I S,et al.Isolation of sulfite reductase variants of a commercial wine yeast with significantly reduced hydrogen sulfide production[J].FEMS Yeast Research,2010,9(3):446-459.
[24] SHEN N,WANG J J,LIU C, et al.Domesticating brewing yeast for decreasing acetaldehyde production and improving beer flavor stability[J].European Food Research and Technology,2014,238(3):347-355.
[25] ROBINS T L,BOILLAT B.Control of odors in the brewing and food processing industries[J].Technical Quarterly,2002(39):29-31.
[26] HANSEN J,KIELLAND-BRANDT M C.Inactivation of MET10 in brewer's yeast specifically increases SO2 formation during beer production[J].Nature Biotechnology,1996,14(11):1 587.
[27] HANSEN J,KIELLAND-BRANDT M C.Inactivation of MET2 in brewer's yeast increases the level of sulfite in beer[J].Journal of Biotechnology,1996,50(1):75-87.
[28] NOBLE J,SANCHEZ I,BLONDIN B.Identification of new Saccharomyces cerevisiae variants of the MET2 and SKP2 genes controlling the sulfur assimilation pathway and the production of undesirable sulfur compounds during alcoholic fermentation[J].Microbial Cell Factories,2015,14(1):68.
[29] 沈楠,王金晶,刘春凤,等.低产乙醛啤酒酵母的定向驯化筛选[J].食品与发酵工业,2013,39(7):94-97.
[30] 沈楠.低产乙醛啤酒酵母的选育[D].无锡:江南大学,2013.
[31] DUAN W,RODDICK F A,HIGGINS V J,et al.A parallel analysis of H2S and SO2 formation by brewing yeast in response to sulfur-containing amino acids and ammonium ions[J].Journal of the American Society of Brewing Chemists,2004,62(1):35-41.
[32] LANDAUD S,HELINCK S, BONNARMME P.Formation of volatile sulfur compounds and metabolism of methionine and other sulfur compounds in fermented food[J].Applied Microbiology and Biotechnology,2008,77(6):1 191-1 205.
[33] THOMAS D,BARBEY R,HENRY D,et al.Physiological analysis of mutants of Saccharomyces cerevisiae impaired in sulphate assimilation[J].Journal of General Microbiology,1992,138(10):2 021-2 028.
[34] BORNAES C,IGNJATOVIC M W,SCHJERLING P,et al.A regulatory element in the CHA1 promoter which confers inducibility by serine and threonine on Saccharomyces cerevisiae genes[J].Molecular and Cellular Biology,1993,13(12):7 604-7 611.
[35] DZIALO M C,PARK R,STEENSELS J,et al.Physiology, ecology and industrial applications of aroma formation in yeast[J].FEMS Microbiology Reviews,2017,41(Supp_1):S95-S128.
[36] HIRAISHI H,MIYAKE T,ONO B I.Transcriptional regulation of Saccharomyces cerevisiae CYS3 encoding cystathionine γ-lyase[J].Current Genetics,2008,53(4):225-234.