马铃薯淀粉是具有多种功能特性的大分子多糖类化合物,具有增稠、填充、保水和黏合等作用,可与蛋白质形成组织结构良好的复合物,因此是肉制品中的主要添加组分之一,能够使肉制品保持良好的乳化、持水、凝胶和质构特性。但原料马铃薯淀粉本身也有多种缺点和加工不耐受性,如淀粉糊的老化性高、热稳定性差、抗剪切能力差等,使其在某些食品加工领域受到限制。但这些不足和加工局限性可以通过淀粉的改性来克服[1-2]。氧化处理(oxidation treatment, OT)可以降低马铃薯淀粉的高黏性和老化特性,使淀粉糊更加透明并具有良好的成膜性,目前已被广泛应用于食品工业中的面团、面包和烘焙食品加工[3]等领域。常用的氧化剂有次氯酸钠和过氧化氢,其中次氯酸钠是商业化生产氧化淀粉最常用的氧化剂[4]。目前,有关氧化马铃薯淀粉应用于食品的研究很多[5-6],但对其应用于肉制品的研究却鲜有报道。湿热(heat moisture treatment, HMT)和压热(heat pressure treatment, HPT)处理是淀粉的2种物理改性方法,因其具有环境友好和价格低廉的优点,目前已被广泛采用[6-8]。许多学者对湿热和压热处理后马铃薯淀粉的体外消化性进行了研究[8],但在肉制品方面的应用研究鲜有报道。
淀粉-蛋白质乳化体系属于O/W型乳状液,其特性可以通过测定内部微观结构的性质来反映[9],如乳化液液滴表面Zeta电势、液滴粒径分布和乳化液的乳化活性等。为使改性马铃薯淀粉更好地应用于肉制品,提高肉制品的品质及功能特性,实验在前一阶段研究的基础上[10-12],考察了原料马铃薯淀粉(native potato starch, NPS)及改性马铃薯淀粉-肌原纤维蛋白复合体系的乳化特性。利用0.2%氧化剂处理的马铃薯淀粉(0.2% oxidation treatment potato starch, 0.2%OTPS)、2.0%氧化剂处理的马铃薯淀粉(2.0% oxidation treatment potato starch, 2.0%OTPS),以及湿热处理马铃薯淀粉(heat moisture treatment potato starch, HMTPS)、压热处理马铃薯淀粉(heat pressure treatment potato starch, HPTPS)分别与猪肉肌原纤维蛋白(myofibrillar protein, MP)相互作用,考察各淀粉-肌原纤维蛋白乳化体系的乳化特性。分别用NPS-MP、0.2%OTPS-MP、2.0%OTPS-MP、HMTPS-MP和HPTPS-MP表示各种类型乳化液。
本研究通过对改性马铃薯淀粉-肌原纤维蛋白乳化特性的考察,旨在进一步探究肌原纤维蛋白与改性马铃薯淀粉这2类生物大分子之间的相互作用机理,对添加改性马铃薯淀粉肉制品的开发提供研究思路和研究基础。
1 材料与方法
1.1 材料与试剂
原料马铃薯淀粉(NPS)、0.2%次氯酸钠氧化处理的马铃薯淀粉(0.2%OTPS),2.0%次氯酸钠氧化处理的马铃薯淀粉(2.0%OTPS)、湿热处理马铃薯淀粉(HMTPS,样品密封、常压、100 ℃恒温1 h)和压热处理马铃薯淀粉(HPTPS,样品密封、0.2 MPa、120 ℃处理20 min),实验室自制(各种类型淀粉理化性质见表1);猪背最长肌,购自黑龙江北大荒肉业有限公司;牛血清蛋白,美国Sigma公司;十二烷基磺酸钠(SDS),北京索莱宝生物科技有限公司;次氯酸钠、磷酸氢二钠、磷酸二氢钠等均为国产分析纯试剂。
表1 不同类型马铃薯淀粉的理化性质[10-12]
Table 1 Physicochemical properties of different type of potato starches
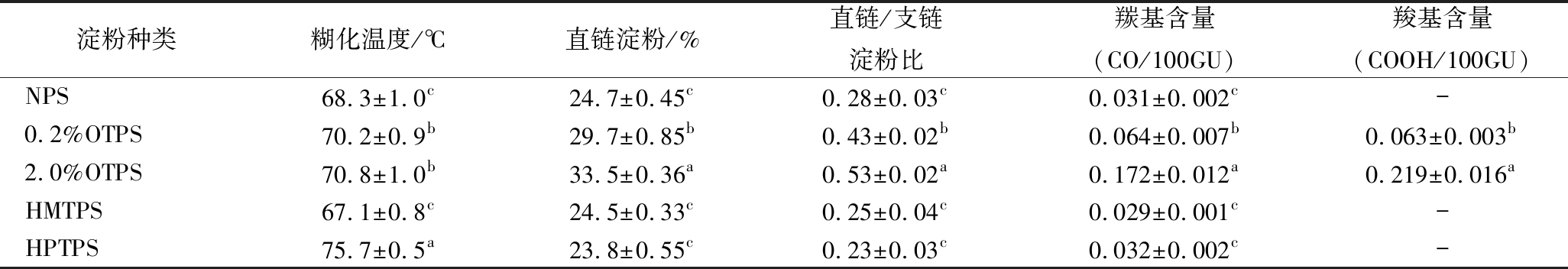
淀粉种类糊化温度/℃直链淀粉/%直链/支链淀粉比羰基含量(CO/100GU)羧基含量(COOH/100GU)NPS68.3±1.0c24.7±0.45c0.28±0.03c0.031±0.002c-0.2%OTPS70.2±0.9b29.7±0.85b0.43±0.02b0.064±0.007b0.063±0.003b2.0%OTPS70.8±1.0b33.5±0.36a0.53±0.02a0.172±0.012a0.219±0.016aHMTPS67.1±0.8c24.5±0.33c0.25±0.04c0.029±0.001c-HPTPS75.7±0.5a23.8±0.55c0.23±0.03c0.032±0.002c-
注:数据表示为平均值±标准差(n=3);a-c 在同一列字母中,相同表示差异不显著(P>0.05),不同表示差异显著(P<0.05)。
1.2 仪器与设备
XT120A 普利塞斯XS系列原装天平,瑞士普利赛斯有限公司;BS203IP数码偏光显微镜,重庆光电仪器有限公司;马尔文激光粒度及ZETA电位仪,英国马尔文公司;T18 basic型高速匀浆机,德国IKA公司。
1.3 试验方法
1.3.1 肌原纤维蛋白的制备
参考XIA等人[13]的方法略有改动,以猪背最长肌为原料提取肌原纤维蛋白,将原料肉中明显的脂肪和结缔组织去除,切成小肉块并称重,加入4倍体积预冷(4 ℃)的提取液(pH 7.0、10 mmol/L磷酸盐缓冲液:其中包括0.1 mol/L NaCl、2 mmol/L MgCl2和 1 mmol/L EGTA),在组织捣碎机中匀浆60 s,得到的肉浆在3 500 r/min、2~4 ℃离心15 min,弃上清液取沉淀,按上述步骤重复2次,得到的沉淀物为粗肌原纤维蛋白。向粗肌原纤维蛋白中加入4倍体积预冷(4 ℃)的洗液(0.1 mol/L NaCl),在组织捣碎机中匀浆60 s,3 500 r/min、2~4 ℃离心15 min,取沉淀,重复上述操作1次,再取沉淀加入4倍体积洗液,匀浆60 s,4层纱布过滤,滤液用0.1 mol/L HCl调节pH值至6.0,3 500 r/min、2~4 ℃ 离心15 min,取沉淀,得肌原纤维蛋白于2~4 ℃保存,48 h内利用。蛋白含量的测定:采用双缩脲法测定。
1.3.2 乳化液的制备
将肌原纤维蛋白溶解于50 mmol/L pH 6.2的磷酸盐缓冲液(含有0.6 mol/L NaCl)中,制得肌原纤维蛋白溶胶,并使蛋白质含量保持1%恒定。向肌原纤维蛋白溶胶中添加质量分数为3% 的改性马铃薯淀粉样品,充分混匀,得到马铃薯淀粉-肌原纤维蛋白复合物,再取2 mL 大豆色拉油与8 mL淀粉-肌原纤维蛋白复合物混合,高速匀浆机10 000 r/min搅打1 min后,得到淀粉-肌原纤维蛋白乳化液。
1.3.3 乳化活性和乳化稳定性的测定
参考PEARCE等人[14]的方法测定。按1.3.2得到的马铃薯淀粉-肌原纤维蛋白乳化液,立即用移液器在容器底部取样50 μL,加入5 mL 0.1%的SDS溶液,混匀后在500 nm处测定吸光值,以SDS溶液作为空白。室温放置10 min后再次取样测定。乳化活性(EAI)及乳化稳定性(ESI)分别按公式(1)、(2)计算:
![]()
(1)
(2)
式中:ρ,样品蛋白质量浓度,g/mL;ω,油的体积分数;n,稀释倍数;A0,初始乳化液的吸光度;A10,10 min后乳化液的吸光度。
1.3.4 乳化液电势的测定
将1.3.2得到的马铃薯淀粉-肌原纤维蛋白乳化液注入毛细管吸收池中,室温下用马尔文纳米电位仪测定乳化液油滴的电势。
1.3.5 乳化液粒径和粒度分布的测定
马铃薯淀粉-肌原纤维蛋白乳化液中粒子的平均粒径和粒度分布采用马尔文激光粒度仪进行测定,该仪器基于激光衍射的原理,小粒子对激光的散射角大,而大粒子则反之,为了避免散射效应,用磷酸盐缓冲液将按1.3.2方法得到的乳化液稀释到合适的浓度[15]。测量时以蒸馏水作为分散介质,分散剂折射率为1.330。粒径分布由d3,2(表面积等效平均粒径)和d4,3(体积等效平均粒径)表示。d3,2用以表征较小粒径粒子的变化,d4,3用以表征较大粒径粒子的变化。
![]()
(3)
![]()
(4)
式中:di,表示测定的第i个液滴的直径;ni,表示直径为di的液滴数。
测定结果除了表示为d4,3 和d3,2 外,还可以表示为d10、d50 和d90,分别指样品的粒径积累值达到10%、50%和90%时所对应的粒径大小。
1.3.6 乳化液的微观结构
将1.3.2制得的的乳化液分别取1滴均匀涂布在载玻片上,用盖玻片盖好,在10倍物镜下观察并拍照。
1.3.7 数据统计分析
每个试验重复3次,结果表示为平均数±SD。数据统计分析采用Statistix 8.1(分析软件,St Paul, MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。采用sigmaplot 11.0 软件作图。
2 结果与分析
2.1 乳化液的电势
大多数稳定的乳化液液滴都带有电荷,通常用Zeta电势(ζ-potential)来表示,一般情况下,ζ-电势的绝对值越大,乳化液体系越稳定[16]。肌原纤维蛋白在pH 6.2时带负电荷,而马铃薯淀粉本身带负电荷[17],因此马铃薯淀粉-肌原纤维蛋白乳化液呈电负性,并且马铃薯淀粉分子链上的负电荷基团可与蛋白之间发生相互作用,从而改善乳化液的稳定性[18]。
原料及氧化马铃薯淀粉与肌原纤维蛋白制备的乳化液电势如图1-a所示。0.2%OTPS-MP和2.0%OTPS-MP乳化液电势(-7.39 mV和-7.16 mV)无显著差别(P>0.05),但上述二者的电势均显著低于(P<0.05)NPS-MP乳化液的电势(-6.18 mV),而肌原纤维蛋白乳化液(MP)的电势(-5.23 mV)则显著高于NPS-MP乳化液的电势(P<0.05)。由于马铃薯淀粉带负电荷,而在乳化液中肌原纤维蛋白也同样带负电荷,因此马铃薯淀粉-肌原纤维蛋白乳化液的电势相比于肌原纤维蛋白(MP)乳化液电势显著降低,而氧化处理马铃薯淀粉分子内形成的羧基基团使乳化液的电负性进一步增强[10],因此添加氧化马铃薯淀粉的乳化液电势相比于添加原料马铃薯淀粉的乳化液电势显著降低。ζ-电势的绝对值越大,液滴间越会产生良好的静电排斥效果,不容易相互接近,从而使乳化液更稳定[19]。原料、湿热和压热马铃薯淀粉与肌原纤维蛋白制备的乳化液电势如图1-b所示,淀粉-肌原纤维蛋白复合乳化液较肌原纤维蛋白乳化液电势显著降低(P<0.05),而3种复合乳化液电势间无显著差别(P>0.05),主要是由于湿热和压热处理属于物理改性,未在淀粉分子内引入新的基团,因此电负性未发生改变。

图1 原料和改性马铃薯淀粉与肌原纤维蛋白制备
乳化液的ζ-电势
Fig.1 ζ-potentials of emulsions prepared with myofibrillar
proteins and native potato starch, or modified potato starch
注:字母a-c不同表示差异显著(P<0.05),相同表示
差异不显著(P>0.05)
2.2 乳化液中液滴平均粒径及粒度分布
乳化液中液滴的大小和粒度分布会影响乳化液的稳定性,通常情况下,乳化液液滴的粒度越小,乳化体系越稳定,当乳化液液滴表面吸附了蛋白质和多糖时会产生一种稳定乳化液液滴的作用,即空间位阻作用[16],此作用是影响乳化液稳定性的重要因素之一。原料及改性马铃薯淀粉与肌原纤维蛋白制备的乳化液中液滴的平均粒径大小和粒度分布结果见表2和图2。
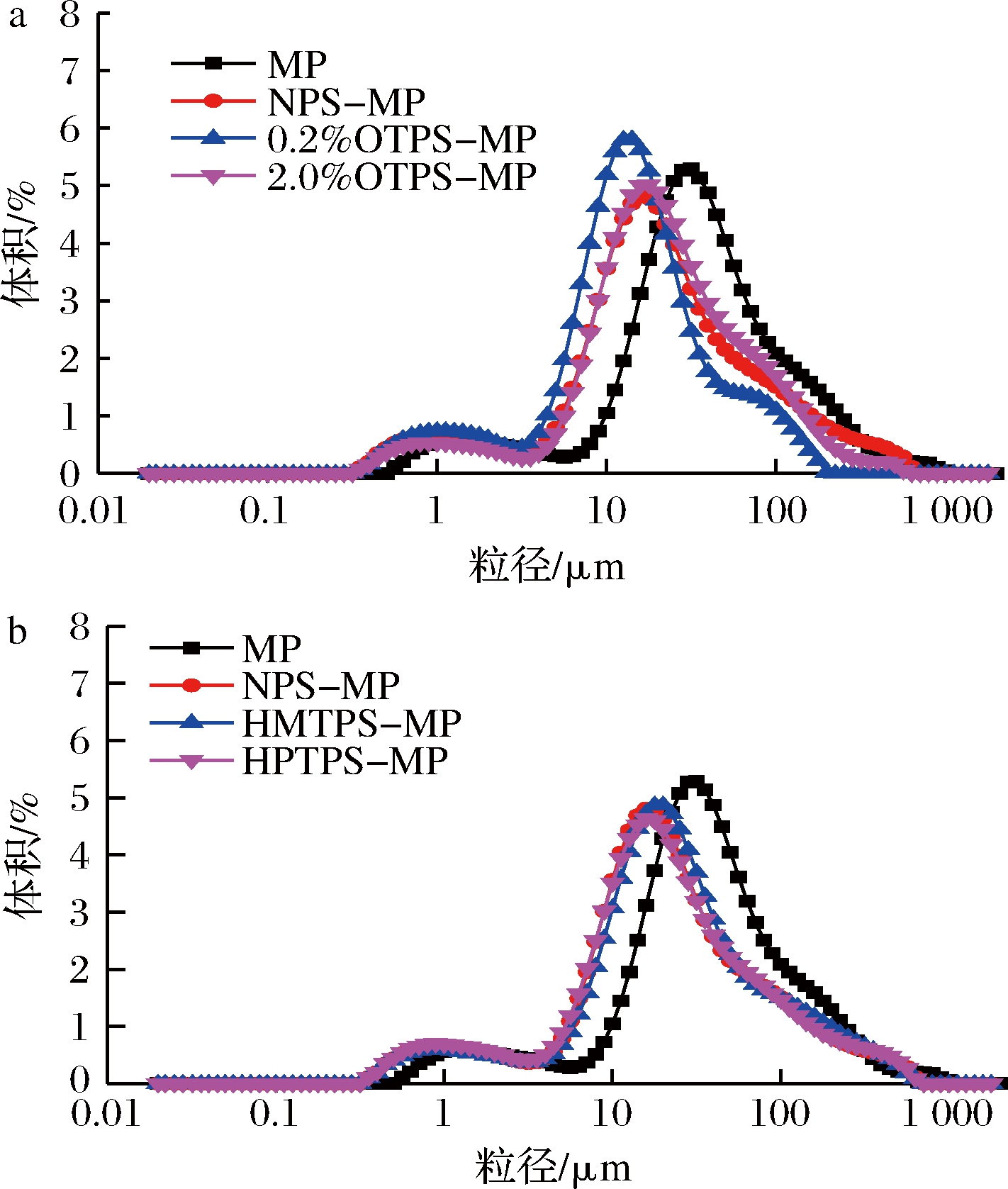
图2 原料和改性马铃薯淀粉与肌原纤维蛋白制备的乳化液中液滴粒度分布
Fig.2 Volume-based droplet size distributions of the emulsions prepared with myofibrillar proteins and native potato starch, or modified potato starch
由表2的结果看出,添加原料和改性马铃薯淀粉的肌原纤维蛋白乳化液平均粒径均显著(P<0.05)低于肌原纤维蛋白乳化液(MP)的平均粒径,说明原料和改性马铃薯淀粉对肌原纤维蛋白乳化液具有稳定的作用。JIANG等[20]研究报道,乳化液的稳定性随液滴粒径的减小而增加,主要是由于更多的乳化剂分子吸附到液滴的表面,而马铃薯淀粉在乳化液中也可以作为良好的乳化剂发挥作用。因此,由2.1试验结果:加入原料及改性马铃薯淀粉后的肌原纤维蛋白乳化液电负性均显著增加来推断,带有负电荷的马铃薯淀粉分子吸附到液滴的表面,增强了液滴间的静电斥力,进一步阻止了液滴的聚集,从而使乳化液中液滴的粒径减小。其中,HMTPS-MP和HPTPS-MP乳化液的平均粒径都与NPS-MP乳化液无显著差别(P>0.05);而添加氧化马铃薯淀粉的乳化液平均粒径均显著(P<0.05)低于添加原料马铃薯淀粉的乳化液;这可能是由于氧化处理后的马铃薯淀粉分子中形成了带负电荷的羧基[10],因此带更多负电荷的淀粉分子吸附到液滴表面,液滴间形成了更大的静电排斥和空间位阻作用[21-22],从而使乳化液平均粒径降低,进一步稳定了乳化体系。
表2 原料和改性马铃薯淀粉与肌原纤维蛋白制备乳化液中油滴的平均粒径
Table 2 Droplet mean diameters, d3,2 and d4,3 of emulsions prepared with myofibrillar proteins andnative potato starch, or modified potato starch
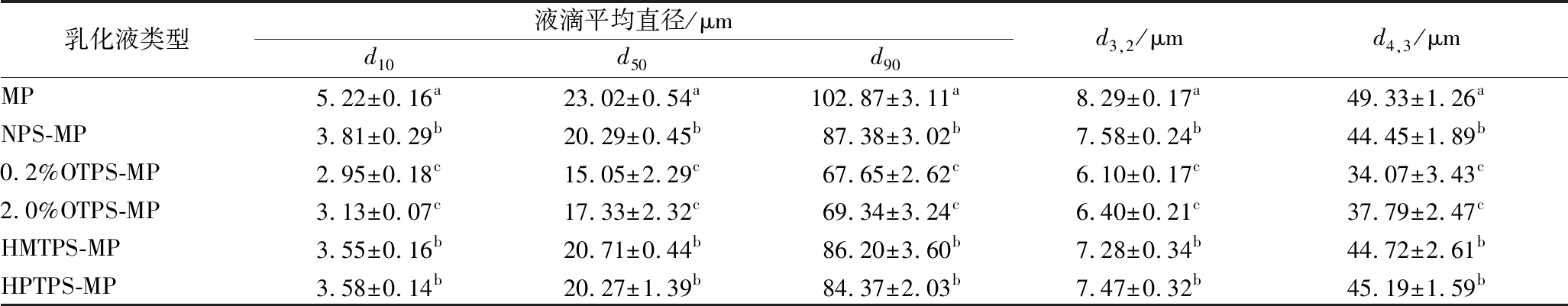
乳化液类型液滴平均直径/μmd10d50d90d3,2/μmd4,3/μmMP5.22±0.16a23.02±0.54a102.87±3.11a8.29±0.17a49.33±1.26aNPS-MP3.81±0.29b20.29±0.45b87.38±3.02b7.58±0.24b44.45±1.89b0.2%OTPS-MP2.95±0.18c15.05±2.29c67.65±2.62c6.10±0.17c34.07±3.43c2.0%OTPS-MP3.13±0.07c17.33±2.32c69.34±3.24c6.40±0.21c37.79±2.47cHMTPS-MP3.55±0.16b20.71±0.44b86.20±3.60b7.28±0.34b44.72±2.61bHPTPS-MP3.58±0.14b20.27±1.39b84.37±2.03b7.47±0.32b45.19±1.59b
注:数据表示为平均值±标准差(n=3);a-e 在同一列字母中,相同表示差异不显著(P>0.05),不同表示差异显著(P<0.05)。
乳化液液滴粒度(particle diameter)分布也是评价乳化液的重要参数之一[23]。当乳化液中所有液滴尺寸相近时,乳化液属于单分散体系;当乳化液中液滴尺寸不同或尺寸范围较大时,乳化液属于多分散体系[16]。图2显示,所有乳化液均呈现双峰分布,属于多分散乳化体系。添加原料和改性马铃薯淀粉后的肌原纤维蛋白乳化液粒径分布相比于肌原纤维蛋白乳化液(MP)均朝着粒径减小的方向移动,有利于乳化液的稳定。可以看出,相比于NPS-MP乳化液,0.2% OTPS-MP和2.0% OTPS-MP乳化液的粒径分布朝粒径减小方向移动的幅度更大;而HMTPS-MP和HPTPS-MP乳化液的粒径分布朝粒径减小方向移动的幅度与NPS-MP乳化液的无明显差别。此结果与表2的结果是基本一致的。
2.3 乳化液的乳化活性及乳化稳定性
乳化活性和乳化稳定性是评价乳化液乳化特性的常用指标。原料、改性马铃薯淀粉-肌原纤维蛋白乳化液的乳化活性(EAI)和乳化稳定性(ESI)如图3和图4所示。由图可以看出,添加马铃薯淀粉后,复合乳化液的乳化活性和乳化稳定性相比于肌原纤维蛋白乳化液(MP)均显著增加(P<0.05),说明马铃薯淀粉的添加提高了肌原纤维蛋白乳化液的乳化活性和乳化稳定性。多糖作为稳定剂能够促使包裹油滴的蛋白质层厚度增加,因此在乳化液中蛋白质-多糖的相互作用能够克服许多不利因素抑制液滴的聚集,提高乳化液的乳化能力[24]。在乳化液中,淀粉颗粒在较低温度下可逆吸水溶胀,与肌原纤维蛋白发生相互作用,使吸附着蛋白质的油滴被固定在多糖形成的交联网络结构中不能相互靠近[25-26],从而使淀粉-蛋白乳化液的乳化活性和乳化稳定性得到提高。
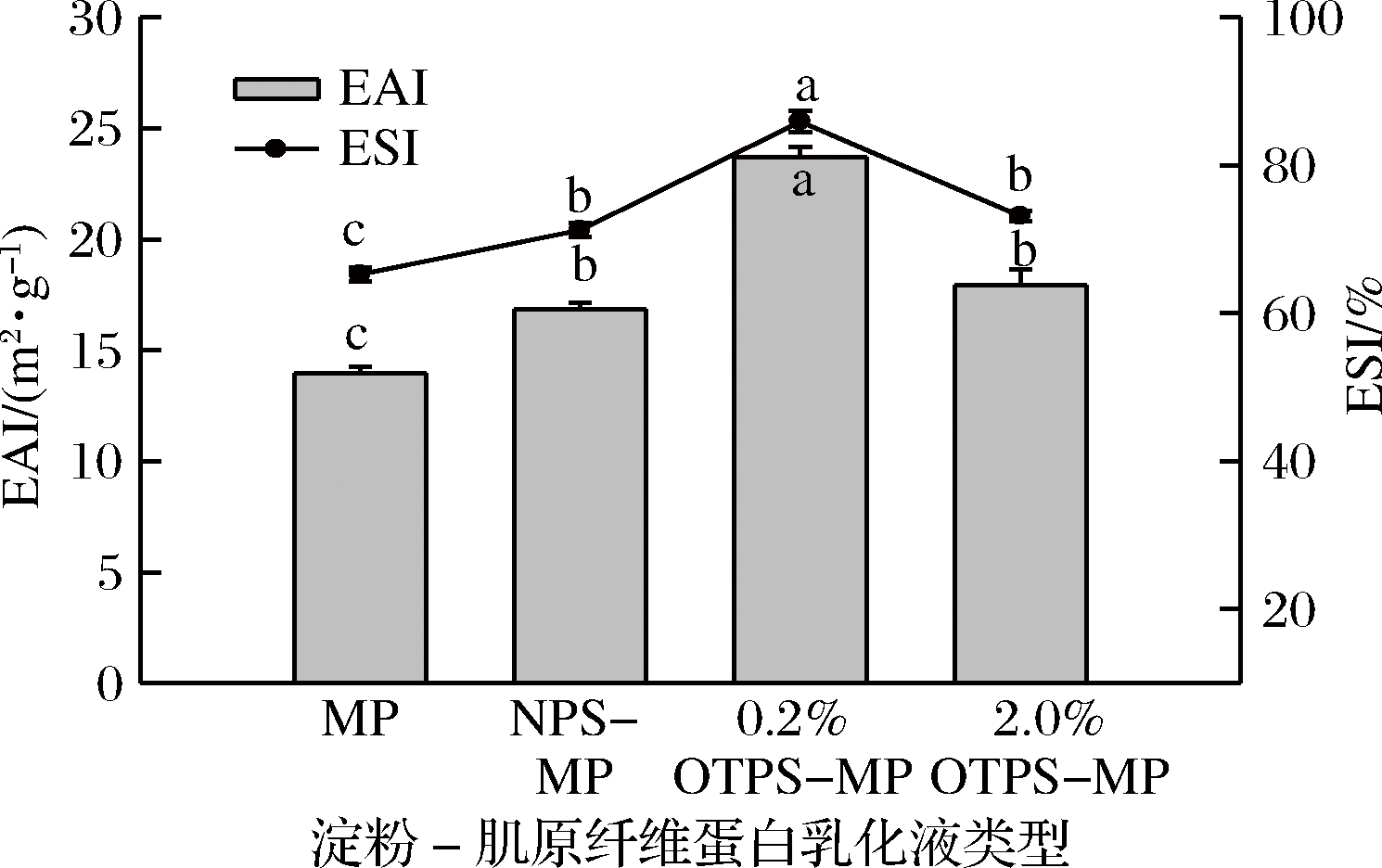
图3 氧化马铃薯淀粉与肌原纤维蛋白制备乳化液的乳化活性及乳化稳定性
Fig.3 Emulsifying activity index (EAI) and emulsion
stability index (ESI) of emulsions prepared with myofibrillar
proteins and native potato starch, or oxidated potato starch
注:对于同一测定指标,字母a-c不同表示差异显著(P<0.05),相同表示差异不显著(P>0.05)。

图4 原料、湿热/压热处理马铃薯淀粉-肌原纤维蛋白乳化液的乳化活性及乳化稳定性
Fig.4 Emulsifying activity index (EAI) and emulsion stability index (ESI) of emulsions prepared with myofibrillar proteins and native potato starch, heat moisture treatment potato starch, or heat pressuer treatment potato starch
注:对于同一测定指标,字母a-c 不同表示差异显著
(P<0.05)。
由图3可知,0.2% OTPS-MP乳化液的乳化活性为23.7 m2/g,显著高于NPS-MP和2.0% OTPS-MP乳化液的乳化活性(P<0.05),而NPS-MP和2.0% OTPS-MP乳化液之间的乳化活性无显著差别(P>0.05)。这主要是由于0.2% 氧化剂处理的马铃薯淀粉相比于原料马铃薯淀粉电负性增强的同时保持了一定的膨润能力,使其在乳化液中能够起到较好的吸水溶胀作用,与肌原纤维蛋白在乳化液中保持较稳定的交联网络结构,从而保持较高的乳化活性;而2.0% 氧化剂处理的马铃薯淀粉膨润能力相对较低,在乳化液中吸水溶胀作用较弱,使其与肌原纤维蛋白在乳化液中形成的交联网络结构稳定性较差,因此表现出来的乳化活性较低。添加不同类型马铃薯淀粉乳化液的ESI变化趋势与EAI相同。
由图4可知,随着马铃薯淀粉处理强度的增强(温度升高和压力增大),HMTPS-MP和HPTPS-MP乳化液的EAI和ESI相比于NPS-MP乳化液显著降低(P<0.05),这主要是由于处理强度的增强使马铃薯淀粉的膨润能力显著降低,从而导致淀粉与蛋白质在乳化液中形成的交联网络结构稳定性逐渐下降,因此乳化活性和乳化稳定性也随之降低。
2.4 乳化液的的微观结构
肌原纤维蛋白乳化液和各类马铃薯淀粉-肌原纤维蛋白乳化液微观结构如图5所示。

a-MP;b-NPS-MP;c-0.2% OTPS-MP;d-2.0% OTPS-MP;>e-HMTPS-MP;f-HPTPS-MP
图5 原料和改性马铃薯淀粉与肌原纤维蛋白制备
乳化液的光学显微镜图(×100) Fig.5 Optical microscopy images of emulsions prepared with myofibrillar proteins and native potato starch, or modified potato starch
注:白色虚线区域:空白区域
肌原纤维蛋白乳化液中(图5-a)不同大小的油滴分散于水相中,而肌原纤维蛋白则分布于油滴表面及油滴之间。显微镜的观察结果与2.2小节的结果一致,添加原料和改性马铃薯淀粉(图5-b,c,d,e,f)的肌原纤维蛋白乳化液相比于肌原纤维蛋白(MP)乳化液,后者乳化液的液滴粒径较大,并且肌原纤维蛋白在液滴表面和液滴之间分布不均匀,出现了大面积的未被填充区域,即空白区域(图5-a白色虚线区域)。空白区域的形成主要是由于乳化液的乳化性相对较差,均质后乳化液内部的液滴发生了聚集。添加淀粉后,这一空白区域明显减少,而且淀粉-肌原纤维蛋白乳化液液滴的粒径变小,肌原纤维蛋白与淀粉在液滴表面和液滴之间的分布致密且均匀。其中,0.2% OTPS-MP乳化液中空白区域最少、液滴分布的效果最好,2.0% OTPS-MP和HPTPS-MP乳化液油滴之间出现了相对较大面积的空白区域,这主要是由于2.0% OTPS和HPTPS的膨润能力相对较低,在乳化液中未能表现出良好的吸水溶胀作用,因此维持乳化液稳定的能力相对较弱。
3 结论
在淀粉-肌原纤维蛋白质乳化体系中,淀粉和蛋白质作为高聚物分子具有较长的分子链,并在分子链上分布了大量的亲水和亲油基团,均可以吸附在脂肪球液滴表面,形成有效的液滴保护层。脂肪球液滴表面吸附的这两种高聚物分子,能够在液滴表面形成静电斥力和空间位阻,使界面张力降低,同时又能够使液滴表面形成较厚的吸附层增大液面黏度,从而使淀粉-蛋白质乳化体系保持良好的稳定性。
马铃薯淀粉经过改性处理后,进一步改善了淀粉-肌原纤维蛋白乳化液的乳化特性。氧化马铃薯淀粉-肌原纤维蛋白乳化液中,0.2%OTPS-MP乳化液相比于NPS-MP乳化液表现出了显著降低(P<0.05)的电势和粒径分布以及显著升高(P<0.05)的乳化活性和乳化稳定性。HMTPS-MP和HPTPS-MP乳化液中,两种乳化液的电势和粒径相比于NPS-MP乳化液无显著变化,而乳化活性和乳化稳定性随处理强度的增强显著降低。乳化液的微观结构观察显示,0.2%OTPS-MP乳化液的粒径大小和分布最均匀,其次为NPS-MP和HMTPS-MP乳化液,而2.0%OTPS-MP和HPTPS-MP乳化液表现出粒径大小和均匀度相对较差。这一实验结论,为改性马铃薯淀粉应用于乳化凝胶类肉制品提供了理论依据。
[1] PIETRASIK Z. Effect of content of protein,fat and modified starch on binding textural characteristics,and colour of comminuted scalded sausages[J]. Meat Science,1999,51(1):17-25.
[2] 王盼盼. 食品增稠剂——淀粉,变性淀粉及淀粉水解物[J]. 肉类科学,2010(4):47-54.
[3] SHENG Y,WANG Q H,XU X C,et al. Oxidation of corn starch using oxygen as oxidant without catalyst[J]. LWT-Food Science and Technology,2010,44(1):139-144.
[4] WANG Y J,WANG L. Physicochemical properties of common and waxy corn starches oxidized by different levels of sodium hypochlorite[J]. Carbohydrate Polymers,2003,52(3):207-217.
[5] FONSECA L M,GONCALVES J R,HALAL S L M E,et al. Oxidation of potato starch with different sodium hypochlorite concentrations and its effect on biodegradable films[J]. LWT-Food Science and Technology,2015,60(2):714-720.
[6] EDR Z,PINTO V Z, KLEIN B,et al. Development of oxidised and heat-moisture treated potato starch film[J]. Food Chemistry,2012,132(1):344-350.
[7] LEEMAN A M,KARLSSON M E,ELIASSON A C,et al. Resistant starch formation in temperature treated potato starches varying in amylose/amylopectin ratio[J]. Carbohydrate Polymers,2006,65(3):306-313.
[8] JOHN M,SUMAN M,ESTHER B,et al. Potato genotype differences in nutritionally distinct starch fractions after cooking,and cooking plus storing cool[J]. Journal of Food Composition & Analysis,2009,22(6):539-545.
[9] 周纷, 谷大海, 徐家慧, 等. 淀粉对鸡胸肉盐溶性蛋白乳化特性的影响[J]. 食品科学, 2016, 37(15): 7-12.
[10] ZHOU F C, LIU Q, ZHANG H W, et al. Potato starch oxidation induced by sodium hypochlorite and its effect on functional properties and digestibility[J]. International Journal of Biological Macromolecules, 2016, 84:410-417.
[11] 周凤超, 李禹儒, 赵俊梅, 等. 氧化和湿热处理对马铃薯淀粉功能特性的影响[J].食品工业科技, 2018, 39(15): 31-36.
[12] 周凤超. 氧化处理和湿热处理对马铃薯淀粉体外消化性的影响[J]. 食品工业, 2018, 39(8):13-18.
[13] XIA X F, KONG B H, LIU Q. Physicochemical change and protein oxidation in porcine longissimus dorsi as infiuenced by different freeze-thaw cycles[J]. Meat Science, 2009, 83:239-245.
[14] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique [J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.
[15] BONNAIRE L, SANDRA S, HELGASON T, et al. Influence of lipid physical state on the in vitro digestibility of emulsified lipids[J]. Journal of Agricultural and Food Chemistry, 2008, 56(10): 3 791-3 797.
[16] 刘丽娅. 酪蛋白酸钠-多糖界面相互作用及其对乳状液稳定性的影响[D]. 广州:华南理工大学, 2011.
[17] SHI X, BEMILLER J N. Effects of food gums on viscosities of starch suspensions during pasting[J]. Carbohydrate Polymers, 2002, 50(1): 7-18.
[18] 张利. 卵清蛋白-多糖共混凝胶的研究[D]. 重庆: 西南农业大学, 2003.
[19] DICKINSON E. Hydrocolloids at interfaces and the influence on the properties of dispersed System[J]. Food Hydrocolloids, 2003, 17: 25-39.
[20] JIANG J, ZHU B, LIU Y, et al. Correction to interfacial structural role of pH-shifting processed pea protein in the oxidative stability of oil/water emulsions[J]. Journal of Agricultural & Food Chemistry, 2014, 62(7): 1 683-1 691.
[21] MATTIA C D D, SACCHETTI G, MASTROCOLA D, et al. Surface properties of phenolic compounds and their influence on the dispersion degree and oxidative stability of olive oil O/W emulsions[J]. Food Hydrocolloids, 2010, 24(6-7): 652-658.
[22] ATARES L, MARSHALL L J, AKHTAR M, et al. Structure and oxidative stability of oil in water emulsions as affected by rutin and homogenization procedure[J]. Food Chemistry,2012, 134(3): 1 418-1 424.
[23] HUCK-IRIART C,PIZONES RUIZ-HENESTROSA V M,CANDAL R J. Effect of aqueous phase composition on stability of sodium caseinate/sunflower oil emulsions[J]. Food and Bioprocess Technology, 2013, 6: 2 406-2 418.
[24] LIU L, ZHAO Q, LIU T, et al. Sodium caseinate/carboxymethylcellulose interactions at oil-water interface: Relationship to emulsion stability[J]. Food Chemistry, 2012, 132(4): 1 822-1 829.
[25] WANG S, LI C, YU J, et al. Phase transition and swelling behaviour of different starch granules over a wide range of water content[J]. Lebensmittel-Wissenschaft und-Technologie, 2014, 59(59): 597-604.
[26] CHENG J, MA Y, LI X, et al. Effects of milk protein-polysaccharide interactions on the stability ofice cream mix model systems[J]. Food Hydrocolloids, 2015, 45(45): 327-336.