牛肉营养丰富、味道鲜美,具有高蛋白、低脂肪、低胆固醇的特点,富含多种矿质元素,氨基酸组成比例更接近人体需要,能提高机体抗病能力,深受消费者喜爱[1-2]。目前,对牛肉凝胶制品的研究多集中在超高压、超声波、微波、加热方式等工艺改进[3-5],以及转谷氨酰胺酶(transglutaminase,TG酶)、多糖、淀粉、磷酸盐等改良剂的添加[6-7],不仅可以促进凝胶三维网络结构的形成,使凝胶结构致密有序,提高其质构特性、保水保油性与出品率,而且还可以增加凝胶制品的营养与保健功能等。靳红果等[8]优化了牛肉盐溶蛋白提取工艺,在此条件下,凝胶保水性最高,破断应力最大,表观弹性率较高,网络结构致密均匀。周佺等[9]研究发现,仙草提取物主要通过疏水相互作用来改善牛肉盐溶蛋白凝胶的网络结构。DONG等[10]研究表明,与超高压和TG酶单独处理效果相比,二者结合处理能显著提高牛肉凝胶硬度、咀嚼性和凝胶强度。
豌豆蛋白占豌豆组成的20%~25%,氨基酸比例均衡,富含赖氨酸,除甲硫氨酸含量较低外,其他均达到FAO/WHO的推荐标准[11],与大豆蛋白相比,豌豆蛋白没有经过转基因[12],同时不含雌性激素,过敏源少,且易于消化,可降低肥胖、动脉粥样硬化、肿瘤等发病风险[13-14];豌豆蛋白具有较好的功能性质,如溶解性、乳化性和胶凝性等,是一种优质的植物蛋白资源。相关研究主要涉及豌豆蛋白提取制备[15-16]、功能特性及改性[17-19]和酶解制备活性产物[20],以及在肉乳制品、水产品、面制品、焙烤制品等领域的应用[21-22]。白一凡与杨震等研究发现,豌豆蛋白添加量在4%及以下时,可改善香肠的品质,如颜色、质构和感官品质等[23-24]。SU等[25]研究表明,添加豌豆蛋白的法兰克福香肠具有更好的热稳定性和更大的剪切硬度。因此,将来源广泛、价格低廉的豌豆蛋白添加到牛肉盐溶蛋白,研究其对牛肉盐溶蛋白凝胶品质的影响,不仅可以提高牛肉制品的营养保健功能,而且还可以丰富我国肉制品种类,满足广大消费者的实际需求。
1 材料与方法
1.1 材料与试剂
牛背最长肌,河南省新乡市易购世纪华联超市;豌豆蛋白,烟台东方蛋白科技有限公司。
NaCl、NaOH、戊二醛、NaH2PO4、Na2HPO4、乙醇、氯仿等试剂均为国产分析纯。
1.2 仪器与设备
UMC-5C斩拌机,德国Stephan公司;台式高速冷冻离心机,Thermo Fisher Scientific;绞肉机,山东嘉信食品机械有限公司;AUY120电子天平,日本岛津公司;DZKW-4电子恒温水浴锅,北京中兴伟业仪器有限公司;TA-XT plus质构仪,英国Stable Micro Systems公司;CR-400色差仪,日本Konica Minolta公司;Quanta 200扫描电子显微镜,美国FEI公司;Haake Mars 60旋转流变仪,德国Thermo Fisher Scientific公司;真空干燥箱,上海一恒科学仪器有限公司;PQ001台式NMR分析仪,上海纽迈电子有限公司。
1.3 实验方法
1.3.1 牛肉盐溶蛋白热凝胶的制备
参考SUN[26]方法并稍作修改。取200 g新鲜牛肉剔除脂肪和结缔组织,切块,用绞肉机绞成肉糜,加入600 mL 0.6 mol/L NaCl溶液,匀浆,调pH值7.0,4 ℃放置24 h,10 000 r/min离心10 min,上清液即盐溶蛋白。
蛋白凝胶制备:取数支50 mL离心管,加入30 mL 30 mg/mL盐溶蛋白,分别加入豌豆蛋白0、1.2、2.4、3.6和4.8 g,使添加质量浓度分别为0、0.04、0.08、0.12和0.16 g/mL,高速均质,4 ℃冰箱静置12 h,25~85 ℃水浴,并于85 ℃保持5 min,取出冷却至室温,备用[27]。
1.3.2 色泽的测定
参照李娜等[28]的方法并稍做修改。采用CR-400色差仪,以标准白板作为对照,记录样品L*、a*和b*值,分别为亮度指数、红度指数和黄度指数,重复6次试验取平均值。
1.3.3 保水性的测定
参照QIN等[29]的方法。将样品切成直径15 mm,高20 mm的圆柱体,称重记为m1。置于离心管中,6 000×g离心10 min,用滤纸吸干表面水分,再次称重,记为m2。以离心后凝胶质量占原质量的百分比,即为保水性(water holding capacity, WHC)。
![]()
(1)
式中:m1,离心前样品质量;m2,离心后样品质量。
1.3.4 蒸煮得率的测定
参照王春彦等[30]的方法并稍作修改。将样品在室温环境回温2 h,吸干表面水分,称量并记录质量。
蒸煮得率![]()
(2)
1.3.5 质构的测定
参照ZHOU等[31]的方法并稍作修改。采用TA-XT plus质构仪对样品(Φ 2 cm×20 mm)进行质构测试,使用直径为50 mm的圆柱形探头(P/36R),参数如下:测试前速2 mm/s,测试速度2 mm/s,测试后速度3 mm/s,压缩样品高度为40%,时间5 s,触发类型为自动,触发力5 g。相关质构参数为硬度、咀嚼性、弹性和恢复性。每组样品测定6次取平均值。
1.3.6 流变性的测定
参考WESTPHALEN等[32]的方法并稍作修改。校准机器并调好参数后,用50 mm不锈钢圆形平板探头,间隙距离为0.6 mm,将样品均匀涂抹在2个平板之间,再涂一层薄的硅油,以防止水分蒸发。在25 ℃保温10 min,然后从25~85 ℃升温,加热速率为2 ℃/min。在加热过程中,在固定的频率(0.1 Hz)和振荡模式下对样品进行连续剪切,测量储能模量(G′)和损耗模量(G″)的变化。
1.3.7 微观结构的测定
将凝胶样品切成2 mm的小条,用质量浓度25 g/L的戊二醛(pH 6.8)浸泡过夜。先用0.1 mol/L pH值6.8的磷酸缓冲液洗3次,每次为15 min,再用50%~90%的乙醇脱水,每次为15 min,无水乙醇脱水3次,每次10 min。采用氯仿进行脱脂1 h,V(无水乙醇)∶V(叔丁醇)=1∶1,以及叔丁醇各进行1次置换,每次为15 min。真空干燥后进行扫描观察[33]。
1.3.8 NMR自旋-自旋驰豫时间(T2)的测定
参考HAN等[34]的方法并稍做修改。称取约2 g的凝胶样品放入直径15 mm的核磁管中。测量温度为32 ℃,质子共振频率为22.6 MHz,采样频率为100 kHz,半回波时间τ-值(90°脉冲和180°脉冲之间的时间)为200 μs,重复扫描 32次,重复间隔时间110 ms,扫描12 000个回波,自旋-自旋弛豫时间T2用CPMG序列测量,得到的图为指数衰减图形,每个样品测定6个重复,结果取平均值。
1.3.9 数据处理
数据用Excel 2010进行处理,SPSS 19.0软件进行单因素方差分析(one-way analysis of variance, ANOVA)及最小显著差法(least significant difference, LSD)进行统计分析,P<0.05为差异显著。每组试验除特殊说明外均重复3次,结果表示为平均值±标准差![]()
2 结果与分析
2.1 豌豆蛋白添加量对牛盐溶蛋白凝胶色泽的影响
评价肉的感官品质的重要指标之一是颜色,它同时也是影响消费者购买力的重要因素。由图1可知,凝胶L*值先升高后下降,豌豆蛋白添加质量浓度在0.12 g/mL时达到最大值,为65.92;凝胶a*值呈下降趋势,但添加量在0.04~0.16 g/mL之间差异不显著(P> 0.05);随豌豆蛋白添加量的增加,凝胶b*值显著增加,添加量在0.16 g/mL时达到最大,是对照组的2.41倍。因为牛盐溶蛋白凝胶呈浅红色,豌豆蛋白本身呈淡黄色,随着豌豆蛋白添加量逐渐增加,混合凝胶颜色也逐渐加深,因此a*值逐渐越低,L*值、b*值升高,当豌豆蛋白添加过多则导致L*值下降。
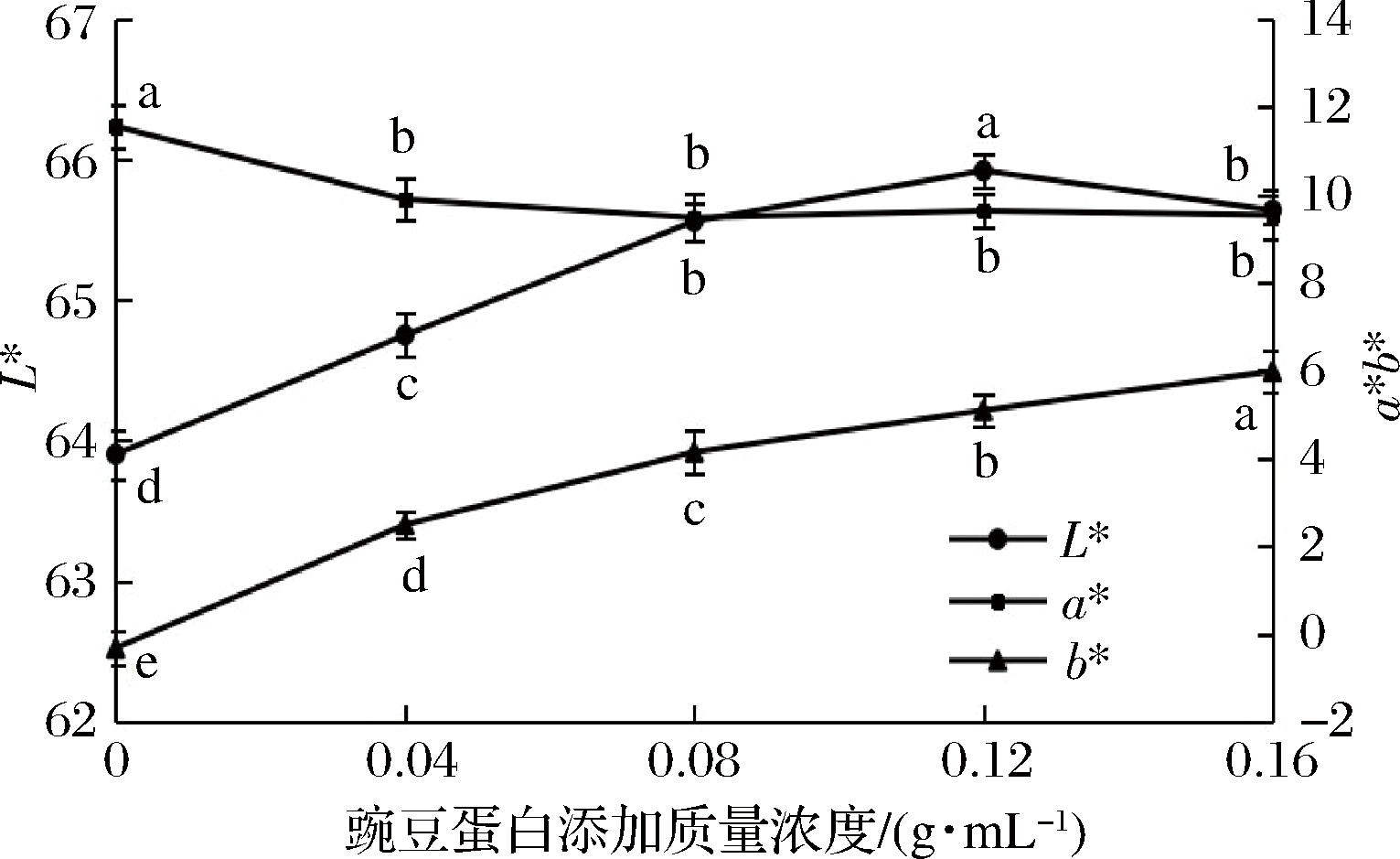
图1 豌豆蛋白的添加量对凝胶色泽的影响
Fig.1 Effect of pea protein addition on the color of gel
注:不同小写字母表示差异显著(P<0.05),下同。
2.2 豌豆蛋白添加量对牛盐溶蛋白凝胶保水性与蒸煮得率的影响
保水性是肉类蛋白凝胶重要的品质特性,它直接影响到肉制品组织结构、风味、以及感官品质等。肉制品中自由水相对百分含量越高,则对应外界处理时损失的水分越多,其保水性也就越差[35]。

图2 豌豆蛋白的添加量对凝胶保水性和蒸煮得率的影响
Fig.2 Effect of pea protein addition on the water holding capacity and cooking yield of gel
由图2可知,随豌豆蛋白添加量的增加,凝胶的保水性和蒸煮得率均呈上升趋势,添加量在0.12 g/mL时,分别为88.85%、89.49%,添加量在0.16 g/mL时,分别为89.62%、90.63%,彼此差异不显著(P>0.05),但与对照相比均差异显著(P<0.05)。表明豌豆蛋白与盐溶蛋白结合,水分子的运动受到束缚,蛋白之间相互作用增强,变性聚集,形成了较为致密的三维网络凝胶结构,从而增强了凝胶的保水性,提高了凝胶的蒸煮得率。冯云等[36]研究表明,牛血浆蛋白具有改善猪肉盐溶蛋白凝胶特性的作用,当添加质量浓度为0.9 g/100mL时,能够降低共混凝胶煮制损失,提高保水性。
2.3 豌豆蛋白添加量对牛盐溶蛋白凝胶质构的影响
凝胶结构的稳定性除了受外界条件的影响外,功能蛋白的数量起了决定性的作用。由表1可知,随着豌豆蛋白添加量的增加,凝胶的硬度、咀嚼性均呈上升趋势,在添加量为0.16 g/mL时最大,分别为1 410 g、949 g,是对照的4.90与4.83倍,差异显著(P<0.05)。凝胶的弹性与恢复性,均随豌豆蛋白添加量的增加,呈先升高后下降趋势,在添加量为0.12 g/mL时最大,分别为0.969、0.432,比对照增加了2.54%和9.09%;在添加量为0.16 g/mL时,弹性与恢复性最低,分别为0.927、0.367。
表1 豌豆蛋白添加量对牛盐溶蛋白凝胶质构的影响
Table 1 Effect of pea protein addition on texture ofbovine gel

添加量/(g·mL-1)硬度/g弹性咀嚼性/g恢复性0.00288±63e0.945±0.004bc196±54e0.396±0.016bc0.04530±104d0.957±0.007ab388±73d0.418±0.012ab0.08798±59c0.955±0.008ab581±75c0.422±0.010ab0.121114±76b0.969±0.006a833±81a0.432±0.011a0.161410±73a0.927±0.003c949±67a0.367±0.007c
注:同一列中不同小写字母表示差异显著(P<0.05),下表同。
由于豌豆蛋白具有较强的乳化性与胶凝性,随豌豆蛋白添加量的增加,使单位体积内凝胶分子数及其分子间碰撞机率增加,促进了豌豆蛋白与牛肉盐溶蛋白的分子间交联,形成了稳定的凝胶网络结构。在豌豆蛋白添加质量浓度为0.12 g/mL时,形成的肉糜凝胶质构特性最好。但加入过量豌豆蛋白,会导致固形物大量增加,对水分的束缚作用增强,且与牛肉蛋白竞争可利用的水分,蛋白相产生浓缩效应,降低了凝胶的弹性与恢复性。孔保华等[37]研究了大豆蛋白对牛肉凝胶特性的影响,结果表明,随大豆蛋白添加量的增加,凝胶弹性大体呈先增加后下降趋势,到3%后,弹性显著降低,与本文研究结果相似。
2.4 豌豆蛋白添加量对牛盐溶蛋白凝胶流变特性的影响
凝胶形成的过程,伴随着肌肉蛋白不断的解链、变性、凝集,是一个不稳定的动态变化过程。储能模量G′的变化能反映出凝胶强度与硬度的变化,G′值越大,对应的凝胶强度与硬度越大。如图3所示,在整个升温过程中,盐溶蛋白凝胶动态流变曲线中弹性模量呈现出 3个阶段的变化。在 25~47 ℃内,弹性模量G′基本保持不变,随着温度的升高,G′在48 ℃左右缓慢增加,并且在 53 ℃达到第1个峰值,这是由于盐溶蛋白中的肌球蛋白分子头部发生变性、聚集,分子的构象发生转变,形成“预凝胶”;继续加热,弹性模量G′急剧下降,并在57 ℃左右达到最小值,这是由于肌球蛋白分子尾部发生变性,使肌球蛋白头部结合崩溃瓦解,形成“凝胶削弱”,破坏了已形成的凝胶的网络结构;G′在57~85 ℃内又快速上升,之后趋于稳定,表明大量变性肌球蛋白之间通过头部二硫键、疏水作用联结,尾部的横向连接等方式发生聚集,形成黏弹性好的凝胶网状结构[38]。
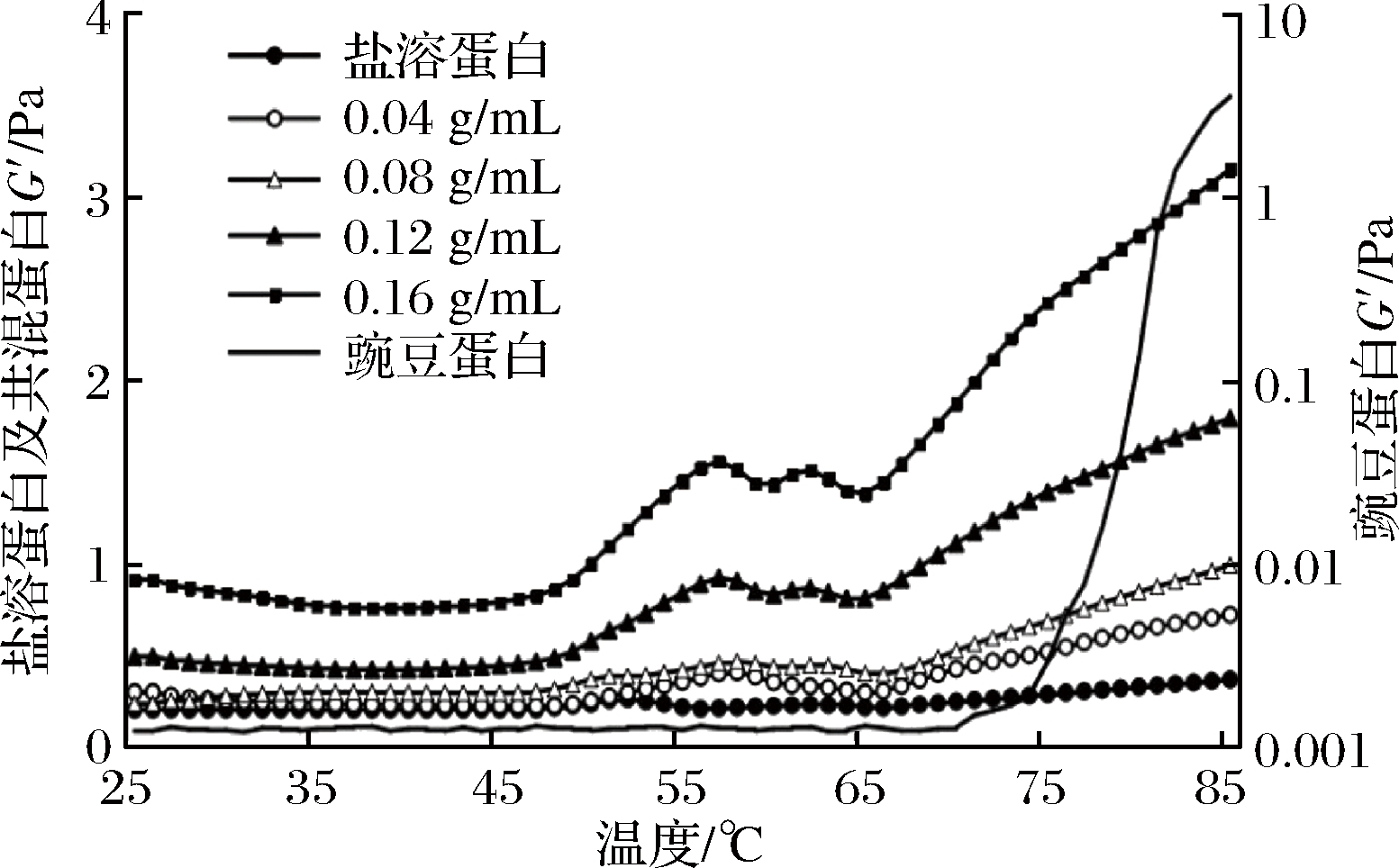
图3 豌豆蛋白添加量对凝胶储能模量的影响
Fig.3 Effect of pea protein addition on storage modulus of gel
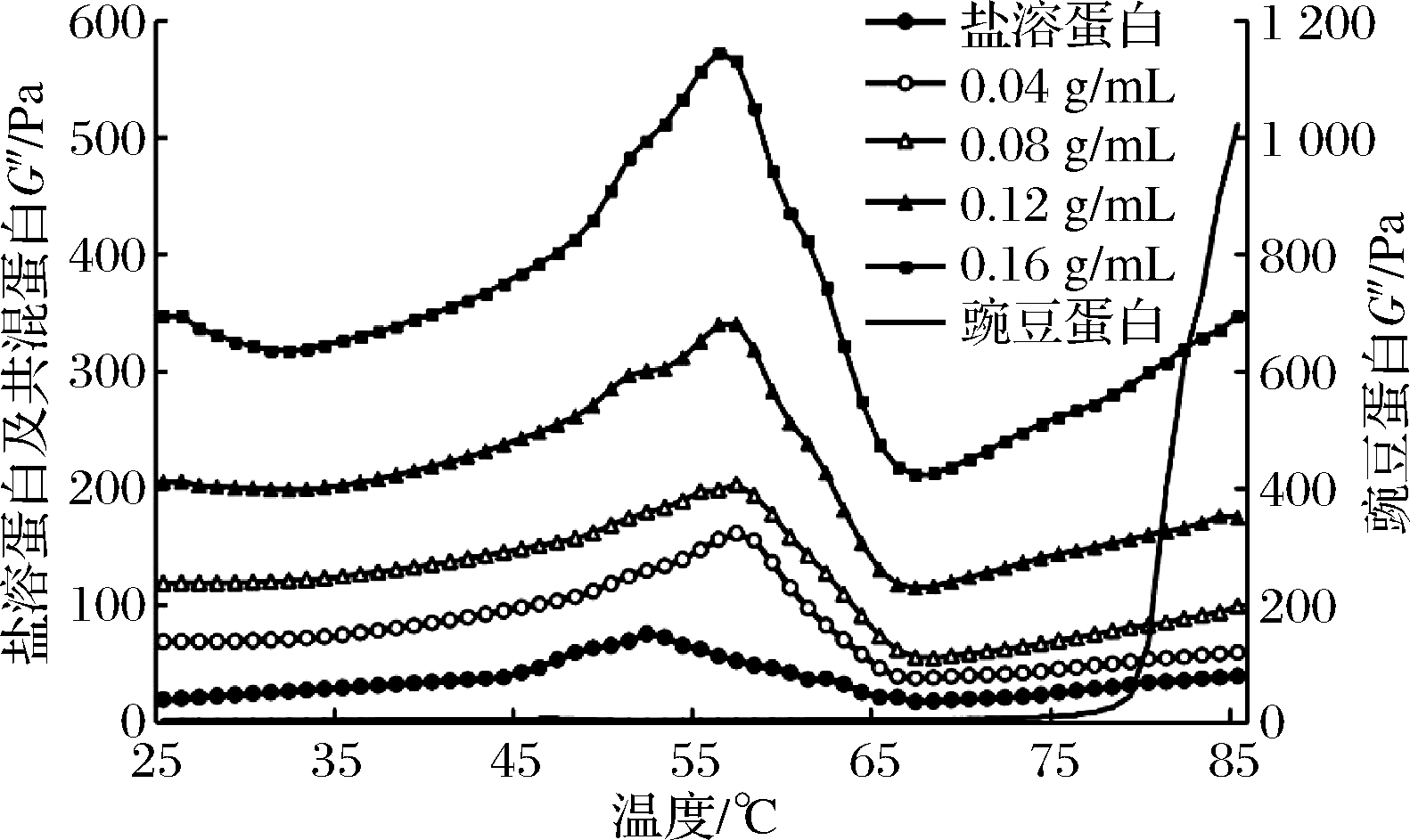
图4 豌豆蛋白添加量对凝胶损耗模量的影响
Fig.4 Effect of pea protein addition on loss modulus of gel
由图3可知,随豌豆蛋白添加量的增加,凝胶G′逐渐增加,添加量越大,初始值与终值越高,且高于对照。在动态流变曲线中,几种添加量的变化趋势类似,G′均呈现出4个阶段的变化。豌豆蛋白添加量影响凝胶盐溶蛋白的变性,第1个峰出现在58 ℃,与盐溶蛋白凝胶峰值温度53 ℃相比,系统峰值温度升高,表明豌豆蛋白推迟了肌球蛋白头部的变性温度;58~60 ℃,G′迅速下降,表明豌豆蛋白推迟了肌球蛋白尾部的变性温度;60~66 ℃,出现了第二峰。SHAND等[39]研究表明,豌豆蛋白有2个热变性温度,分别为67.1和85.1 ℃。MESSION等[40]研究发现,豌豆蛋白7S球蛋白在68.5 ℃、11S球蛋白亚基在75~85 ℃发生变性和聚集。由图3可知,豌豆蛋白从20~76 ℃,G′值基本与横坐标平行,至76 ℃后,G′值快速上升,到85 ℃趋于稳定,与MESSION报道一致,而与SUN等报道豌豆蛋白在82~86 ℃形成凝胶略有差别,可能与豌豆来源、蛋白提取方法、蛋白分散介质有关[41]。据文献报道,牛盐溶蛋白DSC图谱主要有3个热变性峰,分别为峰Ⅰ 50.14 ℃,即肌球蛋白头部的变性峰、峰Ⅱ 60.07 ℃,即肌球蛋白尾部与肌浆蛋白变性峰,峰Ⅲ 74.28 ℃肌动蛋白的变性峰[42]。第2个峰在63 ℃时G′达到最大,且随豌豆蛋白添加量的增加,G′逐渐增加且峰形越来越明显,结合盐溶蛋白与豌豆蛋白凝胶流变曲线特征与文献报道,推测第二峰形变化是由豌豆蛋白7S球蛋白受热解折叠,使其活性巯基、疏水基团等暴露,影响已形成的凝胶结构,造成G′缓慢下降;66~85 ℃,大部分的豌豆蛋白与肌动蛋白分子展开,发生变性交联,G′迅速上升,形成具有一定硬度、弹性、不可逆的热致凝胶。
损耗模量G″反映了凝胶形成过程中盐溶蛋白黏性的变化过程。由图4可知,不同添加量豌豆蛋白的共混凝胶G″值变化趋势相近。36 ℃时G″值开始逐渐增加,58 ℃左右达到最大,之后急剧下降,到68 ℃,继续加热过程中G″值又逐渐上升,最终形成稳定凝胶网络结构。盐溶蛋白凝胶G″值在53 ℃左右达到最大,之后下降,到66 ℃又缓慢上升,与G′中蛋白变性温度一致。有研究表明,46~57 ℃的黏弹性变化可能与肌球蛋白变性有关,46~53 ℃盐溶蛋白处于上升阶段,为肌球蛋白头部结合所致,而豌豆的添加推迟了肌球蛋白头部变性的温度,达到峰值之后的急剧下降可能与肌球蛋白尾部展开有关[43]。图3、图4表明,混合凝胶的G′值和G″值均高于盐溶蛋白,表明添加豌豆蛋白可以提高盐溶蛋白凝胶的形成能力。CHANG等[44]研究表明,大豆豆渣的添加能够影响猪肉凝胶的变性温度,G′值和G″值均随大豆豆渣添加量的增加而升高,与本文结论一致。
2.5 豌豆蛋白对牛盐溶性蛋白凝胶水分迁移的影响
低场核磁共振测量的自旋-自旋弛豫时间(T2),能够反映出凝胶体系水分分布和迁移情况[45],T2越短表明水与底物结合越紧密,反之表明水分越自由[46]。由表2可知,对T2反演拟合后出现3个峰,可能分别对应结合水(T2b),1.87~3.56 ms;不易流动水(T21),20.92~36.63 ms和自由水(T22),177.75~228.88 ms[47]。随豌豆蛋白添加质量浓度的不断增加,T2b、T21、T22均呈现出峰值持续向较短时间方向移动趋势,添加质量浓度为0.16 g/mL时,T2b、T21、T22均降至最低,与添加质量浓度0.12 g/mL时的T2相比,差异不显著(P>0.05),但显著低于对照(P<0.05),表明水分流动性变差,与蛋白凝胶体系结合紧密。峰面积代表此部分水所占的百分比。随豌豆蛋白添加质量浓度的增加,P21持续增加,P22持续下降。添加豌豆蛋白可以降低自由水的峰比例,增加不易流动水的峰比例,表明有更多的自由水附着在蛋白周围或被束缚在凝胶结构中,转变为结合水或不易流动水。添加质量浓度为0.12 g/mL与0.16 g/mL的P21、P22差异不显著(P>0.05),表明添加质量浓度为0.12 g/mL的豌豆蛋白就能够充分降低共混凝胶中水分损失,提高保水性。康壮丽等[48]研究表明,添加大豆分离蛋白乳化猪背膘的凝胶,可降低其自由水峰比例,增加不易流动水峰比例,提高了猪肉凝胶的保水性。本实验中弛豫时间T2的测定结果与保水性结果相一致。
表2 豌豆蛋白对牛盐溶蛋白共混凝胶水分迁移的影响
Table 2 Effect of pea protein on water distribution of beef salt-soluble protein gel

添加量/(g·mL-1)T2弛豫时间/msT2弛豫峰面积相对百分比/%T2bT21T22P2bP21P220.003.56±0.13a36.63±1.87a228.88±3.72a0.62±0.15bc77.32±0.85d22.31±0.56a0.042.61±0.15b30.32±1.72b205.21±3.92b0.75±0.04b81.32±1.55c18.28±0.68b0.082.53±0.12b26.45±1.91c205.12±4.13b0.89±0.03b85.43±1.48b14.37±0.61c0.121.90±0.16c21.71±1.88d179.34±4.31c1.12±0.14a89.23±1.59a8.89±0.65d0.161.87±0.13c20.92±1.82d177.75±4.22c1.25±0.07a90.97±1.60a8.75±0.70d
2.6 豌豆蛋白添加量对牛盐溶蛋白凝胶微观结构的影响
蛋白凝胶为立体网络结构,不仅能留存水分及脂肪,而且也是风味物质载体,因此,蛋白的这种特性具有重大的加工意义。随豌豆蛋白添加量的增加,共混凝胶微观结构得到逐步改善。

图5 豌豆蛋白添加量对凝胶微观结构的影响
Fig.5 Effect of pea protein addition on the microstructure of gel
由图5可知,不添加豌豆蛋白的牛盐溶蛋白凝胶多呈束状,组织状态粗糙松散,感官上颜色发暗,气泡较大、较多;添加质量浓度增加到0.12 g/mL时,凝胶中蛋白交联程度加大,网络结构致密均匀,光滑细腻有层次,感官上颜色发亮,气泡基本消失;到添加质量浓度为0.16 g/mL时,过量的豌豆蛋白与盐溶蛋白激烈的竞争水分,且不能被盐溶蛋白充分“包埋”,已大量裸露。结合流变特性试验结果,推测豌豆蛋白能够促进牛盐溶蛋白凝胶结构的形成,主要是通过物理填充、包埋与机械支撑,以及二者之间可能通过疏水作用、氢键、二硫键等化学相互结合而起作用的。
靳红果等[49]研究了MgCl2、NaCl和pH值等外界因素对牛肉盐溶蛋白热诱导凝胶特性的影响,结果表明,不同的提取条件蛋白含量差异较大。蛋白含量高、保水性好的凝胶网络结构也比较致密,微细孔洞大量均匀分布。
3 结论
豌豆蛋白的添加,有利于促进牛肉盐溶蛋白共混热诱导凝胶立体均一、紧密有序、富有弹性的三维凝胶网络结构的形成;能使共混凝胶获得适宜的色度,能降低凝胶自由水相对百分含量、增加不易流动水的比例,束缚住水分,进而提高了凝胶的保水性与蒸煮得率。随豌豆蛋白添加量的增加,质构特性明显改善,硬度与咀嚼性持续增加,弹性与恢复性呈先增加后下降趋势,添加质量浓度在0.12 g/mL时,凝胶的弹性和恢复性达到最大;豌豆蛋白推迟了肌球蛋白头部的变性温度,随添加量的增加,共混凝胶的G'也明显增大,终值与初始值始终高于对照,且与硬度结果高度一致,G"变化趋势与G′相似;豌豆蛋白可通过物理填充与化学相互作用的形式,改善凝胶的微观结构,添加量在0.12 g/mL时,凝胶网络结构均匀一致,高度有序。
[1] 刘萌, 余小领,王紫燕. 宰后放置时间对牛肉匀浆物热诱导凝胶特性的影响[J]. 食品工业科技, 2015, 36(3): 86-90.
[2] 刘晶晶, 张松山,谢鹏,等. 不同中心温度对牛肉胶原蛋白特性及嫩度的影响[J]. 现代食品科技, 2018, 34(3): 68-76.
[3] 陈驰, 唐善虎,李思宁,等. 微波加热及NaCl添加量对牦牛肉糜凝胶特性和保水性的影响[J]. 食品科学, 2016, 37(21): 67-72.
[4] MA H J, LEDWARD D A. High pressure/thermal treatment effects on the texture of beef muscle[J]. Meat Science, 2004, 68(3): 347-355.
[5] 刘晶晶, 雷元华,李海鹏,等. 加热温度及时间对牛肉胶原蛋白特性及嫩度的影响[J]. 中国农业科学, 2018, 51(5): 977-990.
[6] 孙高军, 马飞,聂兴龙,等. 结冷胶和谷氨酰胺转氨酶对牛肉凝胶持水性与硬度的影响[J]. 肉类研究, 2011, 25(8): 6-11.
[7] 孔保华, 郑冬梅,刁新平. 斩拌时间和pH值对牛肉凝胶特性的影响[J]. 食品与发酵工业, 2003, 29(9): 13-16.
[8] 靳红果, 彭增起,周光宏. 牛肉盐溶蛋白质热诱导凝胶特性研究[J]. 食品科学, 2008, 29(8): 95-99.
[9] 周佺, 蒋爱民,栗俊广,等. 仙草提取物对牛肉盐溶蛋白凝胶过程化学作用力的影响[J]. 食品与机械, 2013, 29(4): 50-53; 169.
[10] DONG J G, PAN R S, WANG Z R, et al. Effects of high hydrostatic pressure and microbial transglutaminase treatment on the qualities of minced beef gels[J]. Food Industry, 2013(8): 171-175.
[11] 王英. 添加豌豆蛋白对Mozzarella干酪品质特性的影响[D]. 大庆:黑龙江八一农垦大学, 2014.
[12] KOWALCZYK D, GUSTAW W, ![]() M, et al. A study on the mechanical properties of pea protein isolate films [J]. Journal of Food Processing and Preservation, 2014, 38(4): 1 726-1 736.
M, et al. A study on the mechanical properties of pea protein isolate films [J]. Journal of Food Processing and Preservation, 2014, 38(4): 1 726-1 736.
[13] SWIATECKA D, NARBAD A, RIDGWAY K P, et al. The study on the impact of glycated pea proteins on human intestinal bacteria [J]. International Journal of Food Microbiology, 2011, 145(1): 267-272.
[14] BOYE J I, AKSAY S, ROUFIK S, et al. Comparison of the functional properties of pea, chickpea and lentil protein concentrates processed using ultrafiltration and isoelectric precipitation techniques [J]. Food Research International, 2010, 43(2): 537-546.
[15] TOMOSKOZI S, LASZTITY R, HARASZI R, et al. Isolation and study of the functional properties of pea proteins[J]. Nahrung/Food, 2001, 45(6): 399-401.
[16] 李慧, 王琪,付鑫,等. 豌豆蛋白挤出物制备抗氧化肽工艺优化及其分离[J]. 食品工业科技, 2018, 39(6): 165-169.
[17] COSTA G E D A, QUEIROZ-MONICI K D S, REIS S M P M, et al. Chemical composition, dietary fibre and resistant starch contents of raw and cooked pea, common bean, chickpea and lentil legumes[J]. Food Chemistry, 2006, 94(3): 327-330.
[18] 周向军, 朱敏涛,袁毅君. 赤藓糖醇对豌豆分离蛋白结构和功能特性的影响[J]. 食品工业科技, 2018, 39(8): 73-77; 84.
[19] SUN X D, ARNTFIELD S D. Gelation properties of myofibrillar/pea protein mixtures induced by transglutaminase cross linking [J]. Food Hydrocolloids, 2012, 27(2): 394-400.
[20] 王琪, 李慧,陆文伟,等. 木瓜蛋白酶酶解豌豆蛋白挤出物产物自由基清除活性评价[J]. 山东理工大学学报(自然科学版), 2018, 32(4): 30-34.
[21] 王正德, 金玉红,杜金华. 豌豆分离蛋白对小麦粉面团特性及挂面品质的影响[J]. 中国粮油学报, 2018, 33(3): 21-26, 63.
[22] 马宁, 魏姜勉. 豌豆蛋白的改性及其开发利用研究进展[J]. 中国市场, 2015, 32: 231-233.
[23] 白一凡, 王辉,杨震,等. 豌豆蛋白加工特性及在乳化香肠中的应用[J]. 肉类研究, 2014, 28(12): 14-16.
[24] 杨震, 曲超,贡慧,等. 豌豆蛋白组织化挤压工艺参数优化及其在肉制品中的应用[J]. 延边大学农学学报, 2016, 38(4): 317-324.
[25] SU Y K, BOWERS J A, ZAYAS J F. Physical characteristics and microstructure of reduced-fat frankfurters as affected by salt and emulsified fats stabilized with nonmeat proteins [J]. Journal of Food Science, 2010, 65(1): 123-128.
[26] SUN J, WU Z, XU X, et al. Effect of peanut protein isolate on functional properties of chicken salt-soluble proteins from breast and thigh muscles during heat-induced gelation [J]. Meat Science, 2012, 91(1): 88-92.
[27] 栗俊广, 蒋爱民,白艳红,等. 木薯淀粉对猪肉盐溶蛋白凝胶特性的影响[J]. 现代食品科技, 2016, 32(11): 123-127, 55.
[28] 李娜, 康庄丽,祝超智,等. NaCl对鸭胸肉糜凝胶特性的影响[J]. 食品工业科技, 2017, 38(14): 51-54.
[29] QIN H, XU P, ZHOU C L, et al. Effects of L-arginine on water holding capacity and texture of heat-induced gel of salt-soluble proteins from breast muscle[J]. LWT-Food Science and Technology, 2015, 63(2): 912-918.
[30] 王春彦, 王锐,康壮丽,等. 冷藏时间对冷却猪肉糜凝胶特性的影响[J]. 食品工业科技, 2018, 39(19): 76-79.
[31] ZHOU Y Z, CHEN C G, CHEN X, et al. Contribution of three ionic types of polysaccharides to the thermal gelling properties of chicken breast myosin [J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2 655-2 662.
[32] WESTPHALEN A D, BRIGGS J L, LONERGAN S M. Influence of pH on rheological properties of porcine myofibrillar protein during heat induced gelation [J]. Meat Science, 2006, 70(4): 697-703.
[33] WATTANACHANT S, BENJAKUL S, LEDWARD D A. Effect of heat treatment on changes in texture, structure and properties of Thai indigenous chicken muscle [J]. Food Chemistry, 2005, 93(2): 337-348.
[34] HAN M, WANG P, XU X, et al. Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with micro-structural characteristics[J]. Food Research International, 2014, 62: 1 175-1 182.
[35] SAOWAKON W, SOOTTAWAT B, DAVID A, et al. Effect of heat treatment on changes in texture, structure and properties of Thai indigenous chicken muscle[J]. Food Chemistry, 2005, 93(2): 337-348.
[36] 冯云, 张伟清,彭增起,等. 牛血浆蛋白对猪肉盐溶蛋白质凝胶特性的影响[J]. 食品科学, 2011, 32(13): 28-31.
[37] 刁新平, 孔保华,郑冬梅. 食盐和大豆蛋白对牛肉凝胶特性的影响[J]. 食品科技, 2003, 11: 29-31;40.
[38] 翟小波, 李洪军,贺稚非. 薯类淀粉对兔肉肉糜流变性质和凝胶特性的影响[J]. 食品与发酵工业, 2016, 42(12): 49-56.
[39] SHAND P J, YA H, PIETRASIK Z, et al. Physicochemical and textural properties of heat-induced pea protein isolate gels [J]. Food Chemistry, 2007, 102(4): 1 119-1 130.
[40] MESSION J, CHIHI M L, SOK N, et al. Effect of globular pea proteins fractionation on their heat-induced aggregation and acid cold-set gelation [J]. Food Hydrocolloids, 2015, 46: 233-243.
[41] SUN X D, ARNTFIELD S D. Gelation properties of salt extracted pea protein induced by heat treatment [J]. Food Chemistry, 2010, 124 (3): 1 011-1 016.
[42] 程述震, 王晓拓,张洁,等. 电子束剂量率对牛肉蛋白结构和理化性质的影响[J]. 食品科学, 2018, 39(3): 150-156.
[43] 魏朝贵, 吴菊清,邵俊花,等. KCl和MgCl2部分替代NaCl对猪肉肌原纤维蛋白乳化凝胶特性的影响[J]. 食品科学, 2014, 35(5): 89-95.
[44] CHANG T, WANG C, WANG S, et al. Effect of okara on textural, color and rheological properties of pork meat gels [J]. Journal of Food Quality, 2014, 37(5): 339-348.
[45] LI C B, LIU D Y, ZHOU G H, et al. Meat quality and cooking attributes of thawed pork with different low field NMR T21[J]. Meat Science, 2012, 92: 79-83.
[46] 韩敏义, 费英,徐幸莲,等. 低场NMR研究pH对肌原纤维蛋白热诱导凝胶的影响[J]. 中国农业科学, 2009, 42(6): 2 098-2 104.
[47] KANG Z L, LI B, MA H J, et al. Effect of different processing methods and salt content on the physicochemical and rheological properties of meat batters [J]. International Journal of Food Properties, 2016, 19(7): 1 604-1 615.
[48] 康壮丽, 李斌,马汉军,等. 大豆分离蛋白添加方式对猪肉凝胶特性的影响[J]. 现代食品科技, 2016, 32(6): 220-224.
[49] 靳红果, 彭增起,周光宏. 牛肉盐溶蛋白质热诱导凝胶特性研究[J]. 食品科学, 2008, 29(8): 95-99.