树莓酮,又称为覆盆子酮[1-2],是树莓果的主要香气成分,具有特征性甜果香气[3-4],存在于树莓、黑莓、葡萄和大黄等水果与蔬菜中[5]。覆盆子酮由于其独特的香味特性在食品工业、化妆品工业、医药行业及农业上具有广泛的应用[6-8]。近年来,有研究发现覆盆子酮可以作用于脂肪代谢,具有减肥功效[9-10]。现如今覆盆子酮在香料工业中,已成为仅次于香兰素的一种具有极高经济价值的香料[11]。
水果中覆盆子酮的含量极低,只有1~4 mg/kg[12],因此从植物中抽提覆盆子酮的成本很高,约为$3 000 /kg[13-14]。目前覆盆子酮的工业生产主要以化学合成法为主,但是根据EC香精指示(88/388/EEC)文件的要求,化学合成的覆盆子酮并不属于天然覆盆子酮,这使得其应用领域受到一定的限制。近年来通过微生物代谢工程合成覆盆子酮的研究逐渐兴起[15]。2007年BEEKWILDER等[5]首次构建合成覆盆子酮的重组大肠
杆菌,但其产量仅为5 mg/L,并伴有柚皮素等其他物质生成。2016年LEE等[16]在酵母菌中构建了覆盆子酮的从头合成途径,产量为2.8 mg/L,同时以对香豆酸为前体生产覆盆子酮的最高产量达到7.5 mg/L。本文以对香豆酸为底物,利用源于植物的4-香豆酰辅酶A连接酶(4-coumarate: CoA ligase,4CL1)[16]、苄基丙酮合酶(benzalacetone synthase,BAS)[17]、苄基丙酮还原酶(raspberry ketone/zingerone synthase,RZS1)[18]3个基因,通过构建重组质粒pCDF-4CL1和pET-BAS-RZS1,导入大肠杆菌中异源表达,以提高大肠杆菌工程菌合成覆盆子酮的能力。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒(表1)
表1 本研究中所用质粒及菌株
Table 1 Plasmids and strains used in this study

名称特征来源质粒pCDF-Duet-1Double T7 promoters, CloDF13 ori, T7lac, SmR本实验室pET-Duet-1Double T7 promoters, pBR322 ori, T7lac, AmpR本实验室pCDF-4CL1pCDF-Duet-1 carrying codon-optimized 4CL1本研究pET-BASpET-Duet-1 carrying codon-optimized BAS本研究pET-BAS-RZS1pET-Duet-1 carrying codon-optimized BAS and codon-optimized RZS1本研究菌株W3110 (DE3)本实验室WCC-1W3110 (DE3) carrying pET-BAS-RZS1 and pCD-4CL1本研究
1.1.2 酶与试剂
PrimeSTAR HS DNA Polymerase、T4 DNA Ligase、QuickCut EcoR I、QuickCut Hind III、QuickCut Sal I、QuickCut Kpn I、QuickCut Bgl II均购自TaKaRa公司;柱式质粒DNA小量抽提试剂盒、柱式DNA胶回收试剂盒、IPTG、硫酸链霉素、氨苄青霉素:生工生物工程(上海)股份有限公司;引物的合成以及测序由金唯智生物科技有限公司完成;SDS-PAGE凝胶快速配置试剂盒:碧云天生物技术有限公司;标准品底物对香豆酸(纯度≥98%)、中间产物对羟基亚苄基丙酮(纯度≥97%)、产物覆盆子酮(纯度≥99%):阿拉丁试剂(上海)有限公司。
1.1.3 培养基
LB培养基(g/L):含胰蛋白胨10,酵母粉5,NaCl 10,pH为7.0。
TB培养基(g/L):胰蛋白胨12,酵母提取物24,甘油5,KH2PO4 2.31,K2HPO4 12.54,pH为7.0。
固体培养基在此基础上添加1.5%琼脂粉。
相应的抗生素(50 mg/L硫酸链霉素,100 mg/L氨苄青霉素)。
1.1.4 主要仪器与设备
小型高速离心机(Centrifuge 5418),德国Eppendorf公司;台式高速冷冻离心机(TGL-20M),上海卢湘仪离心机仪器有限公司;721可见光分光光度计(JH-12-12),上海菁华科技仪器有限公司;金属浴(MK-20),杭州奥盛仪器有限公司;超声破碎仪(92-IIN),宁波新芝生物科技股份有限公司;酶标仪(EPOCH2T),美国伯腾仪器有限公司;PCR仪(Biosafer 9700),赛飞(中国)有限公司。
1.2 实验方法
1.2.1 目的片段的获得及扩增
根据优化过后的4CL1(Arabidopsis thaliana,GeneBank: MK035997),BAS(Rheum palmatum;GeneBank: MK035999)和RZS1(Rubus idaeus;GeneBank: MK036000)的基因序列及pCDF-DUET-1、pET-DUET-1质粒序列设计引物。4CL1基因上游引物4CL1F:5’- ![]() -3’,4CL1基因下游引物4CL1R:5’-
-3’,4CL1基因下游引物4CL1R:5’- ![]() -3’,酶切位点分别为EcoR I与Hind III。BAS基因上游引物
-3’,酶切位点分别为EcoR I与Hind III。BAS基因上游引物![]() ATGAAAAAACTG -3’,BAS基因下游引物
ATGAAAAAACTG -3’,BAS基因下游引物![]() CGC -3’,酶切位点分别为EcoR I与Sal I。RZS1基因上游引物RZS1F:5’-
CGC -3’,酶切位点分别为EcoR I与Sal I。RZS1基因上游引物RZS1F:5’- ![]() -3’,RZS1基因下游引物RZS1R:5’-
-3’,RZS1基因下游引物RZS1R:5’- ![]() TTG -3’,酶切位点分别为Bgl II与Kpn I。PCR反应条件为:94 ℃预变性5 min,98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸20 s,72 ℃延伸10 min,其中第二阶段进行30个循环。利用1%的琼脂糖凝胶电泳进行初步确定,并进行胶回收收集目的基因片段。
TTG -3’,酶切位点分别为Bgl II与Kpn I。PCR反应条件为:94 ℃预变性5 min,98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸20 s,72 ℃延伸10 min,其中第二阶段进行30个循环。利用1%的琼脂糖凝胶电泳进行初步确定,并进行胶回收收集目的基因片段。
1.2.2 表达载体的构建
将目的基因4CL1的PCR产物和质粒pCDF-DUET-1用快切酶EcoR I与Hind III进行双酶切,纯化并回收;将目的基因BAS的PCR产物和质粒pET-DUET-1用快切酶EcoR I与Sal I进行双酶切,纯化并回收;将酶切的PCR产物和对应的线性质粒使用T4连接酶16 ℃过夜连接。连接产物加入到E. coli JM109的感受态中,42 ℃热击90 s,之后将其放冰中静置2 min,加入1 mL LB培养基,于37 ℃,110 r/min培养1 h之后,离心收集菌体,并将菌体重悬于100 μL的LB培养基中,分别涂布于含有50 mg/L的硫酸链霉素及100 mg/L的氨苄青霉素的LB固体培养基上,37 ℃培养12 h。挑取平板上的单菌落进行菌落PCR验证。将验证正确的重组菌株进行培养,提取重组质粒pCDF-4CL1和pET-BAS,并进行双酶切验证,将菌落PCR与双酶切验证都正确的质粒送去测序。将目的基因RZS1的PCR产物以及质粒pET-BAS按照同样的方法构建重组质粒PET-BAS-RZS1。重组质粒pCDF-4CL1和pET-BAS-RZS1,构建图形如图1所示。

a-质粒pCDF-4CL1;b-质粒pET-BAS;c-质粒pET-BAS-RZS1
图1 重组质粒图谱
Fig.1 Maps of recombinant plasmids
将菌落PCR、双酶切及测序验证都正确的重组质粒pCDF-4CL1和PET-BAS-RZS1同时导入到E.coli W3110 (DE3)感受态细胞中,涂布于添加50 mg/L硫酸链霉素和100 mg/L氨苄青霉素抗性平板,37 ℃培养12 h,之后挑取单菌落进行菌落PCR验证,获得阳性克隆,得到重组大肠杆菌。
1.2.3 培养方法
摇瓶培养方法:将-80 ℃甘油管保藏的重组菌株接种在添加50 mg/L硫酸链霉素和100 mg/L氨苄青霉素抗性的LB固体平板上分离活化后,挑取单菌落转接至30 mL LB液体培养基中,37 ℃、110 r/min过夜培养。以体积分数5%的接种量将种子液接种于新鲜的40 mL TB培养基(含有50 mg/L硫酸链霉素和100 mg/L氨苄青霉素)中,37 ℃、110 r/min培养到OD600在0.8~1.2范围时,加入诱导剂IPTG以诱导目的基因表达。每隔12 h取1次样,用HPLC检测底物对香豆酸和产物覆盆子酮的含量。所有的摇瓶发酵设置3个平行,取平均值。
分批发酵培养方法:将-80 ℃甘油管保藏的重组菌株接种在添加50 mg/L硫酸链霉素和100 mg/L氨苄青霉素抗性的LB固体平板上划线活化后,挑取单菌落转接至30 mL LB液体培养基中,37 ℃、110 r/min摇瓶过夜培养。以2%(体积分数)接种量将活化后的菌种转接于75 mL LB液体培养基中,37 ℃、110 r/min培养8 h作为种子液,以5%(体积分数)的接种量接种于3 L发酵罐中(装液量为1.5 L;TB培养基)。发酵条件如下:搅拌转速随溶氧变化,溶氧保持在20%~30%,通气量1 vvm,体积分数25%的氨水和25%的硫酸维持发酵液的pH为7.0。每隔2~3 h取1次样,测量OD600、残糖及底物对香豆酸和产物覆盆子酮的含量。
分批补料发酵培养方法:前期种子液的培养方式如分批发酵培养方法,发酵罐上培养方法有所变化,其发酵条件如下:搅拌转速随溶氧变化,溶氧保持在20%~30%,通气量 1 vvm,体积分数25%的氨水和25%的硫酸维持发酵液的pH为7.0。每隔2~3 h取一次样,测量OD600、残糖及底物对香豆酸和产物覆盆子酮的含量,每当葡萄糖消耗完时一次性补加20 g/L左右的葡萄糖。
1.2.4 重组菌株摇瓶发酵条件优化
起始诱导时间优化:将过夜培养的种子液以5%的接种量接种至40 mL新鲜的TB培养基(含有50 mg/L硫酸链霉素和100 mg/L氨苄青霉素)中,37 ℃、110 r/min培养1、1.25、1.5、1.75、2、2.25及2.5 h时加入终浓度为1 mmol/L的IPTG及终质量浓度为300 mg/L的底物对香豆酸,在20 ℃、110 r/min条件下诱导目的基因表达,培养72 h发酵结束,取样,HPLC检测产物覆盆子酮的产量。
IPTG浓度优化:将过夜培养的种子液以5%(体积分数)的接种量接种至40 mL新鲜的TB培养基(50 mg/L硫酸链霉素和100 mg/L氨苄青霉素)中,37 ℃、110 r/min培养2 h时加入终浓度分别为0.2、0.5、0.8、1.0、1.2、1.5 mmol/L的IPTG及终质量浓度为300 mg/L的底物对香豆酸,在20 ℃、110 r/min条件下诱导目的基因表达,培养72 h发酵结束,取样,HPLC检测产物覆盆子酮的产量。
诱导温度优化:将过夜培养的种子液以5%(体积分数)的接种量接种至40 mL新鲜的TB培养基(50 mg/L硫酸链霉素和100 mg/L氨苄青霉素)中,37 ℃、110 r/min培养2 h时加入0.8 mmol/L的IPTG以及终质量浓度为300 mg/L的底物对香豆酸,分别放到16、20、25、30及37 ℃条件下诱导目的基因表达,培养72 h发酵结束,取样,HPLC检测产物覆盆子酮的产量。
1.2.5 底物及代谢产物的定量检测
采用高效液相色谱(HPLC)检测方法。
紫外检测方法:取1 mL发酵液12 000 r/min离心5 min,之后取500 μL上清液与等体积的甲醇混合,12 000 r/min离心5 min,用0.22 μm的滤膜过滤,HPLC(Waters)定量检测底物对香豆酸和产物覆盆子酮。具体检测条件:色谱柱为AmethystC18-H(4.6 mm×250 mm, 5 μm)反相色谱柱,检测波长222 nm,柱温35 ℃,流动相为V(乙腈)∶V(0.1%磷酸)=2∶8,进样量为20 μL,流速1 mL/min。
示差检测方法:取1 mL发酵液12 000 r/min离心5 min,用0.22 μm的滤膜过滤,HPLC(Waters)定量检测代谢产物乙酸。具体检测条件:色谱柱为Carbomix H-NP 10∶8%(7.8 mm×300 mm, 10 μm)反相色谱柱,柱温55 ℃,流动相为3.3 mmol/L硫酸,流速0.5 mL/min,进样量10 μL,流速0.5 mL/min。
2 结果与讨论
2.1 重组菌株的构建
以合成的4CL1,BAS和RZS1基因为模板,采用引物4CL1F、4CL1R, BASF、BASR, RZS1F、RZS1R进行目的片段的扩增,得到相应的PCR产物,并用核酸电泳表示其大小。目的基因4CL1大小为1 686 bp,BAS为1 155 bp,RZS1为1047 bp,如图2所示。图2-a所示的目的条带大小约为1 600 bp,与4CL1大小吻合,图2-b所示的目的条带大小约为1 100 bp,与BAS大小相吻合,图2-c所示的目的条带大小约为1 000 bp,与RZS1大小吻合。

a-4CL1基因;b-BAS基因;c-RZS1基因
图2 PCR扩增结果电泳
Fig.2 Electrophoretograms of PCR products
将重组质粒pCDF-4CL1和质粒pET-BAS-RZS1分别导入到E. coli JM109的感受态中,进行菌落PCR验证,挑取阳性克隆,培养,提取质粒,使用EcoR I与Hind III对重组质粒pCDF-4CL1进行双酶切验证,验证结果如图3-a所示,其目标条带在1 000 bp与2 000 bp之间,与已知4CL1大小1 686 bp位置相符合;分别使用EcoR I、Sal I,Bgl II、Kpn I及EcoR I、Kpn I对重组质粒pET-BAS-RZS1进行酶切验证,验证结果如图3-b所示。

a-质粒pCDF-4CL1双酶切验证核酸胶图;b-质粒pET-BAS-RZS1双酶切验证胶图;a-中泳道1中1 500~2 000 bp中间的条带表示4CL1基因;b中泳道1中1 000 bp左右的条带表示RZS1基因,泳道2中1 000~1 500 bp中间的条带表示BAS基因,泳道3中2 000~3 000 bp中间的条带表示RZS1与BAS的基因长度之和
图3 重组质粒酶切验证
Fig.3 Identification of recombinant plasmids by digestion with restriction endonuclease
由图3-b可知,其1、2泳道的目标条带都在1 000 bp与2 000 bp之间,与已知RZS1、BAS大小位置相符合,3泳道的目的条带在2 000 bp与3 000 bp之间,与BAS和RZS1相加的大小位置相符;将验证正确的重组质粒pCDF-4CL1和pET-BAS-RZS1进行测序验证,并将测序正确的质粒pCDF-4CL1和pET-BAS-RZS1同时转入感受态E.coli W3110 (DE3)中,以获得重组菌株WCC-1。
2.2 重组菌株WCC-1产覆盆子酮培养条件优化
首先确定重组菌株WCC-1开始诱导的最佳时间,接种1 h后开始添加诱导剂IPTG,起始诱导时间范围为1~2.5 h,其中时间间隔为15 min,诱导到72 h后发酵结束,取上清液按照1.2.5所述的方法检测覆盆子酮的含量,发现在培养2 h时添加IPTG,可以获得最大的覆盆子酮产量,为91.55 mg/L,其结果如图4。
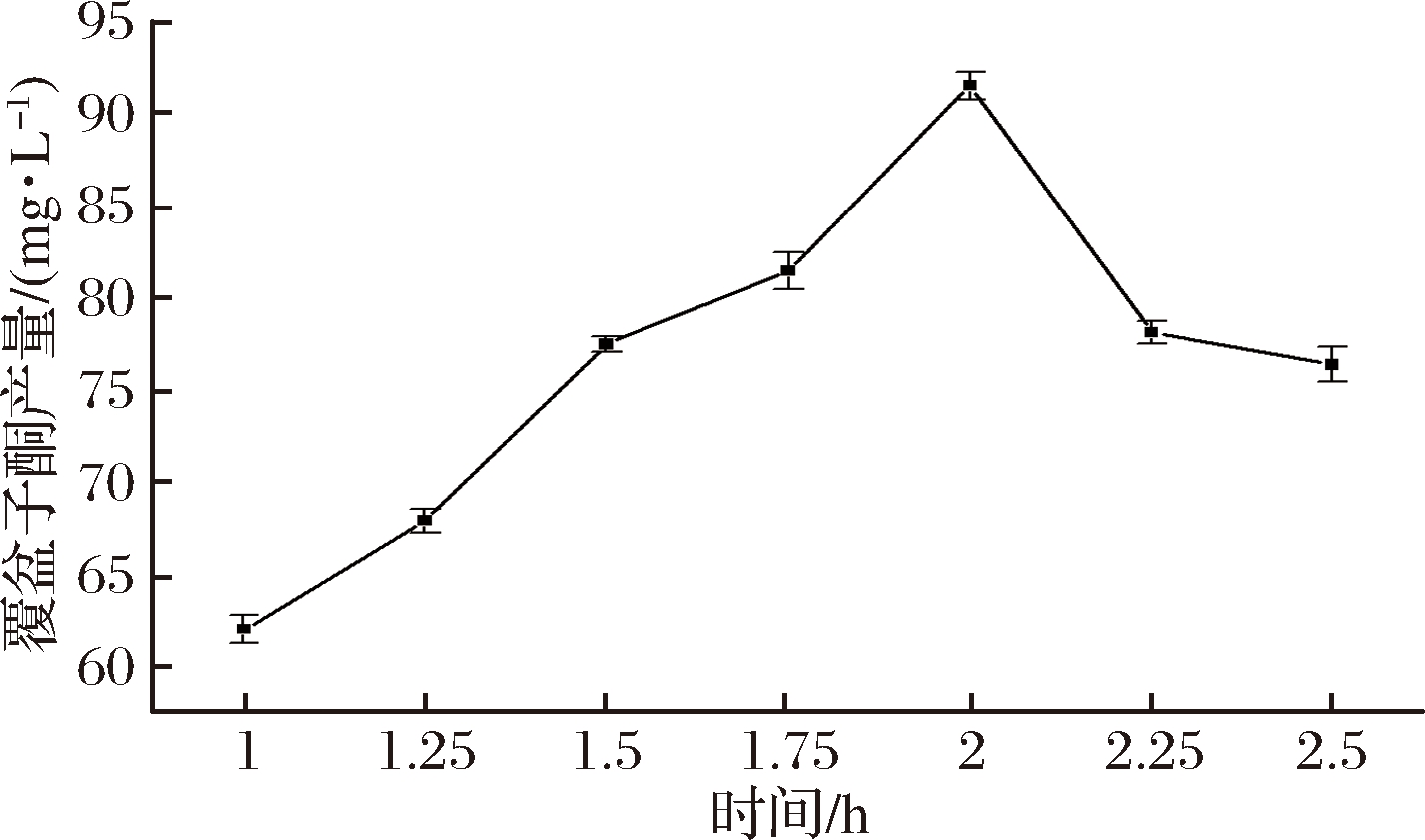
图4 起始诱导时间对覆盆子酮产量的影响
Fig.4 Effect of culture age on the production of raspberry
ketone
在最佳起始诱导时间的基础上确定诱导剂IPTG的最适浓度,使IPTG浓度变化从0到1.5 mmol/L设置梯度变化,诱导到72 h后发酵结束,取上清液按照1.2.5所述的方法检测覆盆子酮的含量,如图5。发现随IPTG浓度的增加,覆盆子酮的产量增加。当IPTG浓度为0.8 mmol/L时,覆盆子酮的产量达到最高,为95.59 mg/L,之后再增加诱导剂IPTG的用量对覆盆子酮的产量并无明显的提高作用,且考虑到经济因素最终确定最适IPTG浓度为0.8 mmol/L。
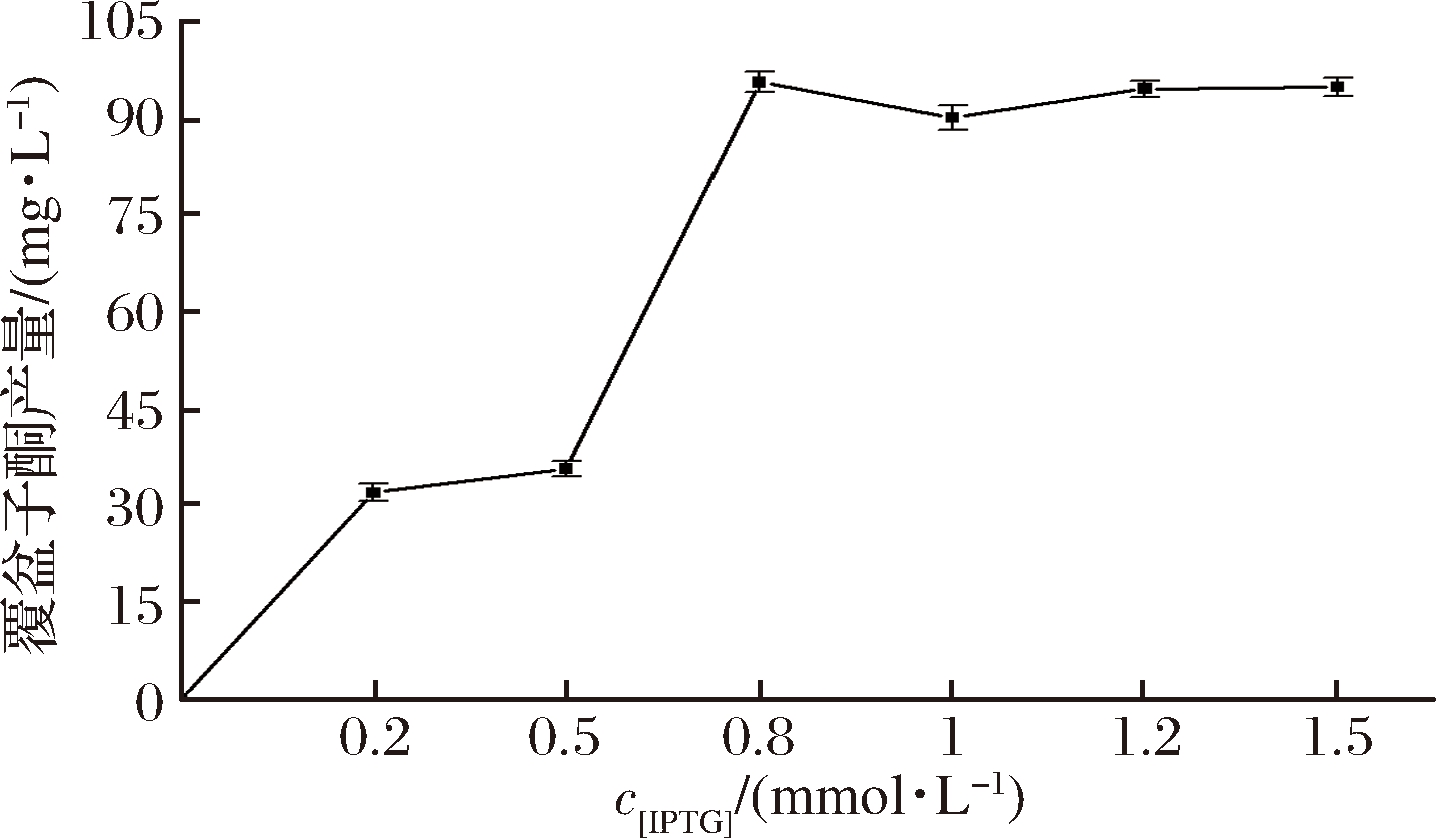
图5 不同IPTG浓度对覆盆子酮产量的影响
Fig.5 Effect of IPTG concentration on the production of raspberry ketone
在一定温度范围内,过高的温度会导致蛋白快速表达,折叠出错,易形成包涵体,但过低的温度又会影响菌体的生长,从而影响产物产量,因此诱导温度在蛋白表达过程中起关键性的作用。如图6所示,在最佳起始诱导时间和最适诱导剂IPTG添加量条件下,在16~37 ℃范围内设置了5个温度梯度,当诱导温度为30 ℃时,覆盆子酮的产量最高,达到了125.86 mg/L,而且可以发现,当诱导温度为37 ℃时,覆盆子酮的产量急剧下降,证明诱导温度确实对产物产量有非常大的影响。
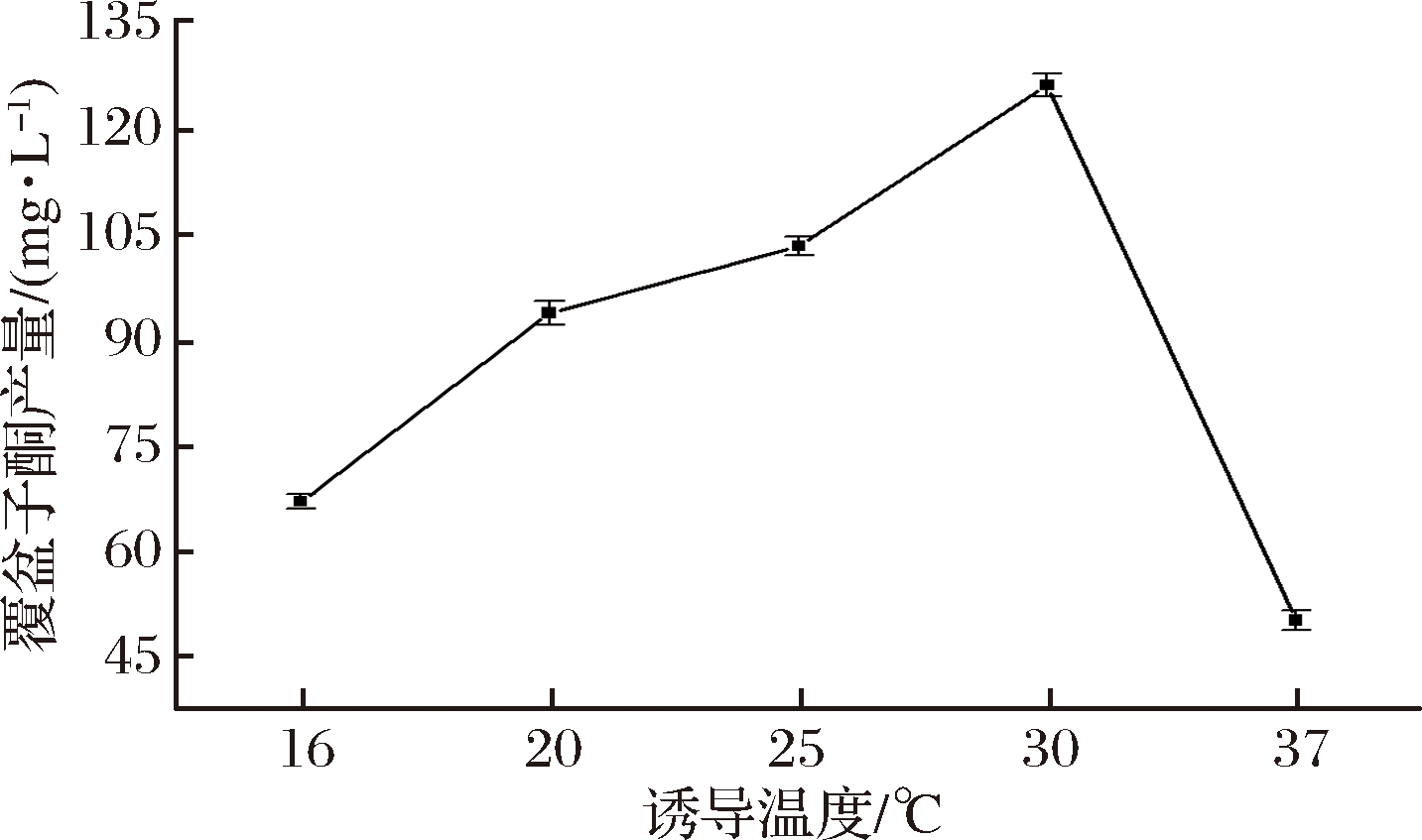
图6 不同诱导温度对覆盆子酮产量的影响
Fig.5 Effect of induction temperature on the production of raspberry ketone
2.3 重组菌株3 L发酵罐发酵生产覆盆子酮
2.3.1 重组菌株WCC-1分批发酵
按照1.2.3中所示的分批发酵培养方法,接种后37 ℃培养至OD600为6~8时,将发酵温度降到30 ℃,加入500 mg/L的底物对香豆酸以及0.8 mmol/L IPTG诱导目的基因表达,发酵结果如图7所示。
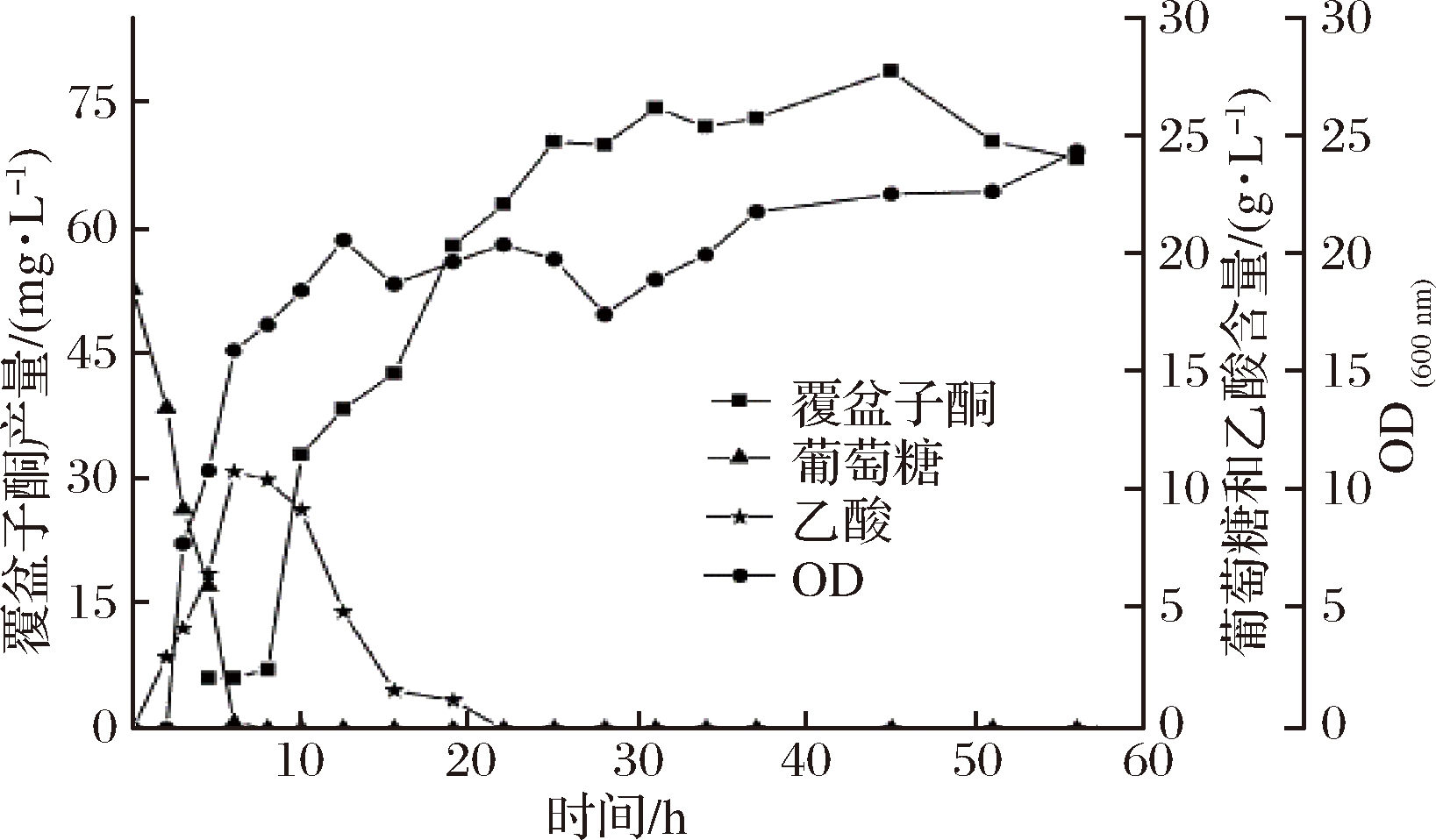
图7 重组菌株WCC-1分批发酵
Fig.7 Batch fermentation of recombinant strain WCC-1
加入诱导剂后覆盆子酮开始积累,接种7 h后葡萄糖耗尽,同时细胞开始以已经积累的乙酸作为碳源,发酵20 h之后葡萄糖和乙酸全部消耗完,OD600基本保持在22左右,在45 h时覆盆子酮的产量达到最大,为78.38 mg/L。LIM等[17]研究重组大肠杆菌合成白藜芦醇时,发现通过添加浅蓝菌素抑制脂肪的合成,增加胞内丙二酰CoA的含量,从而使得白藜芦醇的产量提高了2倍,说明了前体物质丙二酰CoA的重要性。丙二酰CoA也是重组大肠杆菌合成覆盆子酮的前体之一,分批发酵产量低于摇瓶产量的原因,一方面可能是由于乙酸的产生消耗了部分乙酰CoA,使得合成覆盆子酮的前体物质丙二酰CoA的供给不足;另一方面,也有可能是发酵罐中菌体生长优于摇瓶发酵,葡萄糖供给相对不足,造成覆盆子酮的产量较低。
2.3.2 重组菌株WCC-1补料分批发酵
种子液制备及罐上培养方法同2.3.1中所述的分批发酵培养方法,补料分批发酵结果如图8所示,接种后6 h时葡萄糖耗尽,开始进行一次性补料(20 g/L葡萄糖),此时每当葡萄糖耗尽就进行补料,一共补料6次,菌体量在51 h时达到最大,之后开始缓慢下降,说明细胞生长进入衰亡期。在这一阶段,葡萄糖和乙酸都已耗尽,覆盆子酮产量增速也趋于平缓,在68 h时,产物覆盆子酮的产量达到峰值,为178.13 mg/L,较分批发酵提高2.27倍。
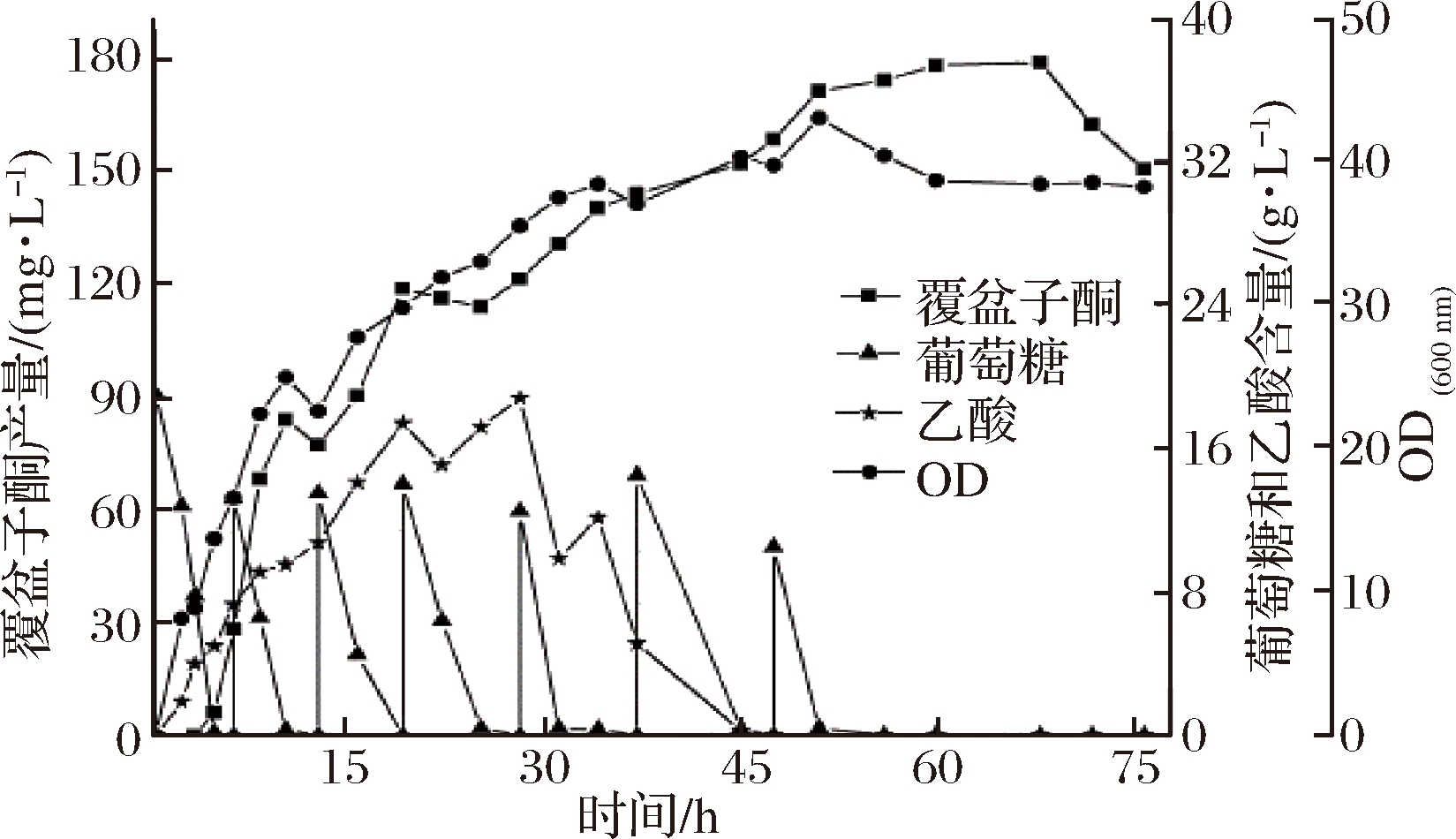
图8 重组菌株WCC-1补料分批发酵
Fig.8 Fed batch fermentation of recombinant strain WCC-1
3 结论
通过在大肠杆菌W3110(DE3)中引入来源于植物的4-香豆酰辅酶A连接酶(4CL1)、苄基丙酮合酶(BAS)和苄基丙酮还原酶(RZS1)基因,成功构建了重组菌株WCC-1。通过对起始诱导时间、诱导剂IPTG浓度、诱导温度的优化,该菌株摇瓶发酵产覆盆子酮质量浓度可达125.86 mg/L。在3 L发酵罐上进行补料分批发酵,覆盆子酮质量浓度提高到178.13 mg/L,较目前已报道的微生物产覆盆子酮的最高产量(7.5 mg/L)显著提高,并展现了微生物发酵生产树莓酮的应用前景。
[1] 孙宝国.日用化工辞典[M].北京:化学工业出版社精细化工出版中心,2002:171-172.
[2] 唐健.复盆子酮的合成及应用[J].化工技术与开发,2006,35(9):21-23.
[3] 孙宝国,何坚.香料化学与工艺学[M].第二版.北京:化学工业出版社,2004:166-196.
[4] LEE J. Further research on the biological activities and the safety of raspberry ketone is needed[J].NFS Journal,2016,2:15-18.
[5] BEEKWILDER J,VAN DER MEER I M,SIBBESEN O,et al.Microbial production of natural raspberry ketone[J].Biotechnol Journol,2007,2(10):1 270.
[6] 李红武,张强,孙力,等.一种烟梗丝状成型加工工艺:中国, CN102631016A[P]. 2012-08-15.
[7] KIM M,BAEK H S,LEE M,et al.Rhododenol and raspberry ketone impair the normal proliferation of melanocytes through reactive oxygen species-dependent activation of GADD45[J].Toxicology in Vitro,2016,32:339-346.
[8] 丹尼尔·雷德尔斯多夫,彼得·韦伯,斯文·沃尔夫拉姆.含没食子酸表儿茶素和树莓酮的营养补充组合物:中国, CN1717268[P]. 2006-01-04.
[9] MORIMOTO C,SATOH Y,HARA M,et al.Anti-obese action of raspberry ketone[J].Life Sciences,2005,77(2):194-204.
[10] WANG Lili,MENG Xianjun,ZHANG Fengqing.Raspberry ketone protects rats fed high-fat diets against nonalcoholic steatohepatitis[J].Journal of Medicinal Food,2012,15(5):495-503.
[11] HAKKINEN S T,SEPPANEN-LAAKSO T,OKSMAN-CALDENTEY K M,et al.Bioconversion to raspberry ketone is achieved by several non-related plant cell cultures[J].Frontiers in Plant Sciences,2015,6:1 035.
[12] LARSEN M,POLL L,CALLESEN O,et al.Relations between the content of aroma compounds and the sensory evaluation of 10 raspberry varieties (Rubus idaeus L.)[J].Acta Agriculturae Scandinavica,1991,41(4):447-454.
[13] FISCHER M,BÖKER A,BERGER R G.Raspberry ketone from submerged cultured cells of the Basidiomycete Nidula niveo-tomentosa[J].Biotechnology Progress,2001,17(3):568-572.
[14] STABNIKOVA O,Wang Jing-yuan,IVANOV V. Value-Added Biotechnological Products from Organic Wastes[M].Humana Press,2010.
[15] 张奋强,刘欢,黄丽娜,等.树莓酮生物合成途径及关键酶功能研究进展[J].生物技术进展,2017,7(2):111-115.
[16] LEE D,LLOYD N D,PRETORIUS I S,et al.Heterologous production of raspberry ketone in the wine yeast Saccharomyces cerevisiae via pathway engineering and synthetic enzyme fusion[J].Microbial Cell Factories,2016,15(1):49.
[17] LIM C G,FOWLER Z L,HUELLER T,et al.High-yield resveratrol production in engineered Escherichia coli[J].Applied and Environmental Microbiology,2011,77(10):3 451-3 460.
[18] ABE I,TAKAHASHI Y,MORITA H,et al.Benzalacetone synthase. A novel polyketide synthase that plays a crucial role in the biosynthesis of phenylbutanones in Rheum palmatum[J].European Journal of Biochemistry,2001,268(11):3 354-3 359.
[19] KOEDUKA T,WATANABE B,SUZUKI S,et al.Characterization of raspberry ketone/zingerone synthase, catalyzing the alpha, beta-hydrogenation of phenylbutenones in raspberry fruits[J]. Biochemical and Biophysical Research Communications,2011,412(1):104-108.