2,5-二甲基吡嗪(2,5-dimethylpyrazine,2,5-DMP)是一种含氮杂环化合物(图1),作为重要的风味化合物广泛存在于传统发酵食品和热处理食品中,例如白酒[1-3]、酱油[4-6]、发酵的可可粉[7-8]、烧烤的牛肉[9]、种子[10]以及花生[11]等,主要贡献食品中的烤花生香气[12-13],是我国GB2760—1986中规定允许使用的香精物质。2,5-DMP具有极低的阈值,在食品中添加1~2 μg/kg,就可以起到明显的增香作用[14]。此外,2,5-DMP还是一种重要的医药中间体——5-甲基吡嗪-2-羧酸的重要合成原料[15]。目前,国内外对于2,5-DMP的合成主要采用化学方法,但化学合成往往存在严峻的环保问题,且产品不是天然的。作为具有增香作用的食品添加剂,生物法生产的2,5-DMP明显更受消费者喜爱,且价格更高。
L-苏氨酸是一种可广泛应用于食品、药品、饲料添加等方面的常用氨基酸,微生物发酵法生产L-苏氨酸的工艺简单,成本低廉,是目前通用的生产方法[16-18]。近年来,国内外大型企业,如中国梅花、日本味之素、德国德固赛等公司逐渐增加产能(100余万t),导致L-苏氨酸产能逐渐过剩,市场饱和,产品价格呈下降趋势。因此,将产能过剩的低值生物基化学品高值化[19],如构建新的以L-苏氨酸为底物的高值生物化学品2,5-DMP生产菌种及方法,是缓解L-苏氨酸产能过剩,实现2,5-DMP生物法生产的有效思路。
在之前的研究工作中,本课题组筛选得到1株可以利用L-苏氨酸为底物生产2,5-DMP的野生型菌种,经鉴定为枯草芽孢杆菌(Bacillus subtilis),且已成功解析B.subtilis利用L-苏氨酸为底物生产2,5-DMP的合成机制(未发表)。如图1所示,在B.subtilis中,微生物利用L-苏氨酸脱氢酶(L-threonine dehydrogenase,TDH)为唯一关键酶,后经过一系列非酶催化反应生成2,5-DMP。然而,该菌种产量、产率均过低,难以满足工业化生产需要。2,5-DMP作为一种重要的食品级风味化合物,其生产菌株的安全性至关重要。B.subtilis为美国食品和药物管理局(food and drug administration,FDA)认定的安全菌种(generally recognized as safe,GRAS)[20],有潜力作为食品级化合物生产宿主。另外,B.subtilis易培养、繁殖快、易保存,具有良好的发酵基础和生产技术[21],是原核表达系统中外源蛋白表达较理想的宿主之一[22]。B.subtilis 168具有更为清晰的遗传背景及较强的遗传操作可行性。因此,本研究以B.subtilis 168为出发菌株,筛选不同种属来源的TDH,在获得外源表达具有高效催化活力的TDH工程菌株的基础上,外源表达NADH氧化酶(NADH oxidase,NOX),以促进辅因子循环,最终构建得到1株可利用L-苏氨酸为底物高产2,5-DMP的基因工程菌株B.subtilis 168/pMA0911-tdh(E.c)-nox,首次实现了从L-苏氨酸到2,5-DMP的高效生物转化。该工作一方面缓解了L-苏氨酸产能过剩的困境,另一方面有机会获得国际认可的“nature flavor”[23]高值风味化合物产品。

TDH-L-苏氨酸脱氢酶;NOX-NADH氧化酶;S-自发反应
图1 2,5-DMP合成途径示意图
Fig.1 Scheme of 2,5-DMP synthetic pathway
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
本研究所用菌株和质粒见表1。
1.1.2 主要试剂与仪器
2,5-DMP标准品,Sigma-Aldrich (美国);限制性内切酶(NdeI,EcoR I,BamH I)、In-Fusion HD Cloning Kit、PrimerSTAR Max DNA Polymerase等分子操作所用酶,宝生物工程(大连)有限公司;溶菌酶、硫酸卡那霉素及氨苄青霉素,生工生物工程(上海)股份有限公司;E.Z.N.A.TM Gel Extraction Kit、Plasmid Mini Kit等分子操作所用试剂盒,Omega Bio-Tek (美国);其他试剂均为国产或进口分析纯。
PCR 仪,Bio-Rad;核酸电泳仪,北京六一仪器厂;凝胶成像仪,美国ProteinSimple;多功能酶标仪,Thermo Scientific公司;高效液相色谱仪,Agilent 1200;超高效液相色谱仪,Waters;超声波细胞破碎仪,Scientz。
表1 本研究中使用的菌株与质粒
Table 1 Strains and plasmids used in this study

菌株与质粒描述来源菌株E.coliDH5αClonedhostTransGenBiotechB.subtilis168ExpressionhostforTDHLabcollectionB.subtilis168/pMA0911B.subtilis168derivativewithpMA0911ThisworkB.subtilis168/pMA0911-tdh(B.s)B.subtilis168derivativewithpMA0911-tdh(B.s)ThisworkB.subtilis168/pMA0911-tdh(B.l)B.subtilis168derivativewithpMA0911-tdh(B.l)ThisworkB.subtilis168/pMA0911-tdh(B.a)B.subtilis168derivativewithpMA0911-tdh(B.a)ThisworkB.subtilis168/pMA0911-tdh(P.p)B.subtilis168derivativewithpMA0911-tdh(P.p)ThisworkB.subtilis168/pMA0911-tdh(E.c)B.subtilis168derivativewithpMA0911-tdh(E.c)ThisworkB.subtilis168/pMA0911-tdh(A.c)B.subtilis168derivativewithpMA0911-tdh(A.c)ThisworkB.subtilis168/pMA0911-tdh(A.u)B.subtilis168derivativewithpMA0911-tdh(A.u)ThisworkB.subtilis168/pMA0911-noxB.subtilis168derivativewithpMA0911-noxThisworkB.subtilis168/pMA0911-tdh(E.c)-noxB.subtilis168derivativewithpMA0911-tdh(E.c)-noxThiswork质粒pMA0911pMA5derivative,PHpall,ColE1,repB,replicatesinE.coli(Ampr)orB.subtilis(Kanr)LabcollectionpMA0911-tdh(B.s)pMA0911derivativewithtdh(B.subtilis168)ThisworkpMA0911-tdh(B.l)pMA0911derivativewithtdh(B.licheniformisATCC14580)ThisworkpMA0911-tdh(B.a)pMA0911derivativewithtdh(B.amyloliquefaciensDSM7)ThisworkpMA0911-tdh(P.p)pMA0911derivativewithtdh(P.putida)GenesynthesispMA0911-tdh(E.c)pMA0911derivativewithtdh(E.coliK-12)GenesynthesispMA0911-tdh(A.c)pMA0911derivativewithtdh(A.candidus)GenesynthesispMA0911-tdh(A.u)pMA0911derivativewithtdh(A.uvarum)GenesynthesispMA0911-noxpMA0911derivativewithnoxGenesynthesispMA0911-tdh(E.c)-noxpMA0911derivativewithtdh(E.coliK-12)andnoxThiswork
注:Ampr:氨苄青霉素抗性;Kanr:硫酸卡那霉素抗性。
1.1.3 培养基及缓冲液
LB培养基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L;固体LB培养基加入2%琼脂。
LBT培养基:LB培养基添加5 g/L L-苏氨酸。添加方法如下:配制50 g/L的L-苏氨酸母液,使用无菌水系滤膜(0.22 μm)过滤除菌后,添加5 mL至无菌浓缩LB培养基中(121 ℃,20 min),培养基中最初的L-苏氨酸浓度以实际检测浓度为准。在菌株构建和发酵过程中,抗生素的添加量为氨苄青霉素100 μg/mL,硫酸卡那霉素50 μg/mL。
PBS缓冲液:50 mmol/L Na2HPO4溶液与50 mmol/L NaH2PO4溶液适量混合,调至pH 8.0。
1.2 TDH过表达菌株的构建
1.2.1 TDH过表达质粒的构建
NCBI查找获取分属于7种不同种属菌株的TDH编码基因:Bacillus subtilis 168、Bacillus licheniformis ATCC 14580、Bacillus amyloliquefaciens DSM7、Pseudomonas putida、Escherichia coli K-12、Aspergillus candidus、Aspergillus uvarum (见表2)。由于P.putida、E.coli K-12、A.candidus及A.uvarums四株菌株的基因组DNA无法获取,且胞内密码子偏好性可能与本研究使用的宿主菌B.subtilis有一定差距,因此,本研究采用全基因合成结合密码子优化方法获取该4株菌株的TDH编码基因tdh。针对B.subtilis 168、B.licheniformis ATCC 14580、B.amyloliquefaciens DSM7三株菌株的基因tdh的获取,本研究首先分别提取3株菌株的基因组[24]。
表2 本研究中使用的基因信息
Table 2 Genes information used in this study

基因名称长度/bp蛋白序列登录号tdh(B.subtilis168)1044NP_389581tdh(B.licheniformisATCC14580)1044WP_085959523tdh(B.amyloliquefaciensDSM7)1047WP_014470388tdh(P.putida)1149WP_064301272tdh(E.coliK-12)1026NP_418073tdh(A.candidus)1053XP_024673913tdh(A.uvarum)1056XP_025487049nox(Lactobacillusbrevis)1353AAN04047
以各菌株基因组DNA为模板,分别以B.subtilis 168-tdh-F/R、B.licheniformis ATCC 14580-tdh-F/R和B.amyloliquefaciens DSM7-tdh-F/R为引物(表3),通过PCR扩增获得相应各菌种基因tdh。PCR反应体系:2×PrimerSTAR Max DNA Polymerase 25.0 μL,引物F和R (20 μM)各1.0 μL,基因组DNA模板2.0 μL,无菌水21.0 μL。PCR 反应条件:98 ℃,3 min;[98 ℃,30 s;55 ℃,15 s;72 ℃,80 s],30个循环;72 ℃,10 min。
表3 本研究中所用引物
Table 3 Primers used in this study

引物名称序列(5′→3′)B.subtilis168-tdh-FGGAGCGATTTACATATGATGCAGAGTGGAAAGATGB.subtilis168-tdh-RGCTTGTCGACGAATTCTTATGGAATTAAAATTACTTTTCCGB.amyloliquefaciensDSM7-tdh-FGGAGCGATTTACATATGATGTTGGACGGAAATATGAAAGCGCB.amyloliquefaciensDSM7-tdh-RGCTTGTCGACGAATTCCTACGGTATCAGTACGACTTTGCCGB.licheniformisATCC14580-tdh-FGGAGCGATTTACATATGATGTTGGGAGGAAAGATGAAAGCB.licheniformisATCC14580-tdh-RGCTTGTCGACGAATTCTTATGGAATCAGAATGACTTTGCCGnox-FCTGGGATTAAGAATTCATGAAAGTTACGGTGGTCGGCnox-RCGACTCTAGAGGATCCTCACGCATTAACGCTTTGTGCpMA0911-FTGCTGAATAAAAGATACGAGpMA0911-RTTCACCGTCATCACCGAAAC
质粒pMA0911进行双酶切(37 ℃,30 min),酶切位点为NdeI/EcoR I。PCR扩增产物和与酶切的质粒pMA0911经胶回收纯化后使用In-Fusion HD Cloning Kit进行连接(50 ℃,15 min)。将连接产物转入E.coli DH5α感受态细胞中,通过氨苄青霉素抗性(100 μg/mL)筛选阳性克隆子。挑取克隆子提取质粒,通过酶切和测序验证阳性克隆子的正确性。
1.2.2 TDH过表达菌株的构建
将构建成功的重组质粒转化至B.subtilis 168感受态细胞中,B.subtilis 168感受态的制备和转化方法详见参考文献[24]。利用硫酸卡那霉素抗性(50 μg/mL)筛选阳性转化子,对挑取的阳性转化子进行菌液PCR验证。所用鉴定引物为pMA0911-F/R (表3),PCR反应体系:2×PrimerSTAR Max DNA Polymerase 12.5 μL,引物F和R (20 μmol/L)各0.5 μL,基因组DNA模板1.0 μL,无菌水10.5 μL。PCR 反应条件:98 ℃,3 min;[98 ℃,30 s;55 ℃,15 s;72 ℃,115 s],30个循环;72 ℃,10 min。
1.3 TDH和NOX共表达菌株的构建
1.3.1 重组质粒pMA0911-tdh(E.c)-nox的构建
通过基因合成获取重组质粒pMA0911-nox,以此质粒为模板,设计引物nox-F/R (表3),通过PCR扩增获得相应的基因nox,PCR反应体系同1.2.1,PCR反应条件:98 ℃,3 min;[98 ℃,30 s;55 ℃,15 s;72 ℃,90 s],30个循环;72 ℃,10 min。PCR扩增产物和酶切质粒pMA0911-tdh(E.c)(EcoR I/BamH I,37 ℃,30 min)经胶回收纯化后使用In-Fusion HD Cloning Kit进行连接(50 ℃,15 min)。将连接产物转入E.coli DH5α感受态细胞,通过氨苄青霉素抗性(100 μg/mL)筛选阳性克隆子,提取质粒,通过酶切和测序验证其正确性。
1.3.2 TDH和NOX共表达菌株的构建
方法同1.2.2。
1.4 发酵实验
将构建成功的基因工程菌株在硫酸卡那霉素(50 μg/mL)抗性LB平板上进行活化,37℃过夜培养,挑取单菌落至LB液体培养基(50 μg/mL 硫酸卡那霉素),37 ℃,200 r/min 培养12 h,转接250 mL摇瓶(含有一定浓度L-苏氨酸的LBT培养基50 mL,50 μg/mL硫酸卡那霉素)进行发酵,24 h后取样,测定在600 nm处的吸光度值OD600,然后计算出2,5-DMP和L-苏氨酸的浓度。
1.5 2,5-DMP浓度测定
2,5-DMP采用超高效液相色谱进行定量测定,所用流动相A为0.1%(体积分数)甲酸溶液,流动相B为色谱级甲醇。流动相体积分数梯度变化为:初始,31% B;0~3 min,31%~69% B;3.10 min,31% B;运行时间为10 min。流速为0.2 mL/min,色谱柱为Waters BEH C18柱(100 mm×2.1 mm,1.7 μm),采用二极管阵列检测器(photo-diode array,PDA)检测器,检测波长为275 nm。
1.6 L-苏氨酸浓度测定
L-苏氨酸的浓度采用邻苯二甲醛(O-phthalaldehyde,OPA)柱前在线衍生-高效液相色谱进行测定。所用流动相A为乙酸钠缓冲液(55 mmol/L,pH 7.2),流动相B为乙酸钠缓冲液(275 mmol/L,pH 7.2)∶色谱级甲醇∶色谱级乙腈=1∶2∶2(体积比)。流动相梯度变化为:初始,8 % B;0~23 min,8%~52.3% B;23~23.5 min,52.3%~100% B;23.5~26.5 min,100% B;26.5~28 min,100%~8% B;运行时间为30 min。流速为1 mL/min,色谱柱为Agilent ZORBAX SB-C18柱(250 mm×4.6 mm,5 μm),采用紫外检测器,检测波长为338 nm。
1.7 菌体生长密度测定
取0.2 mL发酵液,使用蒸馏水进行4倍稀释,测定 600 nm 波长下的吸光值(无菌培养基作为空白对照)。
1.8 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析
取2 mL发酵液进行离心(12 000 r/min,5 min),利用0.85%(质量浓度)的NaCl溶液对菌体洗涤2次。用1 mL PBS缓冲液悬浮菌体至OD600为3.0,加入20 μL溶菌酶(母液质量浓度为20 mg/mL),于37 ℃水浴放置1 h,取出悬浮菌液置于冰上。利用超声波细胞破碎仪对菌体进行破碎(时间1 min;功率36%),对破碎液离心(12 000 r/min,5 min),取上清进行适当稀释至蛋白终质量浓度为0.8 mg/mL。蛋白含量采用Bradford法进行测定[25]。SDS-PAGE上样预处理:取30 μL稀释液加入10 μL的4×蛋白质SDS-PAGE上样缓冲液,混匀后放置沸水中10 min,随后进行离心(12 000 r/min,10 min)。取20 μL上清液进行上样,最终获得SDS-PAGE图。
2 结果与分析
2.1 不同来源的TDH表达载体的构建
前期研究表明,B.subtilis合成2,5-DMP的途径中,TDH为唯一关键酶,催化L-苏氨酸生成2-氨基乙酰乙酸,后者进行一系列非酶促反应最终生成2,5-DMP。因此,以2,5-DMP野生合成菌种为出发菌种,过表达TDH,理论上可以进一步提高2,5-DMP产量,且不同来源的TDH可能具有不同的催化活性。因此,本研究计划以B.subtilis 168为出发菌种,首先选取不同种属来源的TDH,并分别外源表达,通过检测2,5-DMP产量,来筛选具有催化优势的TDH,并获得2,5-DMP增产菌种。
通过在NCBI查找,确定了7种不同种属来源的TDH编码基因tdh (表2):B.subtilis 168、B.licheniformis ATCC 14580、B.amyloliquefaciens DSM7、P.putida、E.coli K-12、A.candidus、A.uvarums。分别提取B.subtilis 168、B.licheniformis ATCC 14580、B.amyloliquefaciens DSM7全基因组,并以此为模板分别进行TDH编码基因tdh的克隆。选用B.subtilis外源表达质粒pMA0911为载体,双酶切(Nde I/EcoR I)后的质粒与PCR扩增的TDH编码基因tdh (图2-A)经胶回收纯化后进行连接,构建TDH表达重组质粒(图2-B)。另外,因P.putida、E.coli K-12、A.candidus、A.uvarums四株菌株的基因组难以获得,因此对上述4种菌株的TDH编码基因tdh密码子优化后进行全基因合成,并构建到表达载体pMA0911上。
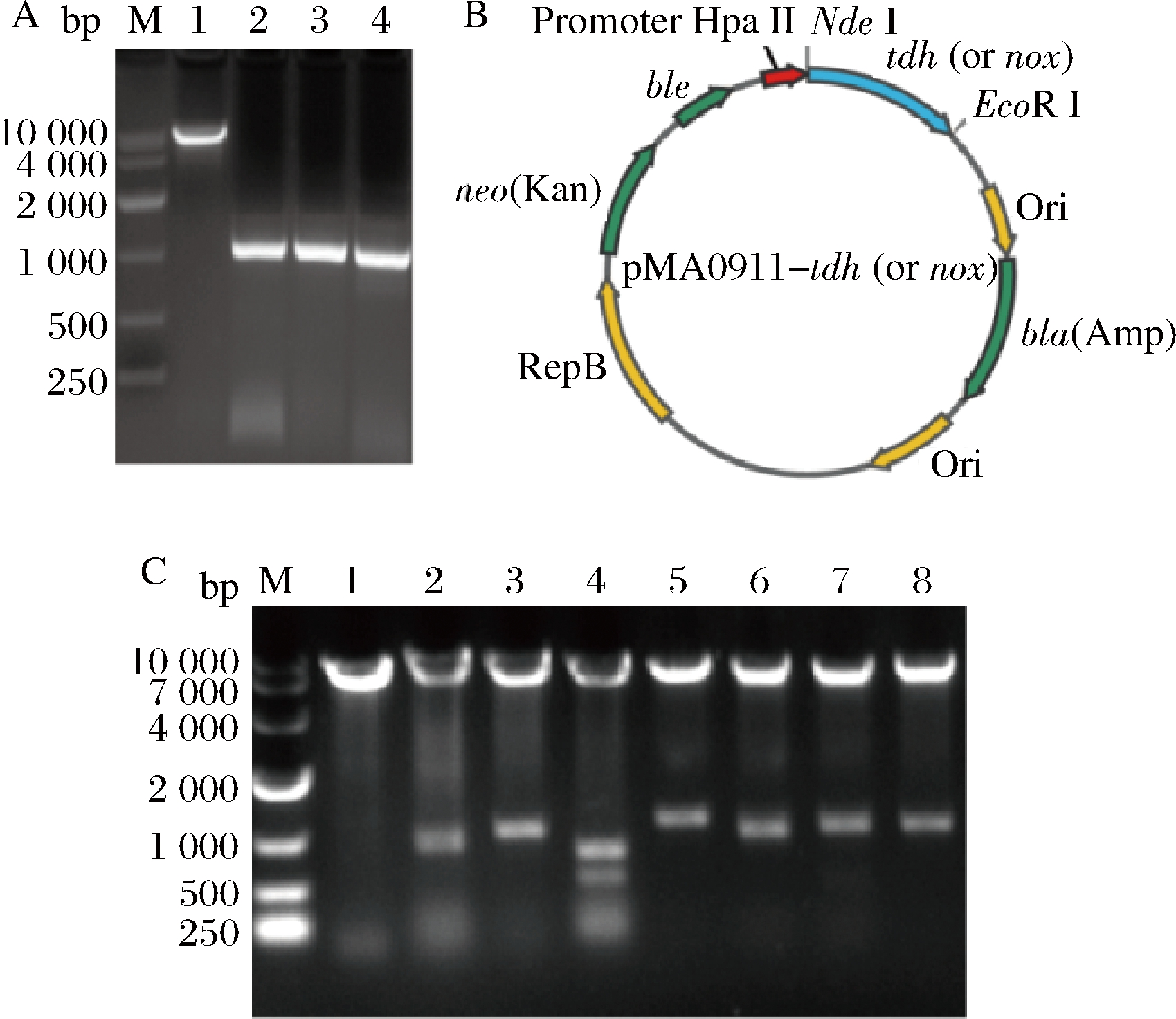
A-质粒pMA0911的酶切与不同菌株的TDH编码基因tdh的PCR扩增,M-marker;1-pMA0911;2-tdh (B.subtilis 168);3-tdh (B.licheniformis ATCC 14580);4-tdh (B.amyloliquefaciens DSM7);B-重组质粒pMA0911-tdh或pMA0911-nox示意图;C-重组质粒pMA0911-tdh的酶切验证;M-marker;1-pMA0911;2-pMA0911-tdh (B.s);3-pMA0911-tdh (B.l);4-pMA0911-tdh (B.a);5-pMA0911-tdh (P.p);6-pMA0911-tdh (E.c);7-pMA0911-tdh (A.c);8-pMA0911-tdh (A.u)
图2 TDH表达载体pMA0911-tdh的构建与酶切验证
Fig.2 Construction and verification of pMA0911-tdh
对构建的重组质粒(图2-B)进行双酶切(Nde I/EcoR I)验证,酶切结果如图2-C所示,各酶切片段长度与表4中一致,表明TDH编码基因tdh成功与表达载体连接。为了进一步确定基因序列的正确性,将酶切结果正确的重组质粒进行测序,测序结果与原有序列进行比对,确定序列一致,表明各个来源的TDH编码基因tdh未发生突变,不同来源的TDH表达载体pMA0911-tdh构建成功。
表4 本研究中重组质粒的酶切片段长度
Table 4 Length of digestion fragments of recombinant plasmids used in this study

重组质粒酶切片段长度/bp重组质粒酶切片段长度/bppMA09117102、116pMA0911-tdh(E.c)7102、1031pMA0911-tdh(B.s)7102、921、128pMA0911-tdh(A.c)7102、1058pMA0911-tdh(B.l)7102、1049pMA0911-tdh(A.u)7102、1061pMA0911-tdh(B.a)7102、592、251、209pMA0911-nox7102、1358pMA0911-tdh(P.p)7102、1154pMA0911-tdh(E.c)-nox7059、1359、1031
2.2 TDH表达菌株的构建及发酵验证
将验证正确的7种不同种属来源的TDH表达载体pMA0911-tdh分别转入B.subtilis 168感受态中,对阳性转化子进行菌液PCR验证,结果如图3所示,与理论上的PCR产物长度一致(表5)。表明以B.subtilis 168为宿主,7种不同种属来源的TDH外源表达菌株构建成功。
对构建成功的工程菌株进行发酵验证,在含有5.83 g/L的L-苏氨酸的LBT液体培养基中发酵24 h,测定细胞生长量(OD600)、生成的2,5-DMP和消耗的L-苏氨酸。结果如图4所示,各基因工程菌的OD600无明显差别(图4-B),不同种属来源的TDH外源表达菌株积累2,5-DMP能力具有显著性差异,来源于E.coli K-12的TDH外源表达菌株B.subtilis168/pMA0911-tdh(E.c)利用L-苏氨酸消耗量最高,积累2,5-DMP质量浓度最高,发酵24 h后,2,5-DMP的积累量高达527.43 mg/L。而来源于P.putida、A.candidus与A.uvarums的TDH外源表达菌株2,5-DMP积累量并无明显提高。
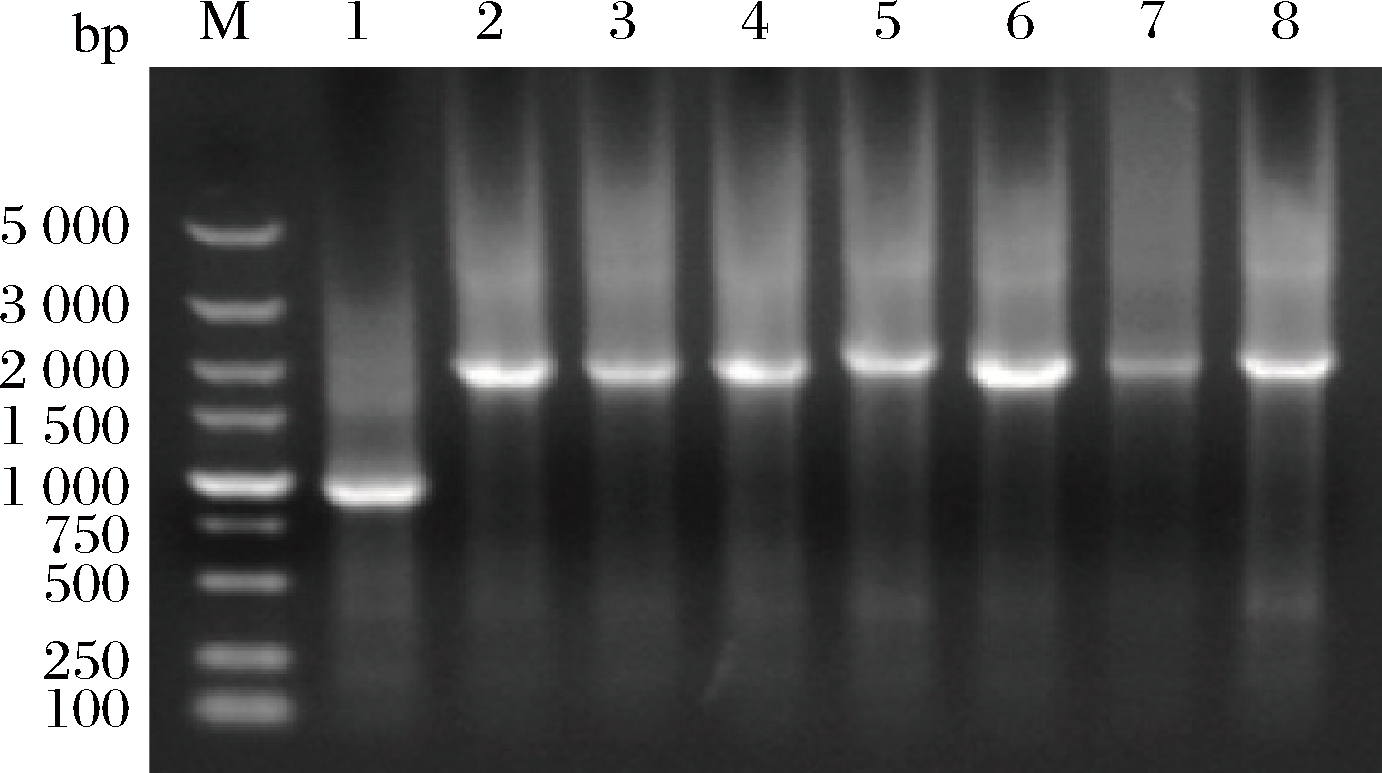
M-marker;1-B.subtilis 168/pMA0911;2-B.subtilis 168/pMA0911-tdh (B.s);3-B.subtilis 168/pMA0911-tdh (B.l);4-B.subtilis 168/pMA0911-tdh (B.a);5-B.subtilis 168/pMA0911-tdh (P.p);6-B.subtilis 168/pMA0911-tdh (E.c);7-B.subtilis 168/pMA0911-tdh (A.c);8-B.subtilis 168/pMA0911-tdh (A.u)(图5同)
图3 基因工程菌株B.subtilis 168/pMA0911-tdh菌液PCR验证
Fig.3 PCR verification of B.subtilis 168/pMA0911-tdh
表5 基因工程菌株菌液PCR产物长度
Table 5 Length of PCR product of gene engineering strain

基因工程菌PCR产物长度/bp基因工程菌PCR产物长度/bpB.subtilis168/pMA0911945B.subtilis168/pMA0911-tdh(E.c)1860B.subtilis168/pMA0911-tdh(B.s)1878B.subtilis168/pMA0911-tdh(A.c)1887B.subtilis168/pMA0911-tdh(B.l)1878B.subtilis168/pMA0911-tdh(A.u)1890B.subtilis168/pMA0911-tdh(B.a)1881B.subtilis168/pMA0911-nox2187B.subtilis168/pMA0911-tdh(P.p)1983B.subtilis168/pMA0911-tdh(E.c)-nox3176
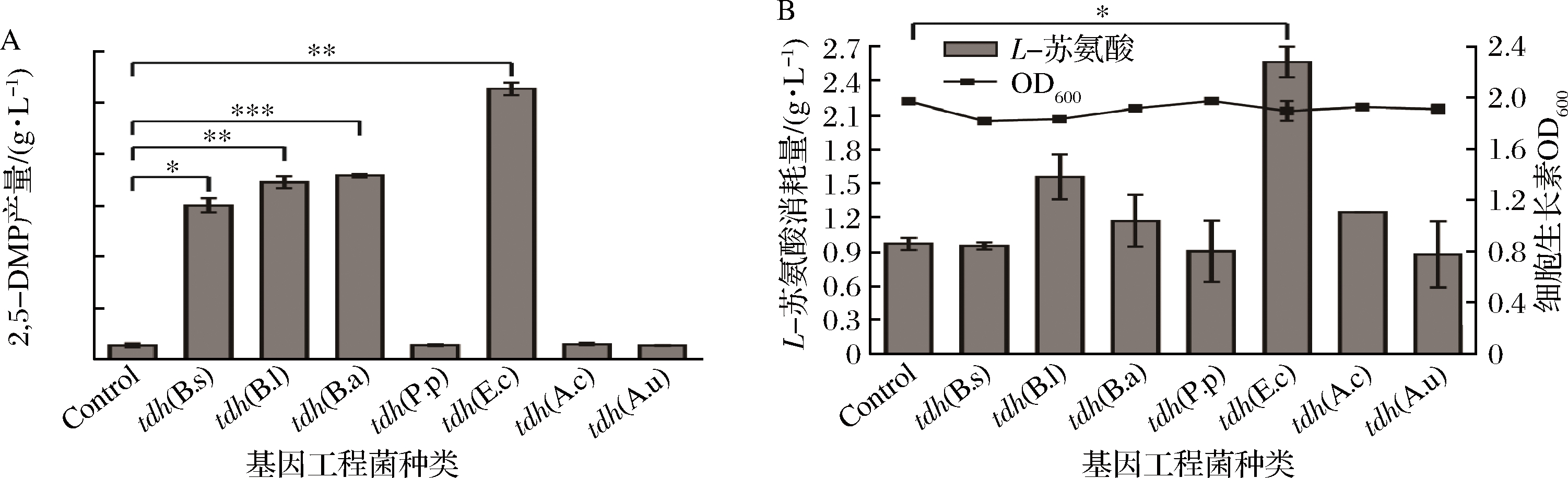
Control-B.subtilis 168/pMA0911;tdh(B.s)-B.subtilis 168/pMA0911-tdh (B.s);tdh (B.l)-B.subtilis 168/pMA0911-tdh (B.l);tdh (B.a)-B.subtilis 168/pMA0911-tdh (B.a);tdh (P.p)-B.subtilis 168/pMA0911-tdh (P.p);tdh (E.c)-B.subtilis 168/pMA0911-tdh (E.c);tdh (A.c)-B.subtilis 168/pMA0911-tdh (A.c);tdh (A.u)-B.subtilis 168/pMA0911-tdh (A.u)
图4 基因工程菌株B.subtilis 168/pMA0911-tdh利用L-苏氨酸生物合成2,5-DMP
Fig.4 B.subtilis 168/pMA0911-tdh utilizes L-threonine to biosynthesize 2,5-DMP
注:***表示差异显著(P≤0.001),**表示差异显著(P≤0.01),*表示差异显著(P≤0.05)(下同)
本研究对各基因工程菌株中TDH的表达情况进行了SDS-PAGE分析。如图5所示,来源于B.subtilis 168、B.licheniformis ATCC 14580、B.amyloliquefaciens DSM7和E.coli K-12的TDH成功表达,该结果与基因工程菌株B.subtilis 168/pMA0911-tdh(B.s)、B.subtilis 168/pMA0911-tdh(B.l)、B.subtilis 168/pMA0911-tdh(B.a)和B.subtilis 168/pMA0911-tdh(E.c)利用L-苏氨酸产2,5-DMP的能力与对照菌株(B.subtilis 168/pMA0911)相比显著提高的实验结果相一致(图4)。然而,如图5所示,基因工程菌株B.subtilis 168/pMA0911-tdh(P.p)、B.subtilis 168/pMA0911-tdh(A.c)和B.subtilis 168/pMA0911-tdh(A.u)的细胞破碎液并未显示明显的TDH目的蛋白条带,与上述菌种利用L-苏氨酸产2,5-DMP的产量与对照菌株相比变化不大的实验结果相一致(图4)。虽进行密码子优化,但菌种P.putida、A.candidus及A.uvarums与宿主B.subtilis亲缘关系相距较远,可能导致目的蛋白TDH表达量较低甚至没有表达。
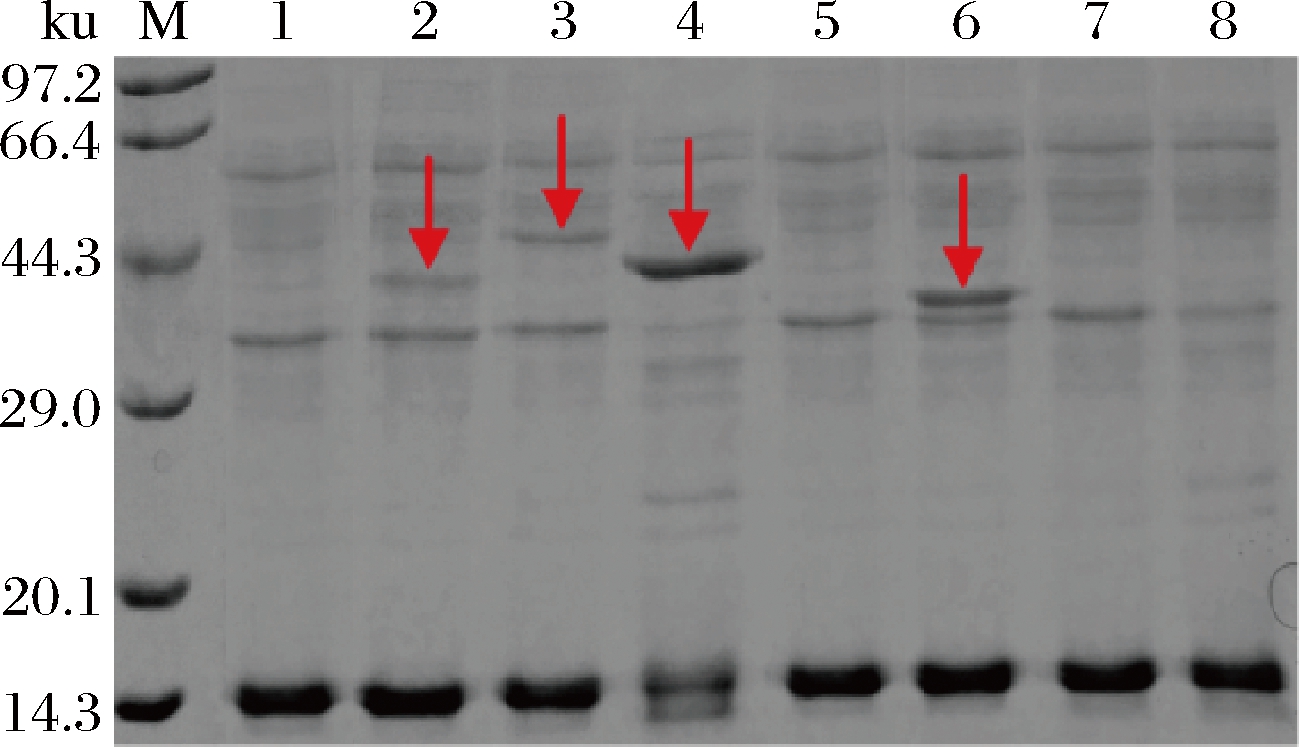
图5 基因工程菌株中TDH的SDS-PAGE分析图谱
Fig.5 SDS-PAGE analysis of TDH in genetically engineered strains
本研究的目的是获得1株可以利用L-苏氨酸高产2,5-DMP的基因工程菌株,因此,基于图4所示结果,本研究选择B.subtilis 168/pMA0911-tdh(E.c)作为后续菌株构建的基础菌种。
2.3 TDH与NOX共表达载体的构建
由图1所示,TDH为2,5-DMP合成过程中的唯一关键酶,其催化L-苏氨酸与NAD+生成2-氨基乙酰乙酸及NADH。因此,在2,5-DMP合成过程中,辅酶NAD+的含量可能是制约2,5-DMP产量的重要因素(图1)。虽然细胞在正常情况下可以实现自身还原力平衡,但在本研究中,由于TDH的过量表达,可能会使得NAD+过度消耗而难以实现快速再生,影响TDH的催化效率。因此,本研究计划外源表达NADH氧化酶NOX,后者可以催化NADH生成NAD+和水,以实现NAD+的快速再生[26]。
因B.subtilis外源表达质粒选择有限,因此本研究决定将NOX编码基因nox与TDH编码基因tdh在同一质粒转录表达。首先通过全基因合成获取携带NOX转录基因nox的质粒pMA0911-nox (图2-B),并以此为模板,扩增出携带质粒pMA0911同源臂的目的基因nox (图6-A),将基因nox构建到酶切质粒pMA0911-tdh(E.c) (图6-A),重组质粒pMA0911-tdh(E.c)-nox示意图如图6-B所示。将构建好的重组质粒转入E.coli DH5 α感受态中进行克隆,对重组质粒进行酶切验证,结果如图6-C所示,各酶切片段长度与表4中一致。为了进一步确定基因序列的正确性,将酶切结果正确的重组质粒进行测序,经过比对进一步确定了序列一致且读码框正确。以上结果说明,双基因共转录质粒pMA0911-tdh(E.c)-nox构建成功。

A-质粒pMA0911-tdh(E.c)的酶切与目的基因nox的PCR扩增;M-marker;1-pMA0911-tdh(E.c);2-nox;B-重组质粒pMA0911-tdh(E.c)-nox示意图;C-重组质粒pMA0911-nox和pMA0911-tdh (E.c)-nox的酶切验证;M-marker;1-pMA0911-nox;2-pMA0911-tdh (E.c)-nox
图6 TDH和NOX共表达质粒pMA0911-tdh(E.c)-nox的构建与酶切验证
Fig.6 Construction and digestion verification of pMA0911-tdh(E.c)-nox for co-expression of TDH and NOX
2.4 TDH与NOX共表达菌株的构建及发酵验证
将重组质粒pMA0911-nox和pMA0911-tdh(E.c)-nox分别转入B.subtilis 168感受态中,对阳性转化子进行菌液PCR验证,所用验证引物为pMA0911-F/R (表3),结果如图7所示,各菌株的菌液PCR产物长度如表5所示,经比对可以确定NOX表达菌株和TDH与NOX共表达菌株构建成功。
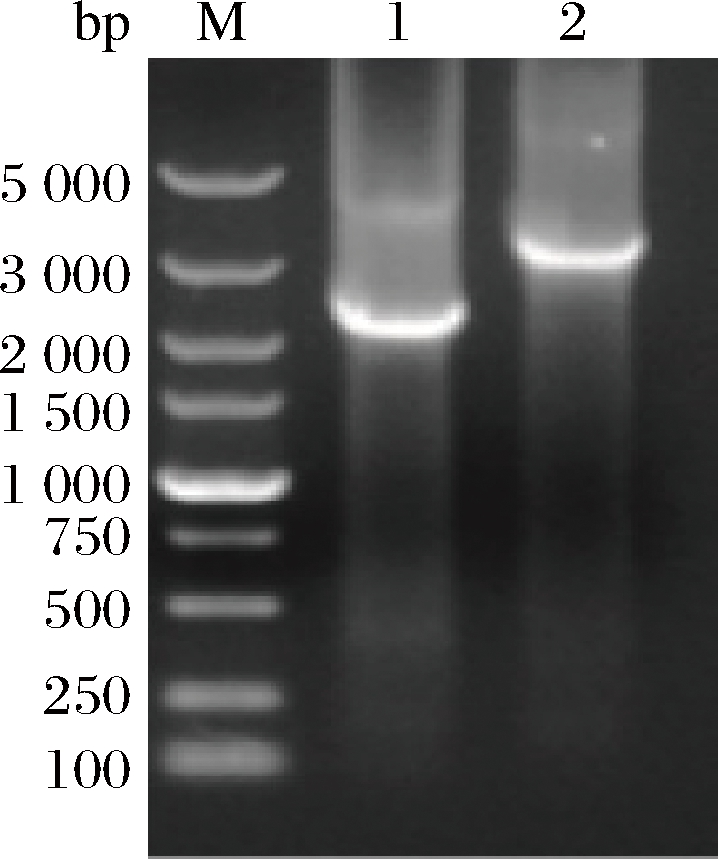
M-marker;1-B.subtilis 168/pMA0911-nox;2-B.subtilis 168/pMA0911-tdh (E.c)-nox
图7 基因工程菌株B.subtilis 168/pMA0911-nox和B.subtilis 168/pMA0911-tdh(E.c)-nox菌液PCR验证
Fig.7 PCR verification of B.subtilis 168/pMA0911-nox and B.subtilis 168/pMA0911-tdh(E.c)-nox
对构建成功的基因工程菌株进行发酵验证,在含有苏氨酸终质量浓度为5.83 g/L的L-苏氨酸的LBT液体培养基中发酵24 h,对细胞生长量(OD600)、生成的2,5-DMP以及消耗的L-苏氨酸进行测定,结果如图8所示。

tdh(E.c)-B.subtilis 168/pMA0911-tdh(E.c);nox-B.subtilis 168/pMA0911-nox;tdh(E.c)-nox-B.subtilis 168/pMA0911-tdh(E.c)-nox
图8 基因工程菌株B.subtilis 168/pMA0911-nox和B.subtilis 168/pMA0911-tdh(E.c)-nox利用L-苏氨酸生物合成2,5-DMP
Fig.8 B.subtilis 168/pMA0911-nox and B.subtilis168/pMA0911-tdh(E.c)-nox utilize L-threonine to biosynthesize 2,5-DMP
从图8可以看出,虽然菌株B.subtilis 168/pMA0911-tdh(E.c)-nox的细胞生长量略低于菌株B.subtilis 168/pMA0911-tdh(E.c)(图8-B),但对于2,5-DMP的积累量却高于菌株B.subtilis 168/pMA0911-tdh(E.c),且具有显著性差异(图8-A),而2菌株对于L-苏氨酸的消耗量并不具有显著性差异(图8-B)。因此,NOX的存在对于过表达的TDH催化L-苏氨酸最终生成2,5-DMP有促进作用。菌株B.subtilis 168/pMA0911-tdh(E.c)-nox利用5.83 g/L的L-苏氨酸发酵24 h,最终2,5-DMP的产量可达616.04 mg/L,与对照菌株B.subtilis 168/pMA0911相比(图4-A),产量提高了22.5倍,与基因工程菌株B.subtilis 168/pMA0911-tdh(E.c)相比,产量增加了88.61 mg/L。有文献报道,B.subtilis利用40 g/L的L-苏氨酸发酵15 d,最终积累2,5-DMP的量为560 mg/L[27],与之相比,本研究构建得到的基因工程菌B.subtilis 168/pMA0911-tdh(E.c)-nox利用L-苏氨酸生物转化为2,5-DMP的效率大大提高。
对基因工程菌株B.subtilis 168/pMA0911-nox中NOX的表达情况和B.subtilis 168/pMA0911-tdh(E.c)-nox中TDH和NOX共表达情况进行SDS-PAGE分析,如图9所示。
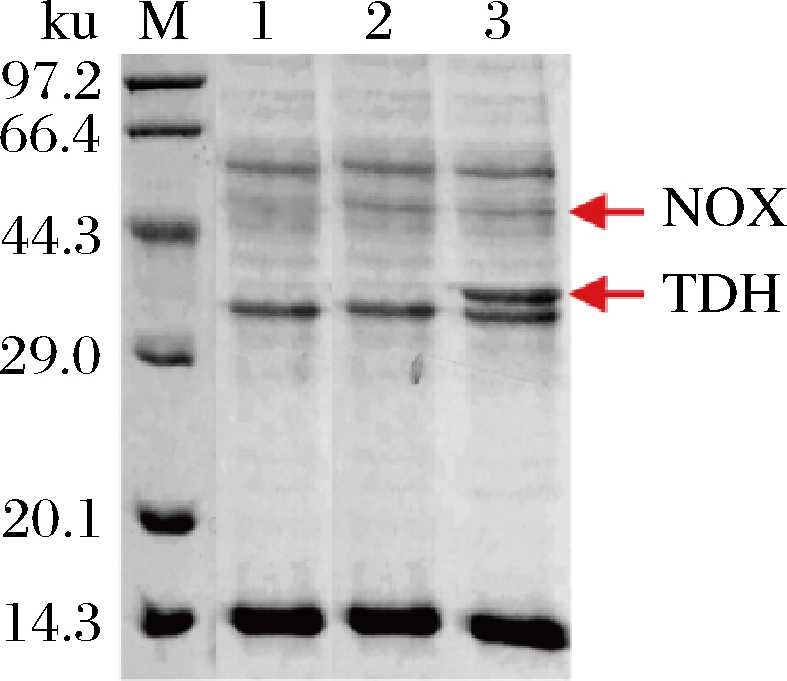
M-marker;1-B.subtilis 168/pMA0911;2-B.subtilis 168/pMA0911-nox;3-B.subtilis 168/pMA0911-tdh(E.c)-nox
图9 基因工程菌株B.subtilis 168/pMA0911-nox和B.subtilis 168/pMA0911-tdh(E.c)-nox中蛋白表达SDS-PAGE分析图谱
Fig.9 SDS-PAGE analysis of protein in B.subtilis168/pMA0911-nox and B.subtilis 168/pMA0911-tdh(E.c)-nox
基因工程菌株B.subtilis 168/pMA0911-nox的破碎液中显示出NOX外源表达目的条带。基因工程菌株B.subtilis 168/pMA0911-tdh(E.c)-nox的细胞破碎液中,均显示出TDH及NOX外源表达目的条带,表明该菌株中TDH及NOX均表达,与基因工程菌株B.subtilis 168/pMA0911-tdh(E.c)-nox具有更高的2,5-DMP产量结果相一致(图8)。
基因工程菌株B.subtilis 168/pMA0911-nox利用L-苏氨酸产2,5-DMP的能力远低于B.subtilis 168/pMA0911-tdh(E.c)-nox (图8-A),分析其原因,在TDH表达水平不高的情况下,细胞自身的还原力水平足以维持菌株自身的TDH催化所需要的还原力,也就是说,即使还原力水平提高,但是在催化过程中真正需要的还原力水平并没有提高,因此,该菌株B.subtilis 168/pMA0911-nox对于2,5-DMP的积累量接近于对照菌株B.subtilis 168/pMA0911 (图4-A)。
3 结论与讨论
来源于E.coli K-12的TDH在B.subtilis 168中可以过表达,并且该蛋白的过表达更有利于B.subtilis 168利用L-苏氨酸合成2,5-DMP。在TDH过表达的基础上,NOX的参与可以促进NAD+的快速再生,从而有助于促进2,5-DMP产量的提高。本研究成功构建得到1株可以利用L-苏氨酸高产2,5-DMP的基因工程菌株B.subtilis 168/pMA0911-tdh(E.c)-nox,该菌株可以在添加5.83 g/L的L-苏氨酸的LBT液态培养基中发酵24 h,便可积累616.04 mg/L 2,5-DMP,与对照菌株B.subtilis 168/pMA0911相比,产量提高了22.5倍。与此前报道的B.subtilis利用40 g/L的L-苏氨酸发酵15 d,最终积累560 mg/L 2,5-DMP[27]相比较,该基因工程菌株利用L-苏氨酸生物转化为2,5-DMP的效率大大提高。该研究对于工业上实现2,5-DMP的生物合成具有重要意义。
与野生菌株相比,虽然构建的基因工程菌株利用L-苏氨酸生物转化为2,5-DMP的效率大大提高,但其转化率仍仅有23.3%。在L-苏氨酸的微生物代谢中,有3条重要的途径,分别起始于3种关键酶:TDH、L-苏氨酸醛缩酶及L-苏氨酸脱水酶(L-苏氨酸脱氨酶)[28-29],即L-苏氨酸在菌株中的代谢流向不止TDH所在的一条途径。另外,2-氨基-3-酮丁酸CoA连接酶可以催化2-氨基乙酰乙酸(TDH催化L-苏氨酸形成的产物,图1)进入甘氨酸代谢途径[30],从而使得流向2,5-DMP的生成方向受阻。因此,本研究构建的基因工程菌株利用L-苏氨酸生产2,5-DMP的转化率仍不高。为了进一步提高转化率,后续可以通过无痕基因敲除手段切断L-苏氨酸其他的代谢途径,使得L-苏氨酸尽可能多地流向2,5-DMP的生成方向。
[1] FAN Wenlai,QIAN M C.Headspace solid phase microextraction and gas chromatography-olfactometry dilution analysis of young and aged Chinese “Yanghe Daqu” liquors[J].Journal of Agricultural and Food Chemistry,2005,53(20):7 931-7 938.
[2] FAN Wenlai,QIAN M C.Characterization of aroma compounds of Chinese “Wuliangye” and “Jiannanchun” liquors by aroma extraction dilution analysis[J].Journal of Agricultural and Food Chemistry,2006,54:2 695-2 704.
[3] FAN Wenlai,XU Yan,ZHANG Yanhong.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].Journal of Agricultural and Food Chemistry,2007,55(24):9 956-9 962.
[4] DAJANTA K,APICHARTSRANGKOON A,CHUKEATIROTE E.Volatile profiles of thua nao,a Thai fermented soy product[J].Food Chemistry,2011,125(2):464-470.
[5] YOON K H,CHANG Y I,LEE G H.Characteristic aroma compounds of cooked and fermented soybean (Chungkook-Jang) inoculated with various Bacilli[J].Journal of the Science of Food and Agriculture,2012,93(1):85-92.
[6] FENG Yunzi,SU Guowan,ZHAO Haifeng,et al.Characterisation of aroma profiles of commercial soy sauce by odour activity value and omission test[J].Food Chemistry,2015,167:220-228.
[7] LIMA L J,ALMEIDA M H,NOUT M J,et al.Theobroma cacao L.,"The food of the Gods":quality determinants of commercial cocoa beans,with particular reference to the impact of fermentation[J].Critical Reviews in Food Science and Nutrition,2011,51(8):731-761.
[8] VAN DURME J,INGELS I,DE WINNE A.Inline roasting hyphenated with gas chromatography-mass spectrometry as an innovative approach for assessment of cocoa fermentation quality and aroma formation potential[J].Food Chemistry,2016,205:66-72.
[9] ERNY C,GROSCH W.Quantification of character-impact odour compounds of roasted beef[J].Zeitschrift für Lebensmittel-Untersuchung Und- Forschung,1993,196(5):417-422.
[10] WU Shimin,XU Ting,AKOH C C.Effect of roasting on the volatile constituents of Trichosanthes kirilowii seeds[J].Journal of Food and Drug Analysis,2014,22(3):310-317.
[11] SMITH A L,BARRINGER S A.Color and volatile analysis of peanuts roasted using oven and microwave technologies[J].Journal of Food Science,2014,79(10):C1 895-C1 906.
[12] MASUDA H,MIHARA S.Olfactive properties of alkylpyrazines and 3-substituted 2-alkylpyrazines[J].Journal of Agricultural and Food Chemistry,1988,36(3):584-587.
[13] GUO Xiangyang,SONG Chuankui,HO C T,et al.Contribution of L-theanine to the formation of 2,5-dimethylpyrazine,a key roasted peanutty flavor in Oolong tea during manufacturing processes[J].Food Chemistry,2018,263:18-28.
[14] MULLER R,RAPPERT S.Pyrazines:occurrence,formation and biodegradation[J].Applied Microbiology and Biotechnology,2009,85(5):1 315-1 320.
[15] SCHMID A,DORDICK J S,HAUER B,et al.Industrial biocatalysis today and tomorrow[J].Nature,2001,409(6 817):258-268.
[16] LEE J H,SUNG B,KIM M S,et al.Metabolic engineering of a reduced-genome strain of Escherichia coli for L-threonine production[J].Microbial Cell Factories,2009,8(1):2.
[17] BECKER J,WITTMANN C.Systems and synthetic metabolic engineering for amino acid production-the heartbeat of industrial strain development[J].Current Opinion in Biotechnology,2012,23(5):718-726.
[18] ZHAO Hui,FANG Yu,WANG Xiao-yuan,et al.Increasing l-threonine production in Escherichia coli by engineering the glyoxylate shunt and the l-threonine biosynthesis pathway[J].Applied Microbiology and Biotechnology,2018,102(13):5 505-5 518.
[19] CARROLL A L,DESAI S H,ATSUMI S.Microbial production of scent and flavor compounds[J].Current Opinion in Biotechnology,2016,37:8-15.
[20] DONG Huina,ZHANG Dawei.Current development in genetic engineering strategies of Bacillus species[J].Microbial Cell Factories,2014,13(1):63.
[21] LIU Long,LIU Yanfeng,SHIN Hyun-dong,et al.Developing Bacillus spp.as a cell factory for production of microbial enzymes and industrially important biochemicals in the context of systems and synthetic biology[J].Applied Microbiology and Biotechnology,2013,97(14):6 113-6 127.
[22] GRYCZAN T J,CONTENTE S,DUBNAU D.Characterization of Staphylococcus aureus plasmids introduced by transformation into Bacillus subtilis[J].Journal of Bacteriology,1978,134(1):318-329.
[23] VANDAMME E J,SOETAERT W.Bioflavours and fragrances via fermentation and biocatalysis[J].Journal of Chemical Technology and Biotechnology,2002,77(12):1 323-1 332.
[24] 郅岩.芽孢杆菌高效合成表面活性素的代谢机制及功能研究[D].无锡:江南大学,2017.
[25] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[26] GEUEKE B,RIEBEL B,HUMMEL W.NADH oxidase from Lactobacillus brevis:a new catalyst for the regeneration of NAD[J].Enzyme and Microbial Technology,2003,32(2):205-211.
[27] LARROCHE C,BESSON I,GROS J B.High pyrazine production by Bacillus subtilis in solid substrate fermentation on ground soybeans[J].Process Biochemistry,1999,34(6-7):667-674.
[28] ALLER K,ADAMBERG K,REILE I,et al.Excess of threonine compared with serine promotes threonine aldolase activity in Lactococcus lactis IL1403[J].Microbiology,2015,161:1 073-1 080.
[29] ADJOGATSE E,ERSKINE P,WELLS S A,et al.Structure and function of l-threonine-3-dehydrogenase from the parasitic protozoan Trypanosoma brucei revealed by X-ray crystallography and geometric simulations[J].Acta Crystallographica Section D Structural Biology,2018,74(9):861-876.
[30] MARCUS J P,DEKKER E E.Threonine formation via the coupled activity of 2-amino-3-ketobutyrate coenzyme A lyase and threonine dehydrogenase [J].Journal of Bacteriology,1993,175(20):6 505-6 511.