甜瓜(Cucumis melo)是重要的葫芦科经济作物,新疆甜瓜品质好、含糖量高、风味优良,深受消费者喜爱。甜瓜采收多集中于高温的夏季,此时,果实不易长期贮藏与异地销售,这严重影响了甜瓜产业的经济效益,甜瓜采后贮藏保鲜的问题已成为制约甜瓜产业发展的重要瓶颈。
大多数甜瓜属于呼吸跃变型水果,具有明显的呼吸和乙烯释放高峰,果实发生后熟即软化加速并容易腐烂[1]。果实后熟软化过程中,与果实品质相关的质地、色泽、糖酸组分、香气及风味物质等评价指标也在发生变化[2-3]。糖类是果实的重要构成物质,并且糖代谢与果实的后熟软化存在显著的相关性[4-5],在果实后熟软化过程中,淀粉酶与蔗糖磷酸酶(sucrose phosphate synthase,SPS)对淀粉与可溶性糖之间的转化起重要作用,使果实中淀粉与可溶性糖含量处于动态变化的平衡中[6-7]。淀粉对果实细胞结构起重要的支撑作用,是维持果实硬度的重要物质[8],果实后熟软化过程中淀粉不断被水解,对果实细胞的支撑作用不断减弱,果实的硬度也随之下降[9]。
低温贮藏能够有效延缓果实后熟软化,在低温下,大量参与果实后熟生理代谢的酶活性、代谢中间物以及相关基因的表达均受到抑制,从而降低了果实中糖类及其他营养物质的消耗。乙烯是影响果实后熟生理过程至关重要的物质,乙烯对果实的糖代谢也存在显著的相关性[10]。1-甲基环丙烯(1-methylcyclopropene,1-MCP)是常用的乙烯抑制剂,能够竞争性地抑制乙烯后熟作用[11-12]。目前,对甜瓜果实后熟软化与糖代谢及相关酶基因表达关系的研究鲜有报道。因此,本研究以甜瓜为研究对象,将甜瓜果实在常温、1-MCP处理和低温下贮藏,研究甜瓜果实后熟软化过程中,淀粉、可溶性糖、关键酶活性及其基因表达的变化,探讨糖代谢对甜瓜果实后熟软化的影响,为改进与优化甜瓜贮藏保鲜技术提供参考依据。
1 材料与方法
1.1 材料与试剂
甜瓜品种‘西州蜜17号’采自新疆石河子下野地,选取达到商品成熟度、重量、大小、无外伤、果型均匀的果实。1-甲基环丙烯,青岛绿诺生物科技有限公司;DP 441 RNA提取试剂盒、KR 113反转录酶、KR 202 cDNA合成试剂盒、FP 209荧光定量检测试剂盒,天根生化科技(北京)有限公司。
1.2 仪器与设备
AGY-1果实硬度测量计,温州艾力仪器制造有限公司;3051H呼吸强度测定仪,杭州绿博仪器有限公司;Trace GC 1300气相色谱仪、ABI 7500荧光定量PCR仪,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 甜瓜果实处理
对照组为直接贮藏于(20±1) ℃常温下的果实;1-MCP处理:将甜瓜果实用1 μL/L的1-MCP在20 ℃下熏蒸24 h后通风[13],并于(20±1)℃下贮藏。冷藏处理:将果实置于(6±1)℃下预冷去除田间热后在(2±0.5)℃下贮藏。每2 d对果实进行硬度、呼吸速率、乙烯释放量、淀粉与可溶性糖代谢酶和基因表达等指标进行测定。
1.3.2 果实硬度和呼吸速率的测定
参照CAMPS等[14]与李明霞等[15]的方法,在果实纵切面,均匀选取4个点,测定果肉硬度,单位kg/cm2。
1.3.3 呼吸速率与乙烯释放量的测定
呼吸速率:用气流法测定,设定呼吸强度测定仪气流速度为0.4 L/min,单位CO2 mg/(kg·h)。
乙烯释放量的测定:参照李江阔等[13]的方法,用气相色谱仪测定,结果用μL/(kg·h)表示。
以上检测每次取9个果实,分3组,每组3个果实,每组重复测3次。
1.3.4 果实可溶性糖和淀粉含量测定
参照谢季云等[16]的方法,略加修改,称取2.0 g鲜样果肉,研磨,加80%(体积分数)乙醇80 ℃水浴20 min,离心,集中上清液,重复3次,蒸去乙醇,加2 mL水溶解残留物,微孔滤膜(0.25 μm)过滤,用液相色谱仪测定可溶性糖(蔗糖、葡萄糖和果糖)含量。将上述提取可溶性糖的残余物用高氯酸提取,用蒽酮比色法测定生成的葡萄糖含量,根据葡萄糖标准曲线计算淀粉含量,重复3次。
1.3.5 蔗糖代谢酶和淀粉酶活性测定
酶液提取和活性测定参照MERLO等[17]和ITAI等[18]的方法略加修改,称取1.5 g鲜样果肉,用液氮冷冻后研磨,加入6 mL提取液(50 mmol/L HEPES-NaOH,pH 7.5,10 mmol/L MgCl2,1 mmol/L EDTA,2.5 mmol/L DTT,0.05% Tritonx-100和0.1% BSA),匀浆后过滤,于4 ℃,12 000 r/min离心10 min,上清液于4 ℃下稀释10倍后透析12 h,透析酶液用于酶活性测定。酶活性以OD520值表示。以失活酶液做空白对照,重复3次。
1.3.6 糖代谢关键酶基因的Real-time荧光定量PCR分析
总RNA提取:利用RNA提取试剂盒提取果实总RNA,以总RNA为模板合成cDNA,Actin为内参基因,进行实时荧光定量PCR分析。
表1 实时定量PCR所需引物
Table 1 Primers for qRT-PCR analysis

基因名称引物序列SPSF5’-AACTCAGCAATGGAATGTCA-3′R5’-GAGTGTGTATTGTAGCGTCA-3′SSF5’-GTCTCAACGTCGGTTCTCCG-3′R5’-AATGCACTCGTCTCACATGT-3AMF5’-ACTGCAAAGTTCATTCCACTG-3′R5’-CTGCACTCGTCATCACATGG-3′AIF5’-ATGGGTTCCATCCCATTTCC-3′R5’-GATGCACTCGTTCCTCACTT-3′ActinF5’-TTCTGGTGATGGTGTGAGTC-3′R5’-GGCAGTGGTGGTGAACATG-3′
1.4 数据统计分析
用Excel软件进行绘图,用SPSS 17.0进行统计分析,以P<0.05作为差异显著的标准。
2 结果与分析
2.1 果实硬度的变化
如图1所示,在20 ℃下,对照组甜瓜果实贮藏8 d后硬度迅速下降;1-MCP处理组果实在12~14 d硬度下降速度略快,与对照组相比,1-MCP处理组果实的后熟软化进程较对照组有所推迟(P<0.05);2 ℃下冷藏的甜瓜果实硬度下降最为缓慢,贮藏至第18天,果实硬度仅下降了2.7 kg/cm2。
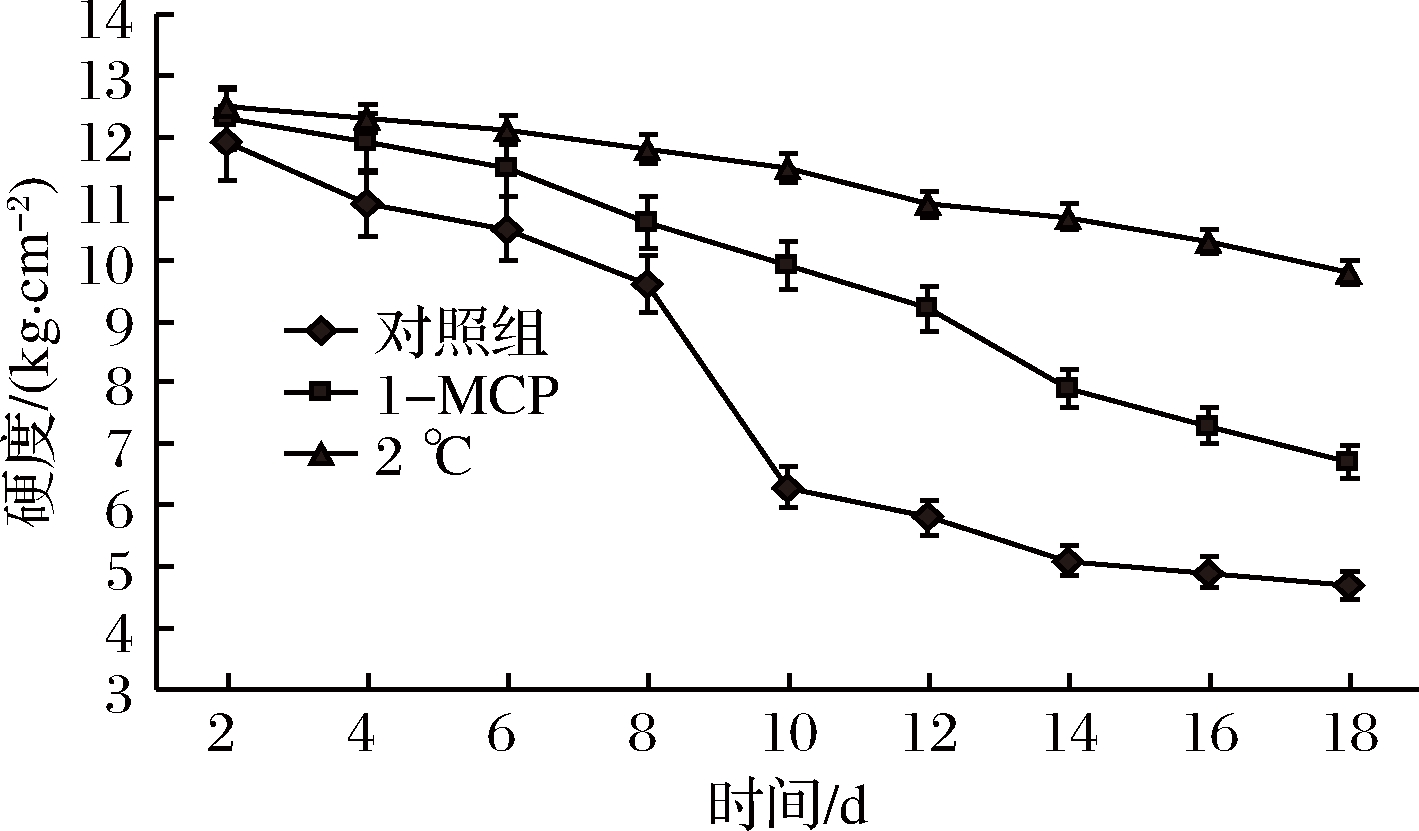
图1 贮藏过程中甜瓜果实硬度的变化
Fig.1 Changes of melon fruit firmness during storage
2.2 甜瓜果实呼吸强度与乙烯释放量的变化
呼吸强度是植物体新陈代谢的重要指标,与果实的成熟衰老密切相关。由图2-a可知,20 ℃下果实呼吸速率迅速升高,第6天出现呼吸跃变峰;1-MCP处理呼吸跃发生在第12天,跃变峰值也显著降低;2 ℃冷藏的果实则未出现呼吸跃变现象。乙烯具有促进果实成熟的作用,能够加剧果实的后熟和衰老。如图2-b所示,对照组与1-MCP处理组的乙烯释放量均呈现先升高后降低的趋势,对照组在第6天释放量出现高峰,1-MCP处理组则推迟至第12天,且峰值较小。在2 ℃下冷藏的果实乙烯释放量未出现显著变化。结合图2-a、b,可以看出,果实的呼吸强度与乙烯释放量的变化存在密切的相关性与同步性。
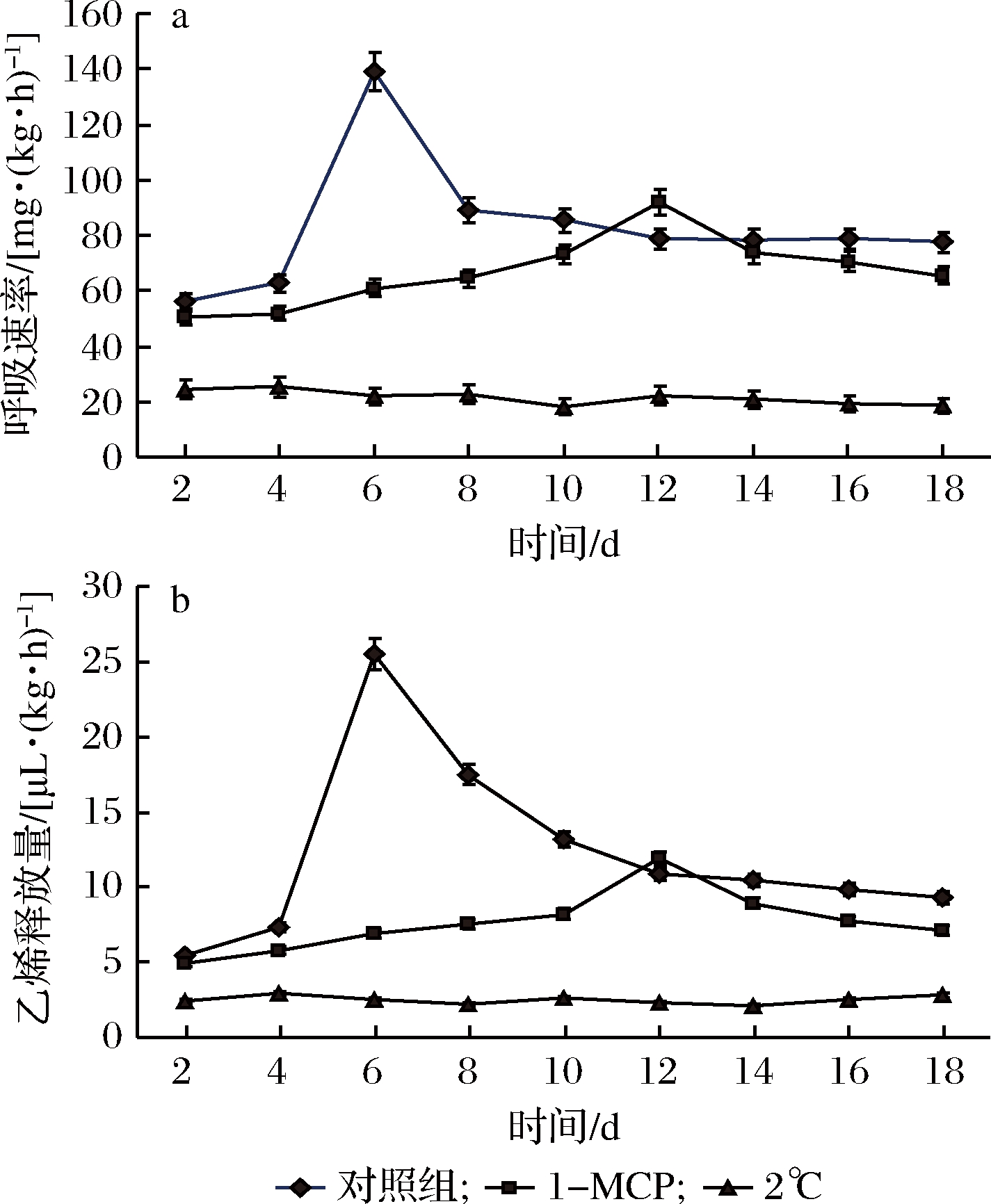
a-呼吸速率;b-乙烯释放量
图2 贮藏过程中甜瓜果实呼吸速率和乙烯释放量的变化
Fig.2 Changes of respiration rate and ethylene production of melon fruit during storage
2.3 果实淀粉和可溶性糖含量的变化
由图3-a可知,在对照组中,甜瓜果实中的淀粉快速降解,淀粉含量下降较快;1-MCP处理能够延缓淀粉降解,但长期贮藏后,淀粉含量下降幅度仍然较大;在2 ℃下,果实内淀粉降解被显著抑制,淀粉下降缓慢,结合图1分析可知,果实淀粉含量的下降与果实硬度的下降存在相同的变化趋势。由图3-b、c、d所示,对照组果实中可溶性糖(蔗糖、果糖和葡萄糖)含量在贮藏初期有小幅增加,并在第6天达到最大值后开始下降,在1-MCP处理组果实的可溶性糖含量的变化幅度较对照组小,在贮藏后期呈下降趋势,其中,葡萄糖含量下降的幅度较蔗糖与果糖大。而在2 ℃下,果实中可溶性糖的含量变化最小(P<0.05),并能够长期保持平稳。
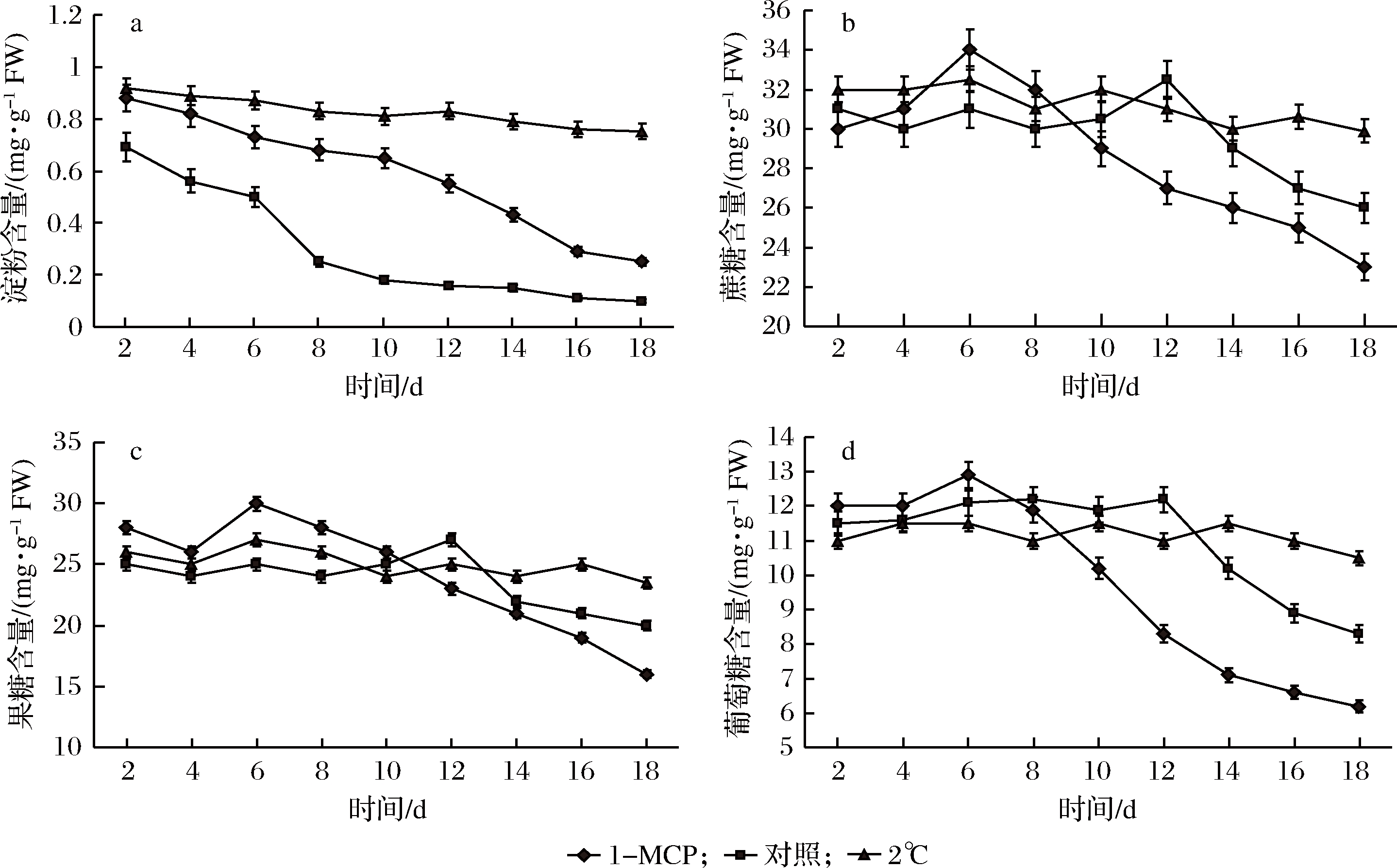
a-淀粉含量;b-蔗糖含量;c-果糖含量;d-葡萄糖含量
图3 贮藏过程中甜瓜果实中淀粉与可溶性糖含量的变化
Fig.3 Changes of the starch soluble sugar content of melon fruit during storage
2.4 蔗糖磷酸合成酶、蔗糖合成酶(sucrosesynthase,SS)活性变化及其基因表达
从图4-a、b可知,对照组与1-MCP处理组,甜瓜果实SPS活性及其基因表达均先升后降,1-MCP处理较对照组变化有所延迟,且变化量较小(P<0.05);与对照组和1-MCP处理相比较,果实在2 ℃低温下,SPS活性和SPS表达受到强烈抑制,酶活性与酶基因表达均处于较低水平(P<0.05),这与蔗糖和果糖含量变化规律相一致(图3-b、c、d)。

a-蔗糖磷酸合成酶活性;b-SPS基因表达量
图4 贮藏过程中甜瓜果实SPS活性及其基因表达的变化
Fig.4 Changes of SPS activity and the gene expression of melon fruit during storage
图5-a、b表明,对照组中,甜瓜果实中SS活性不断增强,SS基因表达则呈现先升高后缓慢下降的趋势,说明基因表达小幅下降仍能维持酶的高活性。与对照组相比,1-MCP处理组中果实SS酶活性与SS的表达量均有所降低(P<0.05),并且SS酶活性与SS基因表达的变化趋势一致;与对照组和1-MCP处理组相比,在2 ℃下的果实中SS酶活性有所下降,并维持在低水平,SS的表达也受到显著抑制(P<0.05)。

a-蔗糖合成酶活性;b-SS基因表达量
图5 贮藏过程中甜瓜果实SS活性及其基因表达的变化
Fig.5 Changes of SS activity and the gene expression of melon fruit during storage
2.5 淀粉酶活性变化及其基因表达
由图6-a、b结合图1分析可知,对照组中,随着甜瓜果实的后熟软化,淀粉酶活性显著升高,AM的表达量亦迅速增加。与对照组相比,1-MCP处理组果实的AM活性与AM基因表达受到一定程度的抑制,并有所降低(P<0.05),但后期AM活性又有增加趋势;3个组中,2 ℃下,果实AM活性与AM的表达所受抑制最为强烈,且始终稳定在低水平。
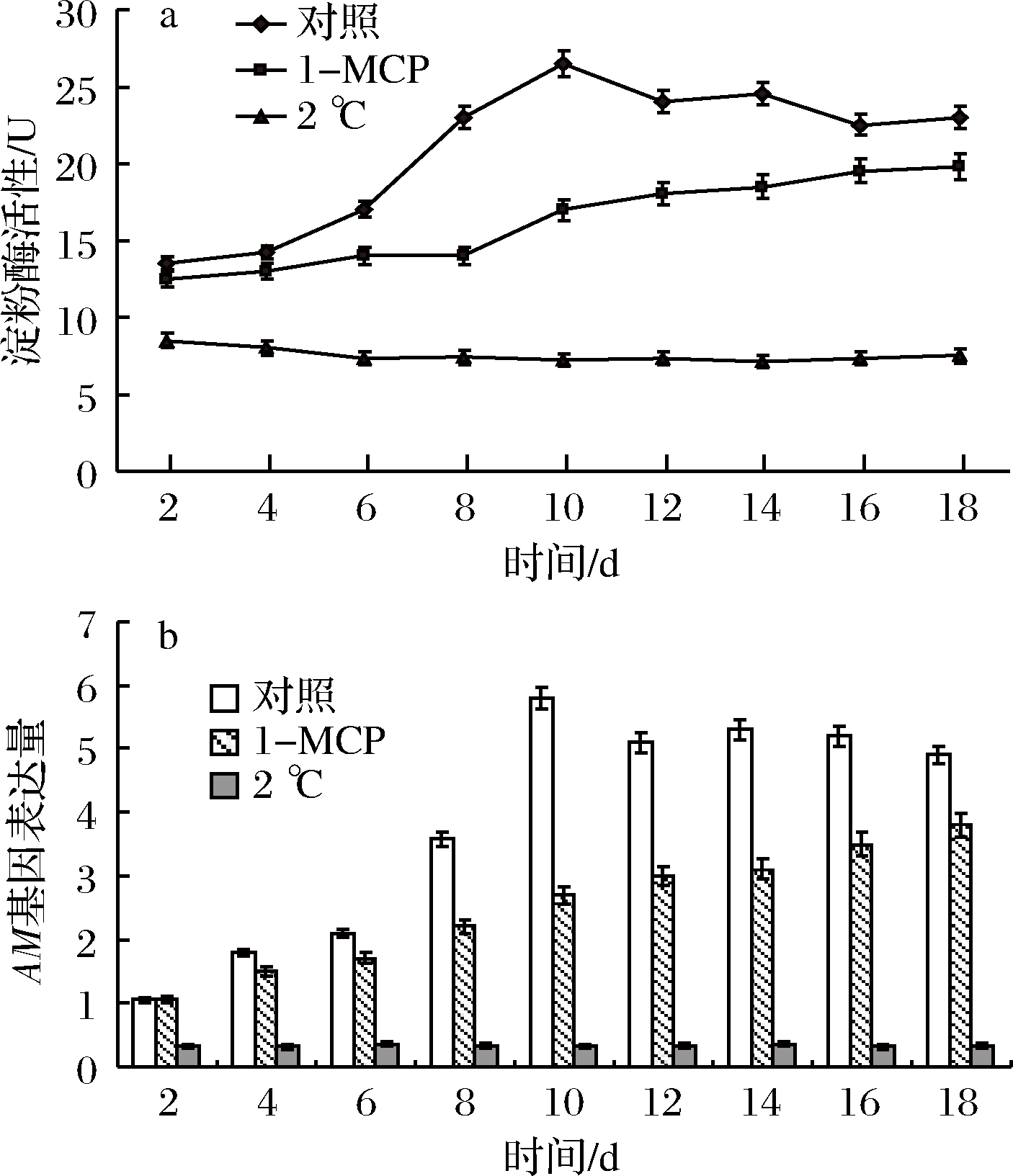
a-淀粉酶活性;b-AM基因表达量
图6 贮藏过程中甜瓜果实淀粉酶活性及其基因表达的变化
Fig.6 Changes of AM activity and the gene expression of melon fruit during storage
2.6 酸性转化酶(acid invertase,AI)活性变化及其基因表达
由图7-a、b结果分析可知,与AM变化相似,对照组中果实酸性转化酶活性随着果实软化迅速上升,并且发生呼吸跃变后呈加速上升趋势,其基因表达也出现相似的规律;1-MCP处理使酶活性与基因表达的增加速度较常温处理有所降低(P<0.05),但同样呈不断上升的趋势;同样,与对照组和1-MCP处理相比,在2 ℃下,果实AI活性与AI基因表达受到强烈抑制,并显著降低(P<0.05)。
3 讨论
果实的后熟与软化是一系列复杂生理生化反应作用的结果,糖类物质是果实的重要内含物质,糖代谢在这一过程中起重要作用[19-20]。
淀粉酶具有启动果实软化的作用,是果实软化的关键酶[21]。研究表明,磨盘柿果实软化主要由淀粉含量下降所致,柿果实在软化前发生呼吸跃变,淀粉在淀粉酶的作用下产生的糖能够为呼吸跃变提供所需的能源物质[22]。此外,在苹果[23]、桃[24]、猕猴桃[25]、香蕉[26]和菠萝蜜[27]等果实软化过程中,均存在淀粉酶活性升高,淀粉大量降解,淀粉含量迅速下降的现象。本研究发现,甜瓜果实软化过程中,淀粉酶活性与AM表达量增加最为显著,在此过程中,淀粉含量迅速降低,果实硬度也快速下降,这表明淀粉降解是造成甜瓜果实软化的重要原因。
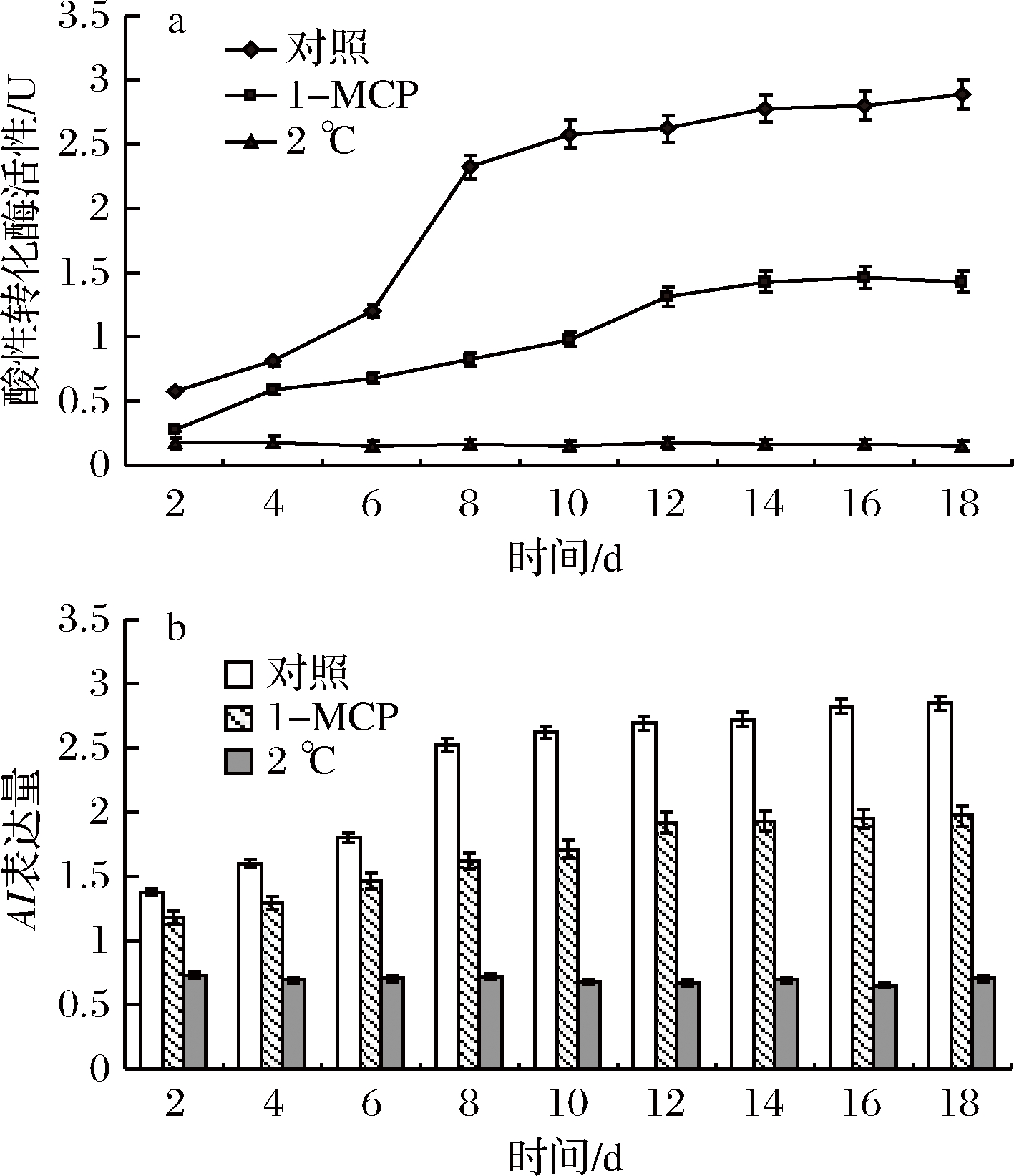
a-酸性转化酶活性;b-AI基因表达量
图7 贮藏过程中甜瓜果实酸性转化酶活性及其基因表达的变化
Fig.7 Changes of AI activity and the gene expression of melon fruit during storage
在果实的软化过程中,蔗糖含量也会发生显著的变化,在香蕉、荔枝和猕猴桃果实的软化阶段,SPS活性显著增加,蔗糖含量也快速上升,在果实软化的后期,SPS活性开始降低,蔗糖含量也随之下降[28-29]。
SPS和SS活性与甜瓜果实硬度的变化存在不同步性,SPS和SS酶活性与酶基因表达量变化趋势一致,但酶活性与酶基因表达的增加要先于果实硬度的下降,这说明果实软化是糖代谢积累到一定程度所产生的结果。此外,SPS和SS活性与酶基因表达均受1-MCP和低温抑制,其变化分别与蔗糖和果糖含量变化趋势一致。糖类物质多处于果实许多代谢的上游,为果实这些生理代谢提供底物和能量等[30]。本研究发现,对照组甜瓜果实中葡萄糖含量在贮藏初期存在短暂的上升,这可能是葡萄糖积累为启动呼吸跃变提供能源物质的阶段,在呼吸速率与乙烯释放量发生跃变后葡萄糖含量又快速下降,这可能是由于果实发生跃变后,后熟软化等一系列生理代谢迅速增加,需要大量的能源物质,消耗了大量葡萄糖,这也解释了甜瓜果实软化过程中,淀粉和其他糖不断降解产生葡萄糖,而葡萄糖含量却没有显著增加。在呼吸跃变后期,AI活性及其酶基因表达量亦显著增加,由此可推断,AI在甜瓜果实软化的后期起作用。1-MCP处理组果实中各种糖含量的变化较对照组有所推迟,并且变化幅度较小,说明乙烯对糖代谢也具有促进作用,因此,抑制乙烯的生产,对延缓甜瓜果实糖代谢与后熟软化有积极的作用。此外,低温贮藏能够更为有效地抑制甜瓜果实的呼吸代谢与乙烯的产生,并降低糖代谢酶活性及相关酶基因的表达量,大幅延缓甜瓜果实的后熟生理代谢进程。所以,在不发生冷害的情况下,适当低温能够抑制甜瓜果实的糖代谢,有效推迟果实的后熟软化,从而延长甜瓜的贮藏保鲜期。
[1] 阎香言,张熠可,李福瑞,等.不同质地桃果实软化过程中细胞壁组分变化的差异[J].北方园艺,2017(20):60-66.
[2] 孔祥佳,任思琪,林河通,等.不同成熟度橄榄果实冷藏期间细胞壁代谢对采后冷害的响应特性[J].食品科学,2018,39(3):229-235.
[3] 曹嵩晓,张冲,汤雨凡,等.植物脂氧合酶蛋白特性及其在果实成熟衰老和逆境胁迫中的作用[J].植物生理学报,2014,50(8):1 096-1 108.
[4] RACQUEL S.WILLIAMS,NOUREDDINE BENKEBLIA.Biochemical and physiological changes of star apple fruit (Chrysophyllum cainito) during different “on plant” maturation and ripening stages[J].Scientia Horticulturae,2018,236(6):36-42.
[5] LATOCHA P,KRUPA T,JANKOWSKI P,et al.Changes in postharvest physicochemical and sensory characteristics of hardy kiwifruit (Actinidia arguta and its hybrid) after cold storage under normal versus controlled atmosphere[J].Postharvest Biology Technology,2014,88:21-33.
[6] JOHN E L,ELSPETH M.New complexities in the synthesis of sucrose[J].Current Opinion in Plant Biology,2003,165(1):9-21.
[7] 马婷,任亚梅,庞荣,等.1-MCP处理对亚特猕猴桃冷藏期生理特性及品质的影响[J].中国食品学报,2016,16(11):145-153.
[8] 艾沙江·买买提,张校立,梅闯,等.库尔勒香梨果实可溶性糖积累及代谢相关酶活性变化[J].新疆农业科学,2018,55(4):664-673.
[9] 李馨玥,李通,袁晖,等.‘南果梨’果实发育过程中糖分积累与相关基因表达分析[J].果树学报,2016,33(S1):59-64.
[10] 张慧琴,谢鸣,张琛,等.猕猴桃果实发育过程中淀粉积累差异及其糖代谢特性[J].中国农业科学,2014,47(17):3 453-3 464.
[11] ALICE T,VANINA Z A S N,et al.On the role of ethylene,auxin and a GOLVEN-like peptide hormone in the regulation of peach ripening[J].BMC Plant Biology,2016,16(1):1-17.
[12] 韩帅,蔡洪芳,马瑞娟,等.1-MCP处理对采后桃果实糖代谢的影响[J].食品工业科技,2018,39(18):264-269.
[13] 李江阔,曹森,张鹏,等.1-MCP采前处理对葡萄采后相关酶活性与品质的影响[J].食品科学,2014,35(22):270-275.
[14] CAMPS C,GUILLERMIN P,MAUGET J C,et al.Data analysis of penetrometric force/displacement curves for the characterization of whole apple fruits[J].Journal of Texture Studies,2005,36(4):387-401.
[15] 李明霞,韩建群,王琦,等.低强度微波处理对猕猴桃细胞壁降解酶活性的影响[J].食品与发酵工业,2015,41(11):52-58.
[16] 谢季云,赵晓敏,汪永琴,等.1-MCP处理对不同期采收的阿克苏富士苹果在采后贮藏期糖代谢的影响[J].现代食品科技,2018,34(9):111-121;214.
[17] MERLO L,PASSERA C.Changes in carbohydrate and enzyme levels during development of leaves of Prunus persica,a sorbitol synthesizing species[J].Physiologia Plantarum,1991,83:621-626.
[18] ITAI A,TANAHASHI T.Inhibition of sucrose loss during cold storage in Japanese pear (Pyrus pyrifolia Nakai) by 1-MCP[J].Postharvest Biology Technology,2008,48:355-363.
[19] SHAO X F,ZHU Y F,CAO S,et al.Soluble sugar content and metabolism as related to the heat-induced chilling tolerance of loquat fruit during cold storage[J].Food and Bioprocess Technology,2013,6(12):3 490-3 498.
[20] 潘俨,孟新涛,车凤斌,等.库尔勒香梨果实发育成熟的糖代谢和呼吸代谢响应特征[J].中国农业科学,2016,49(17):3 391-3 412.
[21] 戚雯烨,周晨卉,宋丽君,等.毛花猕猴桃‘华特’果实采后糖代谢研究[J].果树学报,2016,33(6):744-751.
[22] 魏宝东,梁冰,张鹏,等.1-MCP处理结合冰温贮藏对磨盘柿果实软化衰老的影响[J].食品科学,2014,35(10):236-240.
[23] 齐秀东,魏建梅,李永红.苹果果实质地软化过程中碳水化合物代谢及其关键酶基因表达的变化[J].园艺学报,2015,42(3):409-417.
[24] WANG K,SHAO X F,GONG Y F,et al.The metabolism of soluble carbohydrates related to chilling injury in peach fruit exposed to cold stress[J].Postharvest Biology Technology,2013,86:53-61.
[25] 陈景丹,许凤,陈伟,等.猕猴桃果实采后软化期间淀粉降解关键基因表达分析[J].核农学报,2018,32(2):236-243.
[26] 苗红霞,金志强,刘伟鑫,等.香蕉采后果肉硬度与淀粉代谢变化[J].中国农学通报,2013,29(28):124-128.
[27] 胡丽松,吴刚,郝朝运,等.菠萝蜜果实中糖分积累特征及相关代谢酶活性分析[J].果树学报,2017,34(2):224-230.
[28] AGOPIAN R G D,PERONI-OKITA F H G,SOARES C A,et al.Low temperature induced changes in activity and protein levels of the enzymes associated to conversion of starch to sucrose in banana fruit[J].Postharvest Biology Technology,2011,62:133-140.
[29] 蔡小林,潘介春,周煜棉,等.荔枝糖酸代谢特性及其调控研究进展[J].江苏农业科学,2018,46(4):17-22.
[30] DENG L,PAN X Q,CHEN L,et al.Effects of preharvest nitric oxide treatment on ethylene biosynthesis and soluble sugars metabolism in ‘Golden Delicious’ apples[J].Postharvest Biology Technology,2013,84:9-15.