大豆分离蛋白(soybean protein isolate,SPI)的蛋白质含量可达90%以上,具有良好的营养价值和功能性质,是重要的植物蛋白质来源。当前,大豆分离蛋白作为功能性配料在食品加工中的应用越来越广泛[1],这迫切需要开发具有某些更加突出功能性质的大豆蛋白产品。
蛋白质改性技术是提高大豆分离蛋白功能性质的必要手段。蛋白质改性方法很多[2],糖基化修饰和酶法水解是特别有前景的技术手段[3-4]。蛋白质的功能性质依赖于其相对分子质量、结构和氨基酸组成等[5]。转谷氨酰胺酶催化的糖基化修饰是一种新型的糖基化修饰手段[6]。该酶不仅可以使蛋白质分子之间发生共价交联反应,而且能够催化酰基转移反应,将氨基糖导入蛋白质侧链分子中,致使蛋白质的结构发生显著变化。而酶法水解是在特定pH和温度的条件下,催化大分子蛋白质的肽链断裂,产生肽甚至是氨基酸[7]。这个过程极大地改变了蛋白质的结构及氨基酸组成。理论上,转谷氨酰胺酶催化的糖基化修饰和酶解都会改变蛋白质的功能特性。一些研究结果也表明[8],转谷氨酰胺酶途径的糖基化修饰改善了大豆分离蛋白的乳化性。而酶解改善了葵花分离蛋白的乳化稳定性[9]以及大豆分离蛋白的溶解性[10]。一般来说,单一的改性处理效率相对较低,结合不同的修饰方法处理蛋白质能够提高蛋白质的功能特性[11]。但转谷氨酰胺酶途径的糖基化和酶解相结合改造大豆蛋白的功能性质,尚未见有关的研究报告。
本研究首先利用转谷氨酰胺酶途径制备糖基化大豆蛋白,随后利用碱性蛋白酶(Alcalase)酶解制备其水解产物,评估糖基化大豆蛋白的酶解产物的性质变化,包括热特性及功能性质(溶解性,持水、持油性和乳化性),揭示糖基化和酶解相结合对大豆蛋白性质的影响。
1 材料与方法
1.1 材料
1.1.1 原料与试剂
脱脂豆粉,哈尔滨市宾县禹王植物蛋白有限公司;转谷氨酰胺酶,江苏一鸣精细化工有限公司;壳寡糖(平均分子量为1 kDa,脱乙酰度≥90%),浙江金壳生物化学有限公司;碱性蛋白酶(2.94×102 U/mg),诺维信公司;大豆油,九三粮油工业集团有限公司;其他试剂均为分析纯。
1.1.2 仪器
XW-80A型涡旋混合器,上海青浦沪西仪器厂;T25型均质机,德国IKA公司;UV5100型紫外可见分光光度计,上海元析仪器有限公司;TDZ5-WS型高速离心机,浙江湘仪有限公司;STA 449 F3 Jupiter型热分析仪,德国Netzsch公司;Nano-ZS90型纳米粒度及Zeta电位分析仪,英国Malvern公司。
1.2 方法
1.2.1 糖基化大豆蛋白酶解产物的制备
按照文献[4]的方法制备糖基化大豆蛋白(glycosylation soyoean protein isolate,GSPI),随后以Alcalase为水解用酶,根据pH-Stat法,控制添加的NaOH体积,制得水解度(degree of nydrolysis,DH)分别为1%、2%和4%的酶解产物。具体方法为:配制蛋白质分散液20 g/L,pH 8.5,温度保持60 ℃,按E/S为1‰(w/w)的比例加入Alcalase,反应过程中通过滴加NaOH溶液维持反应体系的pH为8.5。酶解反应结束后,立刻取出反应产物在85 ℃水浴锅中灭酶5 min,随后冷却至室温,调节pH为7.5,冷冻干燥,所得修饰产物进行功能性的测定。
1.2.2 热特性分析
使用STA-449F3型热重分析仪进行热特性分析。待测样品首先在饱和的食盐水环境中(相对湿度约为75.5%)室温放置24 h。随后取5 mg样品放入氧化铝坩埚中,氮气流量为50 mL/min,并且以10 ℃/min的速率在25~140 ℃的温度条件下测定。
1.2.3 溶解性的测定
配制pH 2~11的缓冲液溶解蛋白质样品,样品质量浓度为2 g/L。旋涡30 s后置于4 ℃冰箱过夜,使其充分溶解。次日8 000 g/min离心20 min,收集上清液测定其蛋白质含量。溶解性以蛋白质中可溶性蛋白质含量所占的比例表示[12]。其中,缓冲液的配制方法为:pH 2~3,0.05 mol/L的柠檬酸盐缓冲液;pH 4~5,0.05 mol/L的乙酸盐缓冲液;pH 6~8,0.05 mol/L的磷酸盐缓冲液;pH 9~11,0.05 mol/L的碳酸盐缓冲液。
1.2.4 持水性和持油性的测定
参照文献[13]的方法测定蛋白质的持水性及持油性。称取0.1 g蛋白质于干燥的离心管中(总质量为W1),随后向离心管中加入4 mL蒸馏水,旋涡,至离心管内蛋白质与水充分混合,室温下静置30 min,5 000 g离心30 min,缓慢倒出上清液,称量离心后离心管的质量(W2),持水性按公式(1)计算。
(1)
式中:W0,加入蛋白质干重,g;W1,离心管与干燥的蛋白质质量之和,g;W2,离心后离心管的质量,g。
准确称量0.1 g蛋白质于离心管中,随后加入4 mL(V1)精制大豆油,旋涡使样品与植物油充分接触,室温放置30 min后5 000 g/min离心30 min,随后将上清液移出记录其体积为V2。见公式(2)。
吸油性![]()
(2)
式中:W0,加入蛋白质干重,g;V1,加入油的体积,即4 mL;V2,上清液的体积,mL。
1.2.5 乳化性的测定
1.2.5.1 乳化活性和乳化稳定性的测定
用0.1 mol/L(pH 7.5)的磷酸盐缓冲液溶解待测蛋白质样品,配制1 g/L的蛋白质分散液,从中取75 mL并与25 mL大豆油混合,12 000 r/min均质1 min,静置10 min。分别在0 min和10 min时从底部取50 μL乳液加入到5 mL质量浓度为1 g/L的SDS溶液中,混匀,在500 nm处测定吸光值[14]。乳化活性指数(EAI)及乳化稳定性指数(ESI)计算方法见公式(3)和(4)。
(3)
(4)
式中:T=2.303;A0,零时刻的吸光度值;ρ,乳化前蛋白质样品溶液的质量浓度,g/mL;φ,溶液中油的体积分数;A10,乳液静置10 min后的吸光度。
1.2.5.2 乳液的平均粒径和电位的测定
配制1 g/L的蛋白质分散液,与大豆油以体积比1∶3混合,于12 000 r/min均质1 min,4 ℃放置20 h后,稀释至0.1 mg/mL。随后用Nano-ZS90型粒度分析仪测定乳液的粒径和电位[15]。
2 结果与讨论
2.1 热特性
蛋白质的热稳定性是反映蛋白质结构构象和功能性质的重要指标。本研究分析了大豆分离蛋白及其修饰产物的差示扫描量热(differential scanning calorimetry,DSC)曲线,结果如图1所示。从图1可以看出,在20~140 ℃范围内,所有的测试样品都是吸热反应,对应的SPI、GSPI、GSPI-1%DH、GSPI-2%DH、GSPI-4%DH五种蛋白质热变性温度分别为74.6、66.1、65.2、62.5、75.1 ℃。样品的热稳定性和热变性温度呈正相关,可见经过糖基化修饰的大豆蛋白热稳定性下降,这与FU等[16]的研究结果一致。而糖基化大豆蛋白经过Alcalase酶解后得到的产物(水解度为1%~4%)的热稳定性先下降后增加。焓变ΔH和蛋白质的有序程度有关[17]。相比于大豆蛋白,糖基化大豆蛋白的ΔH显著增高,可能是由于糖基化修饰使蛋白质的结构更紧密,而水解产物的ΔH随着水解度的增大而减小,原因可能是酶解使蛋白质形成小分子肽,降低了蛋白质的有序结构。
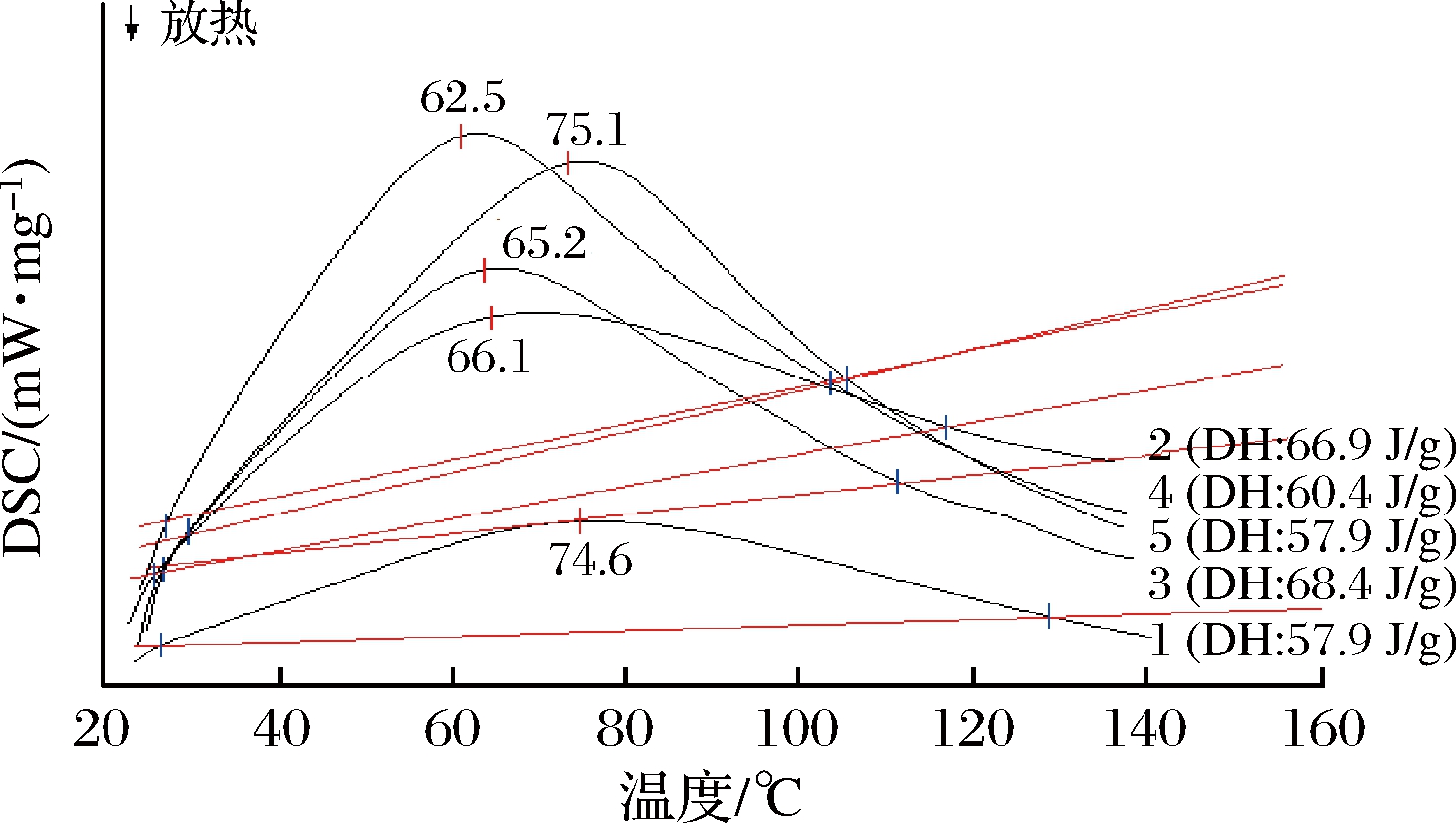
1-SPI;2-GSPI;3-GSPI-1%DH;4-GSPI-2%DH;5-GSPI-4%DH
图1 大豆分离蛋白及其修饰产物的DSC曲线
Fig.1 DSC profile of soybean protein isolate and its modification products
2.2 溶解性
不同pH条件下的大豆蛋白及其修饰产物的溶解性如图2所示。
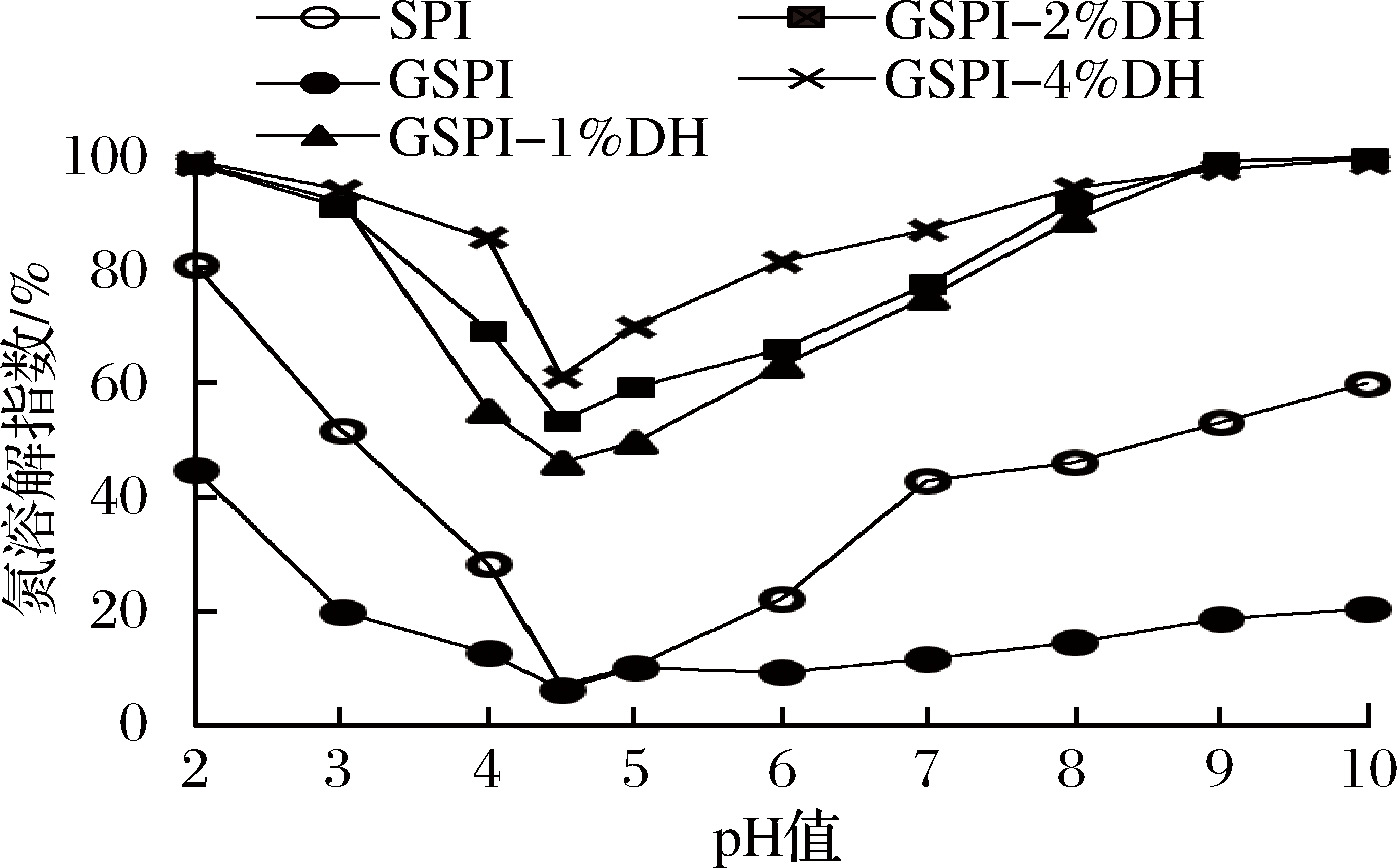
图2 大豆分离蛋白及其修饰产物在pH 2~11的溶解性
Fig.2 Solubility of soybean protein isolate and its modification products at pH 2-11
从图2可以看出,在pH值2~11范围内,大豆分离蛋白的糖基化产物的溶解性下降。虽然糖基的导入有利于提高蛋白质的溶解性[18],但是在糖基化修饰过程中蛋白质分子内/间的交联反应与糖基的导入共同发生,交联修饰导致大豆蛋白聚集生成大分子聚合物[19]。相对于大豆蛋白,糖基化大豆蛋白的酶解产物的溶解性显著提高,并且随着水解度的增大而增大。在等电点(pH 4.5)处,水解度为4%的糖基化大豆分离蛋白(GSPI-4%DH)溶解性提高了54.0%,在中性pH 7.0处的溶解性提高了43.9%。酶解使蛋白质释放小分子肽,从而提高了蛋白质的柔韧性[11]。ZHANG等[20]的实验结果表明,限制性酶解提高了大豆分离蛋白-麦芽糊精交联产物的溶解性。结果表明,糖基化修饰降低了大豆蛋白的溶解性,而随后的限制性酶解显著地提高了蛋白质的溶解性,这有利于扩大大豆蛋白在酸性及中性食品的应用。
2.3 持水性和持油性
蛋白质的持水性和持油性在食品加工和保藏过程中十分重要。大豆分离蛋白及修饰产物的持水性和持油性的结果如图3所示。

图3 大豆分离蛋白及修饰产物的持水性和持油性
Fig.3 Water and oil retention capacities of soybean protein isolate and modified products
注:图中不同小写、大写字母代表差异显著(P<0.05)。下同。
从图3可以看出,相对于大豆分离蛋白,糖基化产物的持水性提高了11.7%,可能是由于蛋白质与糖发生了共价交联反应,而导入的壳寡糖中含亲水性糖基,使蛋白质的持水能力增加。而水解产物的持水性随着水解度的增大逐渐变小,分别降低了86.7%、88.3%和97.1%。原因可能是蛋白质经酶解后肽键断裂,形成小分子肽,不利于网状结构的形成,从而持水性下降[21]。此外可以看出,相比于大豆分离蛋白,改性后蛋白质的持油性显著增强。糖基化和水解使蛋白质内部的疏水基团暴露,有利于提高产物的持油能力[22]。
2.4 乳化性
2.4.1 乳化活性及乳化稳定性
大豆分离蛋白及其修饰产物的乳化活性及乳化稳定性分析结果如图4所示。从图4可以看出,糖基化大豆蛋白的乳化活性最低,但是具有较高的乳化稳定性。经Alcalase酶解后,产物的乳化活性提高,水解度为2%和4%的糖基化产物的乳化活性显著提高(高于大豆蛋白),但是乳化稳定性下降,此时的乳化稳定性为大豆蛋白的79.6%和76.3%。水解物中肽的相对分子质量降低,在界面处不能稳定吸附,所以乳液发生聚集,乳化稳定性下降[23]。
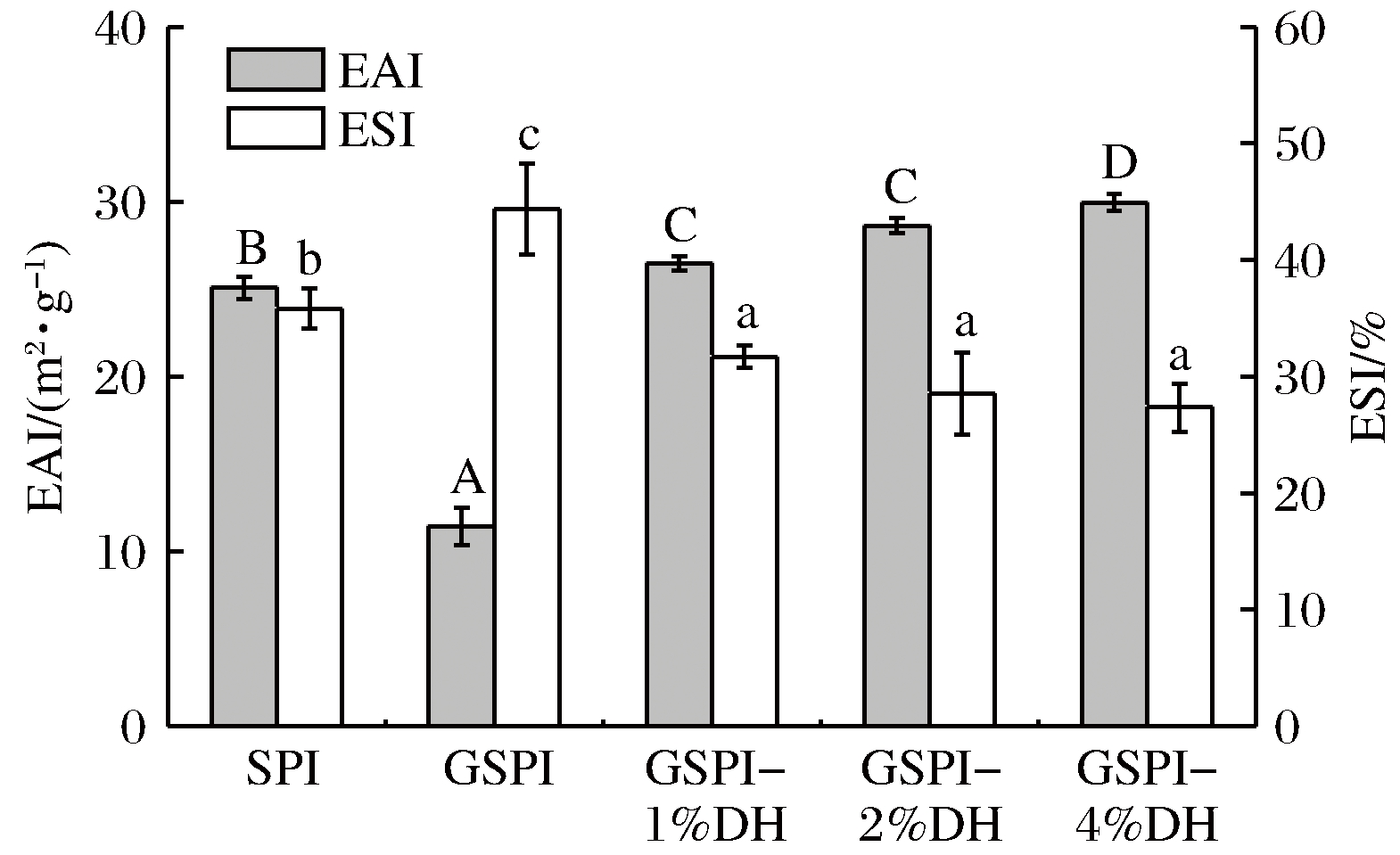
图4 大豆分离蛋白及修饰产物的乳化性
Fig.4 Emulsification of soybean protein isolate and modified products
2.4.2 乳液的平均粒径电位
乳液的平均粒径、电位与蛋白质的乳化活性直接相关[24],分析乳液的平均粒径和电位对深入剖析蛋白质的乳化性有一定的意义。乳化平均粒径和电位分析结果见图5。

a-大豆分离蛋白及修饰产物的乳化平均粒径分布;b-大豆分离蛋白及修饰产物的电位
图5 大豆分离蛋白及修饰产物的乳化平均粒径分布及电位
Fig.5 Emulsified particle size and potential of soybean protein isolate and its modified products
相比于大豆蛋白(130.9 nm),糖基化修饰产物的乳液平均粒径最大(153.5 nm),而其酶解产物的乳液平均粒径减小(1%~4%DH 的GSPI分别为150.7、135.2、116.5 nm),而且随着水解度的增大逐渐减小(图5)。这是因为酶解后的蛋白质疏水基团暴露,随着疏水基团的增加,在均质过程中,蛋白质能更快吸附到油水界面,将油滴包裹起来,阻止液滴聚集,因而使乳液的平均粒径变小。酶解后蛋白质的分子体积变小也是其中一个原因。HEMAR等[25]研究发现,乳液的平均粒径和乳化活性呈负相关,即乳液平均粒径越小,乳化活性越大。这与本实验的研究结果一致。
除此之外,电位的变化也一定程度上与乳液的稳定性相关。本研究分析的电位绝对值变化为:糖基化大豆蛋白>大豆蛋白>糖基化大豆蛋白水解物(GSPI-4%DH 除外)。高电位值表明液滴间的斥力大,乳液的稳定性增强[26]。因而GSPI具有较高的乳化稳定性,而水解物表现为较低的乳化稳定性,这与比浊法分析结果一致(图4);但是,以其水解物制备的乳液电位先下降后增加(1%~4%DH 的GSPI分别为-22.9、-15.3、-29.9 mV),这与乳化稳定性的分析结果不一致。而GSPI-4%DH虽然具有较高的电位,但是其乳化平均粒径下降,在界面处不能稳定吸附,所以乳液发生聚集,乳化稳定性下降[24]。
3 结论
转谷氨酰胺酶途径的糖基化及随后的酶解修饰相结合能够改变大豆分离蛋白的功能性质。糖基化大豆蛋白在低水解度(1%~4%)时,就能够显著地改善糖基化大豆蛋白的一些功能性质。在水解度为4%时,溶解性增加(等电点pH 4.5和中性pH 7.0条件下分别提高了54.0%和43.9%);乳化活性和持油性分别增加了19.5%和35.4%。因而结合糖基化和酶解修饰,能够制备出具有理想功能性质的食品功能性配料。
[1] 王海萍.高固形物浓度大豆分离蛋白酶解特性的研究[D].广州:华南理工大学,2016.
[2] 何伟明,叶劲松,师洁.蛋白质改性对禽蛋粉加工性能影响的研究进展[J].食品与机械,2018,34(10):185-190;195.
[3] 张慧君,陈又铭,辛德慧,等.麦芽糖浆糖基化改性玉米醇溶蛋白及在胶囊壳中的应用[J].食品科学,2018,39(14):29-35.
[4] 宋春丽,任健,陈佳鹏,等.糖基化与胰蛋白酶酶解对大豆蛋白构象和功能性质的影响[J].中国油脂,2017,42(12):22-25.
[5] 王长远,全越,李玉琼,等.燕麦麸皮球蛋白的糖基化结构修饰及功能性变化[J].食品科学,2017,38(9):143-148.
[6] 宋春丽,赵新淮.食品蛋白质的糖基化反应:美拉德反应或转谷氨酰胺酶途径[J].食品科学,2013,34(9):369-374.
[7] 庞美蓉,丁秀臻,孔祥珍,等.蛋白酶水解大豆分离蛋白的分子水平表征[J].中国油脂,2013,38(5):20-23.
[8] SONG Chunli,ZHAO Xinhuai.Structure and property modification of an oligochitosan-glycosylated and crosslinked soybean protein generated by microbial transglutaminase[J].Food Chem,2014,163(3):114-119.
[9] REN Jian,SONG Chunli,ZHANG Huiying,et al.Effect of hydrolysis degree on structural and interfacial properties of sunflower protein isolates[J].J Food Process Preserv,2016,41:1-7.
[10] 王利国,刘锐,张民,等.大豆分离蛋白酶解产物的理化性质研究[J].中国食品添加剂,2018(3):73-79.
[11] YUAN Boen,REN Jiaoyan,ZHAO Mouming,et al.Effects of limited enzymatic hydrolysis with pepsin and high-pressure homogenization on the functional properties of soybean protein isolate[J].Lwt-Food Sci Technol,2012,46(2):453-459.
[12] 徐晶,刘晓兰,郑喜群.玉米谷蛋白的美拉德糖基化改性[J].食品科技,2016,41(7):244-250.
[13] SAETAE D,KLEEKAYAI T,JAYASENA V,et al.Functional properties of protein isolate obtained from physic nut (Jatropha curcas L.) seed cake[J].Food Science and Biotechnology,2011,20(1):29-37.
[14] 王晓杰,曲悦.酶法糖基化修饰对玉米醇溶蛋白物化性质的影响[J].食品科技,2018,43(8):270-276.
[15] 綦玉曼,寻崇荣,车佳玲,等.薄荷油纳米乳液的制备及其性质分析[J].食品科学,2019,40(10):29-35.
[16] FU Miao,ZHAO Xinhuai.Modified properties of a glycated and cross-linked soy protein isolate by transglutaminase and an oligochitosan of 5 kDa[J].J Sci Food Agr,2016,97(1):58-64.
[17] ZHAO Guanli,LIU Yan,ZHAO Mouming,et al.Enzymatic hydrolysis and their effects on conformational and functional properties of peanut protein isolate[J].Food Chem,2011,127(4):1 438-1 443.
[18] TANG Chuanhe,SUN Xin,FOEGEDING E A.Modulation of physicochemical and conformational properties of kidney bean vicilin (phaseolin) by glycation with glucose:implications for structure-function relationships of legume vicilins[J].J Agr Food Chem,2011,59(18):10 114-10 123.
[19] XIU Qingpeng,YAN Tengxu,TONG Xunliu,et al.Molecular mechanism for improving emulsification efficiency of soy glycinin by glycation with soy soluble polysaccharide[J].J Agr Food Chem,2018:1-44.
[20] ZHANG Yating,TAN Chen,ERIC K,et al.Effect of limited enzymatic hydrolysis on physic-chemical properties of soybean protein isolate-maltodextrin conjugates[J].Int J Food Sci Technol,2015,50(1):226-232.
[21] 刘汝萃,曲玲玲,牛祥臣,等.不同水解度的大豆分离蛋白结构与功能性关系探究[J].食品研究与开发,2018,39(11):22-26;36.
[22] REN Jian,SONG Chunli,WANG Ping,et al.Modification of structural and functional properties of sunflower 11S globulin hydrolysates[J].Czech J Food Sci,2017,33(5):474-478.
[23] KRISTINSSON H G,RASCO B A.Fish protein hydrolysates:Production,biochemical,and functional properties[J].Crit.Rev.Food Sci,2000(40):43-81
[24] 江连洲,王欢,韩天翔,等.限制性酶解大豆蛋白-磷脂乳液特性分析[J].中国食品学报,2018,18(3):269-277.
[25] HEMAR Y,TAMEHANA M,MUNRO P A,et al.Influence of xanthan gum on the formation and stability of sodium caseinate oil-in-water emulsions[J].Food Hydrocolloids,2001,15(4):513-519.
[26] 李杨,王妍,张雅娜,等.大豆磷脂对大豆蛋白乳化体系的影响[J].食品工业科技,2013,34(19):74-76;79.