多糖(polysaccharide)是一类由多个相同或不同类型单糖失水缩合而成的高分子碳水化合物,可以激活人体免疫细胞、促进功能细胞因子的生成、诱导癌细胞凋亡和清除自由基等,具有降血糖血脂[1-2]、抗癌[3]、抗辐射、抗氧化[4-5]以及增强机体免疫力[6]等生物活性,因此多糖越来越多地应用于保健饮料的开发。但目前市场上的多糖饮料存在原料单一、口感和功能性差、易产生沉淀等问题[7],急需配方优化和加工技术的改进。
香椿[Toona sinensis(A.Juss.)Roem]为楝科(Meliaceae)香椿属,是著名的药食两用木本植物,被国内外誉为“绿色保健菜”,因富含多酚、黄酮和多糖等活性物质而具有抗氧化和降血糖等功能[8-9]。香椿红茶采用香椿叶发酵做茶,通过适度的萎凋与发酵,激发鲜叶中酶的活性,促使鲜叶中大分子营养物质降解为可吸收的小分子,使茶水中营养物丰富,口感醇香,功能效果更佳[10]。大麦(Hordeum vulgare L.)为禾本科植物,含有多糖等活性成分,具有抗氧化、降低血清胆固醇、刺激免疫和抗肿瘤等多种生物活性,且无毒副作用,在功能食品和医药方面有良好应用前景[11-12]。山药(Dioscorea opposite Thunb.) 为薯蓣科多年生宿根蔓生植物薯蓣的块茎,是我国传统的药食同源食物之一[13]。山药多糖目前被公认为山药主要的生物活性成分,占其干物质的 2.15%~2.92%[14]。决明子(Cassia seem)为豆科植物决明或小决明的干燥成熟种子,具有降压降脂、保肝明目、润肠抗菌等作用,所含多糖、大黄酸和大黄素是治疗糖尿病的活性物质[15]。
目前尚未有功能性复合多糖饮料及其功能活性的研究报道。本研究采用超声波辅助提取香椿、决明子、大麦、山药多糖,以提取到的提取液为主要原料,添加甜叶菊和柠檬酸调节口感,研究功能性复合多糖饮料的生产工艺、产品配方和感官品质,并通过测定对DPPH自由基、羟基自由基的清除作用及对α-葡萄糖苷酶的抑制作用来评价其功能活性,以期得到一种工艺合理、营养健康丰富、富含多糖等生物活性的功能性复合多糖饮料,解决目前市场上的多糖饮料原料单一化、口感和功能性差等问题,为开发功能性复合多糖饮料提供理论指导。
1 材料和方法
1.1 试验材料
香椿叶选取头茬嫩芽,采自登封市嵩阳红香椿种植专业合作社;决明子、大麦和甜叶菊,郑州市张仲景大药房;山药,郑州市拜特超市;α-葡萄糖苷酶、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,pNPG),美国Sigma公司;DPPH,东京化成工业株式会社;铁氰化钾、KH2PO4、K2HPO4、水杨酸和Na2CO3均为分析纯;水为去离子水。
1.2 仪器与设备
BL-250 A型高速多功能粉碎机,浙江省永康市青松五金厂;DGG-9140型电热恒温鼓风干燥箱,上海森信实验仪器有限公司;SB-5200 DTD超声波清洗机,宁波新芝生物科技股份有限公司;ME204E 型电子天平,梅特勒-托利多仪器(上海)有限公司;GENESYS 10S型UV-VIS紫外分光光度计,美国Thermo公司;HHS型电热恒温水浴锅,上海博迅实业有限公司医疗设备厂;H1650R/H1850R 台式高速离心机,湖南湘仪实验仪器开发有限公司;NUII-10T型实验室(超)纯水机,南京优普环保设备有限公司。
1.3 试验方法
1.3.1 功能性复合多糖饮料的工艺流程
制备各种多糖液→混合→调配→过滤→均质→灌装→灭菌→冷却→成品
1.3.1.1 香椿红茶、大麦、决明子和山药多糖提取液的制备
利用本实验室发明的香椿红茶专利制作香椿红茶。取香椿红茶(干)用超微粉碎机粉碎后过200目筛。称取香椿红茶粉20 g,按料液比1∶20(g∶mL)的比例加入80 ℃的水,超声辅助提取3 h,过滤后的上清液为香椿叶多糖提取液。
分别称取40 g大麦和决明子(干),放置烤箱的烤盘中,上火160 ℃,烘烤10 min,冷却至室温备用。将烘烤后的大麦和决明子于超微粉碎机中粉碎后过200目筛子。称取大麦粉和决明子粉各20 g,按料液比1∶20(g∶mL)的比例加入100 ℃的水,超声辅助提取3 h,过滤后的上清液为大麦多糖提取液和决明子多糖提取液。
选取新鲜的山药,经去皮、切片、护色、干燥、粉碎后得到山药粉,称取山药粉20 g,按料液比1∶20(g∶mL)的比例加入80 ℃的水,超声辅助提取3 h,过滤后的上清液为山药多糖提取液。
1.3.1.2 混合调配
以香椿叶、决明子、大麦和山药多糖提取液为原料,甜叶菊和柠檬酸调节口感,设计6因素5水平L25(56)正交试验,按正交试验(表1)确定最佳配比混合,选出最优配方,然后将多糖溶液与稳定剂料液定量混合,充分混合均匀后,最后用饮用水补至产品的最终总体积100 mL。正交试验因素及水平如表1所示。
表1 正交试验因素水平表
Table 1 Orthogonal experimental factors and levels
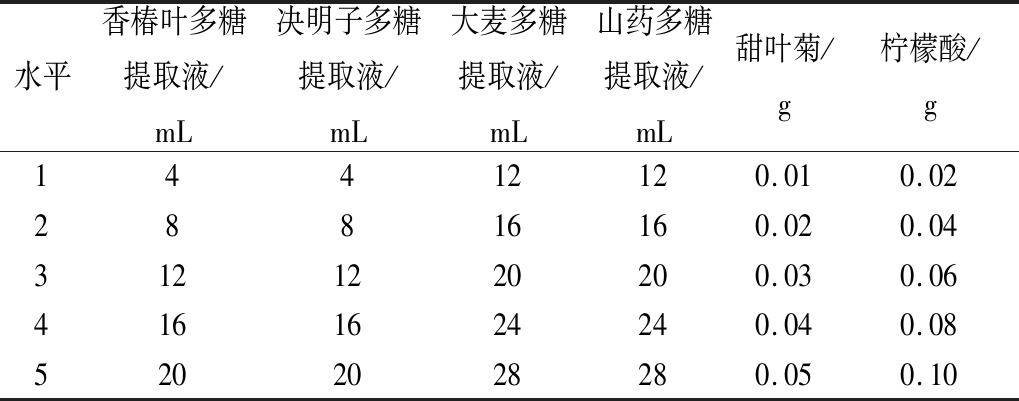
水平香椿叶多糖提取液/mL决明子多糖提取液/mL大麦多糖提取液/mL山药多糖提取液/mL甜叶菊/g柠檬酸/g14412120.010.0228816160.020.043121220200.030.064161624240.040.085202028280.050.10
1.3.1.3 均质
将过滤好的功能性复合多糖饮料在18~20 MPa,50~60 ℃下进行均质4~5 min,使多糖饮料混合均匀,防止分层、沉淀,口感更细腻。
1.3.1.4 杀菌与灌装
将均质后的功能性复合多糖饮料加热到90 ℃,趁热灌装于清洗消毒的玻璃瓶中,封口后在115 ℃的高压蒸汽锅中灭菌20 min后,放于冷水中冷却至室温,即为成品。
1.3.2 感官评定
感官评定从视觉、嗅觉、味觉即澄清度与色泽、气味、口感3方面的指标对其进行评定,其中澄清度与色泽占40分,气味占30分,口感占30分[16]。功能性复合多糖饮料评分标准见表2。
表2 多糖饮料感官评分标准
Table 2 Criteria of sensory evaluation for polysaccharide beverage

等级色泽(20分)滋味(30分)口感(30分)组织形态(20分)一级棕黄色,色泽均匀,颜色鲜亮,透明度好(15~20分)具有厚重的浓香气味,香气和谐(20~30分)口感柔和细腻,酸甜适口,后味有明显茶香,圆滑甘润(20~30分)流动性好,无沉淀(15~20分)二级颜色偏浅,透明度好(11~14分)香味偏淡,有异味(10~20分)口感淡薄,不协调,酸甜不适中,有粗糙感(10~20分)瓶底有少量沉淀(11~14分)三级色泽偏暗(0~10分)香味不明显,有异味(0~10分)口感较差,有明显异味,偏苦涩(0~10分)不澄清瓶底有沉淀(0~10分)
1.3.3 指标测定
1.3.3.1 多糖含量测定
采用硫酸-苯酚比色法[17],称取105 ℃干燥至恒重的无水葡萄糖25 mg,置于250 mL容量瓶中,定容。精密量取葡萄糖标准品溶液0、0.2、0.4、0.6、0.8、1.0 mL,置于试管中,用蒸馏水补足至1 mL,各管再加入5%苯酚溶液1.0 mL,混匀,迅速加入5 mL浓H2SO4摇匀,静置10 min后于30 ℃水浴中加热20 min,去除冷却至室温,在490 nm处测定吸光度。以葡萄糖检测质量浓度(mg/mL)为横坐标,吸光度为纵坐标,制备标准曲线(y=0.010 6x+0.153 8,R2=0.999 3)(x,μg/mL)。吸取1 mL待测液,按上述步骤反应后,平行3次测定吸光度,原液多糖含量(μg/mL)按公式(1)计算:
多糖含量![]()
(1)
式中:A,样品溶液吸光度;f,样品稀释倍数。
1.3.3.2 DPPH自由基清除率的测定
称取7.896 mg DPPH,用无水乙醇定容到100 mL,即配成0.2 mmol/L,4℃冰箱避光保存。样品配制成38.500 mg/mL的母液,再梯度稀释,使质量浓度分别为9.624、4.812、2.406、1.203、0.601、0.300、0.150、0.075 mg/mL。避光反应30 min,517 nm处测试不同浓度样品的吸光度,平行3次测试[18]。·DPPH清除率按公式(2)计算:
·DPPH清除率![]()
(2)
式中:A1,样品溶液吸光度;A2,无水乙醇代替DPPH自由基醇溶液的对照试验吸光度;A0,蒸馏水代替样品溶液或VC的空白试验吸光度。
1.3.3.3 羟基自由基清除率的测定
样品梯度稀释,使之分别稀释成38.50、19.25、9.63、4.81、2.41 mg/mL。在离心管中依次加入1 mL不同质量浓度的样液溶液,0.3 mL 8.0 mmol/L FeSO4,0.25 mL 20 mmol/L H2O2,1.0 mL 3.0 mmol/L水杨酸。在37 ℃水浴中反应30 min,流水迅速冷却,再分别补加0.45 mL蒸馏水,使得溶液体积为3.0 mL。摇匀后10 ℃,2 000 r/min离心15 min,取上清液于510 nm处比色测定OD值,平行测定3次[19]。·OH清除率按公式(3)计算:
·OH清除率![]()
(3)
式中:A1,样品溶液吸光度;A2,蒸馏水代替H2O2溶液的对照试验吸光度;A0,蒸馏水代替样品溶液或VC的空白试验吸光度。
1.3.3.4 复合多糖饮料对α-葡萄糖苷酶的抑制作用
以pNPG为反应底物,经α-葡萄糖苷酶水解α-1,4-葡萄糖苷键后释放出对硝基苯酚(p-nitrophenol,pNP),在410 nm下检测黄色的对硝基苯酚的生成量作为酶活大小的判定标准[20]。实验各组物质加入量如表3所示。
表3 pNPG法测定α-葡萄糖苷酶活力 单位:μL
Table 3 Measure the activity of α-glucosidase by pNPG method
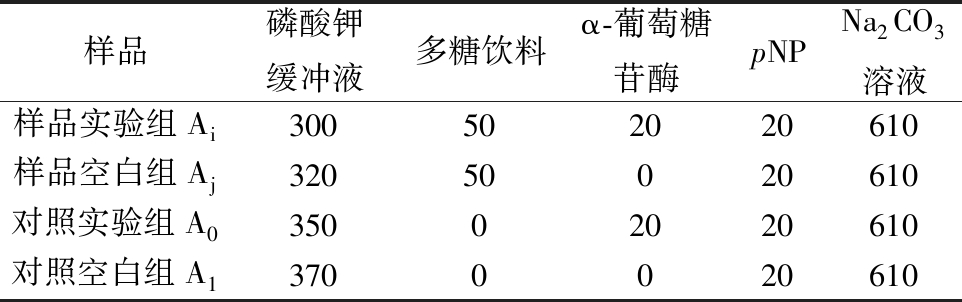
样品磷酸钾缓冲液多糖饮料α-葡萄糖苷酶pNPNa2CO3溶液样品实验组Ai300502020610样品空白组Aj32050020610对照实验组A035002020610对照空白组A13700020610
样品梯度稀释,使之稀释成38.50、19.25、9.63、4.81、2.41 mg/mL。向5 mL试管中依次加入pH 6.8,0.1 mol/L的磷酸钾缓冲液、不同浓度的待测多糖饮料和α-葡萄糖苷酶(1 U/mL)后37℃水浴锅预热20 min,加入pNPG溶液(2.5 mmol/L)37 ℃条件下水浴反应30 min,加入610 μL Na2CO3溶液(1 mol/L)终止反应,于410 nm处测定各组OD值。按照公式(4)计算不同浓度的多糖饮料对α-葡萄糖苷酶的抑制率。通过绘制多糖饮料浓度与酶活抑制率的关系曲线图,利用SPSS软件计算3种水提物对α-葡萄糖苷酶酶活抑制的IC50。
抑制率![]()
(4)
1.3.4 数据处理
每次实验做3次平行,数据统计分析采用SPSS 18.0软件,组间差异显著性采用t检验分析(P<0.05);实验数据用Origin 8.5软件绘图。
2 结果与分析
2.1 功能性复合多糖饮料正交试验结果分析
在前期单因素试验的基础上,选取香椿叶多糖提取液、决明子多糖提取液、大麦多糖提取液、山药多糖提取液、甜叶菊和柠檬酸为因素,分别设计5个水平按L25(56)正交表进行正交试验,以感官评价为衡量指标,优化功能性复合多糖饮料配方工艺参数,试验统计分析结果见表4和表5。
表4 功能性复合多糖饮料配方优化的正交试验L25(56)方案及结果
Table 4 Orthogonal array L25(56) design and results for formula optimization of the functional compound polysaccharide beverage
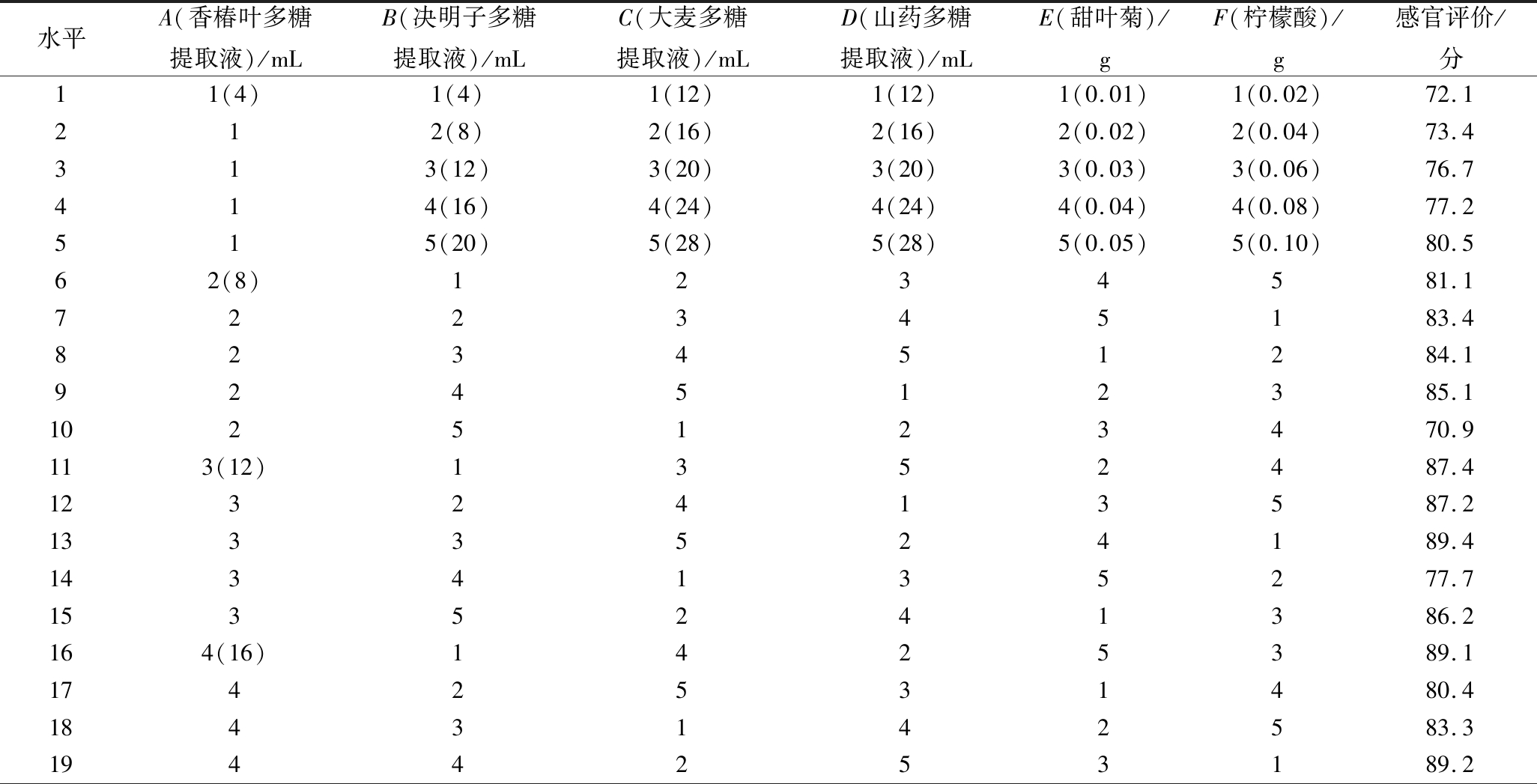
水平A(香椿叶多糖提取液)/mLB(决明子多糖提取液)/mLC(大麦多糖提取液)/mLD(山药多糖提取液)/mLE(甜叶菊)/gF(柠檬酸)/g感官评价/分11(4)1(4)1(12)1(12)1(0.01)1(0.02)72.1212(8)2(16)2(16)2(0.02)2(0.04)73.4313(12)3(20)3(20)3(0.03)3(0.06)76.7414(16)4(24)4(24)4(0.04)4(0.08)77.2515(20)5(28)5(28)5(0.05)5(0.10)80.562(8)1234581.1722345183.4823451284.1924512385.11025123470.9113(12)1352487.41232413587.21333524189.41434135277.71535241386.2164(16)1425389.11742531480.41843142583.31944253189.2
续表4
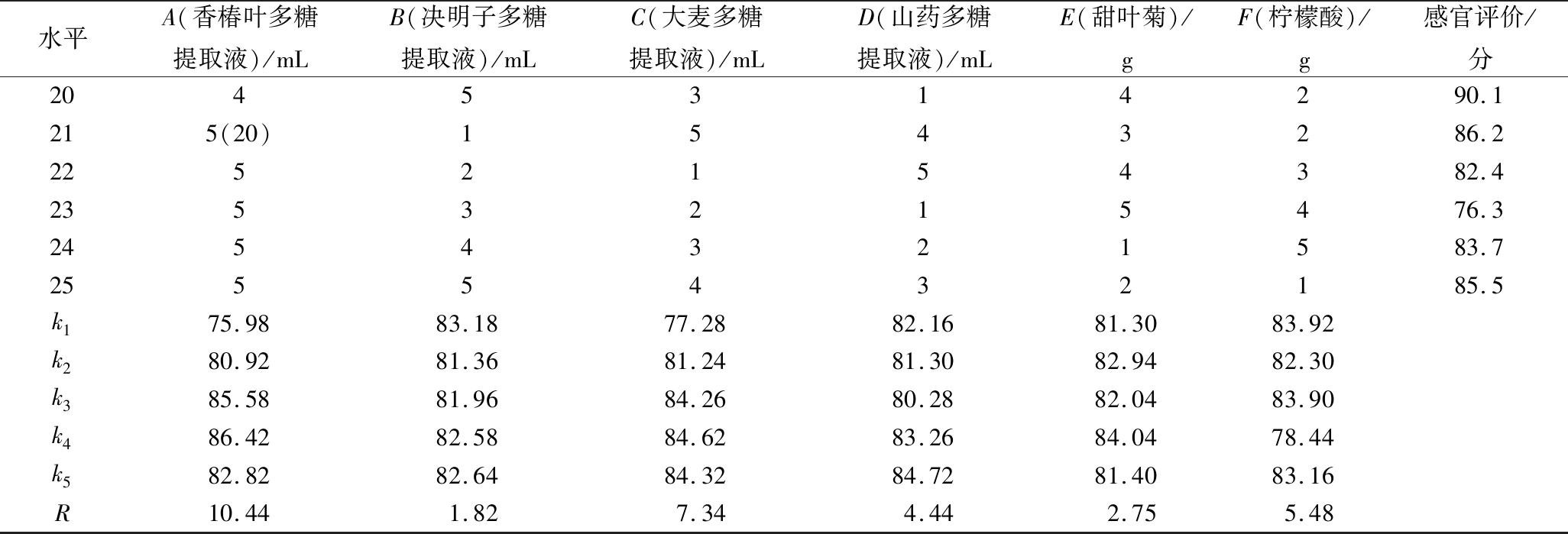
水平A(香椿叶多糖提取液)/mLB(决明子多糖提取液)/mLC(大麦多糖提取液)/mLD(山药多糖提取液)/mLE(甜叶菊)/gF(柠檬酸)/g感官评价/分2045314290.1215(20)1543286.22252154382.42353215476.32454321583.72555432185.5k175.9883.1877.2882.1681.3083.92k280.9281.3681.2481.3082.9482.30k385.5881.9684.2680.2882.0483.90k486.4282.5884.6283.2684.0478.44k582.8282.6484.3284.7281.4083.16R10.441.827.344.442.755.48
表5 正交试验结果方差分析
Table 5 Variance analysis of orthogonal test results

变异来源离差平方和自由度均方F值Sig.显著性A(香椿叶多糖提取液)349.202487.30035.670.002∗∗B(决明子多糖提取液(误差))9.79042.447C(大麦多糖提取液)198.094449.52320.240.006∗∗D(山药多糖提取液)59.342414.8356.060.054E(甜叶菊)26.52646.6312.710.179F(柠檬酸)104.070426.01710.630.021∗合计747.02224
注:**代表极显著(P<0.01);*代表差异显著(P<0.05)。
由表4极差分析可知,影响功能性复合多糖饮料感官评价因素主次顺序依次为A>C>F>D>E>B,即对功能性复合多糖饮料感官评价影响最大的因子是香椿叶多糖提取液。由表5方差分析可知,在实验误差范围内,A(香椿叶多糖提取液)和C(大麦多糖提取液)对功能性复合多糖饮料的口感具有极显著性影响(P<0.01),F(柠檬酸)具有显著性影响(P<0.05),B(决明子多糖提取液)、D(山药多糖提取液)和E(甜叶菊)影响不显著(P>0.05)。获得功能性复合多糖饮料最佳配方工艺条件组合为A4B1C4D5E4F1(M号),即香椿叶多糖提取液16 mL,决明子多糖提取液8 mL,大麦多糖提取液24 mL,山药多糖提取液28 mL,甜叶菊0.04 g,柠檬酸0.02 g,功能性复合多糖饮料的感官评分最高。
为验证正交试验的预测结果,特将(M号)与正交试验表中感官评价较高的16号、19号和20号进行了重复对比试验,试验结果是M号感官评价得分为91.1分,16号为89.2分,19号为89.4分,20号为89.9分,M号感官评价得分最高,说明正交试验预测的准确性。M号功能性复合多糖饮料经高速离心后无沉淀析出,且多糖含量高达7.92 mg/mL,是徐雅雯[21]研究的山药多糖复合饮料中多糖含量(3.82 mg/mL)的2倍多,是卓荣权等[22]研究的秋葵多糖饮料中多糖含量(14 mg/100 mL)的56倍,这说明M号功能性复合多糖饮料不仅具有较好的稳定性,还含有丰富的多糖,具有极强的功能活性。
2.2 不同浓度功能性复合多糖饮料对DPPH自由基清除能力影响分析
利用最优的条件生产功能性复合多糖饮料,按梯度将其稀释成不同浓度,从图1可以看出,多糖饮料对DPPH自由基清除能力随着质量浓度的增加而升高。当多糖饮料质量浓度在0.075~0.601 mg/mL之间时,清除能力随着多糖饮料质量浓度的增加呈直线上升;当多糖饮料质量浓度在0.601~2.406 mg/mL 之间时,清除能力随着多糖饮料质量浓度的增加先急剧升高后逐渐减缓;当多糖饮料浓度在2.406~9.624 mg/mL之间时,清除能力随着多糖饮料质量浓度的增加趋于平稳。因此功能性复合多糖饮料具有很强的DPPH自由基清除能力。
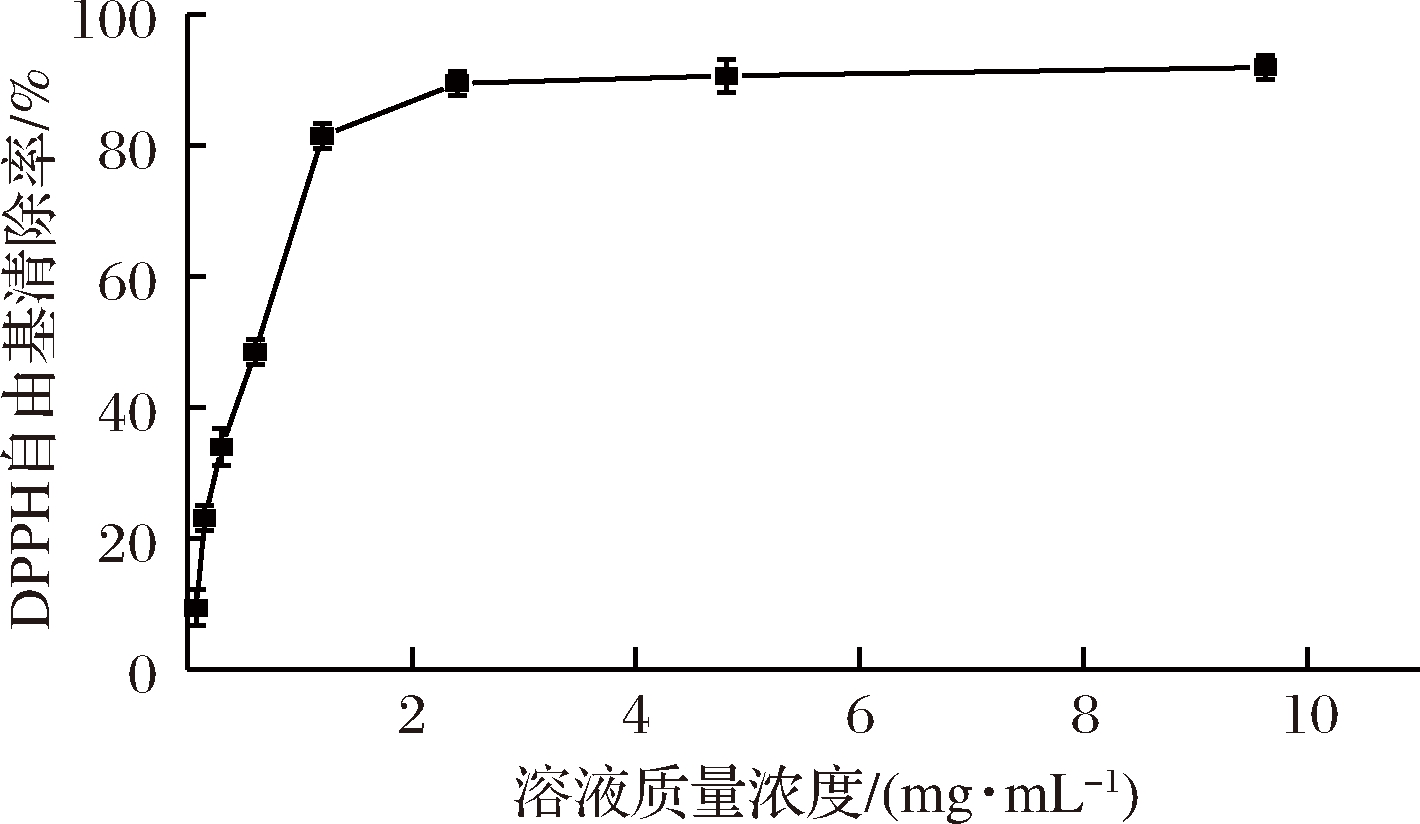
图1 不同质量浓度功能性复合多糖饮料清除DPPH自由基能力
Fig.1 Scavenging effects of the different concentrations of the functional compound polysaccharide beverage on ·DPPH
2.3 不同浓度功能性复合多糖饮料对羟基自由基清除能力影响分析
利用最优的条件生产功能性复合多糖饮料,按梯度将其稀释成不同浓度,多糖饮料对羟基自由基的清除能力如图2所示。功能性复合多糖饮料的质量浓度在2.41~38.50 mg/mL的实验范围内,多糖饮料清除羟基自由基的能力随着溶液质量浓度的增加而升高。通过拟合得到的多糖饮料的溶液质量浓度与羟基自由基清除率的关系方程为y=-0.037 3x2+3.099 9x-2.47(R2=0.993 8;2.41~38.50 mg/mL)。由此可以看出,功能性复合多糖饮料具有很强的羟基自由基清除能力。
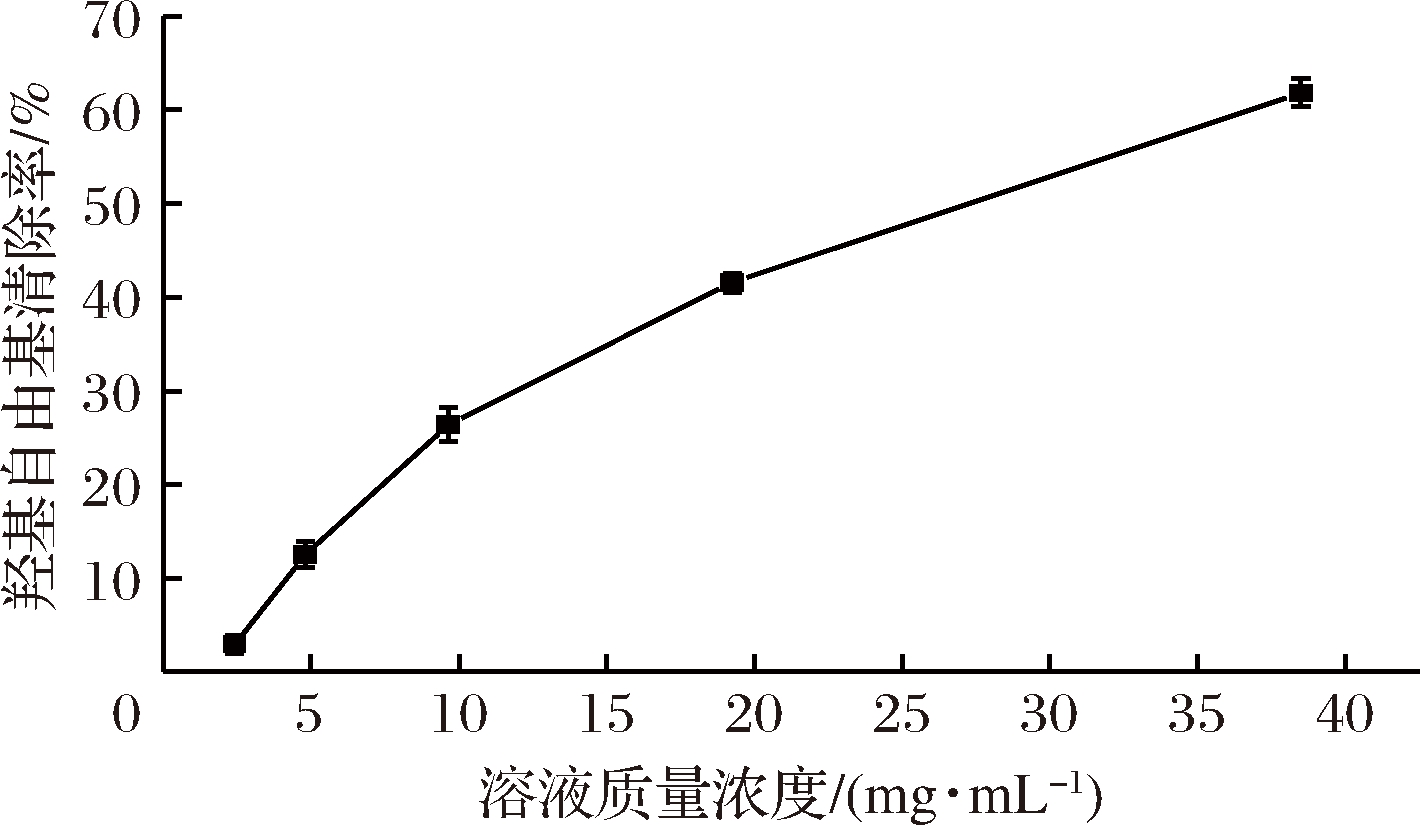
图2 不同质量浓度功能性复合多糖饮料清除羟基自由基能力
Fig.2 Scavenging effects of the different concentrations of the functional compound polysaccharide beverage on ·OH
2.4 不同浓度的功能性复合多糖饮料对α-葡萄糖苷酶抑制能力影响分析
利用最优的条件生产功能性复合多糖饮料,如图3所示,多糖饮料与α-葡萄糖苷酶的抑制率之间存在明显的剂量依赖关系,抑制作用随着多糖饮料质量浓度的增加而升高。当多糖饮料质量浓度在2.41~9.63 mg/mL之间时,此时酶促反应处于混合反应阶段,抑制率随着多糖饮料浓度的增加呈现上升的关系;当多糖饮料质量浓度在9.63~38.50 mg/mL之间时,此时酶促反应处于零级反应阶段,抑制率趋于平稳。当多糖饮料的质量浓度为38.50 mg/mL时,α-葡萄糖苷酶的抑制率可达70.36%。由此可以得出多糖饮料对α-葡萄糖苷酶活性有很明显的抑制作用。
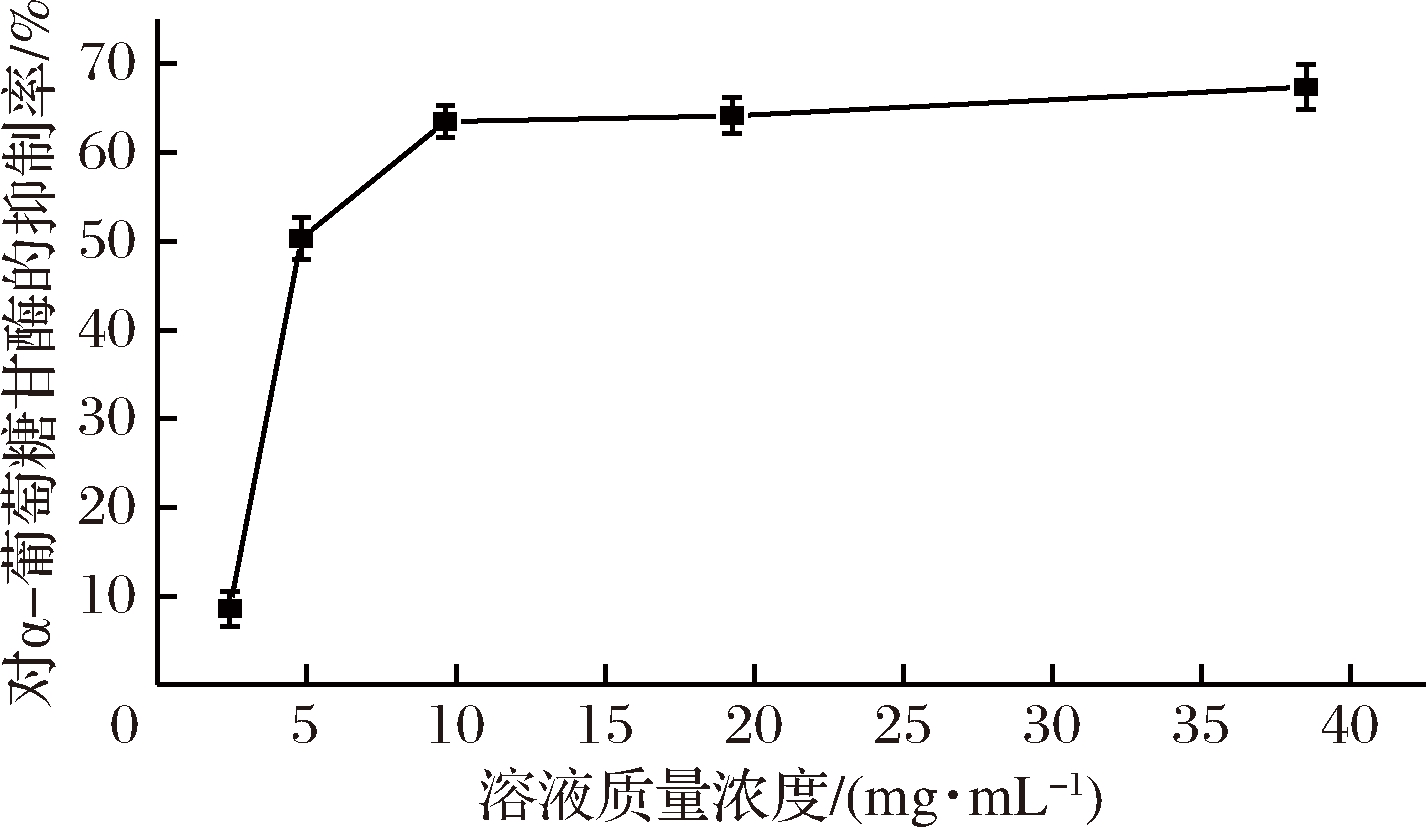
图3 不同质量浓度的功能性复合多糖饮料对α葡萄糖苷酶抑制率影响
Fig.3 Effects of different concentrations of the functional compound polysaccharide beverage on α-glucosidase inhibitory rate
2.5 功能性复合多糖饮料抗氧化和对α-葡萄糖苷酶抑制的IC50值
IC50是评价多糖饮料对DPPH自由基和羟基自由基清除能力、α-葡萄糖苷酶抑制力的重要指标,可作为筛选抗氧化和降糖活性的手段[23]。多糖饮料对DPPH自由基和羟基自由基清除能力、α-葡萄糖苷酶抑制能力都是随着浓度的增减而升高,呈剂量依赖型关系。功能性复合多糖饮料对DPPH自由基和羟基自由基清除、α-葡萄糖苷酶抑制的IC50值分别为0.506、24.494、9.280 mg/mL。
表6 满足95%置信区间的功能性复合多糖饮料抗氧化和对酶抑制的IC50 单位:mg/mL
Table 6 The IC50 of the functional compound polysaccharide beverage that meet the 95% confidence interval for inhibition of antioxidant and enzyme activity

种类预计值下限值上限值DPPH自由基0.5060.3610.693羟基自由基24.49420.17731.281α-葡萄糖苷酶9.2804.6612.857
3 结论与展望
本研究采用正交试验对功能性复合多糖饮料的配方进行优化,还检测了其体外抗氧化活性和体外降糖活性,得到的功能性复合多糖饮料色泽均匀、滋味协调、酸甜适宜,具有较好的稳定性、体外抗氧化活性和体外降糖活性。本研究不仅解决了目前市场上多糖饮料原料单一、口感和功能性差的问题,还进一步评价了复合多糖饮料的功能性,为功能性复合多糖饮料的开发提供了初步理论依据,提高了香椿、大麦、决明子、山药等深加工产品的利用程度,对功能性复合多糖饮料的开发及其精深加工研究具有重要意义。另外香椿、大麦、决明子、山药作为我国传统的药食两用植物,含有丰富的营养成分和功能活性成分,满足了现代人健康的生活需求。香椿、大麦、决明子、山药加工产业的发展提高了山区人民种植和生产的积极性,避免了资源的浪费,带动了农产品加工业和运输业等相关产业的发展,促进农民经济收入,对山区脱贫致富具有重要意义。
[1] 尹凡,赵嘉,侯子驰,等.多糖降血糖作用研究[J].生物化工,2019,5(2):143-145.
[2] 朱娇娇,周安婕,丁怡,等.3种天然植物多糖的抗氧化与降血糖活性研究[J].粮食与油脂,2018,31(8):96-100.
[3] TAO Y W.TIAN G Y.Studies on the physicochemical properties,structure and antitumor activity of polysaccharide Yh PS-1 from the root of Cordalis yanhusuo Wang[J].Chinese Journal of Chemistry,2006,24(2):235-239.
[4] 王希.大麦多糖的提取及其生物活性研究[D].镇江:江苏大学,2008.
[5] 王珊,尹涛,朱梅.长白山药用植物多糖抗氧化活性研究进展[J].吉林农业,2018(23):68-69.
[6] GE Y.DUAN Y F,FANG G Z,et al.Study on biological activities of Physalis alkekengi var francheti polysaccharide[J].J Sci Food Agric,2009,89(9):1 593-1 598.
[7] 韩瑨,吴正钧,高彩霞,等.功能性多糖饮料的研究进展[J].食品研究与开发,2015,36(8):115-119.
[8] 陈刚,杨玉珍,马晓.香椿化学成分与保健功能研究进展[J].北方园艺,2013(20):189-192.
[9] ZHANG W,LI C,YOU L J,et al.Structural identification of compounds from Toona sinensis leaves with antioxidant and anticancer activities[J].Journal of Functional Foods,2014,10:427-435.
[10] 王赵改,王晓敏,史冠莹,等.一种香椿发酵红茶制备方法:中国,CN105230894A[P].2015-11-18.
[11] TEMBHURNE S V,SAKARKAR D M.Anti-obesity and hypoglycemic effect of ethanolic extract of Murraya koenigii (L.) leaves in high fatty diet rats[J].Asian Pacific Journal of Tropical Disease,2012,2:S166-S168.
[12] 陈文若,陈银基,贠婷婷,等.大麦营养与功能组分研究进展[J].粮油食品科技,2017,25(1):1-5.
[13] CHEN Yifeng,ZHU Qin,WU Shengjun.Preparation of oligosaccha-rides from Chinese yam and their antioxidant activity[J].Food Chemistry,2014,173(2 015):1 107-1 110.
[14] 关倩倩,张文龙,杜方岭,等.山药多糖生物活性及作用机理研究进展[J].中国食物与营养,2018,24(3):11-14.
[15] 晋亚楠.决明子治疗糖尿病并发症的活性及氧化应激机制研究[D].重庆:西南大学,2012.
[16] 张静,温暖,刘阳洋,等.蒲公英根多糖提取及蒲公英多糖饮料的研制[J].农产品加工,2018(1):13-17.
[17] 吴舜,张桂娟,吕文博.龙牙楤木芽多糖提取与脱色工艺的研究[J].保鲜与加工,2016(6):80-86.
[18] ZHANG Lu,TU Zongcai,XIE Xing,et al.Antihyperglycemic,antioxidant activities of two Acerpalmatum cultivars,and identification of phenolics profile by UPLC-QTOF-MS/MS:new natural sources of functional constituents[J].Industrial Crops and Products,2016,89:522-532.
[19] DROGOUDI P,GERASOPOULOS D,KAFKALETOU M,et al.Phenotypic characterization of qualitative parameters and antioxidant contents in peach and nectarine fruit and changes after jam preparation[J].Journal of the Science of Food and Agriculture,2017,97(10):3 374-3 383.
[20] YANG X,KONG F.Evaluation of the in vitro α-glucosidase inhibitory activity of green tea polyphenols and different tea types[J].Journal of the Science of Food &Agriculture,2015,96(3):777-782.
[21] 徐雅雯.山药多糖的分离及山药复合饮料的研制[D].天津:天津科技大学,2013.
[22] 卓荣权,王春霞,黄琳,等.秋葵多糖饮料配方及其稳定性研究[J].食品研究与开发,2017,38(7):84-88.
[23] 闫唯,李佳,刘钰华,等.微波辅助提取西瓜番茄红素及其抗氧化活性研究[J].保鲜与加工,2017,17(6):56-60.