西门塔尔牛原产于瑞士阿尔卑斯山西北部的山谷地带,该品种产奶、产肉、役用与适应性能均较出众,由于遗传性强,许多国家都有引进西门塔尔牛在本国培育,并以该国国名命名[1]。中国西门塔尔牛因具有良好的适应性,近年来得到大面积推广与使用,已成为肉牛业的主导品种之一,市场需求量稳中有升,具有良好的行业前景。
肉牛宰后会发生一系列物理化学变化,主要包括肌肉僵直、成熟、自溶、腐败4个阶段[2]。其中达到僵直期的肌肉在进行加热时肉质变硬、保水性差,此阶段的肉不适宜用于烹调加工。当肌肉僵直达到最大程度并维持一段时间后,开始缓慢解僵,肌肉嫩度、保水能力及风味会得到较大改善[3],此时的肌肉进入宰后成熟期,处于僵直期和成熟期的畜肉均为新鲜肉。成熟期过后,肌肉进入自溶阶段,自溶为细菌的侵入、繁殖创造了条件,随后肌肉中的蛋白质、含氮物质分解,pH值上升,肌肉发生腐败变质,逐渐失去食用价值[4]。
排酸是提高牛肉品质的有效手段[5],排酸过程中肉类原料的品质变化机理也是当下的研究热点之一。排酸牛肉又称冷却排酸牛肉,低温排酸(0~4 ℃)可使牛肉经历较为充分的解僵和成熟过程,既可保证肉质细嫩、鲜美,又能有效抑制微生物的生长繁殖,是生产高品质、低风险牛肉的重要工艺[6]。本试验对排酸期间的西门塔尔牛背最长肌的部分新鲜度指标与品质指标进行了测定,探究了排酸期间牛肉的品质变化规律,同时根据其品质变化情况选择牛肉适宜的烹煮时机,以期为高品质牛肉的生产与后期的烹煮加工提供全面的参考依据。
1 材料与方法
1.1 材料与试剂
采集6头12月龄,饲养条件一致的中国西门塔尔公牛,由无锡天鹏集团有限公司提供,宰前禁食禁水。
硫酸铜、硫酸钾、浓硫酸、硼酸、无水乙醇、乙醚、石油醚、浓盐酸均为分析纯,国药集团化学试剂有限公司;2-硫代巴比妥酸为分析纯,美国Sigma公司。
1.2 仪器与设备
BS210S(1/10000)分析天平,北京赛多利斯仪器系统有限公司;HH-S6型数显恒温水浴锅,江苏金坛市科析仪器有限公司;BPH-9082精密恒温培养箱,上海巴玖实业有限公司;721型紫外可见分光光度计,上海佑科仪器仪表有限公司;DSC 204 F1 phoenix®型差示扫描量热仪,德国耐驰公司;C-LM2型肌肉嫩度仪,北京朋利驰科技有限公司;K1100F型全自动凯氏定氮仪,上海固呈科学仪器有限公司;HTG型立式鼓风干燥箱,上海精密仪器有限公司;RH-1000型肉品系水力测定仪,广州润湖仪器有限公司。
1.3 试验方法
1.3.1 样品处理
按照GB/T 19477—2018《畜禽屠宰操作规程》进行屠宰[7],在胴体12~13肋骨处取背最长肌肉样,置4 ℃排酸库中进行排酸处理,记录时间,在排酸12、24、48、72、120、168 h进行取样测定。
1.3.2 细菌总数测定
参照GB 4789.2—2016进行菌落总数的测定[8],取25 g排酸牛肉样品,加入225 mL无菌生理盐水进行均质,以10倍稀释度将牛肉浆稀释,取3个浓度合适的稀释液0.1 mL,涂布于营养琼脂培养基表面,每个稀释液涂布3个平皿,于37 ℃恒温培养箱中培养2 h。
1.3.3 TVB-N值测定
参照GB 5009.228—2016进行排酸牛肉样品的挥发性盐基氮测定[9]。
1.3.4 TBARS值测定
取不同排酸时间的牛肉样品10.0 g,切碎,加50 mL蒸馏水,浸泡2 min后用47.5 mL水冲洗移入蒸馏烧瓶中,加2.5 mL 4 mol/L的盐酸,调节pH至1.5,加入少量消泡剂和玻璃珠,加热蒸馏。沸腾10 min后开始收集50 mL蒸馏物,用移液管移取5 mL于具塞反应管中,加入5 mL 2-硫代巴比妥酸,封口,振荡并置于沸水中35 min。用5 mL蒸馏水作对照。然后将反应管于冷水中冷却10 min,测定其在538 nm处的吸光度(OD)。用公式(1)计算TBARS值。
TBARS值(mg丙二醛/kg样品)=7.8×OD538 nm
(1)
1.3.5 剪切力测定
选用国产C-LM2型肌肉嫩度仪进行测定。取不同排酸时间牛肉,除去肉样表面脂肪、筋腱和膜。然后打开塑料薄膜包装袋,将热电偶插入肉样中心处,包扎好肉样,保持袋口向上,放入80 ℃恒温水浴锅中,加盖持续加热至肉样中心处温度达71 ℃。取出肉样,冷却至室温后用直径1.27 cm的圆形取样器沿与肌纤维平行的方向钻取肉样(避开筋腱),孔样长度不少于2.5 cm,取样位置距离样品边缘不少于5 mm,2个取样的边缘间距不少于5 mm,剔除有明显缺陷孔样,测定样品数量不少于3个。
1.3.6 肌原纤维小片化指数测定
参照CULLER等[10]的方法,并稍作修改。将肉样除去可见脂肪和结缔组织后剪碎,准确称取4.0 g肉样,加入40 mL预冷的(2 ℃)MFI缓冲液(100 mmol/L KCl、20 mmol/L K3PO4、1 mmol/L EDTA、1 mmol/L MgCl2、1 mmol/L NaN3,pH 7.0)进行裂解,高速匀浆3次(4 ℃,每隔l min匀浆20秒);冷冻离心(4 ℃,1 000 g,15 min),弃去上层清液,沉淀用40 mL预冷的MFI缓冲液悬浮,再冷冻离心(4 ℃,1 000 g,15 min),去上层清液,将沉淀用10 mL预冷的MFI缓冲液充分悬浮,后使用150目滤布过滤除去结缔组织碎片,再用10 mL预冷的MFI缓冲液冲洗试管,进行过滤,2次滤液混匀后即为肌原纤维提取液。采用双缩脲法测定肌原纤维提取液的蛋白质浓度。然后采用MFI缓冲液将悬浮液蛋白质质量浓度调整为0.5 mg/mL,在540 nm处测吸光度MFI值的测定见公式(2)。
MFI值=OD540nm×200
(2)
1.3.7 加压失水率测定
取背最长肌肉样,肉块长×宽×高不少于5 cm×5 cm×1 cm(厚度方向为肌纤维方向),平置于洁净的塑料板上,用直径为2.523 cm的圆形取样器,切取中心部分背最长肌肉样一块,立即用感应量为0.01 g的天平称重,在肉样上、下方各覆盖一层医用纱布,纱布外面各垫48层吸水性好的普通卫生纸或18层化学定性分析滤纸。滤纸外再各垫一片硬质塑料板,将垫好的肉样置于系水力测定仪的平台上,缓慢匀速摇动压力仪的摇把,使压力仪百分表上显示出相当于35 kg的读数,并保持此压力5 min,撤去压力后立即称重,压失水率见公式(3)。
加压失水率![]()
(3)
式中:Wa,加压前肉重;Wb,加压后肉重。
1.3.8 僵直指数测定
参照BITO等[11]测定鱼肉僵直指数的方法,将其运用到牛肉中,顺着牛肉肌纤维方向取一定长度背最长肌肉样,置于水平板上,测出牛肉长度的中点,使牛肉的前1/2置于水平板上,后1/2自然下垂,测定其尾端与水平板构成的最初下垂距离(L0)和在不同排酸时期的距离(Lt),用公式(4)计算僵直指数(R)。重复10次,结果以平均值±标准差表示。
(4)
1.3.9 蛋白质热性质测定
用差示扫描量热法(differential scanning calorimeter,DSC)对排酸牛肉蛋白质的热变性情况进行分析。仪器先用铟校准,然后称取15~20 mg肉样于铝质样品盘中,密封后放置于样品舱中,加热温度从20 ℃上升至100 ℃,温度上升速度为10 ℃/min,在初始温度20 ℃处平衡2 min。以空的铝质盘作为对照。用软件Universal Analysis 2000分析蛋白质的热力学参数:Tp(最大变性温度)和ΔH(变性焓值)。每个样品至少进行3次重复。
1.4 数据处理与分析
所有数据用平均值±标准差表示。采用Microsoft Office Excel 2003制表和绘图,采用SPSS 19.0全因子模型对测定结果进行显著性分析。差异显著水平α为0.05。
2 结果与分析
2.1 牛肉的细菌总数
对于在4 ℃环境中排酸的牛肉来说,微生物增长是导致其腐败变质的主要原因[12]。由图1可知,排酸时间对牛肉中微生物的增长有显著影响(P<0.05),细菌总数随排酸时间的延长呈逐渐上升趋势。排酸初期(12~24 h)牛肉中的细菌总数增幅较小,并无明显差异(P>0.05),主要由于环境的改变,微生物处于生长迟滞期。排酸24 h后的牛肉细菌总数增幅明显(P<0.05),此时的微生物进入对数生长期。同时也可以推测,排酸12~24 h的牛肉可能处于僵直急速形成期,肌肉pH较低,不利于微生物的生长,而排酸24 h后的牛肉僵直逐渐解除,肌肉pH不断升高,微生物开始迅速繁殖。国家标准规定新鲜肉的细菌总数不超过1×106 CFU/g,而排酸至168 h时的牛肉中细落总数为6.2×105 CFU/g,未超出肉品新鲜度标准,仍符合食用要求。
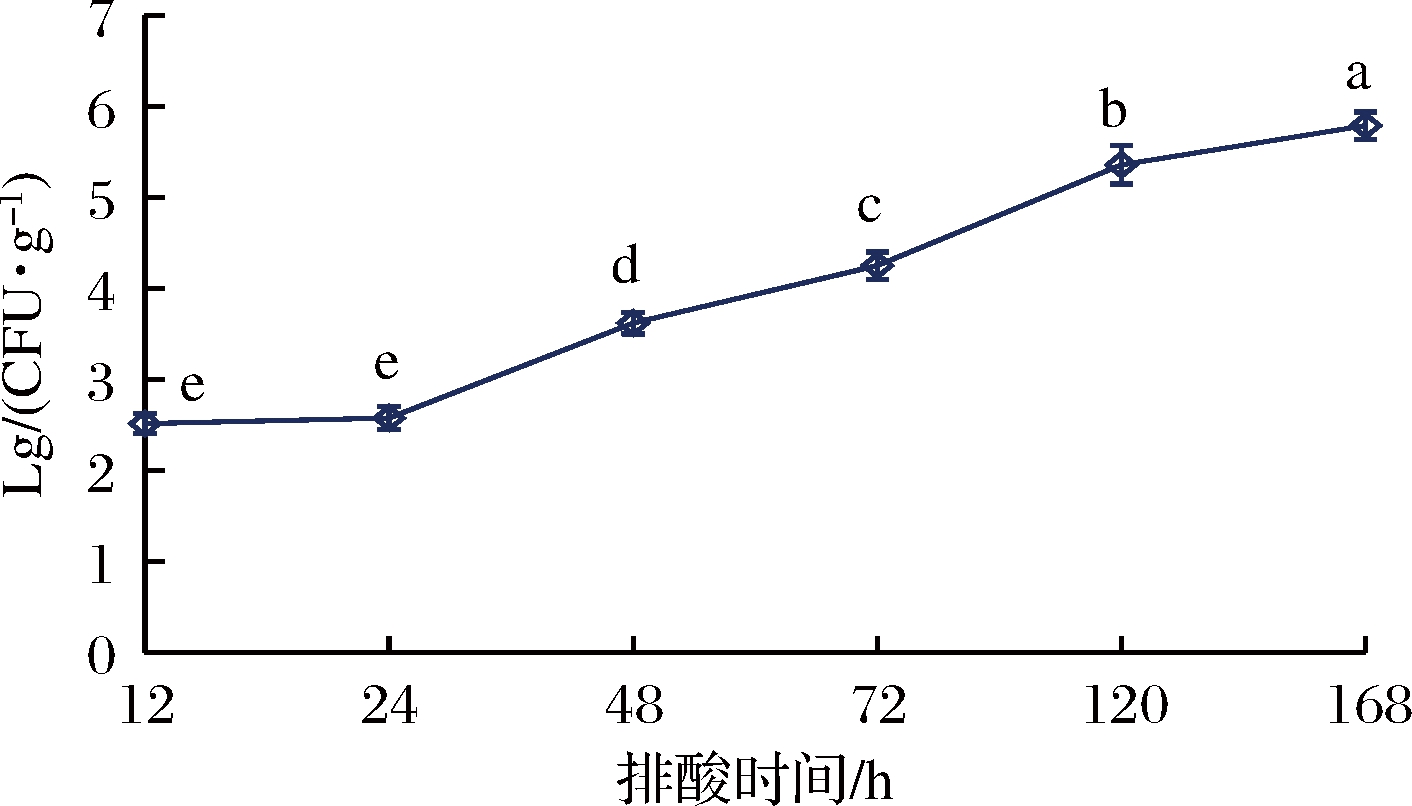
图1 排酸过程中牛肉细菌总数的变化
Fig.1 Changes of total number of beef bacteria during aging
注:标注字母不同者表示差异显著(P<0.05),下同。
2.2 牛肉的TVB-N值
挥发性盐基氮值是肉类由于肌肉内源酶或外界微生物的感染而繁殖分泌酶所引起的脱胺、脱羧等作用,使蛋白质分解产生氨及胺类等碱性含氮物质,其含量高低可用于判断肉类的新鲜程度[13]。TVB-N值越大,表示由蛋白质分解产生的碱性含氮物质越多,肉的新鲜度越低[14]。由图2可知,随着排酸时间的延长,牛肉的TVB-N值呈逐渐上升趋势,且差异显著(P<0.05)。排酸初期,即12 ~24 h范围内的牛肉TVB-N值无明显变化(P>0.05)。排酸24 h后牛肉的TVB-N值增幅明显(P<0.05),样品中的微生物处于对数生长期,代谢旺盛、酶系活跃,分解蛋白质的能力逐渐加强,蛋白质分解产生的碱性含氮物质不断累积,表现出TVB-N值的不断上升。国家标准规定的肉类新鲜度对应的TVB-N值为:鲜肉≤15 mg/100 g,次鲜肉15~20 mg/100 g,变质肉>20 mg/100 g。排酸168 h时,牛肉的TVB-N值上升至15.52 mg/100 g,但只稍超出次鲜度范围,依旧保持新鲜可食状态。
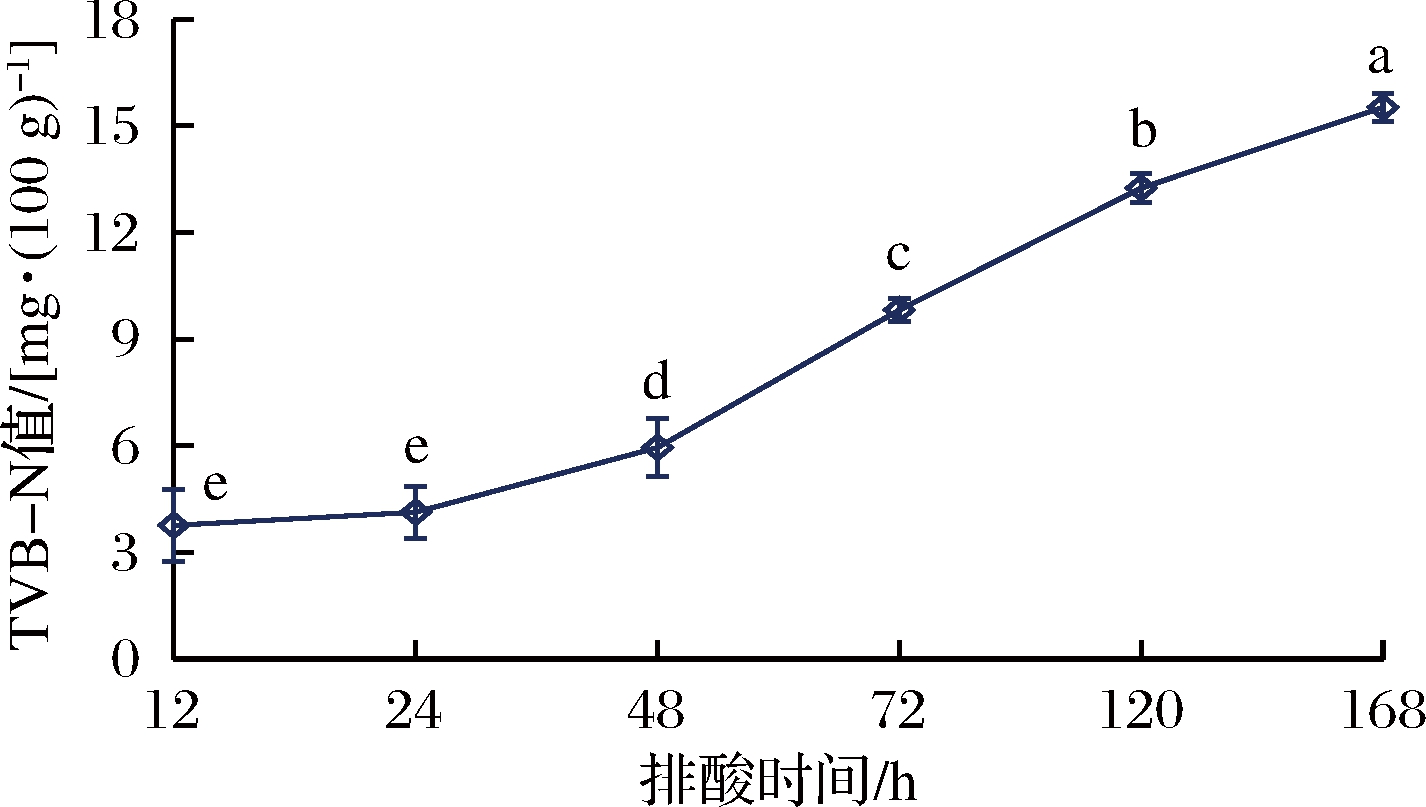
图2 排酸过程中牛肉的TVB-N值变化
Fig.2 Changes of TVB-N value of beef during aging
2.3 牛肉的TBARS值
脂肪氧化是引起肉品质发生腐败变质的主要因素之一,且会降低肉的耐贮藏性[15]。硫代巴比妥酸值是判断肉类食品脂肪氧化程度的有效指标,TBARS值越高,表明脂肪氧化程度越高,肉的腐败程度越大[16]。如图3所示,排酸12~48 h内,牛肉的TBARS值升幅明显(P<0.05),排酸72 h与排酸48 h牛肉的TBARS值无显著差异(P>0.05),伴随着排酸时间的继续延长,牛肉脂肪的氧化速度增加明显,这也与排酸后期微生物生长迅速有关,此时有部分微生物分泌出的脂肪酶加速了肌肉脂肪的水解,提高了脂肪氧化程度。通常认为新鲜肉品的最大TBARS值在0.7~1.0 mg/kg之间,当肌肉的TBARS值处于0.20~0.66 mg/kg时为新鲜肉,超过1.0 mg/kg则为已被严重氧化的变质肉,不再具备可食用性[17]。由图3可知,当排酸时间达168 h,牛肉的TBARS值虽上升至0.57 mg/kg,但仍处于新鲜肉的范畴。
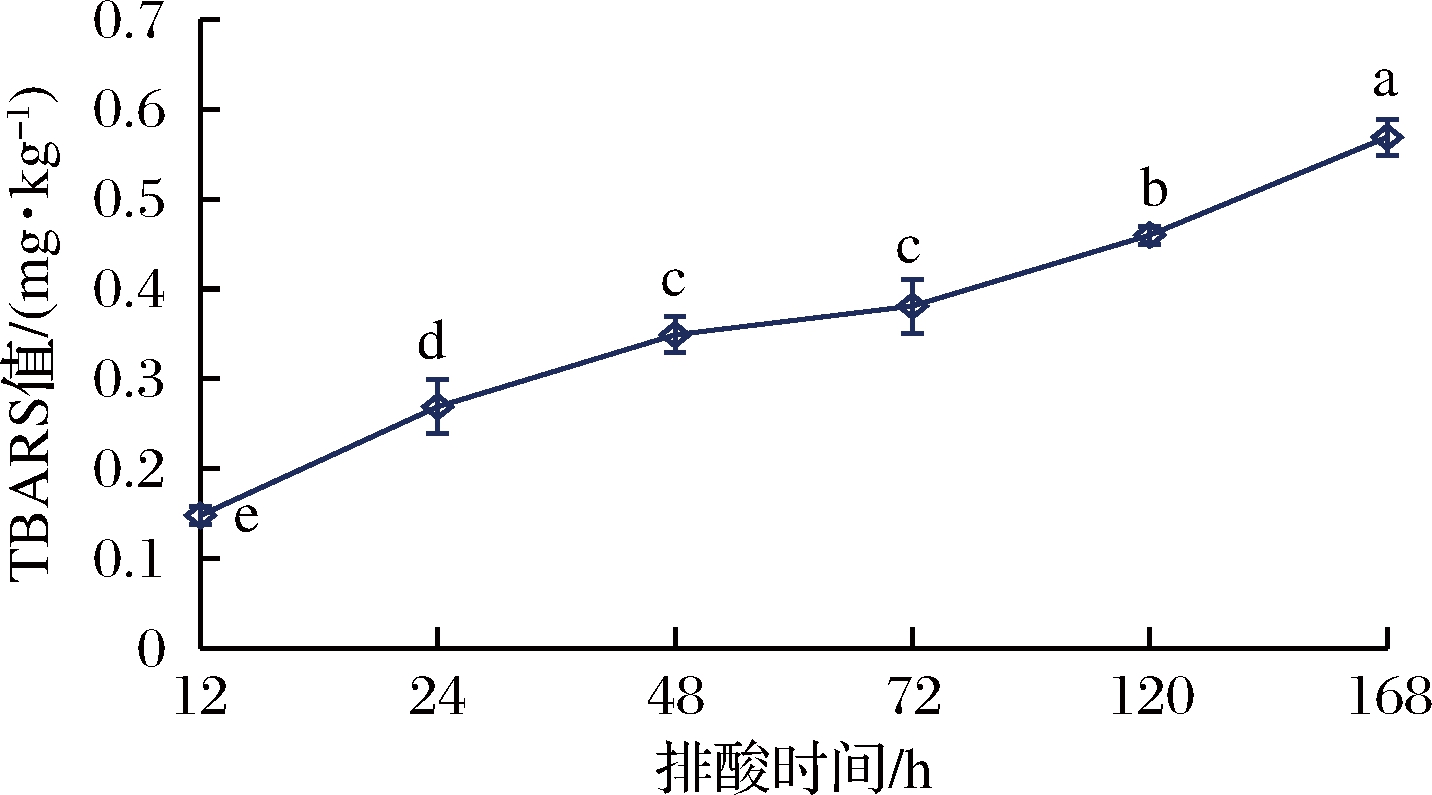
图3 排酸过程中牛肉TBARS值的变化
Fig.3 Changes of TBARS value of beef during aging
2.4 牛肉的剪切力和MFI值
嫩度是评价肉品质量高低的重要指标之一[18],也是消费者评判肉质的最常用指标。牛肉嫩度主要由肌肉中结缔组织含量、肌浆蛋白含量、肌纤维直径与大理石纹理结构所决定[19]。剪切力大小可有效反映肉品的嫩度好坏,是评价牛肉嫩度的客观指标。由表1可知,排酸时间对牛肉的剪切力有显著影响(P<0.05),随着排酸时间的延长,牛肉的剪切力值总体呈先增加后减小趋势。牛肉的剪切力在排酸24 h时迅速增加至最大值96.22 N,推测此时的牛肉进入僵直期,由于肌肉中的ATP含量急剧下降,肌肉的伸缩性较差,肉质变硬导致。随着排酸过程的继续,排酸168 h牛肉的剪切力值仅占排酸24 h牛肉的56.6%,也远低于刚屠宰后牛肉的剪切力,可见排酸处理可有效改善牛肉嫩度,且排酸时间越长,嫩度的改善程度越明显。
表1 排酸过程中牛肉剪切力和MFI值的变化
Table 1 Changes of shearing force and MFI value of beef during aging

排酸时间/h剪切力/NMFI值1271.10±0.37c49.11±0.99f2496.22±4.56a59.36±0.70e4877.69±3.25b67.31±1.03d7269.68±1.45c75.78±0.82c12063.41±1.77cd79.81±0.68b16854.47±2.11d81.61±0.51a
注:同列标注字母不同者表示差异显著(P<0.05)。下同。
肌原纤维小片化指数反映了肌原纤维蛋白降解及其结构被破坏的程度。排酸过程中肌原纤维蛋白和细胞骨架蛋白的降解对于肌肉的嫩化起重要作用,MFI增大,肌肉嫩度提高[20]。由表1可知,牛肉MFI值在排酸12~72 h内显著增大(P<0.05),在排酸72~168 h内虽有显著性增大,但数值逐渐趋于稳定。相比排酸12 h时的49.11,排酸168 h牛肉的MFI值增加到了81.61,结果充分显示,排酸显著影响了牛肉的肌原纤维小片化程度,这在排酸早期的变化最为明显。已有大量研究表明,MFI值越高,肌肉嫩度越好[21-22],而排酸72~168 h的牛肉MFI值较之前均有显著增加(P<0.05),肌肉嫩度得到极大改善。因此,结合剪切力的有利变化,可选择排酸72~168 h作为牛肉较优的烹煮时机。
2.5 牛肉的保水性能
加压失水率是衡量肉品保水性能的主要指标之一。由图4可知,排酸时间对牛肉的加压失水率有显著影响(P<0.05)。牛肉的加压失水率随着排酸时间的延长总体呈先升高后降低趋势,排酸24 h牛肉的失水率达最大值26.62%,与排酸12 h的牛肉有显著差异(P<0.05)。随着排酸过程的继续,牛肉的失水率逐渐减小,排酸48 h牛肉的失水率降至22.26%。排酸72 h牛肉的失水率降低明显,排酸120 h牛肉的失水率则继续降低至最小值12.81%,与成熟168 h的牛肉有差异性,但不显著(P>0.05)。综合看来,牛肉的加压失水率随排酸时间的延长总体呈先升高后降低趋势,在排酸72~168 h加压失水率较低,表现为保水性能的提升,已知肌肉保水能力越强,牛肉品质越好[23]。因此,可选择排酸72~168 h作为牛肉较优的烹煮时机。
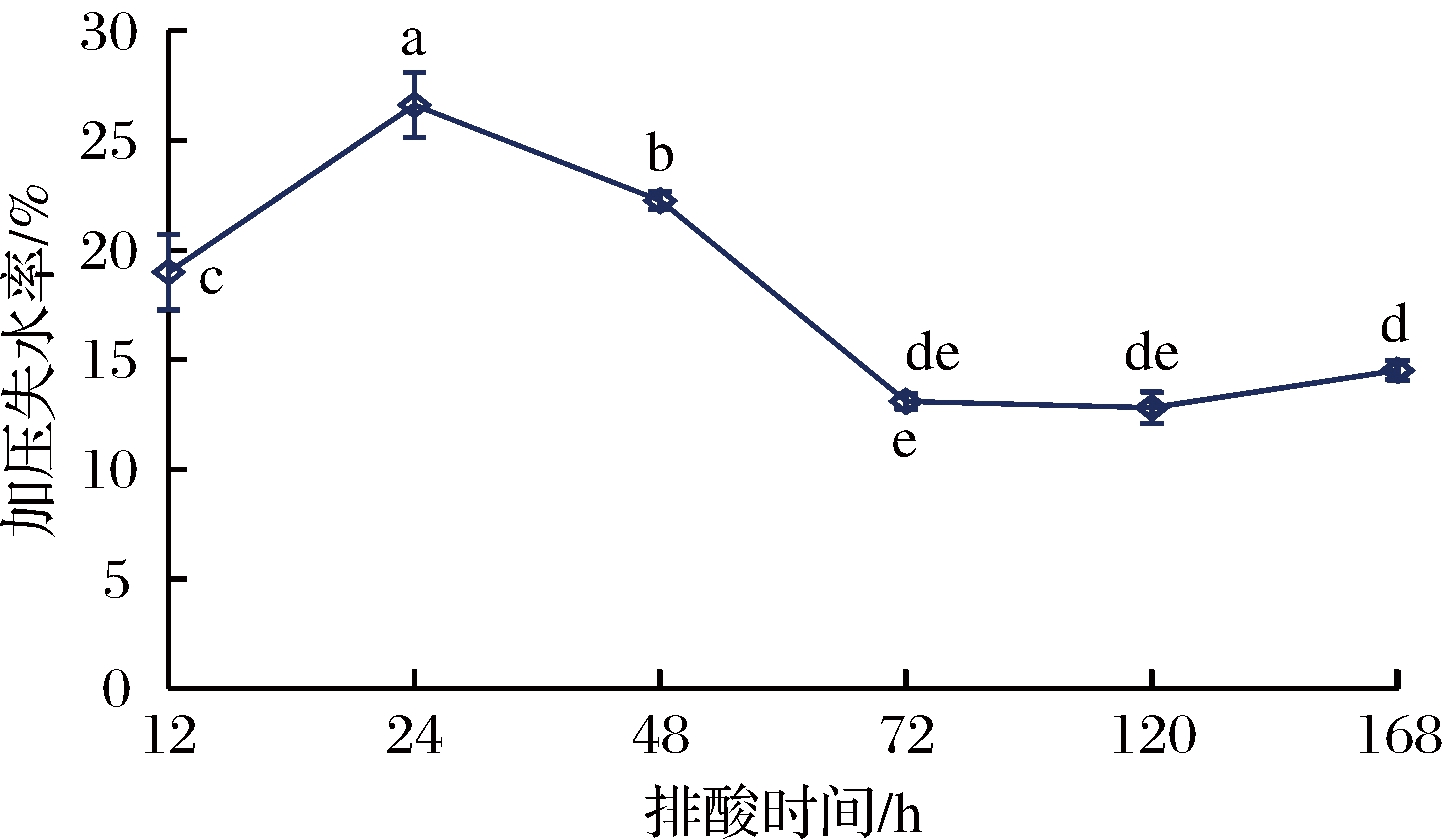
图4 排酸过程中牛肉加压失水率的变化
Fig.4 Changes of pressurized water loss rate value of beef during aging
2.6 牛肉的僵直指数
僵直是动物宰后肌肉向可食用肉质转变过程中发生的最强烈变化之一,即肌肉在某个排酸阶段会发生连续且不可逆的收缩,逐步失去弹性与延展性,当收缩至最大限度时便形成了肌肉的僵直[24]。僵直指数可直观反映肉牛宰后的僵直状况。由图5可知,排酸时间对牛肉的僵直指数有显著影响(P<0.05),排酸12 h时牛肉的僵直指数为14.58%,在排酸24 h时迅速上升至最大值30.83%,结果充分表明此阶段为牛肉的僵直迟滞期[25],肌肉中的ATP含量虽减少,但降幅较小,肌动球蛋白仍可解离成肌球蛋白和肌动蛋白,使得肌肉仍保持一定的伸缩性与弹性[25]。而排酸12~24 h则为牛肉的僵直急速形成期,此阶段牛肉的僵直指数上升明显(P<0.05),肌肉中贮存的ATP逐渐消耗殆尽,大量肌动蛋白和肌球蛋白迅速结合形成肌动球蛋白,且无法再解离,肌肉的伸缩性逐渐丧失[26]。排酸24 h时,牛肉的僵直指数达最大值,此时肌糖原不再继续分解产生ATP,肌肉伸展性彻底消失,这与WHEELER等[27]研究结果一致。随着排酸过程的继续,牛肉的僵直指数于排酸72 h降至1.04%,此后趋于稳定。排酸72~168 h的牛肉僵直指数较之前均有大幅下降,肌肉恢复舒张松弛状态,对肌肉保水性、嫩度和风味均有明显的改善作用。因此,可选择排酸72~168 h作为牛肉较优的烹煮时机。
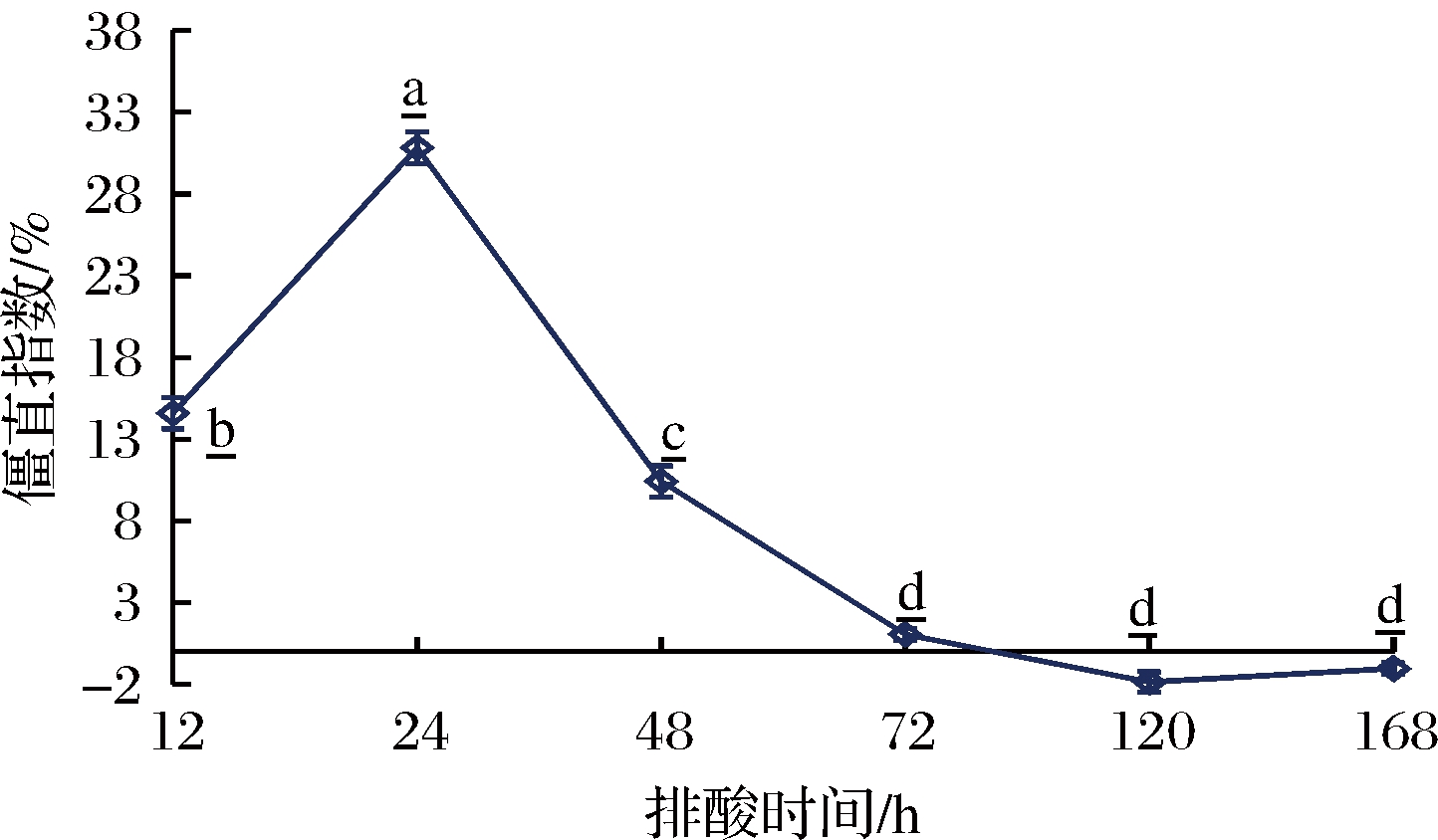
图5 排酸期间牛肉僵直指数的变化
Fig.5 Changes of stiffness Index of beef during aging
2.7 牛肉蛋白质热性质
DSC技术是测定肌肉蛋白质热性质的一种有效手段。蛋白质在受热变性过程中,多肽链展开,分子内相互作用被破坏,该过程需要吸收能量,而吸收热量是一个由有序状态变为无序状态的过程[28]。当达到蛋白质的变性温度时,热分析图谱上会出现吸热峰,由峰值温度、峰面积可确定蛋白质的变性温度、变性热焓等参数[29]。由图6可知,排酸期间牛肉蛋白质的热变性主要表现为2个吸热峰,已有研究表明,由低温区到高温区依次为:峰I代表肌球蛋白及其亚基引起的热流峰,峰II代表肌动蛋白引起的热流峰[30]。
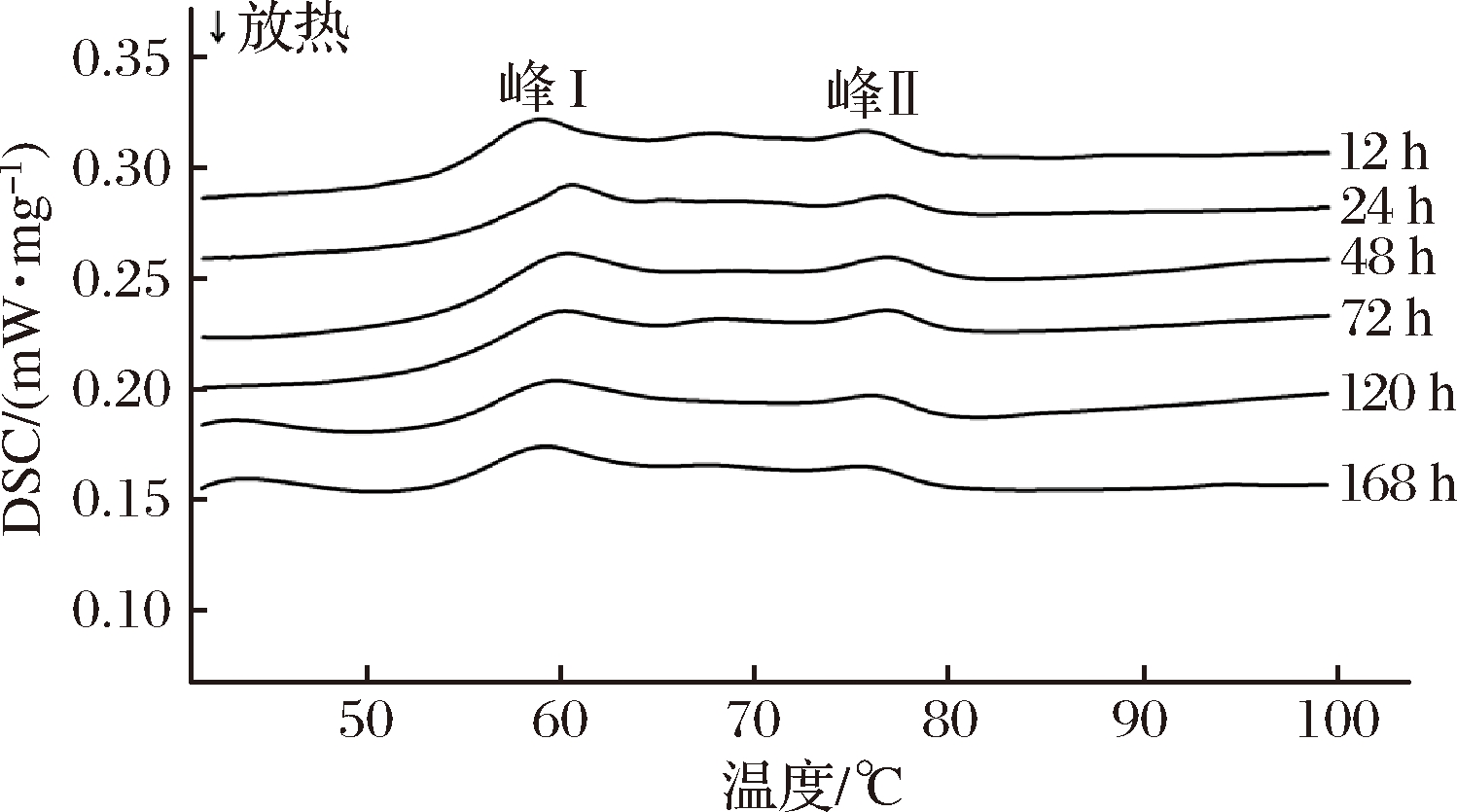
图6 排酸期间牛肉蛋白质的DSC曲线
Fig.6 DSC curve of beef protein during aging
已有研究表明,肉类蛋白质中的肌球蛋白及其亚基典型的热变性温度范围是38~67 ℃,肌动蛋白为70~81 ℃[31],与本文结果相符。由表2可知,排酸时间对牛肉肌球蛋白的变性温度有显著影响(P<0.05),排酸24 h时牛肉肌球蛋白的变性温度达最大值60.7 ℃,主要因为此时牛肉中的肌动蛋白和肌球蛋白大量迅速地结合形成肌动球蛋白,且难以解离,导致肌球蛋白的热稳定性迅速提高[32]。随着排酸时间的继续延长,肌球蛋白的热变性温度不断下降,显示热稳定性的降低。肌动蛋白的变性温度随着成熟时间的延长无明显变化(P>0.05),肌球蛋白和肌动蛋白的变性温度变化的极值分别为2.20 ℃和0.80 ℃,进一步显示相对于肌球蛋白,肌动蛋白的热稳定性更高。牛肉的肌球蛋白与肌动蛋白在排酸24 h时吸热变性所需热焓值均达最高,随后有明显下降(P<0.05),主要因为随着排酸过程的继续,肌肉中的钙激活酶对部分关键肌原纤维蛋白如伴肌球蛋白、伴肌动蛋白及肌间线蛋白等降解作用导致肌球蛋白与肌动蛋白分子间氢键被破坏,使热焓值逐渐降低[32]。随着排酸时间的延长,肌肉蛋白质的热稳定性逐渐降低,更易受热变性,暗示选择利用排酸后期的牛肉进行烹煮可有效缩短加热时间和节约能源。因此,可选择排酸72~168 h作为牛肉较优的烹调时机。
表2 排酸期间牛肉蛋白变性温度(Tp)及其热焓值(ΔH)
Table 2 Beef protein denaturation temperature and enthalpy during aging
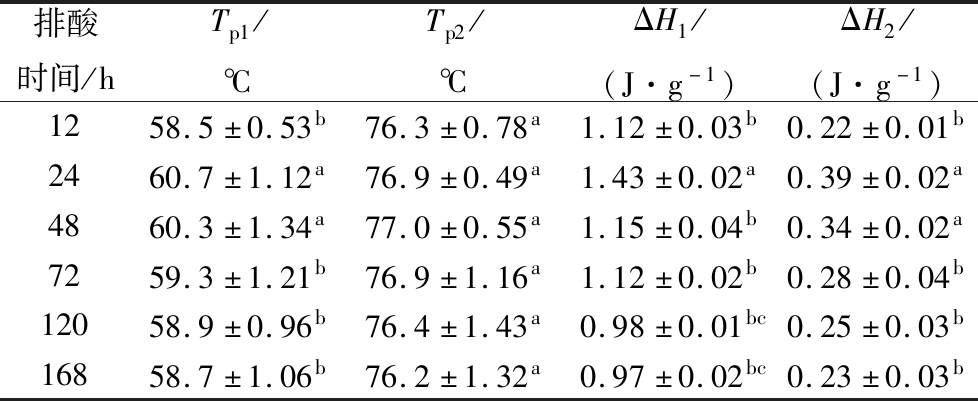
排酸时间/hTp1/℃Tp2/℃ΔH1/(J·g-1)ΔH2/(J·g-1)1258.5±0.53b76.3±0.78a1.12±0.03b0.22±0.01b2460.7±1.12a76.9±0.49a1.43±0.02a0.39±0.02a4860.3±1.34a77.0±0.55a1.15±0.04b0.34±0.02a7259.3±1.21b76.9±1.16a1.12±0.02b0.28±0.04b12058.9±0.96b76.4±1.43a0.98±0.01bc0.25±0.03b16858.7±1.06b76.2±1.32a0.97±0.02bc0.23±0.03b
3 结论
中国西门塔尔牛背最长肌在4 ℃条件下排酸至168 h,其细菌总数、TVB-N值和TBARS值仍在新鲜肉的数值范围内,依旧新鲜可食。随着排酸时间的延长,牛肉的剪切力值呈逐渐降低趋势,MFI值对应呈升高趋势,且均在排酸72 h时发生明显变化,此后牛肉的嫩度均得到了有效改善。同时,牛肉的加压失水率、僵直指数和蛋白质热稳定性均在排酸72、120、168 h有明显降低,此阶段的肌肉恢复到了舒张松弛状态、保水性更好、蛋白质更易受热变性。因此,综合以上品质指标的有利变化,推荐排酸72~168 h作为牛肉较优的烹煮时机是具有现实意义的。
[1] 牛蕾.中国西门塔尔牛肉品质评定及其近红外快速检测方法研究[D].保定:河北农业大学,2011.
[2] 岳喜庆.畜产食品加工学[M].北京:中国轻工业出版社,2014.
[3] JAM P,FJSG C,AMR R,et al.Contribution of major structural changes in myofibrils to rabbit meat tenderization during aging[J].Meat Science,2002,61:103-113.
[4] KULKARNI S,DESANTOS F A,KATTAMURI S,et al.Effect of grape seed extract on oxidative,color and sensory stability of a pre-cooked,frozen,re-heated beef sausage model system[J].Meat Science,2011,88(1):139-144.
[5] KRISTENSEN L,PURSLOW P P.The effect of aging on the water holding capacity of pork:role of cytoskeletal proteins[J].Meat Science,2001,58(1):17-23.
[6] 张成龙,李锐,樊永亮,等.不同品种及排酸成熟时间对南方黄牛嫩度的影响[J].中国牛业科学,2015,41(4):21-23.
[7] 国家质量监督检验检疫总局,国家标准化管理委员会.GB/T 19477—2018牛屠宰操作规程[S].北京:中国标准出版社,2018.
[8] 卫生部.GB 4789.2—2016,食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2016.
[9] 国家卫生和计划生育委员会.GB 5009.228—2016,食品中挥发性盐基氮的测定[S].北京:中国标准出版社,2016.
[10] CULLER R A,PARRISH F C,SMITH G C,et al.Relationship of MFI to certain chemical,physical,and sensory characteristics of bovine LD muscle[J].Journal of Food Science,1978,43:1 177-1 180.
[11] BITO M,YAMADA K,MIKUMO Y,et al.Difference in the mode of rigor mortis among some varieties of fish by modified cuttings method[J].Bulletin of the Tokai Regional Fisheries Research Laboratory,1983,109:89-93.
[12] ERCOLINI O,RUSSO F,NASI A,et al.Mesophilic and psychrotrophic bacteria from meat and their spoiling potential in vitro and in beef[J].Applied and Environmental Microbiology,2009,75(7):1 990-2 001.
[13] 田甲春,韩玲,刘昕,等.牦牛肉宰后成熟机理与肉用品质研究[J].农业机械学报,2012,43(12):146-150.
[14] LI T,LI J,HU W,et al.Quality enhancement in refrigerated red drum (Sciaenops ocellatus) fillets using chitosan coatings containing natural preservatives[J].Food Chemistry,2013,138(2-3):821-826.
[15] CONTINI C, LVAREZ R,O′SULLIVAN M,et al.Effect of an active packaging with citrus extract on lipid oxidation and sensory quality of cooked turkey meat[J].Meat Science,2014,96:1 171-1 176.
LVAREZ R,O′SULLIVAN M,et al.Effect of an active packaging with citrus extract on lipid oxidation and sensory quality of cooked turkey meat[J].Meat Science,2014,96:1 171-1 176.
[16] 焦玉,薛党辰,蒋云升,等.发酵肉制品中的细菌发酵剂的研究进展[J].中国食物与营养,2007(6):21-23.
[17] 李飞燕,梁荣蓉,张一敏,等.冷却牛肉贮藏过程中的品质变化[J].食品与发酵工业,2011,37(3):182-186.
[18] 张秋会,赵改名,李苗云,等.肉制品的食用品质及其评价[J].肉类研究,2011,25(5):58-61.
[19] 余梅,毛华明,黄必志.牛肉品质的评定指标及影响牛肉品质的因素[J].中国畜牧兽医,2007,34(2):33-35.
[20] LONERGAN E H,ZHANG W,LONERGAN S M.Biochemistry of postmortem muscle-Lessons on mechanisms of meat tenderization[J].Meat Science,2010,86(1):184-195.
[21] VOLPELLI L A,FAILLA S,SEPULCRI A.Calpain system in vitro activity and myofibril fragmentation index in fallow deer (Dama dama):effects of age and supplementary feeding[J].Meat Science,2005,69(3):579-582.
[22] VOLPELLI L A,VALUSSO R,MORGANTE M.Meat quality in male fallow deer (Dama dama):effects of age and supplementary feeding[J].Meat Science,2003,65(1):555-562.
[23] 于家丰,刘显军,边连全.不同品种及其杂交组合育肥猪肉pH值和滴水损失的比较研究[J].当代畜牧,2006,2:46-48.
[24] 贾小翠.禁食对鸡肉宰后僵直及其品质影响研究[D].南京:南京农业大学,2011.
[25] ABERLE E D,FORREST J C,GERRARD D E,et al.Principles of meat science[M],2001,Dubuque,IA,USA:Kendall/Hunt Co.
[26] HANNULA T,PUOLANNE E.The effect of cooling rate on beef tenderness:The significance of pH at 7 ℃[J].Meat Science,2004,67(3):403-408.
[27] WHEELER T L,KOOHMARAIE M.The extent of proteolysis is independent of sarcomere length in lamb longissimus and psoas major[J].Journal of Animal Science,1999,77:2 444-2 451.
[28] 汪媛,张立彦,齐宏超.NaCl及温度对猪肉脱水过程中蛋白质性质的影响[J].肉类研究,2018,32(7):1-6.
[29] 黄晓毅,韩剑众,王彦波,等.差示扫描量热技术(DSC)在肉类研究中的应用进展[J].食品工业科技,2009,30(9):353-357.
[30] DENG Y,ROSENVOLD K,KARLSSON A H,et al.Relationship between thermal denaturation of porcine muscle protein and water-holding capacity [J].Journal of Food Science,2002,67(5):1 642-1 647.
[31] SUPAVITITPATANA T,APICHARTSRANGKOON A.Combination effects of ultra-high pressure and temperature on the physical andthermal properties of ostrich meat sausage[J].Meat Science,2007,76(3):555-560.
[32] KOOHMARAIE M,GEESINK G H.Contribution of postmortem muscle biochemistry to the delivery of consistent meat quality with particular focus on the calpain system[J].Meat Science,2006,74(1):34-43.