氨基甲酸乙酯(ethyl carbonate,EC)是食品在发酵工艺中形成的天然副产物,主要存在于面包、酸奶、酿造酱油、食醋、豆豉等发酵食品中[1]。由于发酵食品中基本含有氨甲酰类物质,该类物质发生醇解反应时则生成氨基甲酸乙酯[2-3]。研究表明,氨基甲酸乙酯可诱发体细胞染色体改性,致使基因突变[4-8];同时氨基甲酸乙酯属于多位点致癌物质,若长期摄入,可诱发多系列癌症,如肝癌、肺癌、淋巴癌、皮肤癌等[9-12]。2007年,氨基甲酸乙酯的致癌等级被确认为2A级[13]。因此为监测面包中氨基甲酸乙酯含量,开发快速、高效、稳定、灵敏度高的面包中氨基甲酸乙酯含量检测方法具有重要意义。
目前氨基甲酸乙酯的检测方法主要有气相色谱法[14-15]、气相色谱质谱法(gas chromatograph-mass spectrometry,GC-MS)[16-19]、液相色谱串联质谱法(high performance liquid chromatography-mass spectrometry/mass spectrometry,HPLC-MS/MS)[20]、气相色谱串联质谱法(gas chromatography-mass spectrometry/mass spectrometry,GC-MS/MS)[21]等。由于面包基质较为复杂,富含蛋白质、油脂等,氨基甲酸乙酯本身分子量小,单一色谱法灵敏度相对较低、定性功能较差,易受杂质干扰,若发现阳性样品还需色谱-质谱联用技术进行确认。GC-MS法是目前最常用的检测方法,国家标准也采用该方法实现对食品中氨基甲酸乙酯的测定,但是该方法基质干扰大、选择性较差[16-19];GC-MS/MS法通过采集离子对的方式,较GC-MS法选择性显著增强,灵敏度较高[21]。常见的GC-MS和GC-MS/MS离子源有化学电离源(chemical ionization,CI)和电子轰击源(electron ionization,EI)2种,CI源灵敏度更高、选择性更强,而且受柱流失和基质成分影响低,定性定量分析优势更为明显[22-24]。本文拟采用GC-MS/MS法结合正化学电离源(positive chemical ionization,PCI)模式,建立面包中氨基甲酸乙酯含量的GC-PCI-MS/MS测定方法,提升目标物检测选择特异性和灵敏度,为面包中痕量氨基甲酸乙酯的准确检测提供有利的技术手段。
1 材料与方法
1.1 材料与试剂
氨基甲酸乙酯标准品(纯度≥99.0%),德国Dr.Ehrenstorfer公司;D5-氨基甲酸乙酯标准品(纯度≥99.5%),德国Dr.Ehrenstorfer公司;乙酸铅(分析纯),广州化学试剂厂;石油醚、乙醇、乙酸乙酯(色谱纯)、有机相滤膜(0.22 μm),彼西络(广州)科技有限公司;实验室用水均为超纯水。
1.2 仪器与设备
气相色谱-正化学源-串联质谱仪(7890B气相色谱仪配7000D质谱仪),美国安捷伦公司;VT-WAX色谱柱(30 m×0.25 mm×0.25 μm),广州太玮科技有限公司;Vortex-Genie 2旋涡混匀器,奥然科技有限公司;冷冻离心机,湖南湘仪实验室仪器开发有限公司;Cleanert EC碱性硅藻土固相萃取柱,天津博纳艾杰尔科技有限公司;超声波清洗器,昆山市超声仪器有限公司。
1.3 试验条件
1.3.1 色谱条件
进样口温度:230 ℃;载气:高纯氦气(99.999%);碰撞气:高纯氮气(99.999%);柱流量:1.0 mL/min;进样方式:不分流进样;进样量:1 μL。升温程序:起始温度50 ℃,保持1 min,以8 ℃/min升至170 ℃,再以30 ℃/min升至240 ℃,保持3 min。
1.3.2 质谱条件
离子源:正化学源;电离方式:化学电离;离子源温度:300 ℃;检测方式:质谱多反应检测(multiple realtion monitoring,MRM)模式;色谱-质谱连接口温度:250 ℃;定性、定量离子对、碰撞能量等参数见表1。
表1 氨基甲酸乙酯和D5-氨基甲酸乙酯质谱参数
Table 1 MS/ MS parameters for EC and D5-EC

检测物质保留时间/min前体离子(m/z)产物离子(m/z)碰撞能/eV氨基甲酸乙酯14.47761.944.0∗3061.945.125D5-氨基甲酸乙酯14.12262.944.0∗2562.946.025
注:“*”表示定量离子。
1.4 试验步骤
1.4.1 标准溶液配制
准确称取10.0 mg D5-氨基甲酸乙酯标准物质,用甲醇定容至10 mL,得到1 000 μg/mL的D5-氨基甲酸乙酯储备液,再逐级稀释至1 μg/mL标准中间液。准确称取10.0 mg氨基甲酸乙酯标准物质,用甲醇定容至10 mL,得到1 000 μg/mL的氨基甲酸乙酯储备液,再逐级稀释至1 μg/mL标准中间液。分别准确吸取一定量氨基甲酸乙酯标准中间液,加入10 μL D5-氨基甲酸乙酯标准中间液,用甲醇定容至1.0 mL,得到0.5、1.0、2.0、5.0、10.0、20.0、50.0 μg/L的标准工作液。
1.4.2 样品前处理
将面包剪碎,-20 ℃密封冷冻2 h,取出后迅速破碎均匀,准确称取1.0 g样品于15 mL离心管中,加入25 μL D5-氨基甲酸乙酯标准中间液(1 μg/mL),然后加入10 mL 10 g/100 mL乙酸铅溶液,涡旋,超声10 min,离心,取4 mL上清液于Cleanert EC碱性硅藻土固相萃取柱中,在真空条件下,使样品渗入固相萃取柱中,静置10 min;用10 mL正己烷淋洗后,用20 mL V(乙酸乙酯)∶V(乙醚)=1∶10溶液洗脱,收集洗脱液,经无水Na2SO4除水后,氮吹浓缩至约0.5 mL,用甲醇定容至1 mL,上机,待测。
2 结果与讨论
2.1 色谱条件优化
实验比较了非极性柱VT-5MS、中等极性柱VT-35MS和极性柱VT-WAX对目标分析物的分离效果。氨基甲酸乙酯具有较强极性,导致其在非极性柱VT-5MS和中等极性柱VT-35MS上分离效果不佳以及峰型较差;而在VT-WAX色谱柱上获得较好的分离度和峰型。
2.2 质谱条件优化
2.2.1 质谱离子源选择
由于氨基甲酸乙酯的相对分子质量较小(89),使用EI源进行检测时,特征离子碎片不明显,受背景干扰较为严重,灵敏度较低。CI源是一种软化学电离源,选择特异性强,能够获得准确的分子离子,离子碎片较少,相对EI源具有选择性强、灵敏度高、背景干扰小的特点。由于氨基甲酸乙酯具有碱性和亲核的特性,可用PCI源进行检测。实验比较了面包基质加标样品(氨基甲酸乙酯、D5-氨基甲酸乙酯的质量浓度分别为10 μg/L、10 μg/L)在相同条件下,正化学源结合三重四极杆模式(positive chemical ionization-mass spectrometh/mass spectrometry,PCI-MS/MS)与硬电离源结合三重四极杆模式(electron ionization-mass spectrometry/mass spectrometry,EI-MS/MS)对氨基甲酸乙酯的检测效果,见图1。由图1可得,在选择PCI-MS/MS进行检测时,氨基甲酸乙酯响应更好,同时背景基线更低、杂峰干扰更少,因此本实验采用PCI源,在PCI-MS/MS模式下,以甲烷为反应气对氨基甲酸乙酯进行分析。
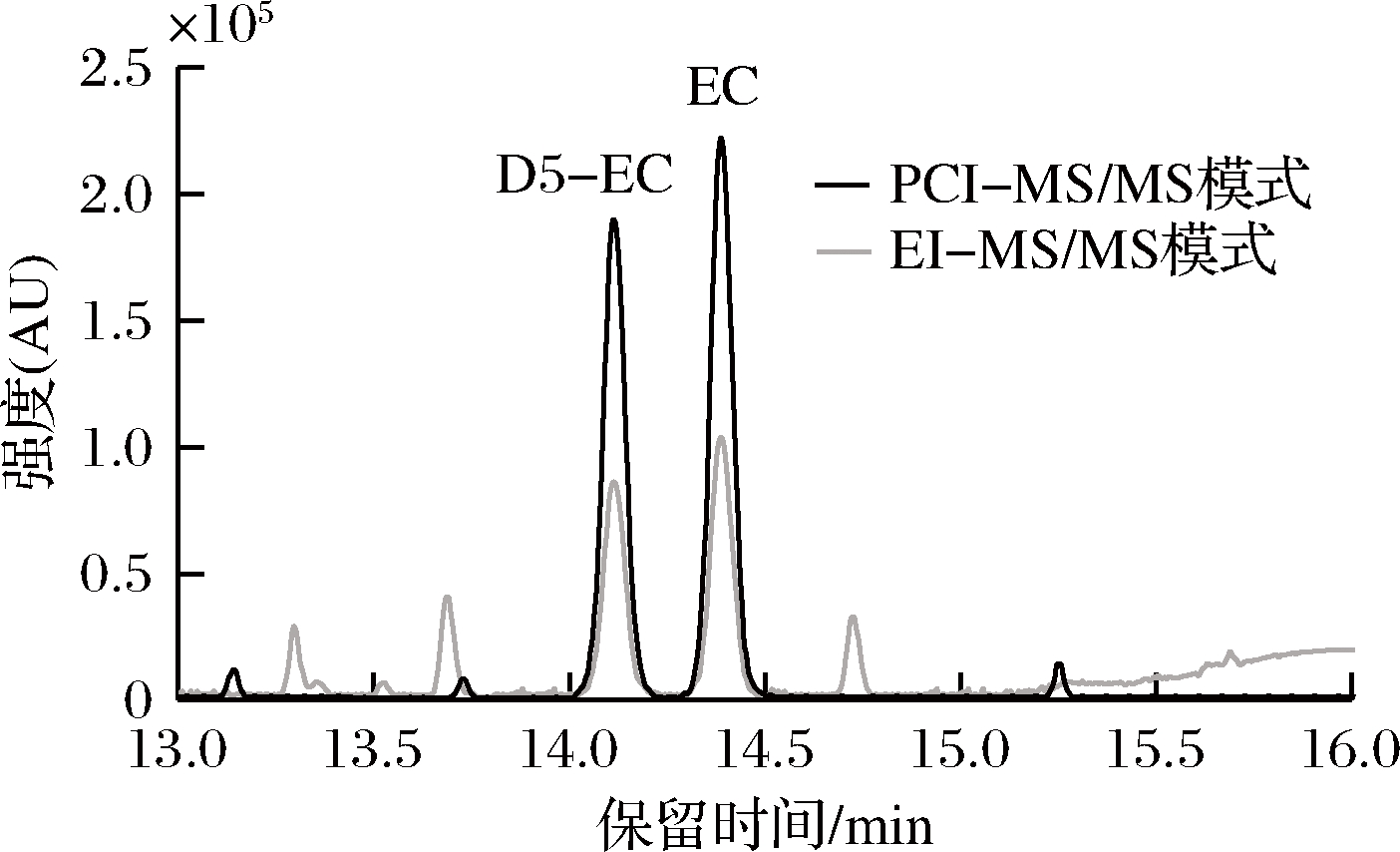
图1 PCI-MS/MS模式和EI-MS/MS模式下EC和D5-EC总离子流图
Fig.1 Tatal ion chromatograms of EC and D5-EC in the mode of PCI-MS/MS and EI-MS/MS
2.2.2 质谱参数优化
在正化学电离源检测模式下对氨基甲酸乙酯及D5-氨基甲酸乙酯进行全扫描分析,在质谱图中选择丰度较高、质荷比较大的离子作为母离子;设定5~40 eV(每5 eV一个间隔)的碰撞能,对选定的母离子进行产物离子扫描,根据产物离子质谱图,选择离子强度大的作为定量离子,离子强度次之的为定性离子,具体质谱参数见表1。图2为使用优化后条件采集氨基甲酸乙酯和D5-氨基甲酸乙酯混合标准溶液的MRM色谱图。
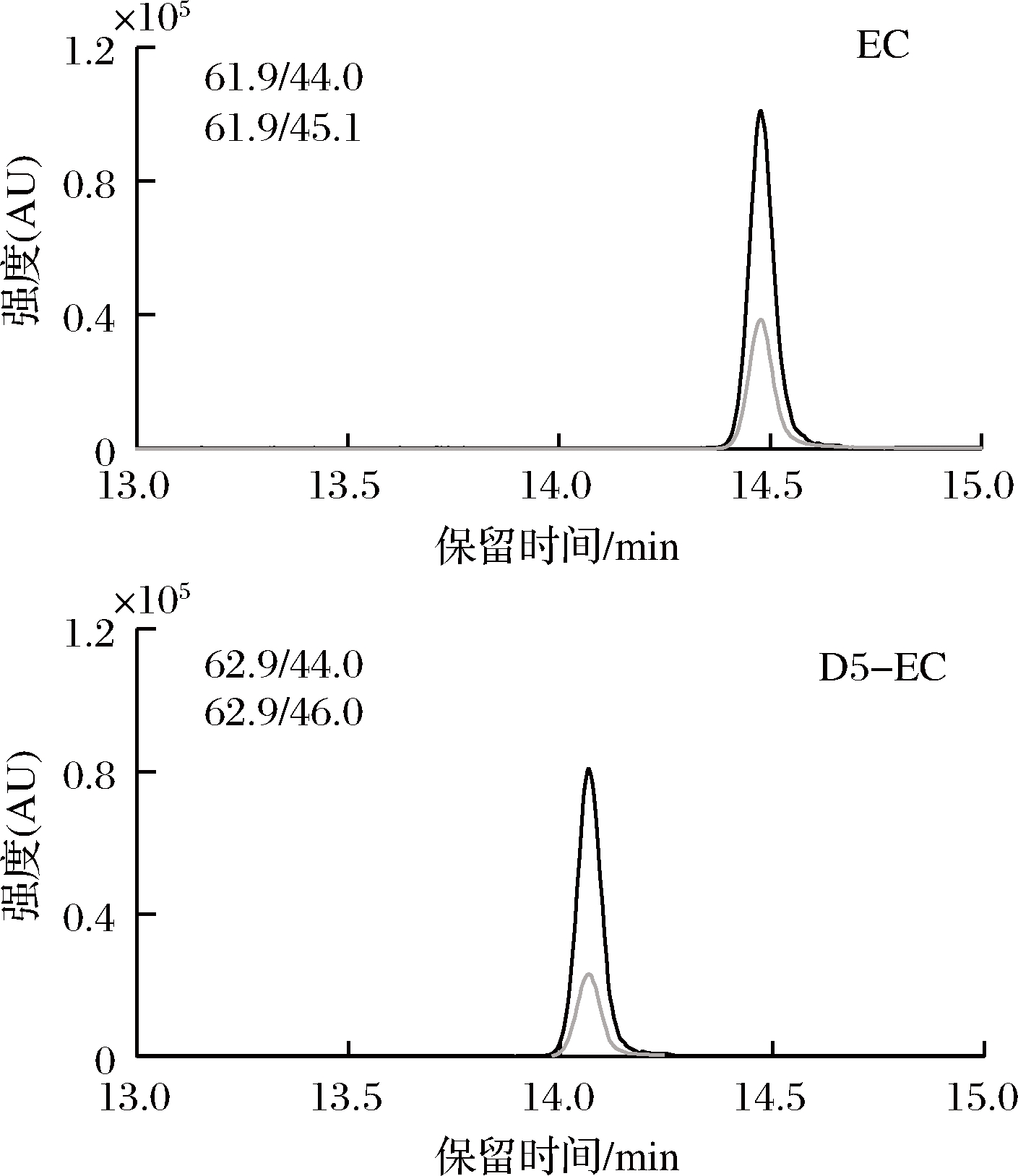
图2 氨基甲酸乙酯和D5-氨基甲酸乙酯混合标准溶液(10 μg/L)MRM色谱图
Fig.2 MRM chromatograms of a standard mixture of EC and D5-EC(10 μg/L)
2.3 前处理条件优化
2.3.1 提取条件优化
面包含油脂及蛋白质较多,经过破碎均匀后,用溶剂提取时易产生溶胀现象,形成黏稠状匀浆。若在提取过程中不进行蛋白沉淀,易导致提取不完全,净化柱被堵塞,即使内标校正亦会出现回收率不稳定及偏低等情况。一般情况下,需要先用沉淀剂进行蛋白沉淀,再用提取溶剂进行提取,但过程相对繁琐且易导致目标物损失。氨基甲酸乙酯具有较强极性,易溶于水,因此实验可采用含蛋白沉淀剂的水溶液进行提取。乙酸铅是典型的蛋白沉淀剂,在阴性面包样品中添加氨基甲酸乙酯0.025 μg,比较10 mL的1、2、5、10、15、20 g/100 mL乙酸铅水溶液作为提取溶剂的提取效果,平行试验6次,以氨基甲酸乙酯平均峰面积指示提取效果(定量离子对61.9/44.0峰面积计),结果见图3。

图3 乙酸铅水溶液质量浓度对氨基甲酸乙酯提取效果的影响
Fig.3 Effect of lead acetate concentration on the extraction of EC
结果表明,当乙酸铅质量浓度≥10 g/100 mL时,氨基甲酸乙酯峰面积趋于平缓,因此选用10 g/100 mL乙酸铅溶液进行提取。
2.3.2 净化条件优化
面包含脂质、蛋白质、维生素、膳食纤维等物质,在提取过程中易形成共提取效应,干扰目标物检测。同时,氨基甲酸乙酯本身分子量较小,形成的离子质荷比较小,易受杂质离子干扰。实验比较了Cleanert EC碱性硅藻土固相萃取柱和佛罗里硅土柱对样品提取液的净化效果。结果发现,弗罗里硅土柱吸附氨基甲酸乙酯的能力较差,回收率不佳,主要体现在目标物损失大,理论加标浓度在仪器上检测信号较低;而Cleanert EC碱性硅藻土固相萃取柱对氨基甲酸乙酯有很强的吸附能力,淋洗杂质后,反向洗脱目标物质,能够得到较好回收率,氨基甲酸乙酯在仪器上的绝对响应更高,回收率在90%左右,因此选择Cleanert EC碱性硅藻土固相萃取柱。
2.4 方法的线性范围、检出限和定量限
经气相色谱-正化学源-串联三重四极杆质谱仪,以选择离子对监测模式进行分析测定,以氨基甲酸乙酯质量浓度为横坐标(X),特征离子对的相对峰面积(D5-氨基甲酸乙酯为内标校正)为纵坐标(Y),作线性回归,绘制标准曲线。氨基甲酸乙酯在0.5~50.0 μg/L范围内相关系数为0.999 5。方法检出限以空白面包基质稀释标准曲线上的最低浓度出峰时,取信噪比S/N=3计算得出。定量限以空白面包基质稀释标准曲线上的最低浓度出峰时,取信噪比S/N=10计算得到。氨基甲酸乙酯线性范围、线性方程、相关系数、检出限(limit of determination,LOD)、定量限(limit of quantitation,LOQ)详见表2。
表2 面包中氨基甲酸乙酯的线性范围、线性方程、相关系数、检出限和定量限
Table 2 Linear range,linear equation,correlation coefficient,LOD and LOQ of EC in breads
检测物质线性范围/(μg·L-1)线性方程相关系数检出限/(μg·kg-1)定量限/(μg·kg-1)氨基甲酸乙酯0.5~50.0μg/LY=1.7862X-0.09020.99950.120.40
2.5 方法回收率和精密度
以面包阴性样品为空白,分别添加2.0、10.0、50.0 μg/kg三个不同水平的氨基甲酸乙酯标准溶液,同时加入25 μL 1 μg/mL的D5-氨基甲酸乙酯标准中间液,按照1.4.2进行样品前处理,经GC-PCI-MS/MS分析。每个加标浓度水平1 d内平行测定6次,连续测定3 d,以当天配制的标准曲线计算加标样品的浓度,并计算回收率和日内日间精密度(relative standard deviation,RSD),结果见表3。
从表3可得出,面包中氨基甲酸乙酯的回收率在89.3%~95.6%之间,日内RSD在1.3%~4.6%之间,日间RSD在4.5%~9.9%之间,表明该方法的准确度高,稳定性好,通用性较强。
表3 面包中氨基甲酸乙酯的回收率和RSD(n=6)
Table 3 Recoveries and RSD of EC in breads
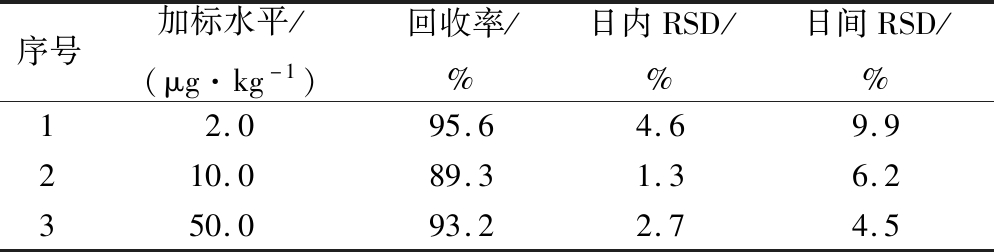
序号加标水平/(μg·kg-1)回收率/%日内RSD/%日间RSD/%12.095.64.69.9210.089.31.36.2350.093.22.74.5
2.6 实际样品测定
应用本方法测定了30批次面包(编号为1~30)中的氨基甲酸乙酯含量。30批次面包中有26批次检出氨基甲酸乙酯,检出率86.7%,数值范围在0.65~92.23 μg/kg之间,其中有检出,但数值低于1 μg/kg的样品有4批次,说明该方法适用于氨基甲酸乙酯痕量分析,具体结果见表4。
表4 面包中氨基甲酸乙酯含量检出情况
Table 4 Contents of EC in breads

编号含量/(μg·kg-1)编号含量/(μg·kg-1)编号含量/(μg·kg-1)124.63110.842133.3620.651246.232213.98339.691318.1223ND4ND141.95242.7652.93158.432549.5863.5616ND269.12731.28172.682712.9881.931823.25288.3490.92192.21290.891026.9820ND3092.23
注:ND表示未检测到。
3 结论
本文比较了不同质量浓度乙酸铅溶液对面包基质的蛋白沉淀效果及氨基甲酸乙酯提取效果,当乙酸铅质量浓度达到10 g/100 mL时即可达到较好的蛋白沉淀效果及氨基甲酸乙酯提取效果;同时比较了氨基甲酸乙酯在PCI和EI两种离子源检测条件下的灵敏度及基质干扰情况,其中氨基甲酸乙酯在PCI源检测条件下灵敏度优势明显,受基质干扰更小。采用优化后的GC-PCI-MS/MS方法,在空白面包样品添加质量浓度为2、10、50 μg/kg的范围内,氨基甲酸乙酯的回收率为89.3%~95.6%,日内RSD为1.3%~4.6%,日间RSD为4.5%~9.9%,检出限为0.12 μg/kg,比一般选择EI源的检测方法检出限(1.0 μg/kg)低5倍以上,因此优化后的方法选择性强、灵敏度高、检出限低、准确度好,适用于面包中氨基甲酸乙酯痕量分析。
[1] 龙顺荣,周勇,郦明浩,等.发酵食品中氨基甲酸乙酯污染状况调查与分析[J].食品与发酵工业,2013,39(2):196-199.
[2] 周凯,唐冰娥,徐振林,等.发酵食品中氨基甲酸乙酯形成机理和快速检测方法研究进展[J].生物加工过程,2018,16(2):31-41.
[3] ZHANG J R,FANG F,CHEN J,et al.The arginine deiminase pathway of koji bacteria is involved in ethyl carbamate precursor production in soy sauce[J].FEMS Microbiol Lett,2014,358(1):91-97.
[4] 刘会昌,石建新.氨基甲酸乙酯诱导HepG2细胞凋亡的分子机制[J].食品科学,2018,39(17):159-164.
[5] CUI X,WANG J J,QIU N N,et al.In vitro toxicological evaluation of ethyl carbamate in human Hep G2 cells[J].Toxicology Research,2016,5(2):697-702.
[6] CHUN S H,CHA Y N,KIM C.Urethane increases reactive oxygen species and activates extracellular signal-regulated kinase in RAW 264.7 macrophages and A549 lung epithelial cells[J].Archives of Pharmacal Research,2013,36(6):775-782.
[7] CHEN W,XU Y,ZHANG L X,et al.Blackberry subjected to in vitro gastrointestinal digestion affords protection against Ethyl Carbamate-induced cytotoxicity[J].Food Chemistry,2016,212(1):620-627.
[8] 魏玉洁,付方圆,武顺,等.葡萄酒酵母car1基因表达量与EC含量相关性的研究[J].食品与发酵工业,2015,41(8):59-64.
[9] ZHOU W Y,FANG R S,CHEN Q H.Effect of gallic and protocatechuic acids on the metabolism of ethyl carbamate in Chinese yellow rice wine brewing [J].Food Chemistry,2017,233(10):174-181.
[10] WEBER J V,SHARYPOV V I.Ethyl carbamate in foods and beverages:a review[J].Environmental Chemistry Letters,2009,7(3):233-247.
[11] BAAN R,STRAIF K,GROSSE Y,et al.Carcinogenicity of alcoholic beverages.[J].Lancet Oncology,2007,8(4):292-293.
[12] 肖泳,邓放明.发酵食品中氨基甲酸乙酯的研究进展[J].食品安全质量检测学报,2012(3):216-221.
[13] STEFANI E D,BOFFETTA P,DE H,et al.The effect of smoking and drinking in oral and pharyngeal cancers:A case-control study in Uruguay[J].Cancer Lett,2007,246(1):282-289.
[14] 黄振波.气相色谱法测定酒中氨基甲酸乙酯[J].现代食品,2016,3(6):74-76.
[15] 蒙法双.气相色谱法测定饮料酒中氨基甲酸乙酯的含量[J].食品安全导刊,2016(9):77-77.
[16] 雒丽娜,王颖,张妮娜,等.固相萃取-气相色谱-质谱法测定酸奶中氨基甲酸乙酯[J].中国卫生检验杂志,2015,25(18):3 070-3 071.
[17] 张万利,梁新红,冉军舰,等.SLE结合GC-MS法测定葡萄酒中氨基甲酸乙酯[J].中国酿造,2017,36(1):176-179.
[18] 张雅琪,王蒙,孔红建,等.固相萃取-气相色谱-质谱法测定腐乳中氨基甲酸乙酯[J].食品安全质量检测学报,2018,9(3):609-613.
[19] GB 5009.223—2014,食品安全国家标准食品中氨基甲酸乙酯的测定[S].北京:中国标准出版社,2014.
[20] 柯润辉,王丽娟,安红梅,等.超高效液相色谱-串联质谱法同时测定白酒中氨基甲酸乙酯和8种甜味剂[J].食品与发酵工业,2016,42(4):174-178.
[21] 徐小民,何华丽,阮宇迪,等.气相色谱-三重四极杆串联质谱法同时测定调味品中的氨基甲酸乙酯和氯丙醇[J].色谱,2013,31(11):1 129-1 133.
[22] KIM E,LEE J,CHOI S,et al.Analysis of ketamine and norketamine in urine by automatic solid-phase extraction(SPE) and postive ion chemical ionization-gas chromatography-mass spectrometry(PCI-GC-MS)[J].Forensic Science International,2008,174(2):197-202.
[23] 司晓喜,张凤梅,朱瑞芝,等.气相色谱-正化学电离源-飞行时间质谱法测定烟草吸食者唾液中的吡嗪和吡啶类物质[J].质谱学报,2018,39(4):467-475.
[24] 幸苑娜,王欣,陈泽勇,等.气相色谱-正化学源质谱法测定家用橡胶手套中7种N-亚硝胺及其前体物的迁移量[J].分析测试学报,2011,30(5):503-508.