低聚葡萄糖氧化酶(gluco-oligosaccharide oxidase,EC1.1.99.B3,Goox)是碳水化合物氧化酶的一种,作用于以α/β-1,4-糖苷键连接的低聚葡萄糖,催化氧化还原性末端残基生成相应的糖酸或内酯[1-3]。寡糖酸具有修复、抗氧化、保湿、促进机体更新等多重功效[4-5],已应用于食品、化妆品、建筑、医疗、保健等诸多领域[6-7]。现有的乳糖酸、麦芽糖酸和纤维二糖酸多采用化学法制备,其工艺复杂、生产成本高且副产物影响较大[8-9]。Goox的发现使酶法制备寡醛糖酸成为可能。此外,Goox作为食品添加剂应用于纤维含量高的面团中,提高面团的筋度;还可以作为添加剂加入到饲料中,促进双歧杆菌的增殖,增加肠道对矿物质的吸收[10];向酶中引入木聚糖底物结合区,可以用来检测和量化不同低聚糖,也可应用于低聚糖生物传感仪的构建[11-12];因此,Goox还可应用于食品、饲料、化工等多个行业,应用潜力巨大。
1991年,LIN等首次在Sarocladium strictum中发现Goox,随后,KIRYU在Paraconiothyrium sp.中也成功分离得到该酶[13-14]。近几年对该酶的研究主要集中于异源表达、蛋白结构和应用领域方面。2005年,HUANG将来源于S.strictum T1中goox-T1基因在毕赤酵母中实现异源表达,通过对其蛋白结构进行分析,确认该酶的活性位点和催化机制[15];2008年,KIRYU对来源于Paraconiothyrium sp.的Goox在乳糖酸转化方面的应用潜力进行研究,结果表明该酶可以有效地将乳糖转化为乳糖酸,转化率为100%[13];2011年,MARYAM通过定点突变将来源于S.strictum CBS 346.7的goox-VN基因在毕赤酵母中实现了异源表达,通过定点突变提高了底物特异性[16]。但目前各项研究也仅围绕着2个来源的Goox进行,需要进一步研究获得不同来源的新酶。
本文通过生物信息学分析,从黑曲霉基因组中寻找到一疑似Goox的开放读框,进一步通过分子克隆技术对其进行克隆表达,并对其酶学性质和生化特征进行分析,为后续应用奠定基础。
1 材料与方法
1.1 菌种与质粒
黑曲霉(Aspergillus niger)F0215、大肠杆菌(Escherichia coli)JM109、毕赤酵母(Pichia pastoris)GS115和质粒pPIC9K,皆为本实验室保藏;黑曲霉和大肠杆菌分别采用PDA和LB培养基进行培养。毕赤酵母及其重组菌按照实验室标准方法进行培养。
1.2 主要试剂
限制性内切酶XbaI、NcoI、SalI以及PyrobestTM DNA聚合酶和T4 DNA连接酶,宝生物工程(大连)有限公司;质粒快速提取试剂盒、DNA纯化回收盒,北京庄盟国际生物基因科技有限公司;cDNA合成试剂盒,Roche公司;辣根过氧化物酶、麦芽三糖、麦芽四糖和麦芽五糖,北京索莱宝科技有限公司;苯酚、4-氨基安替比林,上海阿拉丁生化科技股份有限公司;葡萄糖、半乳糖、木糖、乳糖、蔗糖、纤维二糖、麦芽糖和过氧化氢,国药集团化学试剂有限公司。
1.3 基因克隆与重组菌构建
黑曲霉总RNA提取与cDNA合成按照试剂盒说明书进行,基因克隆中所采用的引物![]() 下划线为人工引入的限制性酶切位点)由生工生物工程股份有限公司合成。PCR产物的纯化、酶切、连接、转化及转化子的筛选均采用实验室常规方法进行[17]。
下划线为人工引入的限制性酶切位点)由生工生物工程股份有限公司合成。PCR产物的纯化、酶切、连接、转化及转化子的筛选均采用实验室常规方法进行[17]。
1.4 重组酶的制备与纯化
参考毕赤酵母表达操作手册对上述重组菌进行发酵,8 000 r/min离心15 min,收集上清液,于-20 ℃保存。发酵上清液经饱和浓度为20%~80% (NH4)2SO4分级盐析后,再以HiTrap Desalting PD-10脱盐柱和Sephadex-100凝胶过滤层析柱进行纯化。
1.5 重组低聚葡萄糖氧化酶活力测定
酶活测定参照LEE等的方法[18]进行。1 mL反应体系包括:稀释酶液0.2 mL,0.1 mmol/L 4-氨基安替比林,1 mmol/L苯酚,1 mmol/L乳糖,0.05 U辣根过氧化物酶,0.1 mol/L碳酸钠-碳酸氢钠缓冲液(pH 9.0)。55 ℃水浴中反应30 min,冰浴5 min终止反应,测定500 nm下吸光度。以不加底物的反应体系作为空白对照组。酶活定义:每分钟氧化底物生成1 μmol过氧化氢的酶量为1个酶活力单位,以U/mL表示。
1.6 重组酶酶学性质与特征分析
1.6.1 最适温度的测定
在不同温度(40、45、50、55、60、65、70、75、80和85 ℃)下测定其酶活力,以最高酶活力为100%计算相对酶活,考察温度对重组酶活力的影响。
1.6.2 温度稳定性的测定
将酶液分别置于55、65、75、85和95 ℃下保温4 h,间隔1 h取样,按照1.5方法测定残余酶活,以最高酶活力为100%,计算相对酶活。
1.6.3 最适pH的测定
分别以0.1 mol/L磷酸-柠檬酸(pH 5.0~8.0)和碳酸钠-碳酸氢钠(pH 9.0~10.0)替换1.5方法中的缓冲液,测定不同pH条件下的酶活力,以最高的酶活力计为100%,计算相对酶活,考察pH值对酶活的影响。
1.6.4 pH稳定性的测定
将酶分别置于不同pH(5.0~10.0)的缓冲液中(终浓度一致),室温放置4 h,间隔1 h取样,测定残余酶活。以最高酶活力为100%,计算相对酶活。
1.6.5 金属离子对酶的影响
在反应体系中分别加入终浓度为1 mmol/L的Ca2+、Zn2+、Mg2+、Fe3+、Ba2+、Co2+、Cu2+、Na+、Mn2+和K+,测定其酶活力,以未加金属离子的酶活力为100%,计算相对酶活。
1.6.6 动力学参数的测定
以不同浓度(1、5、10、15、20 mmol/L)的乳糖为底物,在重组酶的最适作用温度和pH条件下进行反应,测定酶活。采用双倒数法(Lineweaver-Burk)作图,计算米氏常数Km及最大反应速度Vmax。
1.6.7 底物特异性分析
分别以终浓度1 mmol/L的葡萄糖、木糖、半乳糖、乳糖、纤维二糖、蔗糖、麦芽糖、麦芽三糖、麦芽四糖和麦芽五糖为反应底物,测定酶活。以最适底物的酶活力为100%,计算其他底物的相对酶活。
1.7 生物信息学分析
从NCBI数据库中获得不同来源的Goox氨基酸序列,利用软件Clustal X2和Bioedit 7.0.9对这些序列进行多序列比对,并通过MEGA 4.0邻近法构建Goox进化树,分析它们亲缘关系的远近。
2 结果与讨论
2.1 黑曲霉基因组中存在疑似goox基因读框
根据现有报道的Goox序列Goox-vn和Goox-T1,利用NCBI数据库,对黑曲霉基因组序列进行分析发现,黑曲霉基因组中存在一个疑似goox的开放读框,进一步对来源于黑曲霉的Goox(命名为AnGoox)和Goox-vn、Goox-T1进行序列比对,结果如图1所示。

图1 不同来源Goox的氨基酸序列比对
Fig.1 Multiple sequence alignment of gluco-oligosaccharide oxidases
注:FAD结构域开始与结束位点用圆框标出;黄素结构域用方框标出;FAD连接活性中心用阴影标注;其他活性位点氨基酸残基用粗体标注。
AnGoox与Goox-vn和Goox-T1的相似度分别为28.98%和28.71%。在它们的氨基酸序列中,都包含2个较为保守的结构域,一段位置在37~174之间,长度为137的FAD结合域,其起始基序为(PAAI)。另一段在结尾处长度约为44的黄素结构域。通过氨基酸序列比对,可知与FAD进行双共价连接的关键氨基酸残基为His80和Cys141。参与反应的关键氨基酸残基为Asp377和Try428,2个氨基酸引发底物的氢离子的转移,从而降低FAD辅因子能量。
2.2 黑曲霉Goox基因的克隆
以黑曲霉F0215的cDNA为模板对Goox基因进行PCR扩增,PCR产物经纯化和限制性内切酶XbaI酶切后,与经SnaBI和AvrII酶切的pPIC9K载体连接,通过NcoI酶切,验证了重组质粒的正确性,获得重组质粒pPIC-goox。经序列测定与分析发现,goox编码的氨基酸序列与黑曲霉CBS513.88基因组相应序列有2个碱基的差异,在1310和1410位上,F0215来源的碱基为G和A,参照菌株CBS513.88为A和C,导致2个氨基酸不同(G437E和Q467P),但其对酶催化活性中心(H80、C141、D377、Y428)无影响(数据未呈现)。
利用MEGA 4.0将不同来源的Goox的氨基酸序列进行比对并构建进化树(图2),此进化树反映了不同来源的Goox之间的遗传距离,AnGoox与其他来源的Goox相似度为28.91%~97.46%,其中,AnGoox与已报道的Goox-T1分属于不同分支,进一步分析发现,AnGoox的氨基酸与A.piperis中的Goox的相似度为97.46%。

图2 不同来源Goox的系统发育树
Fig.2 Phylogenetic trees of gluco-oligosaccharide oxidase from different sources
注:以左下角线段长度为标尺,绘制了亲缘关系与长度的关系图,线上标记的数字代表bootstrap百分比;已有文献报道的Goox用
▲标注。
2.3 重组Goox的表达与纯化
pPIC-goox重组质粒经SalI进行线性化转化毕赤酵母GS115中,通过G418抗性平板筛选高拷贝。获得重组菌GS115(pPIC-goox)。在250 mL摇瓶发酵120 h后,检测发酵液上清酶活,其Goox活力最高为5 mU/mL,因此确认该酶为Goox。
经硫酸铵沉淀和Sephadex-100凝胶色谱纯化后,比酶活为0.33 U/mL,纯化倍数和回收率分别为16.5和34.7%。进一步经SDS-PAGE分析,蛋白大小约为61 kDa(数据未呈现),略高于理论值,分析可能存在N-糖基化[16]。
2.4 AnGoox酶学性质分析
2.4.1 最适温度和温度稳定性
温度对AnGoox的活力和稳定性的影响见图3。AnGoox的最适作用温度为75 ℃,在70~80 ℃范围内,其相对酶活在75%以上(图3-a);在85 ℃保温4 h,剩余酶活力在70%以上,在95 ℃保温4 h,剩余酶活降至约30%(图3-b)。目前已报道的Goox的最适反应温度在37~55 ℃之间,S.strictum和Paraconiothyrium sp.来源的Goox在20~50 ℃条件下分别孵育1 h和24 h后,酶活维持在100%,但高于50 ℃酶活力迅速降低,S.strictum的Goox在60 ℃孵育1 h后,残余酶活仅剩15%,Paraconiothyrium sp.的Goox在60 ℃孵育24 h后,残余酶活仅为45%[13-14,16]。可见,AnGoox的最适反应温度及热稳定性均显著高于已报道的同类酶。

a-最适温度;b-温度稳定性
图3 温度对AnGoox的酶活和稳定性的影响
Fig.3 Effect of temperature on the activity and stability of AnGoox
2.4.2 最适pH和pH稳定性
pH对AnGoox的活力和稳定性的影响见图4。AnGoox在pH 9.0下表现出最高的酶活力,pH改变则酶活迅速下降,在pH 7.0和pH 10.0下,酶活均降至约40%(图4-a)。在pH 5.0~9.0保温4 h后,剩余酶活在70%以上,显示出较好的pH耐受能力(图4-b)。AnGoox的最适pH与pH稳定性均与来源于S.strictum的Goox(最适pH=10.0,在pH为5~11条件下,孵育1 h酶活维持在100%)相似[13-14]。
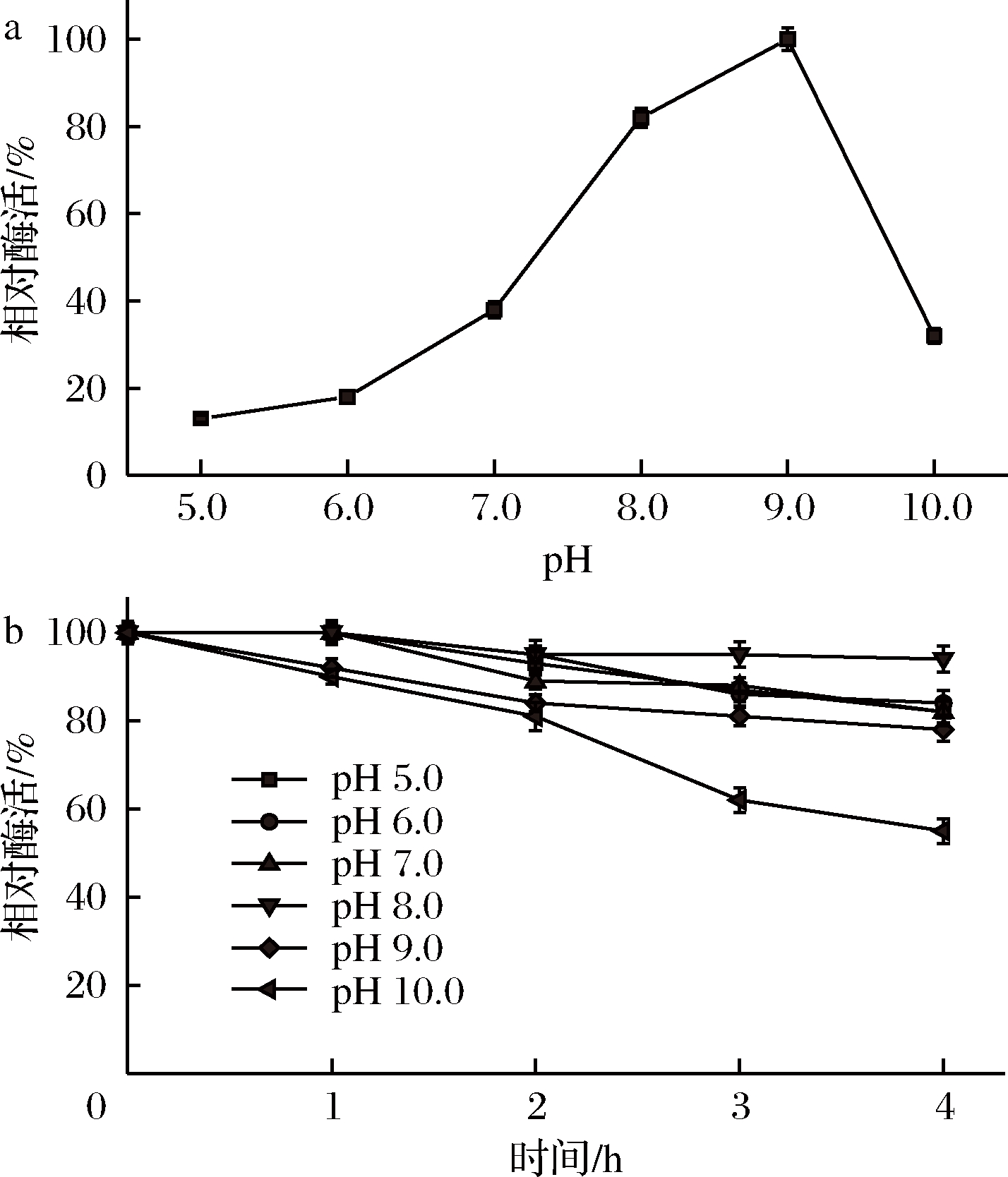
a-最适pH值;b-pH稳定性
图4 pH对AnGoox的酶活和pH稳定性的影响
Fig.4 Effect of pH on the activity and stability of AnGoox
2.4.3 不同金属离子对酶活的影响
如表1所示,多种金属离子均对AnGoox表现出激活或者抑制作用,1 mmol/L 的Mn2+对酶活有较为明显的促进作用,而相同浓度的Fe3+、Ca2+和Ba2+对酶活的抑制作用最为强烈。与来源于S.strictum的低聚葡萄糖氧化酶相比,Zn2+对S.strictum的Goox具有促进作用,而对AnGoox具有抑制作用[14]。
表1 不同金属离子对AnGoox活力的影响
Table 1 Effects of different metal ions on the activity of AnGoox
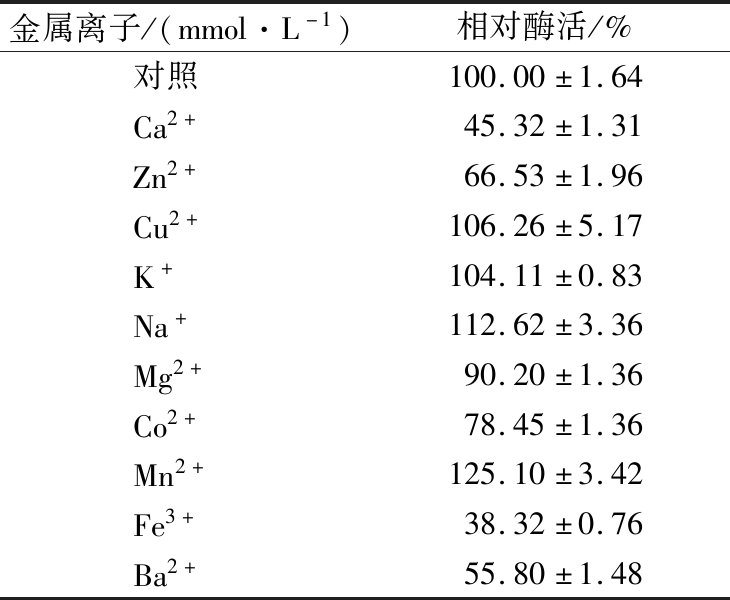
金属离子/(mmol·L-1)相对酶活/%对照100.00±1.64Ca2+45.32±1.31Zn2+66.53±1.96Cu2+106.26±5.17K+104.11±0.83Na+112.62±3.36Mg2+90.20±1.36Co2+78.45±1.36Mn2+125.10±3.42Fe3+38.32±0.76Ba2+55.80±1.48
2.4.4 动力学参数
以不同浓度(1、5、10、15、20 mmol/L)的乳糖为底物,在最适温度和pH条件下测定酶活,采用双倒数法,绘制AnGoox的动力学曲线,如图5所示,求得AnGoox的Km值为0.48 mmol/L,Vmax为2.22 μmol/(L·min)。该酶的Km高于Paraconiothyrium sp.的Goox(0.11 mmol/L)[13]和S.strictum的Goox(0.066 mmol/L)[18],说明AnGoox对乳糖底物的亲和力低于前期报道的2种酶。

图5 底物为乳糖时AnGoox的动力学曲线
Fig.5 The kinetic curve of AnGoox with lactose as substrate
2.4.5 底物特异性研究
分别以10种不同的糖作为底物,研究AnGoox特异性,结果如图6。在10种底物中,AnGoox的氧化能力从高到低依次为麦芽四糖、麦芽三糖、麦芽五糖、乳糖、纤维二糖、麦芽糖、葡萄糖、蔗糖、木糖、半乳糖。该酶与S.strictum的Goox底物特异性相似,都具有对单糖、双糖和麦芽低聚糖的氧化能力[16,18]。AnGoox对麦芽低聚糖氧化能力优于来自S.strictum的Goox,显示该酶为酶法制备低聚糖酸提供新的可能。
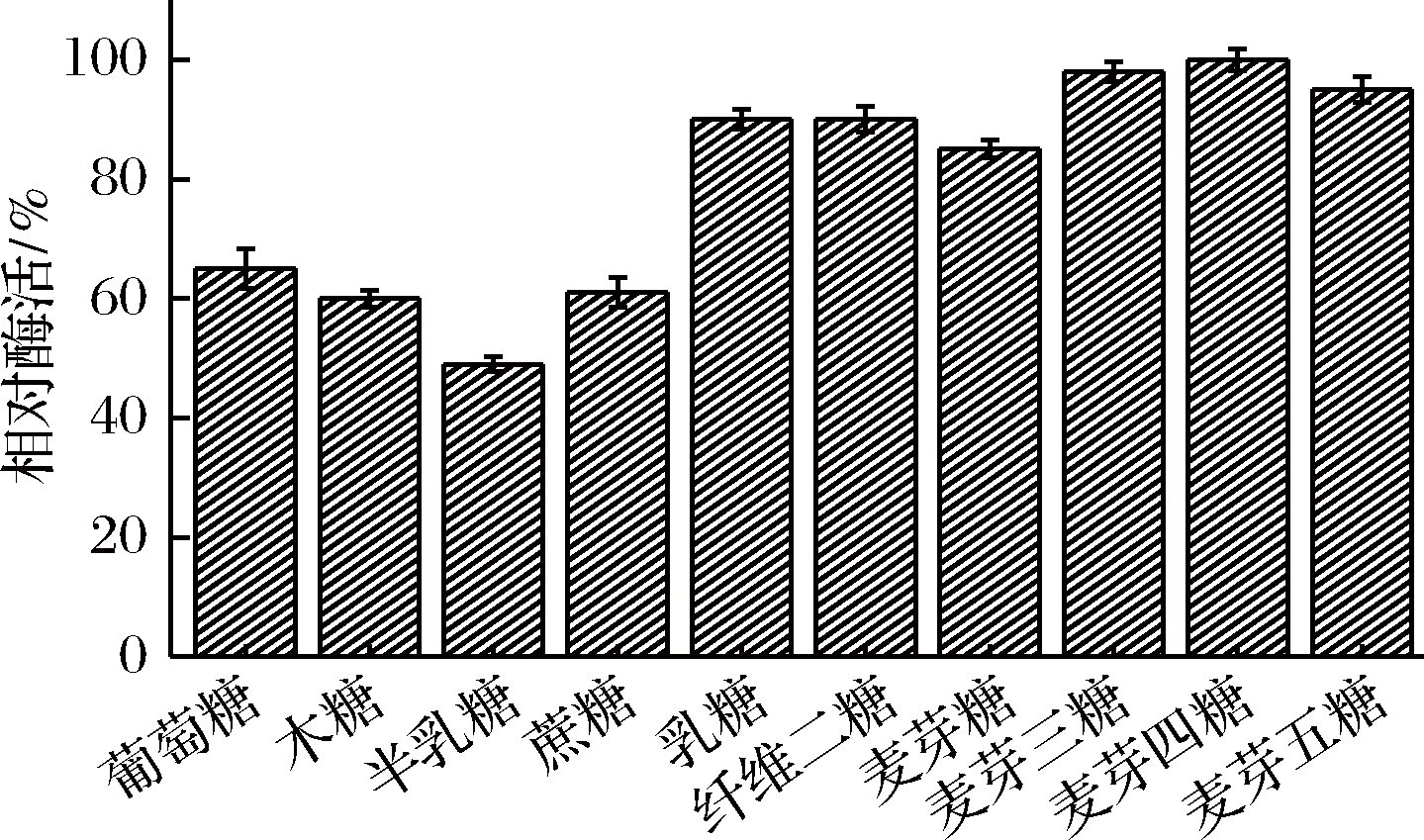
图6 AnGoox的底物特异性
Fig.6 Substrate specificity of AnGoox
3 结论
本研究首次鉴定了黑曲霉来源的低聚葡萄糖氧化酶,并成功在毕赤酵母中异源表达,系统的酶学性质解析为其后续应用研究提供了基础材料。
[1] SCHOEMAKER H E,MINK D,WUBBOLTS M G.Dispelling the myths-biocatalysis in industrial synthesis[J].Science,2003,299(5 613):1 694-1 697.
[2] VAN HELLEMOND E W,LEFERINK N G H,HEUTS D P H M,et al.Occurrence and biocatalytic potential of carbohydrate oxidases[J].Advances in Applied Microbiology,2006,60:17-54.
[3] VUONG T V,FOUMANI M,MACCORMICK B,et al.Direct comparison of gluco-oligosaccharide oxidase variants and glucose oxidase:substrate range and H2O2 stability[J].Scientific Reports,2016,6:37 356.Doi:10.1038/srep37356 (2016).
[4] RUEY J Y,VAN SCOTT E J.Oligosaccharide aldonic acids and their topical use:United States of America,US/6335023B1 [P].2002-01-01.
[5] 白会钗,缪铭,江波,等.乳糖酸的研究进展[J].食品工业科技,2012,33(2):430-432.
[6] GREEN B A,YU R J,VAN S E J.Clinical and cosmeceutical uses of hydroxyacids[J].Clinics in Dermatology,2009,27(5):495-501.
[7] LUIS F G,HAMOUDI S,BELKACEMI K.Lactobionic acid:a high value-added lactose derivative for food and pharmaceutical applications[J].International Dairy Journal,2012,26(2):103-111.
[8] LI X,CHOMVONG K,YU V Y,et al.Cellobionic acid utilization:from Neurospora crassa to Saccharomyces cerevisiae[J].Biotechnology for Biofuels,2015,8(1):120.
[9] GREEN J W.The halogen oxidation of simple carbohydrates [M].New York:Advances in Carbohydrate Chemistry,1948:129-184.
[10] ALHAERI M F.Engineering and production of glucooligosaccharide oxidases for site-specific activation of cellulose and hemicellulose substrates[D].Toronto:University of Toronto,2015.
[11] VUONG T V,MASTER E R.Fusion of a xylan-binding module to gluco-oligosaccharide oxidase increases activity and promotes stable immobilization[J].PLoS One,2014,9(4):e95170.doi:10.1371/journal.pone.0095170
[12] LIN S F,HWANG Y L,TSAI Y C.Immobilization of glucooligosaccharide oxidase of Acremonium strictum for oligosaccharic acid production[J].Biotechnology Techniques,1996,10(1):63-68.
[13] KIRYU T,NAKANO H,KISO T,et al.Purification and characterization of a carbohydrate:acceptor oxidoreductase from Paraconiothyrium sp.that produces lactobionic acid efficiently[J].Bioscience,Biotechnology,and Biochemistry,2008,72(3):833-841.
[14] LIN S F,YANG T Y,INUKAI T,et al.Purification and characterization of a novel glucooligosaccharide oxidase from Acremonium strictum T1[J].Biochimica et Biophysica Acta,1991,1 118(1):41-47.
[15] HUANG C,LAI W,LEE M,et al.Crystal structure of glucooligosaccharide oxidase from Acremonium strictum[J].Journal of Biological Chemistry,2005,280(46):38 831-38 838.
[16] FOUMANI M,VUONG T V,MASTER E R.Altered substrate specificity of the gluco-oligosaccharide oxidase from Acremonium strictum[J].Biotechnology and Bioengineering,2011,108(10):2 261-2 269.
[17] 诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994.
[18] LEE M H,LAI W L,LIN S F,et al.Structural characterization of glucooligosaccharide oxidase from Acremonium strictum[J].Applied and Environmental Microbiology,2005,71(12):8 881-8 887.