酵母含有丰富的蛋白质(45%~60%)、氨基酸、B族维生素、多糖、矿物质等,其自溶物被广泛应用于调味品、化妆品、保健品、医药等领域[1]。酵母自溶物是利用酵母自溶的特性,降解菌体内的蛋白质、核酸类等物质得到的产品[2]。目前生产酵母自溶物的原料主要来自于啤酒酵母、面包酵母和葡萄酒酵母这3大食用酵母。国内主要以面包酵母生产为主,但由于我国具有丰富的啤酒酵母资源,近年来对于啤酒酵母的开发也引起了关注[3]。
酵母自溶物的营养物质包含多糖、多肽、核苷酸及其他可溶性物质。多糖主要是由于细胞壁降解得到的。细胞壁多糖组分中的葡聚糖是主要的活性物质之一,具有增强免疫系统、保护皮肤细胞免受环境污染、延缓细胞衰老等功能[4],除了具有生物活性之外,β-葡聚糖还有改善食品风味的作用。在葡萄酒陈酿过程中,酵母细胞溶出的β-葡聚糖能够改善酒体口感和泡沫稳定性,因此在葡萄酒酿造中往往需要促进β-葡聚糖的溶出[5]或添加酵母多糖[6]。在酸奶中添加β-葡聚糖还有助于提高酸奶的感官接受度[7]。而多肽是酵母自身酶系降解大分子蛋白质得到的。酵母多肽由于分子量小,不仅易于吸收和利用,还具有调节免疫力,抗氧化等功能[8]。因此,富含生物活性物质和较高抗氧化活性的酵母自溶液具有作为功能性食品或营养成分的潜在应用价值[9]。
工业上生产酵母自溶物普遍采用自溶法。通过优化自溶时间[10]、温度[11]、pH和添加助溶剂[12]可促进酵母的自溶,其中温度是影响较大的因素。但是传统的自溶温度较高(45~55 ℃),不利于维持多肽及氨基酸等活性物质天然结构[13]。据报道,啤酒酵母在36 ℃下自溶6 h可获得具有最高抗氧化活性的酵母自溶物[14]。目前,对于提高酵母自溶物抗氧化活性的研究多集中于自溶条件的优化,而对直接改造酵母菌株自溶性能的研究较少。
为了促进酵母自溶、提高自溶物中活性物质的含量和抗氧化活性,本研究通过常温等离子诱变(atmospheric and room temperature plasma,ARTP)手段,以啤酒酵母、面包酵母和葡萄酒酵母为出发菌株,筛选出了3株在37 ℃下快速自溶的高温敏感型酵母,比较了原始菌与突变菌的自溶程度差异,并分析了自溶物活性物质溶出和抗氧化性的差异。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与培养基
啤酒酵母pilsner、安琪面包酵母AQ和葡萄酒酵母D254均为工业酵母菌株;高温敏感型酵母P-510、A-14、D-12分别由pilsner、AQ、D254筛选得到;以上菌株均保藏于实验室。
YPD培养基(g/L):酵母提取物10,胰蛋白胨20,葡萄糖20。固体培养基添加琼脂量为20。
1.1.2 试剂
酵母提取物、蛋白胨,生工生物工程(上海)股份有限公司;2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA),Sigma-Aldrich公司;柠檬酸、柠檬酸钠、甘氨酸、NaOH,HCl,国药集团化学试剂有限公司。
1.2 仪器与设备
ARTP诱变系统,思清源生物科技有限公司;SPX-250生化培养箱,上海跃进医疗器械厂;NanoDrop分光光度计,Thermo Scientific赛默飞世尔科技公司;pH计,梅特勒-托利多仪器有限公司;CX21显微镜,日本OLYMPUS公司;Tecan Infinite 200多功能酶标仪,瑞士Tecan公司;DC-0506恒温水浴槽,上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1 BCIP平板筛选
高温敏感型酵母细胞受到热胁迫后易发生自溶,导致胞内物质溶出。因此利用胞内碱性磷酸酶与5-溴-4-氯-3-吲哚基-磷酸盐(5-bromo-4-chloro-3-indolyl phosphate,BCIP)反应生成蓝色沉淀这一原理,可根据蓝色出现时间与深浅进行突变菌的筛选。BCIP平板筛选方法如图1所示。将对数期的酵母菌液洗涤后用生理盐水重悬稀释,使菌液细胞数达107个/mL。取上述菌悬液10 μL点于ARTP诱变载片上进行诱变处理,功率100 W,气流量10 SLM。将经过ARTP诱变所得到的菌液稀释10倍,涂布于含有40 mg/L BCIP的YPD平板,28 ℃培养36 h。通过平板影印法将菌落复制于YPD平板,并将其放置于28 ℃培养,同时将含有40 mg/L BCIP的YPD平板放置于37 ℃培养24 h,挑选菌落颜色变蓝的单菌落进行后续测定。
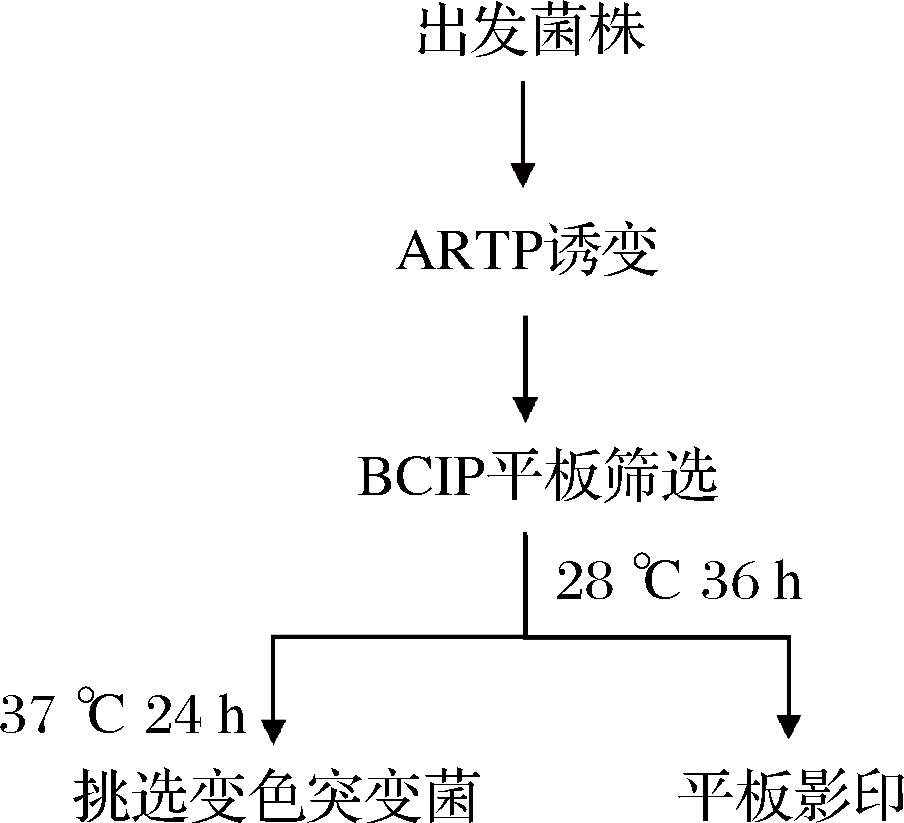
图1 BCIP平板筛选方法流程图
Fig.1 The strategy of BCIP screening
1.3.2 酵母生长性能考察与生长曲线的测定
(1)生长状况分析:将待测菌株28 ℃培养12 h后取1 mL离心,去上清并洗涤。使用血球平板计数法计数后将菌液浓度调为106、105、104、103 个/mL。依次取4个稀释度的菌液3 μL点种在YPD平板上,分别放置于28和37 ℃培养2~3 d,观察菌落大小。
(2)死亡率测定:菌株于28 ℃培养24 h至生长稳定期,转移至37 ℃、180 r/min条件下培养,测定0~72 h间细胞死亡率。菌液用无菌水洗涤后取0.5 mL与0.5 mL亚甲基紫染色液混合,15 min后细胞计数,紫色细胞为死亡细胞[15]。
(3)生长曲线测定:菌种于20 mL YPD培养基中过夜培养,以5%接种量接种至100 mL YPD中,每隔2 h测定OD600,14 h后每隔4 h测定OD600,直至菌体生长至平台期。
1.3.3 自溶液中核酸、蛋白质、氨基酸态氮含量测定
收集5.00 g酵母泥,并加入50 mL柠檬酸缓冲液(pH 4.0)中,于180 r/min、37 ℃自溶48 h,测定上清液核酸、蛋白质、氨基酸态氮的含量。
核酸含量测定:吸取上清2 μL使用微量分光光度计NanoDrop[16]测定RNA含量(ng/μL)。
核酸抽提率![]()
(1)
蛋白质含量测定:吸取上清50 μL使用Brandford法测定蛋白质含量(mg/mL)。
蛋白质抽提率![]()
(2)
氨基酸态氮含量测定:吸取上清1 mL使用甲醛法[17]测定氨基酸态氮含量(g/100 mL)。
氨基氮抽提率![]()
(3)
1.3.4 自溶液中葡聚糖水平测定
通过苯胺蓝法[18]测定自溶液中葡聚糖水平。取1 mL自溶液12 000 r/min离心5 min,吸取上清液100 μL加入1 mL苯胺蓝工作液,50 ℃暗反应保温30 min使荧光物质形成,置于室温30 min,彻底混匀,吸取180 μL至黑色96孔板进行检测。激发波长为405 nm,发射波长为495 nm,测定反应液荧光值。
1.3.5 自溶液中DPPH清除率测定
以DPPH清除率为指标表征自溶液的抗氧化能力。采用分光光度计法,无水乙醇配制0.507 2 mmol/L DPPH自由基醇溶液后,取1 mL DPPH自由基醇溶液与1 mL自溶液混合,避光反应30 min测定其OD517值。DPPH清除率计算如公式(4)所示:
清除率![]()
(4)
式中:A0,DPPH溶液与无水乙醇混合后测定的OD517值;Ai,DPPH溶液与样品反应测得OD517值;Aj,无水乙醇与样品混合反应后测得OD517值。
2 结果与分析
2.1 BCIP平板初筛
啤酒酵母、面包酵母和葡萄酒酵母是3大食用酵母,被广泛应用于酵母自溶物的生产[2],因此本实验同时对这3种酵母进行高温敏感型突变菌的筛选。选择用于商业生产的啤酒酵母pilsner、面包酵母AQ和葡萄酒酵母D254作为出发菌株。ARTP诱变方法能够在大气压下产生等离子体射流从而导致基因突变,具有突变率高、易获得遗传稳定性良好的突变株等特点,在诱变育种研究中被广泛应用[19]。诱变时间影响致死率,致死率过高可能会导致菌株性能大幅度改变,过低又会导致诱变效率降低,一般选择75%~85%的致死率。因此本实验选择的诱变时间为45~46 s,此时致死率大约为80%(图2)。
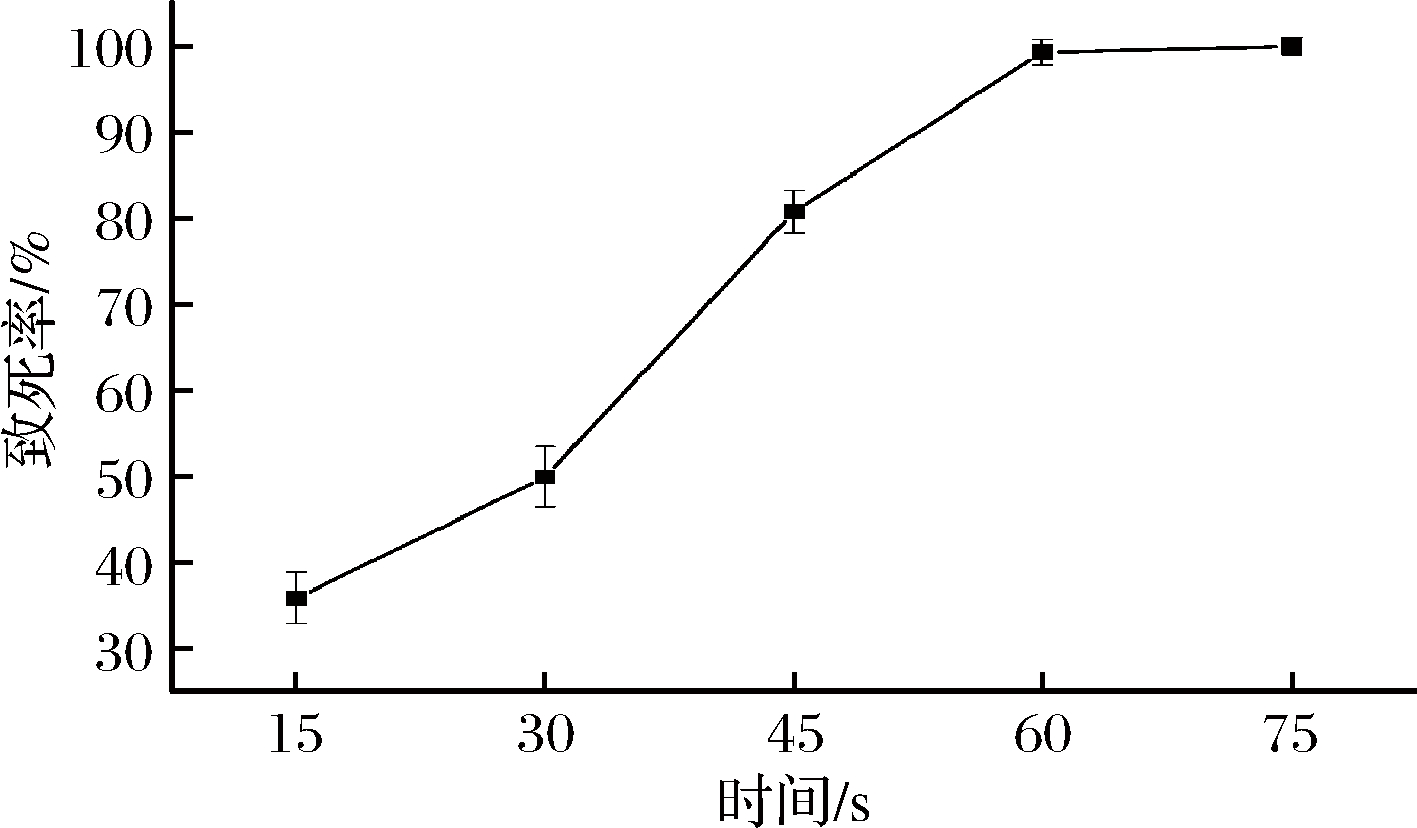
图2 酵母的平均致死率曲线
Fig.2 Lethality curve of yeast
将诱变后的菌液涂布至BCIP平板进行筛选,挑选短时间内蓝色较深的突变菌进行后续测定,共得到16株啤酒酵母突变菌、14株面包酵母突变菌和12株葡萄酒酵母突变菌(图3)。
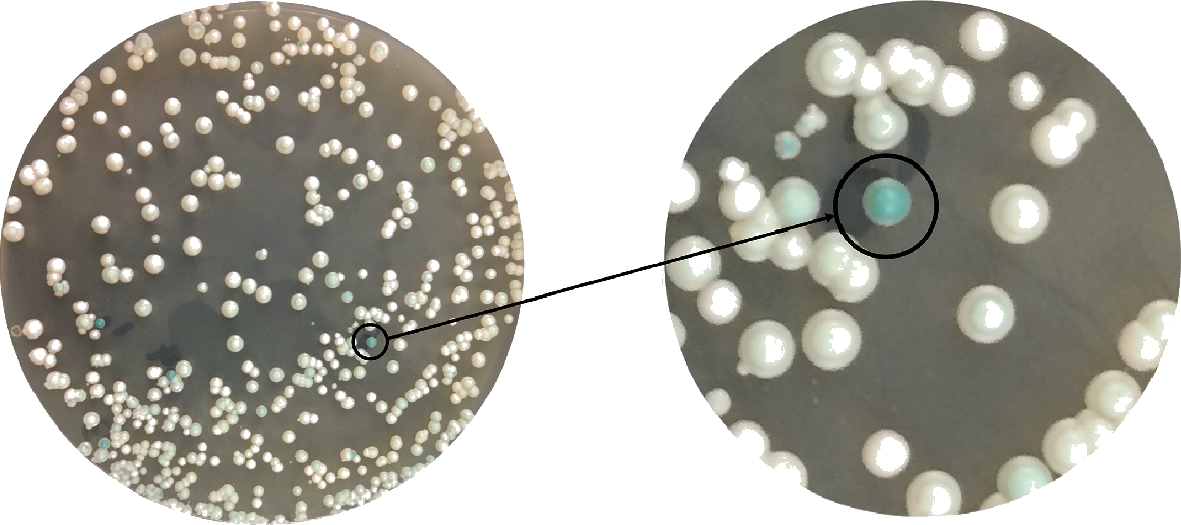
图3 BCIP平板初筛
Fig.3 BCIP chromogenic media
2.2 突变菌的RNA溶出率
突变菌在37 ℃下自溶会导致胞内物质如RNA、蛋白质溶出,因此可通过自溶物中RNA的含量来快速判断酵母自溶程度,以其相对原始菌自溶物的RNA含量表示,结果如表1所示。
表1 突变菌株37 ℃自溶物RNA相对含量 单位:%
Table 1 The relative content of RNA releasement under 37 ℃ autolysis of mutants
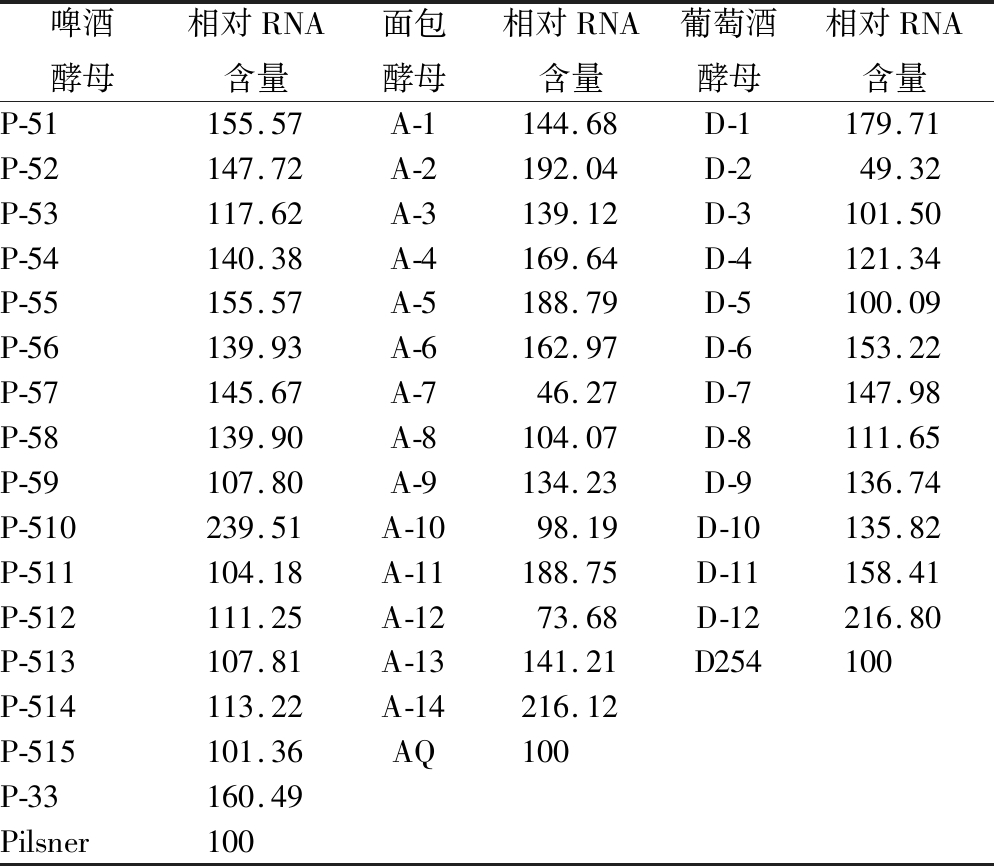
啤酒酵母相对RNA含量面包酵母相对RNA含量葡萄酒酵母相对RNA含量P-51155.57A-1144.68D-1179.71P-52147.72A-2192.04D-249.32P-53117.62A-3139.12D-3101.50P-54140.38A-4169.64D-4121.34P-55155.57A-5188.79D-5100.09P-56139.93A-6162.97D-6153.22P-57145.67A-746.27D-7147.98P-58139.90A-8104.07D-8111.65P-59107.80A-9134.23D-9136.74P-510239.51A-1098.19D-10135.82P-511104.18A-11188.75D-11158.41P-512111.25A-1273.68D-12216.80P-513107.81A-13141.21D254100P-514113.22A-14216.12P-515101.36AQ100P-33160.49Pilsner100
大部分突变菌的自溶液RNA溶出率都高于原始菌,说明BCIP平板筛选法能够用于啤酒酵母、面包酵母和葡萄酒酵母的高温敏感型突变菌的筛选,具有普适性。突变菌中P-510、A-14、D-12的自溶液RNA溶出含量最高,分别为各自原始菌自溶物RNA含量的239.51%、216.12%、216.80%。因此最终选择P-510、A-14、D-12这3株高温敏感型突变菌进行后续分析。
2.3 高温敏感型突变菌的性能考察
2.3.1 高温下的生长状况和死亡率
为了进一步分析突变菌在37 ℃的生理性能,测定了其在37 ℃的生长状况(图4)和死亡率(图5)。P-510、A-14、D-12均能在28 ℃正常生长,但A-14的生长略微弱于AQ。同时P-510、A-14、D-12均在37 ℃表现出明显的生长抑制。在37 ℃下培养12 h后,Pilsner、AQ和D254的死亡率变化不明显,72 h后死亡率分别为4.2%、13.4%和2.5%,P-510、A-14和D-12的死亡率迅速增加,72 h后分别达到87.8%、79.00%和87.9%,说明突变菌P-510、A-14和D-12对高温敏感,不能在37 ℃下正常生长。
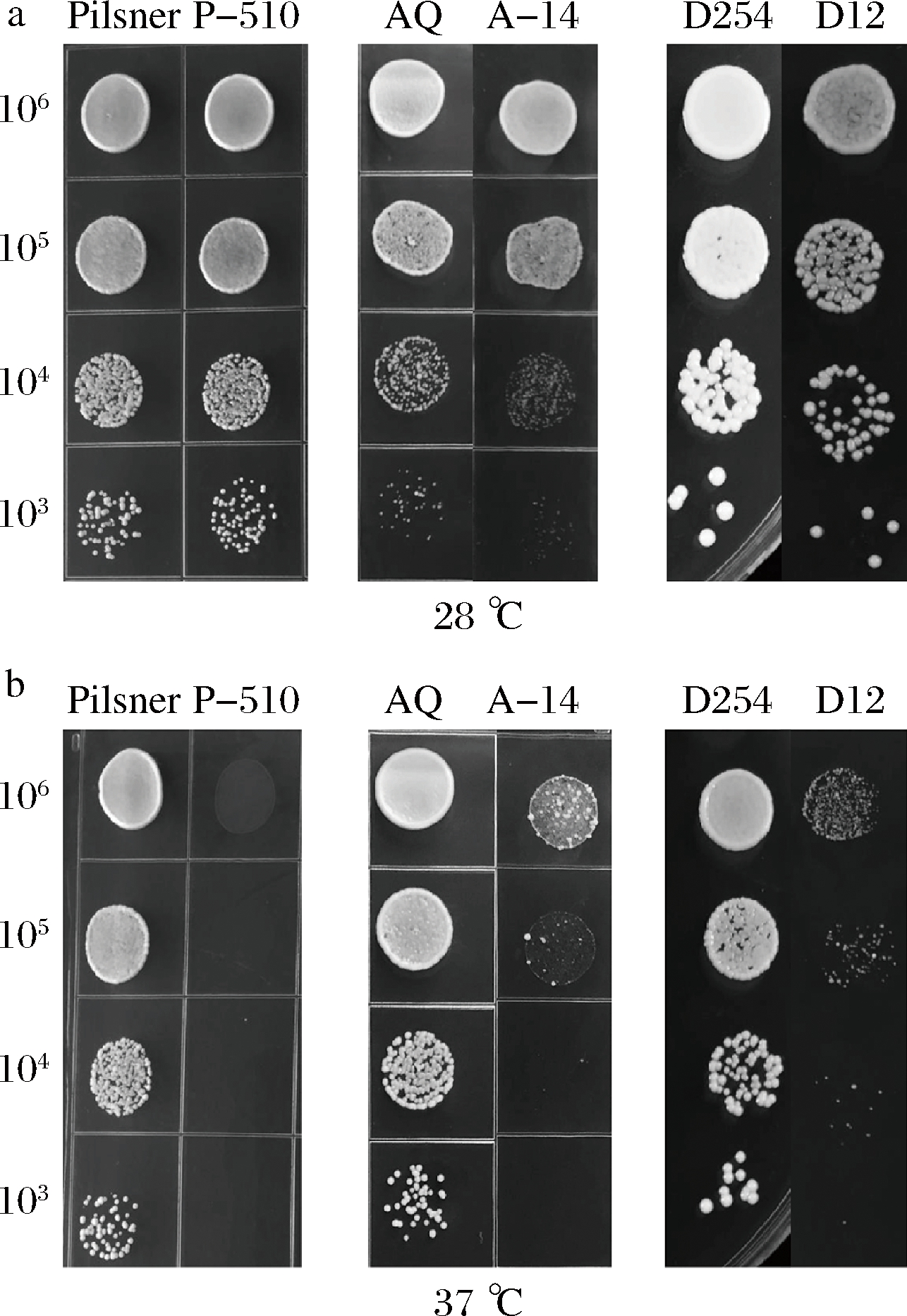
图4 突变菌在28 ℃(a)、37 ℃(b)下生长状况
Fig.4 The growth performance of mutants at 28 ℃ (a) and 37 ℃ (b)
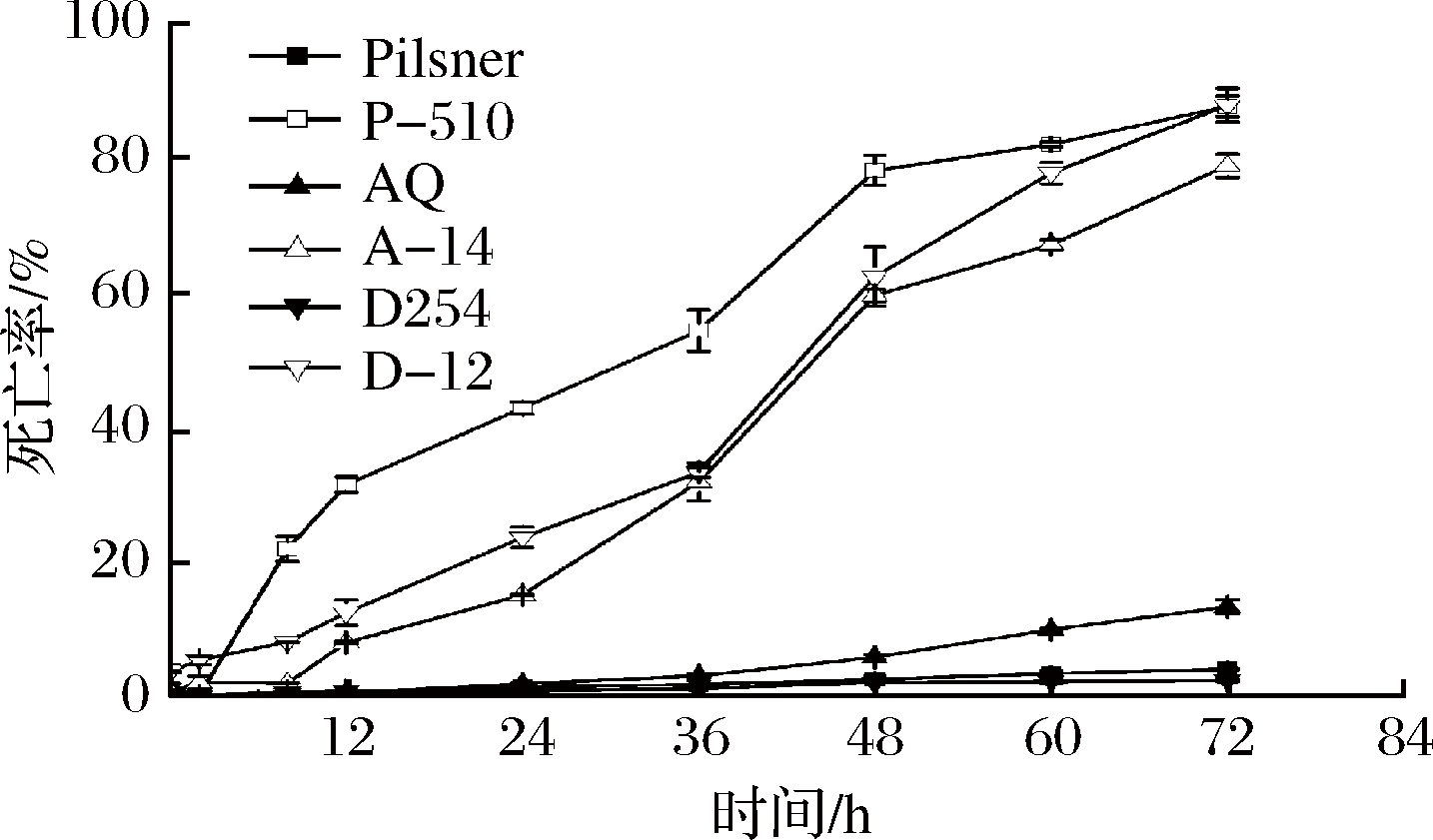
图5 突变菌在37 ℃下的死亡率
Fig.5 The mortality rate of mutants at 37 ℃
2.3.2 突变菌的生长曲线
诱变可能会对菌株的生长能力造成影响,因此测定了突变菌的生长曲线,如图6所示。
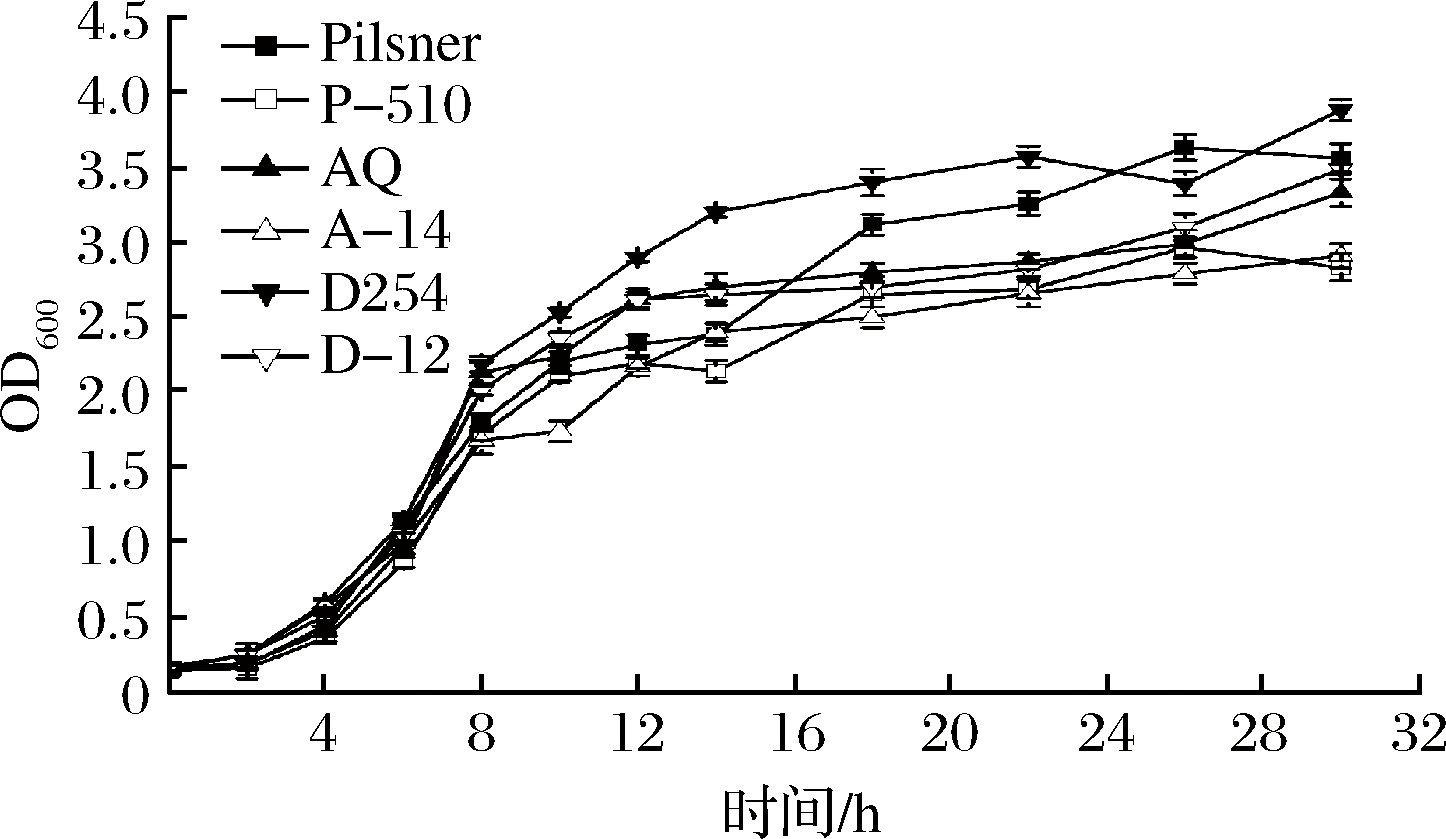
图6 菌株的生长曲线
Fig.6 The growth curve of mutants
3株突变菌和原始菌同时进入对数期,约6 h达到对数期中期。突变菌进入平台期后菌浓比原始菌略低,但菌株总体生长一致,说明经过诱变处理后突变菌的生长能力略微受到影响。
2.4 突变菌与原始菌的自溶物分析
2.4.1 突变菌自溶程度分析
核酸、蛋白质、氨基酸态氮抽提率可用于衡量菌株的自溶程度。测定了原始菌和突变菌在37 ℃下的核酸、蛋白质、氨基酸态氮抽提率(图7)。

图7 37 ℃下原始菌和突变菌的RNA(a)、蛋白质(b)、氨基酸态氮(c)抽提率
Fig.7 The releasement of RNA (a),protein (b),and amino acid nitrogen (c) of mutants during autolysis at 37 ℃
大部分菌株的RNA和蛋白质的溶出在48 h内呈上升趋势,而氨基酸态氮的溶出在36 h到达峰值。对于核酸抽提率,自溶36 h后突变菌P-510、A-14、D-12相比于原始菌Pilsner、AQ、D254分别提高了2.7、1.8、1.7倍;对于蛋白质抽提率,36 h后突变菌相比于原始菌分别提高了2.2、1.7、1.6倍;对于氨基酸态氮抽提率,36 h后突变菌相比于原始菌分别提高了1.3、1.2、1.2倍。其中P-510的核酸、蛋白质、氨基酸态氮抽提率最高,分别能够达到3.52%、0.32%和7.01%。综上,在37 ℃下突变菌胞内物质的溶出率均高于原始菌,说明突变菌的自溶程度高于原始菌,其中P-510的自溶程度最高。
2.4.2 突变菌与原始菌β-葡聚糖溶出差异
自溶过程中细胞壁受到压力,多种水解酶作用于细胞壁,随后细胞壁组分溶出,其中包括生物活性物质β-葡聚糖[20]。β-葡聚糖的水平用相对荧光单位(relative fluorescent unit,RFU)表示,如图8所示。P-510、A-14和D-12的β-葡聚糖溶出分别为5 332、5 157、4 851.5 RFU,比各自原始菌高出26.0%、10.3%和36.6%,说明突变菌的高温敏感性状使其在37 ℃下自溶时溶出β-葡聚糖含量增加。β-葡聚糖是良好的生物活性物质,并在食品、化妆品等领域中被广泛应用[21]。因此本实验筛选出的高温敏感型突变菌能够增加自溶物中β-葡聚糖的含量,具有在功能性食品中应用的潜力。

图8 突变菌与原始菌在37℃自溶液中β-葡聚糖的水平
Fig.8 The releasement of β-glucan of mutants during autolysis at 37 ℃
2.4.3 不同温度下自溶物抗氧化活性差异
酵母自溶物具有一定抗氧化性,主要是由于酵母自溶过程中蛋白质降解成活性肽,以及细胞壁组分溶出的葡聚糖和甘露聚糖等物质具有抗氧化性[22]。P-510在37 ℃的自溶物DPPH清除率在60 h达到最高值,比Pilsner在50 ℃的自溶物DPPH清除率高出13.3% (图9)。D-12在37 ℃的自溶物DPPH清除率也在60 h达到最高值,比D254在50 ℃的自溶物DPPH清除率高出6.8%。同时Pilsner和D254在50 ℃的自溶物DPPH清除率在84 h达到最高值,晚于其突变菌达到最高值的时间。与上述2株突变菌不同,A-14在37 ℃的自溶物DPPH清除率与AQ在50 ℃的自溶物DPPH清除率同时在84 h达到最高值,而前者比后者高出2.1%。以上数据说明与原始菌在50 ℃下自溶相比,突变菌在37 ℃下自溶能够促进活性物质的溶出,且得到抗氧化活性更高的自溶物。可能是由于蛋白酶催化蛋白质中肽键水解时,温度会影响多肽链的长度、游离氨基酸的数量和氨基酸顺序,从而影响自溶液的抗氧化性[13]。因此突变菌P-510、A-14和D-12在37 ℃自溶有利于获得抗氧化活性较强的酵母自溶物。
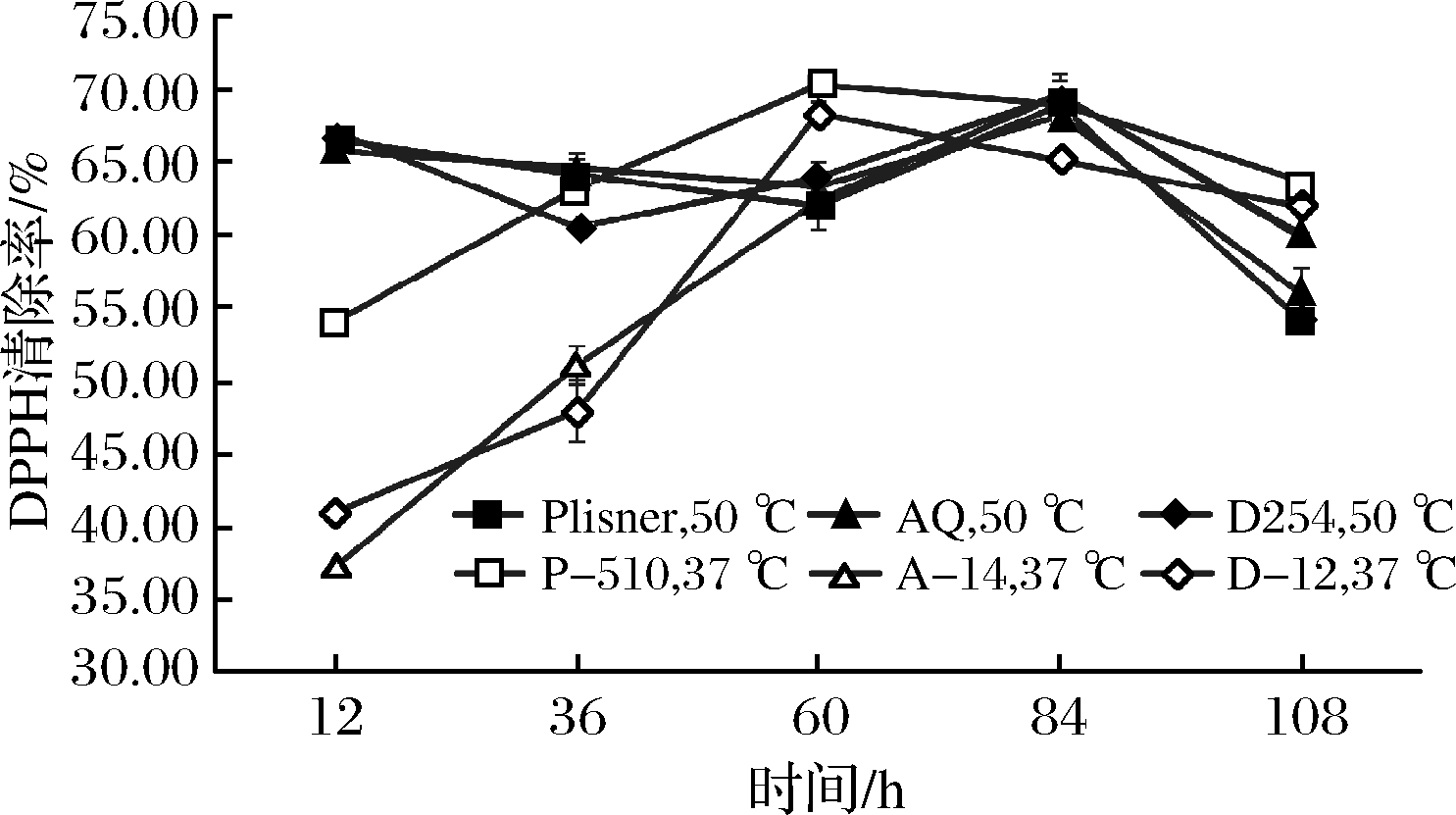
图9 原始菌在50 ℃和突变菌在37 ℃自溶物的DPPH清除率
Fig.9 The DPPH scavenging rate of parental strains at 50 ℃ and mutant strains at 37 ℃
3 结论
酵母自溶物具有较高的营养价值和安全性,特别是其具有的生物活性使酵母自溶物的研究逐渐受到关注。为提高酵母自溶物的活性物质含量和抗氧化性,本研究以啤酒酵母、面包酵母和葡萄酒酵母为出发菌株进行ARTP诱变,使用BCIP平板筛选获得了3株高温敏感型突变菌;突变菌在37 ℃下生长受到抑制,37 ℃自溶时胞内物质溶出增加,具有较好的自溶能力;突变菌自溶物中β-葡聚糖含量增加,且抗氧化活性提高。因此,筛选得到的菌株P-510、A-14和D-12具有功能性食品的应用前景,在动物饲料、化妆品、医药等方面具有重要的应用价值,为进一步开发酵母资源提供依据。但对于温度影响酵母自溶物抗氧化性的具体原因还需要进一步研究。
[1] 朱曼利,郭会明,洪厚胜,等.酵母抽提物的研究概况[J].中国调味品,2017,42(2):175-80.
[2] PODPORA B,SWIDERSKI F,SADOWSKA A,et al.Spent Brewer′s yeast extracts as a new component of functional food[J].Czech J Food Sci,2016,34(6):554-563.
[3] 罗依雨,罗维,刘峻熙,等.啤酒废酵母自溶提取物的制备及抗氧化活性研究[J].华南师范大学学报(自然科学版),2016,48(1):89-93.
[4] TIAN X L,YANG P,JIANG W X.Effect of alkali treatment combined with high pressure on extraction efficiency of beta-D-glucan from spent Brewer′s yeast[J].Waste Biomass Valorization,2019,10(5):1 131-1 140.
[5] GIOVANI G,CANUTI V,ROSI I.Effect of yeast strain and fermentation conditions on the release of cell wall polysaccharides [J].International Journal of Food Microbiology,2010,137(2-3):303-307.
[6] 李惠琳,王婧,许引虎,等.不同酵母多糖对霞多丽干白葡萄酒品质的影响[J].食品与发酵工业,2018,44(4):147-158.
[7] MART NEZ-LAPUENTE L,APOLINAR-VALIENTE R,GUADALUPE Z,et al.Polysaccharides,oligosaccharides and nitrogenous compounds change during the aging of tempranillo and verdejo sparkling wines[J].J Sci Food Agric,2018,98(1):291.
[8] LIEPINS J,KOVACOVA E,SHVIRKSTS K,et al.Drying enhances immunoactivity of spent Brewer′s yeast cell wall beta-D-glucans[J].J Biotechnol,2015,206:12-16.
[9] VIEIRA E F,DAS N J,VITORINO R,et al.Impact of in vitro gastrointestinal digestion and transepithelial transport on antioxidant and ACE-Inhibitory activities of Brewer′s spent yeast autolysate[J].Journal of Agricultural and Food Chemistry,2016,64(39):7 335.
[10] 杨建梅,李红,杜金华.啤酒废酵母自溶条件的研究[J].中国酿造,2012,31(2):95-99.
[11] TANGULER H,ERTEN H.Utilisation of spent Brewer′s yeast for yeast extract production by autolysis:The effect of temperature[J].Food &Bioproducts Processing,2008,86(4):317-321.
[12] BOONYEUN P,SHOTIPRUK A,PROMMUAK C,et al.Enhancement of amino acid production by two-step autolysis of spent Brewer′s yeast[J].Chem Eng Commun,2011,198(12):1 594-1 602.
[13] PODPORA B,![]() F,SADOWSKA A,et al.Spent Brewer′s yeast autolysates as a new and valuable component of functional food and dietary supplements[J].Journal of Food Processing &Technology,2015,6(12):6-12.
F,SADOWSKA A,et al.Spent Brewer′s yeast autolysates as a new and valuable component of functional food and dietary supplements[J].Journal of Food Processing &Technology,2015,6(12):6-12.
[14] VIEIRA E F,MELO A,FERREIRA I M P L V O.Autolysis of intracellular content of Brewer′s spent yeast to maximize ACE-inhibitory and antioxidant activities[J].LWT-Food Science and Technology,2017,82:255-259.
[15] SMART K A,CHAMBERS K M,LAMBERT I,et al.Use of methylene violet staining procedures to determine yeast viability and vitality[J].Journal of the American Society of Brewing Chemists,1999,57(1):18-23.
[16] RODRIGUEZ A,VANEECHOUTTE M.Comparison of the efficiency of different cell lysis methods and different commercial methods for RNA extraction from Candida albicans stored in RNAlater [J].BMC Microbiol,2019,19(1):94.
[17] 李晓东,牛治霞,张柏林.乳清蛋白水解物水解度3种测定方法的比较[J].中国乳品工业,2006,34(10):59-62.
[18] KOENIG S,RUHMANN B,SIEBER V,et al.Quantitative assay of beta-(1,3)-beta-(1,6)-glucans from fermentation broth using aniline blue[J].Carbohydr Polym,2017,174:57-64.
[19] 赵宇,刘珊珊,陈叶福,等.ARTP诱变以及基因组重排筛选具有耐高温性能的酿酒酵母[J].现代食品科技,2017,33(11):37-41.
[20] ALEXANDRE H,GUILLOUX-BENATIER M.Yeast autolysis in sparkling wine-a review[J].Aust J Grape Wine Res,2006,12(2):119-127.
[21] WANG J,LI M,ZHENG F,et al.Cell wall polysaccharides:before and after autolysis of Brewer’s yeast[J].World Journal of Microbiology and Biotechnology,2018,34(9):137-144.