传统发酵肉制品具有高盐、低水分的特点,储存期长,风味独特,营养价值高[1]。它属于在自然条件下,经微生物或酶的作用,发生一系列生物化学及物理变化而形成的肉制品[2-3]。目前,我国发酵肉制品发展较慢,主要原因是缺少自主产权的发酵剂,产品品种单一,加工过程难以控制,产品质量难以稳定等。通过筛选适合于肉制品发酵的优良菌株并制备发酵剂,可以使一些产品实现发酵过程的人工控制,并且开发更多样的发酵肉制品,为发酵肉制品的产业化、规模化生产奠定基础。
乳酸菌是最早从发酵肉制品中分离出的微生物,与产品品质有密切的关系[4-5]。研究发现,乳酸菌可降低产品pH值,赋予产品特殊的发酵风味,改善组织质构,促进色泽与风味的形成[6-7]。同时,某些乳酸菌能产细菌素,抑制腐败菌和致病菌生长繁殖[8-10],甚至还有某些乳酸菌具有降低产品中生物胺[11-13]、降低胆固醇[14]、抗氧化[15]等作用。但并非所有乳酸菌都适合作为肉制品发酵菌株,不同种甚至同一种的不同菌株间特性的差异都会使产品品质产生极大的差别[16-17]。云南火腿是我国重要的传统发酵风味肉制品,不仅具有独特的风味与口感,而且具有悠久的历史与深厚的文化底蕴。本研究拟从云南传统发酵火腿中分离筛选出符合发酵肉制品标准且产酸能力强、耐盐性和耐亚硝酸盐性好的乳酸菌菌株,为云南火腿的工业化生产及肉制品发酵剂的研究与开发提供理论依据。
1 材料与方法
1.1 材料与试剂
材料:云南火腿(农家自制)
试剂:MRS琼脂、MRS肉汤,北京路桥技术股份有限公司;琼脂、牛肉浸粉、蛋白胨、酵母提取物,北京奥博兴生物技术有限责任公司;细菌DNA提取试剂盒,北京天根试剂;CaCO3、NaCl、NaNO2、葡萄糖、MnSO4、MgSO2、乙酸钠、柠檬酸钠、MnO2、KOH等均为分析纯。
1.2 仪器与设备
SW-CJ-2FD无菌操作台,美国Airtech公司;TGradient梯度PCR仪,德国Biometra公司;EC3-310凝胶成像系统,美国UVP公司;DYY-12电泳仪,北京市六一仪器厂;DHP-9272低温培养箱,上海一恒科技有限公司;ECLIPSE 80i共聚焦荧光显微镜,日本尼康公司;UV-2600紫外分光光度仪,日本岛津(Shimadzu)公司;Easy MIX拍击式均质仪,梅里埃诊断产品(上海)有限公司;VORTEX-2 GENIE涡旋震荡器,美国Scientific Industries公司。
1.3 方法
1.3.1 乳酸菌的分离纯化及初步筛选
参考《GB 4789.35—2016食品安全国家标准 食品微生物学检验 乳酸菌检验》,称取样品25 g,剪碎,加入225 mL无菌生理盐水,用均质机均质,并用无菌生理盐水依次做10倍稀释,选择3个适宜稀释度,分别取200 μL稀释液涂布于MRS+3% CaCO3(质量分数)培养基平板上,37 ℃培养24~48 h。挑选有明显溶钙圈且符合乳酸菌菌落形态的菌落,反复划线纯化。对纯化好的菌株进行革兰氏染色及过氧化氢酶试验,选取革兰氏阳性、过氧化氢酶阴性、且不形成芽孢的菌株作为初筛菌株。
1.3.2 菌株复筛试验
产酸能力测定:将活化3代的菌液接种于液体培养基中,37 ℃下培养24 h,测定pH。
发酵性能测定[18-19]:葡萄糖产气试验、H2S产生检测试验、精氨酸产氨试验、过氧化氢产生检测试验。
NaCl和NaNO2耐受性测定:参考张晓东[20]的方法进行测定。
生长曲线和产酸曲线的测定:参考潘晓倩等[21]的方法进行测定。
不同温度条件下的生长能力测定:将活化3代的菌液接种于液体培养基中,分别在10、20、30、40、50 ℃条件下培养24 h,测定菌液的OD600。
不同pH条件下的生长能力测定:将活化3代的菌液分别接种于pH为3.0、4.0、5.0、6.0、7.0液体培养基中,37 ℃条件下培养24 h,测定菌液的pH。
1.3.3 生理生化鉴定
采用生化鉴定试剂盒进行糖醇发酵实验,参考《常见细菌系统鉴定手册》对菌株进行初步鉴定。
1.3.4 16S rDNA 分子生物学鉴定
按照细菌DNA提取试剂盒说明书进行DNA 提取,并以所得DNA 为模板,用细菌16S rDNA通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGYTACCTTGTTACGACTT-3′)作为上下游引物进行PCR扩增。PCR体系(30 μL):buffer 3 μL,dNTP 2 μL,模板1 μL,引物27F 3 μL,引物1492R3 μL,酶0.2 μL,ddH2O补至终体积30 μL;PCR扩增条件:第1阶段:95 ℃预变性5 min;第2阶段:95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35 个循环;第3阶段:72 ℃延伸10 min。
PCR产物经凝胶电泳分析后,送北京六合华大基因科技有限公司(武汉分公司)测序,应用BLAST程序,将测序结果在GenBank基因数据库中进行同源性比较以鉴定菌种归属。
1.4 数据统计处理与分析
所有实验均重复3次,实验结果表示为平均值±标准差。采用SPSS16.0统计软件进行统计学分析,数据间的分析采用单因素方差分析(one way ANOVA)和Duncan多重比较法,显著性水平均设定为P<0.05。生长曲线及产酸曲线的结果使用Origin Pro 8.0进行作图。
2 结果与分析
2.1 菌株的分离和初步筛选结果
从云南火腿中通过MRS+3% CaCO3的培养基筛选乳酸菌,多次纯化后,挑选有明显溶钙圈且具有典型乳酸菌菌落特征,革兰氏阳性且过氧化氢酶阴性的菌株。共得到20株乳酸菌,并分别编号为H1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H14、H15、H16、H17、H18、H19、H20。
2.2 菌株的产酸能力
乳酸菌菌株的产酸性能是决定加工发酵肉制品成功与否及安全性的重要因素[22]。由图1可知,所有菌株在24 h pH均达到4.0以下。选取产酸能力较强的9株菌,即24 h pH≤3.85的菌株进行后续试验。
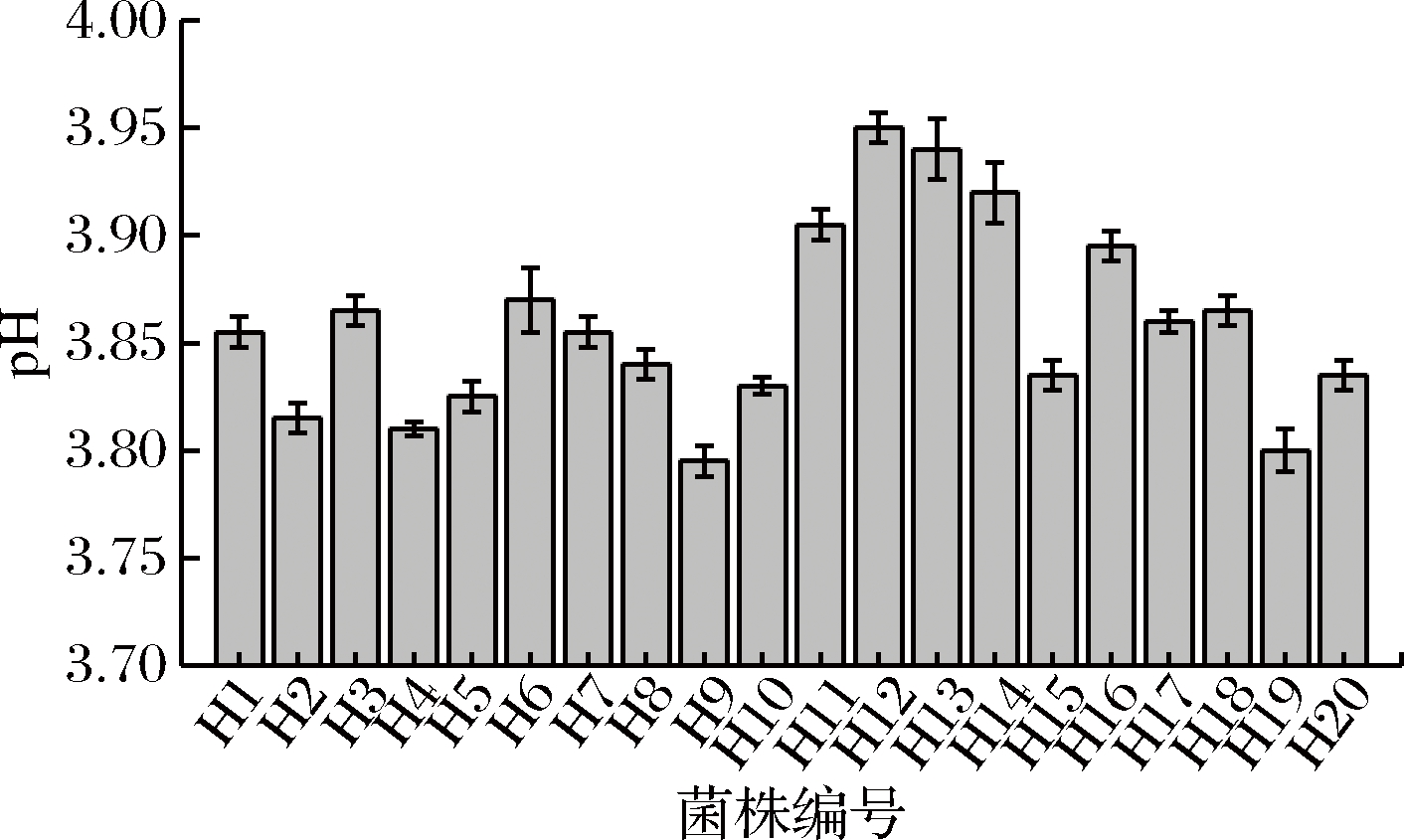
图1 菌株24 h的产酸能力
Fig.1 Acid production capacity of strains 24 hours
2.3 菌株的发酵性能
菌株的发酵特性决定其是否能作为肉制品发酵菌株。筛选的菌株若具有产H2S、产H2O2、精氨酸产氨、葡萄糖产气等特性会严重影响产品的质构、风味、色泽等,使产品品质降低[23]。由表1可知,上述9株菌均不具有以上特性,符合筛选要求。菌株若有适当的蛋白分解能力可增加产品的风味,但以上菌株均不具有蛋白分解能力,这与RAQUEL等[24]的研究一致。并且有研究表明[25-27],在发酵肉制品中产生风味的主要是微球菌和凝固酶阴性葡萄球菌,并非乳酸菌。乳酸菌菌株可与微球菌和凝固酶阴性葡萄球菌或风味蛋白酶复配使用,从而使产品产生更多的风味物质。菌株的脂肪分解能力容易使产品腐败变质,从而缩短产品的货架期,所以菌株不应具有脂肪分解能力。综上所述,上述9株菌的发酵特性均符合要求,可作为肉制品发酵剂的潜在菌株。
表1 菌株的发酵特性
Table 1 Fermentation characteristics of strains

菌株编号发酵特性产H2S产H2O2精氨酸产氨葡萄糖产气蛋白分解能力脂肪分解能力H2------H4------H5------H8------H9------H10------H15------H19------H20------
注:“-”表示反应呈阴性;“+”表示反应呈阳性
2.4 菌株对NaCl的耐受性
发酵肉制品中食盐的添加量一般为质量分数2%~3%,在一些特殊的产品如色拉米香肠的加工中,食盐添加量更高。随着发酵的进行,水分含量的降低,食盐含量也会相对提高,所以要求筛选的菌株有较好的NaCl耐受性。由图2可知,不同菌株对NaCl的耐受性存在显著性差异(P<0.05);陈卫等[28]也表明,即使是相同的属不同的种,甚至不同亚种的乳酸菌,耐盐能力也会有所不同。当NaCl添加量达到6%时,菌株生长受到不同程度的抑制。其中H8的耐受性最好(2.69→2.08),H4的耐盐性最差(2.50→1.52)。这可能是因为高盐浓度会引起高渗透压,触发细胞内水分外流,使细胞胞质分离,从而引起细胞在结构和生理上的损伤,导致细胞停止生长,甚至死亡[29-30]。
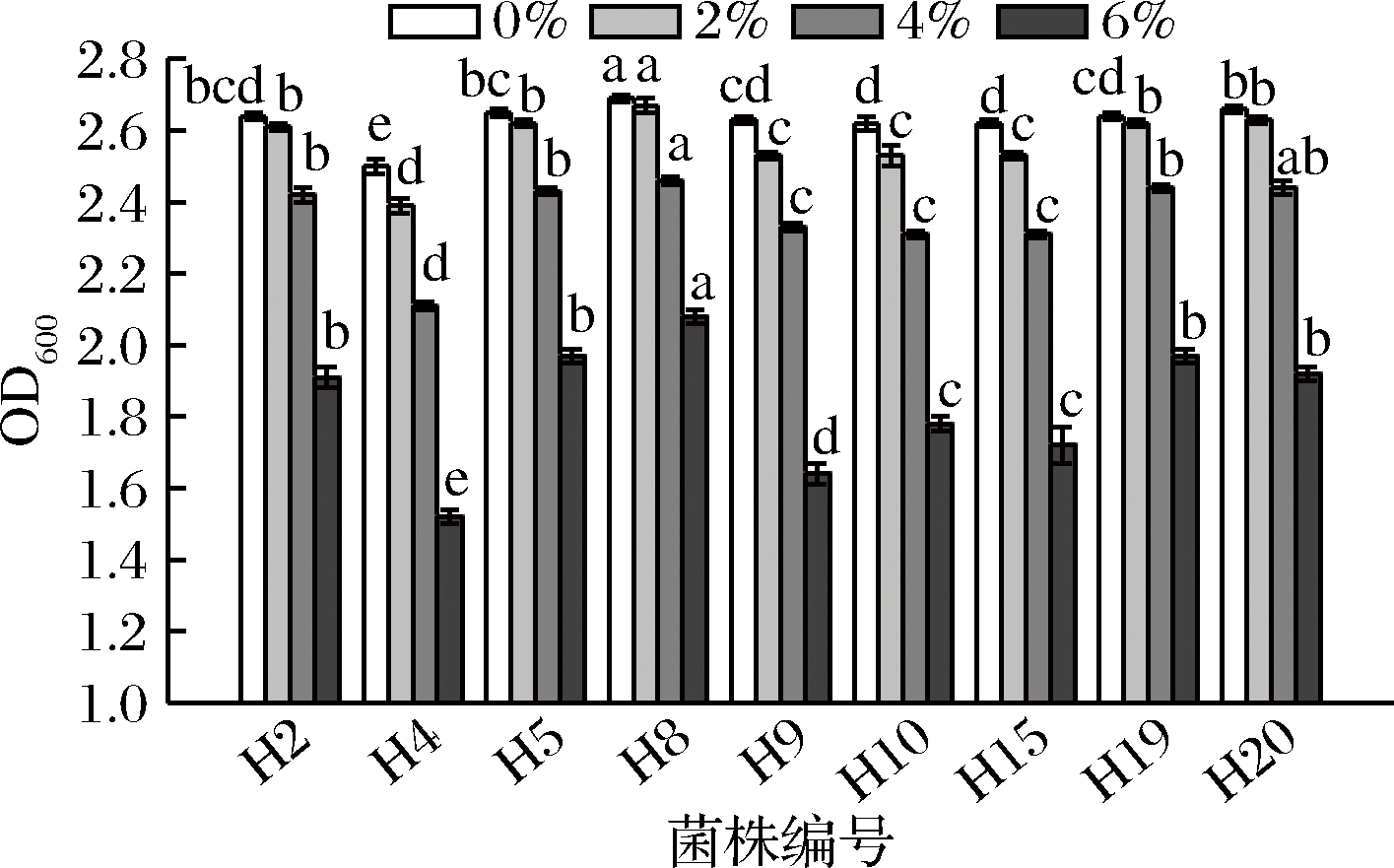
图2 菌株对不同浓度NaCl的耐受性
Fig.2 Resistance of strains to different concentrations of NaCl
注:同一浓度有不同小写字母表示菌株间差异显著(P<0.05)(下同)
2.5 菌株对NaNO2的耐受性
发酵肉制品中添加亚硝酸盐有促进发色、增加风味、抑制微生物的作用,尤其可以有效抑制肉毒梭状芽孢杆菌[31]。但过量的亚硝酸盐会对人体造成潜在的危害,国标中对亚硝酸盐在食品中的添加量有明确的规定。该试验添加的亚硝酸钠的最大量为150 mg/kg,由图3可知,不同菌株对NaNO2的耐受性存在显著性差异(P<0.05)。但当NaNO2添加量为150 mg/kg时,OD值均在2.0以上,整体表现出较好的NaNO2耐受性,这说明当遇到NaNO2胁迫时,菌株自身有较好的调节能力。这可能与菌株的相容性调控系统、热休克蛋白调控系统、糖酵解关键酶调控系统以及胞内离子平衡等有关[32]。
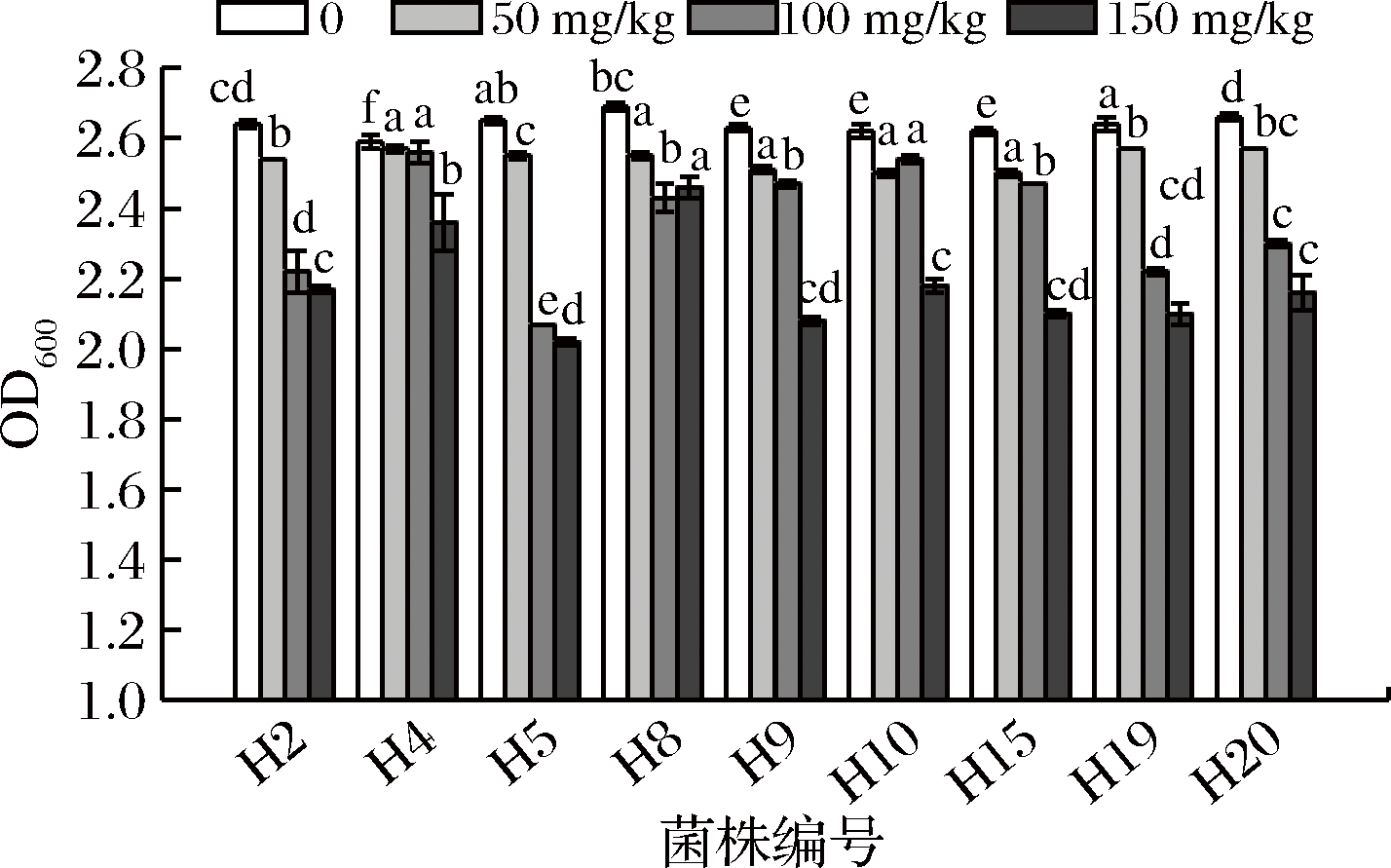
图3 菌株对不同浓度NaNO2的耐受性
Fig.3 Resistance of strains to different concentrations of NaNO2
综合考虑上述所有指标,选择符合发酵肉制品标准要求且产酸较好,NaCl和NaNO2耐受性最好的菌株即H8为目标菌株,进行下一步试验。
2.6 菌株在不同温度条件下的生长能力
发酵肉制品的发酵温度一般为15~40 ℃ [33]。由图4可知,不同温度条件下菌株的生长能力存在显著性差异(P<0.05),在10 ℃条件下生长受到抑制,20~40 ℃均能较好的生长,且在30 ℃条件下生长最好,而在李建等[34]的研究中,其优势菌株在40 ℃条件下生长最好,这种差异可能是由菌株的不同引起的。

图4 菌株H8在不同温度条件下的生长能力
Fig.4 Growth capacity of strain H8 under different temperature conditions
2.7 菌株在不同pH条件下的生长能力
随着发酵的进行,发酵肉制品的pH不断降低,所以要求菌株对酸有一定程度的耐受性。由图5可知,菌株在不同pH值条件下的生长存在显著性差异(P<0.05)。菌株在pH 4.0时仍能较好的生长,适合作为肉制品发酵剂潜在菌株。

图5 菌株H8在不同pH值条件下的生长能力
Fig.5 Growth capacity of strain H8 under different pH values
2.8 菌株的生长曲线和产酸曲线
如图6所示,0~2 h内为延滞期,时间较短,在此期间内,生长速度和产酸速度较慢。2~7 h内为对数生长期,此阶段OD600由0.19增加至2.25。此外,该菌株的产酸能力较强,其中主要在对数生长期产酸较多。菌株生长速度和产酸速度快有助于在肉制品中的快速定植、生长及产酸,从而抑制其他腐败微生物的生长,保证产品的质量[35]。
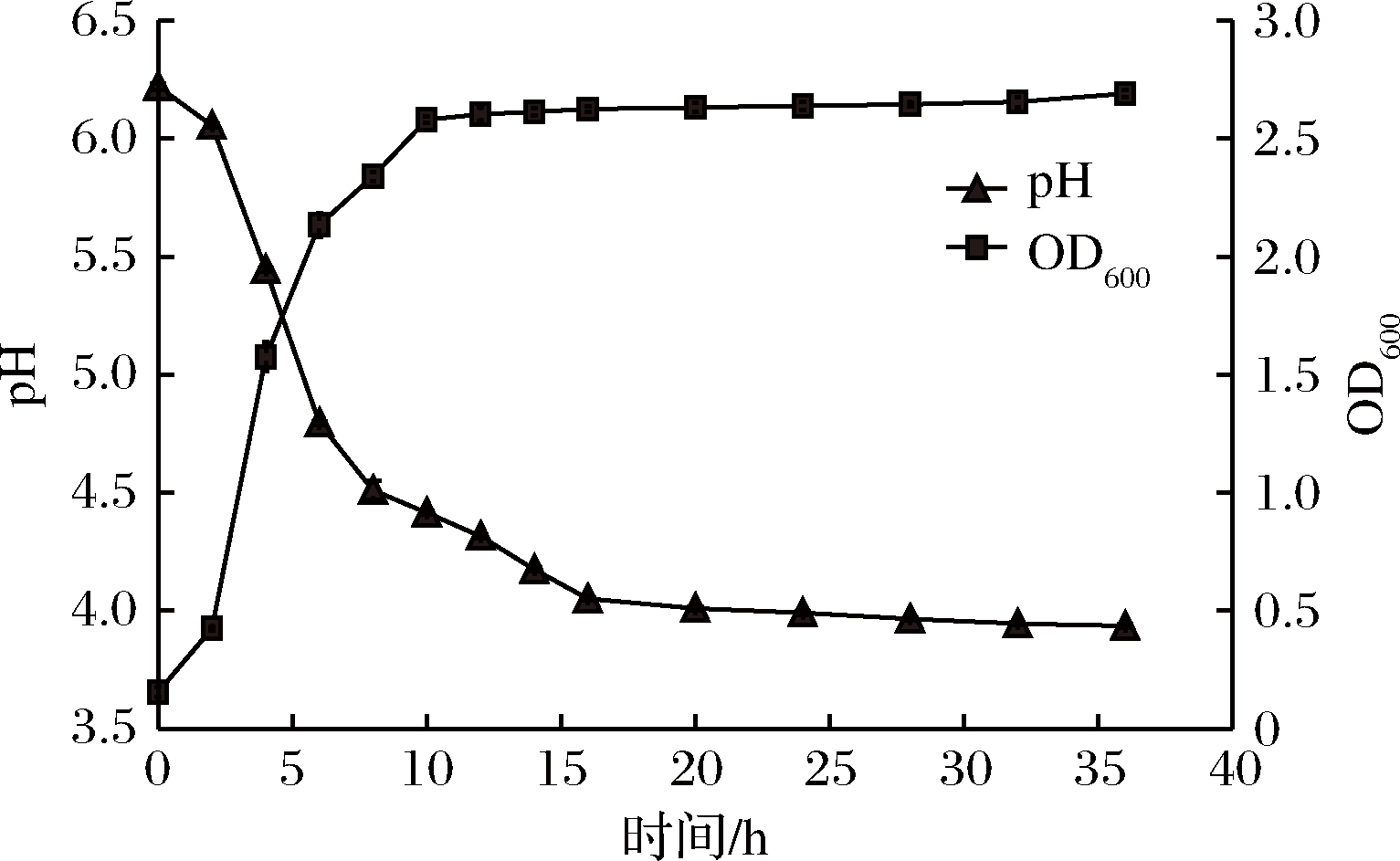
图6 菌株H8生长曲线及产酸曲线
Fig.6 Growth curve and acid-producing curve of strain H8
2.9 菌株鉴定
2.9.1 形态及生理生化鉴定
菌株H8呈乳白色圆形菌落,直径1~2 cm,表面光滑凸起;镜检结果如图7所示,为革兰氏阳性球菌,无鞭毛、无芽孢。生理生化鉴定结果如表2所示,根据形态及生理生化鉴定结果,对照《常见细菌系统鉴定手册》,初步将H8菌株鉴定为片球菌属细菌。
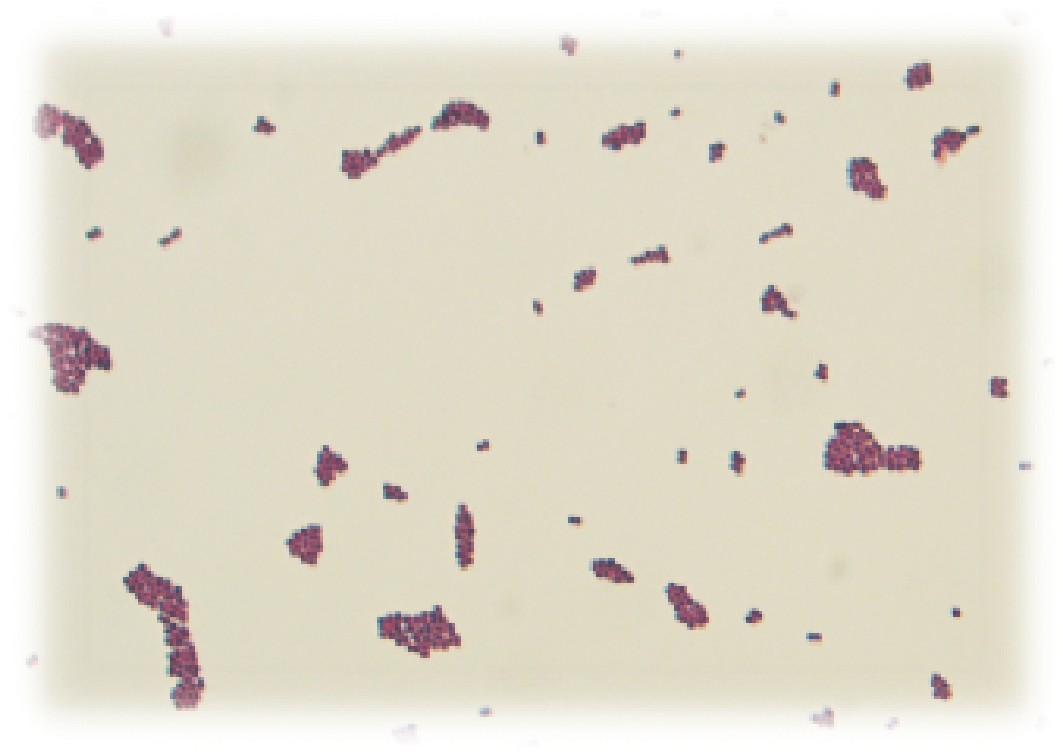
图7 菌株H8形态
Fig.7 Morphology of strain H8
表2 H8菌株生理生化鉴定结果
Table 2 Physiological and biochemical identification of strain H8

实验项目结果实验项目结果葡萄糖+乳糖+麦芽糖+蔗糖+棉子糖-木糖-蜜二糖-果糖+甘露糖+阿拉伯糖+纤维二糖+山梨醇-半乳糖+甘露醇-鼠李糖-核糖+V-P实验-产H2S实验-明胶液化-H2O2实验-
注:“-”表示反应呈阴性;“+”表示反应呈阳性。
2.9.2 分子生物学鉴定结果
经16S rDNA测序,得到长度为1 246 bp的H8菌株16S rDNA序列。用BLAST进行序列同源性比对,并利用MEGA 6.06构建系统发育树,结果见图8。

图8 分离株16S rDNA序列系统进化树
Fig.8 Phylogenetic tree based on 16S rDNA sequences of isolates
由系统发育树可知,H8菌株与戊糖片球菌亲缘关系最近,这与形态及生理生化鉴定结果一致,由此可以进一步将H8菌株归属于戊糖片球菌(Pediococcus pentosaceus)。
3 结论
本实验以云南火腿为原料,初步筛选得到20株革兰氏阳性,过氧化氢酶阴性、符合乳酸菌基本特征且具有明显溶钙圈的菌株。通过研究菌株的产酸能力、发酵特性及对NaCl和NaNO2的耐受性,得到1株性能较好的菌株,经形态学、生理生化和分子生物学鉴定为戊糖片球菌(Pediococcus pentosaceus)。该菌株在不同pH和不同温度条件下的生长能力均符合发酵肉制品菌株的基本要求,且该菌株生长速度和产酸速度较快,生长延滞期短,可作为肉制品发酵剂的潜在菌株。
[1] 潘晓倩,成晓瑜,张顺亮,等.腌腊肉制品中乳酸菌的筛选鉴定及其在腊肠中的应用[J].食品科学,2017,38(16):57-63.
[2] 龙强,聂乾忠,刘成国.发酵肉制品功能性发酵剂研究现状[J].食品科学,2016,37(17):263-269.
[3] COCOLIN L,DOLCI P,RANTSIOU K.Biodiversity and dynamics of meat fermentations:the contribution of molecular methods for a better comprehension of a complex ecosystem[J].Meat Science,2011,89(3):296-302.
[4] 陈韵,胡萍,湛剑龙,等.我国传统发酵肉制品中乳酸菌生物多样性的研究进展[J].食品科学,2013,34(13):302-306.
[5] LIU S N,HAN Y,ZHOU Z J.Lactic acid bacteria in traditionalfermented Chinese foods[J].Food Research International,2011,44(3):643-651.
[6] L PEZ C,MEDINA L M,PRIEGO R,et al.Behaviour of the constitutive biota of two types of Spanish dry-sausages ripened in a pilot0scale chamber[J].Meat Science,2006,73(1):178-180.
PEZ C,MEDINA L M,PRIEGO R,et al.Behaviour of the constitutive biota of two types of Spanish dry-sausages ripened in a pilot0scale chamber[J].Meat Science,2006,73(1):178-180.
[7] COPPOLA R,GIAGNACOVO B,IORIZZO M,et al.Characterization of lactobacilli involved in the ripening of soppressata molisana,a typical southern Italy fermented sausage[J].Food Microbiology,1998,15(3):347-353.
[8] GAO Y R,LI D P,LIU X Y.Bacteriocin-producing Lactobacillus sakei C2 as starter culture in fermented sausages[J].Food Control,2014,35(1):106.
[9] 张小美,楼秀玉,顾青.1株产细菌素乳酸菌的鉴定和细菌素的分离纯化[J].中国食品学报,2013,13(12):181-187.
[10] SWETWIWATHANA A,VISESSANGUAN W.Potential of bacteriocin producing lactic acid bacteria for safety improvements of traditional Thai fermented meat and human health[J].Meat Science,2015,109:101-105.
[11] 孙霞,杨勇,巩洋,等.发酵香肠中生物胺控制技术的研究进展[J].食品工业科技,2015,36(11):373-388.
[12] TOSUKHOWONG A,VISESSAGUAN W,PUM PUANG L,et al.Biogenic amine formation in Nham,a Thai fermented sausage,and the reduction by commercial starter culture,Lactobacillus plantarum BCC 9546[J].Food Chemistry,2011,129:846-853.
[13] ZHANG Q L,LIN S L,NIE X H.Reduction of biogenic amine accumulation in silver carp sausage by an amine-negative Lactobacillus plantarum[J].Food Control,2013,32(2):496-500.
[14] 云月英,马宇南,王文龙.自然发酵肉制品中乳酸菌的体外降胆固醇特性[J].中国酿造,2018,37(1):125-128.
[15] 李默,朱畅,赵冬兵,等.发酵肉制品中高抗氧化肉品发酵剂的筛选鉴定[J].食品科学,2017,38(12):83-88.
[16] LEE J Y,KIM C J,KUNZ B.Identification of lactic acid bacteria isolated from kimchi,and studies on their suitability for application as starter culture in the production of fermented sausages[J].Meat Science,2006,72(3):437-445.
[17] ADAB S E,ESSID I,HASSOUNA M.Microbiological,biochemical and textural characteristics of a Tunisian dry fermented poultry meat sausage inoculated with selected starter cultures[J].Journal of Food Safety,2014,35(1):75-85.
[18] 凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:117-124.
[19] RUBIO R,JOFRE A,MARTIN B,et al.Characterization of lactic acid bacteria isolated from infant faeces as potential probiotic starter cultures for fermented sausages[J].Food Microbiology,2014,38(4):303-311.
[20] 张晓东.发酵香肠菌种的筛选及对香肠理化性质的影响[D].长沙:湖南农业大学,2017.
[21] 潘晓倩,赵燕,张顺亮,等.中温乳化香肠中一株优势腐败菌的分离鉴定与生物学特性[J].食品科学,2016,37(7):93-98.
[22] 杜斌,李苗苗,柴才,等.侗族传统酸肉与腌鱼中降胆固醇乳酸菌的筛选与鉴定[J].食品科技,2017,42(11):8-13.
[23] 郭慧芬.发酵肉制品中抗氧化乳酸菌的筛选及其特性的初步研究[D].呼和浩特:内蒙古农业大学,2017.
[24] RAQUEL T,TERESA A,SARA B C,et al.Probiotic strains Lactobacillus plantarum 299V and Lactobacillus rhamnosus GG as starter cultures for fermented sausages [J].LWT-Food Science and Technology,2013,54(1):51-56
[25] IRENE FRANCIOSA,VALENTINA ALESSANDRIA,PAOLA DOLCI,et al.Sausage fermentation and starter cultures in the era of molecular biology methods[J].International Journal of Food Microbiology,2018(279):26-32.
[26] 龙强,聂乾忠,刘成国.发酵香肠研究进展及展望[J].食品科学,2017,38(13):291-298.
[27] ASKILD HOLCK,LARS AXELSSON,ANETTE MCLEOD,et al.Health and safety considerations of fermented sausages[J].Journal of Food Quality,2017,2017:1-15.
[28] 陈卫,赵山山,张秋香.乳酸菌的耐盐机制[J].中国食品学报,2013,13(10):1-7.
[29] PRASAD J,MCJARROW P,GOPAL P.Heat and osmotic stress responses of probiotic Lactobacillus rhamnosus HN001(DR20) in relation to viability after drying[J].Applied and Environmental Microbiology,2003,69(2):917-925.
[30] ZHANG Y H,ZHANG Y P,ZHU Y,et al.Proteomic analyses to reveal the protective role of glutathione in resistance of Lactococcus lactis to osmotic stress[J].Applied and Environmental Microbiology,2010,76(10):3 177-3 186.
[31] HAMMES W P.Metabolism of nitrate in fermented meats:The characteristic feature of a specific group of fermented foods [J].Food Microbiology,2012,29(2):151-156
[32] 林松洋,郝利民,刘鑫,等.乳酸菌耐盐分子机制研究进展[J].食品科学,2018,39(3):295-301.
[33] 张春晖.发酵肉制品加工技术[M].北京:中国农业出版社,2014.
[34] 李建,李丽,彭翠珍,等.几株适用于发酵肉制品的乳酸菌的分离筛选及鉴定[J].食品研究与开发,2018,39(6):172-177.
[35] BONOMO M G,RICCIARDI A,ZOTTA T,et al.Molecular and technological characterization of lactic acid bacteria from traditional fermented sausages of Basilicata region (Southern Italy)[J].Meat Science,2008,80(4):1 238-1 248.